Abstract
隐球菌性脑膜炎已成为全球范围内中枢神经系统感染性疾病死亡的最大原因,大多数隐球菌性脑膜炎患者都存在艾滋病、自身免疫性疾病、血液系统恶性肿瘤等基础疾病。隐球菌性脑膜炎主要是由新型隐球菌或格特隐球菌感染引起。随着激素、免疫抑制剂的应用,其发病率逐年升高。隐球菌性脑膜炎占全球艾滋病相关死亡人数的15%,对HIV阴性的隐球菌性脑膜炎研究较少。中南大学湘雅二医院神经内科收治1位54岁以牙龈出血为首发表现的女性患者,患者随后出现头痛、脑梗死、癫痫等一系列中枢神经系统症状。血小板最低至4×109/L,抗核抗体(+),抗人球蛋白IgG(++),抗心磷脂抗体IgG、IgA、IgM均阳性,狼疮抗凝物强阳性,抗β2糖蛋白1抗体IgM>841 AU/mL,脑脊液压力升高,脑脊液墨汁染色阳性,脑脊液培养可见新型隐球菌,隐球菌性脑膜炎合并抗磷脂综合征诊断明确。给予积极抗真菌治疗及控制抗磷脂综合征症状,患者仍存在脑脊液压力高、墨汁染色持续阳性、顽固性电解质紊乱、溶血性贫血、心力衰竭等一系列并发症,最终死亡。目前尚未见隐球菌性脑膜炎合并抗磷脂综合征的相关病例报道,本病例可为临床诊治该类疾病提供新的思路。
Keywords: 隐球菌性脑膜炎, 抗磷脂综合征, 系统性红斑狼疮, 头痛
Abstract
Cryptococcal meningitis has become the largest cause for the death of infectious diseases in the central nervous system infectious disease worldwide. Most patients with cryptococcal meningitis have AIDS, autoimmune diseases, hematologic malignancies, and some other relevant diseases. It is mainly caused by infection with Cryptococcus neoformans or Cryptococcus gattii. Although the relationship between cryptococcal meningitis and autoimmune diseases, such as systemic lupus erythematosus, has been recognized, little has been studied about it. Furthermore, with the use of glucocorticoids and immunosuppressants, the incidence of cryptococcal meningitis is increasing year by year. Cryptococcal meningitis accounts for 15% of HIV-related deaths globally, compared with little research on HIV-negative cryptococcal diseases. A 54-year-old female patient with gingival bleeding was admitted to the Department of Neurology at the Second Xiangya Hospital of Central South University. The patient subsequently developed a series of central nervous system symptoms such as headache, ischemic stroke, and epilepsy. The number of thrombocytes was at 4×109/L, antinuclear antibody was (+), antihuman globulin was (++), globulin IgG anticardiolipin antibody IgG, IgA, and IgM was positive, lupus anticoagulant was strong positive, antibody against β2 glycoprotein 1 IgM >841 AU/mL with elevated cerebrospinal fluid (CSF) pressure. The CSF India ink staining was positive, CSF was cultured cryptococcus neoformans. Antiphospholipid syndrome (APS) and cryptococcal neoformans meningitis were diagnosed. After active antifungal therapy and control of APS, the patient still had a serial of complications including high CSF pressure, persistent positive India ink staining, refractory electrolyte disturbance, hemolytic anemia recurs, heart failure, and finally death. No cases of the combination of the two diseases have been reported, and this case of cryptococcal meningitis with APS may provide a new direction to the diagnosis and treatment for this kind of disease.
Keywords: cryptococcal meningitis, antiphospholipid syndrome, systemic lupus erythematosus, headache
隐球菌性脑膜炎(cryptococcal meningitis,CM)是全球范围内中枢神经系统感染性疾病死亡的最大原因,每年约50万人死于CM,治疗后病死率仍高达25%~50%,特别是移植手术后患者或其他细胞免疫缺陷患者患此病风险高[1-2]。大多数CM患者同时患有艾滋病、自身免疫性疾病、血液系统恶性肿瘤、结节病或使用糖皮质激素治疗,但也有10%~40%的患者为HIV阴性且没有其他明显的免疫功能障碍相关疾病[3]。尽管CM与结节病及其他自身免疫性疾病的关系未被阐明,但随着激素、免疫抑制剂的应用,其发病率逐年升高,病死率可高达20%[4-5]。
抗磷脂综合征(antiphospholipid syndrome,APS)是由抗磷脂抗体(antiphospholipid antibodies,APL-Ab)引起的非器官特异性的自身免疫性疾病。临床上常见的APL-Ab包括狼疮抗凝物(lupus anticoagulant,LA)、抗心磷脂抗体(anticardiolipin antibody,ACA)和抗β2糖蛋白1(β2-GP1)抗体。APS可分为原发性APS和继发性APS,后者多并发系统性红斑狼疮(systemic lupus erythematosus, SLE)、类风湿关节炎、干燥综合征等自身免疫性疾病。但原发性APS患者却很少发展为SLE。在128名随访约9年的原发性APS患者中,只有11例(8%)发展为SLE,而抗人球蛋白IgG(Coombs)阳性是进展为SLE的具有重大临床意义的预测指标。虽然人群中APL-Ab阳性率多达5%,但只有一小部分人被诊断为APS[6-7]。APS的临床表现复杂多样,包括动静脉血栓形成、复发性流产、脑卒中、短暂性脑缺血性发作、偏头痛、癫痫、认知功能障碍、舞蹈病、多发性硬化、急性心肌梗死、心脏瓣膜病、网状青斑、皮肤溃疡和坏死、肾小球肾炎、肾血栓性微血管病、骨缺血性坏死及非创伤性骨折等[8]。
CM和APS并发的情况相对罕见且缺乏典型症状。CM与APS分属不同的专科,由于不熟悉CM,风湿免疫科医生可能会低估此病的风险或认为是由自身免疫性疾病本身活动性增加所引起的一系列表现而造成误诊。中南大学湘雅二医院(以下简称我院)神经内科收治1例由风湿免疫科确诊为CM并发APS的患者,该患者以头痛起病,早期并无颅内感染相关的发热以及恶心、呕吐、抽搐、视物模糊等一系列颅高压表现,随着病情进展逐渐出现脑梗死、癫痫等神经系统并发症,病情复杂。在治疗过程中,即使积极、规范地予以两性霉素B脂质体(行22次腰椎穿刺,鞘内注射两性霉素B脂质体)联合氟胞嘧啶、氟康唑抗真菌治疗,仍存在脑脊液压力高、墨汁染色持续阳性、顽固性电解质紊乱等一系列问题;定期复查补体,积极控制APS,患者后期仍出现溶血性贫血复发、心力衰竭等一系列并发症并最终死亡。为提高对于合并自身免疫性疾病的CM的综合认识,现将本病例临床资料报告如下。
1. 临床资料
患者,女,54岁,2019年11月19日因“牙龈出血10月余,头痛3月余”就诊于我院风湿免疫科。患者从2019年1月开始无明显诱因出现牙龈自发性出血,轻微刺激即出血较多,难以止住,伴有全身紫癜,不伴有头晕、头痛及鼻出血,无恶心、呕吐等,当时在中国人民解放军第163医院查血小板为4×109/L。于1月25日转至湖南省人民医院住院治疗,入院检查显示:HIV阴性,红细胞计数为2.86×1012/L,血红蛋白为90 g/L,血小板为16×109/L;免疫球蛋白IgG、IgM阳性;抗核抗体(+),抗人球蛋白IgG(++),抗心磷脂抗体IgG、IgA、IgM均为阳性,抗Coombs试验(++)。予以地塞米松磷酸钠(10 mg/d)、免疫球蛋白(20 g/d),以及护胃、止血、输血小板等对症治疗后血小板升至272×109/L,红细胞计数为3.35×1012/L,血红蛋白为106 g/L。于2月1日出院,出院后口服甲泼尼龙片(每次24 mg,每日2次,3周后逐渐减量,每周减4 mg,减至每日4 mg,维持1个月后再停药)。4月16日因血小板减少再次就诊于湖南省人民医院血液科,入院血小板为11×109/L,继续给予与之前相同的治疗后病情好转,4月23日出院,出院后继续服用甲泼尼龙片(每次24 mg,每日2次,每周监测血常规,血小板计数正常后2周开始减量,每周减4 mg,减至每日1片,维持1个月后再停药),并加用硫酸羟氯喹片(每次0.1 g,每日2次)。7月无明显诱因出现阵发性头痛,自诉休息后可稍缓解;8月初头痛程度较前加重,且波及整个头部,为持续性刺痛感,较剧烈,稍感恶心,未呕吐,无发热,未予以重视,自行服用止痛药(具体不详)后稍缓解;9月初突发左侧肢体活动障碍伴麻木,于当地医院完善头部MRI平扫+磁共振血管成像(magnetic resonance angiography,MRA)+扩散加权成像(diffusion- weighted imaging,DWI),结果提示:1)右侧额顶部急性脑梗死;2)轻度脑白质变性,脑萎缩;3)右侧大脑中动脉远端分支血供减少;4)右侧椎动脉细小(先天发育异常)。予以阿司匹林等相关脑梗死对症治疗(具体不详)后出院。10月16日就诊于北京协和医院门诊,查LA为2.5(参考值范围≤1.2),β2-GP1抗体IgM>841 AU/mL(参考值范围<20 AU/mL),ACA IgM为87.4 MPLU/mL(参考值范围<10 MPLU/mL),APS诊断明确,予以羟氯喹片(每次0.1 g,每日2次)、他克莫司(每次1 mg,每日2次)、阿司匹林肠溶片(每次0.1 g,每日1次)、阿托伐他汀钙片(20 mg,每晚1次)及醋酸泼尼松片(10 mg,每日1次)。患者因头痛加剧,11月21日于我院风湿免疫科完善腰椎穿刺,提示压力为400 mmH2O(1 mmH2O=0.098 kPa),脑脊液微生物学检查结果为墨汁染色阳性。患者多次腰椎穿刺结果见表1。HIV阴性。11月22日头部MRI诊断意见:1)右侧侧脑室后角旁异常信号影,考虑软化灶形成并周围胶质增生;2)脑白质病变,脑萎缩;3)颅内动脉硬化,右侧椎动脉狭窄可能;4)双侧部分胚胎型大脑后动脉;5)双侧颈内动脉、窦汇未见显影,右侧橫窦、乙状窦、上下矢状窦细小,直窦显影浅淡(图1)。在风湿免疫科治疗时给予甲泼尼龙片(每次8 mg,每日1次)和羟氯喹片(每次0.2 g,每日1次)抗炎、抗风湿,低分子肝素钙注射液(5 000 U,每日1次,皮下注射)抗凝,甘露醇(125 mL,每6 h 1次,静脉滴注)、甘油果糖(250 mL,每12 h 1次,静脉滴注)和托拉塞米(10 mg,每日1次,静脉推注)降颅压,左乙拉西坦(500 mg,每12 h 1次)抗癫痫。于11月25日转入神经内科监护室后继续脱水降颅压,当日加用两性霉素B静脉滴注和鞘内注射(0.1 mg,1次)、氟胞嘧啶(0.5 g,每日3次)抗真菌治疗,其中两性霉素B静脉滴注的起始剂量为每日5 mg,后每日增5 mg,最终以每日50 mg维持至12月11日,因顽固性电解质紊乱,12月12日将两性霉素B 50 mg开始改为两性霉素B脂质体每日40 mg静脉滴注。11月26日脑脊液培养可见新型隐球菌。12月12日复查头部MRI,结果提示:1)右侧侧脑室后角旁-右额顶叶交界区软化灶并胶质增生、轻度脑积水,情况大致同前;小脑周边及脑沟内异常的脑膜强化减少;2)脑白质病变、脑萎缩,情况大致同前(图2)。12月15日开始两性霉素B脂质体加量至每日50 mg静脉滴注,2020年1月15日增至60 mg,1月17日药剂科会诊后加用氟康唑(400 mg,每日1次)抗真菌。期间,针对APS原发病继续采用抗炎、抗风湿、抗凝等治疗。2020年1月25日血红蛋白为101 g/L;2月1日血红蛋白降为84 g/L;2月10日血红蛋白为70 g/L,血小板为95×109/L,并出现发热(最高体温达38.5 ℃)和反复发作性心力衰竭;2月11日复查血红蛋白为58 g/L,血小板为73×109/L。家属因经济原因于2020年2月12日转回当地医院治疗,之后电话随访,患者2月14日于当地医院死亡。
表1.
腰椎穿刺脑脊液结果
Table 1 Cerebrospinal fluid resultsoflumbarpuncture Result of cerebrospinal fluid by lumbar puncture
| 日期 | 压力/mmH2O |
细胞数/ ×106 |
白细胞/ ×106 |
葡萄糖/ (mmol·L-1) |
氯化物/ (mmol∙L-1) |
蛋白质/ (mg·L-1) |
墨汁 染色 |
抗酸 染色 |
格兰氏染色 |
|---|---|---|---|---|---|---|---|---|---|
| 2019年11月21日 | 400 | 290 | 40 | 0.82 | 122.3 | 895.43 | + | - | - |
| 2019年11月25日 | 230 | 1 100 | 120 | 0.43 | 119.9 | 981.99 | + | - | - |
| 2019年11月27日 | 300 | 110 | 7 | 0.88 | 118.7 | 632.70 | + | - | - |
| 2019年11月29日 | 120 | 360 | 10 | 0.47 | 122.4 | 372.33 | - | - | - |
| 2019年12月2日 | 145 | 43 | 21 | 0.84 | 127.9 | 597.83 | - | - | - |
| 2019年12月4日 | 159 | 170 | 0 | 1.24 | 126.1 | 556.68 | - | - | - |
| 2019年12月6日 | 215 | 220 | 14 | 1.72 | 128.9 | 440.92 | + | - | - |
| 2019年12月10日 | 360 | 14 | 2 | 1.86 | 126.8 | 617.24 | + | - | - |
| 2019年12月16日 | 235 | 35 | 7 | 2.70 | 128.0 | 641.53 | + | - | - |
| 2019年12月19日 | 265 | 190 | 10 | 2.24 | 127.7 | 674.92 | + | - | - |
| 2019年12月23日 | 295 | 154 | 32 | 2.68 | 125.6 | 635.35 | + | - | - |
| 2019年12月25日 | 320 | 32 | 12 | 3.05 | 127.8 | 496.24 | + | - | - |
| 2019年12月27日 | 275 | 330 | 4 | 2.95 | 125.6 | 488.91 | + | - | - |
| 2019年12月30日 | 205 | 810 | 21 | 3.13 | 130.5 | 337.11 | + | - | - |
| 2020年1月3日 | 280 | 40 | 6 | 2.75 | 122.0 | 567.63 | + | - | - |
| 2020年1月7日 | 350 | 60 | 33 | 2.97 | 123.6 | 676.46 | + | - | - |
| 2020年1月13日 | 290 | 2 | 0 | 3.52 | 126.8 | 665.45 | - | - | - |
| 2020年1月16日 | 235 | 240 | 40 | 4.11 | 128.8 | 624.00 | + | - | - |
| 2020年1月20日 | 270 | 5 | 2 | 4.75 | 130.4 | 518.04 | + | - | - |
| 2020年1月22日 | 330 | 106 | 2 | 4.17 | 131.2 | 570.90 | + | - | - |
| 2020年1月30日 | 100* | 86 | 2 | 5.30 | 133.3 | 547.24 | + | - | - |
*脱水治疗后。
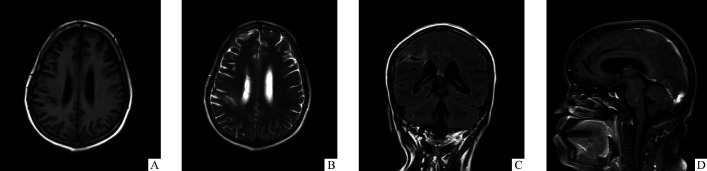
图1.
患者2019年11月22日MRI
Figure 1 MRI of the patient on November 22, 2019
A: Patchy long T1 signal near the posterior horn of the right lateral ventricle. B: Patchy long T2 signal is seen near the posterior horn of the right lateral ventricle; C: T2 FLAIR is low signal, surrounded by visible high signal. D: Sagittal enhancement shows abnormal pia mater enhancement around cerebellar and in cerebral sulcus.
图2.
患者2019年12月12日MRI
Figure 2 MRI of the patient on December 12, 2019
A: Low signal of T1 image; B: High signal of T2 image; C: Softening lesion and glial hyperplasia in the right frontal parietal junction area near the posterior horn of the right ventricle; D: Abnormal meningeal enhancement around the cerebellum and in the sulcus decreases compared with before.
既往史及个人婚育史:既往体健,否认肝炎、结核、糖尿病、冠心病、肿瘤病史。已退休,无鸽子、鸟粪及毒物接触史,无吸烟及饮酒史。已婚已育,育有一子,无流产史,配偶及儿子均体健,否认遗传病家族史。
2. 讨 论
本例患者临床表现主要为头痛,无发热,在我院住院期间有发作性癫痫,有恶心感,但无呕吐,既往无鸽子、鸟粪及毒物接触史,无AIDS、肿瘤等。腰椎穿刺结果显示脑脊液压力明显升高,脑脊液涂片墨汁染色阳性且脑脊液培养出新型隐球菌,符合CM的特点,诊断明确[9]。既往无反复流产史,以血小板重度减少为首要表现,APL-Ab阳性,有缺血性脑卒中的临床表现,符合现临床通用的2006年悉尼国际APS会议修订的分类标准[10],诊断明确。
本例患者的病史、症状、体征及检查结果具有以下特点。第一,血小板减少是APS常见的“诊断标准外”表现,发生率为20%~46%,且通常为轻中度且无明显临床表现,大多数患者血小板>50×109/L,出血现象并不常见[11-12]。而本例患者既往体健,无流产史,却以牙龈出血为最初表现,最初的检查发现其血小板为4×109/L,因此该患者最初并没有被诊断为APS。第二,虽然APS可以表现为多种神经系统相关疾病或临床表现,包括脑血管疾病(脑梗死、脑出血、颅内静脉窦血栓形成)、癫痫、头痛、抑郁、痴呆、认知功能障碍、舞蹈病和多发性硬化等[13-14],但目前尚未见原发性APS患者同时合并颅内真菌感染、脑梗死及癫痫的报道。而本例患者却在出现CM相关头痛后相继发生脑梗死(缺乏高脂血症、高血压病、糖尿病及动脉粥样硬化等脑梗死常见的危险因素)、癫痫等神经系统并发症。第三,本例患者无颊部红斑、盘状红斑、光过敏、口腔溃疡、浆膜炎、非侵蚀性关节炎等SLE症状,抗dsDNA抗体、抗Sm抗体,抗可提取的核抗原(extractable nuclear antigen,ENA)抗体、抗组蛋白抗体也均未见异常,尚不支持SLE诊断(美国风湿病学会诊断标准),但本例患者抗Coombs试验阳性(4+),有研究[7]报道这种情况如果患者存活时间够长,后期会发展为SLE。另外,免疫球蛋白的缺乏、补体缺陷及补体受体表达的下降等与SLE相关的免疫异常会增加发生机会性感染尤其是真菌感染的可能性[15]。体液免疫也可能在隐球菌感染中发挥作用[16]。CM是SLE患者并发的中枢神经系统感染性疾病之一。在SLE人群中,CM患病率约为0.5%[17-18],且即使血清HIV呈阴性,SLE合并隐球菌感染的患者仍常伴明显的CD4+T淋巴细胞比例下降。SLE患者血清补体水平低也可能导致其易于感染[19]。本例患者CD4+T淋巴细胞百分比、绝对计数及CD4+/CD8+T淋巴细胞比值均远低于参考值范围;且C3和C4水平也低于参考值范围。第四,患者在确诊为隐球菌性脑膜脑炎之前有长期不规律服用激素史。糖皮质激素发挥许多复杂的免疫抑制作用,诱导细胞免疫缺陷,导致患者对侵袭性真菌的易感性及其病死率增加[20]。尽管部分CM患者是在诊断为CM前接受了糖皮质激素治疗,但目前已经有研究[15, 21-24]发现患者在诊断为SLE或使用免疫抑制治疗前已患上CM,因此当SLE患者出现中枢神经系统症状时,即使未接受免疫抑制疗法,也应仔细排除中枢神经系统的感染。本例患者的CM是激素等免疫调节药物治疗所导致,还是APS本身类似SLE的免疫缺陷导致,又亦或两种原因都存在,还需进一步的研究来阐明。
本例患者给我们的启示:CM在患有自身免疫性疾病的人群中病死率高,早期可无明显神经系统体征,对已经确诊为自身免疫性疾病的患者,若反复出现头痛等非特异性神经系统症状,也需警惕CM的可能,尽早进行病原学的筛查,为抗真菌治疗争取时间。
利益冲突声明
作者声称无任何利益冲突。
原文网址
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/202104438.pdf
参考文献
- 1. Williamson PR, Nash TE, Williamson KC, et al. CNS infections in 2015: emerging catastrophic infections and new insights into neuroimmunological host damage[J]. Lancet Neurol, 2016, 15(1): 17-19. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Pyrgos V, Seitz AE, Steiner CA, et al. Epidemiology of cryptococcal meningitis in the US: 1997—2009[J]. PLoS One, 2013, 8(2): e56269. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Pappas PG, Perfect JR, Cloud GA, et al. Cryptococcosis in human immunodeficiency virus-negative patients in the era of effective azole therapy[J]. Clin Infect Dis, 2001, 33(5): 690-699. [DOI] [PubMed] [Google Scholar]
- 4. Bernard C, Maucort-Boulch D, Varron L, et al. Cryptococcosis in sarcoidosis: cryptOsarc, a comparative study of 18 cases[J]. QJM, 2013, 106(6): 523-539. [DOI] [PubMed] [Google Scholar]
- 5. Henao-Martínez AF, Gross L, Mcnair B, et al. Risk factors for cryptococcal meningitis: A single United States center experience[J]. Mycopathologia, 2016, 181(11/12): 807-814. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Gómez-Puerta JA, Cervera R. Diagnosis and classification of the antiphospholipid syndrome[J]. J Autoimmun, 2014, 48-49: 20-25. [DOI] [PubMed] [Google Scholar]
- 7. Gómez-Puerta JA, Martín H, Amigo MC, et al. Long-term follow-up in 128 patients with primary antiphospholipid syndrome: do they develop lupus?[J]. Medicine (Baltimore), 2005, 84(4): 225-230. [DOI] [PubMed] [Google Scholar]
- 8. Uthman I, Noureldine MHA, Ruiz-Irastorza G, et al. Management of antiphospholipid syndrome [J]. Ann Rheum Dis, 2019, 78(2): 155-161. [DOI] [PubMed] [Google Scholar]
- 9. 刘正印, 王贵强, 朱利平, 等. 隐球菌性脑膜炎诊治专家共识[J]. 中华内科杂志, 2018, 57(5): 317-323. [Google Scholar]; LIU Zhengyin, WANG Guiqiang, ZHU Liping, et al. Expert consensus on the diagnosis and treatment of cryptococcal meningitis[J]. Chinese Journal of Internal Medicine, 2018, 57(5): 317-323. [DOI] [PubMed] [Google Scholar]
- 10. Miyakis S, Lockshin MD, Atsumi T, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS)[J]. J Thromb Haemost, 2006, 4(2): 295-306. [DOI] [PubMed] [Google Scholar]
- 11. Sciascia S, Amigo MC, Roccatello D, et al. Diagnosing antiphospholipid syndrome: ‘extra-criteria’ manifestations and technical advances[J]. Nat Rev Rheumatol, 2017, 13(9): 548-560. [DOI] [PubMed] [Google Scholar]
- 12. Abreu MM, Danowski A, Wahl DG, et al. The relevance of "non-criteria" clinical manifestations of antiphospholipid syndrome: 14th International Congress on Antiphospholipid Antibodies Technical Task Force Report on Antiphospholipid Syndrome Clinical Features[J]. Autoimmun Rev, 2015, 14(5): 401-414. [DOI] [PubMed] [Google Scholar]
- 13. Sastre-Garriga J, Montalban X. APS and the brain[J]. Lupus, 2003, 12(12): 877-882. [DOI] [PubMed] [Google Scholar]
- 14. Sanna G, Bertolaccini ML, Cuadrado MJ, et al. Central nervous system involvement in the antiphospholipid (Hughes) syndrome [J]. Rheumatology (Oxford), 2003, 42(2): 200-213. [DOI] [PubMed] [Google Scholar]
- 15. Matsumura M, Kawamura R, Inoue R, et al. Concurrent presentation of cryptococcal meningoencephalitis and systemic lupus erythematosus[J]. Mod Rheumatol, 2011, 21(3): 305-308. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. So YS, Maeng S, Yang DH, et al. Regulatory mechanism of the atypical AP-1-like transcription factor Yap1 in cryptococcus neoformans[J]. mSphere, 2019, 4(6): e00785-19. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. Gonzalez-Duarte A, Saniger-Alba Mdel M, Higuera-Calleja J. Cryptococcal meningitis in HIV-negative patients with systemic connective tissue diseases[J]. Neurol Res, 2015, 37(4): 283-287. [DOI] [PubMed] [Google Scholar]
- 18. Fang W, Chen M, Liu J, et al. Cryptococcal meningitis in systemic lupus erythematosus patients: pooled analysis and systematic review[J]. Emerg Microbes Infect, 2016, 5(9): e95. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Zhong Y, Li M, Liu J, et al. Cryptococcal meningitis in Chinese patients with systemic lupus erythematosus[J]. Clin Neurol Neurosurg, 2015, 131: 59-63. [DOI] [PubMed] [Google Scholar]
- 20. Lionakis MS, Kontoyiannis DP. Glucocorticoids and invasive fungal infections [J]. Lancet, 2003, 362(9398): 1828-1838. [DOI] [PubMed] [Google Scholar]
- 21. Chen HS, Tsai WP, Leu HS, et al. Invasive fungal infection in systemic lupus erythematosus: an analysis of 15 cases and a literature review[J]. Rheumatology (Oxford), 2007, 46(3): 539-544. [DOI] [PubMed] [Google Scholar]
- 22. Hung JJ, Ou LS, Lee WI, et al. Central nervous system infections in patients with systemic lupus erythematosus[J]. J Rheumatol, 2005, 32(1): 40-43. [PubMed] [Google Scholar]
- 23. Huston KK, Gelber AC. Simultaneous presentation of cryptococcal meningitis and lupus nephritis[J]. J Rheumatol, 2005, 32(12): 2501-2502. [PubMed] [Google Scholar]
- 24. Mok CC, Lau CS, Yuen KY. Cryptococcal meningitis presenting concurrently with systemic lupus erythematosus[J]. Clin Exp Rheumatol, 1998, 16(2): 169-171 [PubMed] [Google Scholar]