Abstract
目的
氨甲蝶呤(methotrexate,MTX)是导致药物性肝损伤最常见的药物,其致病机制与线粒体功能障碍引起的氧化应激有关。超氧化物歧化酶(superoxide dismutase,SOD)可以通过清除超氧自由基达到抗氧化应激的作用,含锰超氧化物歧化酶(manganese superoxide dismutase,Mn-SOD)属于SOD的一种。本研究拟观察Mn-SOD是否影响MTX对肝细胞的损伤,并探讨其可能的分子机制。
方法
体外培养人肝细胞系L-02,并分为4组:空白对照组(加入同体积无血清培养基)、MTX组(加入40 μg/孔MTX)、MTX+NC组(加入40 μg/孔MTX+转染空白质粒)和MTX+SOD组(加入40 μg/孔MTX+转染Mn-SOD质粒)。分别应用全自动生化仪和real-time RT-PCR法检测每组细胞培养上清的ALT、AST和miR-122的水平,评估各组肝细胞受损伤的程度;使用线粒体超氧化物(mitochondrial superoxide indicator,MitoSOX)荧光探针标记各组细胞内超氧化物,流式细胞术检测细胞凋亡情况;蛋白质印迹法检测细胞中糖原合酶激酶3β(glycogen synthase kinase-3 beta,GSK-3β)、血红素加氧酶1(heme oxygenase 1,HO-1)、线粒体分裂蛋白质(dynamin-related protein 1,Drp1)和Mn-SOD的含量。
结果
与空白对照组比较,MTX组和MTX+NC组肝细胞培养上清中ALT、AST和miR-122水平明显升高(P<0.05),MTX+SOD组较MTX组和MTX+NC组显著降低(P<0.05)且与空白对照组相当。MitoSOX染色显示:MTX组和MTX+NC组的超氧化物最丰富,MTX+SOD组明显减少且与空白对照组差别不大。流式细胞术检测结果表明:与空白对照组相比,MTX组和MTX+NC组细胞凋亡明显增加,MTX+SOD组与MTX组和MTX+NC组比较细胞凋亡明显减少(P<0.05)。蛋白质印迹法检测到空白对照组和MTX+SOD组细胞Mn-SOD、p-GSK-3β和HO-1高水平表达,而MTX组和MTX+NC组细胞Mn-SOD、p-GSK-3β和HO-1比空白对照组明显降低(P<0.05);Drp1则完全相反,在MTX组和MTX+NC组中高表达,在空白对照组和MTX+SOD组中则是低表达。
结论
细胞内Mn-SOD水平的降低导致超氧化物蓄积,通过GSK-3β影响HO-1和 Drp1水平,使线粒体裂解损伤,诱导细胞凋亡,这是MTX引起肝细胞损伤的分子机制之一;将Mn-SOD导入细胞内高表达,可清除药物产生的超氧化物,通过GSK-3β影响HO-1和Drp1水平,从而激活线粒体、保护细胞免受氧化应激损伤,最终抑制肝细胞凋亡。因此,通过外源导入SOD来阻断或逆转MTX相关肝细胞损伤是一条潜在的治疗途径。
Keywords: 含锰超氧化物歧化酶, 氨甲蝶呤, 肝细胞损伤
Abstract
Objective
Methotrexate (MTX) is the most common therapeutic agent that may have the risk of drug-induced liver injury. Its pathogenic mechanism is related to oxidative stress caused by mitochondrial dysfunction. Superoxide dismutase (SOD), including manganese-containing SOD (Mn-SOD), can exert its effect of anti-oxidative stress by scavenging superoxide free radicals. Accordingly, this study is performed to explore the underlying molecular mechanism via observing whether Mn-SOD could affect the damage of MTX to hepatocytes.
Methods
Human hepatocyte cell line L-02 was cultured in vitro and divided into 4 groups, including a blank group with the addition of the same volume of serum-free medium, a MTX group (40 μg/well MTX drug-treatment), a MTX+NC group (40 μg/well MTX drug-treatment+blank plasmid), and a MTX+SOD group (40 μg/well MTX drug-treatment+Mn-SOD plasmid). The levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), and microRNA-122 (miR-122) in the supernatant of cell culture were respectively detected by automatic biochemical analytical instrument and real-time RT-PCR to evaluate the degree of hepatocyte damage in each group. MitoSOX fluorescent probe was used to label intracellular superoxide in each group, and cell apoptosis was detected by flow cytometry. Meanwhile, the contents of glycogen synthase kinase-3 beta (GSK-3β), hemeoxygenase-1 (HO-1), mitochondrial fission-mediated protein of dynamin-related protein 1 (Drp1), and Mn-SOD were detected by Western blotting.
Results
Compared with the blank group, the levels of ALT, AST, and miR-122 in the supernatant of hepatocyte culture of the MTX group and MTX+NC group were significantly elevated (all P<0.05), and that in the MTX+SOD group were significantly decreased (P<0.05) and equivalent to that in the blank group. MitoSOX staining revealed that the MTX group and MTX+NC had the most abundant superoxide; and the amount was significantly reduced in the MTX+SOD group, without a significant difference when compared with the blank group. Furthermore, the results of flow cytometry indicated that compared with the blank group, the MTX group and MTX+NC group showed significantly increased cell apoptosis (P<0.05); while there was obviously reduced cell apoptosis in the MTX+SOD group than that in the MTX group and MTX+NC group (P<0.05). According to the results of Western blotting, the blank group and MTX+SOD group had higher expressions of Mn-SOD, p-GSK-3β, and HO-1; while the MTX group and MTX+NC group exhibited remarkably lower levels of Mn-SOD, p-GSK-3β, and HO-1 than those in the blank group (P<0.05). Besides, a completely opposite trend was found in the expression of Drp1, which was highly expressed in the MTX group and MTX+NC group, but lowly expressed in the blank group and the MTX+SOD group.
Conclusion
MTX may induce hepatocyte damage, and one of the mechanisms may be due to the decrease of intracellular Mn-SOD level, which can cause the accumulation of superoxide, affect the levels of HO-1 and Drp1 through GSK-3β leading to mitochondrial damage and cell apoptosis. High expression of Mn-SOD intracellularly through exogenous introduction can scavenge drug-produced superoxide, affect HO-1 and Drp1 levels through GSK-3β, activate mitochondria, protect cells against damage from oxidative stress, and inhibit hepatocyte apoptosis eventually. So exogenous introduction of SOD may be a potential therapeutic approach to block or reverse MTX-related hepatocyte injury.
Keywords: manganese superoxide dismutase, methotrexate, hepatocellular injury
肝是药物代谢的主要场所,同时也是药物损伤的主要器官之一。最新的流行病学调查[1]表明每100 000人中约有20例药物性肝损伤(drug-induced liver injury,DILI)患者。药物引起的不良反应中有22.8%是药物引起的肝功能异常[2],严重的DILI患者甚至会进展至急性肝衰竭而导致死亡[1],抗肿瘤药物是引起药物性肝损伤的最常见药物之一[3],在中国还有一部分DILI患者是不规范使用中草药导致的[4]。氨甲蝶呤(methotrexate,MTX)是目前应用最广泛的抗肿瘤和抗风湿药物之一,长期使用MTX不仅容易引起肝损伤,还可能引起肝硬化[5]。目前认为MTX对肝的损伤是药物对肝细胞的直接伤害,可能与氧化应激有关[6]。糖原合酶激酶 3β(glycogen synthase kinase-3β,GSK-3β)是一种丝氨酸/苏氨酸蛋白质激酶,参与机体很多信号通路转导,与人类很多疾病密切相关。磷酸化的GSK-3β(p-GSK-3β)可以刺激机体产生氧化应激[7],同时氧化应激也可以影响下游GSK-3β/HO-1分子通路信号表达[8-10],氧化应激过程的最终结局会引起细胞凋亡[11]。血红素加氧酶1(heme oxygenase 1,HO-1)是控制氧化应激反应的关键调节因子,细胞可通过GSK-3β/HO-1信号通路诱导细胞凋亡[12],线粒体损伤也是在氧化应激过程中参与细胞凋亡的机制之一 [13]。当外源性药物等因素引起氧化应激时,大量增加的线粒体分裂蛋白质(dynamin-related protein 1,Drp1)导致线粒体功能紊乱,是药物相关肝毒性机制之一[14]。GSK-3β/Drp1信号通路可以缓解线粒体损伤以减轻氧化应激反应[15-16]。超氧化物歧化酶(superoxide dismutase,SOD)是人体细胞中正常表达的蛋白质,是唯一能清除超氧自由基的抗氧化酶,可以有效缓解氧化应激反应。研究[17]指出SOD在DILI的分子致病机制中扮演重要角色。SOD也属于金属蛋白质酶,按照结合金属离子种类不同可分为含铜与锌超氧化物歧化酶(Cu/Zn-SOD)、含锰超氧化物歧化酶(manganese superoxide dismutase,Mn-SOD)和含铁超氧化物歧化酶(Fe-SOD)3种,其中Mn-SOD广泛存在于哺乳动物的线粒体中。由于很多肝细胞损伤与机体的氧化应激有关[18],线粒体损伤导致其功能障碍是机体氧化应激的原因之一[19-20];因此,以Mn-SOD为载体研究MTX相关肝细胞损伤的分子机制,并且寻找降低MTX对肝细胞损伤的发病机制,对指导临床医生安全使用MTX治疗疾病具有重要意义。
1. 材料与方法
1.1. 材料
胎牛血清和HBSS缓冲液购自美国Gibico公司, DMEM(高糖)细胞培养基购自美国HyClone公司,胰酶购自美国Amresco公司,TRIzol试剂、线粒体超氧化物(mitochondrial superoxide indicator,MitoSOX)荧光探针和转染脂质体Lipofectamin 2000均购于美Invitrogen公司,RT-PCR试剂盒购自加拿大Fermentas公司。注射用MTX为齐鲁制药厂产品,重组人Mn-SOD表达质粒pcDNA-Mn-SOD为中南大学湘雅二医院感染科实验室构建。鼠抗人Mn-SOD、HO-1、Drp1、p-GSK-3β(Ser9)、β-actin单克隆抗体和HRP标记的羊抗鼠IgG均购自美国Santa Cruz公司,正常肝细胞株L-02细胞为湘雅二医院感染科实验室保存。
1.2. 方法
1.2.1. 细胞培养和药物处理
从液氮中取出冻存的L-02细胞,置于37 ℃温水中解冻复苏,使用含10%胎牛血清的DMEM高糖培养基,置于37 ℃、5% CO2的培养箱内培养,待细胞贴壁生长为80%~90%融合状态时用0.25%胰酶消化进行传代培养。将L-02细胞种入6孔板中,细胞培养过夜贴壁后分成4组:空白对照(blank)组(加入同体积无血清培养基)、MTX组(加入40 μg/孔MTX)、MTX+NC组(加入40 μg/孔MTX+转染空白质粒)、MTX+SOD组(加入40 μg/孔MTX+转染Mn-SOD质粒)。每组3个平行孔。MTX+NC组和MTX+SOD组分别使用Lipofectamin 2000转染空白质粒和Mn-SOD质粒2 μg/孔,4 h后换液,继续培养72 h。
1.2.2. 检测细胞培养上清中ALT和AST的水平
收集各组细胞的培养上清于离心管中,应用全自动生化分析仪(日立7600)检测各组细胞上清中ALT和AST水平,以明确各组肝细胞受损程度。
1.2.3. Real-time RT-PCR检测细胞培养上清中miR-122的表达水平
分别取每组细胞培养上清200 μL于EP管中,各加入1 mL的TRIzol试剂,充分混匀后,按照TRIzol试剂说明书一步法提取RNA,使用miR-122的RT引物对miR-122进行反转录并加尾,同时用U6反向引物对U6进行反转录。获得的cDNA再通过real-time PCR对miR-122和U6进行扩增,以U6为内参计算每个标本的miR-122相对定量值。
miR-122-RT引物:5'-GTCGTATCCAGTGCAG-GGTCCGAGGTATTCGCACTGGATACGACCAAACA-3';miR-122-F:5'-TCGCCTGGAGTGTGACAATGG-3',miR-122-R:5'-GTGCAGGGTCCGAGGT-3';U6-F:5'-CGCTTCGGCAGCACATATAC-3',U6-R:5'- TTCACGAATTTGCGTGTCAT-3'。
1.2.4. MitoSOX检测细胞中超氧化物的水平
用HBSS缓冲液稀释MitoSOX试剂至工作浓度(5 μmol/L)备用,从培养箱中取出细胞培养板,吸走培养上清,每孔加入5 μmol/L的MitoSOX试剂0.5 mL,覆盖住底部细胞,然后于37 ℃避光孵育10 min,再用HBSS缓冲液对细胞进行温和清洗3遍,最后于荧光显微镜下观察细胞内红色荧光的量,并拍照记录结果。
1.2.5. 流式细胞术检测细胞凋亡情况
收集各组细胞,使用含2%牛血清白蛋白(bovine serum albumin,BSA)的PBS进行细胞重悬,细胞密度为1×107/mL;加入一抗于4 ℃下孵育30 min,孵育期间每隔10 min晃动一下反应管,使细胞和抗体充分反应;加入适量细胞洗液,以1 000 r/min离心5 min,弃上清,反复洗涤2次;使用100 μL细胞洗液重悬细胞;加入二抗于4 ℃下避光孵育30 min,孵育期间每隔10 min晃动一下反应管;加入适量细胞洗液,以1 000 r/min离心5 min,弃上清,反复洗涤2次;上机检测。
1.2.6. 蛋白质印迹法检测细胞中HO-1、GSK-3β、Mn-SOD和Drp1的含量
收集各组细胞,并用细胞裂解液对细胞进行冰上裂解,离心获得肝细胞裂解蛋白质,进行蛋白质定量后,调整到统一浓度,每组取40 μg蛋白质行SDS-PAGE,并应用湿转法转膜,200 mA稳流2 h,将蛋白质转印到硝酸纤维膜素膜上,用3%脱脂奶粉封闭2 h,然后于4 ℃下分别孵育β-actin(1꞉2 000)、HO-1 (1꞉500)、p-GSK-3β(Ser9,1꞉500)、Mn-SOD(1꞉500)和Drp1(1꞉500)的一抗过夜,PBST洗涤4次,加入HRP标记的羊抗鼠IgG,于37 ℃下孵育2 h后,PBST洗涤4次,于暗室红灯下加入化学发光液,并覆膜压片曝光。底片曝光完成后于暗室进行显影定影处理,洗涤晾干,最后扫描记录结果。
1.3. 统计学处理
采用SPSS 21.0统计学软件分析数据,计量资料以均数±标准差( ±s)表示,各组之间的比较采用单因素方差分析,两两比较采用Tukey检验,检验水准 α=0.05,P<0.05为差异有统计学意义。
2. 结 果
2.1. 各组细胞培养上清中ALT和AST的水平
全自动生化分析仪结果显示:与blank组比较,MTX组和MTX+NC组细胞上清中ALT和AST显著升高(均P<0.05),MTX+SOD组升高幅度不明显(P>0.05);与MTX组和MTX+NC组比较,MTX+SOD组细胞上清中ALT和AST显著降低(均P<0.05,图1)。
图1.
各组细胞培养上清中ALT(A)和AST(B)水平
Figure 1 Levels of ALT (A) and AST (B) in the serum of cells of each group
*P<0.05 vs the blank group; †P<0.05 vs the MTX group or the MTX+NC group.
2.2. 各组细胞培养上清中miR-122的表达水平
Real-time RT-PCR结果显示:Blank组细胞上清中miR-122的水平很低,与blank组比较,MTX组和MTX+NC组miR-122显著升高(P<0.05),而MTX+SOD组则恢复到接近blank组的水平(P>0.05);与MTX组和MTX+NC组比较,MTX+SOD组miR-122的水平明显降低(P<0.05,图2)。
图2.
各组细胞培养上清中miR-122的相对表达量
Figure 2 Relative expression of miR-122 in the serum of cells of each group
*P<0.05 vs the blank group; †P<0.05 vs the MTX group or the MTX+NC group.
2.3. 各组细胞中超氧化物的水平
MitoSOX荧光探针标记各组细胞后,结果显示:Blank组细胞中红色荧光量少,而MTX和MTX+NC组细胞中红色荧光大量增多,MTX+SOD组细胞中红色荧光与blank组无明显差异(图3)。
图3.
各组细胞中线粒体超氧化物水平
Figure 3 Levels of SOD in the mitochondrial of each group
*P<0.05 vs the blank group; †P<0.05 vs the MTX group or the MTX+NC group.
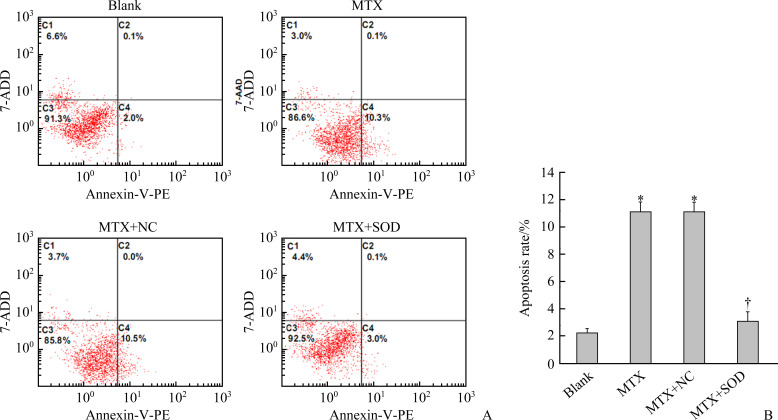
2.4. 各组细胞凋亡情况
流式细胞术检测结果显示:与blank组比较,MTX组和MTX+NC组细胞凋亡明显增加(P<0.05);与MTX组和MTX+NC组比较,MTX+SOD组细胞凋亡明显减少(P<0.05),与blank组比较,细胞凋亡稍有增加,但差异无统计学意义(P>0.05,图4)。
图4.
各组细胞凋亡水平
Figure 4 Relative levels of apoptosis in the cells of each group
A: Apoptosis levels detected by flow cytometry. B: Histogram of apoptosis rates of each group. Compared with the blank group, *P<0.05; compared with the MTX group or the MTX+NC group, †P<0.05.
2.5. 各组细胞中HO-1、GSK-3β、Mn-SOD和Drp1的蛋白质表达水平
蛋白质印迹法结果显示:与blank组比较,MTX组和MTX+NC组细胞中Mn-SOD、p-GSK-3β和HO-1水平明显下调(P<0.05),MTX+SOD组细胞中接近正常水平(P<0.05)。Drp1蛋白质与Mn-SOD、p-GSK-3β和HO-1相反,在MTX组和MTX+NC组中水平明显升高,而在MTX+SOD组中降低至接近正常水平(图5)。
图5.
蛋白质印迹法检测各组细胞中HO-1、GSK-3β、Mn-SOD和Drp1蛋白质表达水平
Figure 5 Western blotting detects the relative levels of HO-1, GSK-3β, Mn-SOD, and Drp1 protein of each group
A: Relative levels of HO-1, GSK-3β, Mn-SOD, and Drp1 protein detected by Western blotting. B: Histogram of levels of HO-1, GSK-3β, Mn-SOD, and Drp1 protein. Compared with the blank group, *P<0.05; compared with the MTX group or the MTX+NC group, †P<0.05.
3. 讨 论
随着药物的广泛应用,DILI已经成为严重影响全球人类健康的主要问题之一[21]。ALT、AST等是DILI的特异性生化标志物,此外还有细胞坏死、凋亡指标和线粒体损伤指标等肝细胞损伤的生物标志物[22]。随着分子诊断学的不断进展,肝细胞特异性miR-122是最近新发现的DILI生物标志物[23]。本研究也发现MTX引起肝细胞受损时,生化标志物ALT、AST和生物标志物miR-122均明显升高。因此,这些标志物的检测不仅能帮助医生在临床上诊断MTX相关肝细胞损伤,还是研究MTX相关肝细胞损伤发病机制的重要手段。
氧化应激是许多药源性肝损伤的机制之一[24-25]。所有进入人体的药物,大多数都会在肝内发生氧化、还原、水解、结合等化学反应,不同程度地被肝代谢,某些药物在氧化还原循环中形成的活性氧(reactive oxygen species,ROS)自由基可以与细胞内的脂质、蛋白质、DNA等发生反应,对肝细胞造成损害,也可能通过某些信号途径导致线粒体损伤和细胞凋亡基因的激活或改变[19,26]。线粒体是ROS的主要来源[19],ROS自由基中的超氧阴离子( )过量,可使脂质过氧化和巯基氧化,损伤线粒体膜,使线粒体裂解,最终导致肝细胞变性坏死[27]。本研究发现:MTX引起的肝细胞受损时,线粒体超氧化物水平明显升高。因此,细胞线粒体中的超氧化物成为研究MTX相关肝细胞损伤的分子机制的一个重要标志物。
SOD能够专一地清除在氧化应激中的 ,因此在DILI的研究中有极其重要的作用[28]。SOD主要分为3种亚型,即SOD1(Cu/Zn-SOD)、SOD2(Mn-SOD)和SOD3(Fe-SOD)[17]。其中Mn-SOD主要位于线粒体中,用于清除线粒体的超氧化物,而线粒体又是氧损伤的主要靶细胞器,Mn-SOD的抗氧化作用与肝损伤有密切的关系[29]。研究[28]发现:Mn-SOD mRNA被敲除后,加剧乙酰氨基酚(acetaminophen,PAPA)诱发的肝损伤。这提示PAPA诱发的肝损伤与Mn-SOD mRNA缺乏有关。本研究也发现:加入Mn-SOD后,肝细胞损伤的生化标志物ALT、AST和生物标志物miR-122均明显降低,线粒体中的超氧化物水平也明显下降。
Drp1是调节线粒体分裂的必需蛋白质,Drp1主要位于细胞质,以多聚体形式存在,是一个GTP酶,其N端具有GTP酶结构域,主要功能是通过影响线粒体微管的分布来控制线粒体的形态。Drp1过表达可以促进线粒体分裂及细胞色素c的释放,引起线粒体功能障碍 [14]。本研究发现:当MTX引起肝细胞损伤时,Drp1水平明显上升,与线粒体损伤有关;加入Mn-SOD后,Drp1基本恢复至正常水平,缓解了线粒体功能障碍。因此,Drp1也可以作为线粒体损伤导致MTX相关肝细胞损伤的一个生物学指标。GSK-3β是HO-1在控制氧化应激方面的关键调节因子,细胞可通过GSK-3β/HO-1信号通路诱导细胞凋亡[12],线粒体损伤也是氧化应激过程中参与细胞凋亡的机制之一[13]。GSK-3β参与机体很多信号通路的转导,在非磷酸化状态时是没有活性的一种激酶,GSK-3β通过磷酸化过程被激活,p-GSK-3β可进一步激活线粒体,使细胞在氧化应激状态下避免线粒体损伤,抑制细胞凋亡[30]。HO-1是氧化应激过程中的关键调节因子,可以保护细胞免受氧化应激的损伤。本研究还发现:MTX引起肝细胞损伤时,肝细胞处于氧化应激状态,抑制了GSK-3β的磷酸化,降低了HO-1表达,从而导致线粒体不能被有效激活,最终诱导细胞凋亡。加入Mn-SOD后,可有效清除超氧化物,阻断细胞氧化应激,p-GSK-3β和调控因子HO-1表达增多,进而激活线粒体,减少细胞凋亡,最终缓解肝细胞损伤。也有研究[15]表明GSK-3β通过下调Drp1减轻线粒体损伤以减轻氧化应激反应,同时Drp1也会影响GSK-3β的激活[16],因此,我们认为Mn-SOD通过GSK-3β影响HO-1和Drp1水平,缓解MTX引起的线粒体损伤和细胞凋亡,可作为MTX相关肝细胞损伤的潜在治疗途径。
本研究通过外源导入Mn-SOD到肝细胞中,提高了MTX处理后的肝细胞中Mn-SOD的水平,结果发现Mn-SOD的导入降低了MTX对肝细胞的损伤程度,进一步检测发现Mn-SOD的导入还降低了肝细胞内线粒体超氧化物和线粒体裂解蛋白质,上调了p-GSK-3β和氧化应激调控因子HO-1的水平,最终避免了细胞凋亡。由此推断,细胞内Mn-SOD水平的降低导致细胞内线粒体超氧化物蓄积,可能通过GSK-3β影响HO-1和Drp1水平,促进线粒体裂解和细胞凋亡,这是MTX引起肝细胞损伤的分子机制之一;外源导入Mn-SOD后其在细胞内高表达,可能通过清除药物代谢产生的超氧化物,进而通过GSK-3β影响HO-1和Drp1水平,激活线粒体,保护细胞免受氧化应激损伤,最终抑制肝细胞凋亡。因此,通过外源导入SOD来阻断或逆转MTX相关肝细胞损伤是一条潜在的治疗途径,然而SOD分子量大、细胞渗透性差、血液中半衰期短、不能口服和价格昂贵,使其作为一种生物制剂药物广泛应用于临床还有待于进一步研究和开发。
基金资助
国家自然科学基金(81500455);湖南省自然科学基金(2022JJ30825,2020JJ4793);湖南省卫生健康委员会项目(202120700992)。
This work was supported by the National Natural Science Foundation (81500455), the Natural Science Foundation of Hunan Province (2022JJ30825, 2020JJ4793), and the Project of Hunan Provincial Health Commission (202120700992), China.
利益冲突声明
作者声称无任何利益冲突。
作者贡献
李卓 论文构想、撰写;陈梦璇、汪苇杭 试剂采购,数据采集;刘其摇、李耐萍、贺波 统计分析;蒋永芳、马静 论文修改。所有作者阅读并同意最终的文本。
原文网址
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2022091191.pdf
参考文献
- 1. Andrade RJ, Chalasani N, Björnsson ES, et al. Drug-induced liver injury[J]. Nat Rev Dis Primers, 2019, 5: 58. 10.1038/s41572-019-0105-0. [DOI] [PubMed] [Google Scholar]
- 2. Duh MS, Walker AM, Kronlund KH. Descriptive epidemiology of acute liver enzyme abnormalities in the general population of central Massachusetts[J]. Pharmacoepidemiol Drug Saf, 1999, 8(4): 275-283. . [DOI] [PubMed] [Google Scholar]
- 3. Hoofnagle JH, Björnsson ES. Drug-induced liver injury—types and phenotypes[J]. N Engl J Med, 2019, 381(3): 264-273. 10.1056/nejmra1816149. [DOI] [PubMed] [Google Scholar]
- 4. Shen T, Liu YX, Shang J, et al. Incidence and etiology of drug-induced liver injury in mainland China[J]. Gastroenterology, 2019, 156(8): 2230-2241. 10.1053/j.gastro.2019.02.002. [DOI] [PubMed] [Google Scholar]
- 5. Mahmoud AM, Hozayen WG, Ramadan SM. Berberine ameliorates methotrexate-induced liver injury by activating Nrf2/HO-1 pathway and PPARγ, and suppressing oxidative stress and apoptosis in rats[J]. Biomed Pharmacother, 2017, 94: 280-291. 10.1016/j.biopha.2017.07.101. [DOI] [PubMed] [Google Scholar]
- 6. Bafna P, Sahoo RR, Hazarika K, et al. Prevalence of liver fibrosis by Fibroscan in patients on long-term methotrexate therapy for rheumatoid arthritis[J]. Clin Rheumatol, 2021, 40(9): 3605-3613. 10.1007/s10067-021-05678-8. [DOI] [PubMed] [Google Scholar]
- 7. Jin FJ, Wu ZZ, Hu X, et al. The PI3K/Akt/GSK-3β/ROS/eIF2B pathway promotes breast cancer growth and metastasis via suppression of NK cell cytotoxicity and tumor cell susceptibility[J]. Cancer Biol Med, 2019, 16(1): 38-54. 10.20892/j.issn.2095-3941.2018.0253. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Arab HH, Safar MM, Shahin NN. Targeting ROS-dependent AKT/GSK-3β/NF-κB and DJ-1/Nrf2 pathways by dapagliflozin attenuates neuronal injury and motor dysfunction in rotenone-induced Parkinson’s disease rat model[J]. ACS Chem Neurosci, 2021, 12(4): 689-703. 10.1021/acschemneuro.0c00722. [DOI] [PubMed] [Google Scholar]
- 9. Lin KL, Zhang Z, Zhang Z, et al. Oleanolic acid alleviates cerebral ischemia/reperfusion injury via regulation of the GSK-3β/HO-1 signaling pathway[J]. Pharmaceuticals (Basel), 2021, 15(1): 1. 10.3390/ph15010001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Diao MY, Zheng JH, Shan Y, et al. Hypothermia prevents hippocampal oxidative stress and apoptosis via the GSK-3β/Nrf2/HO-1 signaling pathway in a rat model of cardiac arrest-induced brain damage[J]. Neurol Res, 2020, 42(9): 773-782. 10.1080/01616412.2020.1774210. [DOI] [PubMed] [Google Scholar]
- 11. Simon HU, Haj-Yehia A, Levi-Schaffer F. Role of reactive oxygen species (ROS) in apoptosis induction[J]. Apoptosis, 2000, 5(5): 415-418. 10.1023/a:1009616228304. [DOI] [PubMed] [Google Scholar]
- 12. Qin ZB, Kong BH, Zheng J, et al. Alprostadil injection attenuates coronary microembolization-induced myocardial injury through GSK-3β/Nrf2/HO-1 signaling-mediated apoptosis inhibition[J]. Drug Des Devel Ther, 2020, 14: 4407-4422. 10.2147/DDDT.S272877. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Verfaillie T, Rubio N, Garg AD, et al. PERK is required at the ER-mitochondrial contact sites to convey apoptosis after ROS-based ER stress[J]. Cell Death Differ, 2012, 19(11): 1880-1891. 10.1038/cdd.2012.74. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Hasnat M, Yuan ZQ, Naveed M, et al. Drp1-associated mitochondrial dysfunction and mitochondrial autophagy: a novel mechanism in triptolide-induced hepatotoxicity[J]. Cell Biol Toxicol, 2019, 35(3): 267-280. 10.1007/s10565-018-9447-8. [DOI] [PubMed] [Google Scholar]
- 15. Yang HY, Zhang F, Cheng ML, et al. Glycogen synthase kinase-3β inhibition decreases inflammation and relieves cancer induced bone pain via reducing Drp1-mediated mitochondrial damage[J]. J Cellular Molecular Medi, 2022, 26(14): 3965-3976. 10.1111/jcmm.17432. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Yan J, Liu XH, Han MZ, et al. Blockage of GSK3β-mediated Drp1 phosphorylation provides neuroprotection in neuronal and mouse models of Alzheimer's disease[J]. Neurobiol Aging, 2015, 36(1): 211-227. 10.1016/j.neurobiolaging.2014.08.005. [DOI] [PubMed] [Google Scholar]
- 17. Kim SH, Kim SH, Lee JH, et al. Superoxide dismutase gene (SOD1, SOD2, and SOD3) polymorphisms and antituberculosis drug-induced hepatitis[J]. Allergy Asthma Immunol Res, 2015, 7(1): 88-91. 10.4168/aair.2015.7.1.88. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Ezhilarasan D. Oxidative stress is bane in chronic liver diseases: clinical and experimental perspective[J]. Arab J Gastroenterol, 2018, 19(2): 56-64. 10.1016/j.ajg.2018.03.002. [DOI] [PubMed] [Google Scholar]
- 19. Ježek J, Cooper KF, Strich R. Reactive oxygen species and mitochondrial dynamics: the Yin and Yang of mitochondrial dysfunction and cancer progression[J]. Antioxidants (Basel), 2018, 7(1): 13. 10.3390/antiox7010013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Braik A, Lahouel M, Merabet R, et al. Myocardial protection by Propolis during prolonged hypothermic preservation[J]. Cryobiology, 2019, 88: 29-37. 10.1016/j.cryobiol.2019.04.003. [DOI] [PubMed] [Google Scholar]
- 21. Andrade RJ, Ortega-Alonso A, Lucena MI. Drug-induced liver injury clinical consortia: a global research response for a worldwide health challenge[J]. Expert Opin Drug Metab Toxicol, 2016, 12(6): 589-593. 10.1517/17425255.2016.1141896. [DOI] [PubMed] [Google Scholar]
- 22. Leise MD, Poterucha JJ, Talwalkar JA. Drug-induced liver injury[J]. Mayo Clin Proc, 2014, 89(1): 95-106. 10.1016/j.mayocp.2013.09.016. [DOI] [PubMed] [Google Scholar]
- 23. Kia R, Kelly L, Sison-Young RL, et al. microRNA-122: a novel hepatocyte-enriched in vitro marker of drug-induced cellular toxicity[J]. Toxicol Sci, 2015, 144(1): 173-185. 10.1093/toxsci/kfu269. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24. Donato MT, Jiménez N, Pelechá M, et al. Oxidative-stress and long-term hepatotoxicity: comparative study in Upcyte human hepatocytes and hepaRG cells[J]. Arch Toxicol, 2022, 96(4): 1021-1037. 10.1007/s00204-022-03236-y. [DOI] [PubMed] [Google Scholar]
- 25. Li FY, Qiu YP, Xia F, et al. Dual detoxification and inflammatory regulation by ceria nanozymes for drug-induced liver injury therapy[J]. Nano Today, 2020, 35: 100925. 10.1016/j.nantod.2020.100925. [DOI] [Google Scholar]
- 26. Ott M, Gogvadze V, Orrenius S, et al. Mitochondria, oxidative stress and cell death[J]. Apoptosis, 2007, 12(5): 913-922. 10.1007/s10495-007-0756-2. [DOI] [PubMed] [Google Scholar]
- 27. Schwabe RF, Brenner DA. Mechanisms of liver injury. I. TNF-α-induced liver injury: role of IKK, JNK, and ROS pathways[J]. Am J Physiol Gastrointest Liver Physiol, 2006, 290(4): G583-G589. 10.1152/ajpgi.00422.2005. [DOI] [PubMed] [Google Scholar]
- 28. Mladenović D, Radosavljević T, Ninković M, et al. Liver antioxidant capacity in the early phase of acute paracetamol-induced liver injury in mice[J]. Food Chem Toxicol, 2009, 47(4): 866-870. 10.1016/j.fct.2009.01.020. [DOI] [PubMed] [Google Scholar]
- 29. Zhang ZW, Zhang XW, Meng L, et al. Pioglitazone inhibits diabetes-induced atrial mitochondrial oxidative stress and improves mitochondrial biogenesis, dynamics, and function through the PPAR-γ/PGC-1α signaling pathway[J]. Front Pharmacol, 2021, 12: 658362. 10.3389/fphar.2021.658362. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30. Miura T, Tanno M. Mitochondria and GSK-3beta in cardioprotection against ischemia/reperfusion injury[J]. Cardiovasc Drugs Ther, 2010, 24(3): 255-263. 10.1007/s10557-010-6234-z. [DOI] [PubMed] [Google Scholar]