Abstract
目的
伴发胸腔积液的晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者已失去手术机会,表皮生长因子受体(epithelial growth factor receptor,EGFR)酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)是EGFR敏感突变的晚期NSCLC患者的一线用药。但EGFR-TKIs治疗时或治疗后出现的疾病进展以及药物的更新迭代给临床诊治带来了挑战,需要对存档的胸腔积液细胞样本进行EGFR复检或比对研究。本研究采用细胞HE染色涂片与细胞蜡块两种制作方法对NSCLC胸腔积液样本的EGFR突变基因进行检测,分析两种保存方式、保存时间对胸腔积液细胞DNA质量的影响,以期探索出一条保存细胞学资料及充分利用细胞学档案资料的可靠途径。
方法
选取2014年10月—2021年4月航天中心医院病理科接收的胸腔积液样本57例,所有样本同时制作细胞HE染色涂片与细胞蜡块。将57例配对的细胞HE染色涂片与细胞蜡块采用扩增阻碍突变系统-聚合酶链反应(amplification refractory mutation system-polymerase chain reaction,ARMS-PCR)技术进行EGFR基因突变检测。DNA检测浓度为2 ng/μL,细胞HE涂片与配对细胞蜡块DNA样本并排进行扩增。结果判读按试剂说明书要求,待测样本的8号孔外控循环阈值(cycle threshold,Ct值)在13~21之间为样本合格,EGFR基因突变Ct值<26时,判断为阳性;26≤Ct值<29为临界阳性,Ct值≥29为阴性。ΔCt值为突变Ct值与外控信号Ct值的差值。比较细胞HE染色涂片与细胞蜡块检测为阳性的ΔCt值。同时将57例患者按时间段分为4组:2014—2015年(n=10),2016—2017年(n=20),2018—2019年(n=17),2020—2021年(n=10)。比较不同时间段的检测结果。
结果
57例晚期NSCLC患者中以胸腔积液为首发症状入院者42例,占73.7%;57例中37例发生EGFR突变,突变率64.9%;19del突变和L858R突变为主要的突变类型,分别占37.8%(14/37)和48.6%(18/37);37例突变患者中女性占56.7%(21/37);细胞涂片与配对的细胞蜡块突变一致率为100%;细胞HE染色涂片的ΔCt值小于配对细胞蜡块的ΔCt值(t=4.526,P<0.001)。37例配对细胞蜡块与细胞HE染色涂片的突变Ct值均<26。4个时间段中,2014—2015年、2016—2017年、2018—2019年的细胞蜡块突变基因Ct均值均高于2020—2021年(P<0.05);4个时间段的细胞HE染色涂片突变Ct均值差异无统计学意义(P>0.05)。57例配对细胞蜡块与细胞HE染色涂片的外控Ct值均在13~21之间。2014—2015年、2016—2017年的细胞蜡块与细胞HE染色涂片的外控Ct值均高于2018—2019年、2020—2021年(均P<0.05)。
结论
细胞HE染色涂片与细胞蜡块检测NSCLC胸腔积液样本EGFR突变具有极好的一致性,且细胞HE染色涂片的DNA质量优于细胞蜡块,但细胞HE染色涂片的局限在于不可复制性,建议在胸腔积液标本制作中进行多张涂片,以满足多次检测的需求。
Keywords: 表皮生长因子受体, 非小细胞肺癌, 胸腔积液, 细胞HE染色涂片, 细胞蜡块
Abstract
Objective
The advanced non-small cell lung cancer (NSCLC) patients with pleural effusion have no opportunity for surgery treatment. Epidermal growth factor receptor (EGFR) tyrosine kinase inhibitors (TKIs) are the first-line drugs for these patients with EGFR-sensitive mutation. However, the disease progression and drug update during or after treatment of EGFR-TKIs bring more challenges and puzzles to clinical diagnosis and treatment, which inevitably requires archived pleural cell samples for EGFR re-examination or comparative study. Understanding the DNA quality of archived pleural fluid samples and effectively using archival data of pleural fluid cells are of great significance for tracing the origin of cases and basic medical research. This study aims to evaluate the consistency of EGFR mutant gene expression between the 2 methods, and to explore a reliable way for preserving cytological data and making full use of cytological archival data via cell HE staining smear and cell paraffin section.
Methods
A total of 57 pleural fluid cytology cases in the Department of Pathology of China Aerospace Center Hospital from October 2014 to April 2021 were selected. Tumor cells were detected by cell HE staining smears and immunohistochemical staining for TTF-1 and Napsin A in the paired cell paraffin sections. There were more than 200 tumor cells in cell HE staining smear and the proportion of tumor cells were ≥70% in matched cell paraffin sections. Patients with 2 cell smears (one for cell data retention and the other for DNA extraction) were selected as the research subjects, and 57 pleural fluid samples were enrolled. EGFR gene mutation was detected by amplification refractory mutation system-polymerase chain reaction in 57 paired cell HE staining smears and cell paraffin sections. DNA concentration was 2 ng/μL. Cell HE smear was amplified side-by-side with DNA samples from paired cell paraffin sections. Result determination was according to the requirements of the reagent instructions. The external control cycle threshold (Ct) value of the No. 8 well of the samples to be tested was between 13 and 21, which was considered as successful and reliable samples. When the Ct value of EGFR gene mutation was <26, it was considered as positive; when the Ct value was between 26 and 29, it was critical positive; when the Ct value was equal or more than 29, it was negative. ΔCt value was the difference between mutant Ct value and externally controlled Ct value. The smaller the ΔCt value was, the better the quality of DNA of the detected sample was.
Results
Among the 57 pleural effusion samples, 42 patients were hospitalized with pleural effusion as the first symptom, accounting for 73.7% (42/57). EGFR mutation was detected in 37 samples [64.9% (37/57)]. The mutation rate for 19del was 37.8% (14/37) while for L858R was 48.6% (18/37). Females were 56.7% (21/37) of mutation cases. The mutation consistency rate of cell HE staining smear and matched cell paraffin sections was 100%. The ΔCt values of cell HE staining smears were less than those of matched cell paraffin sections. The mutation Ct values of 37 cytological samples were statistically analyzed according to the preservation periods of the years of 2014—2015, 2016—2017, 2018—2019, and 2020—2021. There were significant differences in cell paraffin section in the years of 2014—2015 and 2016—2017 compared with the years of 2018—2019 and 2020—2021, while no significant differences were found in cell HE staining smear. Statistical analysis of externally controlled Ct values of 57 cytological samples showed that there were significant differences between cell HE staining smears and cell paraffin section in the years of 2014—2015 and 2016—2017, compared with the years of 2018—2019 and 2020—2021. The mutational Ct values of 37 paired cell blocks and smears were all <26, and the externally controlled Ct values of 57 paired cell paraffin sections and HE staining smears were all between 13 and 21.
Conclusion
The DNA quality of cell HE smears and matched cell paraffin section met the qualified requirements. Two methods possess show an excellent consistency in detecting EGFR mutation in NSCLC pleural fluid samples. The DNA quality of cell HE staining smear is better than that of cell paraffin sections, so cell HE staining smear can be used as important supplement of the gene test source. It should be noted that the limitation of cell HE staining smears is non-reproducibility, so multiple smears of pleural fluid are recommended to be prepared for multiple tests.
Keywords: epithelial growth factor receptor, non-small cell lung cancer, pleural fluid, cell HE staining smear, cell paraffin section
肺癌是全球发病率、病死率最高的恶性肿瘤[1]。 肺癌中约85%的为非小细胞肺癌(non-small cell lung cancer,NSCLC)[2],而10%~50%的NSCLC患者首诊时已出现胸腔积液,失去了手术机会[3]。对于表皮生长因子受体(epithelial growth factor receptor,EGFR)突变敏感的且伴有胸腔积液的NSCLC患者,一线治疗方法是使用EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)[4],但EGFR-TKIs治疗时或治疗后出现疾病进展,以及药物的更新迭代和治疗模式的变化都会给临床诊治带来挑战[5],需要对存档的胸腔积液细胞样本进行复检及比对研究。因此,了解存档胸腔积液资料的DNA质量,有效利用胸腔积液细胞学资料,对病例的溯源及医学基础研究具有重要意义。
胸腔积液样本细胞的保存方式主要为细胞蜡块与细胞HE染色涂片。胸腔积液细胞蜡块已成为检测NSCLC的EGFR基因突变的重要途径[6-7]。李迎雪等[7]研究发现:采用富集胸腔积液沉渣制作的细胞蜡块检测EGFR基因,突变检出率与肺活体组织标本无差别。但在实际工作中,细胞蜡块存在如下问题:1)细胞蜡块制作的成功率仅为88.8%,未能成功制作蜡块的原因是胸腔积液中细胞沉渣过少[8];2)尚未建立必须制作细胞蜡块的规范性要求,导致胸腔积液标本失去制作细胞蜡块的机会;3)EGFR基因检测前,细胞蜡块需经历多次切片,用于NSCLC的免疫组织化学(以下简称免疫组化)鉴别诊断,造成细胞蜡块中肿瘤细胞数量减少;4)经石蜡包埋的细胞蜡块随着储存时间的延长,会出现核酸与蛋白质的损失或片段化现象,保存3年后的细胞蜡块DNA降解严重,影响DNA浓度及质量的检测[9]。上述情况均可导致临床上对NSCLC患者在EGFR突变相关性诊疗、病例溯源性研究方面遇到困难。细胞HE染色涂片是胸腔积液细胞样本制作的重要且必需的技术方法,每一份胸腔积液细胞样本都会被制成细胞HE染色涂片并作为病理档案长期保存,但其被再次使用的概率极低,且对存档细胞涂片DNA质量评估的报道较少。本研究采用扩增阻碍突变系统-聚合酶链反应(amplification refractory mutation system-polymerase chain reaction,ARMS-PCR)方法对航天中心医院近8年的胸腔积液细胞档案资料进行EGFR基因检测,对细胞学HE染色涂片与细胞蜡块样本之间的突变符合率、突变循环阈值(cycle threshold,Ct值)、外控Ct值进行比对分析,验证两种胸腔积液细胞保存方式、保存时间对胸腔积液细胞DNA质量的影响,以期探索出一条保存细胞学资料及充分利用细胞学档案资料的可靠途径。
1. 资料与方法
1.1. 一般资料
选取2014年10月—2021年4月航天中心医院病理科接收的胸腔积液细胞学样本57例。均符合以下标准:细胞HE染色涂片查见肿瘤细胞且配对细胞蜡块中甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)、Napsin A的免疫组化结果为阳性;细胞HE染色涂片查见肿瘤细胞>200个且配对细胞蜡块的肿瘤细胞占比≥70%;具备2张细胞涂片(一张作为细胞资料留档,另一张用于提取DNA样本)。按接受样本的时间分为4组:2014—2015年(n=10)、2016—2017年(n=20)、2018—2019年(n=17)、2020—2021年 (n=10)。
1.2. 检测标本的制备
1.2.1. 胸腔积液细胞蜡块的制备
将新鲜胸腔积液混匀后取50 mL置于离心管内,以2 500 r/min离心10 min,弃上清液,如沉淀量不够,可反复离心收集(如有血性沉淀,加入30%乙醇 20 mL,振荡均匀,以2 500 r/min离心10 min,去除血细胞干扰);向沉淀中加10%的中性缓冲甲醛1 mL,静置10 min,加入95%乙醇13 mL,混匀后以2 500 r/min离心10 min,弃上清液,将底部沉淀吸取到擦镜纸上,将所有沉淀物固定于10%中性缓冲甲醛中,经组织脱水、浸蜡、包埋等过程制成石蜡切片。
1.2.2. 细胞HE染色涂片的制备
将新鲜胸腔积液混匀后取50 mL置于离心管内,以2 500 r/min离心10 min,弃上清液(如有血性沉淀,先加入30%乙醇20 mL,振荡均匀,以2 500 r/min离心10 min,去除血细胞干扰),将所有沉淀物进行直接涂片,并立即放入95%乙醇中固定10 min以上,行细胞病理诊断检查后保留涂片。
1.3. DNA提取方法
每一份样本配对有细胞HE染色涂片与细胞蜡块。细胞HE染色涂片肿瘤细胞数量>200个,封片完好、细胞无退变。去除盖玻片,为避免污染,用一次性刀片刮取富集区的肿瘤细胞入EP管中。选择配对的细胞蜡块,选取肿瘤数量占70%以上的细胞蜡块,用一次性刀片切取蜡片,每片5 μm,连续5片,存放于EP管中。采用DNA提取试剂盒(厦门艾德生物医药科技股份有限公司)严格按试剂盒说明书进行操作。使用超微量紫外分光光度计检测DNA纯度,即260 nm波长处与280 nm波长处的光密度(OD)值的比值(OD260/OD280)。细胞HE染色涂片与细胞蜡块DNA上样浓度一致,均为2 ng/μL;同一病例的细胞HE染色涂片与细胞蜡块同时进行DNA扩增。
1.4. EGFR 基因突变检测
将提取的DNA稀释至2 ng/μL后,按照人类EGFR基因突变检测试剂盒(厦门艾德生物医药科技股份有限公司)说明书制备上样体系,将检测样本置于ABI 7500实时荧光定量PCR仪,同时设置阴性对照与阳性对照,按照试剂盒中的程序进行检测。试剂盒采用8联PCR管设计,每一个8联PCR管检测1个样本,制作中将一例患者的胸腔积液样本的细胞涂片与细胞蜡块并排放于PCR仪。
1.5. 结果判读
待测样本的8号孔外控Ct值在13~21之间为样本合格,EGFR基因突变Ct值<26时,判断为阳性, 26≤Ct值<29为临界阳性,Ct值≥29为阴性。ΔCt值为突变Ct值与外控信号Ct值的差值,ΔCt值越小说明检测样本DNA的质量越好。
1.6. 统计学处理
采用SPSS 19.0统计学软件进行数据分析,对细胞HE染色涂片及石蜡切片检测均为阳性病例的两种ΔCt值行配对t检验,P<0.05为差异有统计学意义。
2. 结 果
2.1. 临床病理特征
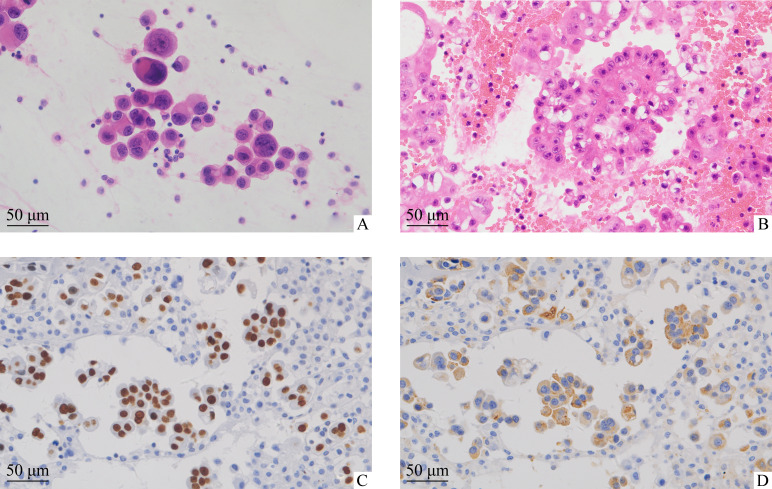
在57例患者中,以胸腔积液为首发症状入院者42例(73.7%),EGFR基因突变37例(64.9%),其中女性21例(56.7%,21/37)。对57例胸腔积液细胞学涂片行病理诊断,可见肿瘤细胞呈簇状、片状或散在排列,胞核染色质粗糙、核仁清晰,胞质丰富,可见黏液空泡,部分病例可见细胞凋亡、红细胞、核碎裂等形态。在显微镜下细胞蜡块中的肿瘤细胞多在纤维素包绕下呈腺腔样、簇状、乳头状肿瘤细胞团,结构类似于腺样组织(图1)。
图1.
胸腔积液细胞涂片及细胞蜡块切片的HE染色、免疫组织化学染色
Figure 1 Pleural fluid cell smears and cell paraffin sections were stained by HE and immunohistochemistry
A: Tumor cells in pleural smear are scattered, with rough chromatin, clear nucleoli and significant cell heterotropy. B: Pleural fluid cells from paraffin section stained by HE show adenoid tissue structure surrounded by cellulose. C: Immunohistochemical staining of TTF-1 cell nuclei in waxy pleural fluid cells are positive. D: Immunohistochemical staining of Napsin A tumor cytoplasm shows the positive expression in the pleural fluid cell paraffin section.
2.2. 细胞HE染色涂片与细胞蜡块检测 EGFR 的 一致性
在57例配对的细胞HE染色涂片和细胞蜡块中,结果均为EGFR突变的37例(64.9%),其中19del突变14例(37.8%,14/37);L858突变共计18例(48.6%,18/37),包括L858R突变17例和L858R与T790M双突变1例;G719X突变1例(2.7%,1/37),L861Q突变2例(5.4%,2/37),20ins突变1例(2.7%,1/37),S768I突变1例(2.7%,1/37)。细胞HE染色涂片与细胞蜡块对EGFR突变的检出率一致性达到100%(图2,表1)。
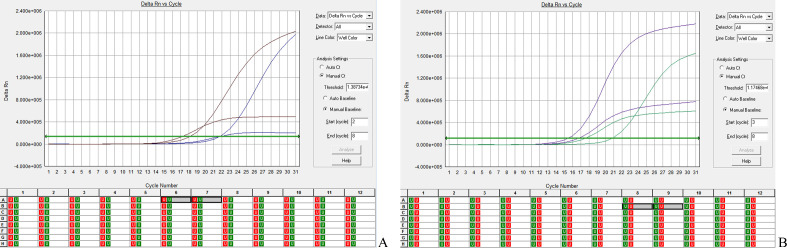
图2.
同一病例的细胞HE染色涂片与配对细胞蜡块的PCR扩增图
Figure 2 In the same case, the cell HE staining smear and the paired cell paraffin section were arranged side-by-side for PCR amplification
A: Mutation at site 19del; B: Mutation at site L858R.
表1.
用细胞HE染色涂片与细胞蜡块检测 EGFR 基因突变的结果
Table 1 EGFR gene mutation detection results of cell HE staining smears and cell paraffin sections
| 样本编号 | 细胞HE染色涂片 | 细胞蜡块 | ||||||
|---|---|---|---|---|---|---|---|---|
| 突变Ct值 | 外控Ct值 | ΔCt值 | 突变 | 突变Ct值 | 外控Ct值 | ΔCt值 | 突变 | |
| 1 | 18.15 | 17.53 | 0.62 | 是 | 20.37 | 16.36 | 4.01 | 是 |
| 2 | 17.43 | 15.68 | 1.75 | 是 | 20.98 | 16.08 | 4.90 | 是 |
| 3 | 19.99 | 17.07 | 2.92 | 是 | 22.98 | 18.12 | 4.86 | 是 |
| 4 | 18.97 | 16.25 | 2.72 | 是 | 20.71 | 17.89 | 2.82 | 是 |
| 5 | 22.18 | 21.66 | 0.52 | 是 | 21.78 | 19.31 | 2.47 | 是 |
| 6 | — | 16.15 | — | 否 | — | 17.31 | — | 否 |
| 7 | — | 18.84 | — | 否 | — | 17.90 | — | 否 |
| 8 | — | 15.34 | — | 否 | — | 18.05 | — | 否 |
| 9 | — | 17.95 | — | 否 | — | 21.47 | — | 否 |
| 10 | 19.08 | 19.78 | -0.70 | 是 | 18.12 | 17.10 | 1.02 | 是 |
| 11 | 19.95 | 17.10 | 2.85 | 是 | 19.76 | 16.57 | 3.19 | 是 |
| 12 | 17.73 | 16.41 | 1.32 | 是 | 20.69 | 18.45 | 2.24 | 是 |
| 13 | 21.48 | 16.47 | 5.01 | 是 | 21.97 | 16.53 | 5.44 | 是 |
| 14 | 22.72 | 15.25 | 7.45 | 是 | 19.85 | 15.42 | 4.43 | 是 |
| 15 | 18.26 | 17.22 | 1.04 | 是 | 21.93 | 17.10 | 4.83 | 是 |
| 16 | 20.76 | 18.23 | 2.53 | 是 | 21.60 | 16.17 | 5.43 | 是 |
| 17 | 16.61 | 15.90 | 0.70 | 是 | 20.81 | 20.08 | 0.73 | 是 |
| 18 | 22.24 | 23.28 | -1.04 | 是 | 21.11 | 18.55 | 2.56 | 是 |
| 19 | 18.14 | 15.01 | 3.13 | 是 | 23.09 | 16.03 | 7.06 | 是 |
| 20 | — | 19.20 | — | 否 | — | 17.44 | — | 否 |
| 21 | — | 19.20 | — | 否 | — | 17.44 | — | 否 |
| 22 | — | 15.86 | — | 否 | — | 16.19 | — | 否 |
| 23 | — | 14.52 | — | 否 | — | 17.76 | — | 否 |
| 24 | — | 15.23 | — | 否 | — | 18.83 | — | 否 |
| 25 | — | 15.15 | — | 否 | — | 17.15 | — | 否 |
| 26 | — | 15.79 | — | 否 | — | 16.32 | — | 否 |
| 27 | — | 16.05 | — | 否 | — | 18.05 | — | 否 |
| 28 | — | 17.66 | — | 否 | — | 18.20 | — | 否 |
2.3. 细胞HE染色涂片与细胞蜡块检测 EGFR 突变的ΔCt值比较
37例胸腔积液样本检测到EGFR基因突变,其细胞HE染色涂片的ΔCt均值小于配对的细胞蜡块的ΔCt均值(2.49 vs 3.73,t=4.526,P<0.001)。
2.4. 不同时间段细胞蜡块与细胞HE染色涂片检测 EGFR 突变的Ct值比较
37例配对细胞蜡块与细胞HE染色涂片的突变Ct值均<26。2014—2015年、2016—2017年、2018—2019年的细胞蜡块突变基因Ct均值均高于2020—2021年(均P<0.05);4个时间段的细胞HE染色涂片突变Ct均值差异无统计学意义(P>0.05,表2)。
表2.
2014—2021年细胞蜡块与细胞HE染色涂片检测 EGFR 突变的Ct值比较
Table 2 Expression of Ct values of samples prepared by the cell HE staining smears and the paired cell paraffin sections from 2014 to 2021
| 样本编号 | 细胞HE染色涂片 | 细胞蜡块 | ||||||
|---|---|---|---|---|---|---|---|---|
| 突变Ct值 | 外控Ct值 | ΔCt值 | 突变 | 突变Ct值 | 外控Ct值 | ΔCt值 | 突变 | |
| 29 | — | 15.65 | — | 否 | — | 21.61 | — | 否 |
| 30 | 15.17 | 13.88 | 1.29 | 是 | 18.46 | 15.47 | 2.99 | 是 |
| 31 | 17.01 | 14.65 | 2.36 | 是 | 19.60 | 15.81 | 3.79 | 是 |
| 32 | 16.86 | 14.07 | 2.79 | 是 | 19.41 | 14.89 | 4.52 | 是 |
| 33 | 16.54 | 15.24 | 1.30 | 是 | 15.34 | 12.58 | 2.76 | 是 |
| 34 | 18.28 | 14.42 | 3.86 | 是 | 23.19 | 14.78 | 8.41 | 是 |
| 35 | 18.64 | 16.11 | 2.53 | 是 | 21.28 | 18.61 | 2.67 | 是 |
| 36 | 17.41 | 16.28 | 1.13 | 是 | 18.43 | 16.72 | 1.71 | 是 |
| 37 | 16.51 | 13.18 | 3.32 | 是 | 18.57 | 12.97 | 5.60 | 是 |
| 38 | 15.88 | 12.23 | 3.65 | 是 | 17.65 | 13.63 | 4.02 | 是 |
| 39 | 23.40 | 15.69 | 7.71 | 是 | 24.57 | 17.55 | 7.02 | 是 |
| 40 | 19.33 | 15.24 | 4.09 | 是 | 19.64 | 15.89 | 3.75 | 是 |
| 41 | 20.24 | 16.64 | 3.60 | 是 | 22.74 | 17.37 | 5.37 | 是 |
| 42 | 18.31 | 14.52 | 3.79 | 是 | 23.32 | 18.07 | 5.25 | 是 |
| 43 | — | 15.51 | — | 否 | — | 15.48 | — | 否 |
| 44 | — | 15.23 | — | 否 | — | 16.98 | — | 否 |
| 45 | — | 11.88 | — | 否 | — | 14.43 | — | 否 |
| 46 | — | 16.02 | — | 否 | — | 17.78 | — | 否 |
| 47 | — | 16.05 | — | 否 | — | 16.47 | — | 否 |
| 48 | 16.34 | 16.06 | 0.28 | 是 | 15.74 | 15.23 | 0.51 | 是 |
| 49 | 14.24 | 15.19 | -0.95 | 是 | 16.14 | 14.24 | 1.90 | 是 |
| 50 | 15.42 | 14.68 | 0.74 | 是 | 18.82 | 15.09 | 3.73 | 是 |
| 51 | 21.08 | 15.15 | 5.93 | 是 | 20.95 | 14.26 | 6.69 | 是 |
| 52 | 14.15 | 15.96 | -1.81 | 是 | 14.70 | 17.00 | -2.30 | 是 |
| 53 | 18.86 | 14.45 | 4.41 | 是 | 18.28 | 14.73 | 3.55 | 是 |
| 54 | 18.05 | 13.81 | 4.24 | 是 | 17.30 | 14.89 | 2.41 | 是 |
| 55 | 19.12 | 16.80 | 2.32 | 是 | 18.43 | 15.78 | 2.65 | 是 |
| 56 | 23.90 | 19.28 | 4.62 | 是 | 20.82 | 15.74 | 5.08 | 是 |
| 57 | — | 15.40 | — | 否 | — | 16.19 | — | 否 |
—:突变Ct值无信号或≥29,EGFR野生型。
2.5. 不同时间段细胞蜡块与细胞HE染色涂片检测 EGFR 外控Ct值比较
57例配对细胞蜡块与细胞HE染色涂片的外控Ct值均在13~21之间。2014—2015年、2016—2017年的细胞蜡块与细胞HE染色涂片的外控Ct值均高于2018—2019年、2020—2021年(均P<0.05,表2)。
表2.
2014—2021年细胞蜡块与细胞HE染色涂片检测EGFR突变的Ct值比较
Table 2 Expression of Ct values of samples prepared by the cell HE staining smears and the paired cell paraffin sections from 2014 to 2021
| 时间段 | 细胞蜡块突变基因Ct均值 | 细胞蜡块外控基因Ct均值 |
细胞蜡块ΔCt 均值 |
细胞涂片突变基因Ct均值 | 细胞涂片外控基因Ct均值 |
细胞涂片ΔCt 均值 |
|---|---|---|---|---|---|---|
| 2014—2015年 | 21.36* | 18.05† | 3.81 | 19.34* | 17.39† | 1.71 |
| 2016—2017年 | 20.89* | 17.55† | 3.69 | 19.69* | 16.95† | 2.23 |
| 2018—2019年 | 20.17* | 15.86 | 4.45 | 17.97* | 14.82 | 3.19 |
| 2020—2021年 | 17.91 | 15.32 | 2.69 | 17.91 | 15.68 | 2.20 |
与2020—2021年比较,*P<0.05;与2020—2021或2018—2019比较,†P<0.05。
3. 讨 论
肺癌是引发胸腔积液的主要病因之一,晚期NSCLC患者的病变常转移至胸膜,造成胸膜的毛细血管和淋巴管回流受阻,产生大量的胸腔积液,超过40%的晚期患者会出现恶性胸腔积液[3, 10]。本研究纳入57例晚期NSCLC患者,其中42例以胸腔积液为首发症状,占73.7%,占比高于以往研究[3, 10]报道,可能与本研究选取的胸腔积液样本中肿瘤细胞含量较高有关。NSCLC患者的EGFR突变率为35%~50%[11-12],伴发胸腔积液的NSCLC患者的EGFR突变率会更高[13-14]。本研究结果显示EGFR基因突变率高达64.9%,提示转移性NSCLC患者有更高的EGFR突变率,与文献[14]报道一致。19del与L858R为EGFR的主要突变类型,研究[15]显示19del和L858R突变占EGFR基因突变的88.9%。本研究结果显示:19del突变占37.8%,L858R突变占48.6%,二者之和占86.4%。研究[16]报道女性患者的EGFR突变率更高,本研究结果显示女性患者EGFR突变率为56.7%,与上述研究结果基本一致。
研究[17]报道“新鲜的”胸腔积液的基因检测与细胞蜡块检测的一致性良好。本研究发现:陈旧的胸腔积液细胞HE染色涂片与细胞蜡块检测EGFR突变率具有极好的一致性。本研究对配对细胞HE染色涂片与细胞蜡块检测的37例EGFR突变ΔCt值进行对比,结果显示细胞HE染色涂片ΔCt值明显低于细胞蜡块ΔCt值。ΔCt值为突变Ct值与外控Ct值的差值,外控Ct值反映DNA提取的效率,而突变Ct值说明DNA底物的数量,二者数值差反映DNA的提取效率及质量。由此可见,储存期在8年以内的细胞HE染色涂片的DNA检测质量优于细胞蜡块质量,其原因与细胞学涂片的流程及保存方式均有关系:1)细胞学涂片的制作建立在离体之后的“新鲜”胸腔积液样本基础之上,离心后将胸腔积液沉渣直接涂于载玻片上,涂片后立即将之投入固定液中。细胞常用固定液为95%的乙醇,乙醇能够沉淀细胞蛋白与核酸,且不与核酸发生任何反应,对细胞具有很好的固定与保护作用。2)细胞学涂片经95%乙醇固定后,直接进行HE染色。此过程未经如细胞蜡块的甲醛固定、脱水、浸蜡的诸多处理环节,避免了DNA暴露于甲醛和石蜡中而产生交联和片段化,极大地保护了DNA的质量。3)中性树胶用于封存细胞学涂片。树胶是树体分泌细胞产生的分泌物,当树体遭受损伤而出现伤口时,树胶流出,包裹细胞,防止病菌的侵袭和氧化;树胶一般会用二甲苯溶剂稀释,树胶与二甲苯均有防霉变作用,有利于细胞的长期保存;另外,中性树胶的 pH呈中性,对于细胞及载玻片无腐蚀作用,所以中性树胶对于细胞的DNA能够起到长久的保存作用。
突变Ct值反映DNA的纯度及样本含量。本研究均以2 ng/μL为加样浓度,对37例EGFR突变样本的突变Ct值进行分析,发现2014—2015年、2016—2017年、2018—2019年的突变Ct值均明显高于 2020—2021年组,而4个时间段的细胞HE染色涂片突变Ct均值无明显差异。表明细胞蜡块随着时间的延长,DNA可能出现降解而影响DNA片段的完整性[9];而细胞学涂片的DNA含量与质量相对稳定。37例配对细胞蜡块与细胞学涂片的EGFR突变Ct值均<26,均在突变阳性值之内,这可能与本组选取的患者胸腔积液中肿瘤细胞的含量高有关。本研究结果与文献[13]报道一致。
本研究对57例样本的外控Ct值进行分析,发现2014—2015年、2016—2017年的细胞蜡块与细胞HE染色涂片的外控Ct值均高于2018—2019年、2020—2021年。按产品说明书,将8号管作为DNA提取质量的监控管,外控Ct值反映DNA提取的质量,正常参考值范围为13~21,本研究的57例样本均在正常参考值范围,表明2014年至今的样本DNA质量是可靠的,均可用于检测。但随着保存时间的延长,无论是细胞蜡块还是细胞学涂片,都可能出现DNA质量下降的情况。
综上所述,本研究通过回顾性分析8年来的NSCLC胸腔积液样本,发现细胞HE染色涂片与细胞蜡块检测EGFR突变具有极好的一致性,且细胞HE染色涂片的DNA质量优于细胞蜡块,提示细胞HE染色涂片能够作为长期且稳定保存DNA的方法,作为基因检测资料来源的重要补充,为细胞学分子检测带来更好的应用价值。但细胞HE染色涂片的局限在于不可复制性,所以建议在制作中进行多张涂片,以满足多次检测的需求。
利益冲突声明
作者声称无任何利益冲突。
作者贡献
侯芳 EGFR分子检测、数据采集和整理、论文写作;齐长海、卢一艳、李方 细胞学病理诊断;郝志红 免疫组织化学制作。
原文网址
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/20220135.pdf
参考文献
- 1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. htttps: //doi.org/10.3322/caac.21442. [DOI] [PubMed] [Google Scholar]
- 2. Lu S, Yu YF, Yang Y. Retrospect and prospect for lung cancer in China: clinical advances of immune checkpoint inhibitors[J]. Oncologist, 2019, 24(Suppl 1): S21-S30. htttps: //doi.org/10.1634/theoncologist.2019-IO-S1-s02. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Li XY, Liu SL, Cha N, et al. Transcription expression and clinical significance of dishevelled-3 mRNA and δ-catenin mRNA in pleural effusions from patients with lung cancer[J]. Clin Dev Immunol, 2012, 2012: 904946. htttps: //doi.org/10.1155/2012/904946. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4. 中国非小细胞肺癌患者表皮生长因子受体基因突变检测专家组 . 中国非小细胞肺癌患者表皮生长因子受体基因突变检测专家共识(2016版)[J]. 中华病理学杂志, 2016, 45(4): 217-220. htttps: //doi.org/10.3760/cma.j.issn.0529-5807. 2016. 04.001. [Google Scholar]; Expert group on epidermal growth factor receptor gene mutation detection in non-small cell lung cancer patients in China . Expert consensus on epidermal growth factor receptor gene mutation detection in non-small cell lung cancer patients in China[J]. Chinese Journal of Pathology, 2016, 45(4): 217-220. htttps: //doi.org/10.3760/cma.j.issn.0529-5807. 2016. 04.001. [DOI] [PubMed] [Google Scholar]
- 5. 洪少东, 张力. 肺癌靶向治疗新进展及展望[J]. 中国癌症杂志, 2020, 30(10): 733-743. htttps: //doi.org/10.19401/j.cnki. 1007-3639. 2020.10.003. [Google Scholar]; HONG Shaodong, ZHANG Li. Recent advances and prospect in targeted therapy for lung cancer[J]. China Oncology, 2020, 30(10): 733-743. htttps: //doi.org/10.19401/j.cnki. 1007-3639. 2020.10.003. [Google Scholar]
- 6. 李媛, 谢惠康, 武春燕. WHO胸部肿瘤分类(第5版)中肺肿瘤部分解读[J]. 中国癌症杂志, 2021, 31(7): 574-580. htttps: //doi.org/10.19401/j.cnki.1007-3639.2021.07.003. [Google Scholar]; LI Yuan, XIE Huikang, WU Chunyan. Interpretation of lung tumours in the WHO classification of thoracic tumours (the 5th edition)[J]. China Oncology, 2021, 31(7): 574-580. htttps: //doi.org/10.19401/j.cnki.1007-3639.2021.07.003. [Google Scholar]
- 7. 李迎雪, 温文娟, 韩琳, 等. 应用ARMS检测不同类型的肺腺癌标本EGFR基因突变[J]. 临床与实验病理学杂志, 2015, 31(6): 700-702. htttps: //doi.org/10.13315/j.cnki.cjcep.2015.06.027. [Google Scholar]; LI Yingxue, WEN Wenjuan, HAN Lin, et al. Detection of EGFR gene mutation in different types of lung adenocarcinoma by ARMS[J]. Chinese Journal of Clinical and Experimental Pathology, 2015, 31(6): 700-702. htttps: //doi.org/10.13315/j.cnki.cjcep.2015.06.027. [Google Scholar]
- 8. Dong Z, Li H, Zhou J, et al. The value of cell block based on fine needle aspiration for lung cancer diagnosis[J]. J Thorac Dis, 2017, 9(8): 2375-2382. htttps: //doi.org/10.21037/jtd. 2017. 07.91. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. 管文燕, 樊祥山, 陈洁宇, 等. ISO 15189认可规范在分子病理检测结果质量保证中的应用[J]. 临床与病理杂志, 2018, 38(10): 2278-2282. htttps: //doi.org/10.3978/j.issn.2095-6959.2018.10.038.30354226 [Google Scholar]; GUAN Wenyan, FAN Xiangshan, CHEN Jieyu, et al. Application of accreditation criteria published by ISO 15189 in quality assurance for results of molecular pathology detection[J]. Journal of Clinical and Pathological Research, 2018, 38(10): 2278-2282. htttps: //doi.org/10.3978/j.issn. 2095-6959. 2018.10.038. [Google Scholar]
- 10. Porcel JM, Gasol A, Bielsa S, et al. Clinical features and survival of lung cancer patients with pleural effusions[J]. Respirology, 2015, 20(4): 654-659. htttps: //doi.org/10.1111/resp.12496. [DOI] [PubMed] [Google Scholar]
- 11. Shiau CJ, Babwah JP, da Cunha Santos G, et al. Sample features associated with success rates in population-based EGFR mutation testing[J]. J Thorac Oncol, 2014, 9(7): 947-956. htttps: //doi.org/10.1097/JTO.0000000000000196. [DOI] [PubMed] [Google Scholar]
- 12. 常莹, 曹阳, 孔薇薇. EGFR和KRAS在肺腺癌和肺鳞癌中的突变差异和临床意义[J]. 川北医学院学报, 2021, 36(8): 964-967. htttps: //doi.org/10.3969/j.issn.1005-3697.2021.08.003. [Google Scholar]; CHANG Ying, CAO Yang, KONG Weiwei. Mutation differences and clinical significance of EGFR and KRAS in lung adenocarcinoma and lung squamous carcinoma[J]. Journal of North Sichuan Medical College, 2021, 36(8): 964-967. htttps: //doi.org/10.3969/j.issn.1005-3697.2021.08.003. [Google Scholar]
- 13. Wang Y, Liu ZA, Yin HL, et al. Improved detection of EGFR mutations in the tumor cells enriched from the malignant pleural effusion of non-small cell lung cancer patient[J]. Gene, 2018, 644: 87-92. htttps: //doi.org/10.1016/j.gene.2017.10.073. [DOI] [PubMed] [Google Scholar]
- 14. 亓岽东, 徐建平, 朱礼阳, 等. EGFR基因突变在非小细胞肺癌胸水细胞蜡块中的检测分析[J]. 贵州医药, 2017, 41(1): 3-5. [Google Scholar]; QI Dongdong, XU Jianping, ZHU Liyang, et al. Analysis of cell blocks EGFR mutation in pleural effusion of non-small cell lung cancer[J]. Guizhou Medical Journal, 2017, 41(1): 3-5. [Google Scholar]
- 15. 鲁涛, 李强, 李岚, 等. 132例晚期非小细胞肺癌胸腔积液EGFR基因突变检测结果及其临床意义: 一项来自单中心的回顾性研究[J]. 中国肺癌杂志, 2020, 23(12): 1059-1065. htttps: //doi.org/10.3779/j.issn.1009-3419.2020.104.23. [Google Scholar]; LU Tao, LI Qiang, LI Lan, et al. Results of EGFR mutations detected in pleural effusion and its clinical significance in 132 patients with advanced non-small cell lung cancer: a retrospective study in a single center[J]. Chinese Journal of Lung Cancer, 2020, 23(12): 1059-1065. htttps: //doi.org/10.3779/j.issn.1009-3419.2020.104.23. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Dong Y, Ren WH, Qi J, et al. EGFR, ALK, RET, KRAS and BRAF alterations in never-smokers with non-small cell lung cancer[J]. Oncol Lett, 2016, 11(4): 2371-2378. htttps: //doi.org/10.3892/ol.2016.4235. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. 李晓玲, 黄仲, 刘美莲. 胸水细胞蜡块与“新鲜”胸水在肺腺癌EGFR基因检测中的应用[J]. 海南医学, 2020, 31(20): 2668-2670. htttps: //doi.org/10.3969/j.issn.1003-6350.2020.20.023. [Google Scholar]; LI Xiaoling, HUANG Zhong, LIU Meilian. Application of pleural fluid cell wax and “fresh” pleural fluid in EGFR gene deteCtion of lung adenocarcinoma[J]. Hainan Medical Journal, 2020, 31(20): 2668-2670. htttps: //doi.org/10.3969/j.issn.1003-6350.2020.20.023. [Google Scholar]