Abstract
目的
制备和评价7-羟乙基白杨素(7-HEC)聚乳酸-羟基乙酸共聚物(PLGA)纳米粒。
方法
采用乳化溶剂挥发法制备7-HEC/PLGA纳米粒,以粒径、多分散系数(PDI)、包封率、载药量及Zeta电位为评价指标,通过单因素考察结合Box-Behnken响应面法优化处方。采用甘露醇作为冻干保护剂制备冻干粉,对最优处方制备的7-HEC/PLGA纳米粒进行表征及体外释放研究。
结果
经Box-Behnken响应面法优化后的最优处方为:药载比2.12∶20,油水体积比1∶14.7,乳化剂为2.72%大豆磷脂。最优处方条件制备的7-HEC/PLGA纳米粒的平均粒径为(240.28±0.96)nm、PDI为0.25±0.69、包封率为(75.74±0.80)%、载药量为(6.98±0.83)%、电位为(-18.17±0.17)mV。体外释放48 h内累积释放度达到50%以上。
结论
优化所得处方工艺稳定、操作简便。所得7-HEC/PLGA纳米粒粒度均匀,包封率较高。相对于7-HEC原料药,7-HEC/PLGA纳米粒的溶出度显著提高。
Keywords: 7-羟乙基白杨素, 聚乳酸-羟基乙酸共聚物纳米粒, 乳化溶剂挥发法, 处方优化, 体外释放
Abstract
Objective
To prepare 7-hydroxyethyl chrysin (7-HEC) loaded poly (lactic-co-glycolic acid) (PLGA) nanoparticles and to detect the in vitro release.
Methods
The 7-HEC/PLGA nanoparticles were prepared by emulsification solvent volatilization method. The particle size, polydispersity index (PDI), encapsulation rate, drug loading and zeta potential were measured. The prescription was optimized by single factor investigation combined with Box-Behnken response surface method. Mannitol was used as protectant to prepare lyophilized powder, and the optimal formulation was characterized and studied for the in vitro release.
Results
The optimal formulation of 7-HEC/PLGA nanoparticles was as follows: drug loading ratio of 2.12∶20, oil-water volume ratio of 1∶14.7, and 2.72% soybean phospholipid as emulsifier. With the optimal formulation, the average particle size of 7-HEC/PLGA nanoparticles was (240.28±0.96) nm, the PDI was 0.25±0.69, the encapsulation rate was (75.74±0.80)%, the drug loading capacity was (6.98±0.83)%, and the potentiostatic potential was (-18.17±0.17) mV. The cumulative in vitro release reached more than 50% within 48 h.
Conclusions
The optimized formulation is stable and easy to operate. The prepared 7-HEC/PLGA nanoparticles have uniform particle size, high encapsulation rate and significantly higher dissolution rate than 7-HEC.
Keywords: 7-hydroxyethyl chrysin, Poly (lactic-co-glyconlic acid) nanoparticles, Emulsion solvent evaporation method, Formulation optimization, In vitro release
白杨素(5,7-二羟基黄酮)是存在于许多天然植物、蜂蜜和蜂胶中的黄酮类化合物。体内外研究显示,白杨素具有抗氧化、抗缺氧、抗炎、抗肿瘤、抗癌和抗病毒活性等多种生物活性和药理作用[1-2],且对多种疾病表现出很好的治疗作用[3]。7-HEC是前期对白杨素进行结构改造而得到的新结构黄酮类化合物(图1),化学名为5-羟基-7-羟乙基黄酮,其呈黄色针状,普通状态下呈棉絮状[4],对低压性缺氧大鼠运动性疲劳具有明显保护作用,具有优异的抗高原缺氧活性[5]。但是,7-HEC溶解度低,不易被机体吸收,其临床使用受到限制。
图1. 白杨素和7-羟乙基白杨素的化学结构式.

纳米递送系统是一种提高难溶性药物溶解度的药剂学途径,可以提高药物的生物相容性、稳定性和药物靶向性,降低不良反应、控制药物释放及刺激响应[6-8],颇受医药研究者的重视。PLGA由乳酸和羟基乙酸缩合而成,被人体吸收后可正常代谢,对生物体毒副作用低,是美国食品药品监督管理局批准的可安全使用的药用高分子材料[9]。PLGA具有良好的生物相容性和可降解性,具有靶向性及缓控释特性[10]。为增加7-HEC的溶解性,提高其生物利用度,本文拟采用难溶性药物增溶技术探索7-HEC/PLGA纳米粒处方,采用乳化溶剂挥发法制备7-HEC/PLGA纳米粒,并进行表征及体外释放研究,以期为开发抗高原缺氧新药提供参考。
1. 材料与方法
1.1. 主要试剂和仪器
7-HEC由本实验室自行合成;PVA为成都市科隆化学品有限公司产品;泊洛沙姆188、甘露醇为北京索莱宝科技有限公司产品;乳糖、蔗糖为成都市科龙化工试剂厂产品;大豆磷脂为上海麦克林生化科技股份有限公司产品;PLGA为上海甄准生物科技有限公司产品;磷酸二氢钾(分析纯)、氢氧化钠(分析纯)为天津市大茂化学试剂厂产品;水为纯化水,其他试剂和试药均为分析纯。
BSA223S-CW型电子分析天平为北京赛多利斯科学仪器有限公司产品;ZKT-7F型真空脱气仪、RC12AD型智能药物溶出仪为天津天大天发科技有限公司产品;UV-1780型紫外分光光度计为岛津仪器(苏州)有限公司产品;Zeta PALS动态激光粒径测定仪为美国Brookhaven仪器公司产品;Starer2100pH测定计为美国奥豪斯仪器(上海)有限公司产品;扫描电镜为德国ZEISS公司产品;D8 ADVANCE型X射线衍射仪为德国Bruker公司产品。
1.2. 乳化溶剂挥发法制备7-HEC/PLGA纳米粒
分别称取PLGA和7-HEC,溶于二氯甲烷中,并加入乳化剂,混匀,将所得纳米粒乳化液逐滴加入纯水中冰浴超声(工作3 s,间隔3 s)后再快速分散到 PVA水溶液中冰浴超声(工作3 s,间隔3 s),磁力搅拌4 h挥发有机溶剂。以553×g离心10 min除去大颗粒和析出的药物,上清液以35 418×g离心40 min,沉淀重悬于蒸馏水中,35 418 ×g离心10 min。洗涤两次,重新分散在少量蒸馏水中,冷冻干燥收集纳米粒,得到7-HEC/PLGA纳米粒。
1.3. 测定7-HEC/PLGA纳米粒粒径、PDI和Zeta电位
将7-HEC/PLGA纳米粒重新分散在蒸馏水中配制成混悬液,取适量置于比色皿,用Zeta PALS动态激光粒径测定仪测定纳米粒的粒径、PDI和Zeta电位。
1.4. 测定7-HEC/PLGA纳米粒包封率、载药量
1.4.1. 专属性考察
称取7-HEC、PLGA和磷脂适量,用甲醇溶解后适当稀释,以甲醇作为空白对照,在185~400 nm波长范围内进行紫外光谱的全波长扫描。
1.4.2. 线性关系考察
精密量取10 mg 7-HEC,置于10 mL容量瓶中,加入适量甲醇,超声5 min使其完全溶解,再加入甲醇稀释至刻度,作为7-HEC的标准储备液。精密量取储备液适量,用甲醇稀释至浓度分别为1、2、3、4、5、6、7、8 μg/mL,精密吸取3 mL不同浓度的7-HEC溶液用紫外-可见光分光光度计在268 nm处测量吸光度,每份样品测量三次,取平均值作为最终吸光度。以7-HEC浓度(mg/mL)为横坐标,吸光度为纵坐标建立标准曲线。
1.4.3. 包封率、载药量测定
精密称取5 mg 7-HEC/PLGA纳米粒,充分溶解于5 mL甲醇中超声20 min,采用紫外-可见分光光度计测量纳米粒中7-HEC吸收峰的吸光度,根据标准曲线计算药物浓度及含量。按下式计算7-HEC/PLGA纳米粒的包封率和载药量。包封率(%)=实测载药量/理论载药量×100%;载药量(%)=测得纳米粒中的药物含量/纳米粒总质量×100%。
1.5. 单因素考察7-HEC/PLGA纳米粒制备工艺及处方
以1.2中7-HEC/PLGA纳米粒的制备方法为基础,以粒径、PDI、包封率、载药量及Zeta电位为评价指标进行单因素实验考察乳化剂种类(大豆磷脂、泊洛沙姆188、聚乙烯醇)、大豆磷脂质量分数(1%、2%、3%、4%、5%)、油(二氯甲烷)水体积比(1∶5、1∶8、1∶10、1∶12、1∶15、1∶20)、PVA质量分数(0.5%、1.0%、2.0%、3.0%)、药载比(1∶20、2∶20、3∶20、4∶20)、超声功率比(30%、40%、50%、60%、70%)、超声时间(1、2、3、4、5 min)、纳米粒乳化液再次分散在PVA后的超声时间(2、3、4、5 min)对制备纳米粒的影响,确定工艺处方。
1.6. Box-Behnken响应面法优化7-HEC/PLGA纳米粒处方
结合单因素实验结果选择试验因素,以包封率(Y 1,权重系数均定为0.25)、载药量(Y 2,权重系数均定为0.25)、粒径(Y 3,权重系数均定为0.5)为评价指标,其中包封率和载药量越大越好,而粒径越小越好。为了矢量一致,拟定粒径0 nm为1000分、500 nm为500分、1000 nm为0分(理想状态下),按照下式归一化后计算综合评分(overall desirability):综合评分=(Y 1/Y 1max)×0.25+(Y 2/Y 2max)×0.25+(Y 3/Y 3max)×0.5。运用Design Expert 10软件分析得到最佳处方,为检验所得制备工艺的可行性,按最佳处方制备三批样品用以试验验证。分别测定7-HEC/PLGA纳米粒的综合评分实际值,并与预测值相比较,当实际值与预测值偏差小于5%,说明7-HEC/PLGA纳米粒实际测得的值与预测值较为接近,证明采用Box-Behnken响应面法优化7-HEC/PLGA纳米粒处方具有良好的预测性,可靠性较高。
1.7. 表征7-HEC/PLGA纳米粒
1.7.1. 扫描电镜观察纳米粒外观
取7-HEC/PLGA纳米粒混悬液滴于铜柱,常温下自然挥干,于真空条件下喷金后置于扫描电镜下观察7-HEC/PLGA纳米粒外貌形态。
1.7.2. X射线衍射仪检测纳米粒固体状态
分别称取7-HEC、PLGA、两者物理混合物和7-HEC/PLGA纳米粒50 mg样品,置于样品池中,采用X射线衍射仪检测样品衍射峰。CuKα1为X射线管阴极,检测条件为衍射角范围为5°~60°,扫描速率为5°/min,扫描模式为2θ,电压为40 kV,电流为30 mA。
1.8. 筛选7-HEC/PLGA纳米粒的冻干保护剂
取7-HEC/PLGA纳米粒混悬液,加入一定体积的冻干保护剂后用保鲜膜封口,-80 ℃预冻2 h,再置于冷冻干燥机中冷冻干燥24 h,得到不同比例、不同类型冻干保护剂的7-HEC/PLGA纳米粒冻干粉,考察冻干后冻干粉的外观和复溶后的粒径。
1.9. 透析扩散法观察7-HEC/PLGA纳米粒的体外释放量
采用透析扩散法研究7-HEC原料药和载药PLGA纳米粒的溶出速率。摇床的温度设置为(37.0±0.5)℃,转速设为100 转/min。溶出介质分别为模拟胃液(pH 1.2)、模拟血浆(pH 7.4)和模拟肠液(pH 6.8),均加入0.5%的泊洛沙姆作为增溶剂。将含有相同量的7-HEC原料药和7-HEC/PLGA纳米粒分别放入6个透析袋中,各加入5 mL溶出介质后密封,将透析袋浸入到相应的溶出介质(100 mL)中。取样时间点设为0.25、0.5、1、1.5、2、3、4、8、12、24和48 h。取样时从溶出介质中取出5 mL样品,并立即补充等体积的溶出介质,以确保溶出介质的体积保持不变。采用紫外-可见光谱法测定各个时间点释放液的药物质量浓度,计算药物累计释放量。
2. 结果
2.1. 建立7-HEC/PLGA纳米粒含量测定方法
在185~400 nm波长范围内进行紫外光谱的全波长扫描,结果见图2。7-HEC在波长268 nm处无辅料的吸收干扰,方法专属性良好,因此选用268 nm为7-HEC的检测波长。以7-HEC浓度(mg/mL)为横坐标,吸光度为纵坐标进行线性回归。得到7-HEC的线性回归方程为y=88.071x-0.0022(r 2=0.9995),表明7-HEC在1~8 μg/mL范围内浓度和吸光度呈良好的线性相关性。该回归方程可用于后续7-HEC/PLGA纳米粒包封率、载药量的计算。
图2. PLGA、7-HEC、磷脂、PVA紫外光谱的全波长扫描结果.
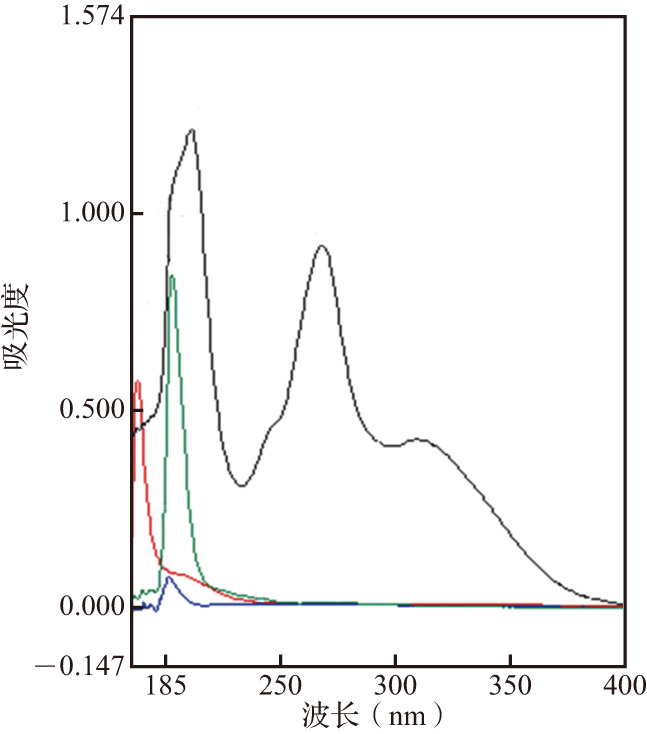
黑色为7-羟乙基白杨素(7-HEC),绿色为磷脂,蓝色为聚乳酸-羟基乙酸共聚物(PLGA),红色为聚乙烯醇(PVA).
2.2. 7-HEC/PLGA纳米粒制备工艺及处方的单因素考察结果
2.2.1. 乳化剂对7-HEC/PLGA纳米粒性能的影响
乳化剂为大豆磷脂时,乳液的粒径较小,电位绝对值较高,并且为均匀的澄清乳剂,有蓝色的乳光,见表1。因此选择大豆磷脂作为乳化剂。
表1.
采用不同乳化剂制备的7-HEC/PLGA纳米粒性能
| 乳化剂种类 | 粒径(nm) | PDI | 包封率(%) | 载药量(%) | Zeta电位(mV) |
|---|---|---|---|---|---|
| 大豆磷脂 | 330.80±0.46 | 0.20±0.25 | 57.40±1.02 | 5.20±0.22 | -14.52±0.62 |
| 泊洛沙姆188 | 435.67±0.58 | 0.21±0.01 | 22.26±1.03 | 2.02±0.43 | -10.45±0.54 |
| 聚乙烯醇 | 616.44±0.32 | 0.25±0.56 | 30.04±1.32 | 2.73±0.32 | -11.32±0.72 |
7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物;PDI:多分散系数.
±s,n=3
2.2.2. 大豆磷脂质量分数对7-HEC/PLGA纳米粒性能的影响
随着大豆磷脂质量分数的增加,粒径呈现先变小后增大趋势,Zeta电位绝对值先增大后减小。可能是当大豆磷脂质量分数过高时,体系的黏度也随之上升,使纳米粒的粒径反而变大的缘故。见表2。综合考虑,选择质量分数为3%左右的大豆磷脂。
表2.
采用大豆磷脂不同质量分数制备的7-HEC/PLGA纳米粒性能
|
大豆磷脂 质量分数(%) |
粒径(nm) | PDI | 包封率(%) | 载药量(%) | Zeta电位(mV) |
|---|---|---|---|---|---|
| 1 | 339.57±0.55 | 0.21±0.01 | 67.32±1.88 | 5.83±0.45 | -14.10±1.37 |
| 2 | 334.25±0.45 | 0.21±0.73 | 77.45±1.43 | 7.22±0.43 | -17.64±0.69 |
| 3 | 329.42±0.46 | 0.22±0.33 | 81.52±1.73 | 8.15±0.82 | -18.10±0.77 |
| 4 | 335.84±0.33 | 0.30±0.65 | 80.65±0.88 | 7.96±0.53 | -17.30±0.72 |
| 5 | 356.38±0.86 | 0.29±0.84 | 41.30±0.93 | 3.76±0.79 | -13.65±1.73 |
7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物;PDI:多分散系数.
±s,n=3
2.2.3. 油水体积比对7-HEC/PLGA纳米粒性能的影响
随着水相加入增多,7-HEC/PLGA纳米粒粒径先增大后减小,在1∶15时粒径较小,载药量、包封率较高,并且载药量随后减小。见表3。综合考虑,选择油水体积比1∶15。
表3.
采用不同油水体积制备的7-HEC/PLGA纳米粒性能
| 油水体积比 | 粒径(nm) | PDI | 包封率(%) | 载药量(%) | Zeta电位(mV) |
|---|---|---|---|---|---|
| 1∶5 | 321.70±1.45 | 0.30±0.55 | 66.48±1.73 | 6.04±0.57 | -14.60±1.09 |
| 1∶8 | 347.52±0.65 | 0.28±0.92 | 75.06±0.87 | 6.82±0.62 | -13.54±1.35 |
| 1∶10 | 355.43±0.87 | 0.31±0.84 | 87.50±1.53 | 7.95±0.90 | -10.65±0.95 |
| 1∶12 | 371.68±0.58 | 0.39±0.69 | 53.50±1.72 | 4.86±0.57 | -15.10±1.55 |
| 1∶15 | 338.29±0.97 | 0.28±0.57 | 81.52±1.46 | 8.15±0.73 | -18.43±1.65 |
| 1∶20 | 345.51±0.81 | 0.34±0.54 | 70.26±2.05 | 6.30±0.48 | -15.61±0.89 |
7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物;PDI:多分散系数.
±s,n=3
2.2.4. PVA质量分数对7-HEC/PLGA纳米粒性能的影响
PVA质量分数在0.5%~1.0%时,乳化液的乳化效果更好,可以装载更多的药物。当PVA质量分数继续增大,粒径变大,包封率和载药量开始下降,见表4。选择PVA浓度为0.5%。
表4.
采用不同PVA质量分数制备的7-HEC/PLGA纳米粒性能
|
PVA质量分数 (%) |
粒径(nm) | PDI | 包封率(%) | 载药量(%) | Zeta电位(mV) |
|---|---|---|---|---|---|
| 0.5 | 325.74±1.75 | 0.29±1.45 | 81.12±0.95 | 8.25±0.57 | -16.80±0.73 |
| 1.0 | 336.93±1.49 | 0.32±1.73 | 82.63±1.71 | 7.62±0.94 | -14.10±0.87 |
| 2.0 | 516.54±0.92 | 0.20±0.90 | 81.86±0.94 | 7.92±0.75 | -15.45±0.58 |
| 3.0 | 615.33±0.65 | 0.13±1.47 | 65.37±1.37 | 5.41±0.96 | -13.60±1.65 |
7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物;PVA:聚乙烯醇;PDI:多分散系数.
±s,n=3
2.2.5. 药载比对7-HEC/PLGA纳米粒性能的影响
随着药物的增加,纳米粒粒径先减小后增大,包封率和载药量则先升高再降低,见表5。综合考虑,选择药载比2∶20。
表5.
采用不同药载比制备的7-HEC/PLGA纳米粒性能
| 药载比 | 粒径(nm) | PDI | 包封率(%) | 载药量(%) | Zeta电位(mV) |
|---|---|---|---|---|---|
| 1∶20 | 349.74±0.52 | 0.26±0.59 | 79.77±0.34 | 6.80±0.57 | -15.60±1.02 |
| 2∶20 | 328.62±0.98 | 0.28±0.62 | 81.52±0.65 | 7.15±0.98 | -17.50±0.93 |
| 3∶20 | 355.15±0.73 | 0.43±0.94 | 50.55±0.79 | 7.59±0.53 | -9.54±0.72 |
| 4∶20 | 452.46±0.69 | 0.32±0.82 | 49.57±0.86 | 7.06±0.46 | -10.76±0.52 |
7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物;PDI:多分散系数.
±s,n=3
2.2.6. 超声功率比对7-HEC/PLGA纳米粒性能的影响
超声功率比达50%时,7-HEC/PLGA纳米粒的包封率、载药量相对较高,且粒径和PDI值相对较小,见表6。故选择超声功率比为50%。
表6.
采用不同超声功率比制备的7-HEC/PLGA纳米粒性能
|
超声功率比 (%) |
粒径(nm) | PDI | 包封率(%) | 载药量(%) | Zeta电位(mV) |
|---|---|---|---|---|---|
| 30 | 328.63±0.93 | 0.35±0.72 | 47.25±0.48 | 5.11±0.94 | -12.30±0.83 |
| 40 | 324.98±0.81 | 0.27±0.89 | 56.64±0.39 | 5.14±0.69 | -17.90±0.92 |
| 50 | 285.70±0.12 | 0.21±0.52 | 64.47±0.82 | 6.06±0.27 | -19.41±0.59 |
| 60 | 313.43±0.59 | 0.33±0.83 | 51.39±0.51 | 5.02±0.69 | -18.90±0.84 |
| 70 | 339.72±0.61 | 0.34±0.91 | 45.41±0.82 | 5.16±0.87 | -15.43±0.67 |
7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物;PDI:多分散系数.
±s,n=3
2.2.7. 超声时间对7-HEC/PLGA纳米粒性能的影响
随着超声时间延长,包封率、载药量和Zeta电位绝对值均先增加后减小,虽然4 min时制备的纳米粒具有较小的粒径,但包封率和载药量低于3 min 时,且4 min时的PDI值也相对较高,见表7。故选择超声时间为3 min。
表7.
采用不同超声时间制备的7-HEC/PLGA纳米粒性能
| 超声时间(min) | 粒径(nm) | PDI | 包封率(%) | 载药量(%) | Zeta电位(mV) |
|---|---|---|---|---|---|
| 1 | 374.81±0.32 | 0.41±0.65 | 65.08±0.73 | 4.52±0.67 | -15.98±0.72 |
| 2 | 309.75±0.97 | 0.34±0.84 | 69.73±0.75 | 4.89±0.90 | -16.47±0.93 |
| 3 | 301.29±0.82 | 0.31±0.97 | 70.70±0.94 | 6.42±0.43 | -18.90±0.71 |
| 4 | 286.43±0.74 | 0.32±0.84 | 64.14±0.63 | 5.74±0.74 | -16.40±0.83 |
| 5 | 297.70±0.96 | 0.33±0.74 | 62.47±0.96 | 4.86±0.94 | -13.38±0.75 |
7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物;PDI:多分散系数.
±s,n=3
2.2.8. 二次分散工艺中超声时间对7-HEC/PLGA纳米粒性能的影响
分散在PVA后超声时间为3 min时,7-HEC/PLGA纳米粒的粒径较小,包封率和载药量较高,见表8。故二次分散选择超声时间为3 min。
表8.
二次分散工艺中采用不同超声时间制备的7-HEC/PLGA纳米粒性能
| 超声时间(min) | 粒径(nm) | PDI | 包封率(%) | 载药量(%) | Zeta电位(mV) |
|---|---|---|---|---|---|
| 2 | 251.61±1.97 | 0.35±0.47 | 70.70±0.75 | 6.42±0.05 | -17.20±1.17 |
| 3 | 217.39±0.94 | 0.28±0.92 | 78.28±1.03 | 7.11±0.74 | -18.73±0.93 |
| 4 | 218.78±0.83 | 0.31±0.74 | 76.52±0.85 | 7.05±0.82 | -15.53±0.87 |
| 5 | 224.32±0.86 | 0.34±0.81 | 72.83±0.73 | 6.62±0.91 | -13.30±0.95 |
7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物;PDI:多分散系数.
±s,n=3
2.3. Box-Behnken响应面法优化处方及验证
2.3.1. 试验设计及结果
结合单因素实验结果及相关文献关于PLGA纳米粒影响因素的分析,选择油水体积比、药载比和乳化剂质量分数为自变量(分别为X 1、X 2、X 3),以纳米制剂的包封率、载药量和粒径大小作为响应值(分别为Y 1 、Y 2 、Y 3),采用响应面法对7-HEC/PLGA纳米粒处方做进一步优化,X 1、X 2、X 3在-1、0、1水平分别为1∶12、1∶15、1∶20,1∶20、2∶20、3∶20,2%、3%、4%。结果见表9。
表9.
Box-Behnken响应面法优化7-HEC/PLGA纳米粒处方试验结果
| 试验号 | X 1 | X 2 | X 3 | Y 1(%) | Y 2(%) | Y 3(nm) | 综合评分 |
|---|---|---|---|---|---|---|---|
| 1 | -1 | -1 | 0 | 64.08 | 4.74 | 374.80 | 0.750 |
| 2 | 1 | -1 | 0 | 49.73 | 5.86 | 309.60 | 0.790 |
| 3 | -1 | 1 | 0 | 70.70 | 5.82 | 270.20 | 0.874 |
| 4 | 1 | 1 | 0 | 52.14 | 5.91 | 297.40 | 0.787 |
| 5 | -1 | 0 | -1 | 64.47 | 5.70 | 285.70 | 0.842 |
| 6 | 1 | 0 | -1 | 69.77 | 5.86 | 322.90 | 0.838 |
| 7 | -1 | 0 | 1 | 71.52 | 5.11 | 314.30 | 0.824 |
| 8 | 1 | 0 | 1 | 50.55 | 5.14 | 328.60 | 0.755 |
| 9 | 0 | -1 | -1 | 49.57 | 5.86 | 314.90 | 0.745 |
| 10 | 0 | 1 | -1 | 81.52 | 5.82 | 285.70 | 0.895 |
| 11 | 0 | -1 | 1 | 70.70 | 4.52 | 322.90 | 0.796 |
| 12 | 0 | 1 | 1 | 52.14 | 4.42 | 314.30 | 0.745 |
| 13 | 0 | 0 | 0 | 64.47 | 6.67 | 238.20 | 0.949 |
| 14 | 0 | 0 | 0 | 82.83 | 7.21 | 233.10 | 0.956 |
| 15 | 0 | 0 | 0 | 81.65 | 6.58 | 236.00 | 0.953 |
| 16 | 0 | 0 | 0 | 75.06 | 7.42 | 238.20 | 0.961 |
| 17 | 0 | 0 | 0 | 87.50 | 6.29 | 233.10 | 0.962 |
X 1、X 2、X 3分别代表油水体积比、药载比和乳化剂质量分数,Y 1、Y 2、Y 3分别代表包封率、载药量和粒径大小. 7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物.
2.3.2. 模型拟合、响应面优化结果
利用Design Expert 10软件对表9中的试验结果进行二次多元回归分析,得到回归方程:综合评分=0.96+0.015×X 1+0.028×X 2-0.025×X 3-0.032×X 1 X 2-0.016×X 1 X 3-0.050×X 2 X 3-0.068×X 1 2-0.088×X 2 2-0.073×X 3 2,P<0.01,R 2=0.9976,调整R 2=0.9946,说明模型与实际吻合度良好,可信度较高。方差分析结果见表10。图3为各因素交互三维曲面图,显示7-HEC/PLGA纳米粒最优处方为油水体积比为1∶14.7、药载比为2.12∶20、乳化剂质量分数为2.72%,在此条件下综合评分预测值为0.928。
表10.
Box-Behnken响应面法优化7-HEC/PLGA纳米粒处方的二次回归方程方差分析结果
| 误差来源 | 平方和 | 自由度 | 均方 | F值 | P值 |
|---|---|---|---|---|---|
| 总和 | 0.1115 | 16 | — | — | — |
| 模型 | 0.1112 | 9 | 0.0124 | 327.37 | <0.01 |
| X 1 | 0.0018 | 1 | 0.0018 | 47.67 | <0.01 |
| X 2 | 0.0061 | 1 | 0.0061 | 160.23 | <0.01 |
| X 3 | 0.005 | 1 | 0.005 | 132.43 | <0.01 |
| X 1 X 2 | 0.004 | 1 | 0.004 | 106.79 | <0.01 |
| X 1 X 3 | 0.0011 | 1 | 0.0011 | 27.97 | <0.01 |
| X 2 X 3 | 0.0101 | 1 | 0.0101 | 267.51 | <0.01 |
| X 1² | 0.0196 | 1 | 0.0196 | 519.07 | <0.01 |
| X 2² | 0.0324 | 1 | 0.0324 | 858.19 | <0.01 |
| X 3² | 0.0226 | 1 | 0.0226 | 597.94 | <0.01 |
| 残差 | 0.0003 | 7 | 0 | — | — |
| 失拟项 | 0.0001 | 3 | 0 | 1.63 | 0.3161 |
| 绝对误差 | 0.0001 | 4 | 0 | — | — |
—:无相关数据. X 1、X 2、X 3分别代表油水体积比、药载比和乳化剂质量分数. 7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物.
图3. 各因素对综合评分的响应面三维图.
A:药载比与油水体积比对综合评分的交互影响;B:油水体积比与乳化剂质量分数对综合评分的交互影响;C:药载比与乳化剂质量分数对综合评分的交互影响.
2.3.3. 最佳工艺验证结果
三批次7-HEC/PLGA纳米粒的平均粒径为(240.28±0.96)nm、PDI为0.25±0.69、包封率为(75.74±0.80)%、载药量为(6.98±0.83)%、电位为(-18.17±0.17)mV,综合评分实际值均值为0.951,与预测值0.928的偏差为2.48%,说明采用Box-Behnken响应面法优化7-HEC/PLGA纳米粒处方具有良好的预测性,可靠性较高。
2.4. 7-HEC/PLGA纳米粒的表征
2.4.1. 7-HEC/PLGA纳米粒的外观及电镜下表现
7-HEC/PLGA纳米粒的外观见图4A,略带浅蓝色乳光。取7-HEC/PLGA纳米粒混悬液置于扫描电镜下观察外貌形态,结果见图4B。7-HEC/PLGA纳米粒外貌形态呈较规则的球形或类球形,表面圆整光滑。提示包封较好。
图4. 7-HEC/PLGA纳米粒的外观及电镜下形态.

A:7-HEC/PLGA纳米粒外观略带浅蓝色乳光;B:电镜下见7-HEC/PLGA纳米粒形态为较规则的球形或类球形,表面圆整光滑. 标尺=100 nm. 7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物.
2.4.2. 7-HEC/PLGA纳米粒固体状态表征
X射线衍射仪结果见图5。与7-HEC、PLGA、两者物理混合物比较,7-HEC/PLGA纳米粒峰强度明显减弱,表明其状态发生改变,7-HEC已被载体包裹。
图5. 7-HEC、PLGA、两者物理混合物和7-HEC/PLGA纳米粒的X射线衍射图.

7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物.
2.5. 冻干保护剂对7-HEC/PLGA纳米粒的影响
考察冻干后冻干粉的外观和复溶后的粒径,结果见表11。采用5%和10%甘露醇冻干粉纳米粒均质地细腻,且PDI和粒径无明显差异。综合考虑,选择5%甘露醇作为冻干保护剂。
表11.
采用不同冻干保护剂的7-HEC/PLGA纳米粒外观和物理性能
| 保护剂 | 冻干粉外观 | 粒径(nm) | PDI |
|---|---|---|---|
| 5%甘露醇 | 质地细腻 | 300.03±0.95 | 0.27±0.63 |
| 10%甘露醇 | 质地细腻 | 308.23±0.43 | 0.27±0.97 |
| 5%乳糖 | 质脆 | 307.31±0.61 | 0.26±0.73 |
| 10%乳糖 | 质脆 | 280.29±0.98 | 0.19±0.69 |
| 5%蔗糖 | 质脆且黏度较大 | 280.66±0.09 | 0.15±0.78 |
| 10%蔗糖 | 质脆且黏度较大 | 260.53±0.85 | 0.16±0.83 |
7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物;PDI:多分散系数.
±s,n=3
2.6. 7-HEC/PLGA纳米粒的体外释放情况
7-HEC/PLGA纳米粒的体外释放结果见图6。PLGA包载的7-HEC在不同介质中快速释放,48 h内累积释放度达到50%以上,证明PLGA包载有效提高7-HEC在介质中的溶出度。
图6. 7-HEC和7-HEC/PLGA纳米粒在不同介质中的释放曲线.
7-HEC:7-羟乙基白杨素;PLGA:聚乳酸-羟基乙酸共聚物.
3. 讨论
目前,乳化溶剂挥发法是制备PLGA纳米粒常用的方法,具有重复性强、稳定性好、包封率高等优点[11]。由于7-HEC在水中溶解性差,油相滴入水相时,容易析出晶体,前期的水相选用了1% PVA水溶液,所得纳米粒粒径较大,乳化效果不佳,包封率和载药量均随着PVA质量分数增大而降低,粒径随着PVA质量分数的增大而增大,可能的原因是PVA是高分子乳化剂,有一定的黏性。后期改用0.5% PVA作为水相,对超声功率、时间均进行了筛选,发现在超声功率50%,加入PVA后超声3 min时可以得到最优的纳米乳化液。本实验采用乳化溶剂挥发法制备7-HEC/PLGA纳米粒,在单因素分析结果的基础上选择油水体积比、药载比、乳化剂质量分数作为考察因素,采用Box-Behnken响应面法来优化7-HEC/PLGA纳米粒得到最优处方,制备工艺稳定可行,得到粒径较小、稳定性良好的7-HEC/PLGA纳米粒。
将纳米粒制成冻干粉时,稳定性可以得到较大改善,但整个体系在冷冻和解冻过程中可能会因为渗透压的改变造成微粒的裂解,从而粒径变大且发生漏药。因此,在冻干的过程中选择适合的冻干保护剂至关重要。本实验选用不同质量分数的甘露醇、蔗糖、乳糖考察,5%甘露醇作为冻干保护剂时,粒径、PDI较小,冻干粉质地细腻,可能是甘露醇在冻干后含水量低,7-HEC/PLGA纳米粒的稳定性增加,与蔗糖、乳糖相比具有较低的黏度[12]。
从体外释放研究结果可以看出,PLGA纳米粒可以使7-HEC快速释放,并且在48 h内累积释放度达到50%以上,证明PLGA的包载可以有效提高难溶性药物在介质中的溶出度。7-HEC在水中的溶解度低,当用普通溶出介质时,溶出液中几乎没有溶出的药物,文献中有报道采用吐温80、吐温20、聚氧乙烯蓖麻油等作为7-HEC体外释放的增溶剂[13-14]。经实验验证后发现,以上增溶剂在测定波长处有干扰,影响含量测定;释放介质中加入0.5%的泊洛沙姆可以有效增加7-HEC在释放介质中的溶解度,使其达到漏槽条件,故采用0.5%的泊洛沙姆作为增溶剂。本实验制备的7-HEC/PLGA纳米粒明显提高了7-HEC的溶出度,为PLGA包载纳米粒技术提供了可行策略,具有更高的应用价值。
Acknowledgments
研究得到国家自然科学基金(81571847,81872796)、军队卫勤保障能力创新与生成专项计划(21WQ045)、甘肃省自然科学基金(22JR11RA011)、联勤保障部队第九四〇医院专项培育项目(2021yxky015)支持
Acknowledgments
This work was supported by National Natural Science Foundation of China (81571847, 81872796),Military Medical Support Capability Innovation and Generation Special Program Plan (21WQ045),Natural Science Foundation of Gansu Province (22JR11RA011),The 940th Hospital of the Joint Logistics Support Force of PLA Special Cultivation Project (2021yxky015)
[缩略语]
7-羟乙基白杨素(7-hydroxyethyl chrysin,7-HEC);聚乳酸-羟基乙酸共聚物[poly (lactic-co-glyconlic acid),PLGA];聚乙烯醇(polyvinyl alcohol,PVA);多分散系数(polydispersity index,PDI)
利益冲突声明
所有作者均声明不存在利益冲突
Conflict of Interests
The authors declare that there is no conflict of interests
参考文献(References)
- 1.刘菁, 冷非凡, 曹琪璐, 等. 7-羟乙基白杨素对PC12细胞的抗氧化作用及机制研究[J]. 中国现代应用药学, 2021, 38(13): 1537-1542. 10.13748/j.cnki.issn1007-7693.2021.13.001 [DOI] [Google Scholar]; LIU Jing, LENG Feifan, CAO Qilu, et al. Study on antioxidative capacity and mechanism of 7-hydroxyethyl chrysin in PC12 cells[J]. Chinese Journal of Modern Applied Pharmacy, 2021, 38(13): 1537-1542. (in Chinese) 10.13748/j.cnki.issn1007-7693.2021.13.001. 10.13748/j.cnki.issn1007-7693.2021.13.001 [DOI] [Google Scholar]
- 2.MANI R, NATESAN V. Chrysin: sources, beneficial pharmacological activities, and molecular mechanism of action[J]. Phytochemistry, 2018, 145: 187-196. 10.1016/j.phytochem.2017.09.016 [DOI] [PubMed] [Google Scholar]
- 3.景临林, 杨颖, 邵瑾, 等. 7-羟乙基白杨素对低压低氧大鼠认知功能的保护作用及机制研究[J]. 中国医院药学杂志, 2020, 40(15): 1622-1626. 10.13286/j.1001-5213.2020.15.05 [DOI] [Google Scholar]; JING Linlin, YANG Ying, SHAO Jin, et al. Protective effect and mechanism of 7-hydroxyethyl salicin on cognitive function in low-pressure hypoxia rats[J]. Chinese Journal of Hospital Pharmacy, 2020, 40(15): 1622-1626. (in Chinese) 10.13286/j.1001-5213.2020.15.05. 10.13286/j.1001-5213.2020.15.05 [DOI] [Google Scholar]
- 4.景临林. 药学自主设计性实验: 7-羟乙基白杨素的合成与表征[J]. 广州化工, 2023, 51(9): 164-167. 10.3969/j.issn.1001-9677.2023.09.047 [DOI] [Google Scholar]; JING Linlin. Pharmacy self-designed experiment: synthesis and characterization of 7-hydroxyethyl salicin[J]. Guangzhou Chemical Industry, 2023, 51(9): 164-167. (in Chinese) 10.3969/j.issn.1001-9677.2023.09.047. 10.3969/j.issn.1001-9677.2023.09.047 [DOI] [Google Scholar]
- 5.苗路伟, 赵彤, 高迎春, 等. 7-羟乙基白杨素对低压性缺氧大鼠运动性疲劳具有保护作用[J]. 浙江大学学报(医学版), 2021, 50(5): 575-581. 10.3724/zdxbyxb-2021-0319 [DOI] [PMC free article] [PubMed] [Google Scholar]; MIAO Luwei, ZHAO Tong, GAO Yingchun, et al. Pro-tective effects of 7-hydroxyethyl salicin against exercise fatigue in hypobaric hypoxic rats[J]. Journal of Zhejiang University (Medical Sciences), 2021, 50(5): 575-581. (in Chinese) 10.3724/zdxbyxb-2021-0319. 10.3724/zdxbyxb-2021-0319 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.肖箫, 陈俊宇, 李彩霞, 等. 纳米载体作为药物递送系统的临床应用和药代动力学研究[J]. 药学学报, 2023, 58(4): 856-866. [Google Scholar]; XIAO Xiao, CHEN Junyu, LI Caixia, et al. Clinical application and pharmacokinetics of nanocarriers as drug delivery systems[J]. Acta Pharmaceutica Sinica, 2023, 58(4): 856-866. (in Chinese) [Google Scholar]
- 7.CATANIA R, ONION D, RUSSO E, et al. A mecha-noresponsive nano-sized carrier achieves intracellular release of drug on external ultrasound stimulus[J]. RSC Adv, 2022, 12(26): 16561-16569. 10.1039/d2ra02307e [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.WILSON B K, SINKO P J, PRUD’HOMME R K. Encapsulation and controlled release of a camptothecin prodrug from nanocarriers and microgels: tuning release rate with nanocarrier excipient composition[J]. Mol Pharmaceutics, 2021, 18(3): 1093-1101. 10.1021/acs.molpharmaceut.0c01012 [DOI] [PubMed] [Google Scholar]
- 9.KURIAKOSE A E, PANDEY N, SHAN D, et al. Characterization of photoluminescent polylactone-based nanoparticles for their applications in cardiovascular diseases[J]. Front Bioeng Biotechnol, 2019, 7: 353. 10.3389/fbioe.2019.00353 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.BAHADORI F, ESKANDARI Z, EBRAHIMI N, et al. Development and optimization of a novel PLGA-Levan based drug delivery system for curcumin, using a quality-by-design approach[J]. Eur J Pharm Sci, 2019, 138: 105037. 10.1016/j.ejps.2019.105037 [DOI] [PubMed] [Google Scholar]
- 11.黄华婷, 吴念, 蔡梦如, 等. 共载姜黄素和IR780的聚乳酸-羟基乙酸共聚物纳米粒的制备及其体外抗肿瘤评价[J]. 中草药, 2023, 54(2): 498-508. 10.7501/j.issn.0253-2670.2023.02.017 [DOI] [Google Scholar]; HUANG Huating, WU Nian, CAI Mengru, et al. Pre-paration of polylactic acid-hydroxyacetic acid copolymer nanoparticles coloaded with curcumin and IR780 and their in vitro antitumor evaluation[J]. Chinese Traditional and Herbal Drugs, 2023, 54(2): 498-508. (in Chinese) 10.7501/j.issn.0253-2670.2023.02.017. 10.7501/j.issn.0253-2670.2023.02.017 [DOI] [Google Scholar]
- 12.金珊珊, 马晓星, 袁橙, 等. 盐霉素纳米结构脂质载体冻干粉的制备[J]. 齐齐哈尔医学院学报, 2017, 38(10): 1193-1196. 10.3969/j.issn.1002-1256.2017.10.037 [DOI] [Google Scholar]; JIN Shanshan, MA Xiaoxing, YUAN Cheng, et al. Preparation of lyophilized powder of salinomycin nano-structured lipid carrier[J]. Journal of Qiqihar Medical University, 2017, 38(10): 1193-1196. (in Chinese) 10.3969/j.issn.1002-1256.2017.10.037. 10.3969/j.issn.1002-1256.2017.10.037 [DOI] [Google Scholar]
- 13.刘永飞. 白藜芦醇过饱和自微乳的制备和溶出率研究[J]. 科技风, 2019, (36): 135-137. 10.1021/acs.nanolett.9b00423 [DOI] [Google Scholar]; LIU Yongfei. Preparation and dissolution rate study of resveratrol supersaturated self-microemulsion[J]. Ke Ji Feng, 2019, (36): 135-137. (in Chinese) 10.1021/acs.nanolett.9b00423. 10.1021/acs.nanolett.9b00423 [DOI] [Google Scholar]
- 14.孔维恺忻, 鄢尤奇, 蔡文康, 等. 十二烷基硫酸钠和吐温20复配体系对姜黄素的增溶和保护作用[J]. 北京大学学报(医学版), 2021, 53 (1): 227-231. 10.19723/j.issn.1671-167X.2021.01.035 [DOI] [Google Scholar]; Kaixin KONG-WEI, YAN Youqi, CAI Wenkang, et al. Solubilizing and protective effects of sodium dodecyl sulfate and Tween 20 on curcumin[J]. Journal of Peking University (Health Sciences), 2021, 53 (1): 227-231. (in Chinese) 10.19723/j.issn.1671-167X.2021.01.035. 10.19723/j.issn.1671-167X.2021.01.035 [DOI] [Google Scholar]




