Abstract
目的
探讨caspase-1经典的细胞焦亡信号通路在绿原酸治疗急性肾损伤小鼠中的作用及机制。
方法
将24只C57Bl/6J小鼠随机分成4组,每组6只:假手术组(Sham组)、盲肠结扎穿刺组(CLP组)、CLP+地塞米松组(CLP+DXM组)、CLP+绿原酸组(CLP+CGA组)。Sham组小鼠仅开腹未造模,CLP组CLP+DXM组和CLP+CGA组小鼠均盲肠结扎穿刺(CLP)造模。Sham组、CLP组、CLP+DXM组和CLP+CGA组在造模后持续静脉泵注生理盐水10 mg/kg、生理盐水10 mg/kg,注地塞米松1 μg/kg和绿原酸15 mg/kg 6 h。各组均在注射药物结束后8 h,比较各组小鼠7 d生存率,肾组织大体形态、HE染色,肾组织细胞凋亡及肾功能相关指标尿素氮(BUN)、肌酐(Scr)、肾损伤分子1(KIM-1);及肾组织NLRP3炎性小体和caspase-1通路关键蛋白表达情况。
结果
绿原酸干预后提高了小鼠7 d生存率,肾组织肾小球毛细血管充血、肾间质水肿、肾小管上皮细胞肿胀程度明显减轻(P < 0.05),降低了肾功能指标BUN、Scr、KIM-1水平;NLRP3炎性小体及caspase-1通路关键蛋白表达。
结论
绿原酸可能通过抑制NLRP3炎性小体和caspase-1信号通路,改善盲肠结扎穿刺所致急性肾损伤。
Keywords: 绿原酸, 急性肾损伤, 脓毒症, 细胞焦亡, NLRP3炎性小体
Abstract
Objective
To investigate the role of caspase-1-medicated canonical pyroptosis pathway in chlorogenic acid (CGA) treatment of acute kidney injury (AKI) in mice.
Method
Twenty-four C57Bl/6J mice were randomized into sham-operated group, cecal ligation and puncture (CLP) group, CLP+dexamethasone group (CLP+DXM group), and CLP+CGA group (n=6) and subjected to either sham operation (laparotomy only) or CLP. After modeling the mice received intravenous infusion of 10 mg/kg normal saline (in sham and CLP groups), 1 μg/kg dexamethasone or 15 mg/kg of chlorogenic acid for 6 h delivered using an intravenous pump. Eight hours after the infusion, renal morphology and histology, renal cell apoptosis, and the renal function parameters such as urea nitrogen (BUN), creatinine (Scr), and kidney injury molecule 1 (KIM-1) were compared among the 4 groups; the 7-day survival rates of the mice were recorded, and the expressions of NLRP3 inflammasomes and key proteins of the caspase-1 pathway in the renal tissue were detected.
Results
CGA treatment significantly improved the 7-day survival rate, reduced renal pathologies of the septic mice (P < 0.05), and lowered the levels of BUN, Scr, KIM-1, NLRP3 inflammasome and expressions of key proteins of the caspase-1 pathway.
Conclusion
CGA alleviates AKI in mice with CLP-induced sepsis by inhibiting NLRP3 inflammasomes and the caspase-1 signaling pathway.
Keywords: chlorogenic acid, acute kidney injury, sepsis, cell pyroptosis, NLRP3 inflammasomes
脓毒症是由感染引起的全身炎症反应综合征[1],肾脏是在感染后发生瀑布式炎症反应的主要攻击器官之一[2, 3]。脓毒症急性肾损伤是因宿主对感染的反应失调,诱发炎症反应,严重危及患者生命[4, 5]。盲肠结扎穿刺(CLP)是模拟脓毒症发生发展的常用动物模型,剖腹术在回盲瓣下结扎、穿刺盲肠[6]。由于盲肠充满大量细菌,穿刺会导致多菌性腹膜炎、细菌移位进入血液,导致多器官功能障碍甚至感染性休克,最后导致死亡[7, 8]。目前临床上脓毒症治疗仍是棘手问题,有待进一步研究和探索。糖皮质激素具有抑制炎症反应的作用,是治疗脓毒症的重要辅助药物,占珠琴等[9]研究证实0.5 mg/kg地塞米松即可对脓毒症急性肾损伤具有保护作用。何荷等[10]研究表明地塞米松可下调ROS/TXNIP/NLRP3信号通路表达水平,抑制炎症分子产生及细胞焦亡发生, 有效减轻脓毒症小鼠肺损伤发生发展。地塞米松是一种有效的抗炎、抗过敏和抗毒作用,能有效减轻组织和细胞的炎症反应,常用于急性脓毒症的治疗[11],在本研究中用于阳性对照。
绿原酸(CGA)是一种存在于高等双子叶之和和蕨类植物中的一类多酚类化合物,由咖啡酸的1位羧基和奎尼酸的3位羟基缩合成酯的天然产物[12]。脓毒症引起的肺损伤的机制与细胞焦亡关系密切[13, 14],脓毒症发生后会诱导机体产生依赖天冬氨酸特异性半胱氨酸蛋白酶, 释放炎性因子白细胞介素-1β(IL-1β)和IL-18为特征的程序性细胞死亡[15, 16]。徐静红等[17]研究表明,绿原酸能通过调节TLR4/NF-κB信号发挥抗炎作用,保护脂多糖(LPS)诱导的急性肾损伤小鼠。何荷等[10]发现绿原酸可通过下调ROS/TXNIP/NLRP3信号通路表达水平,抑制炎症分子产生及细胞焦亡发生,有效减轻脓毒症小鼠肺损伤。但绿原酸能否通过抑制NLRP3炎性小体进而抑制caspase-1介导的焦亡途径,进而降低炎症因子的表达保护脓毒症性AKI呢?目前尚未有文献报道绿原酸通过抑制NLRP3炎性小体,从而抑制caspase-1经典焦亡通路,保护脓毒症急性肾损伤。故本实验探究绿原酸是否通过抑制NLRP3/caspase-1经典细胞焦亡信号通路对AKI的保护作用及机制。
1. 材料和方法
1.1. 实验动物
健康SPF级雄性C57Bl/6J小鼠24只,6~8周龄,体质量18~22 g,购自斯贝福(北京)生物技术有限公司,动物使用许可证号SCXK(京)2019-0010,本实验动物研究符合皖南医学院实验动物伦理委员会所制定的伦理学标准(动物伦理批准号:2023-005),实验遵循3R原则。将上述小鼠使用随机数字表方法分成4组:假手术组(Sham组,n=6)、CLP组(n=6)、CLP +地塞米松组(CLP+DXM组,n=6)、CLP+绿原酸组(CLP+CGA组,n=6)。
1.2. 主要试剂与仪器
绿原酸(上海吉至生化科技有限公司,C78051),地塞米松磷酸钠注射液(辰欣药业股份有限公司,国药准字H37021959)。尿素氮(BUN)、肌酐(Scr)、肾损伤分子-1(KIM-1),IL-18和IL-1β的ELISA试剂盒(江苏菲亚生物科技)。Gasdermin-D抗体(武汉三鹰生物公司),caspase-1、NLRP3和GAPDH抗体(Cell Signal Technology)。
1.3. 方法
1.3.1. 脓毒症性
AKI小鼠模型的建立参考文献[18]中盲肠结扎穿刺法建立脓毒症小鼠模型,适应性饲养1周,术前禁食12 h,正常饮水,1%戊巴比妥钠(50 mg/kg)腹腔注射进行麻醉,仰卧位固定后,备皮酒精消毒,沿腹部正中线开1 cm左右切口,逐层切至腹腔,游离肠系膜和盲肠,于盲肠血管弓内游离部至根部中外1/3处结扎,同时用灭菌的1 mL注射器针头贯通结扎的盲肠末端,并挤出绿豆大小的肠内容物,回纳盲肠至腹腔,关腹。sham组仅开腹,未结扎穿刺盲肠。造模成功小鼠表现:小鼠精神萎靡、嗜睡,活动少、怕冷、竖毛反应、呼吸急促。造模后的小鼠进行分组:sham组、CLP组、CLP+地塞米松组(CLP+DEX组)、CLP+绿原酸组(CLP+CGA组)。分别于造模后12 h持续静脉泵注生理盐水(NS)15 mg/kg,NS 15 mg/kg,地塞米松1 μg/kg,绿原酸15mg/kg 6 h [19],如小鼠在此期间出现体动,需追加戊巴比妥钠(50 mg/kg)1/4剂量,直至实验结束。观察各组小鼠7 d生存率。
1.3.2. 样本采集
各组小鼠均在持续静脉泵注药物结束8 h [10],眼球静脉采血1~2 mL,室温下血液自然凝固后3000 r/min离心20 min后取上清保存于-80 ℃用于血清炎症因子及肾功能指标尿素氮(BUN)、肌酐(Scr)和尿液肾损伤分子1(KIM-1)检测;开腹后游离肾组织,观察小鼠肾组织形态,右肾上1/3用10%甲醛固定后,用于HE染色及TUNEL染色观察,左肾及剩余右肾组织保存于-80℃:用于肾组织相关基因及蛋白检测。
1.3.3. HE染色
小鼠右肾上1/3用10%甲醛固定后石蜡包埋切片,然后进行HE染色,光学显微镜下观察肾脏组织病理学变化并拍照。
1.3.4. TUNEL染色
小鼠右肾上1/3用10%甲醛固定后石蜡包埋切片,按试剂盒说明书检测肾脏组织细胞凋亡情况,每张切片随机选取5个视野。
1.3.5. ELISA检测
用上述血清样本,按照ELISA试剂盒操作步骤检测血清炎症因子IL-1β、IL-18、尿素氮(BUN)和肌酐(Scr);提取尿液按照ELISA试剂盒操作步骤检测肾损伤分子1(KIM-1)。
1.3.6. Western blotting
小鼠左肾蛋白称质量后,提取组织蛋白,BCA法测定蛋白含量,取适量分装好的蛋白,加入5×SDS蛋白上样缓冲液,95 ℃煮10 min使蛋白变性,冷却至室温。每个样本20 μg蛋白经电泳后转移到膜上,室温封闭2 h,然后分别与抗NLRP3、caspase-1、Gasdermin-D抗体以及GAPDH抗体(1∶1000稀释)在4 ℃下孵育过夜,TBST洗涤3次,室温下与相应的二抗孵育1 h,用增强化学发光(ECL)显色并拍照,Image J软件扫描并计算蛋白相对表达量。
1.3.7. qRT-PCR
用TRIzol提取小鼠剩余左肾总RNA。使用TAKARA(RR037A)将mRNA逆转录为cDNA。以cDNA为模板,在Biosystems 7500 Real Time PCR系统上使用TAKARATB Green®Premix Ex TaqTM RT-PCR试剂盒进行qRT-PCR。反应条件:预变性95 ℃ 30 s,变性95 ℃ 5 s,退火-延伸60 ℃ 34 s,40个循环。引物序列:GAPDH,Forward-CGTCCCGTAGACAAAATG,Reverse-TTGATGGCAACAATCTCCAC;TNF-α,Forward-TACTGAACTTCGGGGTGA,Reverse-ACTTGGTGGTTTGCTACG;IL-1β,Forward-GAAATGCCACCTTTTGACAGTG,Reverse-TGGATGCTCTCATCAGGACAG;IL-18,Forward-GTGAACCCCAGACCAGACTG,Reverse-CCTGGAACACGTTTCTGAAAGA;ASC,Forward-GACAGTGCAACTGCGAGAAG,Reverse-CGACTCCAGATAGTAGCTGACAA。
1.3.8. 统计学分析
所有统计分析采用GraphPad Prism 7.0软件进行。数据用均数±标准差表示,多组间比较采取单因素方差分析,组内两两比较采用bonferroni法。当P < 0.05时认为差异具有统计学意义。
2. 结果
2.1. 绿原酸对脓毒症小鼠7 d生存率的影响
术后7 d,CLP组小鼠生存率明显降低,而CLP+ DEX组和CLP+CGA组小鼠生存率明显升高,差异具有统计学意义(图 1,P < 0.05)。
图 1.
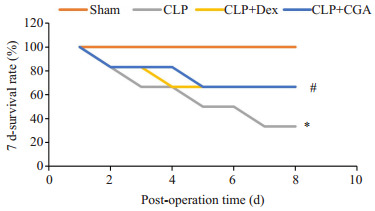
绿原酸改善脓毒症小鼠7 d生存率
CGA improves 7-day survival rate of septic mice. *P < 0.05 vs sham group; #P < 0.05 vs CLP group.
2.2. 绿原酸对脓毒症小鼠肾组织损伤的影响
2.2.1. 肉眼观察小鼠肾脏外观
对照组小鼠肾脏大小正常,红褐色有光泽,包膜紧密;CLP组肾组织整体肿胀,体积变大,充血明显,包膜增厚,CLP+Dex组和CLP+ CGA组肾组织大小接近对照组,红褐色,充血减轻。质地坚硬,包膜增厚(图 2A),肾脏系数结果显示CLP组明显提高,CLP+Dex组和CLP+CGA组肾脏系数接近对照组,差异较CLP组明显降低,差异具有统计学意义(P < 0.05,图 2B)。
图 2.
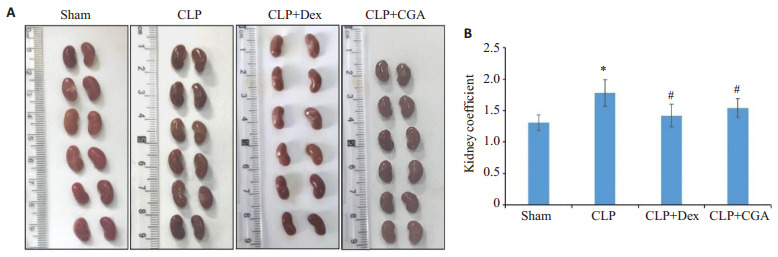
绿原酸改善脓毒症小鼠肾组织大体观及肾脏系数
CGAimproves renal morphology (A) and kidney coefficient (B) in sepsis mice. *P < 0.05 vs sham group; #P < 0.05 vs CLP group.
2.2.2. HE染色结果
sham组肾组织结构相对正常,CLP组小鼠肾组织中肾小球毛细血管扩张,肾小管上皮细胞肿胀等变形脱落的情况,间质水肿明显,炎症细胞浸润。地塞米松和绿原酸治疗后,小鼠肾小球毛细血管扩张减少,肾小管上皮细胞脱落不明显,肾间质水肿和炎症细胞浸润减轻。CLP组肾组织病理评分明显增加,绿原酸可明显改善肾组织病理评分(图 3)。
图 3.
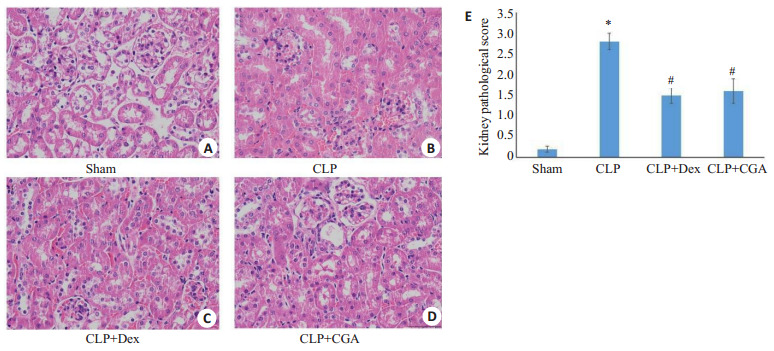
HE染色检测各组肾组织病理损伤情况
Renal pathologies in each group (Original magnification: × 400). A-D: HE staining of the kidney tissues in each group. E: kidney pathological score. *P < 0.05 vs sham group; #P < 0.05 vs CLP group.
2.3. 绿原酸对脓毒症小鼠炎症因子表达的影响
与sham组相比,CLP组小鼠肾脏组织中TNF-α、IL-1β、IL-18 mRNA表达和血清中TNF-α、IL-1β、IL-18的含量明显升高;地塞米松和绿原酸治疗后小鼠肾脏组织中TNF-α、IL-1β、IL-18 mRNA表达和血清中TNF-α、IL-1β、IL-18的含量明显降低(P < 0.05,图 4)。
图 4.
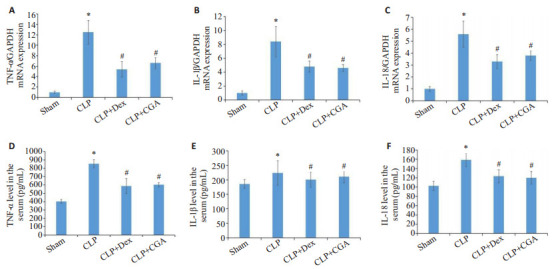
绿原酸减轻脓毒症小鼠肾损伤的炎症因子
CGA reduces inflammatory cytokines in septic mice with acute renal injury. A-C: qRT-PCR for detecting changes of TNF-α, IL-1β and IL-18 mRNA expressions in the kidney tissues. D-F: ELISA for detecting serum levels of TNF-α, IL-1β and IL-18. *P < 0.05 vs sham group; #P < 0.05 vs CLP group.
2.4. 绿原酸对脓毒症小鼠肾组织生化指标的影响
与sham组相比,CLP组小鼠血清中BUN、Scr、尿KIM-1的水平明显升高(P < 0.01)。绿原酸治疗后,小鼠血清中BUN、Scr、尿KIM-1的水平明显下降,差异均具有统计学意义(P < 0.05,图 5)
图 5.
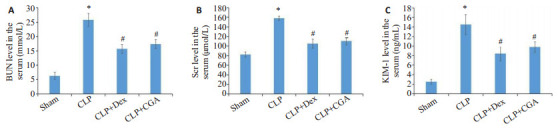
绿原酸减轻脓毒症小鼠肾损伤的生化指标
CGA improves renal function parameters in septic mice. A-C: ELISA for detecting changes of serum levels of BUN, Scr and KIM-1. *P < 0.05 vs sham group; #P < 0.05 vs CLP group.
2.5. 绿原酸对脓毒症小鼠肾组织细胞凋亡的影响
TUNEL染色结果显示CLP组小鼠肾组织细胞凋亡率显著升高,地塞米松和绿原酸处理后能够降低脓毒症小鼠肾组织中细胞凋亡率(P < 0.05,图 6)。
图 6.
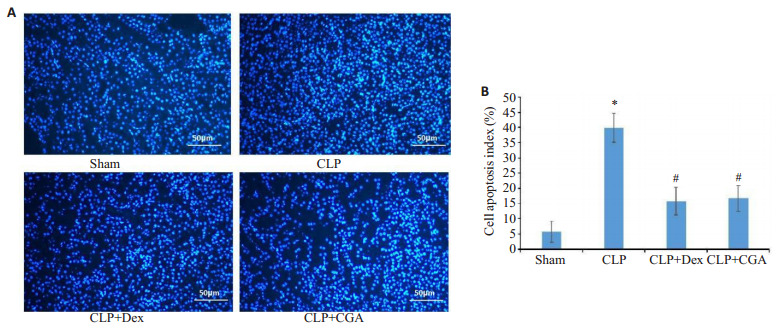
绿原酸减轻脓毒症小鼠组织细胞凋亡
CGA reduces renal cell apoptosis in septic mice. A: TUNEL staining of the renal tissue. B: Renal cell apoptosis rate. *P < 0.05 vs sham group; #P < 0.05 vs CLP group.
2.6. 绿原酸对脓毒症小鼠肾组织NLRP3炎性小体表达的影响
与sham组相比,CLP组小鼠肾脏组织NLRP3、caspase-1蛋白和ASC mRNA水平明显表达明显升高,地塞米松和绿原酸治疗后,小鼠肾脏组织NLRP3、caspase-1蛋白和ASC mRNA表达明显降低(P < 0.05,图 7)。
图 7.
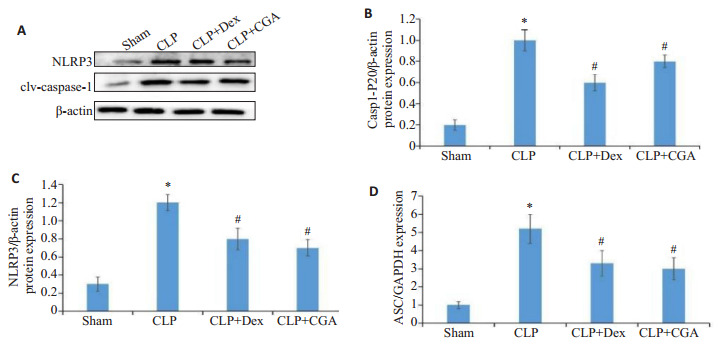
绿原酸抑制脓毒症小鼠肾组织NLRP3炎性小体表达
CGA inhibits the expression of NLRP3 inflammasomes in renal tissues of septic mice. A-C: Western blotting for detecting changes in NLRP3 and caspase-1 in the kidneys of the mice with acute kidney injury. D: qRT-PCR for detecting changes of ASC mRNA expression in the kidney tissues. *P < 0.05 vs sham group; #P < 0.05 vs CLP group.
2.7. 绿原酸对脓毒症小鼠肾组织GSDMD-N表达的影响
与sham组相比,CLP组小鼠肾脏组织Casp1-p20、GSDMD-N蛋白表达升高,地塞米松和绿原酸治疗后,小鼠肾脏组织Casp1-p20、GSDMD-N表达明显降低,差异具有统计学意义(P < 0.05,图 8)。
图 8.
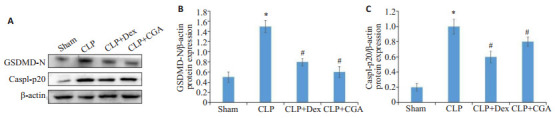
绿原酸减弱脓毒症小鼠肾组织caspase-1及GSDMD-N的表达
CGA reduces expressions of caspase-1 and GSDMD-N in renal tissues of septic mice. A-C: Western blotting for detecting changes in caspase-1 and GSDMD-N in the kidneys of septic mice with acute kidney injury. *P < 0.05 vs sham Group; #P < 0.05 vs CLP group.
3. 讨论
CLP作为研究脓毒症最常见的动物模型,肾脏是其中受累的器官之一,会引发急性肾损伤[20]。其是脓毒症患者常见且严重的并发症之一[21]。本研究结果中,采用CLP构建脓毒症肾损伤模型,发现小鼠7 d生存率明显降低。肉眼观测肾组织整体肿胀,体积变大,充血明显,包膜增厚等大体结构改变,血清BUN、Scr、KIM-1表达明显增高,说明CLP构建的急性脓毒症损伤模型是构建成功的。冯秀晶等[22]研究发现,脂多糖(LPS)诱导的急性肾损伤大鼠,血清肌酐(Scr)、尿素氮(BUN)和尿液肾损伤分子1(KIM-1),及TNF-α,IL-6,IL-1β等血清炎症因子明显升高,说明脓毒症导致的肾损伤不仅会影响肾组织的功能,会引起全身炎症反应。地塞米松是一种有效的抗炎、抗过敏和抗毒作用,能有效减轻组织和细胞的炎症反应,常用于急性脓毒症的治疗[23, 24],因此本研究中用于阳性对照。本研究发现,地塞米松治疗后,脓毒症小鼠的7 d生存率明显提高,肾脏大体观明显好转,及肾损伤后血清中的相关指标BUN、Scr和KIM-1明显降低,提示地塞米松可减轻脓毒症肾损伤的症状。虽然地塞米松抗炎、抗过敏、免疫抑制作用突出,但停药后可能出现停药综合征,如头晕、昏厥、腹痛等症状;长期、大量使用地塞米松,免疫功能会被抑制,导致机体免疫力低下,及感染、胃肠道刺激等其他副作用[25]。基于此,需要寻找其他类似药物替代地塞米松治疗脓毒症急性肾损伤的药物。
绿原酸作为一种天然的多酚类化合物,具有明显的抗炎作用[26]。本研究发现绿原酸干预后脓毒症小鼠的7 d生存率改善,王翔等[19]研究发现与本研究一致,绿原酸可改善脓毒症模型大鼠7 d生存率,可能的原因是绿原酸改善小鼠肾组织血管通透性,引起肾组织损伤,进一步发展为多器官功能障碍导致死亡。本研究发现肾脏大体观和肾脏病理切片炎症渗出明显好转;肾损伤后血清中的相关指标BUN、Scr和尿KIM-1明显降低,冯秀晶等[27]研究发现,绿原酸通过激活Nrf2信号通路促进下游HO-1和NQO1蛋白表达,抑制NLRP3炎症小体激活,减轻炎症级联瀑布反应,从而对LPS诱导的大鼠AKI起到保护作用,说明绿原酸可缓解脓毒症急性肾损伤。
本研究发现,绿原酸干预后肾组织的凋亡细胞数量明显减少,表明绿原酸能明显抑制细胞死亡。Ranjbary等[11]研究发现,绿原酸可治疗结肠癌,对结肠癌细胞系具有细胞毒性、引起细胞周期阻滞和诱导凋亡。NLRP3炎性小体介导的细胞焦亡调控脓毒症的发生发展,NLRP3,ASC蛋白及caspase-1蛋白及下游的Gasdermin-D蛋白是细胞焦亡的重要的蛋白。细胞在感受到外来信号刺激后,激活NLRP3炎性小体,caspase-1前体蛋白被剪切,形成具有活性的cleaved caspase-1,并剪切IL-18、IL-1β前体形成有生物活性的成熟体。同时caspase-1通过剪切Gasdermin-D蛋白诱导细胞焦亡,使细胞发生肿胀和渗透性溶解[28, 29]。本研究发现,脓毒症AKI小鼠肾组织中NLRP3的表达增加。Li等[30]研究发现,NLRP3缺陷,可通过减少肾脏炎症和缺铁性贫血来减轻LPS诱导的脓毒症相关急性肾损伤,表明NLRP3对脓毒症急性肾损伤的促进作用。NLRP3炎性小体激活可促进caspase-1裂解,进而激活下游的炎症因子IL-18、IL-1β的表达,从而促进炎症反应和肾损伤发展[31]。本研究结果显示,CLP组小鼠肾脏组织中NLRP3和ASC的表达较sham组明显升高,说明脓毒症时NLRP3炎性小体被激活;同时caspase-1蛋白及下游的炎症因子IL-18、IL-1β的表达明显增加,说明caspase-1焦亡通路被激活。Chai等[26]研究发现,脓毒症心肌损伤时经典的NLRP3-casepase-1信号通路是被激活的。
绿原酸是源自高等双子叶之和和蕨类植物中的一类多酚类化合物,具有调节脂肪因子、抗炎和抗氧化应激的作用[32]。本研究发现绿原酸干预后,NLRP3、ASC,caspase-1和GSDMD-N蛋白表达显著降低。脓毒症发生时,caspase-1经典细胞焦亡途径被激活,首先激活NLRP3,以NLRP3为代表的炎性小体则进一步切割活化caspase-1,活化的caspase-1促进IL-1β和IL-18等炎症因子的产生,还可以切割GSDMD的N端结构域,介导细胞焦亡发生。绿原酸首先抑制NLRP3和ASC等结构的NLRP3炎性小体的活化,进而抑制caspase-1活化,导致caspase-1 p20亚基,Gasdermin-D蛋白及下游的炎症因子IL-18、IL-1β的表达降低。刘畅等[33]研究发现绿原酸可能通过提高miR-223水平,靶向抑制NLRP3表达, 降低LPS诱导的急性肺损伤小鼠炎症反应, 缓解肺组织病理损伤。刘帆等[34]研究发现,绿原酸可缓解Aβ诱导的AD小鼠神经损伤及NLRP3炎症小体活化。说明绿原酸在不同疾病中可通过抑制NLRP3炎性小体活化,达到治疗疾病的目的。后期我们将进一步深入研究绿原酸是否对miR-223等micro-RNA的影响,进而抑制NLRP3炎性小体的活化,最终影响caspase-1经典细胞焦亡途径。
综上所述,本研究发现绿原酸可减轻脓毒症小鼠急性肾损伤,抑制caspase-1经典细胞焦亡途径的活化,NLRP3炎性小体表达,对脓毒症小鼠具有保护作用。
Biography
房尚萍,硕士,实验师,E-mail: fangshangping0@163.com
Funding Statement
皖南医学院校重点项目科研基金(WK2022Z10);国家级大学生创新创业项目(202310368016);安徽省大学生创新创业项目(S202210368107,S202310368027);安徽省临床重点专科建设项目
Contributor Information
房 尚萍 (Shangping FANG), Email: fangshangping0@163.com.
郭 文俊 (Wenjun GUO), Email: gwj8581@sina.com.
References
- 1.Zhang ZH, Chen L, Liu XL, et al. Exploring disease axes as an alternative to distinct clusters for characterizing sepsis heterogeneity. Intensive Care Med. 2023;49(11):1349–59. doi: 10.1007/s00134-023-07226-1. [DOI] [PubMed] [Google Scholar]
- 2.Cooper BS, Evans S, Jafari Y, et al. The burden and dynamics of hospital-acquired SARS-CoV-2 in England- Nature. 2023;623(7985):132–8. doi: 10.1038/s41586-023-06634-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.White KC, Serpa-Neto A, Hurford R, et al. Sepsis-associated acute kidney injury in the intensive care unit: incidence, patient characteristics, timing, trajectory, treatment, and associated outcomes. A multicenter, observational study. Intensive Care Med. 2023;49(9):1079–89. doi: 10.1007/s00134-023-07138-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Tong SYC, Venkatesh B, McCreary EK. Acute kidney injury with empirical antibiotics for sepsis. JAMA. 2023;330(16):1531–3. doi: 10.1001/jama.2023.18591. [DOI] [PubMed] [Google Scholar]
- 5.Dépret F, Hollinger A, Cariou A, et al. Incidence and outcome of subclinical acute kidney injury using penKid in critically ill patients. Am J Respir Crit Care Med. 2020;202(6):822–9. doi: 10.1164/rccm.201910-1950OC. [DOI] [PubMed] [Google Scholar]
- 6.Lee S, Nakahira K, Dalli J, et al. NLRP3 inflammasome deficiency protects against microbial sepsis via increased lipoxin B4 synthesis. Am J Respir Crit Care Med. 2017;196(6):713–26. doi: 10.1164/rccm.201604-0892OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Nascimento DC, Viacava PR, Ferreira RG, et al. Sepsis expands a CD39+ plasmablast population that promotes immunosuppression via adenosine-mediated inhibition of macrophage antimicrobial activity. Immunity. 2021;54(9):2024–41.e8. doi: 10.1016/j.immuni.2021.08.005. [DOI] [PubMed] [Google Scholar]
- 8.Souto FO, Alves-Filho JC, Turato WM, et al. Essential role of CCR2 in neutrophil tissue infiltration and multiple organ dysfunction in sepsis. Am J Respir Crit Care Med. 2011;183(2):234–42. doi: 10.1164/rccm.201003-0416OC. [DOI] [PubMed] [Google Scholar]
- 9.占 珠琴, 白 海涛. 不同剂量地塞米松对脓毒症肾损伤大鼠血管紧张素Ⅱ及其受体、NO水平变化的影响. 中国临床药理学与治疗学. 2021;26(9):995–1004. [Google Scholar]
- 10.何 荷, 梁 隆斌, 刘 杨, et al. 绿原酸通过ROS/TXNIP/NLRP3信号通路介导的细胞焦亡途径减轻脓毒症小鼠急性肺损伤. 中国病理生理杂志. 2021;37(8):1455–61. [Google Scholar]
- 11.Ranjbary AG, Bagherzadeh A, Sabbaghi SS, et al. Chlorogenic acid induces apoptosis and cell-cycle arrest in colorectal cancer cells. Mol Biol Rep. 2023;50(12):9845–57. doi: 10.1007/s11033-023-08854-y. [DOI] [PubMed] [Google Scholar]
- 12.Qin LY, Wang JM, Wu XH, et al. Antidepressant effects of 70% ethanolic extract of Lonicerae japonicae flos and it contained chlorogenic acid via upregulation of BDNF-TrkB pathway in the hippocampus of mice. Brain Res Bull. 2023;204:110796. doi: 10.1016/j.brainresbull.2023.110796. [DOI] [PubMed] [Google Scholar]
- 13.Li X, Zhang TX, Kang LL, et al. Apoptotic caspase-7 activation inhibits non-canonical pyroptosis by GSDMB cleavage. Cell Death Differ. 2023;30(9):2120–34. doi: 10.1038/s41418-023-01211-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Liu L, Zhou L, Wang LL, et al. MUC1 attenuates neutrophilic airway inflammation in asthma by reducing NLRP3 inflammasome-mediated pyroptosis through the inhibition of the TLR4/MyD88/NF-κB pathway. Respir Res. 2023;24(1):255. doi: 10.1186/s12931-023-02550-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Chang LH, Wu HT, Huang WQ, et al. IL-21 induces pyroptosis of Treg cells via Akt-mTOR-NLRP3-caspase 1 axis in eosinophilic chronic rhinosinusitis. J Allergy Clin Immunol. 2023;152(3):641–55.e14. doi: 10.1016/j.jaci.2023.04.013. [DOI] [PubMed] [Google Scholar]
- 16.Elias EE, Lyons B, Muruve DA. Gasdermins and pyroptosis in the kidney. Nat Rev Nephrol. 2023;19(5):337–50. doi: 10.1038/s41581-022-00662-0. [DOI] [PubMed] [Google Scholar]
- 17.徐 静红, 毛 艳菲. 绿原酸对脂多糖诱导的急性肾损伤小鼠的保护作用. 医药导报. 2019;38(7):860–4. [Google Scholar]
- 18.Mohyeldin RH, Alaaeldin R, Sharata EE, et al. LCZ696 attenuates sepsis-induced liver dysfunction in rats; the role of oxidative stress, apoptosis, and JNK1/2-P38 signaling pathways. Life Sci. 2023;334:122210. doi: 10.1016/j.lfs.2023.122210. [DOI] [PubMed] [Google Scholar]
- 19.王 翔, 何 平, 王 微, et al. 绿原酸减轻脓毒症模型大鼠肺组织损伤的相关机制研究. 免疫学杂志. 2020;36(9):770–6. [Google Scholar]
- 20.Pan P, Chen J, Xie F, et al. Enhancing Nix-dependent mitophagy relieves AKI by restricting TREM-1-mediated hyperactivation of inflammasome in platelets. FASEB J. 2023;37(11):e23239. doi: 10.1096/fj.202202144RRR. [DOI] [PubMed] [Google Scholar]
- 21.Deng Z, He M, Hu H, et al. Melatonin attenuates sepsis-induced acute kidney injury by promoting mitophagy through SIRT3-mediated TFAM deacetylation. Autophagy. 2024;20(1):151–65. doi: 10.1080/15548627.2023.2252265. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.冯 秀晶, 辛 秀, 黄 静, et al. 绿原酸对脓毒症致大鼠急性肾损伤的保护作用. 中国兽医杂志. 2022;58(5):64-70, 2, 133. [Google Scholar]
- 23.Kim SH, Ku YA, Yoo C, et al. Comparison of RCI001 and corticosteroid on the effects on intraocular pressure in mice. Front Med. 2023;10:1256569. doi: 10.3389/fmed.2023.1256569. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Xeroudaki M, Rafat M, Moustardas P, et al. A double-crosslinked nanocellulose-reinforced dexamethasone-loaded collagen hydrogel for corneal application and sustained anti-inflammatory activity. Acta Biomater. 2023;172:234–48. doi: 10.1016/j.actbio.2023.10.020. [DOI] [PubMed] [Google Scholar]
- 25.许 思妍, 晏 扬天, 邱 玺瑞, et al. 玉屏风颗粒对地塞米松诱导的免疫抑制及继发肺部感染的影响. 中医药导报. 2023;29(1):19-23, 30. [Google Scholar]
- 26.Chai X, Liang ZW, Zhang JS, et al. Chlorogenic acid protects against myocardial ischemia-reperfusion injury in mice by inhibiting Lnc Neat1/NLRP3 inflammasome-mediated pyroptosis. Sci Rep. 2023;13(1):17803. doi: 10.1038/s41598-023-45017-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.冯 秀晶, 尹 柏双, 秦 宏宇, et al. 绿原酸通过Nrf2/NLRP3通路减轻LPS致大鼠急性肾损伤的作用机制. 黑龙江畜牧兽医. 2022;(18):111-8, 144. [Google Scholar]
- 28.Li JH, Wang X, Yao ZX, et al. NLRP3-dependent crosstalk between pyroptotic macrophage and senescent cell orchestrates trauma-induced heterotopic ossification during aberrant wound healing. Adv Sci. 2023;10(19):e2207383. doi: 10.1002/advs.202207383. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Pizzuto M, Pelegrin P, Ruysschaert JM. Lipid-protein interactions regulating the canonical and the non-canonical NLRP3 inflammasome. Prog Lipid Res. 2022;87:101182. doi: 10.1016/j.plipres.2022.101182. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Li ZL, Wang X, Peng Y, et al. Nlrp3 deficiency alleviates lipopo-lysaccharide-induced acute kidney injury via suppressing renal inflammation and ferroptosis in mice. Biology. 2023;12(9):1188. doi: 10.3390/biology12091188. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Han S, Li SY, Li JL, et al. Hederasaponin C inhibits LPS-induced acute kidney injury in mice by targeting TLR4 and regulating the PIP2/NF-κB/NLRP3 signaling pathway. Phytother Res. 2023;37(12):5974–90. doi: 10.1002/ptr.8014. [DOI] [PubMed] [Google Scholar]
- 32.Salimi R, Naderi R, Shirpoor A. Involvement of miR-27a/smurf1/TNF-α and mitochondrial apoptotic pathway in apoptosis induced by cerebral ischemia-reperfusion injury in rats: the protective effect of chlorogenic acid. Neurosci Lett. 2023;817:137529. doi: 10.1016/j.neulet.2023.137529. [DOI] [PubMed] [Google Scholar]
- 33.刘 畅, 程 晓丹, 孙 家安, et al. 绿原酸通过调控miR-223/NLRP3轴减轻脂多糖诱导的小鼠急性肺损伤的机制. 中南大学学报: 医学版. 2022;47(3):280–8. doi: 10.11817/j.issn.1672-7347.2022.240248. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.刘 帆, 何 琴, 王 鸿利, et al. 绿原酸缓解Aβ诱导的阿尔茨海默病小鼠神经损伤及NLRP3炎症小体活化. 中国免疫学杂志. 2021;37(16):1933–7. [Google Scholar]


