Abstract
目的
探讨健脾温阳凝胶剂(SSWYG)治疗慢性腹泻的临床疗效及作用机制。
方法
80例脾胃虚弱型慢性腹泻患者随机分为对照组和试验组,每组40例。两组均调整规范的生活方式,对照组给予双歧三联活菌胶囊、试验组给予SSWYG脐疗,1周后评估慢性腹泻的情况。依托中药系统药理学分析平台(TCMSP)、GeneCards、NCBI、OMIM数据库及GEO数据库(GSE14841)获得SSWYG的活性成分和靶点蛋白以及慢性腹泻相关疾病靶点,构建蛋白互作网络(PPI)后,应用拓扑分析获得关键靶点,并对关键靶标进行基因本体(GO)功能富集分析、京都基因与基因组百科全书(KEGG)通路富集分析,运用AutoDock软件进行分子对接以验证SSWYG对特定靶标的亲和力及结合特性。
结果
对照组和试验组患者胃肠道症状评定量表(GSRS),Bristol评分及中医证候评分均有改善(P<0.05),试验组均优于对照组(P<0.05);经筛选,SSWYG治疗慢性腹泻的靶点共68个,拓扑分析筛得最可能的关键靶点33个,GO及KEGG富集分析预测出与慢性腹泻相关的TNF、IL-17等多条通路;分子对接研究提示SSWYG的核心成分均与CASP3、JUN、IL6、AKT1、VEGFA关键靶点有较好的亲和力,尤其JUN和CASP3与复方中多种主要活性成分结合能最低、结合最稳定。
结论
SSWYG不仅明显改善腹痛、便溏等慢性腹泻的临床症状,还能缓解脘腹痞满、倦怠乏力、神疲懒言等症状,从多个维度提高患者生存质量,其作用机制可能主要通过CASP3、JUN调控TNF、IL-17等信号通路发挥治疗慢性腹泻的药理效应,具有多成分、多靶点、多通路协同调节的特点。
Keywords: 健脾温阳凝胶剂, 慢性腹泻, 脐疗, 网络药理学, 分子对接
Abstract
Objective
To investigate the efficacy of Jianpiwenyang Gel (SSWYG) for treating chronic diarrhea and explore its therapeutic mechanism.
Methods
Eighty patients with chronic diarrhea of spleen and stomach weakness type were randomized into two groups for interventions with lifestyle adjustment and treatment with bifid triple viable capsules (control group, n=40) or naval application with SSWYG (treatment group, n=40) for one week, after which symptoms of chronic diarrhea were evaluated. The Chinese medicine system pharmacology analysis platform (TCMSP), GeneCards, NCBI, OMIM database and GEO database (GSE14841) were used to obtain the active ingredients and target proteins of SSWYG and chronic diarrhea-related targets. The key targets were obtained by topological analysis for Gene Ontology (GO) and KEGG analyses. The affinity and binding characteristics of SSWYG for specific targets were verified by molecular docking using AutoDock software.
Results
In both groups, gastrointestinal symptom rating scale (GSRS), Bristol Scale and TCM syndrome scores significantly improved after the treatments (P < 0.05), and better effects were observed in the treatment group (P < 0.05). Sixtyeight targets of SSWYG in treating chronic diarrhea were obtained, and 33 most probable ones were screened out by topological analysis. GO and KEGG analyses identified several chronic diarrhea-related pathways including the TNF and IL-17 pathways. Molecular docking study showed good affinity of the core components of SSWYG for the key targets CASP3, JNK, IL1B, IL6, and AKT1. JUN and CASP3 had the lowest binding energy and the highest stable binding energy with multiple major active ingredients of SSWYG.
Conclusion
SSWYG can significantly improve clinical symptoms of chronic diarrhea possibly by regulating the TNF and IL-17 as well as other pathways via CASP3 and JUN, suggesting a complex therapeutic mechanism of SSWYG involving multiple ingredients and targets and coordinated regulation of multiple pathways.
Keywords: Jianpiwenyang Gel, chronic diarrhea, navel therapy, network pharmacology, molecular docking
慢性腹泻指排便次数明显超过平时习惯(>3次/d),粪质稀薄,可伴有黏液、脓血或未消化的食物,且病程大于4周,或间歇期在2~4周内的复发性腹泻[1, 2],常见于功能性肠病中的肠易激综合征伴腹泻(IBS-D)和功能性腹泻(FDr)[3]。慢性腹泻在我国发病率为3%~5%,基层参训人员特殊群体尤为高发,具有易反复发作、迁延难愈特点,重者可引起吸收不良、水电解质紊乱,甚至焦虑、抑郁等情况,严重影响患者身心健康。《慢性腹泻基层诊疗指南》[4]指出慢性腹泻应以改善症状、提高生活质量为主要目标,提倡以生活方式、情绪及饮食的调整为基础治疗[5],药物治疗多以调节肠道菌群、解痉止泻、抗菌及抗焦虑药物为主[6],虽然短时间内能缓解临床症状,但效果有限,且易产生耐药,不良反应发生率亦高[7]。中医在治疗慢性腹泻上有着独特的优势,将该病归属到“久泻”范畴,健脾温阳是其最常用的临床治法。然而传统口服汤剂有诸如煎煮不便、携带受限等很多局限性,针灸、外敷、灌肠等外治法也很难获得良好的治疗依从性,对于有效制剂的分子机制研究也较少。故而我们在前期研究中开发了健脾温阳凝胶剂(SSWYG),将中医健脾温阳法和中医热熨外敷技术结合起来,有效解决了上述难点。本研究选取80例脾胃虚弱型慢性腹泻的基层参训人员进行前瞻性随机对照研究,同时对SSWYG进行了网络药理学及分子对接技术分析,验证了该凝胶剂临床疗效的同时,进一步阐明其疗效机制,为开发新型制剂奠定临床和药理学基础。
1. 资料和方法
1.1. SSWYG的临床疗效评价研究
1.1.1. 一般资料
研究对象均来源于2023年2月~2023年5月中国人民解放军总医院门诊病例资料完整的脾胃虚弱型慢性腹泻患者,共80例,按随机数字表法随机分为2组。试验组40例:功能性腹泻15例、肠易激综合征(腹泻型)患者25例;对照组40例:功能性腹泻17例、肠易激综合患者23例,两组间年龄、身高、体质量、BMI指数、病程时间等一般资料比较差异均无统计学意义(P>0.05,表 1)。本研究所有患者入组前均由研究者与患者本人及家属充分沟通讲解治疗程序、可能的不良反应等,签署了知情同意书,并通过中国人民解放军总医院医学伦理委员会批准(伦审第S2022-602-01号)。
表 1.
慢性腹泻患者一般资料比较
Comparison of general data of the patients with chronic diarrhea (n=40, Mean±SD)
| Index | Control group | Experimental group | t | P |
| Age (year) | 29.55±8.04 | 28.50±7.69 | 0.597 | 0.552 |
| Height (cm) | 173.80±7.13 | 173.98±7.13 | -0.11 | 0.913 |
| Weight (kg) | 71.69±9.92 | 71.69±10.40 | 0 | 1 |
| BMI (kg/m2) | 23.64±2.22 | 23.60±2.47 | 0.08 | 0.937 |
| Disease duration (week) | 22.80±4.42 | 22.53±4.76 | 0.268 | 0.79 |
1.1.2. 诊断标准
1.1.2.1. 西医诊断标准
参考2019年由中华医学会等机构共同制定的《慢性腹泻基层诊疗指南》[4]:大便次数增加,超过平时排便次数(>3次/d);大便性状有改变,大便稀薄,含水量超过85%,或伴有粘液、脓血、未消化的食物;病程在4周以上,或在2~4周内反复发作。
1.1.2.2. 泄泻中医诊断标准
参考2002年中华人民共和国卫生部制定发布的《中药新药临床研究指导原则》[8]:大便次数增多,3次/d以上,便质或水样便,大便量增加;症状持续1 d以上。
中医证候标准[8]:脾胃虚弱型慢性腹泻判定标准,主症:大便时溏时泻;饮食稍有不慎即发或加重;舌质淡。次症:食后腹胀;食欲不振;倦怠乏力;神疲懒言;苔薄白;脉细弱。证候的确定:主症满足1项,次症满足2项即可确诊。
1.1.3. 纳入标准
符合慢性腹泻的西医诊断标准;符合泄泻中医诊断标准及脾胃虚弱型泄泻的中医证候标准;年龄18~45岁;治疗期间同意不使用其他针对腹泻的治疗;签署知情同意书者。
1.1.4. 排除标准
痢疾、霍乱、寄生虫及胃肠部器质性疾病所致腹泻;合并严重原发性基础性疾病,需服用药物治疗,服用的药物对本次试验有影响者;患有严重的精神类疾病患者,不能对本次试验做出客观的评价者;正在参加其他的药物临床试验患者;病情危重者。
1.1.5. 治疗方法
1.1.5.1. 基础治疗
参考《慢性腹泻基层诊疗指南》调整生活方式的规范性基础治疗。
(1)调整饮食结构:避免诱发或加重腹泻症状的食物,例如既往麦麸过敏或乳糜泻患者,需推荐无麸质饮食;(2)调整生活方式和社会行为,如减少烟酒摄入、注意休息、充足睡眠等;(3)认知治疗:功能性腹泻及IBS患者对疾病的病因和危害的不恰当认知可能会加重症状,诊疗过程中进行良好医患信任沟通对慢性腹泻充分正确的认识。
1.1.5.2. 对照组治疗方法
在基础治疗上给予双歧三联活菌胶囊(上海信谊药厂有限公司,0.21 g×24粒)2粒,3次/d,饭后口服,服用1周。
1.1.5.3. 试验组治疗方法
在基础治疗上给予SSWYG外敷,SSWYG由吴茱萸、干姜、木香、乳香、乌药、小茴香等中药组成,委托贵州省贵成医药科技有限公司制成中药凝胶剂(50 g/贴)。使用方法:脐部(神阙穴)贴敷,分别于第1、2、3、5、7天应用,1贴/d,每次连续贴敷6~8 h,1周为1疗程。
观察期为1周,治疗期间均停用其他相关治疗药物,治疗1周后评价疗效,随访1个月。
1.1.6. 观察指标及疗效判定标准
1.1.6.1. 观察指标
(1)胃肠症状评分:参考胃肠道症状评定量表(GSRS)[9]对治疗前后排便增多、稀便、腹痛、腹鸣、腹胀、排便紧迫感和排便不尽感共7项临床症状评分。排便增多:0分,1次/d;2分,3次/d;4分,5次/d;6分,7次/d或更多。稀便:0分,标准稠度;2分,略稀;4分,糊状的;6分,水样的。余5项临床症状评分:0分,无症状;2分,短暂偶发的临床症状,经提醒后方意识到症状存在;4分,频发的较长时间的临床症状,平素正常行为活动不受限;6分,持续存在,严重影像社会活动;(2)采用Bristol粪便性状评估表(BSFS)[10]对大便性状进行评估7型(7分),水样便,无固形成分;6型(6分),糊状便;5型(5分),边缘清楚的柔软团块,容易排出;4型(4分),光滑而柔软,条状便;3型(3分)表面有裂缝,条状便;2型(2分),表面凹凸,多块的腊肠状;1型(1分),干球状便,很难排出;(3)中医证候积分参考《中药新药临床研究指导原则》[8]泄泻症状分级量化标准由3名副主任医师经验自拟量表评价积分。大便泄泻:无症状,0分;大便不能成形、3~4次/d,2分;大便稀溏、5~10次/d,4分;大便如水样、10次/d以上,6分。脘腹痞满:无症状,0分;食后脘腹痞满、0.5 h内自行缓解,2分;食后脘腹痞满、2h内自行缓解,4分;持续脘腹痞满,6分。食欲:食欲正常,0分;食欲较差、食量减少低于1/3,2分;食欲不佳、食减少1/3以上,4分;终日不欲进食、食量较病前减少1/2,6分;倦怠乏力:无症状,0分;肢体稍倦、可坚持轻体力工作,2分;四肢乏力、勉强坚持日常活动,4分;全身无力、终日不愿活动,6分。神疲懒言:无症状,0分;精神不振、不喜多言、不问不答,2分;精神疲乏、思睡、懒于言语、多问少答,4分;精神萎靡、偶语,6分。
1.1.6.2. 疗效判定标准
参考《中药新药临床研究指导原则》[8]:(1)临床痊愈:症状、体征消失或基本消失,证候积分减少≥95%;(2)显效:症状、体征明显改善,证候积分减少≥70%;(3)有效:症状、体征均有好转,证候积分减少≥30%;(4)无效:症状、体征均无明显改善,甚或加重,证候积分减少不足30%。
计算公式(尼莫地平法)为: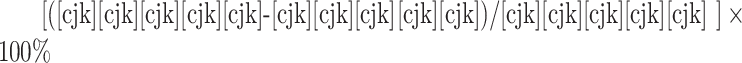 。
。
1.1.6.3. 安全性指标
治疗期间,观察患者贴敷部位出现皮疹、皮肤破溃、水泡等不良事件,分析原因,判断是否与中药相关,并监测血尿便常规、肝肾功能;测定患者心电图,应用不良事件发生率反映不良事件发生情况。
1.1.7. 统计学方法
采用excel录入数据,数据分析采用SPSS26.0,定量数据的描述采用均数±标准差,组间比较采用独立样本t检验,治疗前后的比较,采用配对t检验,计数资料采用例(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
1.2. 网络药理学研究
1.2.1. SSWYG的活性成分及靶标蛋白的筛选
通过中药系统药理学数据库和分析平台(TCMSP)[11](https://tcmspw.com/tcmsp.php)检索吴茱萸、干姜、木香、乳香、乌药、小茴香以及公丁香的主要活性成分、靶标蛋白。因该方为透皮吸收外用制剂,故口服利用度(OB)等因素可不予考虑,参考类药五原则[12]设置成分筛选条件:-2<脂水分配系数(AlogP)<5、相对分子质量(Mw)<500、类药性(DL)≥0.18。将所筛选所得的靶标蛋白经uniprot数据库(https://www.uniprot.org/)[13]校正,并进行标准化处理。
1.2.2. 获取慢性腹泻疾病靶点
在NCBI旗下的GEO数据库中[14]以“Chronic diarrhea”为关键词检索,获得编号为GSE14841的芯片数据原始文件, 使用数据库自带的GE02R分析工具,自定义分组后保存所有结果,保存为geo.csv文件,使用R语言选择P<0.05、|LogFC|>1为限定值获得显著差异基因。以“Chronic diarrhea”为关键词,在GeneCards[15]数据库(https://www.genecards. org/), NCBI基因数据库[16](https://www.ncbi.nlm.nih. gov/),以及DisGeNET数据库[17](https://www.disgenet. org/)进行人类基因检索。将以上4个数据库的基因合并删重之后,得到慢性腹泻相关关键基因。
1.2.3. 韦恩图
将1.2.1中筛选出的药物靶点与1.2.2中获取的疾病靶点通过Venny 2.1.0软件进行交集映射,得到治疗慢性腹泻的潜在作用靶点。
1.2.4. PPI网络图的构建和拓扑学分析
将1.2.3所获得的潜在作用靶点输入String数据库[18](https://string-db. org/cgi/input.pl),将生物种类设定为“Homo sapiens”、minimum required interaction score>0.9,构建PPI网络,借助Cystoscape 3.8.0[19]中NetworkAnalyzer工具进行PPI网络节点的拓扑分析,通过degree排序,设立分值大于平均分的基因作为关键靶点。
1.2.5. GO分析及KEGG富集分析
将SSWYG治疗慢性腹泻的潜在作用靶点进行GO的生物过程(BP)、分子功能(MF)、细胞组分(CC)富集,以及KEGG通路富集分析,引用String数据库,设置P<0.05为筛选条件,筛选出SSWYG干预慢性腹泻的可能生物学过程及通路。
1.2.6. 分子对接
将“1.2.1”中筛选出的核心活性成分与关键靶点进行分子对接,验证网络药理分析结果的准确性。从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中确定复方中5个度值较高的活性成分的名称、分子量和2D结构,然后在RCSB PDB数据库(http://www.rcsb.org/)中下载慢性腹泻的5个核心靶点。运用AutoDock Vina软件(http://vina.scripps.edu/)进行分子对接,测定结合能Affinity值(kcal/mol)即代表两者结合能,Affinity≤-5kcal/mol,结合能力较好,若结合能值越低,配体与受体两者结合越紧密、结合越稳定。取结合能最低的前4个对接结果作图,最后选取affinity最佳构象,使用Pymol软件分析和观察对接结果,并将结果可视化处理。
2. 结果
2.1. 临床研究结果
2.1.1. 胃肠道症状评定量表细则评分比较
对照组、试验组各项症状在治疗前进行独立样本t检验,各项症状积分的差异无统计学意义(P均>0.05),表明两组可进行比较(表 2)。治疗后,对照组和试验组在大便次数、稀便形态、排便紧迫感、腹胀、肠鸣以及GSRS总分比较,与治疗前都有显著差异(P<0.001),且两组治疗后的差异有统计学意义(P<0.05);排便不尽感、腹痛症状的比较发现,两组患者与治疗前相比差异均有统计学意义(P<0.05),且试验组优于对照组,但治疗后两组患者组间比较没有明显统计学差异(P>0.05)。
表 2.
两组患者治疗前后胃肠道症状评分
Comparison of GSRS scores between the two groups before and after treatment (n=40, Mean±SD)
| Index | Control group | Experimental group | t | P | |
| *P<0.05 before and after treatment, △P<0.05 vs control group. | |||||
| Stool frequency score | prior-treatment | 3.45±1.11 | 3.58±1.06 | -0.516 | 0.608 |
| Post-treatment | 2.60±1.53* | 0.40±0.93*△ | 7.766 | <0.001 | |
| Stool shape score | prior-treatment | 3.70±1.40 | 4.05±1.47 | -1.092 | 0.278 |
| Post-treatment | 2.53±1.48* | 0.90±1.35*△ | 5.113 | <0.001 | |
| Incomplete defecation score | prior-treatment | 0.55±0.90 | 0.85±1.27 | -1.216 | 0.228 |
| Post-treatment | 0.53±0.88 | 0.55±0.90*△ | -0.126 | 0.9 | |
| Defecation urgency score | prior-treatment | 2.35±0.58 | 2.33±0.70 | 0.115 | 0.909 |
| Post-treatment | 1.65±1.00* | 0.60±0.93*△ | 4.864 | <0.001 | |
| Abdominal pain score | prior-treatment | 0.85±1.10 | 1.05±1.11 | -0.81 | 0.42 |
| Post-treatment | 0.50±0.88 | 0.28±0.68*△ | 1.283 | 0.203 | |
| Bloating score | prior-treatment | 2.30±0.72 | 2.20±0.88 | 0.554 | 0.581 |
| Post-treatment | 1.98±0.48* | 0.63±1.08*△ | 7.233 | <0.001 | |
| Borborygmus score | prior-treatment | 3.15±1.10 | 2.90±1.10 | 1.015 | 0.313 |
| Post-treatment | 1.95±1.30* | 0.50±0.88*△ | 5.848 | <0.001 | |
| Total points | 16.35±2.44 | 16.90±2.78 | -0.939 | 0.35 | |
| prior-treatment | 11.73±3.43* | 3.85±3.11*△ | 10.763 | <0.001 | |
| post-treatment | |||||
2.1.2. 两组Bristol粪便性状比较
治疗前,对照组的Bristol评分均数为5.90,试验组为6.10,无统计学差异(t=-1.295,P=0.199);治疗后,对照组的Bristol评分均数为5.08,试验组为4.38(t=4.259,P<0.001)。
2.1.3. 两组中医证候积分比较
对照组、试验组的大便泄泻评分、脘腹痞满评分、食欲评分、倦怠乏力评分、神疲懒言评分在治疗前进行独立样本t检验,各项症状积分无统计学差异(P>0.05),表明两组可进行比较(表 3)。治疗后,对照组与试验组的大便泄泻评分、脘腹痞满评分均数差异有统计学意义(P<0.001;),对照组、试验组治疗前后相比较差异有统计学意义(P<0.05);治疗后,对照组与试验组食欲评分、倦怠乏力评分、神疲懒言评分均数差异均有统计学意义(P<0.001),对照组治疗前后相比较差异无统计学意义(P>0.05),试验组治疗前后相比较差异有统计学意义(P<0.05)。
表 3.
两组患者治疗前后中医证候积分
Comparison of TCM syndrome score before and after therapy between the two groups (n=40, Mean±SD)
| Index | Control group | Experimental group | t | P | |
| *P<0.05 before and after treatment, △P<0.05 vs control group. | |||||
| Diarrhea score | prior-treatment | 2.55±1.01 | 2.53±0.85 | 0.12 | 0.905 |
| post-treatment | 1.63±0.74* | 0.55±0.90*△ | 5.817 | <0.001 | |
| Abdominal fullness score | prior-treatment | 2.75±0.98 | 2.60±0.81 | 0.746 | 0.458 |
| post-treatment | 1.95±1.18* | 0.40±0.81*△ | 6.866 | <0.001 | |
| Appetite score | prior-treatment | 2.58±1.03 | 2.75±0.90 | -0.807 | 0.422 |
| post-treatment | 2.55±1.04 | 0.73±1.11*△ | 7.603 | <0.001 | |
| Burnout and fatigue score | prior-treatment | 2.95±0.96 | 2.95±0.93 | 0 | 1 |
| post-treatment | 2.88±1.02 | 1.08±1.16*△ | 7.366 | <0.001 | |
| Mentally tired and lazy score | prior-treatment | 3.10±0.87 | 3.10±0.90 | 0 | 1 |
| post-treatment | 3.00±0.88 | 1.58±1.17*△ | 6.149 | <0.001 | |
2.1.4. 两组临床疗效比较
治疗1周后,试验组临床疗效总有效率97.5%,高于对照组45%,差异有统计学意义(P<0.001)。
2.1.5. 不良反应
治疗7 d后,两组患者血尿便常规、肝肾功能以及心电图检查均未见异常。治疗期间,试验组中2例患者在用药第2天后出现脐部皮肤泛红、瘙痒症状,无明显皮疹、水泡等;追问病史,该2例患者未遵医嘱自行将贴敷时间延长至12 h以上,考虑局部皮肤不良反应与用药时间过长有关,患者停药48 h后皮肤不适情况明显缓解,后继续按医嘱时间应用药物后均未再见不良反应,余患者均未见不良反应发生。
2.2. 网络药理学及分子对接结果
2.2.1. SSWYG治疗慢性腹泻的靶点筛选
通过TCMSP检索吴茱萸获得27个化合物成分、181个靶点,干姜获得17个化合物成分、24个靶点,木香获得7个化合物成分、26个靶点,乳香获得8个化合物成分、74个靶点,乌药获得18个化合物成分、176个靶点,小茴香获得1个化合物成分、7个靶点,公丁香获得8个化合物成分、172个靶点,经标准化处理后获得SSWYG相关靶点共241个。通过GeneCards、NCBI以及DisGeNET数据库分别检索到1164、66、62个相关靶点,GEO数据库中筛选得到的GSE14841的芯片实验的差异靶点进行合并,删除重复靶标,得到1280个疾病相关基因。将SSWYG的活性成分靶点与慢性腹泻的相关靶点韦恩图制作软件取交集,获得68个靶点(图 1)。
图 1.
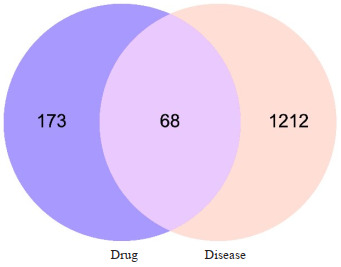
药物与疾病靶标韦恩图
Wayne diagram of drug and disease targets.
2.2.2. PPI网络构建及拓扑分析
将2.2.1所得的靶点导入string网站,对SSWYG治疗慢性腹泻的潜在作用靶点进行PPI分析,蛋白互作信息图可视化,网络中有68个节点,730条边,平均度值为21.8(图 2A)。通过Cytoscape 3.8.0软件中进行拓扑学分析,核心靶点通过degree排序,获得33个度值分值大于平均分的关键靶点,将排名前20的靶点使用R 4.0.3进行图片绘制,横坐标为每个靶点的度值(图 2B)。据此可知,SSWYG治疗慢性腹泻的关键靶点主要有丝氨酸/苏氨酸激酶1(AKT1)、胱天蛋白酶3(CASP3)、白介素6(IL6)、活化蛋白-1(JUN)、血管内皮生长因子A(VEGFA)等。
图 2.
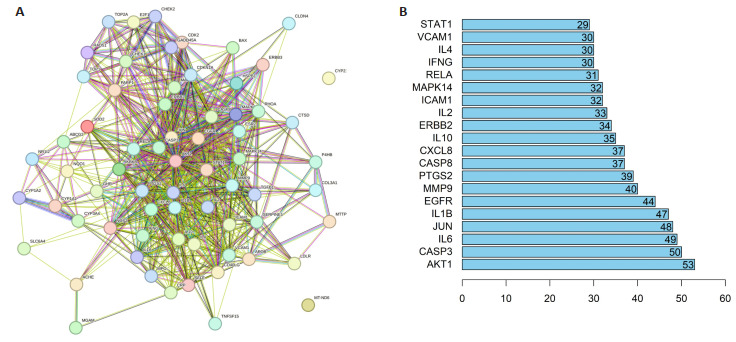
SSWYG与慢性腹泻交集靶点的PPI网络和拓扑分析
PPI network analysis (A) and topological analysis (B) of the intersection targets of SSWYG and chronic diarrhea.
2.2.3. SSWYG中关键成分筛选
通过cytoscape 3.8.0构建了成分-疾病-靶点网络图,将筛选出SSWYG的活性化学成分名称与药物活性成分MOL ID进行对接,并按degree值大小排序,将成分进行degree的排序,degree值越高成分越重要,越可能是SSWYG治疗慢性腹泻的关键化合物。选取度值排名前4的活性成分作为关键成分进行后续的研究,从高到低的化合物分别为MOL000098槲皮素(quercetin)、MOL000390黄豆甙元(daidzein)、MOL000422山奈酚(kaempferol)、MOL000354异鼠李素(isorhamnetin)。
2.2.4. GO富集分析及KEGG分析
将2.2.2所得关键靶点进行GO富集分析,利用R绘制气泡图(图 3A)。结果显示分子功能(MF)72个、细胞组分(CC)富集34种细胞成分,影响了1446条生物过程(BP)。MF方面主要富集在细胞因子受体结合、细胞因子活性、受体配体活性、信号受体激活剂、活性蛋白丝氨酸/苏氨酸激酶活性、血红素结合等。CC方面,在膜筏、膜区域、膜微区等富集占比较高。BP主要富集在对脂多糖的反应、对细菌分子的反应、对氧化应激的反应、活性氧的代谢过程、药物反应细胞对化学应激的反应、对活性氧的反应等。
图 3.
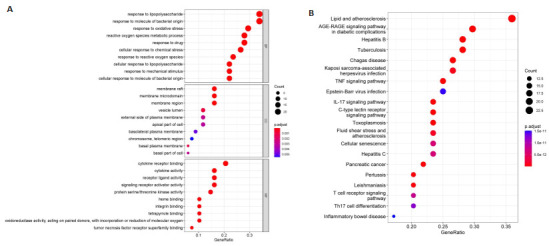
SSWYG治疗慢性腹泻关键靶点的GO功能分析和KEGG通路富集分析
GO function and KEGG analysis of the key targets of SSWYG against chronic diarrhea. A: Bubble map of GO function analysis. B: Bubble map of KEGG analysis.
将关键靶点进行KEGG富集分析,利用R绘制气泡图(图 3B)。结果显示靶基因显著富集在148条信号通路(Count>2,P<0.05),选取前20条通路进行可视化分析得到气泡图(纵坐标为富集条目,横坐标表示基因所占比例,图中气泡越大代表富集基因数越多,颜色越红表示富集程度越显著),除外弓形虫、动脉粥样硬化、肺结核等与“慢性腹泻”不相关的通路后,主要涉及TNF、IL-17、衰老等信号通路。
2.2.5. SSWYG治疗慢性腹泻的关键靶点分子对接验证
4种活性成分与CASP3、JNK、IL1B、IL6、AKT1关键靶点结合能均较低、配体与受体均具有较好的结合力(图 4A)。其中CASP3与槲皮素和异鼠李亭素、JNK靶点与槲皮素、黄豆甙原和山奈酚结合力最好(图 4B~F)。
图 4.
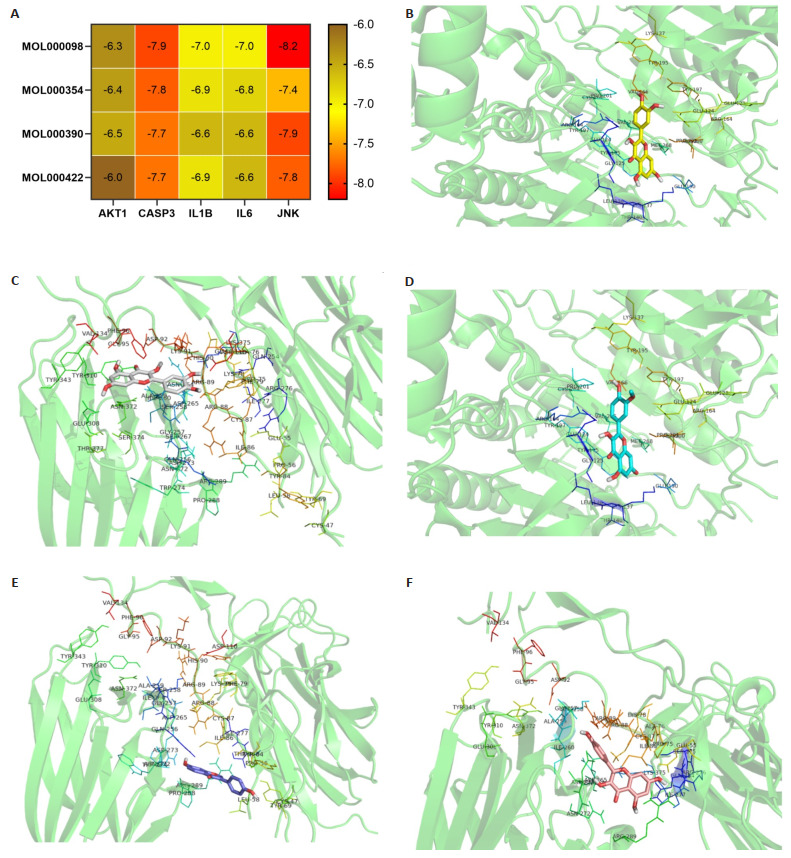
分子对接效能热图与药物活性成分与慢性腹泻关键蛋白对接效能最高的模式图
Heat map of molecular docking efficiency and pattern of the highest docking efficiency between drug active ingredients and the key proteins of chronic diarrhea. A: Heat map. B: CASP3 and MOL000098. C: CASP3 and MOL000354. D: JNK and MOL000098. E: JNK and MOL000390. F: JNK and MOL000422.
3. 讨论
慢性腹泻以大便时溏时泻、饮食稍有不慎即发或加重为主症,以食后腹胀、食欲不振、倦怠乏力、神疲懒言、舌质淡苔薄白、脉细弱为次症,脾胃阳虚、中焦虚寒是其最主要的病机。SSWYG主要是由吴茱萸、干姜、木香、乳香、乌药、小茴香等中药组成,方中吴茱萸味辛苦而性热,既能温胃暖肝祛寒,又能和胃降逆,小茴香、乌药可温中散寒、扶助脾阳,顾护中土,共为君药;木香为臣药,畅通中焦气机,降逆导滞;乳香为佐药,辛窜走散,活血化瘀,诸药共奏健脾和胃、益气温元之功,正可切中慢性腹泻的病机。本研究的结果进一步证实了其不仅可以改善患者大便次数多、稀便形态、排便紧迫感、脘腹痞满情况以及Bristol评分,对西药治疗无效的排便不尽感、腹痛、食欲、倦怠乏力、神疲懒言亦有明显效果,有效率高达97.5%。它的主要优势:其外敷剂型通过脐疗的方式透皮吸收,避免口服剂型难以解决的胃肠降解及肝脏首过效应,提高了药物的利用率;SSWYG是基于中医热熨技术的运用,加强局部血液循环,提高了药物的渗透和吸收,增强了健脾温阳方的疗效;利用中医经络理论神阙穴具有“复元固本、和胃理肠”的功能,达到了更好的临床效果。此外,SSWYG中的主要成分吴茱萸、乳香,口服时对胃肠粘膜有一定的刺激,部分患者会出现恶心、呕吐等消化系统不良反应,改成外用凝胶剂型(SSWYG)后并未再出现上述不良反应。
本研究通过网络药理学筛选出SSWYG中度值较高的主要活性成分为槲皮素、黄豆甙元、山奈酚、异鼠李素。有研究表明,槲皮素是一种类黄酮化合物,可通过诱导激活的NF-κB信号通路抑制轮状病毒性腹泻[20],而且通过诱导紧密连接蛋白一定程度上恢复了肠道的上皮完整性,显著减少肠道炎症[21];黄豆甙元是一种异黄酮植物雌激素化合物,可通过抑制PI3K/AKT和P38通路相关蛋白的磷酸化及相关基因的水平,修复肠上皮屏障损伤,从而发挥防治腹泻的作用[22];山奈酚可通过提高厚壁菌与拟杆菌的比例来重塑肠道微生物,提高有益菌,从而调节肠道微生物群[23];异鼠李素可通过激活Nrf2/HO-1通路,缓解H2O2引起的肠上皮细胞氧化应激损伤[24]。通过对这些药物活性成分与慢性腹泻的相关靶标进行相关性分析,我们可以初步推测,这些主要活性成分发挥的抗肠上皮细胞氧化应激损伤、减少肠道慢性炎症、调节肠道微生物菌群的功能,很可能就是SSWYG治疗慢性腹泻的机理。
网络药理学研究和分子对接技术可通过大数据库去探索药物发挥疗效的关键蛋白和可能的信号通路,诠释临床问题。本研究对SSWYG靶点、通路、分子对接结果的综合分析,也为该新型制剂的疗效机制,提供了非常有价值的线索。首先,分子对接结果显示SSWYG中主要活性成分与AKT1、CASP3、IL6、JUN、VEGFA等关键蛋白结合力良好,尤其是JUN和CASP3与复方中多种主要活性成分结合能最低,结合最稳定,提示JUN和CASP3可能是SSWYG治疗慢性腹泻的两个极其关键的蛋白。相关的研究也有证实,CASP3能够导致DNA裂解促进细胞凋亡,与肠道菌群失调有着重要联系,下调CASP3蛋白的表达可以改善肠道菌群,显著增加有益菌的丰度[25];JUN蛋白是活化蛋白-1(AP-1)转录复合物中具有转录活性的转录因子,对细胞增殖、凋亡等生物学过程进行调控,可响应促炎细胞因子、危险相关分子配体与肠屏障功能障碍相关刺激激活c-Jun氨基末端激酶信号通路,会影响杯状细胞分泌黏蛋白以及紧密连接蛋白的表达,破坏肠黏液层的完整性,引起肠屏障功能障碍[26, 27]。其次,网络药理学KEGG富集结果示TNF信号通路、IL-17信号通路、细胞衰老可能是SSWYG治疗慢性腹泻的重要相关通路,有报道TNF信号通路的主要受体TNFR1在大多数组织中表达,与TNF的交联可以产生经典的促炎反应,激活NF-κB、c-Jun和MAPK通路,影响IL-1、IL-6等各种经典促炎细胞因子的表达,参与肠道炎症的产生和肠道黏膜的修复过程[28]。故此,我们推测,该方中的槲皮素、黄豆甙元、山奈酚、异鼠李素主要活性成分可能通过作用于JUN、CASP3等核心靶点调控TNF等信号通路达到治疗慢性腹泻的作用,这为下一步我们继续进行体内体外实验对SSWYG的疗效机制展开更深入的分子机制研究,从而研制出慢性腹泻的新型药物奠定更坚实的实验研究基础。
Biography
崔艺馨,硕士,副主任医师,E-mail: cuiyixin@301hospital.com.cn
Funding Statement
中医药服务能力培育与提升专项计划面上项目(2021ZY049)
Contributor Information
崔 艺馨 (Yixin CUI), Email: cuiyixin@301hospital.com.cn.
张 印 (Yin ZHANG), Email: 301zhangyin@sina.com.
References
- 1.Arasaradnam RP, Brown S, Forbes A, et al. Guidelines for the investigation of chronic diarrhoea in adults: British Society of Gastroenterology, 3rd edition. Gut. 2018;67(8):1380–99. doi: 10.1136/gutjnl-2017-315909. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Schiller LR, Pardi DS, Sellin JH. Chronic diarrhea: diagnosis and management. Clin Gastroenterol Hepatol. 2017;15(2):182–93. e3. doi: 10.1016/j.cgh.2016.07.028. [DOI] [PubMed] [Google Scholar]
- 3.Savarino E, Zingone F, Barberio B, et al. Functional bowel disorders with diarrhoea: clinical guidelines of the United European Gastroenterology and European Society for Neurogastroenterology and Motility. United European Gastroenterol J. 2022;10(6):556–84. doi: 10.1002/ueg2.12259. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.吴 开春, 邹 多武, 李 景南, et al. 慢性腹泻基层诊疗指南年. 中华全科医师杂志. 2020;19(11):973–982. doi: 10.3760/cma.j.cn114798-20200904-00960. [DOI] [Google Scholar]
- 5.中华医学会消化病学分会胃肠功能性疾病协作组, 中华医学会消化病学分会胃肠动力学组 中国肠易激综合征专家共识意见(2015年, 上海) 中华消化杂志. 2016;36(5):299–312. doi: 10.3760/cma.j.issn.0254-1432.2016.05.005. [DOI] [Google Scholar]
- 6.中华中医药学会脾胃病分会 泄泻中医诊疗专家共识意见(2017) 中医杂志. 2017;58(14):1256–60. [Google Scholar]
- 7.贺双艳. 健脾二术汤治疗慢性腹泻(脾胃虚弱型)的临床疗效观察[D]. 长春: 长春中医药大学, 2022.
- 8.郑 筱萸. 中药新药临床研究指导原则: 试行. 北京: 中国医药科技出版社; 2002. [Google Scholar]
- 9.Bentler PM, Chou CP. Practical issues in structural modeling. Sociol Meth Res. 1987;16(1):78–117. doi: 10.1177/0049124187016001004. [DOI] [Google Scholar]
- 10.Lewis SJ, Heaton KW. Stool form scale as a useful guide to intestinal transit time. Scand J Gastroenterol. 1997;32(9):920–4. doi: 10.3109/00365529709011203. [DOI] [PubMed] [Google Scholar]
- 11.Ru JL, Li P, Wang JN, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines. J Cheminform. 2014;6:13. doi: 10.1186/1758-2946-6-13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Lipinski CA, Lombardo F, Dominy BW, et al. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings. Adv Drug Deliv Rev. 2001;46(1/2/3):3–26. doi: 10.1016/s0169-409x(00)00129-0. [DOI] [PubMed] [Google Scholar]
- 13.UniProt Consortium UniProt: a worldwide hub of protein knowledge. NucleicAcids Res. 2019;47(D1):D506–15. doi: 10.1093/nar/gky1049. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Salvo-Romero E, Martínez C, Lobo B, et al. Overexpression of corticotropin-releasing factor in intestinal mucosal eosinophils is associated with clinical severity in Diarrhea-Predominant Irritable Bowel Syndrome. Sci Rep. 2020;10(1):20706. doi: 10.1038/s41598-020-77176-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Safran M, Dalah I, Alexander J, et al. GeneCards Version 3: the human gene integrator. Database. 2010;2010:baq020. doi: 10.1093/database/baq020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Sayers EW, Beck J, Bolton EE, et al. Database resources of the national center for biotechnology information. Nucleic Acids Res. 2024;52(D1):D33–43. doi: 10.1093/nar/gkad1044. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Piñero J, Bravo À, Queralt-Rosinach N, et al. DisGeNET: a comprehensive platform integrating information on human diseaseassociated genes and variants. Nucleic Acids Res. 2017;45(D1):D833–9. doi: 10.1093/nar/gkw943. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Szklarczyk D, Gable AL, Lyon D, et al. STRING v11: proteinprotein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets. NucleicAcids Res. 2019;47(D1):D607–13. doi: 10.1093/nar/gky1131. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Doncheva NT, Morris JH, Gorodkin J, et al. Cytoscape StringApp: network analysis and visualization of proteomics data. J Proteome Res. 2019;18(2):623–32. doi: 10.1021/acs.jproteome.8b00702. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Banerjee S, Sarkar R, Mukherjee A, et al. Quercetin, a flavonoid, combats rotavirus infection by deactivating rotavirus-induced prosurvival NF-κB pathway. Front Microbiol. 2022;13:951716. doi: 10.3389/fmicb.2022.951716. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Riemschneider S, Hoffmann M, Slanina U, et al. Indol-3-carbinol and quercetin ameliorate chronic DSS-induced colitis in C57BL/6 mice by AhR- mediated anti- inflammatory mechanisms. Int J Environ Res Public Health. 2021;18(5):2262. doi: 10.3390/ijerph18052262. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Zhang BP, Wei XH, Ding MZ, et al. Daidzein protects caco-2 cells against lipopolysaccharide-induced intestinal epithelial barrier injury by suppressing PI3K/AKT and P38 pathways. Molecules. 2022;27(24):8928. doi: 10.3390/molecules27248928. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Gao L, Tang ZP, Li TB, et al. Combination of kaempferol and azithromycin attenuates Staphylococcus aureus-induced osteomyelitis via anti-biofilm effects and by inhibiting the phosphorylation of ERK1/2 and SAPK. Pathog Dis. 2021;79(8):ftab048. doi: 10.1093/femspd/ftab048. [DOI] [PubMed] [Google Scholar]
- 24.王 德宇, 杨 东亮, 常 刘. 异鼠李素对H2O2诱导的肠上皮细胞氧化应激损伤的保护作用. 陕西中医. 2023;44(1):7–11. [Google Scholar]
- 25.尹 红, 唐 艳萍, 杨 磊, et al. 活血通降方对反流性食管炎大鼠肠道菌群及Caspase-3/GSDME通路的影响. 中国中西医结合消化杂志. 2022;8(10):701-7, 712. [Google Scholar]
- 26.Capaldo CT, Powell DN, Kalman D. Layered defense: how mucus and tight junctions seal the intestinal barrier. J Mol Med. 2017;95(9):927–34. doi: 10.1007/s00109-017-1557-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Khan I, Huang ZB, Liang LY, et al. Ammonia stress influences intestinal histomorphology, immune status and microbiota of Chinese striped-neck turtle (Mauremys sinensis) Ecotoxicol Environ Saf. 2021;222:112471. doi: 10.1016/j.ecoenv.2021.112471. [DOI] [PubMed] [Google Scholar]
- 28.Ruder B, Atreya R, Becker C. Tumour necrosis factor alpha in intestinal homeostasis and gut related diseases. Int J Mol Sci. 2019;20(8):1887. doi: 10.3390/ijms20081887. [DOI] [PMC free article] [PubMed] [Google Scholar]


