Abstract
肠道微生物作为人体最庞大的生态系统参与尿酸的合成与代谢,开发和利用肠道细菌降解尿酸或可为高尿酸血症治疗提供新思路。将低尿酸人群粪便样本处理后接种于浓度为1.5 mmol/L尿酸选择培养基进行初筛,通过浓度梯度法对初筛出的可能具有降解能力的菌株进行驯化,并通过16S rRNA序列测定方法对筛选出的具备高效尿酸降解率的菌株进行鉴定。结果表明从低尿酸人群粪便中筛选驯化出一株高效尿酸降解菌S3A,尿酸降解率可达到50.2%,经鉴定该菌为大肠杆菌。高效尿酸降解菌株的分离、驯化不仅可以为肠道微生物降解尿酸的机制研究提供科学依据,还可为今后临床高尿酸血症和痛风的治疗储备生物菌种资源。
Keywords: 低尿酸人群, 尿酸降解功能菌, 筛选, 驯化, 尿酸降解率
Abstract
As the largest ecosystem of human body, intestinal microorganisms participate in the synthesis and metabolism of uric acid. Developing and utilizing intestinal bacteria to degrade uric acid might provide new ideas for the treatment of hyperuricemia. The fecal samples of people with low uric acid were inoculated into uric acid selective medium with the concentration of 1.5 mmol/L for preliminary screening, and the initially screened strains that may have degradation ability were domesticated by concentration gradient method, and the strains with high uric acid degradation rate were identified by 16S rRNA sequencing method. A strain of high-efficiency uric acid degrading bacteria was screened and domesticated from the feces of people with low uric acid. The degradation rate of uric acid could reach 50.2%. It was identified as Escherichia coli. The isolation and domestication of high efficient uric acid degrading strains can not only provide scientific basis for the study of the mechanism of intestinal microbial degradation of uric acid, but also reserve biological strains for the treatment of hyperuricemia and gout in the future.
Keywords: Low uric acid population, Uric acid degrading bacteria, Screen, Domestication, Uric acid degradation rate
引言
尿酸是嘌呤代谢的终产物,尿酸代谢紊乱可导致高尿酸血症的发生,是痛风性关节炎和肾功能衰竭的诱因。此外,高尿酸血症还是糖尿病、非酒精性脂肪肝、心血管疾病、肥胖及高血压等慢性疾病的危险因素[1-5]。人体每天产生的尿酸2/3通过肾脏排出,余1/3则通过肠道排泄,其中肠道菌群对机体尿酸的代谢不容忽视。肠道菌群作为人体内最大的微生态系统,参与人体的消化、营养吸收以及代谢等过程[6],与人体的健康和疾病有着密切的关联。高尿酸血症患者相较正常人群肠道中乳杆菌属、链球菌属、梭菌属及变形杆菌属等菌属的分布存在明显差异[7-10]。在尿酸代谢过程中,部分肠道细菌直接参与尿酸的生成及排泄[11],但具体作用机制尚未明确。
因此,本研究采用细菌的分离培养和筛选技术,对低尿酸人群粪便中可能具有尿酸降解功能的细菌进行筛选驯化,以期对尿酸降解功能菌的进一步开发和利用提供研究思路。
1. 材料方法
1.1. 主要试剂及设备
96孔板(广州赛国生物科技有限公司),尿酸、丙三醇(上海麦克林生化科技有限公司),磷酸氢二钾(天津市致远化学试剂有限公司),琼脂粉、脑心浸液培养基(Brain Heart Infusion Medium,BHI)(青岛海博生物科技有限公司),革兰染液(珠海贝索生物技术有限公司),尿酸测定试剂盒(南京建成生物工程研究所),细菌基因组DNA快速抽提试剂盒(上海生工生物工程股份有限公司),超声震荡仪F-031SD(深圳福洋科技集团有限公司),生物显微镜Ni-U(日本尼康生物),VITEK-2 Compact 30全自动细菌鉴定仪[梅里埃诊断产品(上海)有限公司],日本三菱MGC厌氧产气袋。
1.2. 粪便标本收集
来源于新疆某高校大一健康男性,年龄18~20岁,按照以下纳入标准选择15名研究对象,收集晨起中段无污染粪便于无菌粪便采样管中,置于冰盒,2小时内运送到实验室进行预处理。纳入标准:采样期向前推三个月内无重大疾病且未服用抗生素,健康体检后血尿酸<190 μmol/L的低水平尿酸者,对本研究均知情同意。
1.3. 粪便预处理
无菌离心管称取粪便样本0.2~0.3 g,将其加入到备好玻璃珠和无菌水(10 mL)的试管内,振摇5 min,将标本梯度稀释至10−3~10−5,取上清制备成菌液保存。
1.4. 培养基的制备
1.4.1. 尿酸溶解
根据尿酸的化学式(C5H4N4O3)及摩尔质量(M=168.110 3 g/mol),称取尿酸1.681 1 g溶解在1 000 mL溶剂中,制备成浓度10 mmol/L尿酸溶液 ,具体方法见参考文献[12]。
1.4.2. 尿酸选择培养基的制备
称取3.85 g BHI置于100 mL容量瓶中,并向容量瓶中加入15 mL配置好的10 mmol/L尿酸溶液,超纯水定容至100 mL,配成终浓度为1.5 mmol/L BHI尿酸选择培养基,平行3个样,高压灭菌备用。
1.4.3. 尿酸驯化培养基的制备
称取3.85 g BHI置于4个100 mL容量瓶中,向容量瓶中分别加入17、19、21、23 mL已溶解好的10 mmol/L尿酸溶液,超纯水定容至100 mL。配成终浓度为1.7、1.9、2.1、2.3 mmol/L的尿酸BHI培养基,每个浓度平行3个样,高压灭菌备用。
1.5. 标准曲线的绘制
本研究根据尿酸测定试剂盒所提供的标准品采用尿酸酶法制定标准曲线。将400 μmol/L尿酸标准品稀释为7个浓度,分别为100、150、200、250、300、350、400 μmol/L(每个浓度平行3个样)。取5 μL不同浓度尿酸标准品及稀释后的待测菌培养滤过液(平行3个样)加入至96孔板中,在紫外波长510 nm处测定其吸光度值,根据浓度及其所对应的吸光度值建立标准曲线并计算尿酸浓度。
1.6. 尿酸降解功能菌的筛选
将预处理后的粪便样本接种到尿酸浓度为1.5 mmol/L BHI筛选液体培养液中,置于厌氧条件下37 ℃培养24~48 h。采用分区划线法将具有尿酸降解功能的原始培养液接种于BHI初筛平板中进行分离培养,连续分离纯化三次,每次都进行菌落计数和革兰染色形态鉴定,直到分离纯化出纯的单个菌落。
1.7. 高效尿酸降解菌的驯化及降解效果测定
将分离纯化出的细菌制备成1×107 CFU/mL浓度菌液50 μL,采用浓度梯度法把菌液分别接种于1.7、1.9、2.1、2.3 mmol/L BHI培养液中,每组3个平行样,厌氧条件下37 ℃、220 r/min摇床培养48 h。同时设置相同尿酸浓度不加菌液的BHI培养液进行对照(每个浓度梯度设置3个平行样)。48 h后取培养液12 000 r/min离心10 min,取上清稀释20倍,测定培养液中尿酸浓度。
1.8. 尿酸降解功能菌的鉴定
1.8.1. 形态学观察
① 菌落形态观察:挑取纯培养物进行稀释,采用分区划线法将其接种在1.5 mmol/L BHI平板中,在37 ℃厌氧条件下培养36~48 h后观察。② 细菌形态学观察:用灭菌牙签挑取纯化的单个菌落涂于载玻片上并滴加生理盐水制片,自然干燥1~2 min,用酒精灯进行固定,将固定好的涂片进行革兰染色。方法参照贝索革兰染液说明书进行,将染色完成的玻片置油镜下观察细菌的排列和形态。
1.8.2. 生化反应鉴定
将已分离纯化的菌株采用VITEK-2 Compact 全自动细菌鉴定仪进行菌株生化鉴定。
1.8.3. 16S rRNA测序
使用Rapid Bacterial Genomic DNA Isolation Kit,按照说明书提取细菌DNA的方法进行操作,使用16S通用引物27F(AGAGTTTGATCCTGGCTCAG)和1492R(GGTTACCTTGTTACGACTT)进行PCR扩增。PCR扩增体系为:PCR mix 25 μL,上、下游引物各1 μL,ddH2O 21 μL,DNA模板2 μL,总体积为50 μL。扩增条件:94 ℃预变性 5 min,94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸1 min,35个循环,72 ℃再延伸10 min,16 ℃保存。将PCR产物用1%琼脂糖凝胶电泳进行检测,扩增出目的基因条带的菌株委托给上海生工生物工程股份有限公司进行16S rRNA测序。
1.8.4. 序列比对及同源性分析
测序结果在NCBI上进行BLAST比对,对相似度大于97%的菌株序列进行同源性分析,并采用MEGA-X软件构建系统进化树。
1.9. 统计方法
采用SPSS23.0统计软件将所得数据进行统计学分析,计量资料以均数 ± 标准差( )表示,组间比较用配对样本t检验,检验水准α = 0.05。
)表示,组间比较用配对样本t检验,检验水准α = 0.05。
2. 结果
2.1. 标准曲线的绘制
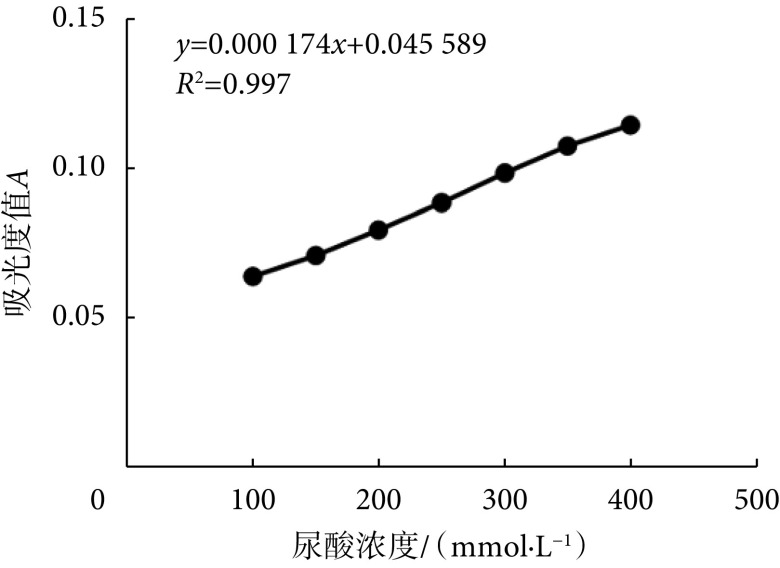
根据尿酸测定试剂盒所提供的标准品制定标准曲线,由标准曲线可得吸光度A与尿酸浓度相关方程为y = 0.000 174 x + 0.045 589,相关系数R2 = 0.997,符合尿酸浓度测定标准(R2 ≥ 0.995),见图1。
图 1.
Standard curve of different concentrations of uric acid standard
不同浓度尿酸标准品标准曲线
2.2. 尿酸功能菌的驯化、筛选及尿酸降解率测定
通过强化筛选获得1株肠道细菌,命名为S3A。驯化后发现S3A菌在不同尿酸浓度驯化培养基中均可生长,在1.7、1.9、2.1、2.3 mmol/L BHI尿酸筛选培养基中的降解率分别为32.2%、37.3%、41.7%、50.2%,且随着培养基中尿酸浓度的增加,降解率也逐步增加。具体结果见表1。
表 1. Uric acid degradation rate of strain S3A in domesticated BHI medium.
菌株S3A在驯化BHI培养基中的尿酸降解率
| 培养基初始 尿酸浓度/ (mmol·L−1) |
降解后培养基 尿酸浓度/ (mmol·L−1) |
尿酸降解率(%) | t 值 | P 值 |
| 注:*为<0.05,**为<0.01 | ||||
| 1.74 ± 0.06 | 1.18 ± 0.04 | 32.2 | 9.626 | 0.011* |
| 1.89 ± 0.04 | 1.19 ± 0.03 | 37.3 | 20.306 | 0.002** |
| 2.05 ± 0.09 | 1.20 ± 0.06 | 41.7 | 26.442 | 0.001** |
| 2.26 ± 0.08 | 1.13 ± 0.04 | 50.2 | 20.092 | 0.002** |
2.3. 尿酸降解功能菌S3A的鉴定
2.3.1. 培养特性及形态学观察
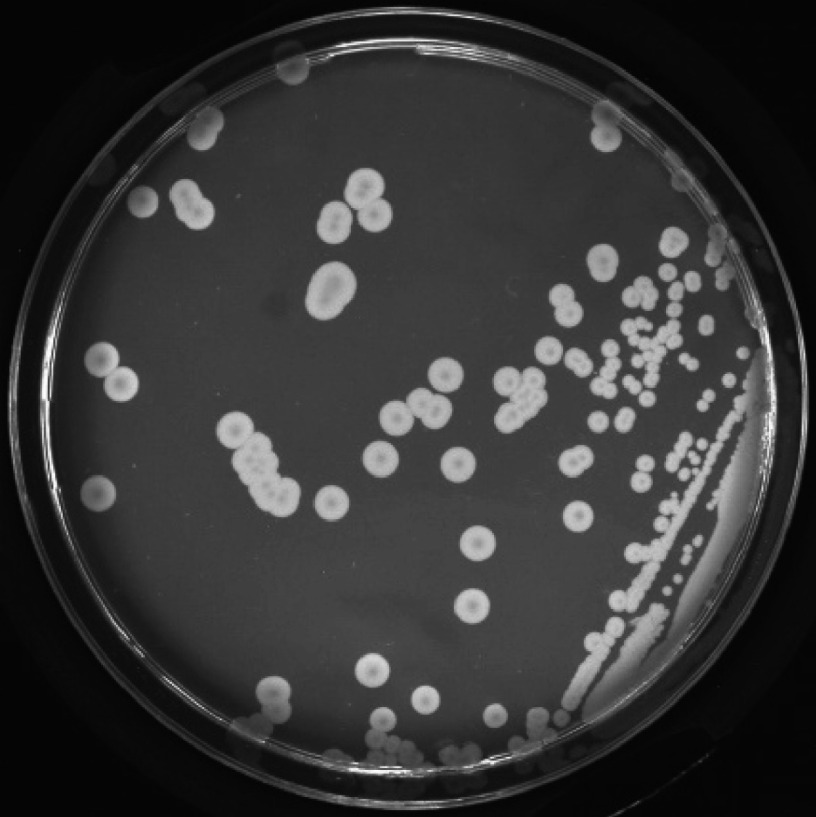
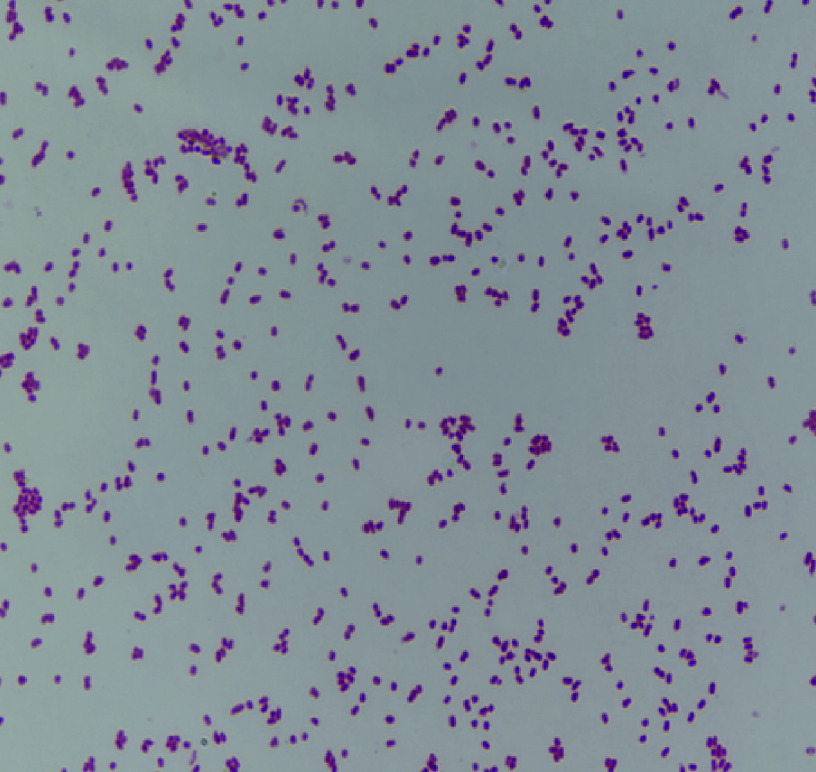
在BHI平板培养基上可见S3A菌落为灰白色,圆形凸起,边缘整齐,表面湿润光滑,见图2。革兰染色后显微镜下可见革兰阴性短杆菌,散在排列,见图3。
图 2.
Colonial morphology of strain S3A
S3A菌落形态
图 3.
Morphology of strain S3A under the microscope after Gram staining (10 × 100)
S3A革兰染色显微镜下形态(10 × 100)
2.3.2. 生化鉴定
菌株S3A生化鉴定结果见表2。通过以上结果,VITEK-2 Compact全自动细菌鉴定仪鉴定出该菌为大肠杆菌。
表 2. Biochemical identification results of strain S3A.
菌株S3A生化鉴定结果
| 生化反应 | 缩写 | 结果 | 生化反应 | 缩写 | 结果 | |
| 丙氨酸-苯丙氨酸-脯氨酸芳胺酶 | APPA | − | 尿素酶 | URE | − | |
| 侧金盏花醇 | ADO | − | D-山梨醇 | dSOR | + | |
| 吡咯烷基芳胺酶 | PyrA | − | 蔗糖 | SAC | − | |
| L-阿拉伯醇 | IARL | − | D-塔格糖 | dTAG | − | |
| D-纤维二糖 | dCEL | − | D-海藻糖 | dTRE | + | |
| β-半乳糖苷酶 | BGAL | + | 柠檬酸钠盐 | CIT | − | |
| H2S产生 | H25 | − | 丙二酸盐 | MNT | − | |
| β-N-乙酰葡萄糖苷酶 | BNAG | − | 5-酮葡萄糖苷 | 5KG | + | |
| 谷氨酰芳胺酶pNA | AGLTP | − | L-乳酸产碱 | ILATK | + | |
| D-葡萄糖 | DGLU | + | α-半乳糖苷酶 | AGAL | + | |
| Y-谷氨酰转移酶 | GGT | − | 磷酸酶 | PHOS | − | |
| 发酵/葡萄糖 | OFF | + | 氨基乙酸芳胺酶 | GlyA | − | |
| β-葡糖糖苷酶 | BGLU | − | 鸟氨酸脱羧酶 | ODC | − | |
| D-麦芽糖 | dMAL | + | 赖氨酸脱羧酶 | LDC | + | |
| D-甘露醇 | dMAN | + | 组氨酸同化 | IHISA | − | |
| D-甘露糖 | dMNE | + | COURMARATE | CMT | + | |
| β-木糖苷酶 | BXYL | − | β-葡萄糖苷酸酶 | BGUR | + | |
| β-丙氨酸芳胺酶pNA | BAlap | − | O/129耐受 | O129R | + | |
| L-脯氨酸芳胺酶 | ProA | − | 谷氨酸-甘氨酸-精氨酸芳胺酶 | GGAA | − | |
| 脂酶 | LIP | − | L-苹果酸盐同化 | IMLTa | − | |
| 古老糖 | PLE | − | ELLMAN | ELLM | + | |
| 酪氨酸芳胺酶 | TyrA | + | L-乳酸盐同化 | ILATa | − |
2.3.3. S3A菌株DNA的提取及PCR扩增
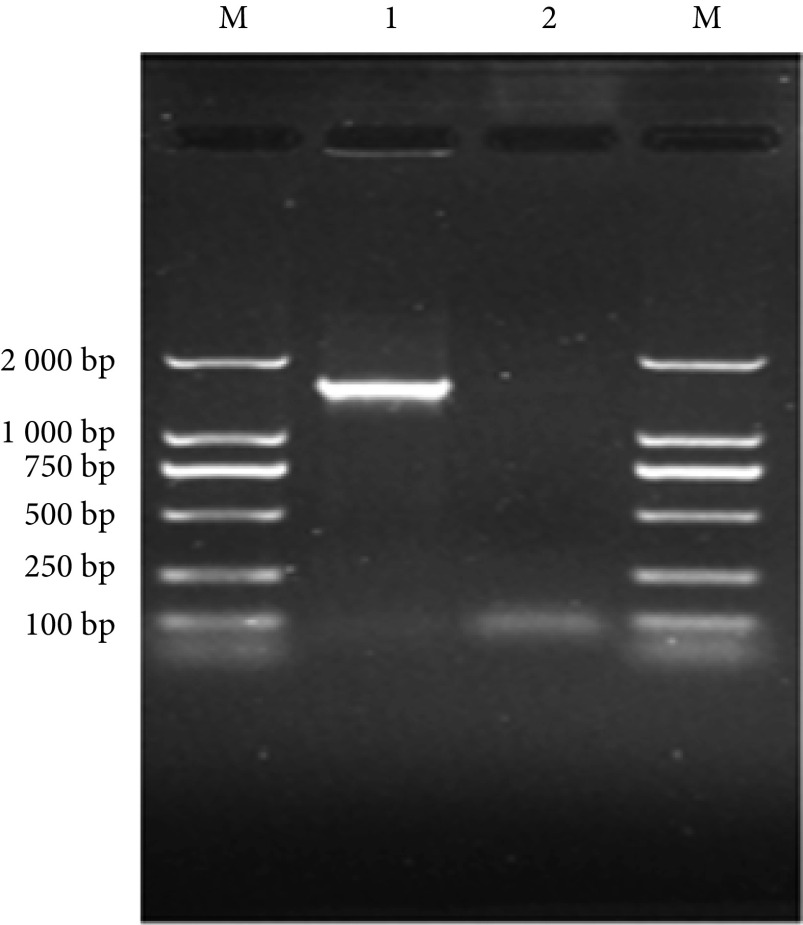
提取S3A菌株DNA后进行PCR扩增,扩增产物凝胶电泳显示在1 500 bp左右存在目的条带,符合16S rRNA测序要求(见图4)。
图 4.
16S rRNA PCR amplification results
16S rRNA PCR扩增结果
M. DNA marker;1. PCR产物;2. 阴性对照
M. DNA marker; 1. PCR products; 2. negative control
2.3.4. S3A菌株16S rRNA序列测定、BLAST比对及进化树建立
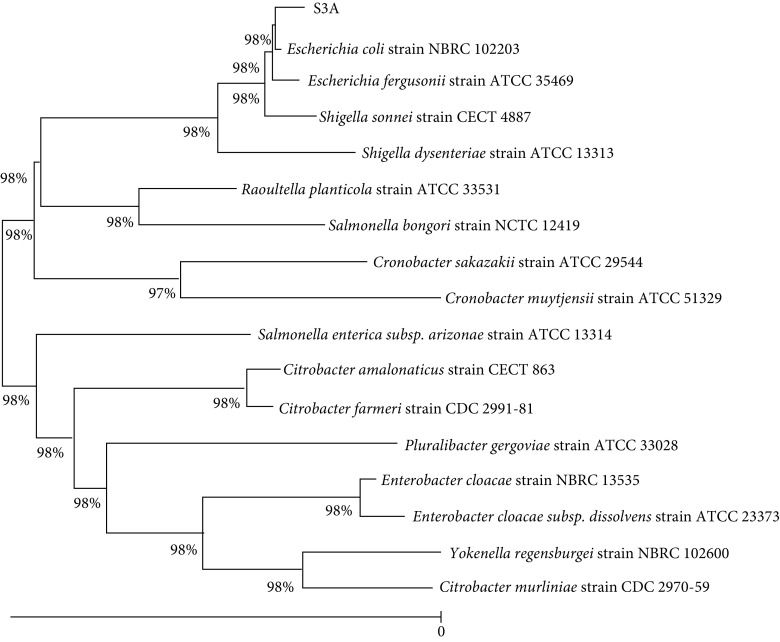
16S rRNA序列测定数据经BLAST比对并建立了S3A的系统进化树(见图5),菌株S3A与大肠杆菌NBRC 102203同源性为98%,鉴定为大肠杆菌。
图 5.
System evolution tree of S3A
S3A株系统进化树
3. 讨论与结论
人体中尿酸的形成主要通过饮食等外源性途径和体内嘌呤代谢等内源性途径产生[13],体内尿酸则主要通过肾脏及肠道排泄。由于肠道菌群组成复杂、各菌体间差异较大等客观因素,关于肠道微生物如何影响尿酸代谢的机制尚未完全被阐明[14-15]。近年来,相关肠道菌群的研究多基于16S rRNA宏基因测序测定和进行不同人群的菌群结构比较,多数研究很难获得菌株为该领域研究的瓶颈。本研究基于目标表型培养原理[16],在BHI培养液中加入尿酸制备成浓度梯度选择驯化培养基,既可以将尿酸作为抑制剂来抑制尿酸不耐受细菌的生长,又可以通过尿酸浓度的不断升高而筛选出具有高效尿酸降解功能的细菌。本研究针对性地从低尿酸男性青年人群粪便中筛选和驯化得到一株具有高效尿酸降解功能的细菌S3A,其降解效率达到50.2%。随后采用传统形态学和16S rRNA序列测定,建立了该菌株的系统进化树,发现其与大肠杆菌NBRC 102203菌株同源性为98%,最终鉴定为大肠杆菌。
随着对肠道菌群研究的不断深入,越来越多的微生物被发现与尿酸降解存在关联,但研究发现不同种属的细菌参与尿酸代谢的机制存在较大差异[9, 17]。Schultz等[18]研究发现枯草芽孢杆菌约有超过14个基因编码参与嘌呤的代谢,其中puc基因决定的pucR蛋白可直接或间接调控pucL和pucLM基因的表达进而影响尿酸酶的活性,该蛋白调控的pucJ和pucK基因则可影响菌体对尿酸的转运。假单胞菌可将尿酸降解为5-羟基异尿酸及尿囊素等次级代谢产物排出体外[19]。Guzmán等[20]发现hpxO、hpxT、hpxQ和hpxB等基因可调控肺炎克雷伯菌将尿酸作为氮源转运至胞内并进一步将其分解。Iwadate等[21]发现大肠杆菌在AegA、YgfT(UacF)及FDH-H等蛋白的作用下利用甲酸盐提供的电子发挥降尿酸作用。还有学者发现大肠杆菌ygfU基因编码YgfU渗透酶,该酶是一种高容量的尿酸转运蛋白,可将细胞外尿酸和黄嘌呤转运至体内,进而将其作为氮源为细胞供能[22-23]。
本研究中菌株S3A能够适应高浓度尿酸,且具备体外尿酸降解功能,推测可能由于环境中特有物质的刺激或外源性DNA的侵入导致了菌株发生变异,进而激发了其降尿酸功能的产生。而S3A是否存在编码与YgfU渗透酶相关的基因,是否通过甲酸盐依赖的尿酸降解途径为细菌提供氮源,课题组后续将会通过基因工程技术和模式动物验证等实验手段进行更深层次的研究。
目前高尿酸血症药物治疗存在不容忽视的副作用[24],因此结合现代微生物学技术,寻找无毒无害的微生物制剂用于临床高尿酸血症治疗是当前研究的前沿领域和热点领域,也是今后很长一段时间研究者需要攻克的难题。本研究从低尿酸人群获得的一株人源性高效尿酸降解菌S3A,为今后将该菌株作为无毒无害生物制剂进行降尿酸治疗的开发应用提供了一定科学依据。该菌株的安全性评价、降解机制的人群和动物实验验证等深层次的研究将是本课题组今后的研究方向和目标。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突。
作者贡献声明:田婷婷完成文章的撰写以及实验的研究操作和数据整理;孙玉萍是本研究的构思者和负责人,指导论文的写作与修改;陈邬锦是本研究的实验指导老师,指导实验设计、研究操作及数据分析;梁美婷参与本研究的实验设计以及实验操作;玛依娜·卡哈尔和李瑞参与本研究的数据分析。
伦理声明:本研究通过了新疆医科大学伦理委员会的审批(伦理审批号:K202105-09)。
Funding Statement
新疆维吾尔自治区自然科学基金(2019D01C219)
References
- 1.李丰琴, 叶志斌 高尿酸血症与糖尿病及其并发症研究进展. 中国实用内科杂志. 2017;37(6):569–572. doi: 10.19538/j.nk2017060122. [DOI] [Google Scholar]
- 2.Sandra S, Lesmana C R A, Purnamasari D, et al Hyperuricemia as an independent risk factor for non-alcoholic fatty liver disease (NAFLD) progression evaluated using controlled attenuation parameter-transient elastography: lesson learnt from tertiary referral center. Diabetes Metab Syndr. 2019;13(1):424–428. doi: 10.1016/j.dsx.2018.10.001. [DOI] [PubMed] [Google Scholar]
- 3.Su Pu, Hong Liu, Zhao Yifan, et al Relationship between hyperuricemia and cardiovascular disease risk factors in a Chinese population: a cross-sectional study. Med Sci Monit. 2015;12(21):2707–2717. doi: 10.12659/MSM.895448. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.何向阳, 刘峥, 徐英, 等 肥胖与四种常见慢性病的相关性分析. 预防医学. 2020;32(7):692–697. doi: 10.19485/j.cnki.issn2096-5087.2020.07.011. [DOI] [Google Scholar]
- 5.王天宇, 窦倩, 郭子坤, 等 1947例体检人群高血压与高血糖和高尿酸血症及血脂异常关系分析. 社区医学杂志. 2020;18(22):1509–1511. doi: 10.19790/j.cnki.JCM.2020.22.04. [DOI] [Google Scholar]
- 6.Lloyd-price J, Abu-ali G, Huttenhower C The healthy human microbiome. Genome Med. 2016;8(1):51. doi: 10.1186/s13073-016-0307-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Guo Zhuang, Zhang Jiachao, Wang Zhanli, et al Intestinal microbiota distinguish gout patients from healthy humans. Sci Rep. 2016;6:20602. doi: 10.1038/srep20602. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.纪泽敏. 基于临床病例筛选高尿酸血症相关的肠道菌群. 北京: 中央民族大学, 2020.
- 9.Ning Yaogui, Yang Guomei, Chen Yangchun, et al Characteristics of the urinary microbiome from patients with gout: a prospective study. Front Endocrinol (Lausanne) 2020;11:272. doi: 10.3389/fendo.2020.00272. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Yu Yiran, Liu Qiuping, Li Haichang, et al Alterations of the gut microbiome associated with the treatment of hyperuricemia in male rats. Fro Mic. 2018;9:2233. doi: 10.3389/fmicb.2018.02233. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.任科雨, 勇春明, 金延春, 等 青岛地区高尿酸血症患者的肠道菌群分析. 中国医师杂志. 2014;16(12):1649–1651. doi: 10.3760/cma.j.issn.1008-1372.2014.12.018. [DOI] [Google Scholar]
- 12.孙玉萍, 陈邬锦, 梁美婷,等. 用于筛选肠道降解尿酸菌株的高尿酸培养基及其制备方法: CN112831448A. 2021-05-25.
- 13.Ma Quantao, Li Yaqi, Li Pengfei, et al Research progress in the relationship between type 2 diabetes mellitus and intestinal flora. Biomed Pharmacother. 2019;117:109138. doi: 10.1016/j.biopha.2019.109138. [DOI] [PubMed] [Google Scholar]
- 14.董文学, 蒋雅琼, 马利锋, 等 肠道菌群对尿酸代谢的影响. 胃肠病学和肝病学杂志. 2021;30(1):55–59. doi: 10.3969/j.issn.1006-5709.2021.01.013. [DOI] [Google Scholar]
- 15.Liu Hong, Zhang Xiaomin, Wang Yanli, et al Prevalence of hyperuricemia among Chinese adults: a national cross-sectional survey using multistage, stratified sampling. J Nephrol. 2014;27:653–658. doi: 10.1007/s40620-014-0082-z. [DOI] [PubMed] [Google Scholar]
- 16.Browne H P, Forster S C, Anonye B O, et al Culturing of 'unculturable' human microbiota reveals novel taxa and extensive sporulation. Nature. 2016;533(7604):543–546. doi: 10.1038/nature17645. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Yu Yiran, Liu Qiuping, Li Haichang, et al Alterations of the gut microbiome associated with the treatment of hyperuricaemia in male rats. Front Endocrinol. 2018;9:1–10. doi: 10.3389/fendo.2018.00001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Schultz A C, Nygaard P, Saxild H H Functional analysis of 14 genes that constitute the purine catabolic pathway in Bacillus subtilis and evidence for a novel regulon controlled by the PucR transcription activator. J Bacteriol. 2001;183(11):3293–3302. doi: 10.1128/JB.183.11.3293-3302.2001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Lee Y, Lee D H, Kho C W, et al Transthyretin-related proteins function to facilitate the hydrolysis of 5-hydroxyisourate, the end product of the uricase reaction. FEBS Lett. 2005;579:4769–4774. doi: 10.1016/j.febslet.2005.07.056. [DOI] [PubMed] [Google Scholar]
- 20.Guzmán K, Badia J, Giménez R, et al Transcriptional regulation of the gene cluster encoding allantoinase and guanine deaminase in Klebsiella pneumoniae. J Bacteriol. 2011;193(9):2197–2207. doi: 10.1128/JB.01450-10. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Iwadate Y, Kato J I Identification of a formate-dependent uric acid degradation pathway in Escherichia coli. J Bacteriol. 2019;201(11):e00573–18. doi: 10.1128/JB.00573-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.常宇骁. 人类肠道微生物培养组优化及肠道菌库构建与应用. 北京: 军事科学院, 2020.
- 23.Papakostas K, Frillingos S Substrate selectivity of YgfU, a uric acid transporter from Escherichia coli. J Biol Chem. 2012;287(19):15684–15695. doi: 10.1074/jbc.M112.355818. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.王智 抗高尿酸血症药物的研究进展. 中国城乡企业卫生. 2019;34(5):34–36. doi: 10.16286/j.1003-5052.2019.05.012. [DOI] [Google Scholar]