Resumen
La Diabetes Mellitus (DM) es una enfermedad crónica cardiometabólica no transmisible, que origina complicaciones macrovasculares como aterosclerosis, enfermedad coronaria e insuficiencia cardíaca (IC). Existe una relación bidireccional entre IC y DM, siendo IC el segundo evento cardiovascular inicial más frecuente en pacientes con diabetes. Incluso puede ser la primera complicación cardiovascular, antes que el infarto de miocardio.
La DM puede conducir a IC a través de mecanismos mediados por aterosclerosis e independientemente de esta. En el primer caso, se produce depósito de colesterol en las arterias coronarias, favorecido por la presencia de otros factores de riesgo. En el segundo caso, a través de mecanismos no aterogénicos (denominada Cardiomiopatía Diabética), conduciendo a cambios estructurales y funcionales.
El tratamiento de la IC con fracción de eyección reducida en el paciente diabético no difiere del de la población no diabética. Se debe conseguir el triple bloqueo neurohumoral. En el caso de los pacientes con IC con fracción de eyección preservada hasta la fecha no tenemos terapia específica que disminuya la morbimortalidad cardiovascular.
En el tratamiento de la diabetes del paciente con IC sobresalen claramente los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) que además de su efecto glucosúrico y natriurético, presentan efectos pleiotrópicos que ejercen una acción metabólica, hemodinámica y en la viabilidad celular al prevenir apoptosis y muerte celular. Finalmente, los beneficios clínicos de los inhibidores SGLT2 en IC van mas allá del control glicémico, como lo demostró el estudio DAPA-HF; iniciando una nueva era en el tratamiento del paciente con IC con fracción de eyección reducida.
Palabras Clave: diabetes, insuficiencia cardíaca
Abstract
Diabetes Mellitus (DM) is a chronic non-communicable cardio-metabolic disease that causes macro-vascular complications such as atherosclerosis, coronary disease and heart failure (HF). There is a bidirectional relationship between HF and DM, HF being the second most frequent initial cardiovascular event in patients with diabetes. It may even be the first cardiovascular complication, before acute myocardial infarction.
DM can lead to HF through mechanisms mediated by atherosclerosis and non mediated by it. In the first case, cholesterol is deposited in coronary arteries, favored by the presence of other risk factors. In the second case, the myocardium is directly affected leading to structural and functional changes through non-atherogenic mechanisms (called Diabetic Cardiomyopathy).
The treatment of HF with reduced ejection fraction in the diabetic patient does not differ from that of the non-diabetic population, the triple neurohumoral block must be achieved. In the case of patients with HF with ejection fraction preserved to date, we do not have specific therapy to reduce cardiovascular morbidity and mortality.
In the diabetes treatment of the patient with HF, sodium-glucose type 2 cotransporter inhibitors (SGLT2i) clearly stand out. In addition to their glucosuric and natriuretic effect, they have pleiotropic effects that produce metabolic, hemodynamic and cellular viability effects preventing apoptosis and cell death. Finally, the clinical benefits of SGLT2 inhibitors in HF go beyond glycemic control, as demonstrated by the DAPA-HF study; initiating a new era in the treatment of patients with HF with reduced ejection fraction.
Keywords: diabetes, heart failure
La diabetes mellitus (DM) es una de las enfermedades crónicas no transmisibles que más ha crecido en los últimos años, tanto por su prevalencia y creciente incidencia; así como por su gran relevancia al tratarse de un factor de riesgo independiente para desarrollar enfermedad cardiovascular aterosclerótica e insuficiencia cardiaca (IC).
La causa primaria de mortalidad en pacientes con diabetes es la enfermedad cardiovascular, que corresponde al 50-80% de las muertes. (1 La American Diabetes association (ADA) estima que el 50% de los pacientes con DM tendrán IC a lo largo de su vida. 2
En el siguiente artículo trataremos de revisar la magnitud del problema, dar una explicación a los mecanismos implicados en la cardiomiopatía diabética y sobretodo, hacer un resumen de los nuevos tratamientos farmacológicos para la diabetes con énfasis en los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) y su impacto en la prevención primaria de insuficiencia cardiaca (nuevos casos) y el tratamiento de los pacientes con enfermedad establecida.
Magnitud del Problema
La DM es una enfermedad cardio metabólica que origina complicaciones microvasculares y macrovasculares, las cuales afectan a múltiples órganos, y cuya prevalencia viene en aumento. 3 Aproximadamente el 10% de la población mundial padece de DM tipo 2 y el 2-3% de insuficiencia cardiaca. Se ha establecido que existe una relación bidireccional entre ambas patologías; múltiples causas comunes llevan a vías comunes fisiopatológicas que resultan en un efecto deletéreo de la DM sobre la IC. La consecuencia clínica es que el paciente con ambas enfermedades presenta peor clínica y peor pronóstico que el paciente con IC sin DM, independientemente de la fracción de eyección. 4
La prevalencia de DM a través de pacientes con IC crónica es 25% y en IC aguda es 40-45%, mientras la prevalencia de IC es 10-23% en los pacientes diabéticos. Los hombres diabéticos tienen 2.4 veces mayor probabilidad de desarrollar insuficiencia cardiaca y las mujeres el riesgo se multiplica por 5, desarrollando éstas últimas, insuficiencia cardiaca con fracción de eyección preservada (ICFEp) predominantemente. 5 La IC también incrementa el riesgo de incidencia de DM tipo 2. En Estudios como CHARM6 y EMPHASIS-HF7 se reportó incremento de incidencia de DM (28 y 21 por 1000 personas-año, respectivamente).
En pacientes con IC sin DM, 20-43% tienen intolerancia a la glucosa y se traduce en mayor mortalidad8 además, en los pacientes con DM, por cada aumento del 1% en la hemoglobina glicosilada, el riesgo de IC se incrementa en 8 %. 9 Sin embargo, el desarrollo de IC en diabéticos está más estrechamente relacionado con la duración de la DM. Aunque varios estudios han demostrado el beneficio del óptimo control glicémico sobre las complicaciones microvasculares, aún queda poco claro los efectos del control estricto glicémico sobre las complicaciones macrovasculares; los últimos ensayos clínicos expresan que la prevención y tratamiento de las complicaciones cardiovasculares, como la insuficiencia va más allá del control glicémico.
La IC es el segundo evento cardiovascular (CV) inicial más frecuente en pacientes con DM, incluso tiene mayor probabilidad de ser la primera complicación CV, antes que el infarto agudo al miocardio o el accidente cerebrovascular. 10
Lo cierto es que ambas patologías son un problema de salud pública en crecimiento. El impacto en cuanto a mortalidad y hospitalizaciones por insuficiencia cardiaca es preocupante, más aún de lo segundo; lo que repercute en el mal pronóstico de los pacientes, alta tasa de readmisión y altos costos directos e indirectos al sistema de salud. El paciente con IC y DM tiene 33% mayor riesgo de hospitalización que un paciente no diabético. 11
Cardiomiopatía Diabética
La DM puede conducir a IC a través de mecanismos mediados por aterosclerosis e independientemente de aterosclerosis. Por un lado, la DM per se y la combinación con otros factores de riesgo cardiovascular como la hipertensión arterial y dislipidemia; favorecen la disfunción endotelial, la inflamación, stress oxidativo y el daño vascular, lo que se traduce en enfermedad coronaria, isquemia miocárdica y miocardiopatía isquémica. Asimismo, existen mecanismo no aterogénicos, por los cuales la DM afecta directamente el miocardio conduciendo a cambios estructurales y funcionales a nivel del corazón. Entre los mecanismos implicados podemos mencionar: la glucotoxicidad directa producida por la hiperglicemia/resistencia insulina, activación del sistema-renina-angiotensina-aldosterona, stress oxidativo, alteración SERCA-2, disfunción autonómica, microangiopatía, disfunción mitocondrial, lipotoxicidad y esteatosis miocárdica, necrosis miocárdica subclínica, apoptosis, anormalidades en la bomba Na/H y alteración en la reserva energética del cardiomiocito. (12-19
Todos estos mecanismos contribuyen en alguna medida en el incremento de la fibrosis intersticial, remodelado e hipertrofia ventricular. (Figura 1)
Figura 1. Cardiomiopatía Diabética. Adaptado de: Wilkinson MJ. Am J Cardiol 2019;124: S3-S11.
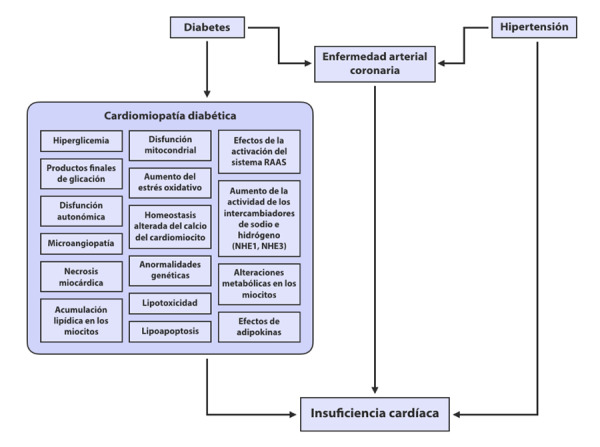
Las alteraciones funcionales, ocurren principalmente a nivel mitocondrial de los miocitos y traen como consecuencia una alteración de la contractilidad miocárdica. El efecto de la hiperglicemia crónica y la resistencia a la insulina afecta el manejo del calcio intracelular. La recaptación de calcio y su sobrecarga a nivel intracelular altera la diástole y en muchos casos, progresa a disfunción sistólica.
El diagnóstico de cardiomiopatía diabética requiere una historia de varios años de diabetes, pobre control glicémico y descartar otras etiologías de la IC. Se caracteriza por disfunción diastólica temprana en ausencia de enfermedad coronaria o enfermedad cardiaca hipertensiva. Sin embargo, deberíamos resaltar que este tipo de cardiomiopatía puede estar presente simultáneamente con otras condiciones cardiovasculares; pero será la diabetes per se, la que explique el daño miocárdico inicial.
Se identifican dos fenotipos: la cardiomiopatía dilatada y el fenotipo restrictivo, en el cual predomina el remodelado concéntrico y la disfunción diastólica, en su evolución natural desarrollan IC con fracción de eyección reducida (ICFEr) o insuficiencia cardiaca con fracción de eyección preservada (ICFEp) respectivamente. (20-23
Los estudios de imágenes y los biomarcadores séricos son de suma utilidad en el diagnóstico de la enfermedad clínica y subclínica. La disfunción diastólica es un hallazgo frecuente en los pacientes con DM y tiene una incidencia entre el 23 y 75%. En el subestudio ADVANCE la existencia de disfunción diastólica, definida como alteración de la relación E/e´ más dilatación auricular, se asoció con eventos cardiovasculares en el 33% de los pacientes. (24
El ecocardiograma es el método más accesible para valorar la contractilidad miocárdica, fracción de eyección, hipertrofia y cuantificación de la masa ventricular, así como la función diastólica. En ese sentido, la valoración de la función cardiaca por ecocardiografía debería ser parte de la evaluación integral de los pacientes diabéticos.
El daño subclínico puede ser detectado por la Resonancia Cardiaca que es el Gold standard para la valoración de fibrosis, disfunción microvascular; y por los nuevos métodos ecocardiográficos de strain y speckle tracking. En ese sentido, la medición del strain longitudinal global (GLS) es el parámetro de deformación más utilizado en la práctica clínica.24-27
En relación con los biomarcadores, el proBNP es el de mayor utilidad clínica; le sigue galactina-3. La detección de la disfunción ventricular subclínica por niveles elevados de péptidos natriuréticos en el estudio PONTIAC en pacientes diabéticos de alto riesgo, demostró disminuir muerte y hospitalizaciones por causa cardiovascular, luego de un inicio precoz de terapias destinadas al tratamiento farmacológico de la IC.28-29
La Guía ACC/AHA 2017 recomienda con un nivel de evidencia IIA el screening con péptidos natriuréticos en aquellos pacientes en riesgo de desarrollar insuficiencia cardiaca para prevenir el desarrollo de disfunción ventricular izquierda (sistólica o diastólica) o IC de novo.30
Manejo de la Insuficiencia Cardíaca en el Diabético
Insuficiencia Cardiaca con fracción de eyección reducida
Los pacientes con IC y DM presentan tasas de mortalidad más altas. En el estudio SOLVD, los pacientes diabéticos tenían una probabilidad mayor de ser admitidos por IC (cociente riesgo 1.6) y tenían tasas más altas al año de mortalidad por todas las causas (32% vs 22%), mortalidad cardiovascular (28% vs 19%) y mortalidad relacionado con falla de bomba (11% vs 6%).31 Sin embargo, la misma población diabética es heterogénea y el enfoque de riesgo dependerá de factores tales como edad, tiempo de DM, comorbilidades, asociación con enfermedad coronaria, etc.
En líneas generales, las recomendaciones no difieren de los pacientes no diabéticos. El triple bloqueo neuro humoral es la piedra angular del tratamiento. Las Guías de práctica clínica recomiendan fuertemente un inhibidor de la enzima convertidora de angiotensina (ECA) o antagonista del receptor de la angiotensina (ARAII) en caso de intolerancia a los primeros, asociados a beta bloqueadores como primera línea, a ellos debería sumarse en caso de persistir sintomáticos un antagonista del receptor mineralocorticoide y sacubitril/valsartán en reemplazo del IECA/ARAII.32-35 Algunos puntos para destacar:
- La eficacia de los IECA/ARAII es igual en población diabética. Sin embargo, debe tenerse en cuenta en su titulación la función renal y el riesgo de hiperkalemia, por ser una población más vulnerable.
- No existen diferencias entre los beta bloqueadores aprobados en IC, los cuatro son igual de eficaces y se debe intentar dar la máxima dosis que tolere el paciente.
- La eplerenona en los estudios EMPHASIS-HF y EPHESUS36 ha demostrado disminuir los casos de diabetes de Novo.
- Sacubitril/Valsartan en el estudio PARADIGM-HF37 demostró una disminución de los valores de hemoglobina glicosilada comparado con enalapril, lo que sugeriría una acción metabólica y de atenuación de la resistencia a la insulina. Además, demostró una disminución en el deterioro de la función renal.
- En relación con los dispositivos implantables las recomendaciones no cambian. El beneficio de la terapia de resincronización abarca a los pacientes diabéticos. No obstante, la tasa de infecciones en el sitio de implante es mayor y requiere supervisión permanente.
Insuficiencia Cardiaca con fracción de eyección preservada
No existe a la fecha tratamiento específico para esta condición que disminuya la morbilidad y mortalidad. El tratamiento que se brinda está dirigido a aliviar la congestión con diuréticos y tratar las comorbilidades. Quizá los ARAII, como candesartan, podría tener un efecto diferencial en disminuir las hospitalizaciones, como lo demostró el estudio CHARM.38 Sacubitril/valsartan en el estudio PARAGON-HF39 no demostró mayor beneficio en la población global, ni en el subgrupo de pacientes diabéticos. Los inhibidores iSGLT2 abren una luz de esperanza en esta población y habrá que estar atentos a los resultados de algunos ensayos clínicos en curso.
Manejo de la Diabetes en la Insuficiencia Cardíaca
El tratamiento se inicia con las medidas de cambio de estilo de vida, una dieta saludable baja en calorías y actividad física regular según la capacidad de cada paciente. El objetivo general es alcanzar niveles de glucosa en sangre tan bajos como sea posible sin aumentar el riesgo de hipoglicemia, para ello existen una serie de fármacos que pasaremos a revisar posteriormente. Lo cierto es que un control intensivo puede también aumentar el riesgo cardiovascular y nuestra meta de hemoglobina glicosilada (HbA1C) va a depender de la antigüedad de la DM, las comorbilidades, la severidad de la IC, la expectativa de vida. Si bien idealmente, se recomienda una HbA1c menor de 7, en IC y DM valores entre 7-8% sería lo más aceptable.40
Haremos un resumen de los fármacos hipoglicemiantes y su beneficio en pacientes con DM e IC41-45
- Metformina: Estudios observacionales han demostrado reducir morbilidad y mortalidad. Es bien tolerado, seguro, bajo riesgo de hipoglicemia y es barato. Es recomendado como tratamiento de primera línea en muchas guías de práctica clínica.
- Sulfonilúreas: Mejoran el control glicémico y no generan retención de sodio. No existen estudios clínicos que hayan evaluado su seguridad cardiovascular, específicamente en IC.
- Tiazolidinadionas: Incrementan el riesgo de hospitalización por IC y muerte. NO están recomendados en IC.
- Insulina: Tiene efecto anti-natriurético dosis dependiente, y se observa ligera retención de fluidos con su uso. Es incierto si aumenta el riesgo de IC o la mortalidad.
- Inhibidores DPP4: Más allá del control glicémico, ninguno ha demostrado un beneficio cardiovascular. No se recomienda saxagliptina y alogliptina porque incrementa la tasa de hospitalización por IC.
- Agonistas GLP-1: Liraglutide en el estudio LEADER46 y semaglutide en el estudio SUSTAIN-647 demostraron una reducción en el punto primario combinado muerte CV, IM no fatal y ACV no fatal; es decir, prevención de eventos aterotrombóticos. Sin embargo, no demostraron beneficio estadísticamente significativo en reducción de hospitalizaciones por IC.
- Inhibidores SGLT2: actúan inhibiendo el cotransportador sodio-glucosa tipo 2, responsable de la mayor parte de la reabsorción de la glucosa a nivel del túbulo contorneado proximal, produciendo glucosuria y disminución de la glicemia. (Figura 2) Tanto empaglifozina (Estudio EMPA-REG48), canaglifozina (Estudio CANVAS49) y dapaglifozina (Estudio DECLARE-TIMI 5850), han demostrado reducir las hospitalizaciones por insuficiencia cardiaca en pacientes con y sin antecedente previo de IC. Un metaanálisis corrobora estos resultados.51 En la Tabla 1 se resumen las principales características de cada uno de estos estudios.
Figura 2. Inhibición SGLT2. Adaptado de: Perel C. Insuf Card 2018;13(4):155-169.
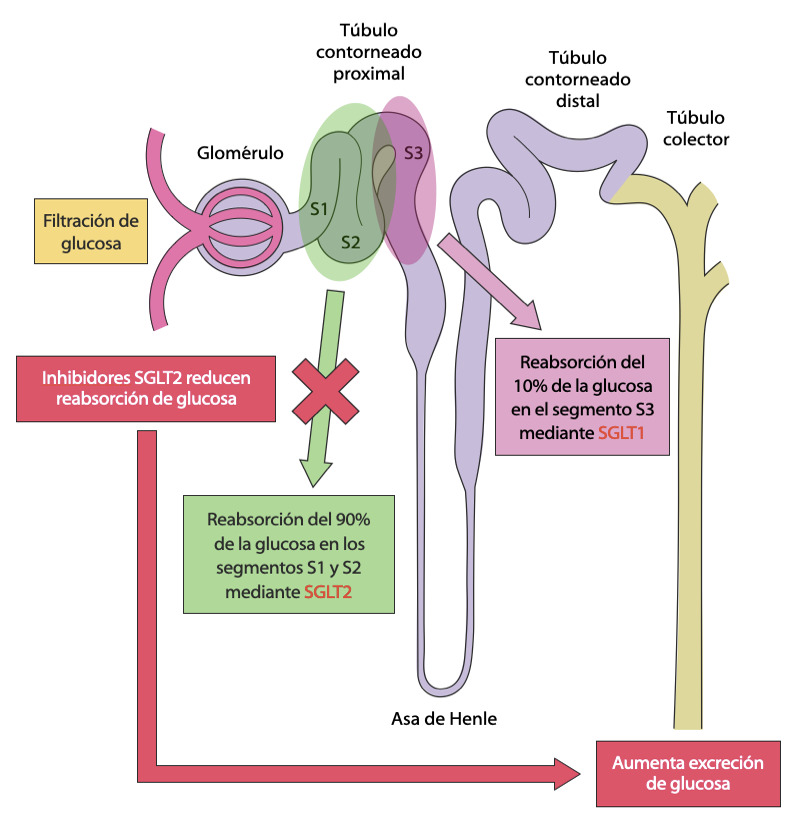
Tabla 1. Estudios Pivotales con los Inhibidores SGLT2: Principales Características.
| EMPA-REG OUTCOME (Empaglifozina) | CANVAS (Canaglifozina) | DECLARE-TIMI 58 (Dapaglifozina) | |
|---|---|---|---|
| N° pacientes | 7,020 | 10,142 | 17,160 |
| Año Publicación | 2015 | 2017 | 2019 |
| Criterio Inclusión | ECV, HBA1C 7-9%, TFG>30 | ECV ó ≥50 años + ≥2 FRCV HBA1C 7-10.5%, TFG>30 | ECV ó ≥50/60 (hombre/mujer) años + ≥1 FRCV, HBA1C 6.5-12%, TFG>60 |
| Dosis | 10-25 mg | 100 mg | 10 mg |
| Prevención Primaria | 0 % | 34.4% | 59.4% |
| Prevención Secundaria | 100 % | 65.6% | 40.6% |
| Población con insuficiencia cardíaca | 10 % | 14.4% | 10% |
| Objetivo Primario | 3-p MACE | 3-p MACE | Co-Primario: 3p-MACE y Muerte CV / Hospitalización IC |
| Seguimiento | 3.1 años | 2.4 años | 4.2 años |
| Resultados | HR 0.86 (0.74-0.99) p= 0.04 superioridad | HR 0.86 p=0.02 superioridad | HR 0.93 (0.84-1.03) HR 0.83 (0.73-0.95) |
| Reducción Hospitalización por insuficiencia cardíaca | 35 % | 33 % | 27% |
ECV: Enfermedad cardiovascular; FRCV: factores de riesgo cardiovascular; TFG: tasa filtración glomerular; 3-p MACE: Muerte cardiovascular + Infarto Miocardio no fatal + stroke no fatal; HR: hazard ratio
Si bien, no se especificaron las poblaciones con IC según su fracción de eyección en los tres estudios, datos del DECLARE demostrarían un mayor beneficio en población con ICFEr. Esta afirmación quedaría confirmada con los resultados del estudio DAPA-HF.
Lo que debemos enfatizar es que el beneficio obtenido en relación con la IC se trataría de un efecto de clase y sin duda, este grupo farmacológico tiene una clara indicación en el tratamiento de la DM en IC, tanto en la prevención de IC como en pacientes sintomáticos (Estadios A-C). Adicionalmente, es el único grupo farmacológico entre los hipoglicemiantes, que tiene un claro efecto de nefro protección y enlentecimiento en el deterioro de la función renal. ¿Qué mecanismos están involucrados y explicarían su beneficio en IC? Además de su efecto glucosúrico y natriurético, se han planteado otros efectos pleiotrópicos que en suma ejercen una acción metabólica, hemodinámica y quizá, en última instancia y no menos importante, una protección y viabilidad celular al prevenir apoptosis y muerte celular.52-57 (Figura 3)
Figura 3. Potenciales mecanismos de los ISGLT2 en la prevención y tratamiento de la IC. Adaptado de: Butler J et al. European Journal of Heart Failure. 2020. A1C: Hemoglobina glicosilada.
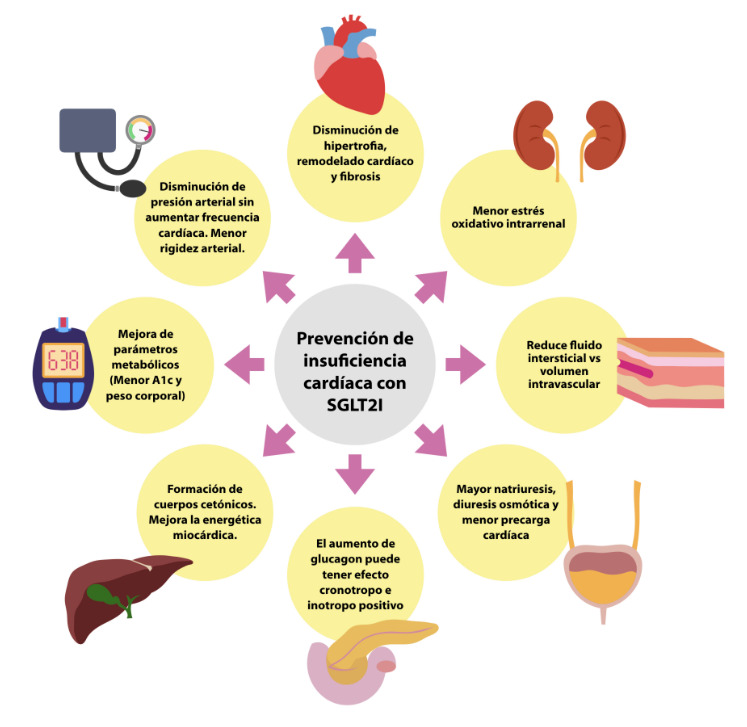
ISGLT2 en Insuficiencia Cardíaca con y sin Diabetes
La información obtenida de los ensayos clínicos mencionados previamente, así como, los buenos resultados de estudios observacionales, ha planteado la interrogante sobre si estos fármacos pueden tener un impacto positivo en el tratamiento de la IC, independientemente a que el paciente padezca de DM. En ese sentido, los resultados del estudio DAPA-HF58 con dapaglifozina en pacientes con ICFEr nos han abierto la posibilidad de contar con un nuevo fármaco que reduce la morbilidad y mortalidad en IC. Incluso la última Guía de Práctica Clínica de la Sociedad Canadiense de Cardiología59) ya la incorpora entre sus recomendaciones.
El estudio DAPA-HF reclutó 4,744 pacientes con IC CF II-IV y Fracción de Eyección menor a 40%, se aleatorizó para recibir dapaglifozina 10mg o placebo. El objetivo primario consistió en el punto combinado de muerte cardiovascular, hospitalización por insuficiencia cardiaca o una visita a emergencia por IC. El tiempo de seguimiento fue de tres años aproximadamente. Los resultados presentados en el congreso ESC 2019 en París muestran que dapaglifozina redujo el objetivo compuesto en un 26% (p<0.0001) (Figura 4) y mostró reducción en cada uno de los componentes individuales del objetivo primario. NNT 21 en el primer mes y otros beneficios como mejoría en la calidad de vida y 17% reducción en la mortalidad por todas las causas, con menos del 5% de suspensión y baja tasa de eventos adversos. La magnitud del beneficio fue independiente de la presencia de diabetes. Sin embargo, existen algunos puntos por resolver:
Figura 4. Resultados del estudio DAPA-HF. Adaptado de McMurray J. Dapaglifozin in patients with heart failure and reduced EF. N Eng J Med 2019. IC: Insuficiencia cardiaca; CV: Cardiovascular.
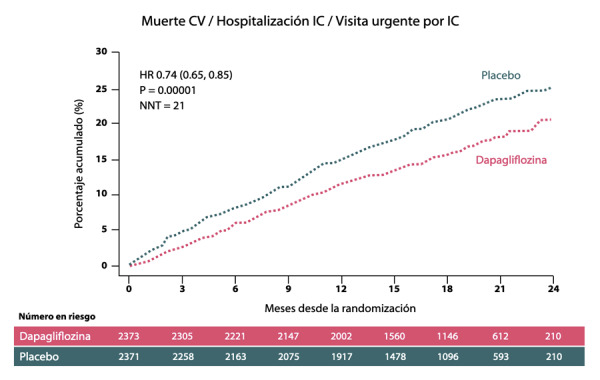
- ¿El beneficio será igual en pacientes con IC de mayor severidad? (En DAPA-HF 80% pacientes en Clase funcional II NYHA)
- Sólo el 10% de pacientes usó sacubitril/valsartán ¿será similar el beneficio y efectos adversos?
- ¿Cuál es el mecanismo de beneficio? En no diabéticos el efecto diurético parece ser irrelevante.
- ¿Hablaremos pronto de cuádruple bloqueo neurohumoral?
- ¿Lo iniciaremos durante la hospitalización?
- ¿En pacientes con ICFEp será el primer grupo farmacológico que disminuya la morbi-mortalidad cardiovascular?
Posiblemente, obtendremos respuestas en los siguientes años a partir de estudios que aún están en curso tanto con dapaglifozina (DELIVER) y empaglifozina (EMPEROR-Reduced y EMPEROR-Preserved).60-61
Conclusiones
Diabetes Mellitus e Insuficiencia Cardiaca mantienen una estrecha relación fisiopatológica y peligrosa. El tratamiento estricto de cada una de estas patologías según la medicina basada en la evidencia disminuirá la posibilidad de la aparición de la otra. Lo cierto es que el manejo de la diabetes mellitus en el paciente con enfermedad cardiovascular e insuficiencia cardiaca va mas allá del control glucémico; destacando claramente los inhibidores de SGLT2. Además, los resultados del estudio DAPA-HF marcan una nueva era en el tratamiento de la IC.
Financiación:
Ninguna
Referencias Bibliográficas
- 1.Wang ZV, Hill JA. Diabetic cardiomyopathy catabolism driving metabolism. Circulation. 2015;131(9):771–773. doi: 10.1161/CIRCULATIONAHA.115.015357. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.ADA. Standards of medical care in diabetes Pharmacologic approaches to glycemic treatment. Diabetes Care. 2017;40(1):S64–S74. doi: 10.2337/dc17-S011. [DOI] [PubMed] [Google Scholar]
- 3.Perel C, et al. Diabetes Insuficiencia cardiaca y diabetes. Nuevos tratamientos para la diabetes. Insuf Card. 2018;13(4):155–169. [Google Scholar]
- 4.Formiga F, Camafort M, Carrasco FJ, et al. Heart failure and diabetes: the confrontation of two major epidemics of the 21st century. Rev Clin Esp. 2019 doi: 10.1016/j.rce.2019.01.009. [DOI] [PubMed] [Google Scholar]
- 5.Gonzalez-Robledo G, Jaramillo M, Comín-Colet J. Diabetes mellitus, insuficiencia cardiaca y enfermedad renal crónica. Rev Colomb. Cardiol. 2020;27(S2):3–6. [Google Scholar]
- 6.Young JB, Dunlap ME, Pfeffer MA, et al. Mortality and morbidity reduction with candesartan in patients with chronic heart failure and left ventricular systolic function results of the CHARM low-left ventricular ejection fraction trials. Circulation. 2004;110:2618–2626. doi: 10.1161/01.CIR.0000146819.43235.A9. [DOI] [PubMed] [Google Scholar]
- 7.Preiss D, van Veldhuisen DJ, Sattar N, et al. Eplerenone and new-onset diabetes in patients with mild heart failure results from the eplerenone in mild patients hospitalization and survival study in heart failure EMPHASIS-HF. Eur J Heart Fail. 2012;14:909–915. doi: 10.1093/eurjhf/hfs067. [DOI] [PubMed] [Google Scholar]
- 8.Seferovic JP, Clagett B, Seidelmann SB, et al. Effect of sacubitril/valsartan versus enalapril on glycaemic control in patients with heart failure and diabetes a post-hoc analysis from PARADIGM-HF trial. Lancet Diabetes Endocrinolgy. 2017;5:333–340. doi: 10.1016/S2213-8587(17)30087-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Iribarren C, Karter AJ, Go AS, et al. Glycemic control and heart failure among adults patients with diabetes. Circulation. 2001;103:2668–2673. doi: 10.1161/01.cir.103.22.2668. [DOI] [PubMed] [Google Scholar]
- 10.Dinesh Shah A, Langerberg C, Rapsomaniki E, et al. Type 2 diabetes and incidence os cardiovascular disease a cohort study in 1.9 million people. Lancet diabetes endocrinol. 2015;3:105–113. doi: 10.1016/S2213-8587(14)70219-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Rawshani A, Franzen S, Sattar N, et al. Risk factors, mortality and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med. 2018;379:633–644. doi: 10.1056/NEJMoa1800256. [DOI] [PubMed] [Google Scholar]
- 12.Lee MMY, McMurray JJ, Lorenzo-Almorós A, et al. Diabetic cardiomyopathy. Heart. 2018;0:1–9. [Google Scholar]
- 13.Manfredi JA. Cardiomiopatía Diabética. Rev Urug Cardiol. 2017;32:264–276. [Google Scholar]
- 14.Athithan L, Gulsin GS, McCann GP, et al. Diabetic cardiomyopathy: pathophysiology, theories and evidence to date. World J Diabetes. 2019;10(10):490–516. doi: 10.4239/wjd.v10.i10.490. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Packer M. Epicardial adipose tissue may mediate deleterious effects of obesity and inflammation on the myocardium. J Am Coll Cardiol. 2018;71:2360–2372. doi: 10.1016/j.jacc.2018.03.509. [DOI] [PubMed] [Google Scholar]
- 16.Wilkinson MJ, Zadourian A, Taub P. Heart failure and diabetes mellitus defining the problem and exploring the interrelationship. Am J Cardiol. 2019;124:S3–S11. doi: 10.1016/j.amjcard.2019.10.024. [DOI] [PubMed] [Google Scholar]
- 17.Ferrini M., Johansson I, Aboyans V, et al. Heart failure and its complications in patients with diabetes mounting evidence for a growing burden. Eur J Prev Cardiol. 2019;26(2S):106–113. doi: 10.1177/2047487319885461. [DOI] [PubMed] [Google Scholar]
- 18.Dunlay SM, Givertz MM, Aguilar D, et al. Type 2 diabetes mellitus and heart failure A scientific statement from the American Heart Association and the Heart Failure Society of America. Circulation. 2019;140(7):e294–e324. doi: 10.1161/CIR.0000000000000691. [DOI] [PubMed] [Google Scholar]
- 19.Maack C, Lehrke M, Backs J, et al. Heart failure and diabetes metabolic alterations and therapeutic interventions: a state-of-the-art review from the traslational research comittee of the Heart Failure Association-European Society of Cardiology. Eur Heart J. 2018;39:4243–4254. doi: 10.1093/eurheartj/ehy596. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Rodriguez-Gonzalez MJ, Contreras J. De la insuficiencia cardiaca a la diabetes ¿Existe un mecanismo común? Rev Colomb Cardiol. 2020;27(S2):7–11. [Google Scholar]
- 21.Saldarriaga C, Navas V, Morales C. De la diabetes a la insuficiencia cardiaca ¿Existe la cardiomiopatía diabética? Rev Colomb Cardiol. 2020;27(S2):12–16. [Google Scholar]
- 22.Chowdhry MF, Vohra HA, Galiñanes M. Diabetes increases apoptosis and necrosis in both ischemic and nonischemic human myocardium. J Thorac Cardiovasc Surg. 2007;134:124–131. doi: 10.1016/j.jtcvs.2006.12.059. [DOI] [PubMed] [Google Scholar]
- 23.Seferovic PM, Paulus WJ. Clinical diabetic cardiomyopathy: a two-faced disease with restrictive and dialted phenotype. Eur Heart J. 2015;36:1718–1727. doi: 10.1093/eurheartj/ehv134. [DOI] [PubMed] [Google Scholar]
- 24.Rendon-Giraldo JA, Godoy P. A Detección temprana de la falla cardiaca en pacientes diabéticos: más allá de la fracción de eyección. Rev Colomb Cardiol. 2020;27(S2):17–21. [Google Scholar]
- Eguchi K, Boden-Albala B, Jin Z, et al. Association between diabetes mellitus and left ventricular hypertrophy in a multiethnic population. Am J Cardiol. 2008;101:1887–1891. doi: 10.1016/j.amjcard.2008.02.082. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Fontes-Carvalho R, Ladeiras-Lopez R, Bettencourt P, et al. A diastolic dysfunction in the diabetic continuum association with insuline resistance, metabolic síndrome and type 2 diabetes. Cardiovasc Diabetol. 2015;14:4–4. doi: 10.1186/s12933-014-0168-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Storz C, Hetterich H, Lorbeer R, et al. Myocardial tissue characterization by contrast-enhanced cardiac magnetic resonance imaging in subjects with prediabetes, diabetes, and normal controls with preserved ejection fraction from the general population. Eur Heart J Cardiovascular imaging. 2017;0:1–8. doi: 10.1093/ehjci/jex190. [DOI] [PubMed] [Google Scholar]
- 28.Flores-Ramirez R, Azpiriz-Lopez JR, González-González JG, et al. Global longitudinal strain as a biomarker in diabetic cardiomyopathy A comparative study with Gal-3 in patients with preserved ejection fraction. Arch Cardiol Mex. 2017;87(4):278–285. doi: 10.1016/j.acmx.2016.06.002. [DOI] [PubMed] [Google Scholar]
- Huelsman M, Neuhold S, Resl M, et al. PONTIAC-: NT-proBNP selected prevention of cardiac events in a population of diabetic patients without a history of cardiac disease: a prospective randomized controlled study. J Am Coll Cardiol. 62(2013):1365–1372. doi: 10.1016/j.jacc.2013.05.069. [DOI] [PubMed] [Google Scholar]
- 30.Yancy CW, Jessup M, Bozkurt B, et al. ACC/AHA/HFSA focused update of the 2013 ACCF/AHA guideline for the management of heart failure:a report of the American college of cardiology/American heart association Task force on clinical practice guidelines and the heart failure society of America. Circulation. 2017;2017;136:e137–e161. doi: 10.1161/CIR.0000000000000509. [DOI] [PubMed] [Google Scholar]
- 31.Rorth R, Jhund PS, Mogensen UM, et al. Risk of incident heart failure in patients with diabetes and asymptomatic left ventricular systolic dysfunction. Diabetes Care. 2018;6:1285–1291. doi: 10.2337/dc17-2583. [DOI] [PubMed] [Google Scholar]
- 32.Ponikowski P, Voors AA, Anker S, et al. Guía ESC 2016 sobre el diagnóstico y tratamiento de la insuficiencia cardiaca aguda y crónica. Rev Esp Cardiol. 2016;69(12):1167.e1–1167e85. [Google Scholar]
- 33.Real Jacqui, Cowles E, Wierzbicki AS, et al. Chronic heart failure in adults summary of updated NICE guidance. BMJ. 2018;362:k3646–k3646. doi: 10.1136/bmj.k3646. [DOI] [PubMed] [Google Scholar]
- 34.Van der Meer P, Gaggin HK, William Dec G. ACC/AHA versus ESC guidelines on Heart Failure. JACC Guideline comparison. J Am Coll Cardiol. 2019;73(21):2756–2768. doi: 10.1016/j.jacc.2019.03.478. [DOI] [PubMed] [Google Scholar]
- 35.SIGN 147 . Management of chronic heart failure. A national clinical guideline Scotish. 2016. [Google Scholar]
- 36.Pitt B, Remme W, Zannad F, et al. Eplerenone, a selective aldosterone blocker in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med. 2003;348:1309–1321. doi: 10.1056/NEJMoa030207. [DOI] [PubMed] [Google Scholar]
- 37.McMurray JJ, Packer M, Desai AS, et al. Angiotensin-Neprilysin inhibition versus enalapril in Heart Failure. N Engl J Med. 2014;371:993–1004. doi: 10.1056/NEJMoa1409077. [DOI] [PubMed] [Google Scholar]
- 38.MacDonald MR, Petrie MC, Varyani F, et al. Impact of diabetes on outcomes in patients with low and preserved ejection fraction heart failure an analysis of CHARM Programme. Eur Heart J. 2008;11:1377–1385. doi: 10.1093/eurheartj/ehn153. [DOI] [PubMed] [Google Scholar]
- 39.Solomon SD, McMurray JJ, Anand IS, et al. Angiotensin-Neprilysin inhibition in heart failure with preserved ejection fraction. N Engl J Med. 2019;381:1609–1620. doi: 10.1056/NEJMoa1908655. [DOI] [PubMed] [Google Scholar]
- 40.Lawson CA, Jones PW, Teece L, et al. Association between type 2 diabetes and all-cause hospitalization and mortality in the UK general heart failure population stratification by diabetic glycemic control and medication intensification. JACC Heart Fail. 2018;6:18–26. doi: 10.1016/j.jchf.2017.08.020. [DOI] [PubMed] [Google Scholar]
- 41.Castillo GA, Morales Villegas E. Tratamiento de la diabetes en el paciente con insuficiencia cardiaca mas allá de la hemoglobina glicosilada. Rev Colomb Cardiol. 2020;27(S2):33–39. [Google Scholar]
- 42.Zheng SL, Roddick AJ, Aghar-Jaffar R, et al. Association between use of sodium-glucose contransporter 2 inhibitors, glucocagon-like peptide 1 agonists, and dipeptidyl peptidase 4 inhibitors with all-cause mortality in patients with tyoe 2 diabetes a systematic review and metaanalysis. JAMA. 2018;319:1580–1591. doi: 10.1001/jama.2018.3024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Butler J, Handelsman Y, Bakris G, et al. Use of sodium-glucose co-transporter-2 inhibitors in patients with and without type 2diabetes: implications for incident and prevalent heart failure. Eur J Heart Fail. 2020 doi: 10.1002/ejhf.1708. [DOI] [PubMed] [Google Scholar]
- 44.Nassif M, Kosiborod M. Effect of glucose-lowering therapies on heart failure. Nat Rev Cardiol. 2018;15:282–291. doi: 10.1038/nrcardio.2017.211. [DOI] [PubMed] [Google Scholar]
- 45.Seferovic PM, Petrie MC, Filippatos GS, et al. Type 2 diabetes mellitus and heart failure a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2018;20:853–872. doi: 10.1002/ejhf.1170. [DOI] [PubMed] [Google Scholar]
- 46.Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Eng J Med. 2016;375:311–322. doi: 10.1056/NEJMoa1603827. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Marso SP, Bain SC, Consoli A, et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Eng J Med. 2016;375:1834.–18344. doi: 10.1056/NEJMoa1607141. [DOI] [PubMed] [Google Scholar]
- 48.Zinman B, Wanner C, Lachin JM, et al. EMPA-REG OUTCOME Investigators Empaglifozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Eng J Med. 2015;373:2117–2128. doi: 10.1056/NEJMoa1504720. [DOI] [PubMed] [Google Scholar]
- 49.Radholm K, Figtree G, Perkovic V, et al. Canaglifozin and heart failure in type 2 diabetes mellitus results from the CANVAS program. Circulation. 2018;138:458–468. doi: 10.1161/CIRCULATIONAHA.118.034222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Wiviott SD, Raz I, Bonaca MP, et al. DECLARE-TIMI 58 Investigators Dapaglifozin and cardiovascular outcomes in type 2 diabetes. N Eng J Med. 2019;380:347–357. [Google Scholar]
- 51.Zelniker TA, Wiviott SD, Raz I, et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes a systematic review and meta-analysis of cardiovascular outcome trials. Lancet. 2019;393:31–39. doi: 10.1016/S0140-6736(18)32590-X. [DOI] [PubMed] [Google Scholar]
- 52.Vaduganathan M, Januzzi J. Preventing and treating heart failure with sodium-glucose co-transporter 2 inhibitors. Am J Cardiol. 2018;124:S20–S27. doi: 10.1016/j.amjcard.2019.10.026. [DOI] [PubMed] [Google Scholar]
- 53.Juni Rio P, Kuster D, Goebel M, et al. Cardiac microvascular endotelial enhancement of cardiomyocite function is impaired by inflammationand restored by empaglifozin. JACC Basic Trans Science. 2019;4(5):575–591. doi: 10.1016/j.jacbts.2019.04.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Butrago AF, Sanchez-Vallejo CA. Mecanismos de acción de los inhibidores del cotransportador de sodio y glucosa tipo 2 - SGLT2-: mas allá del control de glicemia. Rev Colomb Cardiol. 2020;27(S2):22–25. [Google Scholar]
- 55.Packer M. Lessons learned from the DAPA-HF trial concerning the mechanisms of benefits of SGLT2 inhibitors on heart failure events in the contexto of other large-scale trials nearing completion. Cardiovasc Diabet. 2019;18:129–133. doi: 10.1186/s12933-019-0938-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Iborra O, Santiago E, Yurista SR, et al. Unraveling the molecular mechanism of action of empaglifozin in heart failure with reduced ejection fraction with or without diabetes. J Am Coll Cardiol Basic Trans Science. 2019;4(7):831–840. doi: 10.1016/j.jacbts.2019.07.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Verma S. Potential mechanisms of sodium-glucose co-transporter 2 inhibitor-related cardiovascular benefits. American journal of Medicine. 2019;132:S39–S48. doi: 10.1016/j.amjcard.2019.10.028. [DOI] [PubMed] [Google Scholar]
- 58.McMurray JJ, Solomon SD, Inzucchi SE, et al. Dapaglifozin in patients with heart failure and reduced ejection fraction. N Eng J Med. 2019;381:1995–2008. doi: 10.1056/NEJMoa1911303. [DOI] [PubMed] [Google Scholar]
- 59.OMeara E, McDonald M, Chan M, et al. CCS/CHFS Heart Failure Guidelines Clinical Trial Update on functional mitral regurgitation, SGLT2 inhibitors, ARNI in HFpEF, and tafamidis in Amyloidosis. Canadian Journal of Cardiology. 2020;36:159–169. doi: 10.1016/j.cjca.2019.11.036. [DOI] [PubMed] [Google Scholar]
- 60.Anker S, Butler J, Filippatos G, et al. Evaluation of the effects of sodium -glucose co-transporter 2 inhibition with empaglifozin on morbidity and mortality in patients with chronic heart failure and preserved ejection fraction rationale for and design of the EMPEROR-Preserved trial. Eur Heart J. 2019;21(10):1279–1287. doi: 10.1002/ejhf.1596. [DOI] [PubMed] [Google Scholar]
- 61.Packer M, Butler J, Filippatos G, et al. Evaluation of the effects of sodium -glucose co-transporter 2 inhibition with empaglifozin on morbidity and mortality in patients with chronic heart failure and reduce ejection fraction rationale for and design of the EMPEROR-Preserved trial. Eur Heart J. 2019;21(10):1270–1278. doi: 10.1002/ejhf.1536. [DOI] [PubMed] [Google Scholar]


