Abstract
目的
研究系统性红斑狼疮(systemic lupus erythematosus,SLE)患者的真实世界低疾病活动度和临床缓解率,并分析其相关因素。
方法
采用现场调查的研究方法,对国内11家医院1 000例SLE患者进行问卷调查,记录患者的一般资料、临床表现、实验室检查结果和治疗情况等。采用狼疮低疾病活动状态(lupus low disease activity state,LLDAS)和SLE缓解定义(definitions of remission in SLE,DORIS)评价患者低疾病活动度和临床缓解率,进一步分析符合LLDAS或DORIS缓解患者的临床特征。多因素Logistic回归分析影响LLDAS或DORIS缓解的相关因素。
结果
1 000例SLE患者中,207例(20.7%)符合LLDAS标准,104例(10.4%)符合DORIS缓解。与不符合LLDAS或DORIS的患者相比,符合LLDAS或DORIS者高收入比例更高,病程更长,贫血、肌酐升高、红细胞沉降率增快和低白蛋白血症的发生率更低。应用羟氯喹>12个月或免疫抑制剂≥6个月的SLE患者缓解比例较高。多因素Logistic回归分析发现,红细胞沉降率增快、抗双链DNA抗体阳性、低补体血症(C3和C4)、蛋白尿及家庭收入低是不利于达到LLDAS或DORIS缓解的独立相关因素,而应用羟氯喹>12个月为达到LLDAS或DORIS缓解的保护因素。
结论
SLE患者达到LLDAS或DORIS缓解状态的比例较低,规范应用羟氯喹和免疫抑制剂有助于患者的病情缓解。
Keywords: 系统性红斑狼疮, 缓解, 狼疮低疾病活动状态
Abstract
Objective
To investigate the rates of low disease activity and clinical remission in patients with systemic lupus erythematosus (SLE) in a real-world setting, and to analyze the related factors of low disease activity and clinical remission.
Methods
One thousand patients with SLE were enrolled from 11 teaching hospitals. Demographic, clinical and laboratory data, as well as treatment regimes were collec-ted by self-completed questionnaire. The rates of low disease activity and remission were calculated based on the lupus low disease activity state (LLDAS) and definitions of remission in SLE (DORIS). Charac-teristics of patients with LLDAS and DORIS were analyzed. Multivariate Logistic regression analysis was used to evaluate the related factors of LLDAS and DORIS remission.
Results
20.7% of patients met the criteria of LLDAS, while 10.4% of patients achieved remission defined by DORIS. Patients who met LLDAS or DORIS remission had significantly higher proportion of patients with high income and longer disease duration, compared with non-remission group. Moreover, the rates of anemia, creatinine elevation, increased erythrocyte sedimentation rate (ESR) and hypoalbuminemia was significantly lower in the LLDAS or DORIS group than in the non-remission group. Patients who received hydroxychloroquine for more than 12 months or immunosuppressant therapy for no less than 6 months earned higher rates of LLDAS and DORIS remission. The results of Logistic regression analysis showed that increased ESR, positive anti-dsDNA antibodies, low level of complement (C3 and C4), proteinuria, low household income were negatively related with LLDAS and DORIS remission. However, hydroxychloroquine usage for longer than 12 months were positively related with LLDAS and DORIS remission.
Conclusion
LLDAS and DORIS remission of SLE patients remain to be improved. Treatment-to-target strategy and standar-dized application of hydroxychloroquine and immunosuppressants in SLE are recommended.
Keywords: Systemic lupus erythematosus, Remission, Lupus low disease activity state
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及全身多系统和器官的慢性自身免疫病,如长期未能控制,疾病活动将导致多脏器的不可逆损伤,进而影响预后结局。因此,控制疾病活动度是治疗SLE及改善患者预后的重要目标[1-2]。基于此目的,狼疮低疾病活动状态(lupus low disease activity state,LLDAS)和SLE缓解定义(definition of remission in SLE,DORIS)的概念被提出,并用于近些年的临床研究[3-4]。2021年,DORIS国际工作组对SLE缓解定义提出了新的建议,以期能够更好地用于临床治疗和研究,新定义取消了血清学缓解和无药缓解,其临床适用性需进一步验证[5]。
本文对达到不同程度DORIS缓解和LLDAS的患者比例进行研究,旨在分析中国人群SLE缓解状况和特点,并分析影响疾病缓解的相关因素,为SLE患者的临床治疗提供参考依据。
1. 资料与方法
1.1. 研究对象
本研究调查了全国11家三甲医院风湿免疫科就诊的1 000例SLE确诊患者,诊断均符合1997年美国风湿病学会(American College of Rheumatology,ACR)或2012年系统性红斑狼疮国际协作组(Systemic Lupus International Collaborating Clinics,SLICC)的SLE分类标准。
1.2. 研究方法
由经过培训的风湿免疫专科医生面对面指导或帮助患者完成现场问卷调查,收集患者近2周内SLE相关的临床症状和实验室化验检查资料,包括患者的一般情况(性别、年龄、民族、学历、婚姻、家庭收入、发病时间、确诊时间、家族史)、近2周内的临床症状[皮疹、脱发、关节痛、口腔溃疡、雷诺(Raynaud)现象等]及实验室指标(全血细胞分析、尿常规、肝功能、肾功能、24 h尿蛋白、抗核抗体、抗双链DNA抗体、补体C3和C4、红细胞沉降率等)。
记录既往SLE药物(糖皮质激素、免疫抑制剂、羟氯喹、生物制剂等)治疗情况,包括药物的用法、用量及持续时间,并进行SLE活动指数(disease activity index,SLEDAI)、SLEDAI-2000(SLEDAI-2K)和医生总体评价指数(physician global assessment,PGA)评分。
1.3. 定义
LLDAS定义为:SLEDAI-2K≤4,无主要器官/系统(肾、中枢神经系统、心、肺、血管炎、发热)受累表现,血液系统和胃肠道无活动性表现;与既往评估相比,无新发疾病活动;PGA评分≤1;泼尼松龙(或等效激素)维持剂量≤7.5 mg/d;免疫抑制剂和批准的生物制剂常规剂量维持治疗[3]。LLDAS5定义为:除泼尼松龙(或等效激素)维持剂量≤5 mg/d外,其余要求与LLDAS相同。
DORIS的缓解标准包括:(1)临床SLEDAI=0;(2)PGA<0.5;(3)可以服用抗疟药、低剂量糖皮质激素(等效泼尼松龙剂量≤5 mg/d)和/或稳定剂量的免疫抑制剂(包括生物制剂)。参照DORIS缓解标准框架分为以下四类[4]:(1)治疗下临床缓解(clinical remission ON treatment,RONT):临床SLEDAI=0;泼尼松龙(或等效激素)剂量≤5 mg/d;免疫抑制剂和/或批准的生物制剂常规剂量维持。(2)无药临床缓解(clinical remission OFF treatment,ROFT):临床SLEDAI=0;除抗疟药外停用激素、免疫抑制剂等药物。(3)治疗下临床和血清学缓解(complete remission with negative serology ON treatment,CRONT):临床SLEDAI=0;血清学指标阴性;泼尼松龙(或等效激素)剂量≤5 mg/d;免疫抑制剂和/或批准的生物制剂常规剂量维持。(4)无药临床和血清学缓解(complete remission with negative serology OFF treatment,CROFT):临床SLEDAI=0;血清学指标阴性;除抗疟药外,停用激素、免疫抑制剂等药物。其中,免疫抑制剂包括环磷酰胺(cyclophosphamide,CTX)、霉酚酸酯(mycophenolate mo-fetil,MMF)、硫唑嘌呤(azathioprine,AZA)、甲氨蝶呤(methotrexate,MTX)、来氟米特(leflunomide,LEF)、环孢素A(cyclosporin A,CsA)、他克莫司(tacrolimus,FK506),生物制剂包括利妥昔单抗、白细胞介素-2。
1.4. 统计学方法
采用SPSS 18.0软件进行统计学分析。计量资料用x±s表示,两组间比较采用t检验,多组间比较采用方差分析;分类资料用例数(%)表示,两组间比较采用卡方检验。相关因素分析应用单因素和多因素Logistic回归,单因素Logistic回归结果中P<0.05的变量纳入多因素分析。P<0.05为差异有统计学意义。
2. 结果
2.1. 一般资料
1 000例SLE患者中,女性918例,男性82例,年龄为(37.0±13.4)岁(12~86岁),发病年龄为(31.5±12.6)岁(8~77岁),病程(60.7±67.7)个月(1~480个月)。SLEDAI-2K评分0~4分者369例,5~9分者286例,10~14分者198例,15分及以上者147例。
40.7%的患者在入组时无任何临床症状,其余患者伴有不同的临床症状,以脱发(24.3%)、关节痛(18.3%)、皮疹(17.2%)、雷诺现象(16.4%)及口腔黏膜溃疡(10.7%)最常见。实验室结果显示,93.3%为抗核抗体阳性,56.5% C3降低,51.1% C4降低,40.7%抗双链DNA抗体阳性,48.7%红细胞沉降率增快,37.6%为低白蛋白血症,31.7%贫血,26.2%有蛋白尿。
2.2. 缓解情况及其临床特点
1 000例患者中有625例(62.5%)使用常规剂量的免疫抑制剂或生物制剂治疗。369例(36.9%)患者SLEDAI-2K评分≤4,351例(35.1%)患者PGA≤1,218例(21.8%)患者服用泼尼松(或同等剂量激素)≤7.5 mg/d。207例(20.7%)患者达到LLDAS,147例(14.7%)患者达到LLDAS5。104例(10.4%)患者达到DORIS缓解,其中53例(5.3%)达到RONT,11例(1.1%)达到ROFT,32例(3.2%) 达到CRONT,仅8例(0.8%)达到CROFT。
将符合LLDAS或DORIS缓解标准者分别与不符合者的临床特点进行比较,结果如表 1所示。与不符合LLDAS患者相比,符合LLDAS者家庭月收入≥1 000元的比例更高(P=0.033),病程更长(P<0.01),红细胞沉降率增快和低白蛋白血症的比例更低(均P<0.01)。与LLDAS基本相似,符合DORIS缓解标准的患者同样表现为家庭月收入较高(P=0.026),病程较长(P=0.013),且红细胞沉降率增快及低白蛋白血症的比例更低,此外,贫血和肌酐升高的发生率也明显低于不符合DORIS的患者(均P<0.05)。
表 1.
符合与不符合DORIS或LLDAS的SLE患者临床特点对比
Comparison of clinical characteristics between patients who met or unmet DORIS/LLDAS criteria
| Items | DORIS (n=104) | LLDAS (n=207) | |||||
| Met | Unmet | P | Met | Unmet | P | ||
| Data are expressed as x±s or n(%). SLE, systemic lupus erythematosus; LLDAS, lupus low disease activity state; DORIS, definitions of remission in SLE; ESR, erythrocyte sedimentation rate. | |||||||
| Female | 99 (95.2) | 819 (91.4) | 0.183 | 196 (94.7) | 722 (91.0) | 0.089 | |
| Age/years | 37.3±13.1 | 37.0±13.5 | 0.843 | 37.4±12.8 | 37.0±13.6 | 0.713 | |
| Northern region | 88 (84.6) | 723 (80.7) | 0.333 | 171 (82.6) | 640 (80.7) | 0.534 | |
| Married | 82 (78.8) | 712 (79.5) | 0.883 | 168 (81.2) | 626 (78.9) | 0.482 | |
| Bachelor’s degree or above | 71 (68.2) | 635 (70.9) | 0.582 | 152 (73.4) | 554 (69.9) | 0.316 | |
| On-the-job | 69 (66.3) | 548 (61.2) | 0.303 | 138 (66.7) | 479 (60.4) | 0.099 | |
| Outworker | 16 (15.3) | 134 (15.0) | 0.908 | 23 (11.1) | 127 (16.0) | 0.078 | |
| Household income≥1 000 yuan per month | 102 (98.1) | 825 (92.1) | 0.026 | 199 (96.1) | 728 (91.8) | 0.033 | |
| Family history | 19 (18.2) | 112 (12.5) | 0.099 | 28 (13.5) | 103 (13.0) | 0.838 | |
| Disease duration/months | 76.2±59.2 | 58.9±68.4 | 0.013 | 72.4±57.4 | 57.7±69.8 | 0.005 | |
| Increased ESR | 34 (32.7) | 458 (51.1) | <0.001 | 80 (38.6) | 412 (52.0) | 0.001 | |
| Hypoproteinemia | 20 (19.2) | 368 (41.2) | 0.023 | 59 (28.5) | 329 (41.5) | 0.001 | |
| Anemia | 24 (23.1) | 297 (33.1) | 0.048 | 59 (28.5) | 262 (33.0) | 0.213 | |
| Elevated creatinine | 1 (0.1) | 40 (4.5) | 0.046 | 5 (2.4) | 36 (4.5) | 0.171 | |
2.3. 用药情况与SLE疾病缓解状况的关系
在1 000例患者中,仅4.2%的患者停用或未用糖皮质激素治疗,其余患者的激素用量均集中在7.5~15.0 mg/d,占56.2%(538/958)。除激素外,48.2%的患者目前仅使用单药治疗[主要为抗疟药羟氯喹(hydroxychloroquine,HCQ)],38.9%的患者使用两药联合治疗(主要为CTX+HCQ、MMF+HCQ),10.8%的患者使用三药联合治疗(主要为CTX+HCQ+LEF),仅2.1%的患者使用四药联合治疗(主要为CTX+AZA+MMF+HCQ)。HCQ(85.9%)为激素之外应用最为广泛的药物,其次分别为CTX(30.8%)、MMF(16.2%)、LEF(10.8%)、AZA(8.8%)。采用单药、两药以及三药联合治疗方案的患者中达到LLDAS的比例分别为18.8%、21.3%和24.1%,其中HCQ联合两种免疫抑制剂的患者LLDAS比例最高(26.2%)。另外,单药或两药联合治疗24个月及以上的患者LLDAS比例显著高于治疗时间少于24个月的患者(P<0.05)。
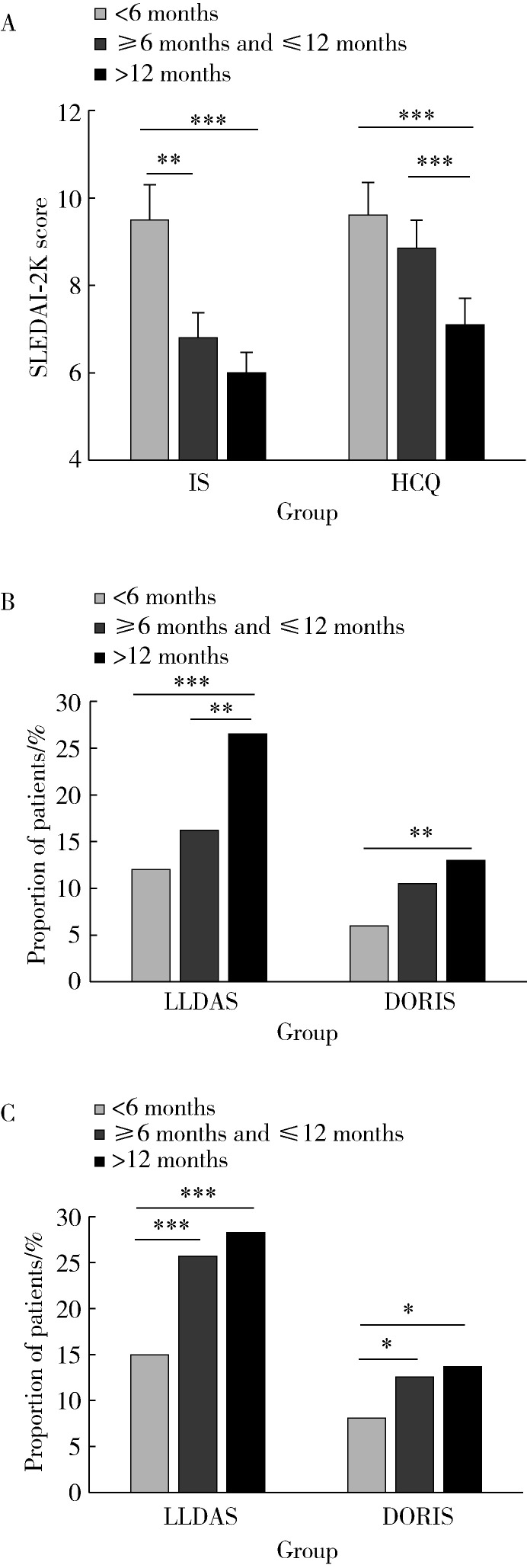
当HCQ使用时间>12个月时,其SLEDAI-2K评分较HCQ使用时间≤12个月的患者明显降低,达到LLDAS缓解比例较后者显著升高。当免疫抑制剂应用时间≥6个月时,SLEDAI-2K评分较免疫抑制剂使用时间<6个月的患者明显降低,同时,LLDAS和DORIS缓解比例亦显著升高(图 1)。以上结果均提示规范应用免疫抑制剂半年以上及HCQ 1年以上的SLE患者缓解情况较好。
图 1.
HCQ及免疫抑制剂疗程对SLE患者疾病活动度的影响
Effect of the course of HCQ and IS on the disease activity in SLE patients
A, effect of the course of HCQ and IS on SLEDAI-2K scores; B, effect of the course of HCQ on LLDAS and DORIS remission; C, effect of the course of IS on LLDAS and DORIS remission. * P < 0.05, * * P < 0.01, * * * P < 0.001. IS, immunosuppressants; HCQ, hydroxychloroquine; SLE, systemic lupus erythematosus; SLEDAI-2K, SLE disease activity index 2000; LLDAS, lupus low disease activity state; DORIS, definition of remission in SLE.
2.4. SLE疾病缓解状况的相关因素
单因素Logistic回归分析提示,红细胞沉降率增快、抗双链DNA抗体阳性、低补体血症、蛋白尿、血尿、低蛋白血症以及低家庭收入、短病程、HCQ应用≤12个月和免疫抑制剂应用<6个月是影响能否达到LLDAS或DORIS缓解状况的不利因素(P<0.05)。
进一步将上述单因素分析获得的变量纳入多因素Logistic回归分析,结果提示红细胞沉降率增快、抗双链DNA抗体阳性、低补体血症、蛋白尿和低家庭收入为不利于达到LLDAS或DORIS缓解状态的独立相关因素,而HCQ应用>12个月是达到LLDAS或DORIS缓解状态的保护因素(表 2)。
表 2.
影响SLE患者达到LLDAS或DORIS缓解的多因素Logistic分析
Multivariat Logitstic analysis of factors related LLDAS or DORIS remission in SLE patients
| Variables | LLDAS | DORIS | |||
| OR (95%CI) | P | OR (95%CI) | P | ||
| SLE, systemic lupus erythematosus; LLDAS, lupus low disease activity state; DORIS, definitions of remission in SLE; ESR, erythrocyte sedimentation rate; HCQ, hydroxychloroquine. | |||||
| Increased ESR | 0.63 (0.45, 0.88) | <0.01 | 0.50 (0.31, 0.81) | <0.01 | |
| Positive anti-dsDNA antibodies | 0.40 (0.27, 0.60) | <0.01 | 0.24 (0.12, 0.48) | <0.01 | |
| Low complement C3 | 0.55 (0.37, 0.83) | <0.01 | 0.29 (0.15, 0.54) | <0.01 | |
| Low complement C4 | 0.63 (0.42, 0.94) | 0.025 | 0.32 (0.17, 0.60) | <0.01 | |
| Urine protein≥0.5 g/d | 0.31 (0.19, 0.52) | <0.01 | 0.21 (0.08, 0.55) | <0.01 | |
| Low household income (<1 000 yuan per month) | 0.44 (0.21, 0.93) | 0.028 | 0.21 (0.05, 0.88) | 0.033 | |
| HCQ usage for longer than 12 months | 3.10 (2.15, 4.45) | <0.01 | 2.35 (1.46, 3.78) | <0.01 | |
3. 讨论
为了改善慢性病的预后,目标治疗(treatment to target,T2T)逐渐成为多种慢性病的治疗策略。2015年,亚太狼疮协作组提出了LLDAS的概念,并建议将其作为SLE治疗的可预期目标。2017年,DORIS国际工作组又制定了DORIS的框架。随后的多项临床研究证实,达到LLDAS或DORIS缓解可以减少疾病相关的脏器损伤,降低复发率[6-7],从而改善患者预后。了解中国SLE患者的缓解情况和临床特点对指导相关治疗具有重要的意义。
既往研究显示,欧美国家SLE患者的5年DORIS缓解比例为30%,横断面研究报道的DORIS缓解比例在50%以上[8-9]。本研究中SLE患者缓解比例低于欧美国家,与文献报道的拉美国家较为接近[1],提示社会经济因素对SLE的疾病状况具有重要影响。Gao等[10]报道,在218例的中国SLE纵向队列中,初治患者第一年达到LLDAS的比例为18.8%,DORIS缓解比例为6.9%,达到LLDAS需要的中位时间为1.4年,随着治疗时间的延长,达到LLDAS或DORIS缓解的累积概率明显增加。本研究也提示,达到LLDAS或DORIS缓解的患者病程更长,应用免疫抑制剂时间超过半年和应用HCQ超过1年以上的SLE患者具有较高比例的缓解。此外,本研究多因素分析表明,蛋白尿、红细胞沉降率增快、抗双链DNA抗体升高和低补体血症等实验室指标为SLE缓解的不利相关因素,提示对存在上述不利因素的患者应积极加强个体化治疗,尽可能使其达到缓解。
HCQ和免疫抑制剂是除激素外治疗SLE的常用药物,本研究中两者均可以明显改善SLEDAI评分,且免疫抑制剂在改善病情活动方面略优于HCQ。但在本研究的多因素分析中,免疫抑制剂并未成为影响缓解的主要因素,这可能与应用免疫抑制剂的患者往往病情较重有关。Ngamjanyaporn等[11]和Bernatsky等[12]的研究结果也提示,免疫抑制剂的应用与SLE的高疾病活动度状态密切相关。本研究中联合用药患者达到LLDAS的比例高于单药治疗,提示免疫抑制剂的应用可能提高LLDAS比例。
本研究中DORIS缓解比例仅为10.4%,明显低于LLDAS的比例,表明DORIS缓解标准较LLDAS更严格。Golder等[13]的2年前瞻性研究显示,DORIS和LLDAS在减轻疾病相关的脏器损伤方面并无明显差异,提示将较为宽松的LLDAS作为治疗目标似乎更为可行。但也有研究认为以DORIS缓解作为治疗目标值得尝试,Petri等[14]的回顾性分析表明,即使短时间维持DORIS缓解,也可以明显减轻脏器损害,其效果优于LLDAS。近期Tani等[15]的研究也显示,以DORIS为治疗目标,有助于降低SLE患者妊娠期间疾病复发和严重产科并发症的风险,可能优于LLDAS为目标的治疗策略。对于SLE预后而言,DORIS与LLDAS的优劣还没有定论,两者在实用性、有效性等方面的差异还需更多的前瞻性临床研究来评价。
综上所述,SLE患者的LLDAS或DORIS缓解比例较低,规范应用HCQ和免疫抑制剂有助于SLE患者病情的改善和缓解。
志谢
感谢王倬榕博士在课题执行、数据采集及分析中做出的重要贡献,发表此文,以示缅怀。
Footnotes
利益冲突 所有作者均声明不存在利益冲突。
作者贡献声明 周惠琼、张莉芸、王友莲、沈凌汛、李洋、厉小梅、王吉波、李茹:提出研究思路;任立敏、赵楚楚设计研究方案;赵义、范文强、程永静、彭嘉婧、赵晓珍、邵苗:收集、分析、整理数据;任立敏、李茹:撰写论文;李茹:总体把关和审定论文。
References
- 1.Ugarte-Gil M, Wojdyla D, Pons-Estel GJ, et al. Remission and low disease activity status (LDAS) protect lupus patients from damage occurrence: Data from a multiethnic, multinational Latin American lupus cohort (GLADEL) Ann Rheum Dis. 2017;76(12):2071–2074. doi: 10.1136/annrheumdis-2017-211814. [DOI] [PubMed] [Google Scholar]
- 2.Floris A, Piga M, Perra D, et al. Treatment target in newly diagnosed systemic lupus erythematosus: The association of lupus low disease activity state and remission with lower accrual of early damage. Arthritis Care Res (Hoboken) 2020;72(12):1794–1799. doi: 10.1002/acr.24086. [DOI] [PubMed] [Google Scholar]
- 3.Franklyn K, Lau CS, Navarra SV, et al. Definition and initial validation of a lupus low disease activity state (LLDAS) Ann Rheum Dis. 2015;75(9):1615–1621. doi: 10.1136/annrheumdis-2015-207726. [DOI] [PubMed] [Google Scholar]
- 4.van Vollenhoven RF, Voskuyl A, Bertsias G, et al. A framework for remission in SLE: Consensus findings from a large international task force on definitions of remission in SLE (DORIS) Ann Rheum Dis. 2017;76(3):554–561. doi: 10.1136/annrheumdis-2016-209519. [DOI] [PubMed] [Google Scholar]
- 5.van Vollenhoven RF, Bertsias G, Doria A, et al. 2021 DORIS definition of remission in SLE: Final recommendations from an international task force. Lupus Sci Med. 2021;8(1):e000538. doi: 10.1136/lupus-2021-000538. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Tsang-A-Sjoe MW, Bultink IE, Heslinga M, et al. Both prolonged remission and lupus low disease activity state are associated with reduced damage accrual in systemic lupus erythematosus. Rheumatology (Oxford) 2017;56(1):121–128. doi: 10.1093/rheumatology/kew377. [DOI] [PubMed] [Google Scholar]
- 7.Smith EMD, Tharmaratnam K, Al-Abadi E, et al. Attainment of low disease activity and remission targets reduces the risk of severe flare and new damage in childhood lupus. Rheumatology (Oxford) 2022;61(8):3378–3389. doi: 10.1093/rheumatology/keab915. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Zen M, Iaccarino L, Gatto M, et al. Prolonged remission in Caucasian patients with SLE: Prevalence and outcomes. Ann Rheum Dis. 2015;74(12):2117–2122. doi: 10.1136/annrheumdis-2015-207347. [DOI] [PubMed] [Google Scholar]
- 9.Ugarte-Gil M, Wojdyla D, Pons-Estel G, et al. Predictors of remission and low disease activity state in systemic lupus erythematosus: Data from a multiethnic, multinational Latin American cohort. J Rheumatol. 2019;46(10):1299–1308. doi: 10.3899/jrheum.180433. [DOI] [PubMed] [Google Scholar]
- 10.Gao D, Hao YJ, Mu L, et al. Frequencies and predictors of the lupus low disease activity state and remission in treatment: Naive patients with systemic lupus erythematosus. Rheumatology (Oxford) 2020;59(11):3400–3407. doi: 10.1093/rheumatology/keaa120. [DOI] [PubMed] [Google Scholar]
- 11.Ngamjanyaporn P, McCarthy EM, Sergeant JC, et al. Clinicians approaches to management of background treatment in patients with SLE in clinical remission: results of an international observational survey. Lupus Sci Med. 2017;4(1):e000173. doi: 10.1136/lupus-2016-000173. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Bernatsky S, Peschken C, Fortin PR, et al. Medication use in systemic lupus erythematosus. Journal Rheumatol. 2011;38(2):271–274. doi: 10.3899/jrheum.100414. [DOI] [PubMed] [Google Scholar]
- 13.Golder V, Kandane-Rathnayake R, Huq M, et al. Evaluation of remission definitions for systemic lupus erythematosus: A prospective cohort study. Lancet Rheumatol. 2019;1(2):e103–e110. doi: 10.1016/S2665-9913(19)30048-7. [DOI] [PubMed] [Google Scholar]
- 14.Petri M, Magder LS. Comparison of remission and lupus low disease activity state in damage prevention in a United States systemic lupus erythematosus cohort. Arthritis Rheumatol. 2018;70(11):1790–1795. doi: 10.1002/art.40571. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Tani C, Zucchi D, Haase I, et al. Are remission and low disease activity state ideal targets for pregnancy planning in systemic lupus erythematosus? A multicentre study. Rheumatology (Oxford) 2021;60(12):5610–5619. doi: 10.1093/rheumatology/keab155. [DOI] [PubMed] [Google Scholar]