Abstract
目的
鞘内镇痛药物的分布特点和目前置管技术的限制使传统的鞘内镇痛方法对头面部难治性疼痛无法发挥作用。本技术应用指南的制订旨在促进经脊柱椎间隙穿刺蛛网膜下腔脑桥前池置管药物输注技术的推广和规范、安全应用。
方法
工作小组采用改良德尔菲法,邀请本技术领域的10名专家对脑桥前池药物输注技术的相关议题进行3轮电子邮件函询及3轮现场会议讨论。
结果
针对脑桥前池药物输注技术的有效性和安全性,在技术原理、适应证和禁忌证、患者准备、脑桥前池置管手术规范、镇痛药物选择和剂量衔接、术后镇痛管理和并发症防治共7个议题形成一致意见(同意率≥80%)。
结论
脑桥前池药物输注镇痛技术应用于头面部难治性疼痛患者具有微创、安全、有效的优点,既可减轻长期罹受疼痛患者的痛苦,也能帮助一些患者保持人生最后一程的生活质量和生命尊严,值得在国内外相关专业领域推广和规范应用。
Keywords: 鞘内药物输注, 脑桥前池, 癌性疼痛, 神经病理性疼痛, 难治性疼痛, 头面部疼痛, 改良德尔菲法
Abstract
Objective
The distribution characteristics of intrathecal drugs and the limitation of current catheterization techniques make traditional intrathecal analgesic treatment nearly useless for refractory craniofacial pain, such as trigemina neuralgia. This technical guideline aims to promote the widespread and standardize the application of intra-prepontine cisternal drug delivery via spinal puncture and catheterization.
Methods
A modified Delphi approach was used to work for this guideline. On the issues related to the intra-prepontine cisternal targeted drug delivery technique, the working group consulted 10 experts from the field with 3 rounds of email feedback and 3 rounds of conference discussion.
Results
For the efficacy and safety of the intra-prepontine cisternal targeted drug delivery technique, a consensus was formed on 7 topics (with an agreement rate of more than 80%), including the principles of the technique, indications and contraindications, patient preparation, surgical specifications for intra-prepontine cisternal catheter placement, analgesic dosage coordination, analgesic management, and prevention and treatment of complications.
Conclusion
Utilizing the intra-prepontine cisternal drug infusion system to manage refractory craniofacial pain could provide advantages in terms of minimally invasive, secure, and effective treatment. This application can not only alleviate the suffering of individuals experiencing the prolonged pain but also support the maintenance of quality of life and dignity in their final moments, justifiing its widespread dissemination and standardized adoption in domestic and international professional fields.
Keywords: intrathecal drug delivery, prepontine cistern, cancer pain, neuropathic pain, refractory pain, craniofacial pain, modified Delphi
导 读
三叉神经痛是临床上常见的颌面部神经病理性疼痛疾病,疼痛呈间歇性暴发式发作,异常剧烈,被称作“天下第一痛”,严重影响患者的生活质量,造成社会及家庭的医疗负担。目前抗癫痫药物如卡马西平是治疗三叉神经痛的首选口服药物,但也存在不良反应较大和治疗效果不佳等问题。临床上其他主要的治疗方案如外科微血管减压手术、三叉神经半月神经节射频消融术或球囊压迫术、伽马刀等方法都是通过解除外周神经压迫或减少外周神经异常放电来缓解三叉神经痛,然而,三叉神经痛患者治疗后仍然有反复发作的情况。目前,三叉神经痛的发病机制尚未完全阐明,微创介入治疗方案有待改进。三叉神经痛的基础和临床研究从整体、细胞及分子水平阐明三叉神经痛的发生机制,寻找新的分子、细胞靶点和更有效的治疗途径,以期为患者提供更为科学、精准的治疗方案,同时为介入治疗方案的改进提供参考和依据。
在本期“三叉神经痛专题”中,我们组织了7篇关于三叉神经痛的基础和临床研究进展的论文,涉及三叉神经痛动物模型的研究进展、大鼠延髓背角A1型反应性星形胶质细胞激活与三叉神经痛慢性化的关系、经脊柱椎间隙穿刺蛛网膜下腔脑桥前池置管药物输注技术应用、首次经皮球囊压迫术与射频热凝术后再行经皮球囊压迫术治疗三叉神经痛的比较等。我们希望这些研究能够为从事三叉神经痛基础和临床研究的研究者提供重要的参考和潜在的研究方向。
(中南大学湘雅三医院 阎雪彬)
自1979年Wang等[1]首次将吗啡用于蛛网膜下腔治疗疼痛以来,鞘内靶向药物输注(intrathecal targeted drug delivery,ITDD)技术逐步被应用于顽固性疼痛治疗。鞘内药物的镇痛效价是口服用药的300倍,具有起效快、药物用量小和不良反应少等优点[2-3],成为疼痛治疗的“第4阶梯”选择[4-5]。由于脑脊液呈钟摆式运动,鞘内注射的药物仅分布在导管尖端的有限范围内,镇痛效果非常局限[4, 6-7]。另外,受目前鞘内置管技术的限制,镇痛药物无法被输送到头面部脑神经周围,传统的鞘内镇痛方法对头面部疼痛“无能为力”。
头面部癌痛发生率高达70%~86%,29%~44%的患者为中重度疼,易发生暴发痛,且常合并神经病理性疼痛,成为难治性疼痛[8-9]。而三叉神经痛是常见的头面部非癌性难治性疼痛,其发生率估计为0.3%[10]。为了缓解头面部疼痛,有病例报道[11-12]通过导管将镇痛药物输送到高位颈髓、枕大池、脚间池等更接近疼痛相关脑神经的位置。头面部及颅底与痛觉信息处理有关的神经有三叉神经、舌咽神经、面神经和迷走神经等,解剖结构上都位于脑桥前池附近。脑桥前池位于脑桥腹侧面和枕骨斜坡之间,此处平坦而宽阔,且向下延续为脊髓蛛网膜下腔[13],经脊柱穿刺蛛网膜下腔通路将导管尖端置于脑桥前池具有解剖可能性。
笔者团队数年来深入剖析脑桥前池的局部解剖结构,探索将药物输注导管经枕骨大孔置入脑桥前池的可行性,评估该技术对头面部难治性疼痛的治疗效果,并探讨镇痛药物在脑桥前池的分布特点和代谢特征[14-17]。迄今,该技术已经在全国各地完成30多例,缓解了患者对疼痛,改善了患者的生活质量,并建立了完善的管理制度和操作规程。笔者召集该领域的相关专家,采用改良德尔菲法(专家函询与现场会议结 合)[18-19]对脑桥前池药物输注技术的相关议题进行讨论、审查,旨在形成该技术的应用指南,促进该技术在国内外推广和规范应用。
1. 方 法
1.1. 制订计划书及平台注册
制订计划,成立工作小组,于国际实践指南注册与透明化平台(Practice Guideline REgistration for transPAREncy,PREPARE)注册并获取注册编号(PREPARE-2023CN310)。
1.2. 专家选择
改良德尔菲法包括专家团队选择、函询主题领域问题和在线讨论。虽然德尔菲法的最佳小组规模尚不清楚,但10~15名专家可以获得满意的结果[18]。被邀请的专家均对本技术领域具有广泛经验和专业知识,由参与该技术研究和施行的6家不同医院疼痛科的10名专家组成。
1.3. 一致意见的定义
至少80%的专家选择“同意”/“强烈同意”或“强烈不同意”/“不同意”的回答被定义为意见一致;同意率低于50%的意见不再讨论;同意率在50%~79%的意见需要在现场讨论中获取一致意见[20]。
1.4. 实施过程
改良德尔菲法是一种有效的指南或共识形成方法,适合证据或结果数据有限的情况,依赖于小组成员的专业知识来提高内容有效性,避免占主导地位的个人影响[21]。改良德尔菲法流程包含至少3轮电子邮件函询和3轮会议讨论。邮件函询意见回复为匿名,但会议讨论为公开形式。第1轮:由指南工作小组秘书进行全面的文献筛查和综述,并将总结报告和指南撰写计划通过邮件发送给10位专家,专家应邀在规定时间内完成审阅并创建至少5个与该技术有关的议题。在随后的现场会议中对这些议题进行讨论,通过审查的议题进入下一轮函询。第2轮:工作小组秘书将通过审查的议题进行整理,细化每个议题的内容,通过邮件发送给10位专家,要求匿名回复。在随后的现场会议中,根据专家的答案进行公开讨论。第3轮:将7个议题下的专家意见进行总结,再次函询专家。将专家反馈的意见或建议汇总后进行最后一次现场会议讨论,同意率低于50%的不予采纳,主要针对接近共识的议题(同意率50%~79%)进行讨论,形成一致性意见。通过3轮讨论形成一致意见,并请每一位专家审阅确认。
2. 结 果
2.1. 技术原理
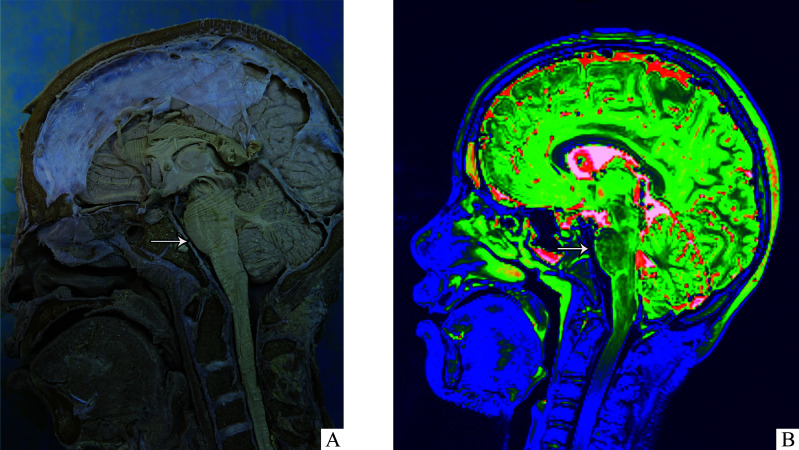
解剖基础:脑桥前池位于枕骨斜坡和脑桥腹侧之间,向下延续为延髓前池,通过枕骨大孔后延续为脊髓蛛网膜下腔(图1)。三叉神经、面神经、舌咽神经和迷走神经分别从脑桥、延髓腹外侧发出,经由脑桥前池、延髓前池穿过(图2)。
图1.
脑桥前池位置
Figure 1 Anatomy of the prepontine cistern
A: Sagittal plane of the prepontine cistern at autopsy; B: Sagittal plane of the head on MRI. The arrows indicate that the prepontine cistern locates at the ventral side of the pons with a relative wide space.
图2.
脑神经出颅部位解剖图
Figure 2 Anatomical view of cerebral nerves
Relationship between craniofacial nociception-related nerves and the prepontine cistern: V is the trigeminal nerve (V1 is the ophthalmic branch, V2 is the maxillary branch, and V3 is the mandibular branch). VII is the facial nerve. Ⅷ is the auditory nerve. IX is the glossopharyngeal nerve. X is the vagus nerve. The blue dotted line shows the possible position of the prepontine cistern.
理论基础:头面部和颅底的痛觉主要经三叉神经、舌咽神经、迷走神经和面神经传递。解剖结构显示这几对脑神经或其分支位于脑桥前池,或从脑桥前池穿过[22],因此药物通过脑桥前池的置入导管可局限于此处,直接作用于这些脑神经,快速发挥作用,减少药物剂量,降低药物不良反应,此为外周机制。μ-阿片受体在大脑皮质、纹状体、海马、蓝斑和脊髓背角等多个部位都有丰富的表达[23],脑神经及相应核团、脊髓背角和脑组织阿片受体的激活,可能是脑桥前池内药物作用的中枢机制。此外,脑桥前池给药可以覆盖多条脑神经包括外展神经、动眼神经和滑车神经,虽然这些脑神经为运动性脑神经,但是近年来有研究[24-25]表明动眼神经和滑车神经参与头面部神经病理性疼痛。
2.2. 适应证与禁忌证
2.2.1. 适应证
对难治性疼痛的治疗,强调重视鞘内药物镇痛的作用,不应将鞘内镇痛作为大剂量阿片类药物使用无效后的补救措施[5]。脑桥前池置管药物输注技术适用于经过规范药物治疗和/或其他介入技术治疗,仍然不能有效缓解的头面部难治性疼痛(包括癌性疼痛和难治性的非癌性疼痛)。根据Deer团队[26]和多学科疼痛专家共识会议(polyanalgesic consensus conference,PACC)[2]的定义,难治性疼痛指对影响疼痛的精神、心理社会因素进行评估和适当优化的前提下,目前临床上多种循证医学支持的合适的治疗方法均不能有效缓解和/或影响日常功能的,或不良反应无法忍受的疼痛;中国《难治性癌痛专家共识(2017年版)》[27]将难治性癌痛定义为:由肿瘤本身或治疗相关因素导致的中、重度疼痛,经过规范化药物治疗1~2周患者疼痛缓解仍不满意和/或不良反应不可耐受。
2.2.2. 禁忌证
禁忌证参考PACC专家共识和目前的《鞘内药物输注技术用于癌痛管理的中国专家共识(2022版)》[20]。绝对禁忌:不愿接受治疗的患者;严重感染或出血倾向者;由于肿瘤椎管内转移等可能影响脑脊液循环者。相对禁忌:患严重心理或精神疾病且未经相应治疗并得到改善者;药物成瘾者。对相对禁忌患者,需要反复全面评估。
2.3. 患者准备
2.3.1. 镇痛方案的制订
对接受脑桥前池内药物输注治疗的患者应进行全面评估和制订详细的方案。头面部疼痛常影响进食和睡眠,患者容易合并焦虑、抑郁情绪[28],术前有必要进行心理学评估和干预。对于晚期恶性肿瘤患者,镇痛治疗是姑息治疗和临终关怀的重要部分,是维护患者生命尊严的必要手段,同时有效的镇痛治疗可改善患者的饮食、睡眠,甚至可能延长患者的寿命[29]。对于病情稳定而残余慢性疼痛和非恶性肿瘤所致慢性疼痛的患者,应注重镇痛治疗的可持续性和规划性。因此,针对患者情况,在植入泵选择、药物滴定速度的调整和镇痛管理上应该制订个体化镇痛方案。
2.3.2. 术前准备
脑桥前池置管可以在局部麻醉或者全身麻醉下完成。术中需要在影像学指导下调节导管尖端位置且考虑患者的舒适化,建议在全身麻醉下完成脑桥前池的置管操作。术前应与患者及其家属反复沟通该技术方案的优缺点、预期效果及其可能产生的不良反应。完善相关检查和评估,注意关注凝血功能,通过影像学检查(CT或MRI扫描)排除椎管或者颅内阻塞性病变,了解穿刺路径。鞘内导管的材质要求软而有一定支撑,长度需要能超过腰椎到脑桥前池的长度,至少80 cm。药物输注装置根据镇痛方案可以选择半植入式或者全植入式。全植入式费用高,但便利性好,感染风险低;半植入式费用较低,但护理维护较繁杂,感染风险较高。预计生存期≤3个月的患者,根据其意愿、经济、疾病进展和疼痛控制需求等情况综合考虑;预计生存期>3个月的患者,推荐使用全植入式装置[20]。
2.4. 脑桥前池置管手术规范
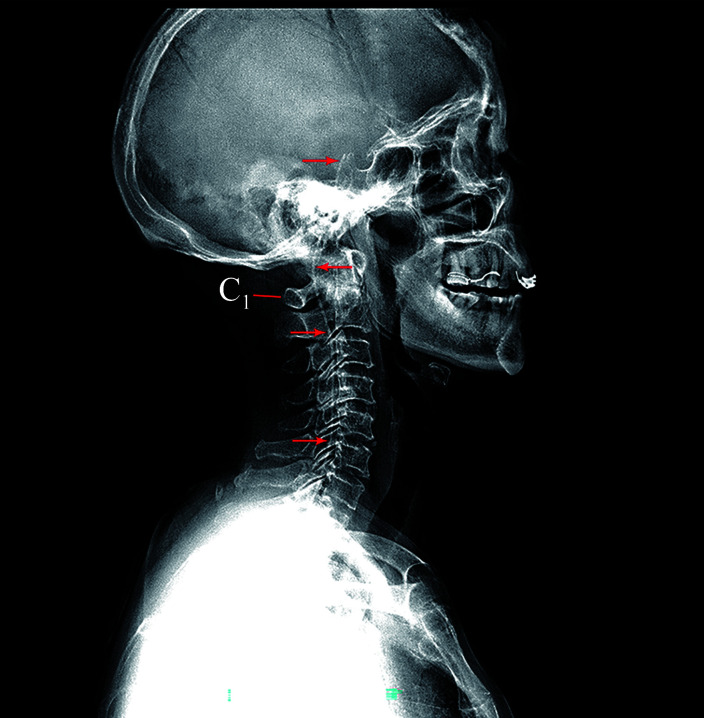
一般选择穿刺点位于L3~4或L2~3间隙,也可以选择T12~L1间隙。患者取左侧卧位,采用14-G Tuohy针进行穿刺,回抽有脑脊液证实到达蛛网膜下腔。经Tuohy针置入鞘内导管,在C型臂引导下缓慢推进导管,经腰、胸、颈段脊髓蛛网膜下腔,通过枕骨大孔,侧位片显示导管尖端位于斜坡,且回抽有脑脊液后,再次确认导管尖端位置(图3)。在连续X线引导下放置导管,尤其当导管尖端到达C1水平时,导管可能触碰周围骨性结构、结缔组织、脊髓延髓蛛网膜结构或其内的神经和血管,而上行受阻。如遇阻力,动作应轻柔并缓慢后退,调整方向后再缓慢、轻柔地移动导管,避免导管抵抗阻力。
图3.
术中全程X线引导置管定位
Figure 3 Intraoperative positioning of the intrathecal catheter under X-ray guidance throughout the operation
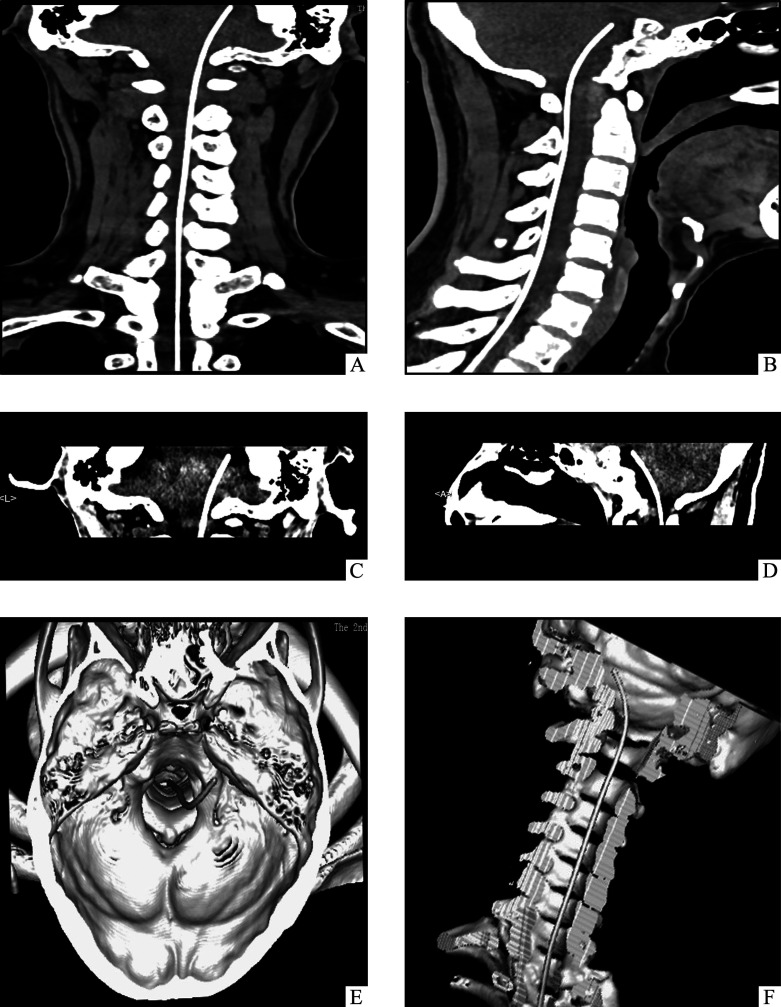
导管尖端到达目标位置并确认通畅后,在右上腹部(局部皮肤没有感染或者瘢痕)皮下做好囊袋并固定药物输注装置。为了防止发生因脑脊液漏而引起的低颅压头痛,术后要求患者卧床至少2 d。术后1周内行CT或MRI三维重建以确定导管尖端的位置以及其与周围结构的关系(图4)。
图4.
术后影像学检查脑桥前池内置管定位及三维重建
Figure 4 Postoperative imaging to confirm location of the catheter placement and three-dimensional reconstruction
A and B: Sagittal (A) and coronal (B) planes show the position of the intrathecal catheter. C and D:Sagittal (C) and coronal (D) planes of scanning demonstrate that the tip of intrathecal catheter is located at the level of posterior clinoid process. E: Skull base is reconstructed to reveal the location of the catheter. F: Three-dimensional reconstruction of catheter placement is performed by computed tomography.
2.5. 镇痛药物选择和剂量衔接
美国食品药品监督管理局批准用于鞘内输注的药物仅限于不含防腐剂的硫酸吗啡、齐考诺肽和巴氯芬。然而,需使用鞘内镇痛的患者通常病情复杂,常需要联合使用多种药物。PACC共识[2]和国内专家共识[20]对鞘内镇痛药物的推荐均包含了未被美国食品药品监督管理局批准的药物,如氢吗啡酮、芬太尼和舒芬太尼、可乐定、布比卡因等。由于脑桥前池内药物的作用效价是脊髓蛛网膜下腔的3~4倍[30],药物直接输注于脑池内,且吗啡仍然是最经典的鞘内镇痛的药物,故建议选择吗啡作为脑桥前池镇痛药物的一线用药。
参照枕大池和脑室吗啡的用法以及脑桥前池内阿片类药物的效价,使用口服剂量吗啡当量的 1/1 000作为初始剂量[31-32],以减少不良反应。在此基础上进行调节,以达到最低的剂量、最小的不良反应和最大的镇痛效果。可以参考的方案(半植入泵):配置镇痛泵时,吗啡质量-体积浓度为33 μg/mL,以0.1 mL/h的初始速率持续泵注;为应对暴发痛,自控剂量设置为0.1 mL,每30 min可追加1次。若持续痛控制不佳,可增加持续泵注量;若暴发痛控制不佳或者疼痛范围较大,可增加单次量。可参考疼痛数字分级评分法(Numerical Rating Scale,NRS)来调节剂量,该评分法的评分范围为1~10,经NRS评为轻度(≤3分)、中度(4~6分)和重度(≥7分)疼痛时,镇痛药物可分别增加<25%、25%~50%和51%~100%剂量。调整剂量期间,密切关注患者的呼吸抑制、神志改变等情况。脑桥前池靶向药物输注系统的剂量可缓慢增加,同时全身性用药剂量逐渐降低[33],根据个体情况,实现全身性镇痛药物向脑桥前池内药物的转换。
2.6. 术后镇痛管理
2.6.1. 药物输注设备管理
半植入式设备尤其注重护理,应严格无菌操作,防止感染。若蝶形针或者输液导管接头脱落,建议更换。蝶形针和患者自控镇痛(patient-controlled analgesia,PCA)药盒应在15 d内进行,更换时要详细询问患者是否有发热、头痛等情况,必要时进行血常规和炎症指标检测。全植入泵设备的药物再灌注和管理必须由经过培训的医师实施,严格无菌操作[4, 20, 34]。
2.6.2. 疼痛管理
当镇痛效果不佳时或者疼痛发生突然改变时,需要寻找原因,排查导管是否折叠、脱落、堵塞或者下移,必要时通过影像学检查确认;检查泵是否功能正常及药物输注参数。同时需要结合患者病情进行综合分析,如病情是否发生进展、扩散或者转移,密切关注患者的情绪、睡眠及心理状况。
2.7. 并发症防治
2.7.1. 操作和装置相关并发症
2.7.1.1. 体位性头痛
可能与脑脊液漏导致的低颅压有关,建议术后常规卧床2 d,进行补液和对症治疗,避免多次反复穿刺[33]。
2.7.1.2. 出血和血肿
关注患者凝血功能,术中的操作尽可能轻柔,遇阻力立刻停止。若出现术后肌力改变,需考虑椎管内血肿的可能,采用CT/MRI进行排查。与手术操作有关的出血和血肿还包括穿刺部位出血、脑内血肿、脑干出血等,虽然较少发生,但是仍需密切关注。
2.7.1.3. 感染
与导管置入手术、蝶形针、连接管道以及镇痛泵的护理有关。术前使用抗生素预防感染,监测植入部位是否有红、肿、热、痛和炎症指标。若出现寒战发热、呕吐、颈部强直、头痛等症状,需警惕脑膜炎。发生感染时,积极给予抗生素治疗,必要时取出植入设备。
2.7.1.4. 置入装置相关问题
装置故障包括导管打折、移位、脱开、脱落,药物渗漏,泵故障和输注港移位等,应及时发现,并进行手术修复或更换。
2.7.2. 药物相关不良反应
最常见的不良反应为意外药物过量引起的呼吸抑制,必须加强对镇痛泵的规范管理。与全身阿片类药物相似,恶心呕吐和尿潴留是常见的不良反应,但是发生率较全身用药明显降低[4];其他不良反应如瘙痒、阿片类药物诱导的痛觉过敏,可通过调整剂量或停药缓解。
3. 讨 论
本研究采用改良德尔菲法形成技术应用指南。德尔菲法又称专家调查法,是由工作小组按照设定好的程序向专家组成员进行函询,经过反复征询和反馈,最终形成一致意见,是指南或者专家共识形成的常用方法[21]。由于是匿名收集意见,德尔菲法可以避免参与专家被学术地位最权威或学术造诣最高的人影响。但是经典的德尔菲法,可能受到参与专家主观因素的影响。因此,本工作小组参考文献[18],采用改良德尔菲法,即函询与现场会议相结合的形式,经过3轮函询-现场会议,最终形成意见。
鞘内药物输注技术是难治性疼痛的有效治疗方法,但是药物在蛛网膜下腔分布的空间局限性,限制了该技术的应用范围。近年来,应用MRI技术对脑脊液运动的观察[35]显示:脑脊液的运动方式为钟摆式振荡分布,向头尾方向振荡,受心动周期、呼吸运动驱动;而脑脊液的“循环净运动”或固定方向循环流动的“体流”并未观察到。这与传统认知完全不同,也解释了鞘内导管必须达到对应的脊髓节段位置,镇痛作用才有效的现象。
笔者团队的多项研究[14-17]证实了从腰椎段蛛网膜下腔至脑桥前池置管技术的可行性,所有患者均在C形臂X线引导下经腰椎蛛网膜下腔穿刺将导管成功放置到脑桥前池。在临床接受治疗的30多例患者均获得了大于50%的疼痛缓解。患者治疗前有严重的疼痛和频繁发作的暴发痛,NRS疼痛评分高达7~9,镇痛药物消耗高达790 mg吗啡当量,或者存在难以耐受的不良反应,如头晕、恶心、呕吐、便秘和成瘾等。最终,所有患者脑桥前池置管成功,脑池内药物输注开启后疼痛立即得到不同程度的缓解。在开始治疗后的1周~1个月,所有患者均完成全身性阿片类药物向脑池内药物输注的转换,最短脱离口服药物时间在治疗后1周,患者依靠脑桥前池内药物输注即可获得良好的疼痛控制。鞘内使用的吗啡用量与患者术前吗啡使用量转化率为300꞉1~500꞉1,患者的生活质量和睡眠状况得到极大改善[14, 16-17]。
操作的安全性是任何技术需要考虑的问题。脑桥前池内有血管、神经及结缔组织通过,且位于颅内,任何血管损伤引起的出血都可能带来严重的后果。随着科技的发展和鞘内导管材质的更新迭代,目前市面上使用的导管,误伤血管和神经的风险很低,但是仍需保持警惕。选择尖端柔软且柔韧性强的导管,在连续X线引导下缓慢小心地操作是有必要的。目前该技术在置管操作中未发生导管误伤血管神经等不良反应或并发症,因此,在小心谨慎、规范操作的前提下,脑桥前池置管安全可行。
脑桥前池导管置入成功的关键是确认导管尖端的位置。侧位片上导管尖端定位于脑桥腹侧与枕骨斜坡之间,此处脑脊液流动性不强,药物停留时间更长;且三叉神经等由此穿过,在此处给药,药物可以迅速与阿片受体结合[6]。除了在脑桥前池内的深度,鞘内导管的尖端是否必须放置在脑桥前池间隙的痛侧,值得探讨[16]。因为空间有限,脑桥前池处药物输注可以通过脑脊液向对侧扩散,可能最终会达到两侧药物浓度相同。笔者团队的一项研究[14]也证实,脑桥前池内药物输注确实会向对侧扩散,但是24 h后两侧的药物扩散是有差异的,是否与扩散时间不够有关,尚不明确。关于痛侧和对侧给药镇痛效果是否会达到一致,药物的扩散是否会随着时间的延长而达到均衡,值得进一步研究。
脑桥前池输注药物的代谢特征比较复杂,对于与口服药物的效价换算,目前没有共识[36-37]。脑桥前池内输注的阿片类药物,可以通过与脑神经结合的外周机制发挥作用,也可能通过中枢性机制发挥镇痛作用[23]。此外,患者的个体化因素也影响鞘内药物作用的分布和代谢,可能与个体蛛网膜下腔的解剖差异,脑脊液压力、密度、容量,药物输注速率以及导管内径等有关[37]。因此,对于脑桥前池内药物治疗的初始剂量,建议选择较小一点的安全剂量,使用口服剂量1/1 000作为初始剂量,以减少不良反应,之后逐步滴定,实现口服药物向鞘内用药的转换。结果显示此剂量无明显不良反应,镇痛效果明显。
尽管初步的研究[14]揭示了脑桥前池内给药的造影分布特点,但是仍然有很多问题值得研究和探讨。一方面,脑桥前池内阿片类药物的代谢特点、阿片类药物合并其他药物代谢的特点、镇痛药物和输注系统参数的关系(如速率、容量、药物浓度、导管内径等),以及高度可变的患者个体差异,都是值得研究的方向;另一方面,因为血脑屏障的存在,药物难以到达肿瘤位置,颅脑肿瘤的治疗效果往往不佳,脑桥前池药物输注系统是否对这类患者具有潜在的应用前景,也值得关注与探索。
综上,对于三叉神经痛等头面部难治性疼痛患者来说,脑桥前池药物输注镇痛技术微创、有效。虽然仍需要大规模多中心的研究进一步促进该技术的临床评价和完善,但是笔者团队欣慰于在安全的范围内,可减轻长期罹受疼痛患者的痛苦,也帮助一些患者保持人生最后阶段的生活质量和生命尊严。“天下无痛”是每一位疼痛从业者的心愿,这也是笔者团队希望促进该技术规范推广的初衷。笔者团队采用改良德尔菲法,形成本技术指南,以期更早、更优质地服务于患者,也将继续跟踪进展,并进行相关研究,促进该技术应用的更新。
基金资助
湖南省重点研发计划(2020SK2079);湖南省卫生健康委员会科研计划课题(202104112304)。This work was supported by the Key Research and Development Program of Hunan Province (2020SK2097) and the Scientific Research Project of Health Commission of Hunan Province (202104112304), China.开放获取(Open access):本文遵循知识共享许可协议,允许第三方用户按照署名-非商业性使用-禁止演绎4.0(CC BY-NC-ND 4.0)的方式,在任何媒介以任何形式复制、传播本作品(<ext-link>https://creativecommons.org/licenses/by-nc-nd/4.0/</ext-link>)。
利益冲突声明
作者声称无任何利益冲突。
作者贡献
李欣宁 研究实施,数据整理与分析,论文撰写与修改;王亚平 研究设计与指导,工作协调,技术支持,论文修改;邹定全、张伟、李欣、贺佩瑶 研究实施,工作协调,数据整理与分析;周浩宬、杨彤飚、朱钧、洪波、张宇 研究实施,论文修改;肖艳英 研究设计与指导,工作协调,数据整理与分析,论文撰写与修改。所有作者阅读并同意最终的文本。
Footnotes
http://dx.chinadoi.cn/
原文网址
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2024011.pdf
参考文献
- 1. Wang JK, Nauss LA, Thomas JE. Pain relief by intrathecally applied morphine in man[J]. Anesthesiology, 1979, 50(2): 149-151. 10.1097/00000542-197902000-00013. [DOI] [PubMed] [Google Scholar]
- 2. Deer TR, Hayek SM, Pope JE, et al. . The polyanalgesic consensus conference (PACC): recommendations for trialing of intrathecal drug delivery infusion therapy[J]. Neuromodulation, 2017, 20(2): 133-154. 10.1111/ner.12543. [DOI] [PubMed] [Google Scholar]
- 3. 曹启旺, 黄东, 徐慧巧, 等. 普瑞巴林联合鞘内输注舒芬太尼治疗骨转移癌爆发痛的临床研究[J]. 中南大学学报(医学版), 2014, 39(4): 384-388. 10.11817/j.issn.1672-7347.2014.04.011. [DOI] [PubMed] [Google Scholar]; CAO Qiwang, HUANG Dong, XU Huiqiao, et al. . Pregabalin combined with intrathecal sufentanil infusion for breakthrough pain in patients with bone metastases[J]. Journal of Central South University. Medical Science, 2014, 39(4): 384-388. 10.11817/j.issn.1672-7347.2014.04.011. [DOI] [PubMed] [Google Scholar]
- 4. Dupoiron D, Duarte R, Carvajal G, et al. . Rationale and recent advances in targeted drug delivery for cancer pain: is it time to change the paradigm?[J]. Pain Physician, 2022, 25(3): E414-E425. [PubMed] [Google Scholar]
- 5. Hochberg U, Ingelmo P, Solé E, et al. . Early interventional treatments for patients with cancer pain: a narrative review[J]. J Pain Res, 2023, 16: 1663-1671. 10.2147/JPR.S405808. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Tangen KM, Leval R, Mehta AI, et al. . Computational and in vitro experimental investigation of intrathecal drug distribution: parametric study of the effect of injection volume, cerebrospinal fluid pulsatility, and drug uptake[J]. Anesth Analg, 2017, 124(5): 1686-1696. 10.1213/ANE.0000000000002011. [DOI] [PubMed] [Google Scholar]
- 7. Hunt MA, Hunt SAC, Edinger K, et al. . Refinement of intrathecal catheter design to enhance neuraxial distribution[J]. J Neurosci Methods, 2024, 402: 110006. 10.1016/j.jneumeth.2023.110006. [DOI] [PubMed] [Google Scholar]
- 8. Aghajanzadeh S, Karlsson T, Tuomi, et al. . Facial pain, health-related quality of life and trismus-related symptoms up to 5years post-radiotherapy for head and neck cancer[J]. Support Care Cancer, 2023, 31(12): 699. 10.1007/s00520-023-08162-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Khawaja S, Bavarian R, Abdul Rehman S, et al. . Head and neck cancer-related pain: a descriptive analysis of the pain phenotypes[J]. J Pain Res, 2023, 16: 2919-2927. 10.2147/JPR.S411285. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Cruccu G, Di Stefano G, Truini A. Trigeminal neuralgia[J]. N Engl J Med, 2020, 383(8): 754-762. 10.1056/nejmra1914484. [DOI] [PubMed] [Google Scholar]
- 11. Fu F, Jiang XF, Wang JJ, et al. . Interpeduncular cistern intrathecal targeted drug delivery for intractable postherpetic neuralgia: a case report[J]. World J Clin Cases, 2023, 11(30): 7380-7385. 10.12998/wjcc.v11.i30.7380. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Moman RN, Rogers JM, Pittelkow TP. High cervical intrathecal targeted drug delivery: a case report of refractory oropharyngeal cancer pain[J]. Case Rep Oncol Med, 2019, 2019: 2098921. 10.1155/2019/2098921. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Chichorro JG, Porreca F, Sessle B. Mechanisms of craniofacial pain[J]. Cephalalgia, 2017, 37(7): 613-626. 10.1177/0333102417704187. [DOI] [PubMed] [Google Scholar]
- 14. Zhou H, Zou D, Hong B, et al. . Gadolinium-based MR cisternography with prepontine cisternal routine for evaluating distribution pattern of intrathecal targeted drug delivery in pain management[J]. Drug Deliv, 2023, 30(1): 2189588. 10.1080/10717544.2023.2189588. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. 费若楠, 邹定全, 张伟, 等. 经腰骶蛛网膜下腔入路吗啡泵脑桥前池置管的解剖学可行性及其在头面部癌痛患者中的应用 [J] 中华疼痛学杂志,2022, 18(3): 319-324. 10.3760/cma.j.cn101658-20210414-00053. [DOI] [Google Scholar]; FEI Ruonan, ZOU Dingquan, ZHANG Wei, et al. . Anatomical feasibility of morphine pump catheter placement into the anterior pontine cistern via lumbosacral subarachnoid approach and the clinical application for patients with cancer-related craniofacial pain[J]. Chinese Journal of Painology, 2022, 18(3): 319-324. 10.3760/cma.j.cn101658-20210414-00053. [DOI] [Google Scholar]
- 16. Zhou H, Huang D, Zou D, et al. . Prepontine cisternal routine for intrathecal targeted drug delivery in craniofacial cancer pain treatment: technical note[J]. Drug Deliv, 2022, 29(1): 3213-3217. 10.1080/10717544.2022.2134507. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. Zou D, Zhang W, Wang Y. Prepontine cistern intrathecal targeted drug delivery for cancer-related craniofacial pain[J]. Pain Med, 2021, 22(12): 3112-3114. 10.1093/pm/pnab059. [DOI] [PubMed] [Google Scholar]
- 18. Azimaraghi O, Bilal M, Amornyotin S, et al. . Consensus guidelines for the perioperative management of patients undergoing endoscopic retrograde cholangiopancreatography [J]. Br J Anaesth, 2023, 130(6): 763-772. 10.1016/j.bja.2023.03.012. [DOI] [PubMed] [Google Scholar]
- 19. 彭慕云, 喻风雷. 基于德尔菲法构建胸外科手术难度评价量表[J]. 中南大学学报(医学版), 2022, 47(5): 655-664. 10.11817/j.issn.1672-7347.2022.200782. [DOI] [PMC free article] [PubMed] [Google Scholar]; PENG Muyun, YU Fenglei. Establishment of Thoracic Surgical Difficulty Assessment Scale based on Delphi method[J]. Journal of Central South University. Medical Science, 2022, 47(5): 655-664. 10.11817/j.issn.1672-7347.2022.200782. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. 冯智英, 王昆, 金毅, 等. 鞘内药物输注技术用于癌痛管理的中国专家共识(2022版)[J]. 中华疼痛学杂志, 2022, 8(5): 579-589. 10.3760/cma.j.cn101658-20220208-00140. [DOI] [Google Scholar]; FENG Zhiying, WANG Kun, JIN Yi, et al. . Expert consensus on intrathecal drug delivery technology for cancer pain management in China(2022)[J]. Chinese Journal of Painology, 2022, 8(5): 579-589. 10.3760/cma.j.cn101658-20220208-00140. [DOI] [Google Scholar]
- 21. Diamond IR, Grant RC, Feldman BM, et al. . Defining consensus: a systematic review recommends methodologic criteria for reporting of Delphi studies[J]. J Clin Epidemiol, 2014, 67(4): 401-409. 10.1016/j.jclinepi.2013.12.002. [DOI] [PubMed] [Google Scholar]
- 22. Piekartz HV, van der Meer H, Olivo SA. Craniofacial disorders and headaches. A narrative review[J]. Musculoskelet Sci Pract, 2023, 66: 102815. 10.1016/j.msksp.2023.102815. [DOI] [PubMed] [Google Scholar]
- 23. Li L, Chen J, Li YQ. The downregulation of opioid receptors and neuropathic pain[J]. Int J Mol Sci, 2023, 24(6): 5981. 10.3390/ijms24065981. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24. Akhondian J, Ashrafzadeh F, Seilanian Toosi F, et al. . Recurrent painful ophthalmoplegic neuropathy with unilateral oculomotor and trochlear nerve palsy in an 8-year-old girl[J]. J Binocul Vis Ocul Motil, 2022, 72(4): 199-204. [PubMed] [Google Scholar]
- 25. Nandana J, Nair SS, Girdhar S, et al. . Recurrent painful ophthalmoplegic neuropathy: a cause for recurrent third nerve palsy in a child[J/OL]. BMJ Case Rep, 2021, 14(11): e246179[2023-12-22]. 10.1136/bcr-2021-246179. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Deer TR, Caraway DL, Wallace MS. A definition of refractory pain to help determine suitability for device implantation[J]. Neuromodulation, 2014, 17(8): 711-715. 10.1111/ner.12263. [DOI] [PubMed] [Google Scholar]
- 27. 王昆, 金毅. 难治性癌痛专家共识(2017年版)[J]. 中国肿瘤临床, 2017, 44(16): 787-793. 10.3969/j.issn.1000-8179.20107.16.714. [DOI] [Google Scholar]; WANG Kun, JIN Yi. Expert consensus on refractory cancer pain (2017 edition)[J]. Chinese Journal of Clinical Oncology, 2017, 44(16): 787-793. 10.3969/j.issn.1000-8179.20107.16.714. [DOI] [Google Scholar]
- 28. Ren JL, Rojo RD, Perez JVD, et al. . Variations in pain prevalence, severity, and analgesic use by duration of survivorship: a cross-sectional study of 505 post-treatment head and neck cancer survivors[J]. BMC Cancer, 2021, 21(1): 1304. 10.1186/s12885-021-09024-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29. Yalamuru B, Weisbein J, Pearson ACS, et al. . Minimally-invasive pain management techniques in palliative care[J]. Ann Palliat Med, 2022, 11(2): 947-957. 10.21037/apm-20-2386. [DOI] [PubMed] [Google Scholar]
- 30. Dupoiron D. Targeted drug delivery (intrathecal and intracranial) for treatment of facial pain[J]. Prog Neurol Surg, 2020, 35: 181-193. 10.1159/000509623. [DOI] [PubMed] [Google Scholar]
- 31. Sun C, Wang YT, Dai YJ, et al. . Programmable pump for intrathecal morphine delivery to cisterna Magna: clinical implications in novel management of refractory pain above middle thoracic vertebrae level utilizing a prospective trial protocol and review[J/OL]. Anesth Pain Med, 2021, 11(3): e115873[2023-10-18]. 10.5812/aapm.115873. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32. Staquet H, Dupoiron D, Nader E, et al. . Intracerebroventricular pain treatment with analgesic mixtures including ziconotide for intractable pain[J/OL]. Pain Physician, 2016, 19(6): E905-E915[2023-10-18]. https://www.painphysicianjournal.com/linkout?issn=&vol=19&page=E905. [PubMed] [Google Scholar]
- 33. Duarte R, Copley S, Nevitt S, et al. . Effectiveness and safety of intrathecal drug delivery systems for the management of cancer pain: a systematic review and meta-analysis[J]. Neuromodulation, 2023, 26(6): 1126-1141. 10.1016/j.neurom.2022.03.003. [DOI] [PubMed] [Google Scholar]
- 34. Deer TR, Pope JE, Hayek SM, et al. . The polyanalgesic consensus conference (PACC): recommendations on intrathecal drug infusion systems best practices and guidelines[J]. Neuromodulation, 2017, 20(2): 96-132. 10.1111/ner.12538. [DOI] [PubMed] [Google Scholar]
- 35. Henry-Feugeas MC, Idy-Peretti I, Baledent O, et al. . Origin of subarachnoid cerebrospinal fluid pulsations: a phase-contrast MR analysis[J]. Magn Reson Imaging, 2000, 18(4): 387-395. 10.1016/s0730-725x(99)00142-3. [DOI] [PubMed] [Google Scholar]
- 36. Bhatia G, Lau ME, Koury KM, et al. . Intrathecal Drug Delivery (ITDD) systems for cancer pain[J]. F1000Res, 2013, 2: 96. 10.12688/f1000research.2-96.v4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37. Sindt JE, Odell DW, Tariq R, et al. . Initial intrathecal dose titration and predictors of early dose escalation in patients with cancer using a 100: 1 oral to intrathecal morphine conversion ratio[J]. Neuromodulation, 2021, 24(7): 1157-1166. 10.1111/ner.13517. [DOI] [PubMed] [Google Scholar]