Abstract
目的
通过建立大鼠牙周炎模型,探讨生物钟蛋白Bmal1对慢性牙周炎相关肾损伤的影响。
方法
将12只雄性Wistar大鼠随机分为对照组和牙周炎组,每组6只。采用正畸结扎丝对牙周炎组大鼠双侧上颌第一磨牙进行结扎处理,对照组大鼠不进行任何干预措施。8周后,检测2组大鼠的牙周临床指标,包括牙周探诊深度、牙龈出血指数和牙齿松动度。采用Micro-CT对大鼠上颌骨进行扫描和三维图像重建,评估牙槽骨吸收情况。采用苏木精-伊红(HE)和过碘酸雪夫(PAS)染色对牙周组织和肾组织进行病理学观察。采用生化试剂盒检测肾脏功能指标肌酐、白蛋白、血尿素氮的水平,以及氧化应激指标超氧化物歧化酶、谷胱甘肽和丙二醛的水平。MitoSOX red染色检测肾组织内活性氧(ROS)含量。实时荧光定量聚合酶链反应(RT-qPCR)和免疫组织化学染色检测大鼠肾组织中Bmal1、核因子-E2相关因子2(Nrf2)和血红素加氧酶1(HO-1)的基因及蛋白表达水平。
结果
与对照组相比,牙周组织Micro-CT及HE染色结果显示,牙周炎组上颌第一磨牙区出现明显的骨吸收和附着丧失;肾组织HE及PAS染色结果表明,牙周炎组大鼠肾组织有显著的组织病理损伤;肾功能和氧化应激指标结果显示,牙周炎组的氧化应激水平出现异常而肾功能指标无明显异常;MitoSOX red结果显示,牙周炎组肾组织内ROS含量升高;RT-qPCR和免疫组织化学结果显示,牙周炎组肾组织内Bmal1、Nrf2和HO-1表达水平降低。
结论
生物钟蛋白Bmal1在牙周炎大鼠肾脏的氧化损伤过程中发挥重要作用。
Keywords: 牙周炎, 肾损伤, 昼夜节律, 氧化应激, 生物钟蛋白Bmal1
Abstract
Objective
To investigate the mechanism of circadian clock protein Bmal1 (Bmal1) on renal injury with chronic periodontitis, we established an experimental rat periodontitis model.
Methods
Twelve male Wistar rats were randomly divided into control and periodontitis groups (n=6, each group). The first maxillary molars on both sides of the upper jaw of rats with periodontitis were ligated by using orthodontic ligature wires, whereas the control group received no intervention measures. After 8 weeks, clinical periodontal parameters, including probing depth, bleeding index, and tooth mobility, were evaluated in both groups. Micro-CT scanning and three-dimensional image reconstruction were performed on the maxillary bones of the rats for the assessment of alveolar bone resorption. Histopathological observations of periodontal and renal tissues were conducted using hematoxylin-eosin (HE) and periodic acid-Schiff (PAS) staining. Renal function indicators, such as creatinine, albumin, and blood urea nitrogen levels, and oxidative stress markers, including superoxide dismutase, glutathione, and malondialdehyde levels, were measured using biochemical assay kits. MitoSOX red staining was used to detect reactive oxygen species (ROS) content in the kidneys. The gene and protein expression levels of Bmal1, nuclear factor erythroid 2-related factor 2 (Nrf2), and heme oxygenase-1 (HO-1) in rat renal tissues were assessed using real-time quantitative polymerase chain reaction (RT-qPCR) and immunohistochemical staining.
Results
Micro-CT and HE staining results showed significant bone resorption and attachment loss in the maxillary first molar region of the periodontitis group. Histological examination through HE and PAS staining revealed substantial histopathological damage to the renal tissues of the rats in the periodontitis group. The findings of the assessment of renal function and oxidative stress markers indicated that the periodontitis group exhibited abnormal levels of oxidative stress, whereas the renal function levels showed abnormalities without statistical significance. MitoSOX Red staining results showed that the content of ROS in the renal tissue of the periodontitis group was significantly higher than that of the control group, and RT-qPCR and immunohistochemistry results showed that the expression levels of Bmal1, Nrf2, and HO-1 in the renal tissues of the rats in the periodontitis group showed a decreasing trend.
Conclusion
Circadian clock protein Bmal1 plays an important role in the oxidative damage process involved in the renal of rats with periodontitis.
Keywords: periodontitis, renal injury, circadian rhythm, oxidative stress, circadian clock protein Bmal1
牙周炎是一种由龈下微生物感染引发的局部炎症,如未及时治疗会造成牙齿支持组织的破坏,从而引起生活质量降低,并可能引发全身性炎症反应。研究[1]表明,牙周炎与糖尿病、心血管疾病以及慢性肾病(chronic kidney disease,CKD)等系统性疾病存在关联。近年来,探究牙周炎对肾脏的结构和功能产生的影响已成为现阶段研究的热题。一项调查[2]显示,CKD患者患有严重的牙周疾病时,更容易演变成严重的CKD。另一项研究报告[3]指出,血液透析的肾病患者的牙槽骨丧失风险显著高于正常人。Fang等[4]研究发现,牙周治疗不仅可以减轻牙周炎症还可以改善肾功能,进一步支持牙周疾病与CKD之间存在联系的假设。这些研究表明牙周炎与CKD之间存在显著关联。然而,目前尚未明确这两种疾病之间关联的具体机制。
在大脑外,肾脏维持着仅次于肝脏的第二大昼夜节律基因表达节律[5]。这一节律系统在肾脏的代谢、分泌和排泄等生理过程发挥着积极作用。研究[6]发现可能由于CKD患者的昼夜节律系统被破坏,从而引起肾脏功能进一步恶化。生物钟蛋白Bmal1是驱动昼夜节律的分子机制的重要转录因子。如今Bmal1的功能不仅限于核心时钟基因调控,还参与调节氧化应激、炎症等多种病理生理过程[7]–[8]。体内外实验发现,Bmal1通过调节核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/血红素加氧酶1(heme oxygenase-1,HO-1)信号分子抵御氧化应激所引起的损伤,从而减少尿草酸钙结石的形成。这一发现强调了生物钟基因在调节细胞氧化应激反应和维持细胞稳态中的重要作用。其中Nrf2/HO-1信号分子被认为是细胞内最主要的抗氧化防御系统之一[9]–[10]。此外,抗氧化剂白藜芦醇可以通过激活Nrf2/HO-1介导的信号传导来改善牙周炎和肾损伤[11]–[12]。然而,至今尚不清楚Bmal1、Nrf2、HO-1如何参与慢性牙周炎模型中肾损伤的过程,因此,本研究旨在探讨Bmal1在牙周炎模型大鼠肾损伤中的作用,对于牙周炎大鼠相关肾损伤的研究具有重要意义。
1. 材料和方法
1.1. 实验动物、主要试剂和仪器
本实验已获得吉林大学动物伦理福利委员会的批准(SY202306050),并在吉林大学实验动物研究中心开展,购入6周龄SPF级别的12只雄性Wistar大鼠(辽宁长生生物技术股份有限公司),饲养条件严格按照GB14925进行。
MitoSOX red试剂(Thermo Fisher Science公司,美国),BCA试剂盒、逆转录试剂盒(TaKaRa公司,日本),Bmal1抗体(Abcam公司,美国),Nrf2抗体、HO-1抗体(武汉塞维尔生物科技有限公司),通用SP试剂盒(北京中杉金桥生物技术有限公司),Micro-CT系统(SCANCO公司,瑞士),聚合酶链反应(polymerase chain reaction,PCR)扩增仪MX3005P(AgILent公司,美国)。
1.2. 构建大鼠牙周炎模型
将12只大鼠随机分为对照组和牙周炎组,每组6只。在经过1周的适应性喂养后,使用0.2 mm正畸结扎丝对牙周炎组大鼠双侧上颌第一磨牙进行结扎,并在饲养过程中对结扎丝进行检查,如发现有脱落则重新进行结扎。对照组大鼠不进行任何干预措施。8周后,使用相机拍摄大鼠口内照片并检查记录大鼠牙周临床指标,随后腹腔注射2%戊巴比妥钠进行处死,迅速收取组织用于后续的实验。
1.3. 检查大鼠牙周临床指标
由一名实验员观察并记录每只大鼠上颌第一磨牙牙龈的色泽、质地和形态以及牙周临床指标。牙周临床指标包括牙周探诊深度(probing depth,PD)、牙龈出血指数(bleeding index,BI)、牙齿松动度(tooth mobility,TM)。检查PD时,使用合适大小的牙周探针轻轻探入上颌第一磨牙的龈沟或袋底,检测并记录颊腭侧的近中、中央和远中6个位点的牙周袋深度,计算平均值[13]。根据Mazza的标准将牙龈出血指数划分为六级:0=牙龈健康,无炎症和出血;1=牙龈色泽呈现出炎症性变化,而探诊不出血;2=探诊后出现点状出血;3=探诊出血沿牙龈缘扩散;4=出血流满并溢出龈沟;5=自动出血。松动度检查时,将镊子并拢置于第一磨牙颌面中央窝,向颊腭、近远中及垂直方向上摇动,观察并记录牙齿的松动度。松动度评判标准为:Ⅰ度,仅颊腭方向松动;Ⅱ度,颊腭及近远中方向松动;Ⅲ度,颊腭、近远中和垂直方向均松动。
1.4. Micro-CT分析
采用Micro-CT对大鼠上颌骨进行扫描和三维图像重建。选取第一磨牙与第二磨牙之间的骨质,对该区域的骨小梁厚度(trabecular thickness,Tb.Th)、骨体积/总体积(bone volume/total volume,BV/TV)和骨密度(bone mineral density,BMD)进行计算分析。测量第一磨牙近中、远中及中央的釉牙骨质界(cement-enamel junction,CEJ)到牙槽嵴顶(alveolar bone crest,ABC)的距离,并计算三者的平均值,以评估牙周炎大鼠牙槽骨吸收情况。
1.5. 苏木精-伊红(hematoxylin-eosin,HE)染色
将经多聚甲醛固定好的大鼠上颌骨置于碱性的脱钙液中进行脱钙处理,随后脱水、透明、浸蜡包埋和切片;同样肾组织经固定后按上述步骤制成石蜡切片。按照常规步骤,对2组大鼠牙周组织和肾组织的切片进行HE染色后,光学显微镜下观察牙周组织和肾组织形态结构特点并拍摄记录。
1.6. 过碘酸雪夫(periodic acid-schiff,PAS)染色
将制作好的肾组织石蜡切片脱蜡至水,根据PAS试剂盒的步骤进行染色后中性树胶封片,光学显微镜下观察并拍摄肾小球和肾小管的病理变化。
1.7. 生化试剂盒检测肾功能和氧化应激指标水平
称取50 mg新鲜肾组织,加入500 µL生理盐水,冰上匀浆(75 Hz、30 s、3次),取上清,BCA试剂盒测定蛋白浓度后,采用肾脏功能检测试剂盒检测大鼠血清中肌酐、白蛋白和血尿素氮水平,超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)和丙二醛(malondialdehyde,MDA)试剂盒检测氧化应激指标SOD、GSH和MDA的水平。
1.8. MitoSOX red染色
将肾组织冰冻切片室温放置1 h后,每张切片滴加稀释后的MitoSOX red试剂50 µL,37 °C环境下暗盒孵育10 min,滴加稀释后的Hochest试剂50 µL,暗盒内孵育5 min后封片,荧光倒置显微镜下观察肾组织内活性氧(reactive oxygen species,ROS)含量并拍摄记录。
1.9. 实时荧光定量PCR(quantitative real-time polymerase chain reaction,RT-qPCR)
使用Trizol法提取新鲜肾组织中的RNA,按照逆转录试剂盒说明将RNA逆转录成cDNA后进行RT-qPCR实验。每个样本设置2个复孔,重复3次实验,内参基因为β-actin,检测Bmal1、Nrf2和HO-1的mRNA表达情况。PCR引物序列见表1。采用2−ΔΔct法计算基因相对表达量。
表 1. PCR引物序列.
Tab 1 PCR primer sequences
| 基因 | 引物序列(5′-3′) | 基因号 |
| β-actin | F:GGAGATTACTGCCCTGGCTCCTA | NM_024362.2 |
| R:AAGGGCTCCAAGGTCCACAG | ||
| Bmal1 | F:GCTTTGAGGTGACCAGCAAGTACA | NM_031144.3 |
| R:AAGGGCTCCAAGGTCCACAG | ||
| Nrf2 | F:TTGGCAGAGACATTCCCATTTGTA | NM_001399173.1 |
| R:GAGCTATCGAGTGACTGAGCCTG | ||
| HO-1 | F:GAGACGGCTTCAAGCTGGTGATG | NM_012580.2 |
| R:GTTGAGCAGGAACGCAGTCTTGG |
1.10. 免疫组织化学染色
将肾组织切片按照通用SP试剂盒说明书进行免疫组织化学染色,光学显微镜下观察Bmal1、Nrf2和HO-1表达情况并拍摄记录。分析计算Bmal1、Nrf2和HO-1阳性表达区域的平均光密度值(averaged optical density,AOD),评估目的蛋白的表达水平。
1.11. 统计学分析
采用GraphPad Prism 9.0软件进行统计学分析。2组大鼠的数据用均数±标准差来表示,2组间样本均数比较采用t检验,P<0.05为差异具有统计学意义。
2. 结果
2.1. 成功构建大鼠牙周炎模型
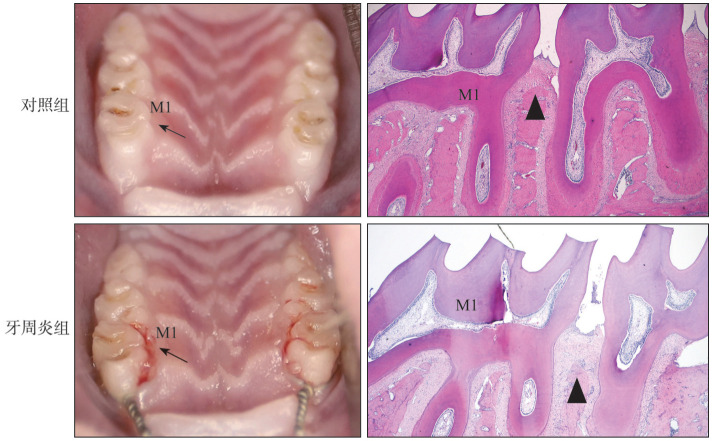
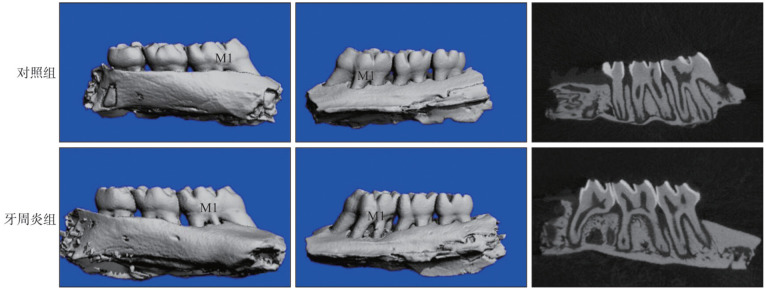
对照组大鼠牙周临床指标处于正常范围;而牙周炎组第一磨牙区探诊出血,并探及深牙周袋,牙齿出现Ⅰ度和Ⅱ度松动(表2)。口内照(图1左)显示,对照组牙龈质地坚韧富有弹性,呈粉色,菲薄紧贴于牙面;而牙周炎组第一磨牙区牙龈肿胀,颜色鲜红,质地松软,龈缘处的牙龈与牙冠分离,牙龈退缩。HE染色(图1右)显示:对照组上皮连续性完整,无附着丧失和牙槽骨丧失;牙周炎组上皮连续性受到破坏,附着丧失和骨吸收明显。Micoro-CT三维重建结果显示:牙周炎组上颌骨第一磨牙区较对照组有明显的骨吸收(图2)。牙周炎组CEJ-ABC的距离大于对照组,BMD、BV/TV和Tb.Th小于对照组,差异具有统计学意义(表3)。
表 2. 2组牙周临床指标.
Tab 2 Periodontal clinical indicators of two groups
| 指标 | 对照组 | 牙周炎组 |
| PD/mm | 0.22±0.02 | 2.03±0.12*** |
| BI | 0.17±0.41 | 2.33±0.52*** |
| TM | 0.00±0.00 | 1.17±0.41*** |
注:与对照组相比,***P<0.001。
图 1. 2组大鼠口内照及牙周组织HE染色.
Fig 1 Intraoral photographs and HE staining of periodontal tissue of two groups
左:口内照;右:牙周组织 HE × 40。M1:上颌第一磨牙;黑色箭头指向的是上颌第一磨牙区的牙龈;黑色三角显示第一磨牙与第二磨牙之间的牙槽嵴顶。
图 2. 2组牙槽骨Micro-CT三维重建.
Fig 2 Micro-CT 3D reconstruction of alveolar bone of two groups
左:大鼠颌骨颊侧三维重建;中:大鼠颌骨腭侧三维重建;右:大鼠颌骨矢状面Micro-CT。M1:上颌第一磨牙。
表 3. 2组Micro-CT检测结果.
Tab 3 Micro-CT results of two groups
| 项目 | 对照组 | 牙周炎组 |
| BMD/mm3 | 974.67±13.80 | 841±21.28*** |
| BV/TV | 0.79±0.05 | 0.30±0.04*** |
| Tb.Th/mm | 0.26±0.04 | 0.12±0.02** |
| CEJ⁃ABC/mm | 0.82±0.02 | 1.12±0.04*** |
注:与对照组相比,**P<0.01,***P<0.001。
2.2. 肾组织HE和PAS染色结果
HE染色结果显示,对照组的肾皮质区呈现正常的肾小球和肾小管结构;牙周炎组肾小球与肾小囊之间的间隙增加,近端和远端小管管型异常,肾小管周围区域的毛细血管有充血现象(图3上)。PAS染色结果显示:对照组肾小球基底膜较薄且清晰可见,肾小管刷状缘排列整齐,形态正常;牙周炎组肾小球基底膜出现明显的增厚和变异,肾小管刷状缘破坏呈现毛刺状(图3下)。HE和PAS染色结果表明,牙周炎组大鼠肾组织有显著的组织病理损伤。
图 3. 2组肾组织病理学染色结果.
Fig 3 Histopathological staining results of kidney of two groups
每组中,左侧为× 200,右侧为× 400。HE染色中,黑色五角星示鲍曼间隙,黑色箭头示毛细血管充血部位。PAS染色中,黑色箭头示肾小球基底膜,红色三角形示肾小管刷状缘。
2.3. 肾功能和氧化应激指标
肾功能和氧化应激指标结果见表4。与对照组相比,牙周炎组氧化应激指标SOD和GSH水平降低,MDA水平升高,差异具有统计学意义(P<0.05),表明牙周炎组的氧化应激水平出现异常。2组的肾功能指标肌酐、白蛋白和血尿素氮水平差异无统计学意义(P>0.05)。
表 4. 2组肾功能和氧化应激指标结果.
Tab 4 Results of renal function and oxidative stress markers of two groups
| 指标 | 对照组 | 牙周炎组 |
| SOD | 80.65±2.05 | 68.54±4.08* |
| GSH | 59.37±1.44 | 38.65±4.38*** |
| MDA | 1.54±0.02 | 3.55±0.21*** |
| 白蛋白 | 29.55±1.38 | 33.71±3.10 |
| 尿素氮 | 6.40±1.35 | 7.20±0.97 |
| 肌酐 | 34.54±4.45 | 41.54±2.16 |
注:与对照组相比,*P<0.05,***P<0.001。
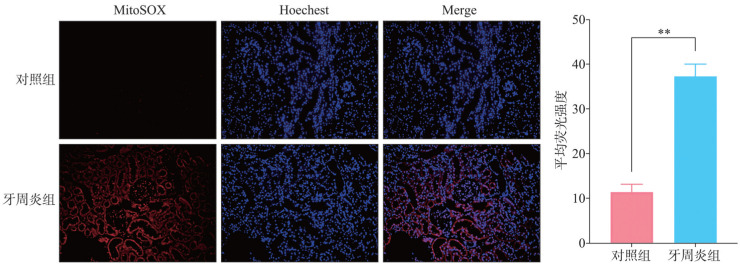
2.4. MitoSOX red检测结果
MitoSOX red检测结果(图4)显示,与对照组相比,牙周炎组肾细胞内的红色荧光强度显著增强,提示牙周炎组肾组织内ROS含量升高。
图 4. 2组MitoSOX red染色结果和荧光强度分析.
Fig 4 MitoSOX red staining results and fluorescence intensity analysis of two groups
左:染色结果 ×200,其中MitoSOX染料激发出红色荧光,标记肾细胞内的ROS;Hoechest染料激发出蓝色荧光,标记肾细胞的细胞核;Merge是将肾细胞的细胞核和细胞内ROS进行共定位。右:荧光强度分析,**P<0.01。
2.5. RT-qPCR检测结果
RT-qPCR检测结果(图5)显示,牙周炎组肾组织内Bmal1、Nrf2和HO-1的mRNA表达水平均低于对照组,差异具有统计学意义(P<0.05)。
图 5. 2组RT-qPCR检测结果.
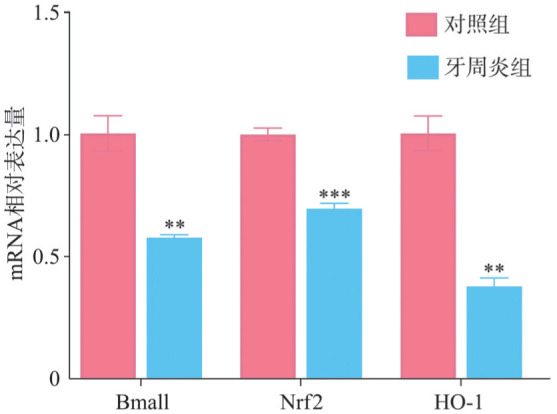
Fig 5 RT-qPCR results of two groups
与对照组相比,**P<0.01,***P<0.001。
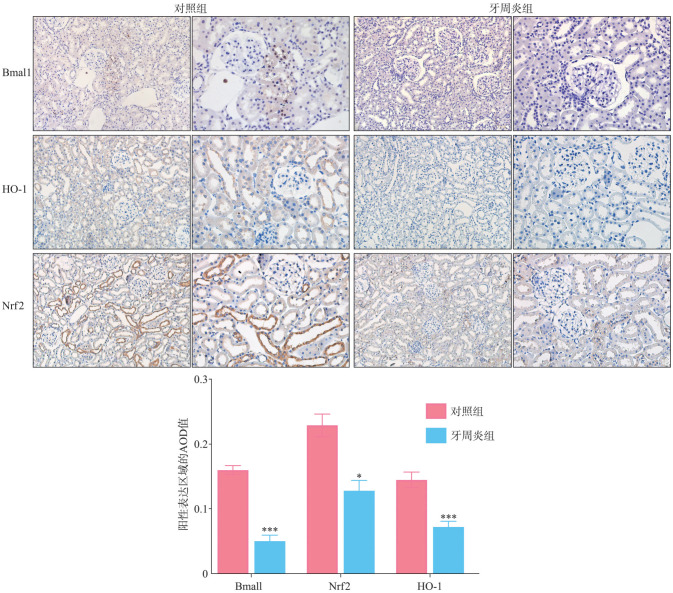
2.6. 免疫组织化学染色结果
免疫组织化学染色结果(图6)显示,与对照组相比,牙周炎组肾组织内棕黄色阳性颗粒减少;对阳性面积的定量分析结果显示差异具有统计学意义(P<0.05),表明牙周炎组Bmal1、Nrf2和HO-1的蛋白表达水平降低。
图 6. 2组肾组织的免疫组织化学染色结果及分析.
Fig 6 Results and analysis of immunohistochemical staining of renal tissues in two groups
上图每组中,左侧为× 200,右侧为× 400;棕黄色部分为阳性表达区域。下图中,与对照组相比,*P<0.05,***P<0.001。
3. 讨论
牙周炎是一种由微生物引起的牙齿支持组织炎症,与多种全身性疾病相关[14]。最近研究[15]发现,牙周细菌及其毒力因子可以进入体循环并到达肾组织,或通过血液循环从炎性牙周病灶转运到肾脏。对大鼠双侧上颌第一磨牙进行结扎,本研究建立了大鼠牙周炎模型,并通过口内照、牙周临床指标、牙周组织HE染色和Micro-CT的检测结果,证明大鼠牙周炎模型已成功构建。根据改善全球肾脏病预后组织(Kidney Disease Improving Global Outcomes,KDIGO)对CKD的定义[16],CKD是由各种原因引起肾脏结构或功能异常持续超过3个月,在关于CKD的异常指标中包括肾组织病理学检测异常或者其他方式检测到的异常。
本研究在对大鼠肾组织进行组织病理学检测时,发现牙周炎组大鼠肾小管刷状缘损伤、肾小球囊间隙增大、毛细血管充血等病理损伤,而这些结果与本课题组之前关于牙周炎相关肾损伤的研究[17]类似。生化试剂盒检测肾脏功能指标时发现,与对照组相比,牙周炎组肾脏的功能参数水平均有上升,但差异无统计学意义。同样地,其他关于评估牙周炎对肾功能影响的研究也呈现类似的结果[15],[18]。因此,牙周炎对肾脏结构的损伤是一定的,然而实验性牙周炎对肾脏功能的损伤是有限的,猜测这可能与造模周期有关,需要进一步的实验加以验证。
Bmal1作为昼夜节律系统的重要组成部分,通过调节下游靶基因的表达和功能,参与机体多种生理和代谢过程,对于维持机体的稳态和健康具有重要作用[19]。研究[20]指出,在肾脏中近端小管Bmal1的缺失会加重慢性肾损伤并加剧肾纤维化。这项结果表明Bmal1在慢性肾小管损伤中具有保护作用,这可能为治疗CKD提供了新的靶点。大量研究[20]–[22]表明,多种组织内的昼夜节律和氧化还原系统之间存在密切联系,包括脑、牙周组织、肾脏等。例如昼夜节律紊乱后引起Bmal1表达下调,导致核因子活化B细胞κ轻链增强子的转录活性升高,进而引发牙周组织的氧化应激和细胞凋亡增加,表明Bmal1可以通过调控氧化应激和炎症反应来参与牙周炎的发生发展[21]。另外,Gong等[22]发现,脑出血大鼠转染Bmal1过表达的重组病毒后,其体内Nrf2信号通路被激活,脑损伤和神经功能缺损有所减轻,证实Bmal1能够通过抑制氧化应激和炎症反应来发挥其潜在的神经保护作用。Bmal1的表达水平影响着下游Nrf2、HO-1信号分子,过表达的Bmal1可通过增强Nrf2、HO-1信号分子的表达水平,进而降低过氧化氢对心肌细胞造成的氧化损伤[23]。Wang等[9]研究表明,通过转染增加Bmal1表达,可以调节Nrf2、HO-1转录和表达,从而抵抗氧化应激损伤。因此,Bmal1能通过影响Nrf2、HO-1信号分子表达,在氧化还原系统和炎症反应过程中发挥重要作用,对维持细胞稳态以及疾病发生发展具有重要意义。
Nrf2、HO-1在牙周炎和肾损伤中发挥抗氧化作用。Nrf2是CNC-bZIP蛋白家族成员,在抗炎、抗氧化和其他免疫反应中发挥着显著作用[24]。在静态条件下,Nrf2与Kelch样ECH关联蛋白1(kelch-like ECH-associated protein-1,Keap1)结合,而当受到外界刺激时,Nrf2则会与Keap1解离,从而激活多种细胞保护基因表达,如HO-1[25]。HO-1可以催化血红蛋白分子中的血红素转化为胆红素,其中胆红素具有强大的抗氧化作用[26]。五味子α-异羰酚可以激活Nrf2、HO-1的表达,使牙龈卟啉单胞菌脂多糖刺激的巨噬细胞的抗炎活性增加[27]。这项结果表明,五味子α-异羰酚可以通过该通路预防牙周炎和其他慢性炎症性疾病的发生。此外,白藜芦醇通过刺激肾小球足细胞中的Nrf2结合活性,激活HO-1表达,从而降低膜性肾病对肾脏的影响[10]。以上研究表明Nrf2、HO-1信号分子在牙周炎和肾损伤中起着保护作用。因此在这些理论基础上,笔者推测Bmal1、Nrf2、HO-1信号分子可能在影响牙周炎大鼠肾损伤的过程中发挥作用。本研究发现,与对照组相比,牙周炎组肾组织内Bmal1、Nrf2、HO-1的基因及蛋白表达水平均下调,并且差异具有统计学意义。GSH、MDA和SOD是反映细胞是否受到氧化损伤的指标,而牙周炎大鼠肾组织内GSH、MDA、SOD水平明显异常,同时MitoSOX red检测结果显示牙周炎大鼠肾组织内ROS含量增多,提示牙周炎大鼠肾组织遭受了一定程度的氧化损伤。这些结果表明,牙周炎可能下调了Bmal1、Nrf2和HO-1信号分子的表达,导致肾组织内氧化应激水平升高,从而诱发了牙周炎大鼠肾组织的氧化损伤。
综上,本研究通过建立大鼠牙周炎模型,首次探究了Bmal1在牙周炎大鼠相关肾损伤中的作用,为探究与牙周炎相关肾损伤提供了新的视角和研究思路,此外本研究也存在一些局限性,即未深入探讨Bmal1对Nrf2和HO-1的调控作用。未来可通过采用Bmal1的抑制剂、促进剂或通过病毒干扰等途径来开展相关研究。
Funding Statement
[基金项目] 吉林省科技计划项目(20220402069GH)
Supported by: Jilin Provincial Science and Technology Plan Project (20220402069GH)
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Serni L, Caroti L, Barbato L, et al. Association between chronic kidney disease and periodontitis. A systematic review and metanalysis[J] Oral Dis. 2023;29(1):40–50. doi: 10.1111/odi.14062. [DOI] [PubMed] [Google Scholar]
- 2.Ausavarungnirun R, Wisetsin S, Rongkiettechakorn N, et al. Association of dental and periodontal disease with chronic kidney disease in patients of a single, tertiary care centre in Thailand[J] BMJ Open. 2016;6(7):e011836. doi: 10.1136/bmjopen-2016-011836. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Zhao D, Zhang S, Chen X, et al. Evaluation of periodontitis and bone loss in patients undergoing hemodialysis[J] J Periodontol. 2014;85(11):1515–1520. doi: 10.1902/jop.2014.140119. [DOI] [PubMed] [Google Scholar]
- 4.Fang F, Wu B, Qu Q, et al. The clinical response and systemic effects of non-surgical periodontal therapy in end-stage renal disease patients: a 6-month randomized controlled clinical trial[J] J Clin Periodontol. 2015;42(6):537–546. doi: 10.1111/jcpe.12411. [DOI] [PubMed] [Google Scholar]
- 5.Zhang R, Lahens NF, Ballance HI, et al. A circadian gene expression atlas in mammals: implications for biology and medicine[J] PNAS. 2014;111(45):16219–16224. doi: 10.1073/pnas.1408886111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Albrecht U. Timing to perfection: the biology of central and peripheral circadian clocks[J] Neuron. 2012;74(2):246–260. doi: 10.1016/j.neuron.2012.04.006. [DOI] [PubMed] [Google Scholar]
- 7.Chhunchha B, Kubo E, Singh DP, et al. Clock protein Bmal1 and Nrf2 cooperatively control aging or oxidative response and redox homeostasis by regulating rhythmic expression of Prdx6[J] Cells. 2020;9(8):E1861. doi: 10.3390/cells9081861. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Nakazato R, Kawabe K, Yamada D, et al. Disruption of Bmal1 impairs blood-brain barrier integrity via pericyte dysfunction[J] J Neurosci. 2017;37(42):10052–10062. doi: 10.1523/JNEUROSCI.3639-16.2017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Wang J, Bai Y, Yin S, et al. Circadian clock gene BMAL1 reduces urinary calcium oxalate stones formation by regulating NRF2/HO-1 pathway[J] Life Sci. 2021;265:118853. doi: 10.1016/j.lfs.2020.118853. [DOI] [PubMed] [Google Scholar]
- 10.Zhou Y, Jiang Z, Lu H, et al. Recent advances of natural polyphenols activators for Keap1-Nrf2 signaling pathway[J] Chem Biodivers. 2019;16(11):e1900400. doi: 10.1002/cbdv.201900400. [DOI] [PubMed] [Google Scholar]
- 11.Wang Y, Feng F, Liu M, et al. Resveratrol ameliorates sepsis-induced acute kidney injury in a pediatric rat model via Nrf2 signaling pathway[J] Exp Ther Med. 2018;16(4):3233–3240. doi: 10.3892/etm.2018.6533. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Bhattarai G, Poudel SB, Kook SH, et al. Resveratrol prevents alveolar bone loss in an experimental rat model of periodontitis[J] Acta Biomater. 2016;29:398–408. doi: 10.1016/j.actbio.2015.10.031. [DOI] [PubMed] [Google Scholar]
- 13.曹 牛奔, 刘 笑梦, 邓 愉, et al. 活性氧/c-Jun氨基末端激酶/核因子-κB信号分子通过调控凋亡参与牙周炎诱导肝损伤[J] 华西口腔医学杂志. 2022;40(5):532–540. doi: 10.7518/hxkq.2022.05.005. [DOI] [PMC free article] [PubMed] [Google Scholar]; Cao NB, Liu XM, Deng Y, et al. Reactive oxygen species/c-Jun N-terminal kinase/nuclear factor kappa-B signaling molecules are involved in pe riodontitis-induced liver injury by regulating apoptosis[J] West China J Stomatol. 2022;40(5):532–540. doi: 10.7518/hxkq.2022.05.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Tomofuji T, Ekuni D, Irie K, et al. Relationships between periodontal inflammation, lipid peroxide and oxidative damage of multiple organs in rats[J] Biomed Res. 2011;32(5):343–349. doi: 10.2220/biomedres.32.343. [DOI] [PubMed] [Google Scholar]
- 15.Kose O, Kurt Bayrakdar S, Unver B, et al. Melatonin improves periodontitis-induced kidney damage by decreasing inflammatory stress and apoptosis in rats[J] J Periodontol. 2021;92(6):22–34. doi: 10.1002/JPER.20-0434. [DOI] [PubMed] [Google Scholar]
- 16.Stevens PE, Levin A, DiseaseKidney: Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline[J] Ann Intern Med. 2013;158(11):825–830. doi: 10.7326/0003-4819-158-11-201306040-00007. [DOI] [PubMed] [Google Scholar]
- 17.Ding X, Hou Y, Liu X, et al. The role of Sirt3-induced autophagy in renal structural damage caused by periodontitis in rats[J] J Periodontal Res. 2023;58(1):97–108. doi: 10.1111/jre.13071. [DOI] [PubMed] [Google Scholar]
- 18.França LFC, Vasconcelos ACCG, da Silva FRP, et al. Periodontitis changes renal structures by oxidative stress and lipid peroxidation[J] J Clin Periodontol. 2017;44(6):568–576. doi: 10.1111/jcpe.12729. [DOI] [PubMed] [Google Scholar]
- 19.Ye P, Li W, Huang X, et al. BMAL1 regulates mitochondrial homeostasis in renal ischaemia-reperfusion injury by mediating the SIRT1/PGC-1α axis[J] J Cell Mol Med. 2022;26(7):1994–2009. doi: 10.1111/jcmm.17223. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Liu C, Li S, Ji S, et al. Proximal tubular Bmal1 protects against chronic kidney injury and renal fibrosis by maintaining of cellular metabolic homeostasis[J] Biochim Biophys Acta Mol Basis Dis. 2023;1869(1):166572. doi: 10.1016/j.bbadis.2022.166572. [DOI] [PubMed] [Google Scholar]
- 21.Liu X, Cao N, Liu X, et al. Circadian rhythm disorders aggravate periodontitis by modulating BMAL1[J] Int J Mol Sci. 2022;24(1):374. doi: 10.3390/ijms24010374. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Gong Y, Zhang G, Li B, et al. BMAL1 attenuates intracerebral hemorrhage-induced secondary brain injury in rats by regulating the Nrf2 signaling pathway[J] Ann Transl Med. 2021;9(21):1617. doi: 10.21037/atm-21-1863. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.易 娜, 袁 李礼. BMAL1对H2O2诱导的H9C2心肌细胞损伤的影响及机制探讨[J] 天津医药. 2021;49(8):791–795. [Google Scholar]; Yi N, Yuan LL. Effects and mechanism of BMAL1 on H2O2-induced H9C2 cardiomyocyte injury[J] Tianjin Med J. 2021;49(8):791–795. [Google Scholar]
- 24.Chiu AV, Saigh MA, McCulloch CA, et al. The role of NrF2 in the regulation of periodontal health and disease[J] J Dent Res. 2017;96(9):975–983. doi: 10.1177/0022034517715007. [DOI] [PubMed] [Google Scholar]
- 25.Nguyen T, Nioi P, Pickett CB. The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress[J] J Biol Chem. 2009;284(20):13291–13295. doi: 10.1074/jbc.R900010200. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Huang C, Zhang C, Yang P, et al. Eldecalcitol inhibits LPS-induced NLRP3 inflammasome-dependent pyroptosis in human gingival fibroblasts by activating the Nrf2/HO-1 signaling pathway[J] Drug Des Devel Ther. 2020;14:4901–4913. doi: 10.2147/DDDT.S269223. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Park SY, Park DJ, Kim YH, et al. Schisandra chinensis α‑iso-cubebenol induces heme oxygenase-1 expression through PI3K/Akt and Nrf2 signaling and has anti-inflammatory activity in Porphyromonas gingivalis lipopolysaccharide-stimulated macrophages[J] Int Immunopharmacol. 2011;11(11):1907–1915. doi: 10.1016/j.intimp.2011.07.023. [DOI] [PubMed] [Google Scholar]