Abstract
目的
调查学龄前孤独症谱系障碍(autism spectrum disorder, ASD)儿童血清叶酸和维生素B12(vitamin B12, VB12)水平及其与神经发育水平的关联。
方法
招募324例2~6岁ASD儿童和318例2~6岁健康儿童,采用化学发光免疫分析法测定血清叶酸和VB12水平,采用社交反应量表和儿童孤独症评定量表评估ASD儿童的核心症状,采用格塞尔发育量表评估神经发育水平。
结果
ASD儿童的血清叶酸及VB12水平均显著低于健康儿童(P<0.05)。ASD儿童血清叶酸水平与大运动和精细运动发育商呈正相关(P<0.05),血清VB12水平与适应性行为、精细运动、语言发育商呈正相关(P<0.05)。2~<4岁ASD儿童血清叶酸水平与各能区发育商均呈正相关(P<0.05),血清VB12水平与语言发育商呈正相关(P<0.05);ASD男童血清VB12水平与语言、个人-社会发育商呈正相关(P<0.05)。
结论
学龄前ASD儿童血清叶酸和VB12水平较健康儿童低,且与神经发育水平相关,尤其<4岁ASD儿童。因此,保持正常的血清叶酸和VB12水平可能有益于ASD儿童,特别是<4岁ASD儿童的神经发育。
Keywords: 孤独症谱系障碍, 神经发育水平, 叶酸, 维生素B12 , 儿童
Abstract
Objective
To investigate the levels of serum folate and vitamin B12 (VB12) and their association with the level of neurodevelopment in preschool children with autism spectrum disorder (ASD).
Methods
A total of 324 ASD children aged 2-6 years and 318 healthy children aged 2-6 years were recruited. Serum levels of folate and VB12 were measured using chemiluminescent immunoassay. The Social Responsiveness Scale and the Childhood Autism Rating Scale were used to assess the core symptoms of ASD children, and the Gesell Developmental Schedule was employed to evaluate the level of neurodevelopment.
Results
The levels of serum folate and VB12 in ASD children were significantly lower than those in healthy children (P<0.05). Serum folate levels in ASD children were positively correlated with gross and fine motor developmental quotients (P<0.05), and serum VB12 levels were positively correlated with adaptive behavior, fine motor, and language developmental quotients (P<0.05). In ASD children aged 2 to <4 years, serum folate levels were positively correlated with developmental quotients in all domains (P<0.05), and serum VB12 levels were positively correlated with language developmental quotient (P<0.05). In male ASD children, serum VB12 levels were positively correlated with language and personal-social developmental quotients (P<0.05).
Conclusions
Serum folate and VB12 levels in preschool ASD children are lower than those in healthy children and are associated with neurodevelopmental levels, especially in ASD children under 4 years of age. Therefore, maintaining normal serum folate and VB12 levels may be beneficial for the neurodevelopment of ASD children, especially in ASD children under 4 years of age.
Keywords: Autism spectrum disorder, Neurodevelopment, Folic acid, Vitamin B12 , Child
孤独症谱系障碍(autism spectrum disorder, ASD)是一种复杂的神经发育障碍,核心症状为社会交流缺陷、重复刻板行为和狭隘兴趣。根据美国最新报告显示,ASD患病率高达1/36[1]。我国目前ASD的患病率为0.7%~1%[2]。ASD病因不清,致病机制尚未明确,公认的发病机制是复杂的遗传背景叠加环境因素共同作用导致了ASD的发生。与正常儿童相比,ASD儿童存在更多的挑食等饮食行为问题[3]和胃肠道问题[4],因此ASD儿童更容易出现营养素的缺乏。叶酸和维生素B12(vitamin B12, VB12)等营养素是儿童早期大脑发育的重要因素,与ASD发病可能存在一定关联,受到了较广泛的关注[5]。国内外研究显示,ASD儿童血清叶酸和VB12水平显著低于正常儿童[6-10],但也有研究报道ASD儿童血清叶酸及VB12水平与正常儿童无显著差异[11-12],还有研究发现ASD儿童血清VB12水平高于正常儿童[13]。这些研究尚未得出一致结论。此外,关于ASD儿童血清叶酸和VB12水平与核心症状及神经发育水平的相关性,目前尚未见研究探讨其性别差异。因此,本研究拟调查学龄前ASD儿童血清叶酸、VB12水平及与核心症状和神经发育水平之间的关联,并进一步分析该关联有无年龄及性别差异,为临床监测ASD儿童的营养状况提供依据,从而更好地促进ASD儿童的康复。
1. 资料与方法
1.1. 研究对象
本研究为横断面调查。ASD组为2020年11月—2022年10月招募的重庆市特教机构的324例2~6岁ASD儿童,由专科医师诊断,符合精神障碍诊断与统计手册第5版中ASD诊断标准[14]。采用社交反应量表(Social Responsiveness Scale, SRS)和儿童孤独症评定量表(Childhood Autism Rating Scale, CARS)评估ASD儿童的核心症状。采用格塞尔发育量表(Gesell Developmental Schedule)评估儿童的神经发育水平。排除标准:(1)有其他独立的神经发育障碍或精神疾病的儿童,包括脑性瘫痪、慢性癫痫等;(2)近3个月有急性或慢性感染性疾病;(3)近6个月进行了叶酸和VB12补充者。
对照组为2020年11月—2023年3月招募的重庆市幼儿园318例2~6岁健康儿童。排除标准:(1)临床有发育行为疾病表现;(2)有任何已知的影响维生素体内代谢的疾病;(3)近3个月有急性或慢性感染性疾病;(4)近6个月进行了叶酸和 VB12补充者。
该研究涉及的所有参与者遵循自愿原则,调查前均与儿童监护人签署知情同意书。本研究经重庆医科大学附属儿童医院伦理委员会审核通过(2018年伦审研第121-1号)。
1.2. 研究方法
采集所有入组儿童空腹静脉血2~3 mL,在37℃水浴条件下放置约30 min,然后置离心机以3 000 r/min离心10 min,使血清和血细胞分开,采用化学发光免疫分析法检测血清叶酸和VB12水平。
1.3. 统计学分析
采用 SPSS 25.0 软件进行统计学分析。对所有数据进行正态性检验。符合正态分布或近似正态分布的计量资料以均值±标准差( ±s)表示,不符合正态分布的计量资料采用中位数(四分位数间距)[M(P 25,P 75)]表示。符合正态分布且方差齐的两组间数据的比较采用两样本t检验,不符合正态分布的计量资料两组间的比较采用Mann-Whitney U检验。计数资料以例数和百分率(%)表示,两组间计数资料的比较采用卡方检验。采用Spearman秩相关分析探讨血清叶酸与VB12水平之间的相关性。使用多因素(校正年龄、性别)二元逻辑回归模型比较ASD组与对照组血清叶酸、VB12水平的差异。采用多元(校正年龄、性别)线性回归模型评估血清叶酸、VB12水平与ASD儿童核心症状和神经发育水平之间的关联。P<0.05为差异有统计学意义。
2. 结果
2.1. 人口学信息
ASD组324例儿童中,男童257例,女童67例;中位年龄为3.79岁。对照组318例儿童中,男童157例,女童161例;中位年龄为4.57岁。两组儿童的年龄和性别的比较差异均有统计学意义(均P<0.05),见表1。
表1.
ASD组和对照组基本资料的比较
| 组别 | 例数 | 年龄[M(P 25, P 75), 岁] | 性别 [例(%)] | |
|---|---|---|---|---|
| 男 | 女 | |||
| 对照组 | 318 | 4.57(3.84, 5.27) | 157(49.4) | 161(50.6) |
| ASD组 | 324 | 3.79(3.17, 4.49) | 257(79.3) | 67(20.7) |
| Z/ 值 | 9.43 | 62.86 | ||
| P值 | <0.001 | <0.001 | ||
注:[ASD]孤独症谱系障碍。
2.2. ASD组与对照组血清叶酸和VB12水平的比较
校正年龄、性别因素后ASD组儿童的血清叶酸和VB12水平显著低于对照组(均P<0.05),见表2。
表2.
ASD组和对照组血清叶酸和VB12水平的比较
| 组别 | 例数 | 叶酸[M(P 25, P 75), nmoL/L] | VB12[M(P 25, P 75), pmol/L] | 校正后# | |||
|---|---|---|---|---|---|---|---|
| 叶酸 | VB12 | ||||||
| OR(95%CI) | P | OR(95%CI) | P | ||||
| 对照组 | 318 | 34.1(27.3, 41.1) | 812.2(586.6, 1 012.9) | 1 |
<0.001 |
1 |
<0.001 |
| ASD组 | 324 | 31.6(23.1, 40.8) | 667.9(466.3, 958.6) | 0.951(0.932~0.970) | 0.999(0.998~0.999) | ||
注: #校正年龄、性别因素。[ASD]孤独症谱系障碍;[VB12]维生素B12。
2.3. ASD组和对照组血清叶酸与VB12水平之间的相关性
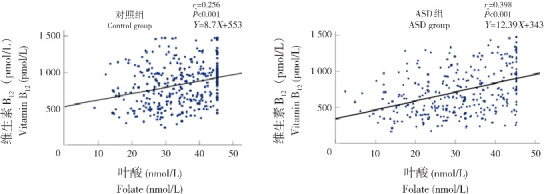
Spearman秩相关分析显示,ASD组和对照组儿童血清叶酸与VB12水平均呈正相关关系(分别r s=0.398,P<0.001;r s=0.256,P<0.001),见图1。
图1. ASD组和对照组血清叶酸和维生素B12水平之间的相关性.
2.4. ASD儿童血清叶酸、VB12水平与SRS、CARS及格塞尔发育量表得分的关联
控制年龄、性别因素后,ASD儿童血清叶酸和VB12水平与SRS、CARS量表得分均未发现显著相关性(均P>0.05),但血清叶酸水平与格塞尔发育量表大运动、精细运动得分呈正相关(P<0.05),血清VB12水平与格塞尔发育量表适应性、精细运动、语言得分呈正相关(P<0.05)。见表3。
表3.
ASD儿童血清叶酸和VB12水平与核心症状及神经发育量表评估得分的关联
| 项目 | 叶酸 | VB12 | ||
|---|---|---|---|---|
| β(95%CI) | P | β(95%CI) | P | |
| SRS量表 (n=306) | ||||
| 知觉 | 0.017(-0.017~0.050) | 0.324 | -0.001(-0.002~0) | 0.116 |
| 认知 | -0.012(-0.063~0.039) | 0.648 | -0.000 08(-0.002~0.002) | 0.925 |
| 交流 | -0.045(-0.140~0.049) | 0.346 | -0.001(-0.004~0.002) | 0.724 |
| 动机 | -0.007(-0.070~0.057) | 0.841 | -0.000 07(-0.002~0.002) | 0.947 |
| 行为方式 | -0.001(-0.073~0.071) | 0.973 | 0.002(-0.001~0.004) | 0.197 |
| 总分 | -0.048(-0.309~0.213) | 0.716 | -0.000 03(-0.008~0.008) | 0.994 |
| CARS量表总分 (n=284) | -0.023(-0.099~0.053) | 0.554 | -0.001(-0.003~0.002) | 0.635 |
| 格塞尔发育量表 (n=291) | ||||
| 适应性 | 0.185(-0.029~0.399) | 0.090 | 0.007(0~0.014) | 0.049 |
| 大运动 | 0.215(0.012~0.417) | 0.038 | 0.005(-0.002~0.011) | 0.171 |
| 精细运动 | 0.228(0.002~0.455) | 0.048 | 0.009(0.002~0.017) | 0.015 |
| 语言 | 0.205(-0.044~0.455) | 0.106 | 0.010(0.002~0.018) | 0.012 |
| 个人-社会 | 0.202(-0.001~0.405) | 0.052 | 0.006(0~0.013) | 0.064 |
注:已校正年龄、性别因素。[VB12]维生素B12;[SRS]社交反应量表;[CARS]儿童孤独症评定量表;[ASD]孤独症谱系障碍。
2.5. 不同年龄组ASD儿童血清叶酸、VB12水平与格塞尔发育量表得分的关联
控制性别因素后,2~<4岁ASD儿童血清叶酸水平与格塞尔发育量表各能区均呈正相关(均P<0.05),4~6岁ASD儿童血清叶酸水平与格塞尔发育量表各能区均无显著相关(均P>0.05);2~<4岁ASD儿童血清VB12水平与格塞尔发育量表语言得分呈正相关(P<0.05),4~6岁ASD儿童血清VB12水平与格塞尔发育量表适应性、精细运动、个人-社会得分均呈正相关(均P<0.05)。见表4。
表4.
不同年龄组ASD儿童血清叶酸、VB12水平与格塞尔发育量表各能区得分的关联
| 能区 | 叶酸 | VB12 | ||||||
|---|---|---|---|---|---|---|---|---|
| 2~<4岁组 (n=166) | 4~6岁组 (n=125) | 2~<4岁组 (n=166) | 4~6岁组 (n=125) | |||||
| β(95%CI) | P | β(95%CI) | P | β(95%CI) | P | β(95%CI) | P | |
| 适应性 | 0.303(0.040~0.566) | 0.024 | 0.130(-0.227~0.488) | 0.471 | 0.005(-0.003~0.014) | 0.235 | 0.012(0~0.025) | 0.046 |
| 大运动 | 0.352(0.110~0.594) | 0.005 | 0.139(-0.209~0.487) | 0.431 | 0.002(-0.006~0.010) | 0.622 | 0.011(-0.001~0.023) | 0.062 |
| 精细运动 | 0.314(0.039~0.589) | 0.026 | 0.211(-0.165~0.586) | 0.268 | 0.007(-0.002~0.016) | 0.152 | 0.016(0.003~0.029) | 0.016 |
| 语言 | 0.336(0.031~0.642) | 0.031 | 0.056(-0.354~0.465) | 0.788 | 0.010(0~0.020) | 0.048 | 0.012(-0.002~0.026) | 0.086 |
| 个人-社会 | 0.371(0.127~0.614) | 0.003 | 0.010(-0.331~0.351) | 0.955 | 0.003(-0.005~0.011) | 0.435 | 0.013(0.001~0.025) | 0.028 |
注:已校正性别因素。[VB12]维生素B12;[ASD]孤独症谱系障碍。
2.6. 不同性别ASD儿童血清叶酸和VB12水平与格塞尔发育量表得分的关联
控制年龄因素后,ASD男童及女童的血清叶酸水平与格塞尔发育量表各能区发育商的相关性均无统计学意义(均P>0.05);血清VB12水平与ASD男童格塞尔发育量表语言和个人-社会能区得分呈正相关(P<0.05),血清VB12水平与ASD女童格塞尔发育量表各能区发育商的相关性均无统计学意义(均P>0.05)。见表5。
表5.
不同性别组ASD儿童血清叶酸、VB12水平与格塞尔发育量表得分的关联
| 能区 | 叶酸 | VB12 | ||||||
|---|---|---|---|---|---|---|---|---|
| 男童 (n=233) | 女童 (n=58) | 男童 (n=233) | 女童 (n=58) | |||||
| β(95%CI) | P | β(95%CI) | P | β(95%CI) | P | β(95%CI) | P | |
| 适应性 | 0.171(-0.079, 0.421) | 0.179 | 0.238(-0.171, 0.647) | 0.249 | 0.007(-0.002, 0.015) | 0.109 | 0.008(-0.005, 0.021) | 0.215 |
| 大运动 | 0.196(-0.031, 0.422) | 0.090 | 0.287(-0.184, 0.757) | 0.228 | 0.005(-0.003, 0.012) | 0.204 | 0.004(-0.011, 0.019) | 0.602 |
| 精细运动 | 0.231(-0.024, 0.487) | 0.076 | 0.238(-0.263, 0.739) | 0.345 | 0.008(-0.001, 0.016) | 0.070 | 0.014(-0.001, 0.030) | 0.075 |
| 语言 | 0.129(-0.152, 0.409) | 0.367 | 0.502(-0.058, 1.062) | 0.078 | 0.010(0, 0.019) | 0.039 | 0.013(-0.005, 0.031) | 0.146 |
| 个人-社会 | 0.184(-0.038, 0.405) | 0.105 | 0.281(-0.227, 0.788) | 0.273 | 0.007(0, 0.015) | 0.046 | 0.003(-0.014, 0.019) | 0.751 |
注:已校正年龄因素。[VB12]维生素B12;[ASD]孤独症谱系障碍。
3. 讨论
ASD病因复杂,目前尚无特效治疗方法,临床只能以行为干预为主。微量营养素作为重要的环境因子,近年研究发现可能影响ASD儿童的干预。叶酸是主要来源于食物的人体必需的维生素,参与核酸的合成、DNA及蛋白质等物质的甲基化过程,是神经元发挥正常功能不可或缺的,其严重缺乏可能直接影响大脑功能[15]。VB12作为辅酶能增加叶酸的利用率,是蛋氨酸转甲基化和转硫代谢中的必需辅助因子,有助于神经元发育和髓鞘形成[16]。二者协同参与甲基化过程,影响神经系统发育。本研究发现学龄前ASD儿童血清叶酸与VB12水平明显低于对照组,与ASD核心症状无明显关联,但与大部分神经发育能区存在关联,且与神经发育能区的关联在不同年龄和性别间存在一定差别。
多项研究表明,ASD儿童血清叶酸、VB12水平与健康儿童不同。孙艺等[6]对3~17岁的110例ASD儿童和110例正常儿童进行调查,发现ASD儿童血清叶酸和VB12的水平显著低于正常儿童。Li 等[8]的研究亦得出相同结论。此外,两项来自阿曼的3~5岁ASD病例对照研究(ASD组和正常对照组各40例)也支持以上结果[7,17]。然而,一项来自土耳其的研究显示ASD儿童和青少年的血清VB12水平低于健康对照组,叶酸水平没有显著差异[11]。另一项来自河南的研究报道ASD儿童叶酸水平较正常儿童低,VB12水平较正常儿童高[13]。本研究扩大样本量,对324例ASD儿童和318例健康儿童进行比较,校正年龄及性别的影响后发现ASD儿童的血清叶酸和VB12水平均显著低于健康对照组,与Saha等[10]的研究结果一致。ASD儿童血清叶酸、VB12水平较健康儿童低下的原因可能与ASD儿童存在限制和刻板进食行为有关,如全国多中心调查发现,ASD儿童挑食、不愿尝试新的食物的比例高达67.4%[3];也可能与ASD儿童存在较高比例的胃肠道问题有关[18]。
有研究表明营养脆弱可加剧ASD症状[19]。关于血清叶酸、VB12水平与ASD核心症状之间的关联已有研究进行探索。多项研究表明,ASD儿童的CARS评分与血清叶酸、VB12水平没有显著相关性[8,11]。然而,有研究显示血清叶酸、VB12水平与CARS评分呈负相关[7]。本研究校正年龄及性别因素后,发现ASD儿童血清叶酸、VB12水平与SRS、CARS量表得分无显著相关。既往两项研究也发现ASD儿童血清叶酸、VB12水平与孤独症行为量表、SRS量表得分均无显著相关性[20-21]。既往全国多中心研究显示7岁以下ASD儿童的血清叶酸水平与孤独症行为量表、SRS和CARS量表得分均无显著相关性[22]。以上结果提示ASD儿童血清叶酸、VB12水平可能与核心症状关联不大,但还需要多中心研究对VB12与核心症状的相关性进行进一步验证。
据报道,叶酸和VB12对正常的神经元功能至关重要,严重缺乏可能会通过破坏大脑神经发育过程中的髓鞘形成和突触形成直接影响大脑功能[23]。已有较多文献报道血清叶酸与ASD存在明显关联,本团队前期开展的中国多中心研究仅发现3岁及以下小年龄ASD儿童血清叶酸与神经发育水平存在明显关联[22],而血清VB12水平与ASD儿童格塞尔发育量表的相关性研究相对较少,仅有一项研究发现血清VB12与ASD儿童格塞尔发育量表部分能区得分存在关联[8]。本研究在校正年龄、性别因素后发现ASD儿童血清叶酸水平与大运动、精细运动发育商呈正相关,血清VB12水平与适应性行为、精细运动、语言发育商呈正相关。进一步分析发现2~<4岁ASD儿童血清叶酸水平与格塞尔发育量表各能区均呈正相关,而4~6岁ASD儿童血清叶酸水平与格塞尔发育量表各能区均无显著相关性,与本团队前期研究结果[22]类似,而血清VB12水平与2~<4岁ASD儿童的格塞尔发育量表语言得分呈正相关,与4~6岁ASD儿童的格塞尔发育量表适应性、精细运动和个人-社会得分均呈正相关。这提示叶酸可能主要影响低龄ASD儿童的神经发育,VB12则可能参与学龄前儿童神经发育,但具体机制有待进一步研究。美国儿科学会最新指南认为智力水平与ASD预后相关[24],因此临床上应关注评估学龄前ASD儿童的血清叶酸和VB12水平。由于ASD儿童不仅在患病率、临床表现上存在性别差异,近年来有研究发现在血液、代谢物上也存在性别差异[25-27]。然而,目前尚未见报道ASD儿童血清叶酸、VB12水平与神经发育水平的关联是否存在性别差异。本研究发现血清VB12水平对ASD男童神经发育的影响更为显著,ASD男童血清VB12水平与格塞尔发育量表语言和个人-社会得分均呈正相关,而在ASD女童中未发现类似结果,这为研究VB12与ASD关系的机制提供新的思路。
本研究是目前为止样本量最大报道学龄前ASD儿童血清叶酸、VB12水平与神经发育特征关联的研究,但存在以下局限性。首先,本研究没有调查两组儿童饮食及胃肠道问题发生情况,因此不能评估叶酸和VB12水平低是摄入的原因还是其他代谢的原因;其次,本研究是横断面设计,无法确定叶酸、VB12与ASD之间的因果关系;第三,母孕期情况、围产期情况、家庭环境的支持情况以及儿童本身的心理学因素等均可影响儿童认知,本研究没有对这些影响因素进行校正;第四,ASD组和对照组儿童的纳入均采用了自由招募的形式,样本代表性较随机抽样差。因此在后续研究中我们将进一步完善样本抽样,全面评估造成儿童体内叶酸和VB12水平低的可能原因,关注影响儿童认知的因素,以得到更准确的结果。另外我们还需深入研究探讨叶酸和VB12在ASD发病中的作用及具体机制,并进一步观察叶酸和VB12治疗后的效果。
综上所述,学龄前ASD儿童的血清叶酸和VB12水平与核心症状无明显关联,主要与神经发育水平有关。其中,血清叶酸水平主要与2~<4岁ASD儿童的神经发育水平有关,无性别差异;血清VB12水平与2~<4岁ASD儿童语言发育有关,与4~6岁ASD儿童适应性行为、精细运动和个人-社会行为有关,还与男童的语言和个人-社会行为相关。因此,保持正常的血清叶酸和VB12水平可能有益于ASD儿童,特别是<4岁ASD儿童的神经发育。
基金资助
国家自然科学基金面上项目(81771223)。
利益冲突声明
所有作者均声明无利益冲突。
作者贡献
吴媛负责数据收集与分析、论文撰写;陈红羽、龙丹、向雪利、冯钰茹、韦秋宏负责数据收集、整理;杨亭、陈洁、李廷玉负责文章的构思、设计与修改。
参 考 文 献
- 1. Maenner MJ, Warren Z, Williams AR, et al. Prevalence and characteristics of autism spectrum disorder among children aged 8 years: Autism and Developmental Disabilities Monitoring Network, 11 sites, United States, 2020[J]. MMWR Surveill Summ, 2023, 72(2): 1-14. DOI: 10.15585/mmwr.ss7202a1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Zhou H, Xu X, Yan W, et al. Prevalence of autism spectrum disorder in China: a nationwide multi-center population-based study among children aged 6 to 12 years[J]. Neurosci Bull, 2020, 36(9): 961-971. DOI: 10.1007/s12264-020-00530-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. 艾女湉, 张倩, 杨亭, 等. 孤独症谱系障碍儿童严重挑食与核心症状的关联[J]. 中国儿童保健杂志, 2022, 30(4): 355-360. DOI: 10.11852/zgetbjzz2021-0398. [DOI] [Google Scholar]
- 4. Leader G, Abberton C, Cunningham S, et al. Gastrointestinal symptoms in autism spectrum disorder: a systematic review[J]. Nutrients, 2022, 14(7): 1471. DOI: 10.3390/nu14071471. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Raghavan R, Riley AW, Volk H, et al. Maternal multivitamin intake, plasma folate and vitamin B12 levels and autism spectrum disorder risk in offspring[J]. Paediatr Perinat Epidemiol, 2018, 32(1): 100-111. DOI: 10.1111/ppe.12414. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. 孙艺, 梁爽, 孙彩虹, 等. 孤独症谱系障碍患儿血清叶酸及其代谢产物与维生素B12水平状况[J]. 中国学校卫生, 2018, 39(3): 331-334. DOI: 10.16835/j.cnki.1000-9817.2018.03.004. [DOI] [Google Scholar]
- 7. Al-Farsi YM, Waly MI, Deth RC, et al. Low folate and vitamin B12 nourishment is common in Omani children with newly diagnosed autism[J]. Nutrition, 2013, 29(3): 537-541. DOI: 10.1016/j.nut.2012.09.014. [DOI] [PubMed] [Google Scholar]
- 8. Li B, Xu Y, Pang D, et al. Interrelation between homocysteine metabolism and the development of autism spectrum disorder in children[J]. Front Mol Neurosci, 2022, 15: 947513. DOI: 10.3389/fnmol.2022.947513. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Altun H, Kurutaş EB, Şahin N, et al. The levels of vitamin D, vitamin D receptor, homocysteine and complex B vitamin in children with autism spectrum disorders[J]. Clin Psychopharmacol Neurosci, 2018, 16(4): 383-390. DOI: 10.9758/cpn.2018.16.4.383. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Saha S, Saha T, Rajamma U, et al. Analysis of association between components of the folate metabolic pathway and autism spectrum disorder in eastern Indian subjects[J]. Mol Biol Rep, 2022, 49(2): 1281-1293. DOI: 10.1007/s11033-021-06956-z. [DOI] [PubMed] [Google Scholar]
- 11. Yektaş Ç, Alpay M, Tufan AE. Comparison of serum B12, folate and homocysteine concentrations in children with autism spectrum disorder or attention deficit hyperactivity disorder and healthy controls[J]. Neuropsychiatr Dis Treat, 2019, 15: 2213-2219. DOI: 10.2147/NDT.S212361. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Liu X, Liu J, Xiong X, et al. Correlation between nutrition and symptoms: nutritional survey of children with autism spectrum disorder in Chongqing, China[J]. Nutrients, 2016, 8(5): 294. DOI: 10.3390/nu8050294. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. 周安然, 段桂琴, 王亚哲, 等. 孤独症谱系障碍儿童血清生物学因子水平分析[J]. 北京医学, 2021, 43(11): 1060-1064. DOI: 10.15932/j.0253-9713.2021.11.005. 34187293 [DOI] [Google Scholar]
- 14. First MB. Diagnostic and Statistical Manual of Mental Disorders, 5th Edition, and clinical utility[J]. J Nerv Ment Dis, 2013, 201(9): 727-729. DOI: 10.1097/NMD.0b013e3182a2168a. [DOI] [PubMed] [Google Scholar]
- 15. Mitchell ES, Conus N, Kaput J. B vitamin polymorphisms and behavior: evidence of associations with neurodevelopment, depression, schizophrenia, bipolar disorder and cognitive decline[J]. Neurosci Biobehav Rev, 2014, 47: 307-320. DOI: 10.1016/j.neubiorev.2014.08.006. [DOI] [PubMed] [Google Scholar]
- 16. Georgieff MK, Ramel SE, Cusick SE. Nutritional influences on brain development[J]. Acta Paediatr, 2018, 107(8): 1310-1321. DOI: 10.1111/apa.14287. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. Ali A, Waly MI, Al-Farsi YM, et al. Hyperhomocysteinemia among Omani autistic children: a case-control study[J]. Acta Biochim Pol, 2011, 58(4): 547-551. [PubMed] [Google Scholar]
- 18. Zhu J, Guo M, Yang T, et al. Nutritional status and symptoms in preschool children with autism spectrum disorder: a two-center comparative study in Chongqing and Hainan province, China[J]. Front Pediatr, 2020, 8: 469. DOI: 10.3389/fped.2020.00469. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Peretti S, Mariano M, Mazzocchetti C, et al. Diet: the keystone of autism spectrum disorder?[J]. Nutr Neurosci, 2019, 22(12): 825-839. DOI: 10.1080/1028415X.2018.1464819. [DOI] [PubMed] [Google Scholar]
- 20. 蔡小凡, 郭敏, 刘李燕, 等. 叶酸和维生素B12与孤独症谱系障碍儿童症状和发育水平相关性研究[J]. 中国实用儿科杂志, 2021, 36(7): 514-517. DOI: 10.19538/j.ek2021070608. [DOI] [Google Scholar]
- 21. Guo M, Li L, Zhang Q, et al. Vitamin and mineral status of children with autism spectrum disorder in Hainan Province of China: associations with symptoms[J]. Nutr Neurosci, 2020, 23(10): 803-810. DOI: 10.1080/1028415X.2018.1558762. [DOI] [PubMed] [Google Scholar]
- 22. Li Q, Yang T, Chen L, et al. Serum folate status is primarily associated with neurodevelopment in children with autism spectrum disorders aged three and under: a multi-center study in China[J]. Front Nutr, 2021, 8: 661223. DOI: 10.3389/fnut.2021.661223. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23. Prado EL, Dewey KG. Nutrition and brain development in early life[J]. Nutr Rev, 2014, 72(4): 267-284. DOI: 10.1111/nure.12102. [DOI] [PubMed] [Google Scholar]
- 24. Hyman SL, Levy SE, Myers SM, et al. Identification, evaluation, and management of children with autism spectrum disorder[J]. Pediatrics, 2020, 145(1): e20193447. DOI: 10.1542/peds.2019-3447. [DOI] [PubMed] [Google Scholar]
- 25. Beggiato A, Peyre H, Maruani A, et al. Gender differences in autism spectrum disorders: divergence among specific core symptoms[J]. Autism Res, 2017, 10(4): 680-689. DOI: 10.1002/aur.1715. [DOI] [PubMed] [Google Scholar]
- 26. Xiong X, Liu D, He W, et al. Identification of gender-related metabolic disturbances in autism spectrum disorders using urinary metabolomics[J]. Int J Biochem Cell Biol, 2019, 115: 105594. DOI: 10.1016/j.biocel.2019.105594. [DOI] [PubMed] [Google Scholar]
- 27. Aita C, Mizoguchi Y, Yamamoto M, et al. Oxytocin levels and sex differences in autism spectrum disorder with severe intellectual disabilities[J]. Psychiatry Res, 2019, 273: 67-74. DOI: 10.1016/j.psychres.2018.12.139. [DOI] [PubMed] [Google Scholar]


