Abstract
时间干涉(TI)作为一种新的神经调控技术可以应用于非侵入性深部脑刺激。为了验证它在动物运动行为调控中的有效性,本文使用TI方法将包络电场聚焦到小鼠脑深部的丘脑腹后外侧核(VPL)调控左、右转运动行为。通过有限元方法分析TI在小鼠VPL的聚焦性,利用数值计算获得聚焦面积和体积,采用刺激器产生TI电流对小鼠VPL进行刺激,验证TI刺激方法的有效性,进一步通过c-Fos免疫荧光实验确定聚焦位置的准确性。结果表明,通过调整电极位置,当刺激电流达到800 μA时,TI刺激产生的电场能够聚焦到VPL核团;小鼠能够根据刺激位置进行相应的左、右转;刺激后VPL核团c-Fos阳性细胞标记明显增加。本研究证实了TI在动物运动行为调控中的可行性,为动物机器人提供了一种对脑组织无创的刺激方法。
Keywords: 时间干涉, 行为调控, 丘脑腹后外侧核, 刺激电流
Abstract
Temporal interference (TI) as a new neuromodulation technique can be applied to non-invasive deep brain stimulation. In order to verify its effectiveness in the regulation of motor behavior in animals, this paper uses the TI method to focus the envelope electric field to the ventral posterior lateral nucleus (VPL) of the thalamus in the deep brain of mouse to regulate left- and right-turning motor behavior. The focusability of TI in the mouse VPL was analyzed by finite element method, and the focus area and volume were obtained by numerical calculation. A stimulator was used to generate TI current to stimulate the mouse VPL to verify the effectiveness of the TI stimulation method, and the accuracy of the focus location was further determined by c-Fos immunofluorescence experiments. The results showed that the electric field generated by TI stimulation was able to focus on the VPL nuclei when the stimulation current reached 800 μA; the mouse were able to make corresponding left and right turns according to the stimulation position; and the c-Fos positive cell markers in the VPL nuclei increased significantly after stimulation. This study confirms the feasibility of TI in regulating animal motor behavior and provides a non-invasive stimulation method for brain tissue for animal robots.
Keywords: Temporal interference, Behavioral regulation, Ventral posterior lateral nucleus of the thalamus, Stimulation current
0. 引言
运动行为调控研究广泛应用于动物机器人控制,其基本原理是根据动物的神经生物学特点,选取能够导致发生预期运动行为的相关脑区,利用适宜的人工电信号刺激所选脑区的适宜神经位点,导致动物发生相应的运动行为[1-2]。传统调控方式是以植入电极的深部脑刺激方法进行的,在大鼠、鲤鱼、鸽子等动物体均取得了较好的控制效果[3-6]。然而,长期电极植入及刺激引起的胶质细胞增生,会使得动物运动控制效果减弱或消失,同时也存在感染等伤害的局限[7-8]。因此,寻找新的对脑组织无创的调控方法具有重要意义。
在动物机器人非侵入式运动行为调控中,Pi等[9]利用多种刺激方式,将超声波刺激源、表皮电极刺激和光辅助刺激相结合,控制了大鼠的基本运动行为;彭勇等[10-11]则利用光刺激装置及光控实验方法控制鲤鱼机器人的转向和前进行为;Kim等[12]通过光、电和食物奖励等联合刺激诱导形成操作式条件反射,完成对海龟运动行为的调控。上述研究主要为光源、超声以及多种方式的结合刺激,刺激位置在皮层或外周感受器官。
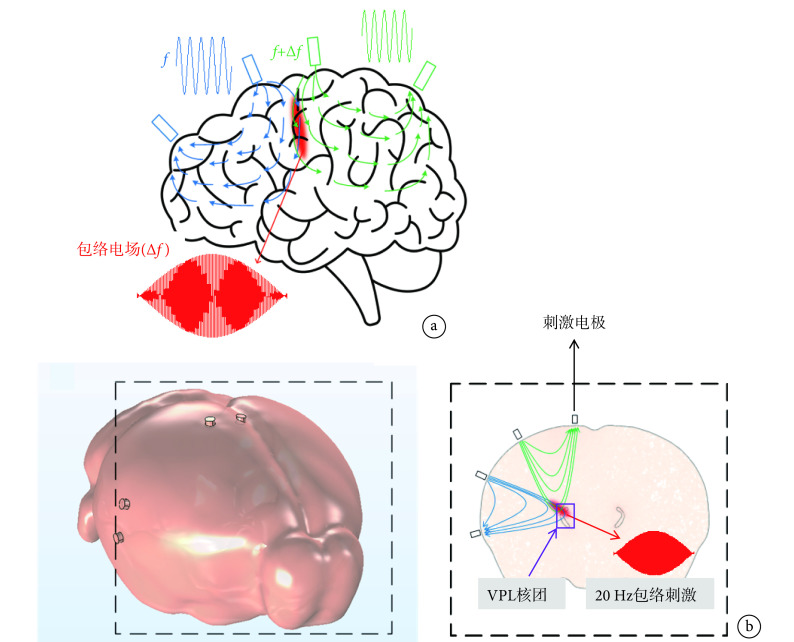
时间干涉(temporal interference,TI)是Grossman等[13]提出的一种新型非侵入性神经调控方式,该方法通过两组流经组织的互不干扰的高频交变电流产生的频率差,改变作用区域神经元的活动(见图1a),从而实现以无创方式调控深部脑区神经功能的目的。TI神经调控方法的提出引起了广泛的关注,Rampersad等[14]通过TI方法注入总电流776 μA,在模拟的小鼠脑中可以产生383 V/m的电场强度。Gomez-Tames等使用多尺度小鼠模型计算研究,发现TI神经调控产生阈值随着载波频率的增加而增加,并且拍频不影响阈值[15]。为了精确定位脑内的较小区域,Song等[16]提出了一种多通道TI策略,该策略使用多对电极,能够产生多组干扰电场,通过尝试不同的频率进行动物实验,成功激活了小鼠的运功皮层神经元。Missey等[17-18]使用方向可调的时间干扰方法(ot-TI)和激光驱动的无线TI方法,在小鼠海马体(CA1、CA3)成功地唤起了具有快速放电特征频率的癫痫事件。然而,当前对于TI刺激的研究都是在较大的核团中进行研究的,且核团的深度相对较浅。
图 1.
Time interference stimulation mode of action
时间干涉刺激作用方式
a. 时间干涉原理图;b. 小鼠头部模型以及VPL的截面原理图
a. a principle diagram of temporal interference; b. a diagram of the mouse brain model and a cross-sectional of VPL
动物机器人研究中,采用丘脑腹后外侧核(ventral posterolateral nucleus of the thalamus,VPL)能够有效完成对动物的左、右转运动行为调控。VPL核团的深度为4.1~4.6 mm,在此区域实现电场的聚焦和对动物运动行为的调控具有挑战性。本研究通过仿真和动物实验验证TI神经调控方法的可行性。首先建立精确的小鼠头部以及VPL模型,利用有限元方法计算TI刺激在小鼠头部模型中电场大小和分布情况,运用数值计算的方法研究TI的聚焦性,以确定TI刺激是否精确定位到小鼠脑中体积较小、深度较深的VPL核团(见图1b)。再结合仿真实验,进行动物实验验证,并通过c-Fos免疫荧光实验确定其聚焦位置。
1. 方法
1.1. 小鼠头部模型和VPL模型构建
建立小鼠头部和VPL模型使用的数据集来自Allen Brain Atlas研究机构[19]。将数据集图片导入MIMICS软件中,通过MASK指令重建小鼠头部模型和VPL模型,对模型进行光滑处理后,再通过GeoMagic软件对模型进行优化处理以满足有限元分析要求。建立的头部模型尺寸为19.21 mm × 16.20 mm × 11.70 mm,分辨率为10 μm。整体建模过程如图2所示。
图 2.
Construction of mouse brain and VPL model
小鼠头部模型和VPL模型的构建过程
1.2. 虚拟仿真方法
在COMSOL软件中,将刺激电极和接地电极嵌入组织模型环境中,电极半径为0.3 mm,高度为0.4 mm,以lambda点为坐标原点,将电极布置在小鼠脑表面上左右± 2 mm,从后到前依次为–0.3、1.7、4.7、6.7 mm。设置电极的电导率为6 × 106 S/m,小鼠脑部模型的电导率为0.333 S/m,两组电极刺激参数(f1 = 2 kHz,f2 = 2.02 kHz,∆f = 20 Hz),总刺激时间1 s,并以时间间隔为0.001 s产生一个仿真结果。
1.3. 动物及手术
雄性昆明小鼠(8~10周,购于北京维通利华实验动物有限公司),体重30~40 g,实验前后均放置于透明笼中,房间温度控制在(20 ± 3)℃。手术前12 h停止喂食,术前用10%的水合氯醛(400 mg/kg)腹腔注射麻醉。将小鼠固定在立体定位仪上,切开头皮,分离两侧皮肤除去肌肉和骨膜。以lambda点为参考点,使用仿真得到的坐标将四个不锈钢螺钉电极固定于颅骨,并用牙科水泥将与之相连的排母固定于颅骨(见图3)。术后5~7 d,经检查伤口愈合较好、无异常反应、各项生理参数均正常的小鼠,可进行TI刺激行为学实验。
图 3.
Animal surgical model
动物手术模型
a. 仿真实验确定的电极放置位置;b. 电极放置位置模式图;c. 电极固定完成
a. electrode placement position determined by simulation experiments; b. electrode placement pattern diagram; c. electrode fixation completed
1.4. c-Fos免疫荧光实验
选取小鼠的单侧VPL核团进行TI刺激,另一侧不刺激作为对照。以刺激10 s、停止刺激10 s的方式,刺激10 min,选取刺激转向效果较好的小鼠进行后续实验。刺激结束后2 h,使用10%水合氯醛对小鼠过量麻醉,灌流,固定,取脑,并将脑组织置于4%的多聚甲醛溶液中后固定4 h,然后依次移入含有15%和30%蔗糖的磷酸缓冲液(phosphate buffer solution,PBS)中进行梯度脱水。冰冻连续切片,厚度35 μm。
选取含有VPL核团的切片进行免疫荧光实验,步骤如下(每个步骤完成后均使用PBS漂洗5次,每次5 min):① 含2%正常驴血清的PBS溶液常温孵育2 h。② c-Fos兔单克隆抗体(1∶500),4 ℃孵育过夜。③ FITC(1∶500)标记的山羊抗兔IgG溶液,常温避光4 h。④ DAPI溶液常温避光10 min。反应结束后,将切片贴附于多聚赖氨酸处理的载玻片上,使用甘油和PBS(1∶1)溶液封片。通过荧光显微镜(LEICA,DMi8,德国)观察,标记结果采用ImageJ软件分析。
2. 结果
2.1. TI刺激在VPL的聚焦性仿真
将注入电流以每组300 μA增加到1 000 μA(步长100 μA),观察到电场聚焦位置由浅到深(见附件1),其中电流为800 μA时,在VPL核团边界聚焦较好(见图4a)。测得VPL处电场强度结果如表1所示,从表中数据可知,随着电流的增加,聚焦的电场强度也随之增加。小鼠头部模型实验结果表明,800 μA时在小鼠头皮处的电场强度比较小(≤ 27.516 V/m),在VPL核团边界处的电场强度较大,并且在1 s时VPL核团边界处最大电场可以达到153.667 V/m。
图 4.
Focusing effect of electric field on VPL nuclei
电场在VPL核团处聚焦效果
a. 二维平面图以及VPL处局部放大图;b. VPL核团表面电场分布图
a. two-dimensional plan view and partial enlargement at VPL; b. surface electric field distribution map of VPL nuclear clusters
表 1. The magnitude of electric field intensity at VPL nuclei with different currents.
不同电流下VPL核团处电场强度
| 电流大小/μA | 电场强度/(V/m) | 电流大小/μA | 电场强度/(V/m) | |
| 300 | 40.537 | 700 | 95.580 | |
| 400 | 46.025 | 800 | 153.667 | |
| 500 | 50.716 | 900 | 222.260 | |
| 600 | 57.042 | 1000 | 328.190 |
二维图像(见图4a)只能反映一个截面的聚焦分布,无法直观反映电场在VPL核团实际的电场聚焦分布情况。为此,通过三维模型呈现了VPL核团表面的电场聚焦情况(见图4b)。通过二维-三维的TI聚焦分布情况可以观察到,在VPL核团周边产生的包络电场强度较高,在核团内部产生的电场强度较低,这与Missey等[17]的结果一致。
2.2. 聚焦性计算
TI神经调控聚焦性的评判主要包括刺激强度、刺激深度、聚焦面积等几个方面[18, 20]。本研究中,刺激强度为聚焦位置的最大电场强度,实验中采用了800 μA的注入电流,通过小鼠模型仿真实验,得到VPL边界周围的最大电场强度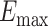 为153.667 V/m。Koponen等[21]使用了超出最大电场值的
为153.667 V/m。Koponen等[21]使用了超出最大电场值的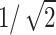 部分来定义聚焦点的体积,这种聚焦性的定义方法适用于最大刺激在明确目标区域内的情况。从仿真二维平面结果可以观察到本实验的聚焦范围在VPL核团组织附近,因此采用该方法进行聚焦性的数值计算。刺激深度表征TI刺激在小鼠脑内部的穿透能力,计算头皮位置与感应电场强度为
部分来定义聚焦点的体积,这种聚焦性的定义方法适用于最大刺激在明确目标区域内的情况。从仿真二维平面结果可以观察到本实验的聚焦范围在VPL核团组织附近,因此采用该方法进行聚焦性的数值计算。刺激深度表征TI刺激在小鼠脑内部的穿透能力,计算头皮位置与感应电场强度为 的最大距离表示刺激深度
的最大距离表示刺激深度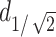 ,通过坐标位置的计算得到本研究中的
,通过坐标位置的计算得到本研究中的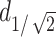 为4.52 mm,该深度在VPL深度范围之内。聚焦面积计算公式如下:
为4.52 mm,该深度在VPL深度范围之内。聚焦面积计算公式如下:
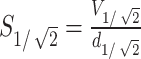 |
1 |
式中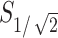 表示聚焦面积;
表示聚焦面积;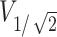 表示半值体积,指暴露在大于或等于
表示半值体积,指暴露在大于或等于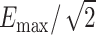 中的脑区域的体积。通过COMSOL软件算出小鼠模型中每个时间点的半值体积,如图5a所示,计算出的聚焦体积
中的脑区域的体积。通过COMSOL软件算出小鼠模型中每个时间点的半值体积,如图5a所示,计算出的聚焦体积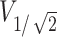 最大值为19.1 mm3,根据式(1)可以计算出聚焦面积
最大值为19.1 mm3,根据式(1)可以计算出聚焦面积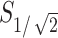 的最大值为4.22 mm2;1 s时聚焦体积
的最大值为4.22 mm2;1 s时聚焦体积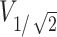 为17.81 mm3,1 s时聚焦面积
为17.81 mm3,1 s时聚焦面积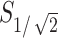 为3.94 mm2。聚焦面积随时间的变化如图5b所示。从聚焦面积和体积随时间变化的曲线图可知,聚焦性在0.35 s之前变化较大,而在0.80 s以后聚焦面积和体积数值趋于稳定,故仿真实验中设计刺激时长为1 s可以满足实验的要求。
为3.94 mm2。聚焦面积随时间的变化如图5b所示。从聚焦面积和体积随时间变化的曲线图可知,聚焦性在0.35 s之前变化较大,而在0.80 s以后聚焦面积和体积数值趋于稳定,故仿真实验中设计刺激时长为1 s可以满足实验的要求。
图 5.
Change trend in focus volume and focus area
聚焦体积和聚焦面积变化趋势图
a. 体积变化图;b. 面积变化图
a. volume change chart; b. area change chart
通过COMSOL软件可以计算出单个VPL核团模型的表面积为3.5946 mm2,数值计算得出的聚焦面积比单个核团的表面积略大,这可能是在计算时把VPL核团周围的部分电场计算在内。
2.3. 小鼠刺激结果
通过两个刺激器(成都仪器厂,RM6240E/EC多道生理信号采集处理系统,中国)产生一组频率为2 kHz、另一组为2.02 kHz,电流大小同为800 μA可调的TI刺激进行动物实验验证。将刺激器连接到小鼠头部固定电极,施加TI刺激调控小鼠的运动行为(见图6)。为了验证TI刺激对小鼠的控制效果,本研究分别在10只小鼠中进行了双侧VPL刺激实验。
图 6.
RM6240E systems form an enveloping electric field to stimulate mice
RM6240E系统形成包络电场刺激小鼠
分别刺激10只小鼠左、右两侧VPL各20次,其中有8只成功地完成了左、右转向调控(以转向成功率达到80%为标准),实验成功率80%。为了达到理想的调控效果,不同小鼠实验时施加的电流略不同,变动范围750~850 μA,小鼠刺激实验施加电流和转向成功率如表2所示。动物左、右转向调控视频见附件2~3。
表 2. Animal control experiment results.
动物控制实验结果
| 小鼠 | 电流/μA | 刺激总次数 | 左转次数 | 右转次数 | 转向成功率 |
| 1 | 800 | 40 | 17 | 18 | 87.5% |
| 2 | 750 | 40 | 18 | 17 | 87.5% |
| 3 | 800 | 40 | 16 | 17 | 82.5% |
| 4 | 750 | 40 | 15 | 18 | 82.5% |
| 5 | 850 | 40 | 18 | 15 | 82.5% |
| 6 | 800 | 40 | 18 | 14 | 80.0% |
| 7 | 750 | 40 | 17 | 18 | 87.5% |
| 8 | 750 | 40 | 15 | 19 | 85.0% |
| 9 | 800 | 40 | 5 | 6 | 27.5% |
| 10 | 800 | 40 | 3 | 1 | 10.0% |
2.4. c-Fos荧光反应实验结果
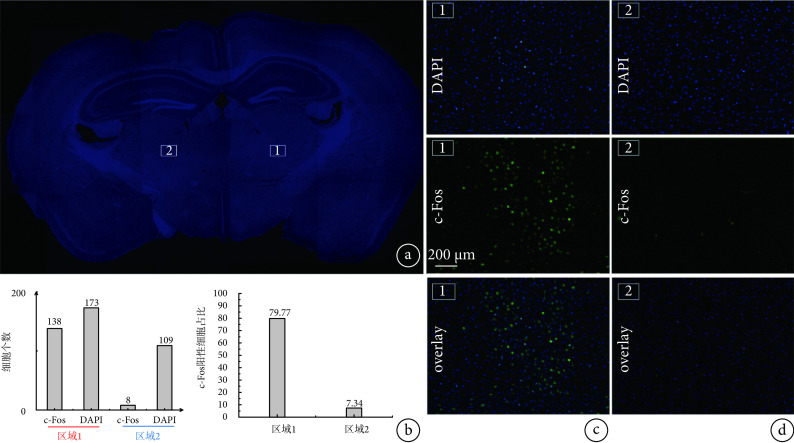
对采集的图像进行分析,将同一位置的DAPI细胞染色图像和c-Fos阳性细胞图像重合,如图7所示,1号VPL刺激区域的c-Fos阳性细胞较多,并且几乎与DAPI细胞重叠。2号对照区域的c-Fos阳性细胞较少,在重叠图像中几乎看不到与DAPI的重叠。使用ImageJ软件对细胞进行计数,如图7b所示,1号区域c-Fos阳性细胞占比为79.77%,远远高于2号区域的7.34%。从c-Fos阳性细胞占比数据以及重叠图像中,可以直观地发现刺激区域与非刺激区域的差别。
图 7.
Comparison of c-Fos reaction results
c-Fos反应对比结果
a. 荧光显微镜下采集的小鼠脑切片整体图;b. 区域1和区域2采集的DAPI、c-fos阳性细胞个数统计图以及c-fos阳性细胞占比对比图;c. 1号刺激区域DAPI、c-fos阳性细胞及其叠加图;d. 2号未刺激区域DAPI、c-fos阳性细胞及其叠加图
a. overall view of a mouse brain section collected under fluorescence microscope; b. statistical graphs of the number of DAPI and c-fos positive cells collected from regions 1 and 2 and the comparison of the percentage of c-fos positive cells; c. DAPI, c-fos-positive cells and their merged image on the map of stimulation region #1; d. DAPI, c-fos-positive cells and their merged image on the map of unstimulated region #2
为验证TI神经调控刺激方法作用的区域,本文对电极下方的皮层区域Ⅰ和Ⅱ以及偏离电极的VPL核团Ⅲ、皮层区域Ⅳ分别采集图像,发现区域Ⅰ、Ⅱ、Ⅳ无明显c-Fos阳性细胞,而VPL核团Ⅲ附近阳性细胞较多(具体图示见附件4)。这与TI神经调控刺激原理相吻合,即TI神经调控刺激方法不会作用于电极周边的皮层区域,而是聚焦到特定的脑区发挥作用。
3. 讨论
已有的TI刺激大多以动物的海马体(CA1-CA3)或其他浅层脑区作为靶点[18-19],实现特定功能的调控。Missey等以50 μA为步长增加刺激电流,实现了TI刺激小鼠海马体诱发癫痫事件;Zhang等通过TI成功激活大鼠的初级运动皮层。根据动物机器人的调控原理,本文选取能够引起小鼠左、右转行为的VPL核团。相比于已有研究,VPL核团深度更深,体积小,TI刺激聚焦到该脑区具有一定挑战性。本文将刺激电流大小以100 μA为步长从每组300 μA开始逐渐递增,直到出现良好的聚焦性为止。仿真结果发现电流强度在300~500 μA时,包络电场在皮层区域聚焦,并且随着电流强度的增加,聚焦深度和电场强度也在逐渐增加;当电流增加到每组600 μA时,在鼠脑VPL核团周边出现良好的聚焦性,继续提高电流强度,聚焦深度不再增加,仅聚焦位置的电场强度不断增大。表1记录了不同电流强度下,所产生的最大电场值,结合附件1可知包络电场能够聚焦到深度较深的VPL核团处,通过仿真实验与动物实验结合,发现电流强度在800 μA时能够实现小鼠左右转控制,当电流继续增大时,则会引起小鼠痉挛反应。因此,文中刺激实验采用了800 μA左右的电流强度进行调控测试。
为了更直观地获得TI刺激位置的数据,本文通过二维和三维图像和数值计算进一步优化了聚焦结果。Missey等建立的模型可以从三维模型中看到电场线的表达,由二维平面结果反映场强大小。在此基础上,本文通过二维平面结果进行数值运算,可以计算出TI电场作用的深度和聚焦性,通过三维模型可以观察到TI产生的电场在VPL核团周围的表达结果,并发现电场集中在VPL核团边界。本研究采用Koponen等[21]的方法,计算了TI刺激方法聚焦的深度为4.52 mm,在VPL实际深度范围中;同时计算了聚焦面积为3.94 mm2,该数值与实际VPL核团的截面积接近。仿真和数值计算结果验证了TI刺激聚焦到VPL核团的可行性。
已有的动物机器人运动行为调控研究大部分为植入式电极刺激,Huai等[22]对10只大鼠进行了测试,其中8只可以按照指定的路线进行引导。2只大鼠因电极植入不准确未能得到有效控制,刺激成功率达到80%。该团队另一项研究[23]中指出控制大鼠的成功率可达90%。王浩等[24]对鸽子的运动行为调控成功率为90%。本文在TI调控小鼠运动行为的实验中,对10只小鼠进行实验,其中有8只小鼠能够根据刺激指令进行左、右转,成功率达到80%,与植入式电极刺激方式相当。
非侵入式刺激调控生物机器人目前主要集中在刺激表层脑区及光控动物外部视觉诱导方面。Pi等[9]针对大鼠机器人,利用超声波刺激其听觉、表皮电极刺激其痛觉及LED灯光辅助刺激器刺激其视觉,从而控制动物运动行为。Kim等[12]采用LED刺激诱导,并通过反复的刺激-奖励交互形成操作式条件反射,完成对海龟运动行为的调控。彭勇等[11]提出了一种用于鲤鱼机器人的光刺激装置及光控实验方法,诱导鲤鱼在水迷宫中完成转向和前进动作,且不同波长的光对运动速度产生了不同的影响。TI作为一种可聚焦到脑内深部核团的神经调控方法,近年来引起了广泛关注[25-27],本文通过模型验证了TI刺激小鼠VPL核团的可行性,在此基础上,提出了TI刺激调控动物机器人的一种新方法,并完成了对小鼠左、右转向行为的控制。尽管本文已经验证了TI刺激深部脑区对动物运动行为调控的可行性,但要想达到完全的非侵入式TI刺激,需要对小鼠头部模型中的颅骨、头皮等部位深入建模,这也是下一步需要开展的工作之一。此外,对于动物机器人应用而言,多个神经核团同时刺激以调控不同运动行为以及TI遥控刺激系统两方面的工作也需要进一步探索。
本研究采用即刻早期基因c-Fos来标记刺激后VPL核团周围的神经激活情况,验证TI在脑内的聚焦效果。通过细胞计数发现,VPL靶区激活神经元数与总神经元数的比值为79.77%,非靶区激活神经元数为7.34%,刺激区域与非刺激区域神经元激活数存在明显的差异。Song等将TI神经调控后的小鼠脑进行切片,通过免疫荧光标记观察c-Fos的表达[16],研究发现,靶区激活神经元数与总神经元数的比值为82.4%,非靶区激活神经元数为18.2%,该研究中靶区和非靶区中激活神经元数占比略高于本研究,可能与靶向深度或抗体的敏感性有关。c-Fos免疫反应实验并非验证TI刺激效果的唯一方法,通过采集小鼠特定位点的场电位信号也可以体现TI刺激产生的电场在小鼠脑内引起的反应[16-17],在刺激后使用肌电信号及时观察动物的响应也是一种无损且实时的评价方式。为了从多方面验证TI刺激方法在动物运动行为调控中的应用效果,在今后的研究中,将继续探索TI刺激后特定脑区场电位或特定肌肉的电信号变化,通过实时分析电信号有效评价动物对TI刺激的反应。
4. 结论
本文通过TI刺激方法聚焦到脑内深度较深、体积较小的VPL核团,从而调控小鼠左、右转向的运动行为。首先,仿真和数值计算方法证实了TI方法聚焦的有效性。通过调节电极放置的位置和电流强度大小将包络电场聚焦到VPL核团,确定了当电流为800 μA时电场聚焦性良好。通过数值计算方法,得出聚焦深度为4.52 mm,该深度在VPL核团深度范围之内,同时计算出聚焦面积在0~0.35 s时波动较大,在0.80 s后趋于稳定,为3.94 mm2,此面积较小,能够聚焦到VPL核团。其次,动物实验证明了TI方法能够有效调控小鼠左、右转向的运动行为。在小鼠实验中,根据数值模拟实验确定的颅骨位置放置电极,施加的电流强度为800 μA,发现小鼠能够根据控制指令进行相应的左、右转向行为。最后,c-Fos荧光反应实验验证了小鼠实验中TI聚焦的位置为VPL核团。在c-Fos荧光反应实验中,能够从脑切片上观察到VPL核团附近的c-Fos阳性细胞较多,而小鼠浅层区域以及非刺激区域的c-Fos阳性细胞较少。结果表明,TI刺激能够聚焦到VPL核团,并调控小鼠左、右转向的运动行为。本文为动物机器人运动行为调控提供了一种对脑组织无创的刺激方法。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突。
作者贡献声明:朱浩然负责实验平台搭建,论文撰写、修订。于志豪负责实验设计与指导。张平丘、殷涛负责动物实验手术及数据记录。汪慧负责动物实验设计与分析。杨俊卿负责实验平台指导与维护。槐瑞托负责研究计划安排、实验指导、论文审阅修订。邵峰负责提供动物及实验规范性指导。
伦理声明:本研究通过了山东本明生物科技股份有限公司动物伦理委员会的审批。
本文附件见本刊网站的电子版本(biomedeng.cn)。
Funding Statement
国家自然科学基金(61903230);山东省自然科学基金(ZR2020MF098)
References
- 1.苏学成, 槐瑞托, 杨俊卿, 等 控制动物机器人运动行为的脑机制和控制方法. 中国科学: 信息科学. 2012;42(9):1130–1146. [Google Scholar]
- 2.郭策, 戴振东, 孙久荣 生物机器人的研究现状及其未来发展. 机器人. 2005;(2):187–192. doi: 10.3321/j.issn:1002-0446.2005.02.019. [DOI] [Google Scholar]
- 3.Talwar S K, Xu S, Hawley E S, et al Rat navigation guided by remote control. Nature. 2002;417(6884):37–38. doi: 10.1038/417037a. [DOI] [PubMed] [Google Scholar]
- 4.Yang J, Huai R, Wang H, et al A robo-pigeon based on an innovative multi-mode telestimulation system. Biomed Mater Eng. 2015;26(s1):S357–S363. doi: 10.3233/BME-151323. [DOI] [PubMed] [Google Scholar]
- 5.彭勇, 王婷婷, 闫艳红, 等 鲤鱼机器人无线遥控系统设计与应用. 中国生物医学工程学报. 2019;38(4):431–437. doi: 10.3969/j.issn.0258-8021.2019.04.007. [DOI] [Google Scholar]
- 6.Feng Z, Chen W, Ye X, et al A remote control training system for rat navigation in complicated environment. J Zhejiang Uni Sci A. 2007;8:323–330. [Google Scholar]
- 7.伊国胜, 焦立峰, 王江, 等 深部脑刺激的逆向激活效应及其研究进展. 中国生物医学工程学报. 2021;40(3):364–374. doi: 10.3969/j.issn.0258-8021.2021.03.12. [DOI] [Google Scholar]
- 8.Vissani M, Isaias I U, Mazzoni A Deep brain stimulation: a review of the open neural engineering challenges. J Neural Eng. 2020;17(5):051002. doi: 10.1088/1741-2552/abb581. [DOI] [PubMed] [Google Scholar]
- 9.Pi X, Li S, Xu L, et al A preliminary study of the noninvasive remote control system for rat bio-robot. J. Bionic Eng. 2010;7(4):375–381. doi: 10.1016/S1672-6529(10)60269-7. [DOI] [Google Scholar]
- 10.彭勇, 韩晓晓, 王婷婷, 等 一种用于鲤鱼机器人的光刺激装置及光控实验方法. 生物医学工程学杂志. 2018;35(5):720–726. doi: 10.7507/1001-5515.201801076. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.彭勇, 赵洋, 张乾, 等 不同波长的光对鲤鱼机器人运动行为影响的研究. 生物医学工程学杂志. 2021;38(4):647–654. doi: 10.7507/1001-5515.202012078. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Kim D G, Lee S, Kim C H, et al Parasitic robot system for waypoint navigation of turtle. J Bionic Eng. 2017;14(2):327–335. [Google Scholar]
- 13.Grossman N, Bono D, Dedic N, et al Noninvasive deep brain stimulation via temporally interfering electric fields. Cell. 2017;169(6):1029–1041. doi: 10.1016/j.cell.2017.05.024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Rampersad S, Roig-Solvas B, Yarossi M, et al Prospects for transcranial temporal interference stimulation in humans: a computational study. NeuroImage. 2019;202:116124. doi: 10.1016/j.neuroimage.2019.116124. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Gomez-Tames J, Asai A, Hirata A Multiscale computational model reveals nerve response in a mouse model for temporal interference brain stimulation. Front Neurosci. 2021;15:684465. doi: 10.3389/fnins.2021.684465. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Song X, Zhao X, Li X, et al Multi-channel transcranial temporally interfering stimulation (tTIS): application to living mice brain. J Neur Eng. 2021;18(3):036003. doi: 10.1088/1741-2552/abd2c9. [DOI] [PubMed] [Google Scholar]
- 17.Missey F, Rusina E, Acerbo E, et al Orientation of temporal interference for non-invasive deep brain stimulation in epilepsy. Front Neurosci. 2021;15:656. doi: 10.3389/fnins.2021.633988. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Missey F, Donahue M J, Weber P, et al Laser‐driven wireless deep brain stimulation using temporal interference and organic electrolytic photocapacitors. Adv Funct. 2022;32(33):2200691. [Google Scholar]
- 19.Wang Q, Ding S L, Li Y, et al. The Allen mouse brain common coordinate framework: a 3D reference atlas. Cell, 2020, 181(4): 936-953. e20.
- 20.熊慧, 景昭, 刘近贞 新型经颅磁刺激三层-8字形线圈的结构设计. 浙江大学学报(工学版) 2021;55(4):793–800. doi: 10.3785/j.issn.1008-973X.2021.04.022. [DOI] [Google Scholar]
- 21.Koponen L M, Nieminen J O, Ilmoniemi R J Minimum-energy coils for transcranial magnetic stimulation: application to focal stimulation. Brain Stimul. 2015;8(1):124–134. doi: 10.1016/j.brs.2014.10.002. [DOI] [PubMed] [Google Scholar]
- 22.Huai R, Yang J, Wang H, et al. A new robo-animals navigation method guided by the remote control// 2009 2nd International Conference on Biomedical Engineering and Informatics. Tianjin: IEEE, 2009: 1-4.
- 23.王勇, 槐瑞托, 王敏, 等 基于脑微刺激的智能动物的研究. 中国生物医学工程学报. 2006;(4):497–502,506. doi: 10.3969/j.issn.0258-8021.2006.04.022. [DOI] [Google Scholar]
- 24.王浩, 王绍康, 邱兆成, 等 户外鸽子生物机器人的设计及初步应用. 生物医学工程学杂志. 2022;39(6):1209–1217. doi: 10.7507/1001-5515.202207077. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Esmaeilpour Z, Kronberg G, Reato D, et al Temporal interference stimulation targets deep brain regions by modulating neural oscillations. Brain Stimul. 2021;14(1):55–65. doi: 10.1016/j.brs.2020.11.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Guo W, He Y, Zhang W, et al A novel non-invasive brain stimulation technique: “Temporally interfering electrical stimulation”. Front Neurosci. 2023;17:1092539. doi: 10.3389/fnins.2023.1092539. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Zhang Z, Lin B S, Wu C W G, et al Designing and pilot testing a novel transcranial temporal interference stimulation device for neuromodulation. IEEE T Neur Sys Reh. 2022;30:1483–1493. doi: 10.1109/TNSRE.2022.3179537. [DOI] [PubMed] [Google Scholar]