Abstract
目的
探究锌指蛋白-36(ZFP36)对成骨细胞分化的调控作用及机制。
方法
通过提取小鼠原代骨髓间充质干细胞, 结合小鼠成骨细胞前体细胞系MC3T3-E1, 在体外成骨分化诱导状态下观察Zfp36(编码ZFP36)的表达变化。通过干扰RNA技术构建Zfp36缺陷的细胞, 观察成骨分化作用的改变。通过第二代转录组测序技术探究Zfp36缺陷细胞成骨分化过程中的转录组水平改变。通过ERK/MAPK信号抑制分子U0126验证Zfp36缺陷对成骨分化作用的调控机制。
结果
小鼠原代骨髓间充质细胞以及MC3T3-E2细胞中Zfp36表达在成骨分化0~14 d过程中呈逐渐升高趋势, 在第7天到达峰值时较第0天升高3.85倍(P < 0.0001)。抑制上述细胞Zfp36的表达后, 成骨分化过程中碱性磷酸酶染色及茜素红染色弱于对照组, 成骨分化标志基因Alpl (P < 0.01)、Sp7(P < 0.001)、Bglap (P < 0.01)、Ibsp (P < 0.0001)表达显著减弱。转录本测序结果提示Zfp36缺陷细胞的下调基因富集到骨矿化相关基因集中, 且与ERK信号相关。蛋白表达检测显示Zfp36缺陷细胞的磷酸化ERK蛋白比例较对照组升高2.1倍(P=0.0274)。通过分子化合物U0126抑制Zfp36缺陷细胞中被激活的ERK/MAPK信号, 可观察到表型挽救现象, 并且呈剂量依赖。Zfp36缺陷细胞在10 μmol/L度U0126作用下碱性磷酸酶染色增强, 成骨细胞分化标志基因Runx2(P < 0.05)及Bglap (P < 0.05)表达显著增高。
结论
ZFP36参与了小鼠成骨细胞的分化调控过程, Zfp36缺陷会引起ERK/MAPK信号通路的激活, 进而抑制成骨细胞向骨细胞的分化。
Keywords: 锌指蛋白-36, 成骨细胞分化, ERK/MAPK信号通路, 骨髓间充质干细胞
Abstract
Objective
To explore the role of zinc finger protein 36(ZFP36) in regulating osteogenic differentiation of bone marrow-derived mesenchymal stem cells (BMSCs) and preosteoblasts.
Methods
ZFP36 expression was observed in primary mouse BMSCs and mouse preosteoblasts (MC3T3-E1 cells) during induced osteogenic differentiation. Zfp36-deficient cell models were constructed in the two cells using RNA interference technique and the changes in differentiation capacities of the transfected cells into osteoblasts were observed. Transcriptome sequencing was used to investigate the potential mechanisms of ZFP36 for regulating osteoblast differentiation of the two cells. U0126, a ERK/MAPK signal suppressor, was used to verify the regulatory mechanism of Zfp36 in osteogenic differentiation of Zfp36-deficient cells.
Results
During the 14-day induction of osteogenic differentiation, both mouse BMSCs and MC3T3-E1 cells exhibited increased expression of ZFP36, and its mRNA expression reached the peak level on Day 7(P < 0.0001). The Zfp36-deficient cell models showed reduced intensity of alkaline phosphatase (ALP) staining and alizarin red staining with significantly lowered expressions of the osteogenic marker genes including Alpl, Sp7, Bglap and Ibsp (P < 0.01). Transcriptome sequencing verified the reduction of bone mineralization-related gene expressions in Zfp36-deficient cells and indicated the involvement of ERK signaling in the potential regulatory mechanism of Zfp36. Immunoblotting showed that pERK protein expression increased significantly in Zfp36-deficient cells compared with the control cells. In Zfp36-deficient MC3T3-E1 cells, inhibition of activated ERK/MAPK signaling with U0126 resulted in obviously enhanced ALP staining and significantly increased expressions of osteoblast differentiation markers Runx2 and Bglap (P < 0.05).
Conclusions
ZFP36 is involved in the regulation of osteoblast differentiation of mouse BMSCs and preosteoblasts, and ZFP36 deficiency causes inhibition of osteoblast differentiation of the cells by activating the ERK/MAPK signaling pathway.
Keywords: zinc finger protein 36, osteoblast differentiation, ERK/MAPK signaling pathway, bonemarrow-derived mesenchymal stem cells
成骨细胞分化是参与维持骨代谢动态平衡的重要生理功能之一,对脊椎动物的骨骼健康具有重要意义[1, 2]。骨骼作为脊椎动物的身体及四肢框架而具有不可替代的作用,然而其内部的代谢过程却容易被忽视。为了适应日常的使用以及顺应外部的刺激,骨骼系统无时无刻不在自我更新[3, 4]。这种自我更新藉由成骨细胞分化介导的新骨形成以及破骨细胞分化介导的旧骨吸收过程而得以实现[5]。因此,成骨细胞分化的增强或减弱都可能打破骨代谢平衡,从而引起疾病[6-8]。然而,目前对成骨细胞分化过程的调节及机制的了解仍比较有限。
锌指蛋白家族是一类具备锌指结构的RNA结合蛋白的集合[9]。锌指结构是一种蛋白三维结构状态,具有多种类型[10]。目前已知锌指蛋白通过与信使RNA(mRNA)结合等途径广泛参与了机体的免疫、炎症、癌症等多种生理及病理过程[11-13]。研究者前期的一项研究发现,骨质疏松患者来源的成骨细胞中一名锌指蛋白家族成员——ZFP36表达显著降低[14]。骨质疏松是一种骨代谢异常导致的骨量降低的疾病,表现为成骨细胞分化减弱以及破骨细胞分化增强[15]。据报道,ZFP36通过抑制巨噬细胞中TNF-α等多种炎症细胞因子的产生,在调节免疫反应和炎症性疾病中发挥重要作用[16-18]。然而关于ZFP36对成骨细胞分化及骨形成方面的作用及机制研究暂时未见报道。
为了进一步探究ZFP36对成骨细胞分化的调控作用及机制,揭示其在骨质疏松过程中可能扮演的角色。本研究以小鼠来源的骨髓间充质干细胞(BMSCs)以及小鼠来源的成骨细胞前体细胞系MC3T3-E1作为体外研究细胞模型,通过诱导成骨细胞分化、干扰RNA转染诱导Zfp36表达下降、第二代转录组测序分析以及ERK/MAPK信号通路抑制分子U0126诱导等实验进行了系统的探索。发现ZFP36缺陷可以通过激活ERK/MAPK通路介导抑制成骨细胞分化。这一发现不仅为认识ZFP36在成骨分化中的作用提供了新的理论基础,还可能为治疗成骨分化缺陷相关疾病提供新的策略依据。
1. 材料和方法
1.1. 小鼠原代BMSCs
取4周龄C57BL/6J雄性小鼠12只(南方医科大学实验动物管理中心,No.4402100038046),颈椎脱臼处死、75%酒精浸泡消毒1min后转移至无菌操作台。分离双侧股骨及胫骨。剪去股骨和胫骨两端暴露骨髓腔, 置于嵌套的双层无菌离心管内,离心机瞬时离心速度达到10 000 g后即停止离心。此时骨髓组织位于离心管底部。以含2%胎牛血清的完全培养基重悬骨髓组织,按1小鼠/皿的比例,将骨髓重悬液接种于10 cm培养皿。置于37 ℃、含有5% CO2的细胞培养箱中培养24 h。取出培养皿,轻柔洗去未贴壁的细胞,更换培养基继续培养。此时培养皿中贴壁细胞为本研究的小鼠原代BMSCs。细胞培养过程隔日更换培养基,待细胞长至80%密度时进行传代培养,以传代代数3代之前的细胞接种细胞培养板进行实验。动物实验符合相关伦理要求(伦理编号:IACUC-LAC-20221025-003)。
1.2. MC3T3-E1
小鼠成骨细胞前体细胞系(MC3T3-E1细胞,ATCC),按说明书要求进行体外培养、传代培养。待贴壁细胞密度达到80%时进行接种细胞培养板进行实验。
1.3. 主要试剂及仪器
α-MEM培养基(Gibco)、胎牛血清(Gibco)、青/链霉素(Invitrogen)、0.25%胰酶/EDTA消化液(Gibco)、mZfp36 siRNA(擎科生物)、Lipofectamine 3000(Invitrogen)、TRIzol(Sigma)、RevertAid RT逆转录试剂盒(ThermoFisher)、SYBR Green PCR master mix(ThermoFisher)、RIPA裂解液(新赛美生物)、BCA蛋白浓度测定试剂盒(Beyotime)、SDS-PAGE蛋白电泳胶(Beyotime)、硝酸纤维素膜PVDF(Beyotime)、Trisbuffered saline with Tween,TBST(Beyotime)、抗ERK抗体(Beyotime)、抗p-ERK抗体(Cell Signaling Technology)、抗GAPDH抗体(Beyotime)、抗OCN抗体(Beyotime)、抗RUNX2抗体(Beyotime)、抗OSX抗体(Beyotime)、U0126(Beyotime)、二甲基亚砜DMSO(Sigma)。二氧化碳恒温细胞培养箱(Binder)、Quant Studio5实时荧光定量PCR仪(ThermoFisher)、超微量紫外分光光度计NanoDrop(ThermoFisher)、Odyssey近红外成像系统(LI-COR)、IX63半自动倒置荧光显微镜(Olympus)。
1.4. 实验方法
1.4.1. 体外成骨细胞分化诱导
配制含10 nmol/L β-GP和100 μg/mL抗坏血酸的完全培养基(含10% FBS,1% 青/链霉素)作为成骨诱导培养基。当体外扩增培养的BMSCs或MC3T3-E1密度达到80%时进行种板。通过胰酶消化、消化终止、细胞离心、细胞重悬及细胞计数后,按2.5×104/cm2的细胞密度将细胞均匀接种于24孔细胞培养板中。置于37 ℃、含有5% CO2的细胞培养箱中培养过夜后,更换完全培养基为成骨诱导培养基。不进行分化诱导的对照组仍使用完全培养基。诱导过程2 d/次更换培养基,收取特定时间点的细胞RNA或蛋白样本进行检测。
1.4.2. 细胞总RNA提取及提纯、RNA逆转录和RT-PCR
移除细胞培养基,以DPBS洗涤1次后,加入500 μL TRIzol组织RNA提取液,并按说明书完成RNA提纯。通过超微量紫外分光光度计NanoDrop测定RNA浓度后,按照RevertAid RT逆转录试剂盒说明书进行RNA逆转录制备cDNA。按照SYBR Green PCR master mix试剂盒说明构建10 μL RT-PCR反应体系,在Quant Studio5实时荧光定量PCR仪完成RT-PCR实验并收集数据。
1.4.3. 细胞总蛋白提取
总蛋白提取的MC3T3-E1细胞实验系接种于12孔板,BMSCs接种于6孔板。提取蛋白的操作一致,简述如下:移除细胞培养基,以DPBS洗涤1次。置于冰面,每孔加入150 μL RIPA蛋白裂解液充分吹打并适当研磨孔底5 min。收集蛋白裂解液到离心管中,4 ℃,14 000 g离心15 min,收集上清液。按照BCA蛋白浓度测定试剂盒说明书对蛋白浓度进行测定。使用用RIPA调整蛋白浓度到1 μg/μL,加入4×SDSPAGE蛋白上样缓冲液,混匀后干浴锅95 ℃加热5 min。样品可用于Western blot检测,或置-20 ℃保存。
1.4.4. Western blot实验
样本按照20 μL/孔构建SDSPAGE蛋白电泳体系。蛋白恒定电压60 V电泳20 min后,转为恒定电压110 V电泳40 min。随后构建湿性蛋白转膜体系,在恒定电流0.37A将蛋白从电泳胶转至硝酸纤维素膜(PVDF)60 min。转膜结束后使用TBST洗涤10 min,加入封闭液室温封闭60 min。按照蛋白大小裁剪PVDF膜,配制抗体4 ℃过夜摇床孵育。次日取出蛋白条带,TBST洗涤3次,5 min/次,避光条件下加入荧光二抗,室温摇床孵育60 min后TBST清洗3次,5 min/次,用Odyssey近红外成像系统(LI-COR)检测结果。
1.4.5. 细胞碱性磷酸酶(ALP)染色及茜素红(ARS)染色
将成骨诱导7 d的MC3T3-E1细胞和mBMSC用于碱性磷酸酶染色,将成骨诱导14 d的MC3T3-E1细胞和mBMSC用于茜素红染色,同时将对应的未诱导的细胞作为对照组。去除培养液后使用无菌PBS清洗3次,加入4%PFA固定15 min后再次用PBS清洗3次。7 d样本加入ALP染液避光37 ℃,30 min后观察大体观及镜下观。同理,14 d样本加入ARS染液室温下静置30 min后观察大体观及镜下观,观察矿化结节的形成与分布。
1.4.6. 小鼠Zfp36 siRNA转染
MC3T3-E1细胞和BMSCs接种于24孔板中。转染前1 d,待细胞贴壁至80%时,按照siRNA说明书及Lipofectamine 3000转染试剂说明书要求,配制siRNA终浓度20 nmol/L的转染体系,室温静置孵育15 min。吸去24孔板内培养基,用无菌PBS清洗2次,每孔先加入450 μL成骨诱导培养基,然后轻轻地在每孔均匀滴入50 μL转染体系试剂,混匀后置于37 ℃、含有5%CO2的恒温湿润培养箱中培养。用定量RT-PCR检测基因敲除效率以及成骨标志物的表达量。在分化的第3、7、14天,提取总RNA用于后续实验,在分化的7 d和14 d分别进行ALP和ARS染色。
1.4.7. 转录组RNA测序及数据分析
提取第14天小鼠Zfp36 siRNA转染MC3T3-E1细胞成骨分化诱导实验样本的总RNA,干冰运送至擎科生物科技公司进行样本转录组RNA测序。按照流程完成样本质控、cDNA文库构建、cDNA Illumina Novaseq 6000平台RNA测序后。使用HISAT2R软件将RNA测序的reads与小鼠基因组(GRCm39, http://asia.ensembl.org/Mus_musculus/Info/Index)进行比对。随后使用StringTie进行RNAseq比对,对转录本进行定量。生成的原始基因读数文件导入R语言平台进行表达水平估计及差异表达等分析[19]。
1.4.8. MAPR/ERK信号通路抑制
在小鼠Zfp36 siRNA转染MC3T3-E1细胞成骨分化诱导实验中设置加入U0126抑制MAPR/ERK信号的分组。其中U0126溶解于DMSO溶液中,在培养基中的终浓度为0.1、1、10及20 μmol/L,对照条件为不含U0126的DMSO溶剂。
1.5. 统计学分析
细胞实验所有定量数据均用均数±标准差表示。两组比较采用t检验,单因素方差分析用于单个条件多组比较。使用Excel或R进行统计学分析及数据可视化。P < 0.05为差异有统计学意义。
2. 结果
2.1. Zfp36在小鼠BMSC和MC3T3-E1细胞成骨分化过程中表达增加
小鼠MC3T3-E1细胞体外成骨分化诱导实验第7天,成骨分化诱导组ALP阳性细胞显著增加(图 1B)。成骨分化相关标志基因Alpl、Bglap以及Ibsp表达随着分化进程逐渐增加(图 1C)。Zfp36基因以及ZFP36蛋白表达随着成骨分化逐渐增高(图 1D、E)。与不含成骨分化诱导试剂的对照组相比,诱导组的成骨分化相关标志基因Alpl(P < 0.01)、Runx2(P < 0.0001)、Col1a1(P < 0.01)、Bglap(P < 0.01)及Ibsp(P < 0.01)表达显著增高(图 1F),并且Zfp36家族中Zfp36(P < 0.0001)、Zfp36l1(P < 0.0001)及Zfp36l2(P < 0.001)表达显著增高(图 1G)。小鼠原代BMSCs体外成骨分化诱导实验第7天的ALP阳性细胞以及第14天的ARS染色阳性区域在成骨分化诱导组中显著增多(图 1H、I)。BMSCs体外成骨分化诱导实验诱导组的成骨分化相关标志基因Alpl(P < 0.01)、Runx2(P < 0.01)及Sp7(P < 0.05)表达显著增高(图 1J),并且Zfp36家族中Zfp36(P < 0.0001)、Zfp36l1(P < 0.01)及Zfp36l2(P < 0.001)表达显著增高(图 1K)。
图 1.
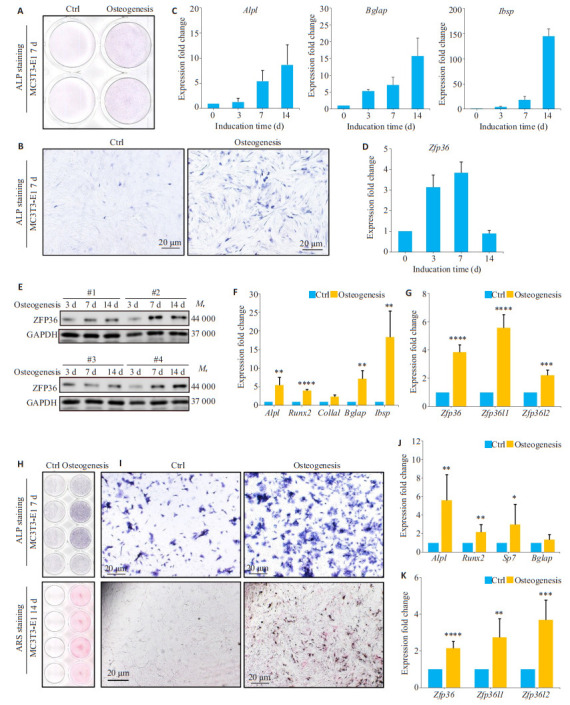
Zfp36在小鼠MC3T3-E1及BMSCs细胞中随着成骨细胞分化表达增加
MC3T3-E1 cells and primary mouse BMSCs show increased expressions of Zfp36 during induction of osteogenic differentiation. A, B: ALP staining of MC3T3-E1 cells on Day 7 of induction. C, D: Expressions of Alpl, Bglap, Ibsp, and Zfp36 mRNA in MC3T3-E1 cells at different time points during induction. E: Expressions of ZFP36 protein in MC3T3-E1 cells at different time points during induction. F, G: Expressions of Alpl, Runx2, Col1a1, Bglap, Ibsp, and ZFP36 family genes in MC3T3-E1 cells on Day 7 of osteogenic induction and in control cells. H, I: ALP staining (on Day 7) and ARS staining (on Day 14) of mouse BMSCs during osteogenic induction. J, K: Expressions of Alpl, Runx2, Sp7, Bglap, and ZFP36 family genes in mouse BMSCs on Day 6 of osteogenic induction and in cells without induction. *P < 0.05, ** P < 0.01, ***P < 0.001, ****P < 0.0001 vs NC.
2.2. Zfp36缺陷导致对小鼠BMSC和MC3T3-E1细胞成骨分化的抑制
小鼠Zfp36 siRNA转染MC3T3-E1细胞成骨分化诱导实验中,第7天的ALP细胞染色结果显示,敲低了Zfp36的kd-Zfp36组ALP阳性细胞显著减少(图 2A)。RT-PCR结果显示第7天样本中kd-Zfp36组的Zfp36表达较阴性对照组降低了72%(P < 0.0001,图 2B)。第14天的ARS染色结果显示,kd-Zfp36组ARS阳性区域显著减小(图 2C)。RT-PCR结果显示第14天样本中kd-Zfp36组的Zfp36表达较阴性对照组降低了70%(P < 0.0001,图 2D)。成骨分化相关标志基因Alpl(P < 0.01)、Sp7(P < 0.001)、Bglap(P < 0.01)及Ibsp(P < 0.0001)在第7天及第14天的kd-Zfp36组中的表达显著低于对照组(图 2B、C)。小鼠Zfp36 siRNA转染小鼠原代BMSCs成骨分化诱导实验的结果与MC3T3-E1实验的结果一致。在第7天kd-Zfp36组的ALP阳性细胞以及在第14天kd-Zfp36组的ARS阳性区域均显著小于对照组(图 2E、G)。成骨分化相关标志基因Alpl(P < 0.0001)、Sp7(P < 0.0001)及Bglap(P < 0.001)在第7天的kd-Zfp36组中的表达显著低于对照组(图 2F)。Zfp36(P < 0.0001)、Alpl(P < 0.0001)、Runx2(P < 0.001)、Sp7(P < 0.01)、Bglap(P < 0.0001)及Ibsp(P < 0.001)在第14天的kd-Zfp36组中的表达显著低于对照组(图 2H)。ZFP36蛋白在kd-Zfp36组的表达显著低于对照组,成骨分化相关的标志转录因子Osterix(OSX)及RUNX2的表达在kd-Zfp36组的表达显著低于对照组(图 2I、J)。
图 2.
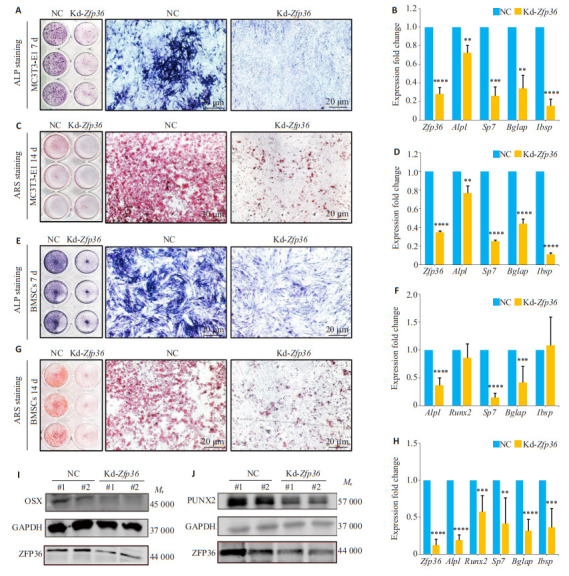
Zfp36缺陷抑制小鼠BMSCs及MC3T3-E1细胞成骨细胞分化
Zfp36 deficiency suppresses osteogenesis in MC3T3-E1 cells and mouse BMSCs. A, B: ALP staining (A) and the expressions of Zfp36, Alpl, Sp7, Bglap, and Ibsp (B) in Zfp36-deficient and control MC3T3-E1 cells on Day 7 of osteogenic induction. C, D: ARS staining (C) and expressions of Zfp36, Alpl, Sp7, Bglap, and Ibsp (D) in Zfp36-deficient and control MC3T3-E1 cells on Day 14. E, F: ALP staining (E) and expressions of Zfp36, Runx2, Sp7, Bglap, and Ibsp (F) in Zfp36-deficient and control BMSCs on Day 7 during osteogenic induction. G, H: ARS staining (G) and expressions of Zfp36, Runx2, Alpl, Sp7, Bglap, and Ibsp (H) in Zfp36-deficient and control BMSCs on Day 14. I, J: Comparison of expressions of Osterix (OSX) (I) and RUNX2 (J) in Zfp36-deficient and control MC3T3-E1 cells on Day 14. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001 vs NC.
2.3. Zfp36缺陷下调了MC3T3-E1细胞成骨分化相关转录组的表达
小鼠Zfp36 siRNA转染MC3T3-E1细胞成骨分化诱导实验第14天,在转录组表达水平,主成分分析(PCA)结果可见kd-Zfp36组与阴性对照组(NC)组内样本聚集靠近分布,组别之间区分明确(图 3A)。标准化后Zfp36转录本分析显示kd-Zfp36组显著低于NC组(P=0.0003,图 3B)。差异表达基因(DEGs)分析结果显示kd-Zfp36组下调基因262个,上调基因300个(图 3C)。生物矿化相关基因表达分析结果显示kd-Zfp36组中表达水平低于NC组(图 3D)。用kd-Zfp36组下调基因中前50个作为基因集进行基因本(GO)分析,结果显示kd-Zfp36组下调基因集富集于biomineral tissue development、biomineralization、bone mineralization及ossifications等骨矿化相关过程,并发现kd-Zfp36组下调基因富集到了ERK1/ERK2信号调控过程中(图 3E)。其中,ERK1/ERK2信号正调控基因C3(P < 0.0001),Angpt1(P < 0.01),Cd36(P < 0.01),Ednra(P < 0.01),Ptpn22(P < 0.01)以及ERK1/ERK2信号负调控基因Chrna10(P < 0.001),Ndrg2(P < 0.01)表达在kd-Zfp36组显著降低(图 3F),而ERK/MAPK级联信号中的磷酸化蛋白相关基因如Ras、Raf、Mapk等表达未见显著差异,但发现在kd-Zfp36组的Rasl家族成员表达如Rasl12(P < 0.01),Rasl10b(P < 0.01)显著增加(图 3F)。
图 3.
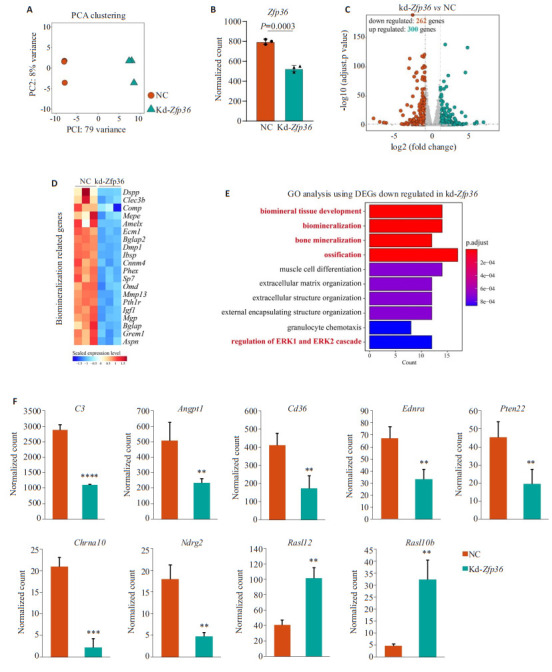
Zfp36缺陷抑制小鼠MC3T3-E1细胞成骨细胞分化骨化进程并参与ERK信号调控
Zfp36 deficiency suppresses ossification process and participates in ERK signaling in MC3T3-E1 cells. A-D: Principal components analysis (A), normalized gene counts of Zfp36 (B), differentially expressed genes (C), and the scaled expression levels of biomineralization related genes (D) in Zfp36-deficient and control MC3T3-E1 cells on day 7 during osteogenic induction. E: Top 10 biological processes with the lowest adjusted P value analyzed by inputting the downregulated DEGs in kd-Zfp36 group. F: Normalized gene counts of positive ERK cascade genes (C3, Angpt1, Cd36, Ednra, and Ptpn22), negative ERK cascade genes (Chrna10, Ndrg2), Ras-like family members (Rasl12, Rasl10b) in Zfp36-deficient and control MC3T3-E1 cells on day 7 during osteogenic induction. **P < 0.01, ***P < 0.001, ****P < 0.0001 vs NC.
2.4. Zfp36缺陷激活ERK/MAPK信号并引起成骨分化的抑制
小鼠Zfp36 siRNA转染MC3T3-E1细胞成骨分化诱导实验第7天,Western blotting结果显示kd-Zfp36组p-ERK表达显著增高(图 4A),p-ERK与总ERK比值pERK/ERK显著增高(P < 0.05,图 4B)。加入ERK/MAPK信号抑制剂U0162后(按照浓度分组,使用溶剂DMSO作为对照),NC组及kd-Zfp36组中成骨分化标志转录因子Runx2以及骨化后期标志物Bglap呈现浓度依赖的升高趋势,而Zfp36的表达也呈随U0126浓度依赖的升高趋势(图 4C)。加入U0162显著抑制kd-Zfp36组p-ERK的表达(图 4D),加入U0162挽救了kd-Zfp36组ZFP36的表达(图 4E)。成骨分化第7天,ALP染色结果显示,加入U0126在一定程度挽救了kd-Zfp36组引起的ALP阳性细胞减少(图 4F)。
图 4.
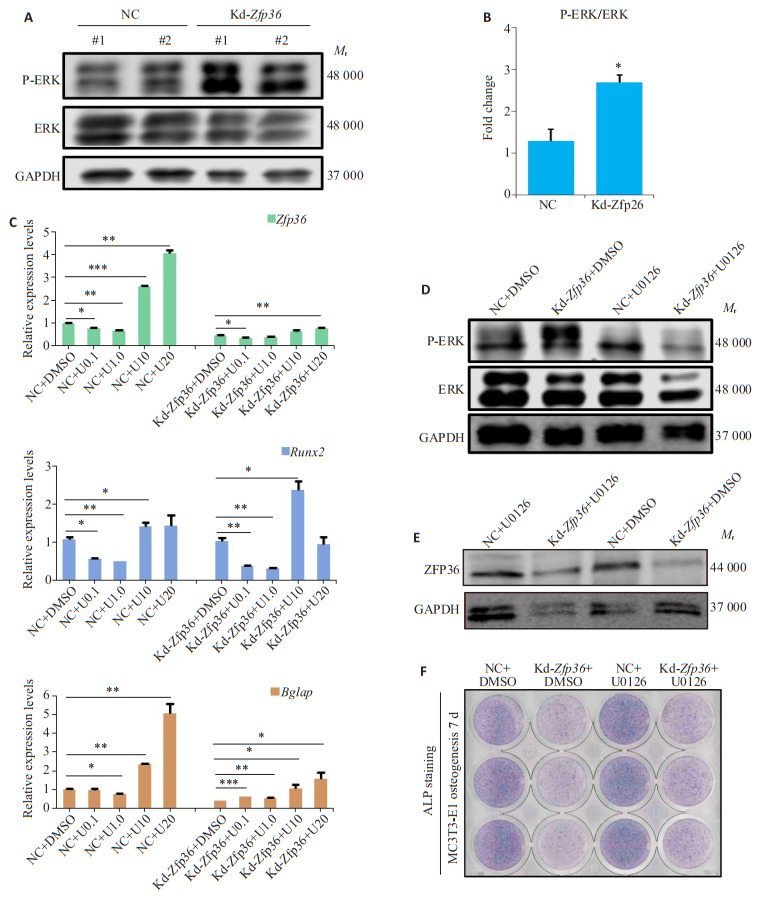
Zfp36缺陷通过ERK/MAPK信号激活抑制小鼠MC3T3-E1细胞成骨细胞分化
Zfp36 deficiency suppresses osteogenesis in MC3T3-E1 cells by activating ERK/MAPK signaling. A, B: Immunoblots and p-ERK/ERK ratio (B) in Zfp36-deficient and control MC3T3-E1 cells on Day 7 of osteogenesis. C: Expressions of Zfp36, Runx2, and Bglap in Zfp36-deficient and control MC3T3-E1 cells treated with different concentrations of U0126 on Day 7 during osteogenesis. D, E: Immunoblots of p-ERK and ERK (D) and ZFP36 (E) in Zfp36-deficient and control MC3T3-E1 cells treated with U0126 on Day 7 during osteogenesis. F: ALP staining in Zfp36-deficient and control MC3T3-E1 cells treated with U0126 on Day 7 during osteogenesis. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001.
3. 讨论
成骨细胞分化是骨代谢过程的重要组成部分,参与骨骼发育、骨骼修复以及骨骼重塑过程。骨骼发育目前被归纳为以长骨发育为代表的软骨内成骨以及以颅骨发育为代表的膜内成骨[20]。其中软骨内成骨参与成骨细胞分化的主要细胞是BMSCs,颅骨膜内成骨中参与成骨细胞分化的主要细胞是一类较为专能的成骨细胞前体细胞[21, 22]。骨骼修复如骨折后修复过程以软骨内成骨及膜内成骨协同完成。骨重塑则特指骨骼组织的自我更新,是新骨取代旧骨的缓慢但普遍存在的生理现象[3]。尽管对这些生命现象的观察已经较为透彻,但是对其背后的分子调节作用及机制的认识仍然十分有限。MC3T3-E1细胞是来源于新生小鼠的颅骨的成骨细胞前体细胞[23]。本研究使用BMSCs和MC3T3-E1作为细胞模型,首次探索了Zfp36在成骨细胞分化过程中的作用,发现Zfp36会随成骨细胞分化而表达增高。
锌指蛋白仅存在于真核生物中,并且其含量十分丰富。锌指蛋白家族成员的功能十分复杂且多样,包括识别DNA、包装RNA、调节转录步骤、调节细胞凋亡以及蛋白质折叠等[11-13]。然而,关于锌指蛋白家族成员在调节成骨分化方面的作用及机制报道仍十分有限。在前期一项人类骨质疏松骨组织研究中,我们发现,骨质疏松患者成骨细胞中Zfp36表达显著降低[14]。ZFP36家族由ZFP36(也称为三四肽蛋白、TTP)、ZFP36L1、ZFP36L2和ZFP36L3(仅在啮齿动物中)组成。同其他ZNF一样,目前关于锌指蛋白36(ZFP36)的研究主要集中在癌症、免疫、炎症等相关领域。然而,关于骨形成方面的研究尚未见被报道。本研究发现Zfp36缺陷会造成成骨细胞分化的抑制,这提示ZFP36可能在成骨分化过程中发挥的保护性的作用。
ERK/MAPK信号对成骨细胞的分化具有调控作用。一方面ERK/MAPK信号的激活参与了成骨分化的早期进程,促进BMSCs或成骨细胞前体细胞进入成骨分化状态[24-26]。另一方面,ERK/MAPK信号在成骨分化后期逐渐减弱,ERK/MAPK的持续激活甚至会对骨化过程发挥阻遏作用,而抑制ERK可以促进骨形成过程[27]。本研究通过转录组RNA测序探索Zfp36缺陷造成成骨分化抑制的作用机制时发现,Zfp36缺陷主要引起骨化相关的基因集表达降低,而同时会激活ERK信号。ERK/MAPK信号是级联反应,该过程中关键蛋白包括Raf、Ras、MEK以及MAPK蛋白磷酸化是信号激活的表现,但是这些蛋白在Zfp36组未见显著改变。进一步分析测序结果发现,在Zfp36组的差异显著上调的基因中,Rasl家族成员表达显著升高,这类家族被认为具有磷酸化Ras蛋白的潜能,因此可能是Zfp36组造成ERK信号的持续激活的原因之一。而Zfp36缺陷所造成ERK信号的持续激活,可能在成骨细胞分化后期骨化形成过程中发挥抑制作用。以ERK/MAPK信号抑制剂进行的挽救实验结果佐证了这一推测。
本研究中Zfp36的缺陷会造成成骨细胞分化的抑制,尽管发现Zfp36可能通过ERK/MAPK信号参与了成骨细胞分化的调控,通过U0126抑制ERK/MAPK信号后虽然成骨分化有所恢复,但并不能完全恢复到未敲低Zfp36的水平。这提示,除了ERK/MAPK信号,Zfp36还可能通过其他途径调节成骨细胞分化的过程。另一方面,细胞学的实验虽然可以为分子生物学研究提供有效的证据参考,然而生物体体内是个比体外细胞培养要更加复杂的环境,Zfp36调节的成骨细胞分化最终引起的骨形成情况如何,仍需要体内实验的支持。以上都是本研究后续进一步探索的重要方向。
综上所述,ZFP36参与了小鼠成骨细胞的分化调控过程,锌指蛋白-36缺陷会引起ERK/MAPK信号通路的激活,进而抑制成骨细胞分化。本研究不仅为认识ZFP36在成骨分化中的作用提供了新的理论基础,还可能为治疗成骨分化缺陷相关疾病提供新的策略依据。
Biographies
戎圣炜,在读博士研究生,E-mail: 516617613@qq.com
李宏芳,主治医师,E-mail: lhf_yjdclinic@126.com
Funding Statement
国家自然科学基金(82370886,31771051)
Supported by National Natural Science Foundation of China (82370886, 31771051)
Contributor Information
戎 圣炜 (Shengwei RONG), Email: 516617613@qq.com.
李 宏芳 (Hongfang LI), Email: lhf_yjdclinic@126.com.
邓 仲豪 (Zhonghao DENG), Email: dzh000@126.com.
赵 亮 (Liang ZHAO), Email: lzhaonf@126.com.
References
- 1.Choi JY. Healthy bone tissue homeostasis. Exp Mol Med. 2020;52(8):1165. doi: 10.1038/s12276-020-0472-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Zaidi M. Skeletal remodeling in health and disease. Nat Med. 2007;13(7):791–801. doi: 10.1038/nm1593. [DOI] [PubMed] [Google Scholar]
- 3.Raggatt LJ, Partridge NC. Cellular and molecular mechanisms of bone remodeling. J Biol Chem. 2010;285(33):25103–8. doi: 10.1074/jbc.R109.041087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Sims NA, Martin TJ. Coupling the activities of bone formation and resorption: a multitude of signals within the basic multicellular unit. Bonekey Rep. 2014;3:481. doi: 10.1038/bonekey.2013.215. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Siddiqui JA, Partridge NC. Physiological bone remodeling: systemic regulation and growth factor involvement. Physiology. 2016;31(3):233–45. doi: 10.1152/physiol.00061.2014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Feng X, McDonald JM. Disorders of bone remodeling. Annu Rev Pathol. 2011;6:121–45. doi: 10.1146/annurev-pathol-011110-130203. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Goldring SR, Purdue PE, Crotti TN, et al. Bone remodelling in inflammatory arthritis. Ann Rheum Dis. 2013;72(Suppl 2):ii52–5. doi: 10.1136/annrheumdis-2012-202199. [DOI] [PubMed] [Google Scholar]
- 8.Walsh NC, Reinwald S, Manning CA, et al. Osteoblast function is compromised at sites of focal bone erosion in inflammatory arthritis. J Bone Miner Res. 2009;24(9):1572–85. doi: 10.1359/jbmr.090320. [DOI] [PubMed] [Google Scholar]
- 9.Corley M, Burns MC, Yeo GW. How RNA-binding proteins interact with RNA: molecules and mechanisms. Mol Cell. 2020;78(1):9–29. doi: 10.1016/j.molcel.2020.03.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Lai WS, Carballo E, Thorn JM, et al. Interactions of CCCH zinc finger proteins with mRNA. Binding of tristetraprolin-related zinc finger proteins to Au-rich elements and destabilization of mRNA. J Biol Chem. 2000;275(23):17827–37. doi: 10.1074/jbc.M001696200. [DOI] [PubMed] [Google Scholar]
- 11.Bruno M, Mahgoub M, MacFarlan TS. The arms race between KRAB-zinc finger proteins and endogenous retroelements and its impact on mammals. Annu Rev Genet. 2019;53:393–416. doi: 10.1146/annurev-genet-112618-043717. [DOI] [PubMed] [Google Scholar]
- 12.Sun MY, Ju JY, Ding Y, et al. The signaling pathways regulated by KRAB zinc-finger proteins in cancer. Biochim Biophys Acta Rev Cancer. 2022;1877(3):188731. doi: 10.1016/j.bbcan.2022.188731. [DOI] [PubMed] [Google Scholar]
- 13.Wang GM, Zheng CF. Zinc finger proteins in the host-virus interplay: multifaceted functions based on their nucleic acid-binding property. FEMS Microbiol Rev. 2021;45(3):fuaa059. doi: 10.1093/femsre/fuaa059. [DOI] [PubMed] [Google Scholar]
- 14.Liao ZT, Jin Y, Chu YH, et al. Single-cell transcriptome analysis reveals aberrant stromal cells and heterogeneous endothelial cells in alcohol-induced osteonecrosis of the femoral head. Commun Biol. 2022;5(1):324. doi: 10.1038/s42003-022-03271-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Appelman-Dijkstra NM, Papapoulos SE. Modulating bone resorption and bone formation in opposite directions in the treatment of postmenopausal osteoporosis. Drugs. 2015;75(10):1049–58. doi: 10.1007/s40265-015-0417-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Cicchetto AC, Jacobson EC, Sunshine H, et al. ZFP36-mediated mRNA decay regulates metabolism. Cell Rep. 2023;42(5):112411. doi: 10.1016/j.celrep.2023.112411. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Cook ME, Bradstreet TR, Webber AM, et al. The ZFP36 family of RNA binding proteins regulates homeostatic and autoreactive T cell responses. Sci Immunol. 2022;7(76):eabo0981. doi: 10.1126/sciimmunol.abo0981. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Zhang ZL, Guo M, Li YJ, et al. RNA-binding protein ZFP36/TTP protects against ferroptosis by regulating autophagy signaling pathway in hepatic stellate cells. Autophagy. 2020;16(8):1482–505. doi: 10.1080/15548627.2019.1687985. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Love MI, Huber W, Anders S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biol. 2014;15(12):550. doi: 10.1186/s13059-014-0550-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Olsen BR, Reginato AM, Wang W. Bone development. Annu Rev Cell Dev Biol. 2000;16:191–220. doi: 10.1146/annurev.cellbio.16.1.191. [DOI] [PubMed] [Google Scholar]
- 21.Salhotra A, Shah HN, Levi B, et al. Mechanisms of bone development and repair. Nat Rev Mol Cell Biol. 2020;21(11):696–711. doi: 10.1038/s41580-020-00279-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Shu HS, Liu YL, Tang XT, et al. Tracing the skeletal progenitor transition during postnatal bone formation. Cell Stem Cell. 2021;28(12):2122–36. doi: 10.1016/j.stem.2021.08.010. [DOI] [PubMed] [Google Scholar]
- 23.Wang D, Christensen K, Chawla K, et al. Isolation and characterization of MC3T3-E1 preosteoblast subclones with distinct in vitro and in vivo differentiation/mineralization potential. J Bone Miner Res. 1999;14(6):893–903. doi: 10.1359/jbmr.1999.14.6.893. [DOI] [PubMed] [Google Scholar]
- 24.Matsushita T, Chan YY, Kawanami A, et al. Extracellular signalregulated kinase 1 (ERK1) and ERK2 play essential roles in osteoblast differentiation and in supporting osteoclastogenesis. Mol Cell Biol. 2009;29(21):5843–57. doi: 10.1128/MCB.01549-08. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Ge CX, Xiao GZ, Jiang D, et al. Critical role of the extracellular signal-regulated kinase-MAPK pathway in osteoblast differentiation and skeletal development. J Cell Biol. 2007;176(5):709–18. doi: 10.1083/jcb.200610046. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Lai CF, Chaudhary L, Fausto A, et al. Erk is essential for growth, differentiation, integrin expression, and cell function in human osteoblastic cells. J Biol Chem. 2001;276(17):14443–50. doi: 10.1074/jbc.M010021200. [DOI] [PubMed] [Google Scholar]
- 27.Kim JM, Yang YS, Hong J, et al. Biphasic regulation of osteoblast development via the ERK MAPK-mTOR pathway. eLife. 2022;11 doi: 10.7554/eLife.78069. [DOI] [PMC free article] [PubMed] [Google Scholar]


