Abstract
目的
探究贵州苗医验方“四大血”(SX)对胶原诱导型关节炎(CIA)大鼠关节骨、软骨破坏及滑膜血管新生的作用机制。
方法
将42只SD大鼠均分为空白组(Nor)、模型组(Mod)、雷公藤多苷片阳性对照组(GTW,40 g/kg)和SX高、中、低剂量组(SX 40、20、10 g/kg),7只/组。通过皮下注射牛型Ⅱ胶原来建立CIA大鼠模型,并且通过每天经口灌胃的方式给予治疗,持续3周。采用AI评分分别于造模前,灌胃前1周,灌胃后1周,灌胃2周,灌胃3周观察大鼠后足关节病变情况。HE染色法观察大鼠关节滑膜病理变化,ELISA法检测TNF-α、IL-1β,Real-time PCR检测滑膜组织中NF-κB p65、MMP1、MMP2、MMP9 mRNA表达水平,Western blot检测滑膜组织中NF-κB p65、基质金属蛋白1(MMP1)、MMP2、MMP9蛋白表达水平。网络药理学获取SX外用途径治疗类风湿性关节炎(RA)中的重要靶蛋白,经拓扑分析后筛选出核心靶蛋白。
结果
GTW组和SX高、中、低剂量组足跖肿胀度及关节炎指数评分均小于Mod组(P<0.05)。光镜下观察大鼠关节滑膜病理组织切片,Mod组可见较多软骨细胞坏死,软骨下层骨组织受侵蚀,并有新生毛细血管形成;而GTW组和SX高、中、低剂量组中,软骨及骨损伤均有不同程度地降低,新生血管数量减少,随SX剂量增高,治疗效果呈逐渐增强的趋势。与Mod组相比,GTW组和SX高、中、低剂量组滑膜组织TNF-α、IL-1β、NF-κB p65、MMP1、MMP2、MMP9 mRNA和蛋白表达量有不同程度地降低(P<0.05)。经网络药理学分析得到外用SX治疗RA中的核心靶蛋白—MMPs。
结论
SX可以改善CIA大鼠关节骨和软骨的破坏、减缓滑膜血管新生,其机制可能为调节MMP基因表达的TNF-α/IL-1β/NF-κB-MMP1、2、9信号转导途径,下调MMPs表达水平,此外可初步推断MMPs在除口服治疗途径以外仍发挥关键作用。
Keywords: 苗医药方“四大血”, 类风湿性关节炎, 基质金属蛋白, 网络药理学, 关节骨和软骨的破坏
Abstract
Objective
To explore the inhibitory effect of Sidaxue, a traditional Miao herbal medicine formula, on articular bone and cartilage destruction and synovial neovascularization in rats with collagen-induced arthritis (CIA).
Methods
In a SD rat model of CIA, we tested the effects of daily gavage of Sidaxue at low, moderate and high doses (10, 20, and 40 g/kg, respectively) for 21 days, with Tripterygium glycosides (GTW) as the positive control, on swelling in the hind limb plantar regions by arthritis index scoring. Pathologies in joint synovial membrane of the rats were observed with HE staining, and serum TNF-α and IL-1β levels were detected with ELISA. The expressions of NF-κB p65, matrix metalloproteinase 1 (MMP1), MMP2 and MMP9 at the mRNA and protein levels in the synovial tissues were detected using real-time PCR and Western blotting. Network pharmacology analysis was conducted to identify the important target proteins in the pathways correlated with the therapeutic effects of topical Sidaxue treatment for RA, and the core target proteins were screened by topological analysis.
Results
Treatment with GTW and Sidaxue at the 3 doses all significantly alleviated plantar swelling, lowered arthritis index scores, improved cartilage and bone damage and reduced neovascularization in CIA rats (P<0.05), and the effects of Sidaxue showed a dose dependence. Both GTW and Sidaxue treatments significantly lowered TNF-α, IL-1β, NF-κB p65, MMP1, MMP2, and MMP9 mRNA and protein expressions in the synovial tissues of CIA rats (P<0.05). Network pharmacological analysis identified MMPs as the core proteins associated with topical Sidaxue treatment of RA.
Conclusion
Sidaxue alleviates articular bone and cartilage damages and reduces synovial neovascularization in CIA rats possibly by downregulating MMPs via the TNF-α/IL-1β/NF-κB-MMP1, 2, 9 signaling pathway, and MMPs probably plays a key role in mediating the effect of Sidaxue though the therapeutic pathways other than oral administration.
Keywords: Miao medicine Sidaxue formula, rheumatoid arthritis, matrix metalloproteinase, matrix metalloproteinases, network pharmacology, cartilage and bone destruction
类风湿性关节炎(RA)是一种致残率较高的慢性自身免疫性疾病,滑膜组织侵犯和滑膜增生是RA发展的重要病理改变之一,可进而导致软骨和骨的破坏[1, 2]。目前其发病机制尚不完全清楚[3]。滑膜成纤维细胞(FLSs)在其发病机制中起主导作用[4]。前期课题组证明在RA中异常活化的RA-FLSs表现出类似于肿瘤样特性,可经历“肿瘤样”增殖、侵袭,并可迁移到未受影响的关节,附着在软骨和骨上,侵入细胞外基质(ECM)[5]。而ECM是维持骨组织完整性的重要结构成分。在正常的生理过程中,关节软骨基质蛋白的合成和降解处于动态平衡状态; 然而,在RA患者中,这种平衡被破坏。关节软骨中的蛋白聚糖、胶原蛋白和ECM附属蛋白的损失,永久性地改变了组织的生物力学特性,最终导致滑膜关节衰竭[6]。在RA患者中,基质金属蛋白酶(MMPs)降解ECM被认为是关节破坏所必需的[7]。MMPs是生物体中一种重要的蛋白水解酶。在细胞因子的刺激下,滑膜细胞和血管内皮细胞产生多种基质金属蛋白酶,打破了细胞外基质的产生和降解之间的平衡,这是RA的重要发病机制之一[8]。而根据相关研究显示MMP-1、MMP-2、MMP-9能直接降解骨和软骨[7],并能刺激内皮细胞, 使血管再生形成血管翳[8, 9]。
MMP的活性受到NF-κB信号转导途径的调控。当身体受到外部因素的刺激时,NF-κB信号通路被激活,导致下游MMP过表达,并与其他炎症因子一起参与炎症反应,加速关节运动,其中一个结果是软骨的破坏[10]。其中,肿瘤坏死因子-α、白介素-1β(IL-1β)在组织炎症、自身免疫中发挥关键作用,是一种强炎症细胞因子。TNF-α抑制剂在临床上已被用于平衡高TNF水平导致的RA关节炎症[11]。目前可用的TNF抑制剂有依那西普、英夫利昔单抗、阿达木单抗、戈利木单抗和certolizumab pegol。TNF-α抑制剂可显著改善RA的治疗效果[12]。TNF-α、IL-1β可通过启动子与转录因子结合经由核因-κB(NF-κB)信号转导途径激活MMP基因[13],使关节和滑膜成纤维细胞等分泌MMP-1、MMP-2、MMP-9等[14],从而参与疾病进程[15]。多种MMPs如MMP-1、MMP-9和受促炎性细胞因子的诱导性分泌而在滑膜成纤维细胞中表达上调,被认为在RA关节软骨退化中起关键作用,可能参与RA患者的关节损伤[16]。因此基于MMP表达的信号通路探索骨与软骨的破坏与血管新生的作用将为RA的发生发展提供关键线索。
目前,以非甾体类抗炎药、糖皮质激素为主的治疗药物起效慢,且毒副作用较大[17],而生物药物(如托珠单抗)和口服Janus激酶抑制剂(如托法替尼)虽已被研制出来并应用于临床,但这些新药非常昂贵,且并不是对所有RA患者都有效[18-20],因此进一步探究和开发新的治疗药物是十分迫切的。中药被证实在改善RA的临床症状和稳定病情等方面展现出独特优势,可以弥补西药的不足,具有多靶点、多途径、多层次治疗RA的特点,且其参与类风湿关节炎的治疗也有较高的认可度[21-23]。贵州特色苗医药方“四大血”(SX)是由鸡血藤、五花血藤、见血飞、黑骨藤四种藤本药材组成,作为苗族地区流传的通气散血的代表方剂,是治疗RA的优势药物,但其作用机制不清,尚处于经验用药阶段[24]。课题组前期研究结果显示,通过SX水煎液可减轻胶原诱导性关节炎大鼠(CIA)关节骨和软骨的破坏,抑制关节滑膜组织炎症,减少血管生成改善血管新生等病理表现,并由网络药理学结果显示基质金属蛋白家族中的MMP1、MMP2、MMP9是口服治疗途径中四大血的主要靶点[25],因此本研究通过构建CIA大鼠模型以TNF-α、IL-1β/NF-κB/MMPs信号通路为靶点,探究SX对CIA大鼠关节骨和软骨及滑膜血管增生的干预机制,为临床用药提供更多的科学依据。在灌胃训练中,我们发现操作不当会导致大鼠患处皮肤与药液接触,同时我们了解到目前存在治疗RA的其他外用药方[26, 27],故本小组利用网络药理学模拟分析并预测SX经皮渗透治疗RA的作用机制,为进一步探索SX的其他临床应用提供理论基础。
1. 材料和方法
1.1. 实验材料
1.1.1. 实验动物与药物
42只雄性SPF级SD大鼠(伦理审查编号:2200095),8周龄,体质量为180~220 g,贵州医科大学实验动物中心提供,合格证号[SYXK(黔)2018-001]。SX由五花血藤、鸡血藤、见血飞、黑骨藤按15∶22∶15∶8比例组成,药材均由贵州中医药大学中医学院苗医药教研室提供,并经田振华副教授鉴定,雷公藤多苷片购至黄石飞云制药公司(批号:20080301)。
1.1.2. 主要试剂与仪器
不完全弗氏佐剂(Sigma),牛Ⅱ型胶原(Chondrex),TNF-α及IL-1β试剂盒(上海巧伊生物科技有限公司),一抗NF-κB、MMP1、MMP2、MMP9(华安生物),二抗(Bioworld),PCR逆转录试剂盒(宝日医生物技术有限公司),水平电泳槽DYY-Ⅲ31D(北京六一仪器厂),酶标仪(BIO-TEK),Quanity One凝胶成像分析系统(BIO-RAD),DYY-5型稳压稳流电泳仪(北京六一仪器厂)。
1.2. 方法
1.2.1. 分组与造模
42只SPF级雄性SD大鼠,体质量为180~200 g,随机分为空白组(Nor)、模型组(Mod)、“四大血”高剂量组(SX 40 g/kg)、中剂量组(SX 20 g/kg)、低剂量组(SX 10 g/kg)和雷公藤多苷片对照组(GTW40 g/kg),7只/组。适应性饲养1周后造模,将2 mg/mL牛Ⅱ型胶原与等量不完全弗氏佐剂于冰上混合,充分乳化后,以1滴乳化剂于水中不扩散为准,大鼠麻醉后,取乳化后的混合物0.2 mL于尾根部皮下注射进行初次免疫,1周后于足跖皮下加强免疫1次,通过关节炎指数(AI)评分判定造模情况,其中,达到4分及4分以上,则判定造模成功。
1.2.2. 药物制备与给药方案
五花血藤、鸡血藤、见血飞、黑骨藤,按照15∶22∶15∶8比例配制,共取2000 g,加适量水煮3次(时间分别为1 h、30 min、30 min),合并浓缩液500 mL,生药浓度为4 g/mL,4 ℃冰箱备用。第2次造模结束后开始给药,给药方案:SX高、中、低剂量组灌胃给药浓度分别为40、20、10 g/kg(按生药计);GTW组给药浓度为40 g/kg,Nor组和Mod组用等量0.9%氯化钠注射液灌胃,1次/d,连续21 d。
1.2.3. 各组大鼠AI、关节肿胀率测算
每日定期观察大鼠情况,拍照记录关节红肿、关节畸形情况,初次注射乳化剂当天起,采用AI评分分别于造模前1周,灌胃前1周,灌胃后1周,灌胃2周,灌胃3周观察大鼠后足关节病变情况。AI评分标准如下:0分(无红肿);1分(关节有红色斑点或轻度肿胀);2分(关节病变中度红肿);3分(关节除中度红肿外,伴有轻度功能障碍);4分(关节重度红肿,僵直甚至畸形,严重功能障碍);将2只后踝关节的病变程度累计积分,计算关节炎指数,每只大鼠AI评分最高为8分,AI评分越高表示关节病变越严重。初次免疫起,每隔1周,采用大鼠足部容积测量仪测量大鼠双后足肿胀度,足肿胀度计算公式如下:ER(%)=(V1-V2)/V2× 100%(其中V2为造模前的容积,V1造模后的容积)。
1.2.4. 标本采集
给药3周后,麻醉各组大鼠,真空采血管进行心脏取血,静置10 min后4 ℃,3000 r/min离心10 min,分离血清用于ELISA实验;取脾脏和胸腺组织并称量各组织质量,计算脾腺指数,胸腺指数(脾指数)=胸腺(脾)质量(g)/体质量(g)×100%;并取各组大鼠炎性后腿,一部分使用4%多聚甲醛固定,用于HE染色,另一部分使用生理盐水冲洗后置于-80 ℃冰箱保存,用于Western blotting及Real-time PCR检测相关蛋白表达水平。
1.2.5. 滑膜组织病理学观察
将固定于4%多聚甲醛中的膝关节滑膜组织进行石蜡包埋、切片、贴片、染色,并使用光学显微镜观察周围组织病理变化。
1.2.6. Western blot检测NF-κB、MMP-1、MMP-2、MMP-9蛋白表达
使用RIPA裂解液提取滑膜组织总蛋白,BCA试剂盒检测蛋白浓度。聚丙烯酰胺凝胶进行蛋白电泳,PVDF转膜,封闭,加入对应的一抗NF-κB(1∶1000)、MMP-1(1∶1000)、MMP-2(1∶1000)、MMP-9(1∶1000)、β-actin(1∶5000),4 ℃孵育过夜,TBST洗涤5 min/次,共6次,加入二抗(1∶5000),室温摇床缓慢摇动1.5 h,TBST洗涤5 min/次,共6次,凝胶成像仪上进行蛋白条带检测,Image Pro Plus 6.0软件分析蛋白表达量。
1.2.7. Real-time PCR检测滑膜组织中NF-κB、MMP1、MMP2、MMP9 mRNA表达
使用Trizol Reagent试剂盒提取总RNA,反转录为cDNA,以cDNA为模板进行PCR扩增,GAPDH作为内参,采用2-ΔΔCt法对结果进行分析,扩增程序为:95 ℃ 300 s;循环反应,95 ℃ 10 s,60 ℃ 20 s,循环40次。引物序列如表 1。
表 1.
引物序列
Sequence of primers for RT-PCR
| Primer | Sequence |
| NF-κB | |
| Forward | 5'-ATGGCAGACGATGATCCCTAC-3 |
| Reverse | 5'-CGGAATCGAAATCCCCTCTGTT-3' |
| MMP1 | |
| Forward | 5'-AAAATTACACGCCAGATTTGCC-3' |
| Reverse | 5'-GGTGTGACATTACTCCAGAGTTG-3' |
| MMP2 | |
| Forward | 5'-TACAGGATCATTGGCTACACACC-3' |
| Reverse | 5'-GGTCACATCGCTCCAGACT-3' |
| MMP9 | |
| Forward | 5'-TCCTGGTGCTCCTGGCTCTA-3' |
| Reverse | 5'-GTGTCCGTGAGGTTGGAGGTT-3' |
1.2.8. 网络药理学方法
1.2.8.1. 苗药“四大血”的活性成分及潜在靶基因的预测
首先在中药系统药理学分析平台(http://tcmspw.com/tcmsp.php)、中国科学院上海有机化学研究所化学专业数据库(http://organchem.csdb.cn),获取化合物吸收、分布、代谢、排泄(ADME)参数,然后根据Alogp=2~3[28, 29]、DL>0.18的标准[30],筛选出表皮渗透性较佳的成分(图 1),然后再利用有机小分子生物活性数据数据库(https://pubchem.ncbi.nlm.nih.gov)对化合物的二维结构、标准SMILES和PubChemID进行标定;将化合物的标准SMILES上传至瑞士生物信息研究所靶点预测工具(http://www.swisstargetprediction.ch)预测其潜在靶基因。
图 1.
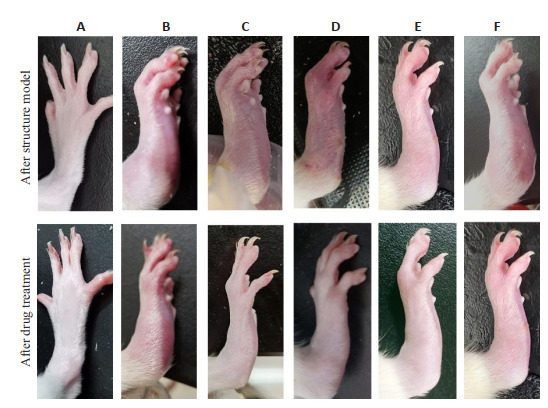
各组大鼠足肿胀度
Hind limb joint swelling of the rats in each group. A-F: Normal control group, CIA model group, GTW group, Sidaxue (SX) 40 g/kg group, SX 20 g/kg group, and SX 10 g/kg group, respectively.
1.2.8.2. 获取RA的靶基因及交集基因筛选
从GeneCards(https://www.genecards.org/)和OMID数据库(https://omim.org/)中获取类风湿性关节炎的靶基因,导出按照Relevance score的值,从高到低对Gene Symbol进行排列。将筛选出的药物成分靶基因与RA靶基因求交集,其交集基因即为外用四大血治疗类风湿性关节炎作用的潜在靶点。
1.2.8.3. 蛋白互作网络构建及核心蛋白筛选
将通过1.2.1.2得到的潜在靶点导入STRING平台(https://string-db.org/)获取PPI网络图,使用Cytoscape3.8.0软件构建PPI网络,利用软件中的Analyze Network功能进行拓扑分析,获得各节点的中心度值(degree),并根据degree值筛选出核心蛋白。
1.3. 统计学分析
应用SPSS 23.0软件进行数据分析,数据采用均数±标准差表示,各组间数据比较采用单因素方差分析,以P<0.05表示差异有统计学意义,所有实验都是独立重复3次。
2. 结果
2.1. SX对各组大鼠关节肿胀度的影响
第2次造模结束后,与Nor组相比,各组大鼠双后肢均出现明显红肿,毛发干枯现象,行动迟缓甚至无法直立行走,连续给药3周后,与Mod组相比,各给药组足肿度均降低,其中GTW组、SX 40 g/kg足肿度降低最显著(P<0.001,表 2、图 1)。
表 2.
SX对CIA大鼠双后肢足肿胀度的影响
Effect of Sidaxue on swelling of bilateral hind limb joints in rats with collagen-induced arthritis (Mean±SD, n=7)
| Group | 1week before the animal model-making | 1week before the intragastric administration | 1week after intragastric administration | 2weeks after intragastric administration | 3weeks after intragastric administration |
| Nor: Normal control group; Mod: CIA model group; GTW: Tripterygium glycosides group; SX: Sidaxue group. **P<0.01, ***P<0.001 vs the Nor group; #P<0.05, ##P<0.01, ###P<0.001 vs the Mod group; ▲P<0.05, ▲▲P<0.01, ▲▲▲P<0.001 vs GTW group. | |||||
| Nor | 1.326±0.087 | 1.364±0.084 | 1.415±0.063 | 1.465±0.067 | 1.534±0.093 |
| Mod | 1.287±0.073 | 1.735±0.081*** | 1.736±0.056*** | 1.769±0.078*** | 1.789±0.082** |
| GTW | 1.336±0.071 | 1.665±0.075 | 1.526±0.086### | 1.474±0.076### | 1.515±0.085### |
| SX 10g/kg | 1.287±0.068 | 1.721±0.067 | 1.689±0.089▲▲ | 1.657±0.062##▲▲▲ | 1.645±0.159#▲▲▲ |
| SX 20g/kg | 1.331±0.062 | 1.734±0.036 | 1.656±0.067# | 1.653±0.049###▲ | 1.554±0.124##▲▲ |
| SX 40g/kg | 1.292±0.036 | 1.684±0.093 | 1.546±0.078### | 1.464±0.061### | 1.531±0.079## |
2.2. SX对各组大鼠关节AI评分的影响
AI评分可以客观反映出大鼠发病的情况,连续给药3周后,与Nor组相比,Mod组大鼠AI评分明显增高(P<0.001),而与Mod组相比,GTW组和SX 40 g/kg组的AI评分明显下降(P<0.001、P<0.01),而其余给药组差异无统计学意义(表 3)。
表 3.
SX对CIA大鼠关节AI评分的影响
Effect of Sidaxue on arthritis index score in rats with collagen-induced arthritis (Mean±SD, n=7)
| Group | 1 week before CIA modeling | 1 week before drug administration | 1 week after administration | 2 weeks after administration | 3 weeks after administration |
| ***P<0.001 vs the Nor group; #P<0.05, ##P<0.01, ###P<0.001 vs the Mod group. | |||||
| Nor | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
| Mod | 3.75±0.51*** | 3.62±0.53*** | 3.62±0.46*** | 3.50±0.53*** | 3.62±0.518*** |
| GTW | 3.55±0.65 | 3.53±0.55 | 2.50±0.53# | 1.25±0.43## | 0.37±0.58### |
| SX 10g/kg | 3.85±1.51 | 3.63±0.58 | 3.25±0.62 | 2.62±0.51 | 1.87±0.64 |
| SX 20g/kg | 3.58±0.55 | 3.51±0.52 | 2.87±0.64 | 1.87±0.64 | 1.25±0.42 |
| SX 40g/kg | 3.87±0.63 | 3.67±0.51 | 2.62±0.58 | 1.50±0.53# | 0.50±0.53## |
2.3. SX对CIA大鼠脾脏及胸腺的质量分数的影响
连续给药3周后,与Nor组相比,Mod组胸腺和脾脏指数均升高(P<0.001),与Mod组相比,其中,GTW组、SX 40 g/kg组胸腺和脾脏指数均明显降低(P<0.001),SX 20 g/kg胸腺和脾脏指数有所下降(P<0.05、P<0.01),且SX 40 g/kg组与GTW组相比,差异无统计学意义(图 2)。
图 2.
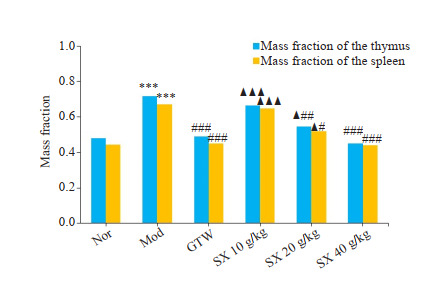
SX对CIA大鼠脾脏及胸腺的质量分数的影响
Effect of Sidaxue on mass fraction of the spleen and thymus in rats with collagen-induced arthritis (n=7). ***P<0.001 vs the Nor group; #P<0.05, ##P<0.01, ###P<0.001 vs Model group; ▲P<0.05, ▲▲▲P<0.01 vs GTW group.
2.4. SX对CIA大鼠滑膜组织病理学的影响
光镜下观察组织病理变化显示,连续给药3周后,Nor组关节软骨结构完整,骨层清晰,关节面光滑,软骨细胞分布均匀,滑膜组织未见炎性细胞浸润及纤维组织增生;Mod组滑膜细胞坏死,坏死区域见多量炎性细胞浸润;GTW组滑膜组织衬里层完整清晰,衬里下层见少量炎性细胞浸润;SX 40 g/kg、SX 20 g/kg组关节腔内滑膜组织充血明显减轻,未见明显炎性细胞浸润。SX 10 g/kg组软骨组织中度增生,软骨细胞生长活跃,炎性细胞浸润程度较Mod组有所减轻(图 3)。
图 3.
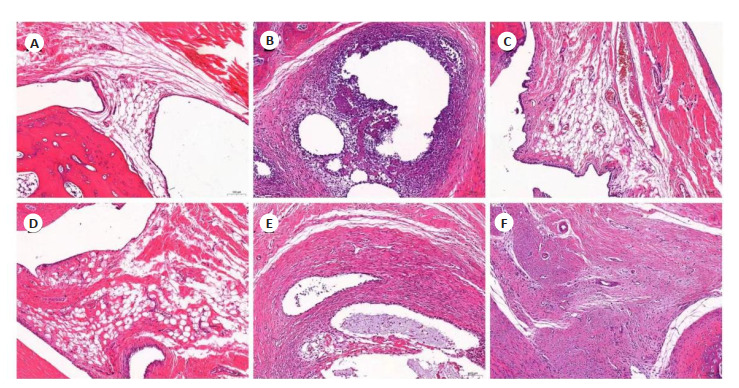
SX对各组大鼠滑膜组织病理改变的影响
Effect of Sidaxue on synovial pathology of the rats (HE staining, original magnification: ×100). A-F: Normal control group, CIA model group, GTW group, SX 40 g/kg group, SX 20 g/kg group, and SX 10 g/kg group, respectively.
2.5. 血清TNF-α、IL-1β含量
给药第21天时,与Nor组比较,Mod组血清TNF-α、IL-1β含量升高(P<0.05);与Mod组比较,GTW、SX40 g/kg组血清IL-1β含量下降(P<0.05),SX 40 g/kg、GTW组血清TNF-α含量下降明显(P<0.05,图 4)。
图 4.
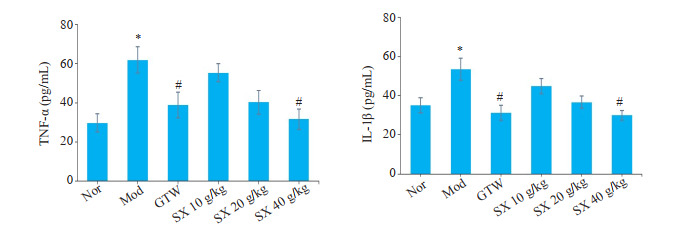
SX对CIA大鼠血清中TNF-α、IL-1β含量的影响
Effect of Sidaxue on serum TNF-α and IL-1β levels in rats with collagen-induced arthritis (Mean±SD, n=7). *P<0.01 vs the Nor group; #P<0.05 vs the Mod group.
2.6. SX对CIA大鼠中NK-κB、MMP1、MMP2、MMP9 mRNA表达水平的影响
给药3周后,取大鼠膝关节滑膜组织进行RT-PCR实验,结果显示,与Nor组相比,Mod组中NF-κB mRNA表达水平增高(P<0.01);而与Mod组相比,SX 40 g/kg组与GTW组中NF-κB的mRNA表达水平降低(P<0.01、P<0.05),而SX 20 g/kg、SX 10 g/kg组差异无统计学意义(图 5A)。进一步检测MMP1、MMP2、MMP9 mRNA表达,结果显示,与Nor组相比,Mod组中MMP1、MMP2、MMP9 mRNA表达均增高(P<0.001、P<0.001、P<0.01),而与Mod组相比,SX 40 g/kg、SX 20 g/kg组MMP1、MMP2、MMP9 mRNA表达均降低,其中,SX 40 g/kg组降低更显著(P<0.001、P<0.001、P<0.01),而SX 10 g/kg组差异无统计学意义(图 5B~D)。
图 5.
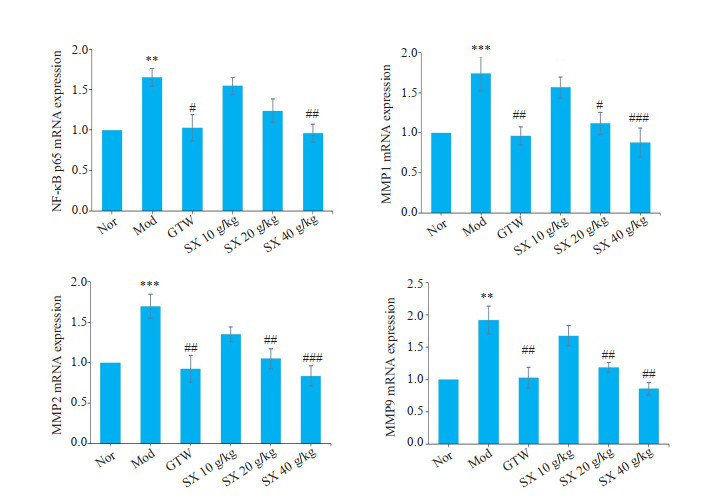
SX对CIA大鼠中NF-κB、MMP1、MMP2、MMP9 mRNA表达水平的影响
Effect of Sidaxue on mRNA expression levels of NF-κB, MMP1, MMP2 and MMP9 in the synovium of the rats with collagen-induced arthritis (n=7). **P<0.01, ***P<0.001 vs the Nor group; #P<0.05, ##P<0.01, ###P<0.001 vs the Mod group.
2.7. SX对CIA大鼠中NF-κB、MMP1、MMP2、MMP9蛋白表达水平的影响
给药3周后,与Nor组相比,Mod组中NF-κB的蛋白表达水平增高(P<0.01);而与Mod组相比,SX进一步检测促血管生长因子MMP1、MMP2、MMP9蛋白表达,结果显示,与Nor组相比,Mod组中MMP1、MMP2、MMP9蛋白表达水平增高(P<0.001、P<0.001、P<0.01);与Mod组相比,SX 40 g/kg、SX 20 g/kg组MMP1、MMP2、MMP9表达均降低,其中,SX 40 g/kg组降低更显著(P<0.001),SX 10 g/kg中MMP1、MMP2、MMP9蛋白表达差异无统计学意义(图 6A~D)。40 g/kg组下调NF-κB蛋白表达(P<0.01,P<0.001),SX 10 g/kg组NF-κB的蛋白表达差异无统计学意义(图 6)。
图 6.
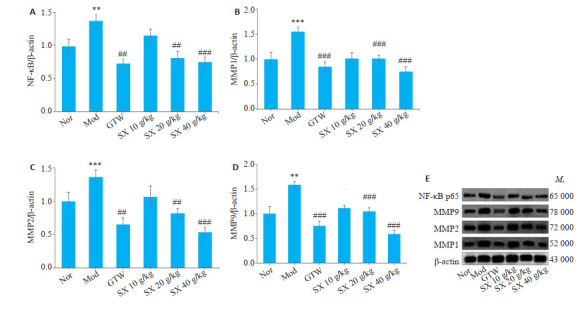
SX对CIA大鼠中NF-κB、MMP1、MMP2、MMP9蛋白表达水平的影响
Effect of Sidaxue on expression level of NF-κB, MMP1, MMP2 and MMP9 proteins in the synovium of the rats with collagen-induced arthritis (n=7). **P<0.01, ***P<0.001 vs the Nor group; ##P<0.01, ###P<0.001 vs the Mod group.
2.8. 网络药理学分析
2.8.1. 网络药理学中苗药“四大血”的活性成分和潜在靶基因的预测
筛选出类药性及表皮渗透性俱佳的杠柳甙元(MOL005658)、大豆苷元(MOL000390)、刺芒柄花素(MOL000392)、茵芋碱(MOL002663)等20个有效成分,并预测出其潜在164个靶基因。
2.8.2. 获取类风湿性关节炎的靶基因及交集基因筛选
运用GeneCards、OMIM数据库检索RA靶点,整理后得到靶点2620个。与药物靶点取交集共得到42个交集基因,即为四大血治疗类风湿性关节炎作用的潜在靶点。2.8.3蛋白互作网络构建及关键靶点结果分析结果显示,PPI网络有37个节点(图 7A)。利用Analyze Network进行拓扑分析,获得各节点的中心度值(表 3),并筛选出度值排名前13的靶蛋白,即核心蛋白(图 7B)。
图 7.
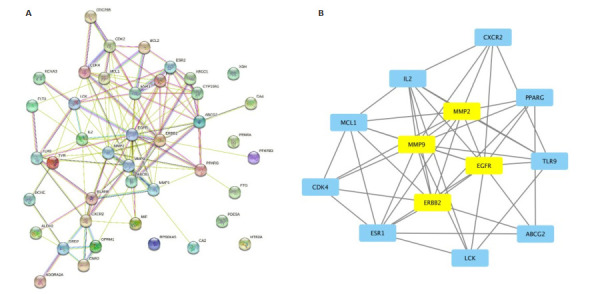
蛋白互作网络构建及关键靶点分析
Protein-protein interaction network (A) and analysis of the key targets (B).
3. 讨论
RA是一种以关节滑膜为主要靶器官的慢性自身免疫性疾病,属于中医“痹病”的范畴,以雷公藤为代表的中药在治疗RA方面取得了较好的效果[31]。国内的一项对照试验研究表明雷公藤制剂与甲氨蝶呤(MTX)联用效果优于MTX单用,并且其单一疗法对于控制RA活动性效果不逊于MTX单一法[32, 33]。SX是一种传统苗医验方复方药, 符合中药“君、臣、佐、使”的原则,本研究表明, SX能明显改善CIA大鼠AI指数评分胀,缓解免疫器官的过度反应,减少各炎性介质的产生,证实了SX抗炎、消肿、抗风湿的功效。
MMPs属于锌依赖性和钙依赖性内肽家族,通常由滑膜成纤维细胞释放[34, 35]。有研究表明[36]在静息FLS中,只观察到低水平的组成型MMP表达。MMPs酶可以降解细胞外基质的所有成分。胶原酶MMP-1因其在胶原降解过程中具有限速作用,在RA中起主要作用。其他MMPs如MMP-2、MMP-9的表达在关节炎中也升高,并降解关节的非胶原基质成分。此外有研究表明,MMP-9在关节滑膜血管新生的过程中具有重要作用,MMPs可通过分解内皮细胞的细胞外基质,刺激血管内皮细胞游走、转移,促进血管新生,参与血管翳形成[37]。Chen等[38]提出阻断MMPs可能是开发RA新疗程的潜在策略。有研究通过抑制JNK/P38/AP-1途径,下调MMPs的表达,使CIA小鼠具有较低程度的组织病理学评分、炎症、滑膜增生、关节软骨和骨破坏,软骨和滑膜组织中MMP-1、MMP-3和MMP-13的表达水平也显著降低[39]。在本实验研究中,通过观察镜下组织HE病理切片,检测MMP1、MMP2、MMP9 mRNA和蛋白表达,表明MMPs在正常结缔组织中,生理性表达较低,但在RA病理条件下显著增加,并可引起滑膜血管增生、软骨及骨损害等病理变化。而SX可降低MMPs水平,减轻大鼠足趾炎症,抑制新生血管形成,改善滑膜关节衰竭。
RA的特征是免疫和非免疫细胞从外周循环迁移到滑膜和滑膜关节液中,导致促炎细胞因子水平升高,最显著的是TNF-α、IL-1β、IL-6等。这些细胞因子激活的信号转导通路似乎调节了MMP基因的表达[34]。本实验测得Mod组血清TNF-α、IL-1β含量升高,与之MMPs表达上升,而SX能下调其含量使MMPs表达下降。研究表明,细胞因子TNF-α、IL-1β可通过启动子与转录因子结合经由核因子-κB(NF-κB)等信号转导途径激活MMP基因[40]。NF-kB是细胞因子诱导的转录因子,在控制关节炎中MMP的表达中起关键作用。NF-kB是p50和p65亚基(61-63)的二聚体,当与NF-kB抑制剂(IkB)结合时,在细胞质中无活性。当TNF-α结合到TNF-fr/IL-β结合到IL-R。IKK向IKBα添加磷酸盐。IkB被磷酸化,并在蛋白体中被靶向破坏。p50和p65亚基从IkB分离并转运到细胞核,在那里它们与靶向基因启动子的位点结合(共识序列=GGGACTTTCC)并激活转录。MMP-1、MMP-3和MMP-9的启动子含有NF-kB的典型结合位点,NF-kB的激活是这些基因转录诱导的必要条件[41]。NF-kB在关节炎中的重要性已被动物模型证明,缺乏p50亚基的小鼠对胶原诱导的关节炎具有难治性。Wang等[6]证明激活NF-κB通路促进RA患者MMP-9水平升高,从而加速骨侵蚀过程,增加RA患者的疾病严重程度。而运用NF-κB抑制剂BAY 11-7082可显著降低MMP-9水平。本研究RT-PCR和Western blot实验结果显示给予SX治疗后,大鼠滑膜组织中TNF-α、IL-1β含量明显降低,对下游靶基因NF-κB的激活效应减弱,使NF-κB表达量降低,进而抑制MMP1、MMP2、MMP9表达,减轻了炎症反应,减缓滑膜血管增生,减少软骨和骨破坏。
综上所述,本研究提示,SX可以改善CIA软骨和骨的破坏及滑膜血管增生,其机制可能与抑制TNF-α/IL-1β/NF-κB/MMP信号通路,下调NK-κB、TNF-α、IL-1β、MMP1、MMP2、MMP9表达有关。提示SX可作为治疗RA的合适候选药物,以预防RA滑膜关节衰竭等不良后果。
本研究针对下游分子的选择及信号通路的探索进行了创新,而实验方法的选择仍延续了前人经验,出现了一定滞后性。中医外治疗法治疗RA,具有“简、便、验、廉”的特色优势,毒副作用较小[42],是课题组过去未涉足过的领域,我们将在后续研究中继续基于网络药理学模拟预测的数据,探究其外用下的作用机制,并比较其与口服、以及口服联合外用的效果差异,为丰富SX的研究提供理论基础和科学依据。
Biography
李云飞,E-mail: 18785065316@163.com
Funding Statement
国家自然科学基金(82060776);2021年省级大学生创新创业计划训练项目[S202110660045]
Supported by National Natural Science Foundation of China (82060776)
Contributor Information
李 云飞 (Yunfei LI), Email: 18785065316@163.com.
孙 见飞 (Jianfei SUN), Email: 553164552@qq.com.
吴 遵秋 (Zunqiu WU), Email: 457581851@qq.com.
References
- 1.Smolen JS, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet. 2016;388(10055):2023–38. doi: 10.1016/S0140-6736(16)30173-8. [DOI] [PubMed] [Google Scholar]
- 2.Firestein GS, McInnes IB. Immunopathogenesis of rheumatoid arthritis. Immunity. 2017;46(2):183–96. doi: 10.1016/j.immuni.2017.02.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Scherer HU, Häupl T, Burmester GR. The etiology of rheumatoid arthritis. J Autoimmun. 2020;110:102400. doi: 10.1016/j.jaut.2019.102400. [DOI] [PubMed] [Google Scholar]
- 4.Geng Q, Wei QF, Wang SJ, et al. Physcion 8-O-β-glucopyranoside extracted from Polygonumï??cuspidatum exhibits anti-proliferative and anti-inflammatory effects on MH7A rheumatoid arthritis-derived fibroblast-like synoviocytes through the TGF-β/MAPK pathway. Int J Mol Med. 2018;42(2):745–54. doi: 10.3892/ijmm.2018.3649. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.吴 宁, 袁 桃花, 姬 进忠, et al. 苗药验方四大血对人类风湿性关节炎成纤维样滑膜细胞凋亡和焦亡的影响. 南方医科大学学报. 2021;41(10):1473–83. doi: 10.12122/j.issn.1673-4254.2021.10.05. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Wang XX, Tang K, Wang YY, et al. Elevated microRNA-145-5p increases matrix metalloproteinase-9 by activating the nuclear factor-κB pathway in rheumatoid arthritis. Mol Med Report. 2019;20(3):2703–11. doi: 10.3892/mmr.2019.10499. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.方 欢英, 杨 术生. 基质金属蛋白酶与类风湿性关节炎. 生命的化学. 2020;40(2):216–21. [Google Scholar]
- 8.王 海波. MMP-2/MMP-9在炎症中的研究进展. 医学综述. 2014;20(17):3120–2. doi: 10.3969/j.issn.1006-2084.2014.17.018. [DOI] [Google Scholar]
- 9.Smeets TJ, Kraan MC, Galjaard S, et al. Analysis of the cell infiltrate and expression of matrix metalloproteinases and granzyme B in paired synovial biopsy specimens from the cartilage-pannus junction in patients with RA. Ann Rheum Dis. 2001;60(6):561–5. doi: 10.1136/ard.60.6.561. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Muniz-Bongers LR, McClain CB, Saxena M, et al. MMP2 and TLRs modulate immune responses in the tumor microenvironment. JCI Insight. 2021;6(12):e144913. doi: 10.1172/jci.insight.144913. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Zamri F, de Vries TJ. Use of TNF inhibitors in rheumatoid arthritis and implications for the periodontal status: for the benefit of both? Front Immunol. 2020;11:591365. doi: 10.3389/fimmu.2020.591365. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Ma XX, Xu SQ. TNF inhibitor therapy for rheumatoid arthritis. Biomed Rep. 2013;1(2):177–84. doi: 10.3892/br.2012.42. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Yan CH, Boyd DD. Regulation of matrix metalloproteinase gene expression. J Cell Physiol. 2007;211(1):19–26. doi: 10.1002/jcp.20948. [DOI] [PubMed] [Google Scholar]
- 14.Araki Y, Tsuzuki Wada T, Aizaki Y, et al. Histone methylation and STAT-3 differentially regulate interleukin-6-induced matrix metalloproteinase gene activation in rheumatoid arthritis synovial fibroblasts. Arthritis Rheumatol. 2016;68(5):1111–23. doi: 10.1002/art.39563. [DOI] [PubMed] [Google Scholar]
- 15.Hu YJ, Pan HW, Peng JQ, et al. Resveratrol inhibits necroptosis by mediating the TNF-α/RIP1/RIP3/MLKL pathway in myocardial hypoxia/reoxygenation injury. Acta Biochim Biophys Sin. 2021;53(4):430–7. doi: 10.1093/abbs/gmab012. [DOI] [PubMed] [Google Scholar]
- 16.Wang YW, Zhao MH, He SJ, et al. Necroptosis regulates tumor repopulation after radiotherapy via RIP1/RIP3/MLKL/JNK/IL8 pathway. J Exp Clin Cancer Res. 2019;38(1):461. doi: 10.1186/s13046-019-1423-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Cush JJ. Rheumatoid arthritis: early diagnosis and treatment. Med Clin North Am. 2021;105(2):355–65. doi: 10.1016/j.mcna.2020.10.006. [DOI] [PubMed] [Google Scholar]
- 18.Association CR. 2018 Chinese guideline for the diagnosis and treatment of rheumatoid arthritis. Zhonghua Nei Ke Za Zhi. 2018;57(4):242–51. doi: 10.3760/cma.j.issn.0578-1426.2018.04.004. [DOI] [PubMed] [Google Scholar]
- 19.Scott DL, Stevenson MD. Treating active rheumatoid arthritis with Janus kinase inhibitors. Lancet. 2017;390(10093):431–2. doi: 10.1016/S0140-6736(17)31659-8. [DOI] [PubMed] [Google Scholar]
- 20.Burmester GR, Pope JE. Novel treatment strategies in rheumatoid arthritis. Lancet. 2017;389(10086):2338–48. doi: 10.1016/S0140-6736(17)31491-5. [DOI] [PubMed] [Google Scholar]
- 21.禄成龙宫玉锁, 刘 建平, et al. 中医药介导OPG/RANK/RANKL信号通路防治类风湿关节炎的研究进展. 数理医药学杂志. 2023;36(9):697–707. [Google Scholar]
- 22.刘 丽莹, 麦 泳仪. 中药治疗类风湿关节炎及临床应用研究进展. 临床医药文献电子杂志. 2020;7(23):195. [Google Scholar]
- 23.杨 丽, 刘 荣华, 黄 四碧, et al. 类风湿性关节炎的发病机制及治疗药物研究进展. 中国药房. 2021;7(17):2154–9. doi: 10.6039/j.issn.1001-0408.2021.17.18. [DOI] [Google Scholar]
- 24.吴 宁, 袁 桃花, 姬 进忠, et al. 苗药验方四大血对人类风湿性关节炎成纤维样滑膜细胞凋亡和焦亡的影响. 南方医科大学学报. 2021;7(10):1473–83. doi: 10.12122/j.issn.1673-4254.2021.10.05. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Wu N, Yuan TH, Yin ZX, et al. Network pharmacology and molecular docking study of the Chinese Miao medicine sidaxue in the treatment of rheumatoid arthritis. Drug Des Devel Ther. 2022;16:435–66. doi: 10.2147/DDDT.S330947. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.王 序. 外用清热利湿通络中药治疗湿热痹阻型类风湿性关节炎的效果研究. 中国现代药物应用. 2021;15(1):213–5. [Google Scholar]
- 27.方剑乔. 治疗类风湿性关节炎中药外用新药-马藤祛痹镇痛凝胶膏的研发[P]. 浙江中医药大学, 2014-09-12.
- 28.Diez I, Colom H, Moreno J, et al. A comparative in vitro study of transdermal absorption of a series of calcium channel antagonists. J Pharm Sci. 1991;80(10):931–4. doi: 10.1002/jps.2600801006. [DOI] [PubMed] [Google Scholar]
- 29.Bousquet E, Tirendi S, Bonina FP, et al. Bioavailability of two formulations of acetylsalicylic acid gums. Pharmazie. 1992;47(8):607–9. [PubMed] [Google Scholar]
- 30.李 光华. 口服药物吸收的研究进展. 天津药学. 2014;26(2):69–71. [Google Scholar]
- 31.任 春贞, 骆 亚莉, 李 玲, et al. 焦树德教授治疗类风湿关节炎经验小结. 甘肃科技. 2016;32(5):120–1. [Google Scholar]
- 32.Spurlock CF 3rd, Tossberg JT, Matlock BK, et al. Methotrexate inhibits NF-κB activity via long intergenic (noncoding) RNA-p21 induction. Arthritis Rheumatol. 2014;66(11):2947–57. doi: 10.1002/art.38805. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Chen SR, Dai Y, Zhao J, et al. A mechanistic overview of triptolide and celastrol, natural products from Tripterygium wilfordii hook F. Front Pharmacol. 2018;9:104. doi: 10.3389/fphar.2018.00104. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Malemud CJ. Matrix metalloproteinases and synovial joint pathology. Prog Mol Biol Transl Sci. 2017;148:305–25. doi: 10.1016/bs.pmbts.2017.03.003. [DOI] [PubMed] [Google Scholar]
- 35.Itoh Y. Metalloproteinases in rheumatoid arthritis: potential thera-peutic targets to improve current therapies. Prog Mol Biol Transl Sci. 2017;148:327–38. doi: 10.1016/bs.pmbts.2017.03.002. [DOI] [PubMed] [Google Scholar]
- 36.Yamanishi Y, Firestein GS. Pathogenesis of rheumatoid arthritis: the role of synoviocytes. Rheum Dis Clin North Am. 2001;27(2):355–71. doi: 10.1016/s0889-857x(05)70206-4. [DOI] [PubMed] [Google Scholar]
- 37.邓 庆, 贺 飞, 胡 清桥, et al. 桑枝调控HIF-1α/VEGF/MMPs信号通路改善佐剂性关节炎大鼠骨破坏的研究. 湖南中医药大学学报. 2022;42(7):1096–104. [Google Scholar]
- 38.Chen SJ, Lin GJ, Chen JW, et al. Immunopathogenic mechanisms and novel immune-modulated therapies in rheumatoid arthritis. Int J Mol Sci. 2019;20(6):1332. doi: 10.3390/ijms20061332. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Jia QY, Wang TT, Wang XY, et al. Astragalin suppresses infl-ammatory responses and bone destruction in mice with collagen-induced arthritis and in human fibroblast-like synoviocytes. Front Pharmacol. 2019;10:94. doi: 10.3389/fphar.2019.00094. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Yan CH, Boyd DD. Regulation of matrix metalloproteinase gene expression. J Cell Physiol. 2007;211(1):19–26. doi: 10.1002/jcp.20948. [DOI] [PubMed] [Google Scholar]
- 41.Le Rossignol S, Ketheesan N, Haleagrahara N. Redox-sensitive transcription factors play a significant role in the development of rheumatoid arthritis. Int Rev Immunol. 2018;37(3):129–43. doi: 10.1080/08830185.2017.1363198. [DOI] [PubMed] [Google Scholar]
- 42.韩 豪, 徐 进, 钟 文楷, et al. 类风湿关节炎中医外治疗法临床应用研究概况. 中医外治杂志. 2018;27(1):47–9. [Google Scholar]


