Resumo
Fundamento:
A doença por coronavírus 2019 (COVID-19) está associada à hipercoagulabilidade. Permanece incerto se a anticoagulação contínua para fibrilação atrial (FA) em pacientes que posteriormente contraem COVID-19 melhora os desfechos clínicos.
Objetivos:
Comparar a anticoagulação oral crônica com ausência de anticoagulação prévia em pacientes com FA que contraíram uma infecção por COVID-19 em relação aos desfechos de mortalidade por todas as causas, mortalidade por COVID-19, admissão em unidade de terapia intensiva (UTI) e hospitalização.
Métodos:
Buscamos sistematicamente no PubMed, Embase e Cochrane Library estudos elegíveis desde o início até dezembro de 2022. Incluímos estudos que compararam desfechos de COVID-19 em pacientes com e sem anticoagulação crônica prévia para FA. Foram agrupadas razões de risco (RR) com intervalos de confiança (IC) de 95% por meio de um modelo de efeitos aleatórios. O nível de significância foi estabelecido em p < 0,05. As avaliações da qualidade e do risco de viés foram realizadas de acordo com as recomendações da Cochrane.
Resultados:
Foram identificados 10 estudos abrangendo 1.177.858 pacientes com COVID-19 e FA, dos quais 893.772 (75,9%) estavam em anticoagulação crônica prévia para FA. Em pacientes com COVID-19, a anticoagulação crônica para FA reduziu significativamente a mortalidade por todas as causas (RR 0,75; IC 95% 0,57 a 0,99; p = 0,048; I2 = 89%) e a mortalidade relacionada à COVID-19 (RR 0,76; IC 95% 0,72 a 0,79; p < 0,001; I2 = 0%) quando comparada com a ausência de anticoagulação prévia. Em contrapartida, não houve diferença entre os grupos em relação à hospitalização (RR 1,08; IC 95% 0,82 a 1,41; p = 0,587; I2 = 95%) ou internação em UTI (RR 0,86; IC 95% 0,68 a 1,09; p = 0,216; I2 = 69%).
Conclusões:
Nesta metanálise, a anticoagulação crônica para pacientes com FA que contraíram COVID-19 foi associada a taxas significativamente mais baixas de mortalidade por todas as causas e mortalidade relacionada à COVID-19 em comparação com a ausência de anticoagulação anterior.
Palavras-chave: Anticoagulantes, Fibrilação Atrial, COVID-19, Inibidores do Fator Xa, Vitamina K
Introdução
A doença por coronavírus 2019 (COVID-19), causada pelo coronavírus 2 da síndrome respiratória aguda grave (SARS-CoV-2), surgiu em dezembro de 2019, levando a uma pandemia global com uma elevada carga de morbidade, mortalidade e dificuldades econômicas.1 A Organização Mundial da Saúde relatou um total de 767 milhões de casos confirmados e 6,9 milhões de mortes em todo o mundo até 5 de julho de 2023.2
A infecção por SARS-CoV-2 está associada a uma grande variedade de apresentações clínicas não respiratórias, incluindo trombose microvascular pulmonar e coagulação anormal, mesmo em casos leves. A fisiopatologia por trás disso refere-se principalmente à hipercoagulabilidade imune-induzida secundária à resposta do paciente à infecção.3,4 Levando isso em consideração, as diretrizes recomendam que os pacientes com COVID-19 em uso de anticoagulação oral para condições subjacentes e sem quaisquer contraindicações com relação a ela não interrompam esses tratamentos.5
A terapia prolongada com anticoagulante oral (ACO) é uma medida essencial para evitar eventos tromboembólicos em pacientes com fibrilação atrial (FA). A hipercoagulabilidade associada à infecção por SARS-CoV-2 levanta preocupações sobre como a anticoagulação contínua em pacientes com FA que posteriormente contraem COVID-19 pode afetar os desfechos clínicos.5 Portanto, realizamos uma revisão sistemática e metanálise comparando os desfechos da anticoagulação versus a ausência de anticoagulação em pacientes com FA que desenvolveram COVID-19.
Métodos
Esta revisão sistemática e metanálise foram realizadas seguindo as diretrizes da Manual da Colaboração Cochrane para Revisões Sistemáticas de Intervenções e da declaração dos Principais Itens para Relatar Revisões Sistemáticas e Metanálises (PRISMA).6,7 A metanálise foi registrada prospectivamente no Registro Prospectivo de Revisões Sistemáticas (PROSPERO) sob o número de protocolo CRD42022341926.
Estratégia de busca e extração de dados
Buscamos sistematicamente no PubMed, Embase e na Biblioteca Cochrane desde o início até dezembro de 2022. Depois de remover as duplicatas, dois autores (I.L. e N.F.) selecionaram títulos e resumos e avaliaram independentemente os artigos de texto integral para inclusão com base em critérios pré-especificados. As discrepâncias foram resolvidas por consenso entre os autores. Além disso, utilizamos a técnica de backward snowballing (isto é, revisão de referências) para identificar textos relevantes de artigos identificados na pesquisa original.
Nossa estratégia de pesquisa incluiu os seguintes descritores em ciências da saúde: "atrial fibrillation", "oral anticoagulant", "OACs", "NOAC", "non-vitamin K", "novel anticoagulant", "DOAC", "DOACs", "direct oral anticoagulant", "dabigatran", "apixaban", "edoxaban", "rivaroxaban", "VKA", "vitamin K antagonist", "warfarin", "LMWH", "low-molecular-weight heparin", "low molecular weight heparin", "enoxaparin", "bivalirudin", "dalteparin", "fondaparinux", "COVID-19", "coronavirus disease 19", "coronavirus disease-19", "SARS-CoV-2."
Critérios de elegibilidade
Esta revisão sistemática e metanálise incluíram estudos que (1) eram relatórios completos publicados em jornais indexados ou resumos de grandes conferências científicas; (2) incluíram pacientes adultos (idade ≥ 18 anos) previamente diagnosticados com FA que posteriormente contraíram COVID-19 confirmada por teste validado; (3) estratificaram pacientes em uso ou não de anticoagulação crônica para FA; (4) relataram qualquer um dos nossos resultados de interesse, nomeadamente: mortalidade por todas as causas, mortalidade por COVID-19, internação em unidade de terapia intensiva (UTI) e hospitalização; e (5) foram publicados em inglês ou espanhol. Excluímos (1) estudos com populações sobrepostas; (2) relatos de casos, séries de casos, cartas ao editor, comentários ou editoriais; e (3) estudos sem grupo controle.
Avaliação de qualidade
Os estudos observacionais foram avaliados usando o risco de viés de estudos de intervenção não randomizados (Risk of Bias Summary for Non-randomized Studies – ROBINS-I) para avaliar a qualidade metodológica dos estudos incluídos, uma ferramenta baseada em respostas às questões de sinalização e análises para cada domínio de viés e para risco geral de viés, o que permite classificar cada estudo como risco de viés "baixo", "moderado", "grave" ou "crítico".8 O efeito de estudos pequenos (viés de publicação) foi avaliado com gráficos de funil e teste de regressão de Egger.9
Análise estatística
Os desfechos binários foram resumidos usando o modelo de efeitos aleatórios de Mantel-Haenszel (MH), com risco relativo (RR) e intervalo de confiança (IC) de 95% como medida do tamanho do efeito. Utilizamos o estimador Sidik-Jonkman (método de variância do erro do modelo) para calcular a variância da heterogeneidade τ2, uma vez que se esperava que o grau de heterogeneidade fosse substancial.10
O hazard ratio ajustado (HRa) para múltiplos fatores de confusão, se relatados, foi agrupado usando o modelo de efeitos aleatórios de MH com IC de 95% e estimador de Paule-Mandel para cálculo de variância de heterogeneidade. A heterogeneidade entre os estudos foi avaliada com a estatística Q de Cochrane (e o qui-quadrado resultante), com p ≤ 0,10 considerado estatisticamente significativo. O teste estatístico I2 de Higgins e Thompson foi usado para medir a consistência.11 Um valor de 0% indica nenhuma heterogeneidade observada, e valores de 1% a 25%, 26% a 50% e > 50% indicam heterogeneidade baixa, moderada e substancial, respectivamente.11 A significância estatística foi estabelecida em p < 0,05 e todos os testes foram bicaudais. Realizamos todos os cálculos e gráficos com o software R versão 4.2.2 (R Core Team 2021) usando os pacotes de extensão "meta", "metafor" e "dmetar".12-15
Abordando a heterogeneidade
Realizamos uma análise de exibição gráfica de heterogeneidade (GOSH) para mortalidade por todas as causas para identificar possíveis outliers e estudos influentes.16 Primeiro, foi gerado um gráfico GOSH. Em seguida, foram aplicados 3 algoritmos de aprendizado de máquina (AM) não supervisionados para detectar clusters nos dados do gráfico GOSH, da maneira seguinte: (1) o algoritmo k-means;17 (2) agrupamento espacial baseado em densidade de aplicações com ruído (DBSCAN);18 e (3) modelos de mistura gaussiana.19
Alternativamente, aplicamos as funções "find.outliers" e "InfluenceAnalysis" (pacote R dmetar) para mortalidade por todas as causas, hospitalização e internação em UTI para auxiliar na identificação de possíveis outliers. A função "find.outliers" define o estudo como um outlier se o intervalo de confiança do estudo não se sobrepuser ao intervalo de confiança do efeito agrupado. A função "InfluenceAnalysis", por sua vez, gera 3 gráficos de diagnóstico: (1) o gráfico de Baujat, usado para identificar estudos que tiveram altas contribuições para a heterogeneidade nos dados meta-analíticos;20 (2) a análise de sensibilidade de exclusão, removendo iterativamente um estudo de cada vez para garantir que os resultados não dependessem de um único estudo; e (3) diagnósticos de influência segundo Viechbauer e Cheung.21
Resultados
Seleção dos estudos e características de linha de base
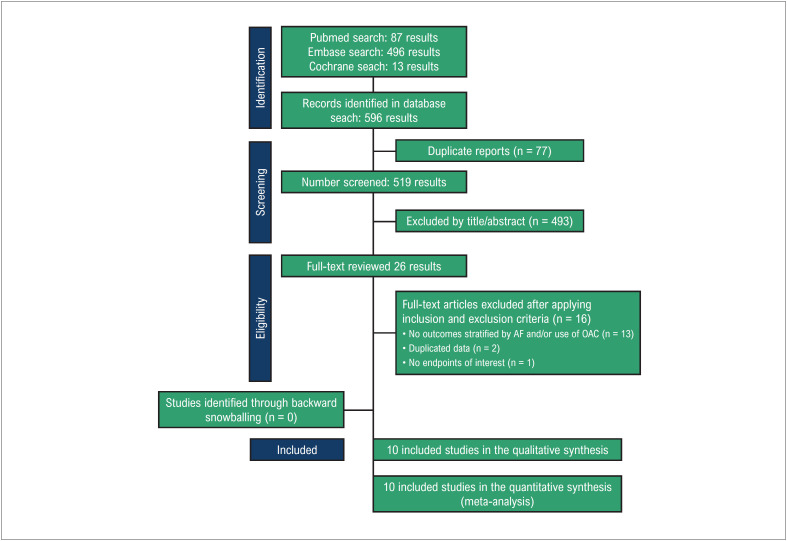
Conforme ilustrado na Figura 1, foram identificados 596 estudos, dos quais 493 foram excluídos com base na revisão do título ou do resumo. Foram completamente revisados 26 estudos, com base em nossos critérios de inclusão. Após a avaliação final, restaram 10 manuscritos elegíveis para inclusão nesta metanálise.22-31 Foram incluídos 1.177.858 pacientes, dos quais 893.772 (75,9%) estavam em uso de anticoagulantes para FA antes da infecção por COVID-19. A média de idade variou de 71 a 82 anos e 629.628 pacientes eram do sexo masculino (55,5%). As características individuais do estudo são relatadas na Tabela 1.
Figura 1. Fluxograma PRISMA de triagem e seleção de estudos. ACO: anticoagulante oral; FA: fibrilação atrial.
Tabela 1. Características de linha de base dos estudos incluídos.
| Estudo | Número de pacientes ACO / sem ACO | Sexo masculino, n (%) | Idade média, (anos) | HTN, n (%) | IC, n (%) | AVC, AIT ou embolia sistêmica, n (%) | Doença renal, n (%) | Doença hepática, n (%) | DAP, n (%) | DM, n (%) | Doença pulmonar, n (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ageno, 202122 | 43 / 111 | 91 (59,1) | 81,0† | 104 (67,5) | 52 (33,8) | 24 (15,6) | NA | NA | NA | 30 (19,4) | 43 (27,9) |
| Denas, 202123 | 559 / 559 | 608 (54,4) | NA | 972 (86,9) | 184 (16,4) | 169 (15,1) | 96 (8,6) | 11 (1,0) | 27 (2,4) | 298 (24,0) | NA |
| Flam, 202024 | 103.703 / 36.875 | 87.508 (62,2) | 73,6† | NA | 30.986 (22,0) | 28.803 (20,5) | 7.823 (5,6) | 2.227 (1,6) | NA | NA | 27.855 (19,8) |
| Fumagalli, 202225 | 91 / 85 | 91 (51,7) | 82,0 | 125 (71,0) | 55 (31,0) | 23 (13,0) | 36 (20,0) | 3 (1,7) | 37 (21,0) | 58 (32,0) | 37 (21,0) |
| Gómez, 202226 | 1.361 / 392 | 1.065 (59,1) | 78,1* | 1.430 (79,4) | 568 (31,5) | NA | NA | NA | 174 (9,6) | 555 (30,8) | 269 (14,9) |
| Handy, 202227 | 722.737 / 187.133 | 480.676 (52,8) | 79,0 | 630.245 (69,2) | 225.746 (24,8) | 180.958 (19,9) | 293.949 (32,3) | 7.983 (0,9) | 137.666 (15,1) | 245.195 (26,9) | NA |
| Louis, 202228 | 361 / 269 | 354 (56,1) | 77,4 | 542 (86,0) | 310 (49,2) | 92 (14,6) | 229 (36,3) | 57 (9,0) | 7 (1,1) | 280 (44,4) | 83 (13,2) |
| Rivera-Caravaca, 202229 | 675 / 7.023 | 4.500 (58,4) | 63,0† | 3.718 (48,3) | 174 (2,3) | 570 (7,4) | 484 (6,3) | 271 (3,5) | 645 (8,4) | 1.455 (18,9) | 523 (6,8) |
| Wong, 202230 | 52.832 / 18.271 | 54.735 (76,9) | 71,0† | 29.683 (41,7) | 7.124 (10,0) | 2.244 (3,1) | 10.524 (14,8) | NA | 634 (0,9) | 9.190 (12,9) | 6.815 (9,6) |
| Zadeh, 202231 | 11.410 / 33.368 | NA | NA | NA | 44.778 (100,0) | NA | NA | NA | NA | NA | NA |
Dados referentes a pacientes não falecidos.
Dados referentes a pacientes anticoagulados. ACO: anticoagulante oral; AIT: ataque isquêmico transitório; AVC: acidente vascular cerebral; DAP: doença arterial periférica; DM: diabetes mellitus; HTN: hipertensão; IC: insuficiência cardíaca.
Dada a natureza não randomizada dos estudos, relatamos características basais estratificadas por uso versus não uso de anticoagulação entre os 7 estudos que relataram esses dados (Tabela 2). Como esperado, houve uma carga maior de comorbidades em pacientes com FA em uso de ACO em comparação com aqueles não em uso de ACO, incluindo hipertensão, insuficiência cardíaca, doença renal e eventos tromboembólicos prévios. Os pacientes em uso de ACO também eram mais velhos do que aqueles que não estavam anticoagulados.
Tabela 2. Características dos estudos individuais subdivididas por uso de anticoagulação.
| Estudo | Número de pacientes ACO / sem ACO | Sexo masculino, n (%) ACO / sem ACO | Idade média, (anos) ACO / sem ACO | HTN, n (%) ACO / sem ACO | IC, n (%) ACO / sem ACO | AVC, AIT ou embolia sistêmica, n (%) ACO / sem ACO | Doença renal, n (%) ACO / sem ACO | Doença hepática, n (%) ACO / sem ACO | DAP, n (%) ACO / sem ACO | DM, n (%) ACO / sem ACO | Doença pulmonar, n (%) ACO / sem ACO |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ageno, 202122 | 43 / 111 |
23 (53,5) / 68 (61,3) |
81,0 / 80,0 |
30 (69,8) / 74 (66,7) |
24 (55,8) / 28 (25,2) |
8 (18,6) / 16 (14,4) |
NA | NA | NA | 10 (23,2) / 20 (18,0) |
11 (25,6) / 32 (28,8) |
| Denas, 202123 | 559 / 559 |
303 (54,2) / 306 (54,7) |
NA | 490 (87,7) / 485 (86,8) |
93 (16,6) / 91 (16,3) |
78 (14,0) / 91 (16,3) |
47 (8,4) / 49 (8,8) |
6 (1,1) / 5 (0,9) |
15 (2,7) / 12 (2,1) |
132 (23,6) / 137 (24,5) |
NA |
| Flam, 202024 | 103.703 / 36.875 |
62.488 (60,3) / 25.020 (67,9) |
73,6 / 66,4 |
NA | 26.544 (25,6) / 4.442 (12) |
17.650 (17) / 2.853 (7,7) |
6.082 (5,9) / 1.741 (4,7) |
1.445 (1,4) / 832 (2,3) |
NA | NA | 21.762 (21) / 6.093 (16,5) |
| Handy, 202227 | 722.737 / 187.133 |
384.260 (53,2) / 96.416 (10,6) |
79,0 / 79,0 |
600.623 (83,1) / 124.731 (66,6) |
228.877 (31,6) / 33.723 (18,0) |
183.140 (25,3) / 30.370 (16,2) |
284.379 (39,3) / 55.984 (29,9) |
8.462 (1,17) / 2.543 (1,40) |
159.892 (22,1) / 33.720 (18,0) | 242.060 (33,5) / 47.979 (25,6) |
NA |
| Louis, 202228 | 361 / 269 |
206 (57,1) / 148 (55) |
78,5 / 75,9 |
311 (86,1) / 231 (85,9) |
200 (55,4) / 110 (40,9) |
62 (17,2) / 30 (11,2) |
113 (31,3) / 65 (24,2) |
26 (7,2) / 31 (11,5) |
4 (1,1) / 3 (1,1) |
158 (43,8) / 122 (45,4) |
55 (15,2) / 28 (10,4) |
| Rivera-Caravaca, 202229 | 675 / 7.023 |
403 (59,7) / 4.097 (58,3) |
80,0 / 63,0 |
543 (80,3) / 3.176 (45,2) |
46 (6,8) / 128 (1,8) |
131 (19,4) / 439 (6,3) |
115 (17) / 369 (5,3) |
33 (4,9) / 238 (3,4) |
102 (15,1) / 543 (7,7) |
198 (29,3) / 1.257 (17,9) |
104 (15,4) / 419 (6,0) |
| Wong, 202230 | 52.832 / 18.271 |
41.870 (79,2) / 12.865 (70,4) |
71,0 / 69,0 |
22.061 (41,8) / 7.622 (41,7) |
5.700 (10,8) / 1.424 (7,8) |
1.041 (2,0) / 336 (1,8) |
8.477 (16,0) / 2.047 (11,2) |
NA | 426 (0,8) / 208 (1,1) |
6.508 (12,3) / 2.682 (14,6) |
7.372 (14) / 2.302 (12,6) |
ACO: anticoagulante oral; AIT: ataque isquêmico transitório; AVC: acidente vascular cerebral; DAP: doença arterial periférica; DM: diabetes mellitus; HTN: hipertensão; IC: insuficiência cardíaca.
Análise agrupada de todos os estudos
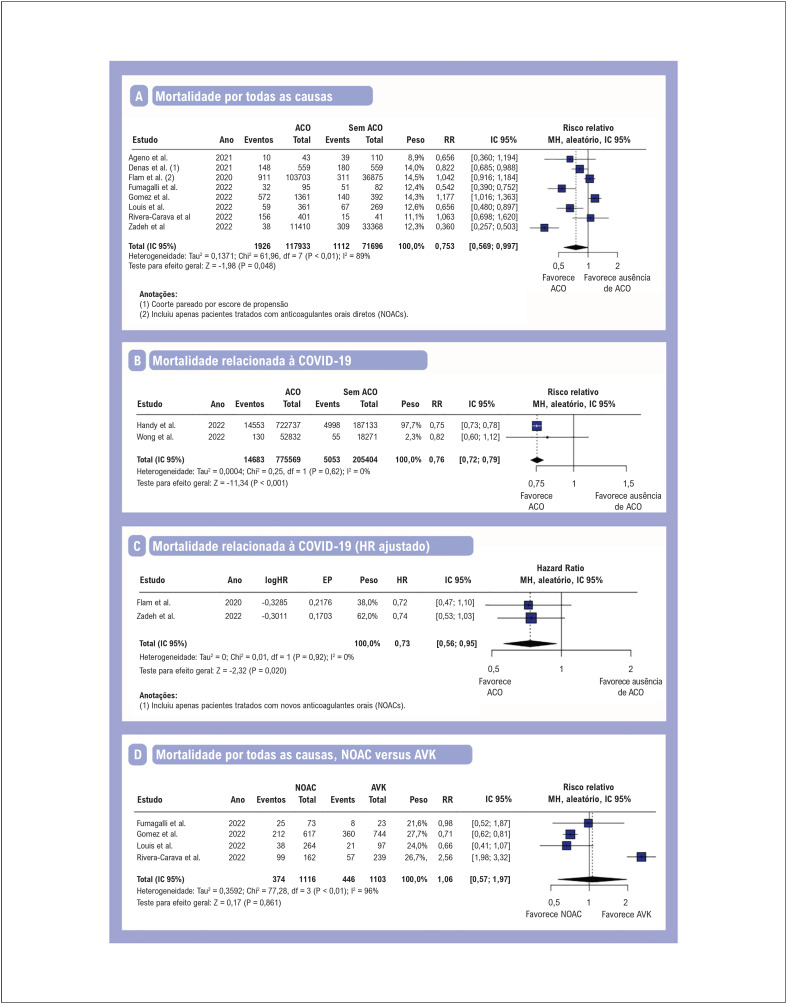
Os desfechos de mortalidade estão resumidos na Figura 2A-D. A mortalidade por todas as causas (Figura 2A) e a mortalidade relacionada à COVID-19 (Figura 2B) foram significativamente reduzidas entre os pacientes que receberam terapia com ACO em comparação com aqueles sem uso prévio de ACO. Realizamos uma análise de subgrupo pré-especificada agrupando estudos que relataram HRa para mortalidade por COVID-19, levando em consideração vários fatores de confusão. Na análise de sensibilidade, a terapia com ACO permaneceu significativamente associada à redução da mortalidade relacionada à COVID-19 (Figura 2C). Quando estratificado pelo tipo de terapia com ACO, não houve diferença significativa entre a terapia com anticoagulantes oral não-antagonistas da vitamina K (NOAC) versus a terapia com antagonistas da vitamina K (AVK) para mortalidade por todas as causas (Figura 2D).
Figura 2. Metanálise de desfechos de mortalidade em pacientes com fibrilação atrial em terapia com ACO. Gráficos de floresta apresentando risco relativo (RR) ou hazard ratio (HR) e intervalo de confiança de 95% (IC) para (A) mortalidade por todas as causas, (B) mortalidade relacionada à COVID-19, (C) mortalidade relacionada à COVID-19 (HR ajustado) e (D) mortalidade por todas as causas com NOAC versus AVK. ACO: anticoagulantes orais; AVK: antagonista da vitamina K; EP: erro padrão; HR: hazard ratio; IC: intervalo de confiança; MH: Mantel-Haenszel; NOAC: anticoagulante oral não-antagonista da vitamina K; RR: risco relativo.
As incidências de hospitalização (Figura 3A) e internação em UTI (Figura 3B) foram semelhantes entre a terapia com ACO versus sem ACO, com heterogeneidade substancial entre os estudos em ambos os resultados. Considerando isso, realizamos uma análise de sensibilidade para o desfecho de hospitalização, incluindo apenas estudos que relataram HRa por modelos multivariados ou pareamento por escore de propensão, que obteve resultados consistentes com a análise geral e eliminou a heterogeneidade entre os estudos (Figura 3C).
Figura 3. Metanálise de desfechos hospitalares em pacientes com fibrilação atrial em terapia com ACO. Gráficos de floresta apresentando risco relativo (RR) ou hazard ratio (HR) e intervalo de confiança de 95% (IC) para (A) admissão hospitalar, (B) internação em unidade de terapia intensiva e (C) admissão hospitalar (HR ajustado). ACO: anticoagulantes orais; HR: hazard ratio; IC: intervalo de confiança; MH: Mantel-Haenszel; RR: risco relativo.
Abordando a heterogeneidade
Considerando a heterogeneidade significativa entre estudos obtida nos principais desfechos, realizamos análises GOSH para mortalidade por todas as causas, nosso desfecho primário. O gráfico GOSH ilustra o tamanho do efeito plotado em relação ao I2 para todas as combinações possíveis de estudos. Os 255 subconjuntos possíveis de metanálise (2κ – 1 combinações possíveis) para mortalidade por todas as causas são apresentados como um gráfico GOSH na Figura 4A. Ao analisar o padrão dos nossos dados, descobrimos que a maioria dos valores está concentrada em um cluster com elevada heterogeneidade. A distribuição de I2 é relativamente unimodal, embora pareça haver algumas combinações de estudos esparsamente distribuídas para as quais a heterogeneidade estimada é levemente inferior, com um tamanho de efeito agrupado razoavelmente preservado, resultando em uma distribuição global de I2 distorcida para baixo e para a esquerda.
Figura 4. Abordando a heterogeneidade. (4A) Gráfico GOSH; (4B) Algoritmo K-means; (4C) Algoritmo DBSCAN; (4D) Modelo de mistura gaussiana; (4E) Gráfico GOSH com o subconjunto correspondente (Zadeh et al., 2022), incluindo os potenciais outliers coloridos em ciano; (4F) Análise de exclusão (leave-one-out); (4G) Gráfico de Baujat; (4H) Diagnósticos de influência. ACO: anticoagulantes orais; DBSCAN: agrupamento espacial baseado em densidade de aplicações com ruído; GMM: modelo de mistura gaussiana; GOSH: exibição gráfica de heterogeneidade; HR: hazard ratio; IC: intervalo de confiança; MH: Mantel-Haenszel; RR: risco relativo.
Para identificar quais estudos podem ter causado esse formato, aplicamos 3 algoritmos de AM não supervisionados, detalhados nos Métodos, para detectar clusters nos dados do gráfico GOSH (Figuras 4B-D). Em última análise, um potencial outlier foi identificado pelas ferramentas de AM.31 O subconjunto correspondente, incluindo o nosso potencial outlier, é demonstrado na Figura 4E. Em resumo, a análise GOSH mostrou que a heterogeneidade não mudou significativamente, independentemente da publicação que foi excluída; o efeito geral também não mudou significativamente. Isso é mais consistente com a interpretação de que nossos resultados são robustos e confiáveis, embora a heterogeneidade geral entre os estudos possa ser significativa.
Como a análise GOSH permaneceu heterogênea para mortalidade por todas as causas, exploramos ainda mais a influência de cada estudo realizando uma análise de sensibilidade de exclusão (Figura 4F), traçando o gráfico de Baujat (Figura 4G) e realizando diagnósticos de influência (Figura 4H). A análise de exclusão e o gráfico de Baujat mostraram que Zadeh et al. teve a maior contribuição para a alta heterogeneidade, consistente com os resultados da análise GOSH.31 Além disso, as estimativas de efeito agrupado (RR) na análise de exclusão variaram de 0,70 a 0,85. Ao excluir Flam et al.,24 Gómez et al.26 e Rivera-Caravaca et al.,29 o tamanho do efeito resultante permaneceu estatisticamente significativo. Paralelamente, aplicamos a função InfluenceAnalysis (pacote R dmetar) para verificar se outra abordagem para reconhecer casos influentes detectou os mesmos outliers encontrados nas análises mencionadas. Diagnósticos de influência caracterizaram quais estudos se enquadram bem em nosso modelo de metanálise e quais não.
Avaliação de qualidade
A ferramenta ROBINS-I identificou 7 estudos com risco geral moderado de viés, enquanto 3 foram identificados como apresentando risco geral grave de viés (Tabela Suplementar S1). Os gráficos de funil para mortalidade por todas as causas, hospitalização e internação na UTI foram levemente assimétricos (Tabela Suplementar S2A-C). No entanto, o teste de Egger para viés de publicação foi estatisticamente significativo apenas para o desfecho de internação em UTI (p = 0,04) (Tabela Suplementar S2C).
Discussão
Nesta revisão sistemática e metanálise de 10 estudos observacionais e 1.177.858 pacientes comparando a anticoagulação oral crônica com ausência de anticoagulação prévia em pacientes com FA que contraíram COVID-19, nossos principais achados foram os seguintes: (1) a mortalidade por todas as causas e a mortalidade relacionada à COVID-19 foram significativamente menores em pacientes em terapia crônica com ACO; e (2) a associação da terapia com ACO a uma redução da mortalidade relacionada à COVID-19 persistiu mesmo após uma análise conjunta de hazard ratios ajustados para múltiplos fatores de confusão.
A associação entre FA e desfechos adversos está bem documentada na literatura, uma vez que a FA aumenta significativamente o risco de acidente vascular cerebral, embolia sistêmica e mortalidade.32-35 Neste contexto, a anticoagulação oral melhora substancialmente os desfechos cardiovasculares e, em última análise, a sobrevivência em pacientes com AF.32-34 Especificamente, foi demonstrado que a anticoagulação oral reduz o risco de acidente vascular cerebral isquêmico em 64% e a mortalidade por todas as causas em 26%.34 Como a FA está associada a piores desfechos em pacientes com COVID-19, o benefício da anticoagulação pode ser ainda maior em pacientes com FA infectados por COVID-19.36 Dentro do contexto do nosso desenho de estudo, não é possível avaliar quanto os benefícios mostrados são específicos para pacientes infectados por COVID-19 versus os benefícios da anticoagulação na FA independentemente de COVID-19.
Ensaios randomizados anteriores avaliaram o impacto da anticoagulação em pacientes com COVID-19.37-39 Com base nesses estudos, tanto o Fórum de Anticoagulação quanto o Painel de Diretrizes de Tratamento para COVID-19 sugerem fornecer aos pacientes hospitalizados com infecção por SARS-CoV-2 uma dose profilática de heparina e uma dose terapêutica, por exemplo, em situações em que o paciente apresenta níveis elevados de dímero D e necessita de suporte de oxigenoterapia.5,40 A Sociedade Americana de Hematologia, porém, aconselha o uso de uma dose terapêutica em vez de uma dose profilática para pacientes hospitalizados com COVID-19.41
Mesmo assim, o regime e a dose ideais de anticoagulação para pacientes com COVID-19 permanecem controversos e seus efeitos sobre os resultados concretos são incertos.40,41 Por exemplo, ainda não foi determinado se a anticoagulação reduz a mortalidade em pacientes com COVID-19 internados em UTI.42-44 Além disso, o perfil de segurança dos ACOs nesta população de pacientes ainda não está claro, com dados observacionais sugerindo preocupações em relação às taxas de sangramento.45 Além disso, a enoxaparina terapêutica pode diminuir a necessidade de ventilação mecânica, embora isso não possa ser generalizado para anticoagulação oral no momento presente.46
Os pacientes que já estão em anticoagulação para condições subjacentes, como FA, podem apresentar menor risco tromboembólico ao desenvolverem infecção por COVID-19.26 Como não há consenso sobre quando exatamente o risco de tromboembolismo aumenta ao longo do curso da doença, aqueles que iniciam o tratamento com terapêutica anticoagulante após o diagnóstico de COVID-19 podem ainda ter uma janela de hipercoagulabilidade, com impacto pouco claro nos resultados.47 Isso pode ser particularmente importante em doentes com FA, que já apresentam um risco tromboembólico mais elevado devido à carga da doença e às comorbilidades.48 Nossa metanálise aborda esse assunto comparando a anticoagulação antes da aquisição da infecção por SARS-CoV-2 com ausência de anticoagulação prévia em pacientes com FA que posteriormente contraem COVID-19, indicando que a anticoagulação contínua pode afetar positivamente os desfechos de mortalidade de todas as causas e mortalidade relacionada à COVID-19.
A significância estatística de um desfecho pode ser afetada por vários fatores, por exemplo, tamanho da amostra, magnitude do efeito, variabilidade aleatória dos dados e o nível de confiança usado para testar a hipótese.49 Nesse caso, a mortalidade por todas as causas tem maior impacto clínico e significância estatística em comparação com a internação em UTI. Existem algumas explicações para esse efeito aparentemente discordante. Primeiro, os desfechos de mortalidade são menos propensos a vieses de medição.50 Em segundo lugar, a decisão de admitir um paciente na UTI é frequentemente influenciada por fatores individuais e locais, tais como disponibilidade de leitos, comorbidades do paciente, prognóstico geral e prioridade em relação a outros pacientes com doenças agudas.51
A maior heterogeneidade em nossos resultados merece discussão. Decidimos usar o modelo de efeitos aleatórios de MH porque previmos uma heterogeneidade considerável entre os estudos. Além disso, para abordar essa heterogeneidade, utilizamos 3 outros métodos: análise de sensibilidade de exclusão, gráfico de Baujat e diagnóstico de influência. Um estudo, Zadeh et al., destacou-se como um outlier.31 Este estudo incluiu apenas pacientes que apresentavam FA e insuficiência cardíaca. Dado o risco aumentado de eventos trombóticos em pacientes com insuficiência cardíaca, isso pode explicar o benefício exagerado do ACO neste estudo em relação a outros estudos de pacientes com FA, mas predominantemente sem insuficiência cardíaca.52
Esta metanálise apresenta algumas limitações. Primeiro, devido à natureza da comparação entre a presença versus ausência de anticoagulação crônica no momento do diagnóstico de COVID-19, apenas estudos observacionais puderam ser realizados e incluídos, o que pode introduzir viés de seleção inerente e fatores de confusão. No entanto, realizamos análises multivariadas ajustadas, quando possível, com resultados globalmente concordantes. É importante ressaltar que os pacientes em uso de ACO tiveram uma carga maior de comorbidades e ainda assim apresentaram redução da mortalidade por todas as causas e da mortalidade relacionada à COVID-19, o que aumenta a confiança nesses achados. Em segundo lugar, incluímos diferentes classes de ACO na análise conjunta, e não se sabe se existem efeitos diferenciais entre eles nesta população. Terceiro, a maioria dos estudos não mostrou nem comparou a dosagem de anticoagulantes tomados cronicamente, e as análises de sensibilidade que abordam esta limitação não puderam ser realizadas devido à falta de dados individuais ao nível do paciente. Além disso, por causa da ausência de dados específicos, não foi possível realizar análises para avaliar o desfecho de mortalidade para cada internação na UTI. Quarto, a heterogeneidade entre os estudos foi significativa nos principais resultados da nossa análise. Diferentes métodos foram utilizados para avaliar essa heterogeneidade e os resultados permaneceram consistentes nessas análises. Quinto, não foi possível avaliar resultados que pudessem determinar a gravidade da doença, como mortalidade para cada internação na UTI, devido a relatos incompletos nos resultados individuais e à ausência de dados no nível do paciente. Finalmente, não podemos atribuir os desfechos clínicos apenas ao uso prévio de terapia com ACO, uma vez que os pacientes frequentemente receberam terapias concomitantes antes e depois do diagnóstico de COVID-19. Esses fatores, sem dúvida, contribuíram para a heterogeneidade entre os estudos, limitando a nossa capacidade de analisar o efeito isolado dos anticoagulantes e de realizar metanálise de dados em subgrupos específicos.
Em relação aos pontos fortes, uma amostra considerável de mais de 1.177.000 pacientes foi incluída neste estudo. Além disso, nossa metanálise está relacionada a uma área essencial de pesquisa, pois aborda uma questão clínica significativa de anticoagulação crônica em pacientes com FA e infecção por COVID-19. Realizamos ainda análises ajustadas para avaliar os resultados controlando os fatores de confusão medidos, embora o risco de fatores de confusão residuais não possa ser excluído. No entanto, conforme apontado na Tabela 2, os pacientes em uso de ACO apresentaram maior carga de comorbidades e ainda apresentaram menor mortalidade por todas as causas e mortalidade relacionada à COVID-19, o que aumenta a confiança nesses achados. Em última análise, até onde sabemos, esta é a primeira metanálise que avalia os efeitos da anticoagulação crônica nesta população específica.
Conclusões
Nesta metanálise de 10 estudos e 1.177.858 pacientes, a ACO crônica para FA em pacientes que posteriormente contraíram COVID-19 foi associada a taxas significativamente mais baixas de mortalidade por todas as causas e mortalidade por COVID-19 em comparação com nenhuma anticoagulação prévia.
Material suplementar
Para informação adicional, por favor, clique aqui.
Footnotes
Fontes de financiamento
O presente estudo não teve fontes de financiamento externas.
Vinculação acadêmica
Não há vinculação deste estudo a programas de pós-graduação.
Aprovação ética e consentimento informado
Este artigo não contém estudos com humanos ou animais realizados por nenhum dos autores.
Referências
- 1.World Health Organization . Coronavirus disease (COVID-19). [Internet] Geneva: World Health Organization; 2023. [cited 2023 Jul 11]. Available from: https://www.who.int/health-topics/coronavirus#tab=tab_1. [Google Scholar]
- 2.World Health Organization (WHO) COVID-19 dashboard. [Internet] Geneva: World Health Organization; 2023. [cited 2023 Jul 2023]. Available from: https://covid19.who.int/ [Google Scholar]
- 3.Ackermann M, Verleden SE, Kuehnel M, Haverich A, Welte T, Laenger F, et al. Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. N Engl J Med. 2020;383(2):120–128. doi: 10.1056/NEJMoa2015432. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Wichmann D, Sperhake JP, Lütgehetmann M, Steurer S, Edler C, Heinemann A, et al. Autopsy Findings and Venous Thromboembolism in Patients with COVID-19: A Prospective Cohort Study. Ann Intern Med. 2020;173(4):268–277. doi: 10.7326/M20-2003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.National Institutes of Health . Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. [Internet] Bethesda: National Institutes of Health; 2023. [cited 2023 Jul 11]. Available from: https://www.covid19treatmentguidelines.nih.gov/ [PubMed] [Google Scholar]
- 6.Higgins JPT, Thomas J, Chandler J, Cumpston M, Li T, Page MJ. Cochrane Handbook for Systematic Reviews of Interventions version 6.3 [Internet] Londres: Cochrane; 2023. [cited 2023 Mac 14]. Available from: www.training.cochrane.org/handbook. [Google Scholar]
- 7.Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. The PRISMA 2020 Statement: An Updated Guideline for Reporting Systematic Reviews. BMJ. 2021;372:n71–n71. doi: 10.1136/bmj.n71. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Sterne JA, Hernán MA, Reeves BC, Savović J, Berkman ND, Viswanathan M, et al. ROBINS-I: A Tool for Assessing Risk of Bias in Non-Randomised Studies of Interventions. BMJ. 2016;355:i4919–i4919. doi: 10.1136/bmj.i4919. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Harbord RM, Egger M, Sterne JA. A Modified Test for Small-Study Effects in Meta-Analyses of Controlled Trials with Binary Endpoints. Stat Med. 2006;25(20):3443–3457. doi: 10.1002/sim.2380. [DOI] [PubMed] [Google Scholar]
- 10.Sidik K, Jonkman JN. A Comparison of Heterogeneity Variance Estimators in Combining Results of Studies. Stat Med. 2007;26(9):1964–1981. doi: 10.1002/sim.2688. [DOI] [PubMed] [Google Scholar]
- 11.Higgins JP, Thompson SG. Quantifying Heterogeneity in a Meta-Analysis. Stat Med. 2002;21(11):1539–1558. doi: 10.1002/sim.1186. [DOI] [PubMed] [Google Scholar]
- 12.Viechtbauer W. Conducting Meta-Analyses in R with the Metafor Package. J. Stat. Soft. 2010;36(3):1–48. doi: 10.18637/jss.v036.i03. [DOI] [Google Scholar]
- 13.Harrer H, Cuijpers P, Furukawa T, Ebert DD. Dmetar: Companion R Package For The Guide "Doing Meta-Analysis in R". [cited 2023 Jul 11];R package version 0.0.9000. [Internet] 2019 Available from: http://dmetar.protectlab.org/ [Google Scholar]
- 14.Balduzzi S, Rücker G, Schwarzer G. How to Perform a Meta-Analysis with R: A Practical Tutorial. Evid Based Ment Health. 2019;22(4):153–160. doi: 10.1136/ebmental-2019-300117. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Wickham H. Ggplot, Elegant Graphics for Data Analysis. 2th ed. New York: Springer; 2009. [Google Scholar]
- 16.Olkin I, Dahabreh IJ, Trikalinos TA. GOSH - A Graphical Display of Study Heterogeneity. Res Synth Methods. 2012;3(3):214–223. doi: 10.1002/jrsm.1053. [DOI] [PubMed] [Google Scholar]
- 17.Hartigan JA, Wong MA. Algorithm AS 136: A K-Means Clustering Algorithm. J R Stat Soc. 1979;28(1):100–108. doi: 10.2307/2346830. [DOI] [Google Scholar]
- 18.Schubert E, Sander J, Ester M, Kriegel HP, Xu X. DBSCAN Revisited, Revisited: Why and How You Should (Still) Use DBSCAN. ACM Trans. Database Syst. 2017;42(3):1–21. doi: 10.1145/3068335. [DOI] [Google Scholar]
- 19.Fraley C, Raftery AE. Model-Based Clustering, Discriminant Analysis, and Density Estimation. J Am Stat Assoc. 2002;97(458):611–631. doi: 10.1198/016214502760047131. [DOI] [Google Scholar]
- 20.Baujat B, Mahé C, Pignon JP, Hill C. A Graphical Method for Exploring Heterogeneity in Meta-Analyses: Application to a Meta-Analysis of 65 Trials. Stat Med. 2002;21(18):2641–2652. doi: 10.1002/sim.1221. [DOI] [PubMed] [Google Scholar]
- 21.Viechtbauer W, Cheung MW. Outlier and Influence Diagnostics for Meta-Analysis. Res Synth Methods. 2010;1(2):112–125. doi: 10.1002/jrsm.11. [DOI] [PubMed] [Google Scholar]
- 22.Ageno W, De Candia E, Iacoviello L, Di Castelnuovo A, CORIST investigators Protective Effect of Oral Anticoagulant Drugs in Atrial Fibrillation Patients Admitted for COVID-19: Results from the CORIST Study. Thromb Res. 2021;203:138–141. doi: 10.1016/j.thromres.2021.05.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Denas G, Gennaro N, Ferroni E, Fedeli U, Lorenzoni G, Gregori D, et al. Reduction in All-Cause Mortality in COVID-19 Patients on Chronic Oral Anticoagulation: A Population-Based Propensity Score Matched Study. Int J Cardiol. 2021;329:266–269. doi: 10.1016/j.ijcard.2020.12.024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Flam B, Wintzell V, Ludvigsson JF, Mårtensson J, Pasternak B. Direct Oral Anticoagulant Use and Risk of Severe COVID-19. J Intern Med. 2021;289(3):411–419. doi: 10.1111/joim.13205. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Fumagalli S, Trevisan C, Del Signore S, Pelagalli G, Volpato S, Gareri P, et al. COVID-19 and Atrial Fibrillation in Older Patients: Does Oral Anticoagulant Therapy Provide a Survival Benefit?-An Insight from the GeroCovid Registry. Thromb Haemost. 2022;122(1):105–112. doi: 10.1055/a-1503-3875. [DOI] [PubMed] [Google Scholar]
- 26.Gómez JA, Pérez-Belmonte LM, Rubio-Rivas M, Bascuñana J, Quirós-López R, Martínez MLT, et al. Mortality Risk Factors in Patients with SARS-CoV-2 Infection and Atrial Fibrillation: Data from the SEMI-COVID-19 Registry. Med Clin. 2022;159(10):457–464. doi: 10.1016/j.medcli.2022.01.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Handy A, Banerjee A, Wood AM, Dale C, Sudlow CLM, Tomlinson C, et al. Evaluation of Antithrombotic Use and COVID-19 Outcomes in a Nationwide Atrial Fibrillation Cohort. Heart. 2022;108(12):923–931. doi: 10.1136/heartjnl-2021-320325. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Louis D, Kennedy K, Saad M, Salber G, Imran HM, Wark T, et al. Pre-Admission Oral Anticoagulation is Associated with Fewer Thrombotic Complications in Patients Admitted With Covid-19. J Am Coll Cardiol. 2022;79(9):1798–1798. doi: 10.1016/S0735-1097(22)02789-9. [DOI] [Google Scholar]
- 29.Rivera-Caravaca JM, Núñez-Gil IJ, Lip GYH, Uribarri A, Viana-Llamas MC, Gonzalez A, et al. Chronic Oral Anticoagulation Therapy and Prognosis of Patients Admitted to Hospital for COVID-19: Insights from the HOPE COVID-19 Registry. Int J Clin Pract. 2022;2022:7325060–7325060. doi: 10.1155/2022/7325060. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Wong AY, Tomlinson L, Brown JP, Elson W, Walker AJ, Schultze A, et al. Association between Oral Anticoagulants and COVID-19-Related Outcomes: A Population-Based Cohort Study. Br J Gen Pract. 2022;72(720):e456–e463. doi: 10.3399/BJGP.2021.0689. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Zadeh AV, Wong A, Zachariah A, Collado J, Larned JM. The Impact of Oral Anticoagulants on the Outcomes of Covid-19 Patients with a History of Hf and Atrial Fibrillation. J Am Coll Cardiol. 2022;79(9):2142–2142. doi: 10.1016/S0735-1097(22)03133-3. [DOI] [Google Scholar]
- 32.Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, et al. 2020 ESC Guidelines for the Diagnosis and Management of Atrial Fibrillation Developed in Collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the Diagnosis and Management of Atrial Fibrillation of the European Society of Cardiology (ESC) Developed with the Special Contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373–498. doi: 10.1093/eurheartj/ehaa612. [DOI] [PubMed] [Google Scholar]
- 33.Steinberg BA, Piccini JP. Anticoagulation in Atrial Fibrillation. BMJ. 2014;348:g2116–g2116. doi: 10.1136/bmj.g2116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Hart RG, Pearce LA, Aguilar MI. Meta-Analysis: Antithrombotic Therapy to Prevent Stroke in Patients who Have Nonvalvular Atrial Fibrillation. Ann Intern Med. 2007;146(12):857–867. doi: 10.7326/0003-4819-146-12-200706190-00007. [DOI] [PubMed] [Google Scholar]
- 35.Schnabel RB, Yin X, Gona P, Larson MG, Beiser AS, McManus DD, et al. 50 Year Trends in Atrial Fibrillation Prevalence, Incidence, Risk Factors, and Mortality in the Framingham Heart Study: A Cohort Study. Lancet. 2015;386(9989):154–162. doi: 10.1016/S0140-6736(14)61774-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Yang H, Liang X, Xu J, Hou H, Wang Y. Meta-Analysis of Atrial Fibrillation in Patients with COVID-19. Am J Cardiol. 2021;144:152–156. doi: 10.1016/j.amjcard.2021.01.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Lawler PR, Goligher EC, Berger JS, Neal MD, McVerry BJ, Nicolau JC, et al. Therapeutic Anticoagulation with Heparin in Noncritically Ill Patients with Covid-19. N Engl J Med. 2021;385(9):790–802. doi: 10.1056/NEJMoa2105911. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Spyropoulos AC, Goldin M, Giannis D, Diab W, Wang J, Khanijo S, et al. Efficacy and Safety of Therapeutic-Dose Heparin vs Standard Prophylactic or Intermediate-Dose Heparins for Thromboprophylaxis in High-Risk Hospitalized Patients with COVID-19: The HEP-COVID Randomized Clinical Trial. JAMA Intern Med. 2021;181(12):1612–1620. doi: 10.1001/jamainternmed.2021.6203. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Lopes RD, Silva PGMB, Furtado RHM, Macedo AVS, Bronhara B, Damiani LP, et al. Therapeutic versus Prophylactic Anticoagulation for Patients Admitted to Hospital with COVID-19 and Elevated D-Dimer Concentration (ACTION): An Open-Label, Multicentre, Randomised, Controlled Trial. Lancet. 2021;397(10291):2253–2263. doi: 10.1016/S0140-6736(21)01203-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Barnes GD, Burnett A, Allen A, Ansell J, Blumenstein M, Clark NP, et al. Thromboembolic Prevention and Anticoagulant Therapy During the COVID-19 Pandemic: Updated Clinical Guidance from the Anticoagulation Forum. J Thromb Thrombolysis. 2022;54(2):197–110. doi: 10.1007/s11239-022-02643-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Cuker A, Tseng EK, Nieuwlaat R, Angchaisuksiri P, Blair C, Dane K, et al. American Society of Hematology Living Guidelines on the Use of Anticoagulation for Thromboprophylaxis in Patients with COVID-19: January 2022 Update on the Use of Therapeutic-Intensity Anticoagulation in Acutely Ill Patients. Blood Adv. 2022;6(17):4915–4923. doi: 10.1182/bloodadvances.2022007561. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Nadeem R, Thomas SJ, Fathima Z, Palathinkal AS, Alkilani YE, Dejan EA, et al. Pattern of Anticoagulation Prescription for Patients with Covid-19 Acute Respiratory Distress Syndrome Admitted to ICU. Does it Impact Outcome? Heart Lung. 2021;50(1):1–5. doi: 10.1016/j.hrtlng.2020.10.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Jonmarker S, Hollenberg J, Dahlberg M, Stackelberg O, Litorell J, Everhov ÅH, et al. Dosing of Thromboprophylaxis and Mortality in Critically Ill COVID-19 Patients. Crit Care. 2020;24(1):653–653. doi: 10.1186/s13054-020-03375-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Canoglu K, Saylan B. Therapeutic Dosing of Low-Molecular-Weight Heparin May Decrease Mortality in Patients with Severe COVID-19 Infection. Ann Saudi Med. 2020;40(6):462–468. doi: 10.5144/0256-4947.2020.462. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Lynn L, Reyes JA, Hawkins K, Panda A, Linville L, Aldhahri W, et al. The Effect of Anticoagulation on Clinical Outcomes in Novel Coronavirus (COVID-19) Pneumonia in a U.S. Cohort. Thromb Res. 2021;197:65–68. doi: 10.1016/j.thromres.2020.10.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Lemos ACB, do Espírito Santo DA, Salvetti MC, Gilio RN, Agra LB, Pazin A, Filho, et al. Therapeutic versus Prophylactic Anticoagulation for Severe COVID-19: A Randomized Phase II Clinical Trial (HESACOVID) Thromb Res. 2020;196:359–366. doi: 10.1016/j.thromres.2020.09.026. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Bunch CM, Moore EE, Moore HB, Neal MD, Thomas AV, Zackariya N, et al. Immuno-Thrombotic Complications of COVID-19: Implications for Timing of Surgery and Anticoagulation. Front Surg. 2022;9:889999–889999. doi: 10.3389/fsurg.2022.889999. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, et al. 2020 ESC Guidelines for the Diagnosis and Management of Atrial Fibrillation Developed in Collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the Diagnosis and Management of Atrial Fibrillation of the European Society of Cardiology (ESC) Developed with the Special Contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373–498. doi: 10.1093/eurheartj/ehaa612. [DOI] [PubMed] [Google Scholar]
- 49.Schober P, Bossers SM, Schwarte LA. Statistical Significance versus Clinical Importance of Observed Effect Sizes: What do P Values and Confidence Intervals Really Represent? Anesth Analg. 2018;126(3):1068–1072. doi: 10.1213/ANE.0000000000002798. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Kloka JA, Blum LV, Old O, Zacharowski K, Friedrichson B. Characteristics and Mortality of 561,379 Hospitalized COVID-19 Patients in Germany Until December 2021 Based on Real-Life Data. Sci Rep. 2022;12(1):11116–11116. doi: 10.1038/s41598-022-15287-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Ioannidis JP. Why Most Published Research Findings are False. PLoS Med. 2005;2(8):e124. doi: 10.1371/journal.pmed.0020124. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Lin AY, Dinatolo E, Metra M, Sbolli M, Dasseni N, Butler J, et al. Thromboembolism in Heart Failure Patients in Sinus Rhythm: Epidemiology, Pathophysiology, Clinical Trials, and Future Direction. JACC Heart Fail. 2021;9(4):243–253. doi: 10.1016/j.jchf.2021.01.009. [DOI] [PubMed] [Google Scholar]