Abstract
目的
探讨脱细胞真皮基质(acellular dermal matrix,ADM)/磷酸氢钙(dicalcium phosphate,DCP)复合支架的理化特性、成骨性能及在兔股骨髁缺损模型中的成骨能力。
方法
采用微纤维化技术制备ADM/DCP复合支架,行DNA残留、脂肪含量及α-半乳糖基抗原(α-1,3-galactosyle,α-Gal)抗原表位数检测ADM/DCP复合支架的脱细胞效果;场发射扫描电镜观察及压汞仪测定支架孔隙率行支架微观结构表征;行支架X射线衍射分析晶型是否发生变化;支架溶解性检测溶液pH值和钙离子含量;支架体外矿化实验观察表面矿化物。选取健康雄性新西兰大白兔12只,制备兔股骨髁缺损模型,左、右侧缺损处分别植入ADM/DCP复合支架(实验组)和骼金®人工骨修复材料(对照组)。术后6、12周取材行大体观察;行Micro-CT检测并定量分析相关指标 [骨体积(bone volume,BV)、骨体积分数(bone volume/tissue volume,BV/TV)、骨表面积和骨体积之比(bone surface/bone volume,BS/BV)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁数目(trabecular number,Tb.N)、骨小梁间隙(trabecular separation,Tb.Sp)、骨密度(bone mineral density,BMD)];行HE染色和Masson染色,观察骨缺损修复及骨基质成熟情况。
结果
大体观察示ADM/DCP复合支架为白色海绵状固体。与ADM相比,ADM/DCP复合支架的DNA残留、脂肪含量和α-Gal抗原含量均大幅降低(P<0.05)。场发射扫描电镜观察示ADM/DCP复合支架具有多孔联通结构,猪真皮纤维上附着DCP颗粒;压汞仪测得ADM/DCP复合支架孔隙率为76.32%±1.63%。X射线衍射分析示,ADM/DCP复合支架中的DCP晶相保持完整。体外矿化结果示ADM/DCP复合支架的羟基磷灰石层基本成熟。兔股骨髁缺损修复实验示,术后12周切口完全愈合,无骨痂、骨赘。术后12周,Micro-CT观察示两组材料缺损部位已完成骨性愈合且生成大量新生骨组织,密度与周围骨组织无差异,两组材料成骨性能相当;除实验组Tb.Sp 显著大于对照组(P<0.05)外,两组BV、BV/TV、BS/BV、Tb.Th、Tb.N、BMD比较差异均无统计学意义(P>0.05)。术后6、12周HE染色和Masson染色示两组新生骨和自体骨融合良好,骨组织均趋于成熟。
结论
ADM/DCP复合支架具有良好生物相容性,修复兔股骨髁缺损具有与人工骨修复材料相似的成骨能力,是骨修复领域具有应用潜力的新型支架材料。
Keywords: 骨组织工程, 脱细胞真皮基质, 磷酸氢钙, 复合支架, 骨修复
Abstract
Objective
To investigate the physicochemical properties, osteogenic properties, and osteogenic ability in rabbit model of femoral condylar defect of acellular dermal matrix (ADM)/dicalcium phosphate (DCP) composite scaffold.
Methods
ADM/DCP composite scaffolds were prepared by microfibril technique, and the acellular effect of ADM/DCP composite scaffolds was detected by DNA residue, fat content, and α-1, 3-galactosyle (α-Gal) epitopes; the microstructure of scaffolds was characterized by field emission scanning electron microscopy and mercury porosimetry; X-ray diffraction was used to analyze the change of crystal form of scaffold; the solubility of scaffolds was used to detect the pH value and calcium ion content of the solution; the mineralization experiment in vitro was used to observe the surface mineralization. Twelve healthy male New Zealand white rabbits were selected to prepare the femoral condylar defect models, and the left and right defects were implanted with ADM/DCP composite scaffold (experimental group) and skeletal gold® artificial bone repair material (control group), respectively. Gross observation was performed at 6 and 12 weeks after operation; Micro-CT was used to detect and quantitatively analyze the related indicators [bone volume (BV), bone volume/tissue volume (BV/TV), bone surface/bone volume (BS/BV), trabecular thickness (Tb.Th), trabecular number (Tb.N), trabecular separation (Tb.Sp), bone mineral density (BMD)], and HE staining and Masson staining were performed to observe the repair of bone defects and the maturation of bone matrix.
Results
Gross observation showed that the ADM/DCP composite scaffold was a white spongy solid. Compared with ADM, ADM/DCP composite scaffolds showed a significant decrease in DNA residue, fat content, and α-Gal antigen content (P<0.05). Field emission scanning electron microscopy showed that the ADM/DCP composite scaffold had a porous structure, and DCP particles were attached to the porcine dermal fibers. The porosity of the ADM/DCP composite scaffold was 76.32%±1.63% measured by mercury porosimetry. X-ray diffraction analysis showed that the crystalline phase of DCP in the ADM/DCP composite scaffolds remained intact. Mineralization results in vitro showed that the hydroxyapatite layer of ADM/DCP composite scaffolds was basically mature. The repair experiment of rabbit femoral condyle defect showed that the incision healed completely after operation without callus or osteophyte. Micro-CT showed that bone healing was complete and a large amount of new bone tissue was generated in the defect site of the two groups, and there was no difference in density between the defect site and the surrounding bone tissue, and the osteogenic properties of the two groups were equivalent. There was no significant difference in BV, BV/TV, BS/BV, Tb.Th, Tb.N, and BMD between the two groups (P>0.05), except that the Tb.Sp in the experimental group was significantly higher than that in the control group (P<0.05). At 6 and 12 weeks after operation, HE staining and Masson staining showed that the new bone and autogenous bone fused well in both groups, and the bone tissue tended to be mature.
Conclusion
The ADM/DCP composite scaffold has good biocompatibility and osteogenic ability similar to the artificial bone material in repairing rabbit femoral condylar defects. It is a new scaffold material with potential in the field of bone repair.
Keywords: Bone tissue engineering, acellular dermal matrix, dicalcium phosphate, composite scaffold, bone repair
骨缺损修复一直是骨科面临挑战之一,每年有数百万骨缺损患者需要进行骨移植治疗。自体骨移植是骨缺损修复的“金标准”,但自体骨量有限,无法满足较大缺损部位移植需求[1-3],同种异体骨或异种骨移植存在免疫排斥反应和交叉感染等隐患;而组织工程骨作为骨修复材料,在骨外科手术中具有广阔应用前景。
胶原基生物材料因具有极优的生物活性、较高强度和可塑性,被广泛应用于各医疗领域[4]。作为基质材料时,胶原的三维网状结构易于与其他骨传导性材料结合,如羟基磷灰石、β-磷酸三钙和磷酸氢钙(dicalcium phosphate,DCP)等。胶原占据大多数组织和器官干重的近90%[5],矿化胶原也是骨组织的最主要成分,其由成骨细胞所分泌并矿化,胶原蛋白可结合血凝块和宿主自身骨细胞,已被证实可以加速骨骼再生[6]。因此,基于天然仿生构建思路,胶原蛋白-生物陶瓷复合物是构建骨修复支架的理想材料。
然而,目前市场上的胶原类产品多使用化学提纯制备,如Healos®(Johnson & Johnson公司,美国)、Vitoss®(Stryker公司,美国)等[7],制备工艺中的胶原纯化处理会破坏胶原的天然结构和基质中的活性因子,影响产品的组织再生性能。同时,为了提高材料机械性能和减缓材料降解,会对提纯胶原材料用醛类交联剂进行化学交联处理,造成潜在材料毒性[8-10]。由于提纯胶原材料存在的局限性,脱细胞基质相关研究和应用逐渐得到发展。天然材料如脱细胞软组织或骨组织等具有丰富的胶原蛋白等细胞外基质成分和多种活性因子[8,11],脱细胞处理在结构上保留了细胞外基质的天然三维微观结构和胶原分子的天然三螺旋结构,在成分上有效利用了脱细胞材料中胶原等生物活性成分,且维持基质的自然交联,具有良好生物相容性[12]。大量研究和临床应用使用脱细胞软组织(如真皮和小肠黏膜下层等)用于腹疝、心肌、肠胃[13-15]、跟腱[16]修复,或脱细胞骨软骨用于软骨重建再生[17]等,取得了良好疗效。
为了提高胶原基材料的骨再生性能和生物相容性,我们开发了基于天然猪真皮基质的新型骨组织工程支架,对猪真皮进行脱细胞和微纤维化处理后,将其与具有良好生物可吸收性的DCP陶瓷颗粒通过物理方法复合[18],制备具有高孔隙率和孔连通率的多孔支架材料,以探索脱细胞软组织在骨修复再生中的应用潜力。
1. 材料与方法
1.1. 实验动物、材料及主要试剂、仪器
健康成年雄性新西兰大白兔12只,体质量>2.5 kg,由浙江中医药大学动物实验研究中心提供。猪皮(浙江天天田园控股集团有限公司);无水DCP(湖州展望药业有限公司);骼金®人工骨修复材料(主要成分为Ⅰ型胶原及羟基磷灰石;北京奥精医疗科技有限公司)。
GM 200刀式研磨仪(Restch公司,德国);FESEM SU-8010场发射扫描电镜(Hitachi公司,日本);AutoPore Ⅳ 9510压汞仪 [麦克默瑞提克(上海)仪器有限公司];SmartLab X射线衍射仪(上海力晶科学仪器有限公司)。
1.2. 脱细胞真皮基质(acellular dermal matrix,ADM)/DCP复合支架制备及表征
1.2.1. 猪ADM和ADM/DCP复合支架制备
取新鲜猪皮去除表皮层和皮下脂肪得到真皮层,将真皮层裁切为宽3~5 mm、长3~5 cm的条状,用0.2%过氧乙酸-2%碳酸氢钠溶液浸泡消毒2 h。将消毒并清洗后的猪真皮层置于刀式研磨仪中,高速搅拌研磨处理为微纤维;然后于24 mmol/L脱氧胆酸钠-0.2%EDTA溶液中振摇24 h后,生理盐水清洗15次,离心除去多余液体,得到猪ADM。
对猪ADM进行水分测定并计算其干重,称取其2倍干重的无水DCP混合放入烧杯中,加入与ADM和DCP总质量等重的生理盐水,搅拌均匀后倒入刀式研磨仪高速搅拌混合;然后将材料倒入模具中,冻干,密封包装,经20 kGy 60Co辐照灭菌后,得到ADM/DCP复合支架,备用。
1.2.2. 支架脱细胞效果检测
对ADM/DCP复合支架行大体观察;并进行DNA残留、脂肪含量及α-半乳糖基抗原(α-1,3-galactosyle,α-Gal)抗原表位数检测[19-22],定量分析ADM/DCP复合支架的脱细胞效果,以猪ADM作为对照。
1.2.3. 支架微观结构表征
将ADM/DCP复合支架样品喷金后,使用场发射扫描电镜对产品表面形貌进行表征;使用压汞仪测定支架孔隙率(n=6),真空6.65 kPa,平衡5 min,计算范围为0.1~30.0 psia。
1.2.4. 支架的X射线衍射分析
将ADM/DCP复合支架裁切为10 mm×10 mm×2 mm的薄片,同时称取无水DCP 0.5 g,分别使用X射线衍射仪进行表征分析,对比图谱分析晶型是否发生变化。
1.2.5. 支架溶解性检测
按照标准方法检测ADM/DCP复合支架溶解性[23]。裁切并称取80 mg材料,置于离心管中,按照2.0 mg/mL比例加入Tris缓冲溶液(pH=7.3±0.1),(37±1)℃、200 r/min条件下振荡浸泡,于0、24、48、72 h后分别取样测量溶液pH值(n=9,以与0 h pH值的差值计算)和钙离子含量(n=3)。
1.2.6. 支架的体外矿化实验
按照Kokubo等[24]报道的方法配制模拟体液(simulated body fluid,SBF)。无菌操作下将ADM/DCP复合支架裁切为10 mm×10 mm×2 mm的薄片,游标卡尺测量其尺寸(精确至±0.1 mm),并计算表面积。按以下公式计算所用SBF体积:SBF体积=100 mm×样品表面积。
于离心管中加入相应体积SBF并放置于36.5℃ CO2培养箱中预热,然后将样品浸没于SBF中,每天更换SBF。分别于浸泡1、2、4、8周时取样,用纯化水轻柔清洗5 min后常温干燥。使用扫描电镜进行表面矿化物检测,确定磷灰石层存在与否。
1.3. 兔股骨髁缺损修复实验
1.3.1. 实验分组及方法
材料准备:将ADM/DCP复合支架用环钻钻取为直径6 mm、高8 mm的圆柱体,将骼金®人工骨修复材料钻取为直径6 mm、高4 mm的圆柱体,备用。取12只健康新西兰大白兔,采用耳缘静脉注射陆眠宁、舒泰溶液进行麻醉;于兔双侧髂骨处备皮、穿刺抽取红骨髓1 mL于采血管中备用。于兔双侧股骨外侧髁各钻取一直径6 mm、深8 mm的腔洞,将两组材料分别混合吸收自体红骨髓后,左侧股骨髁植入1个ADM/DCP复合支架圆柱体(实验组),右侧植入2个骼金®人工骨修复材料圆柱体(对照组);逐层缝合筋膜和皮肤,术后3 d连续皮下注射青霉素40万U/d。
1.3.2. 兔股骨髁缺损修复评价指标
术后6、12周分别处死6只动物,取股骨髁修复组织标本进行评价。① 大体观察:观察缺损部位及周边骨是否存在骨痂、骨赘,以及与正常组织的整合情况。② Micro-CT检测:将术后12周组织标本置于中性甲醛固定48 h,行Micro-CT扫描并定量分析植入区域的骨体积(bone volume,BV)、骨体积分数(bone volume/tissue volume,BV/TV)、骨表面积和骨体积之比(bone surface/bone volume,BS/BV)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁数目(trabecular number,Tb.N)、骨小梁间隙(trabecular separation,Tb.Sp)、骨密度(bone mineral density,BMD)。③ 组织学观察:将术后6、12周组织标本置于中性甲醛固定48 h,经常规脱钙、梯度脱水、石蜡包埋,5 μm厚切片,行HE染色和Masson染色,观察骨缺损修复及骨基质成熟情况。
1.4. 统计学方法
采用SPSS23.0统计软件进行分析。计量资料经Shapiro-Wilk正态性检验,均符合正态分布,数据以均数±标准差表示,组间比较采用独立样本t检验;检验水准α=0.05。
2. 结果
2.1. ADM/DCP复合支架表征
大体观察示所制备的ADM/DCP复合支架为白色海绵状固体(图1a);与猪ADM比较,ADM/DCP复合支架的DNA残留、脂肪含量和α-Gal抗原含量均大幅降低,差异有统计学意义(P<0.05),说明脱细胞处理具有较高的去核酸、去抗原效率;且ADM/DCP复合支架的DNA残留量满足DNA残留安全限度(50 ng/mg)[25]。见表1。
图 1.
Characterization of the ADM/DCP composite scaffold
ADM/DCP复合支架表征
a. 大体观察;b. 场发射扫描电镜观察 右图(×200)为左图(×100)白色虚线框放大图,白色颗粒为DCP,纤维为猪真皮纤维;c. ADM/DCP复合支架和无水DCP的X射线衍射分析图谱;d、e. ADM/DCP复合支架溶解性实验pH值和钙离子浓度;f. ADM/DCP复合支架在SBF中矿化不同时间点扫描电镜观察(×1 000) 内嵌图为局部放大(×10 k),从左至右依次为矿化1、2、4、8周
a. Gross observation; b. Field emission scanning electron microscopy obsevation The right image (×200) was the white dotted box enlargement of the left image (×100), the white granules were DCP, and the fibers were porcine dermal fibers; c. X-ray diffraction analysis of ADM/DCP composite scaffolds and DCP; d, e. pH value and calcium ion concentration in the solubility experiment of ADM/DCP composite scaffold; f. Scanning electron microscopy observation of ADM/DCP composite scaffolds mineralized in SBF at different time points (×1 000) The embedded image was a local magnification (×10 k), from left to right for the mineralization at 1, 2, 4, and 8 weeks, respectively
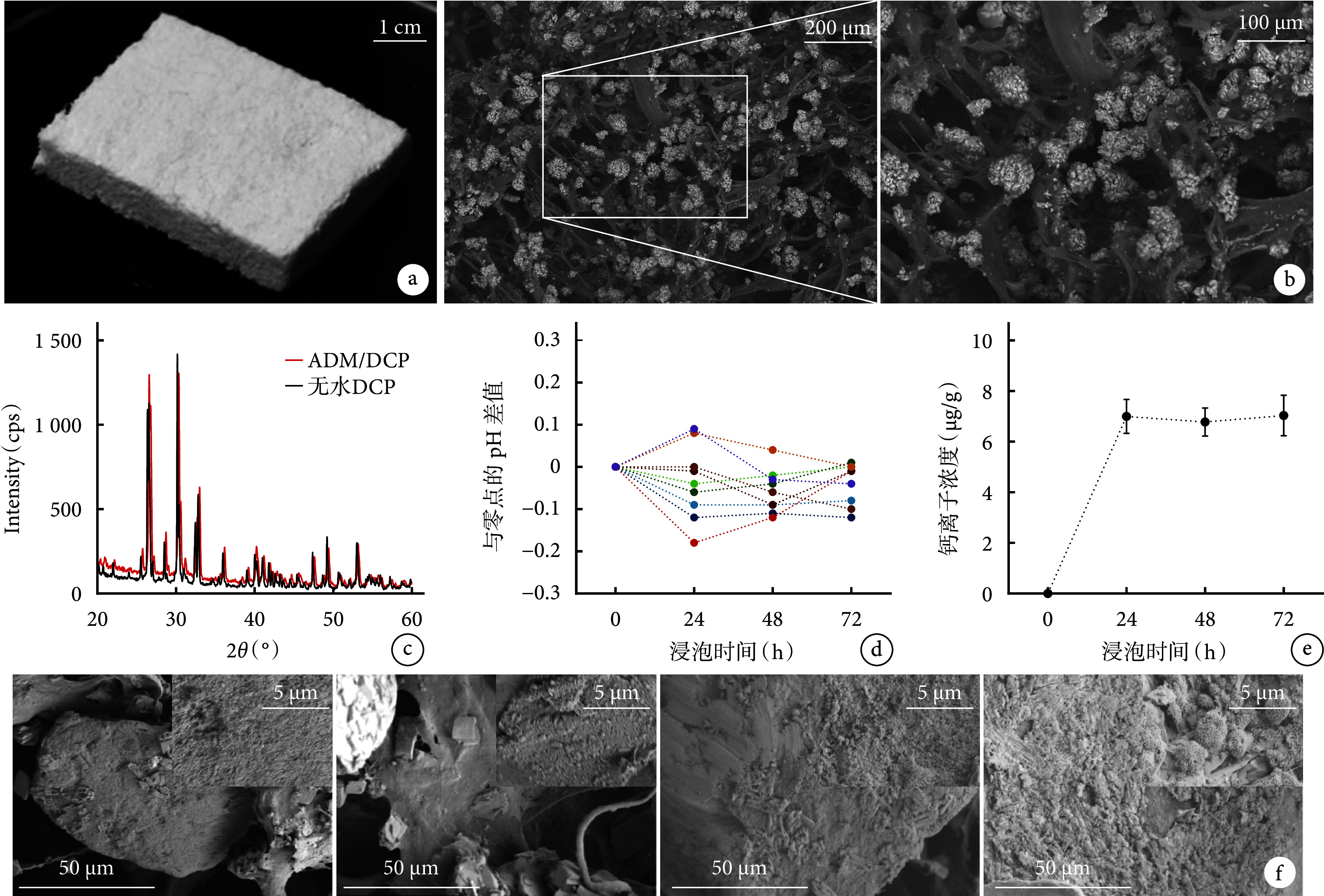
表 1.
Decellularization effect detection of porcine ADM and ADM/DCP composite scaffold (x±s)
猪ADM和ADM/DCP复合支架脱细胞效果检测(x±s)
| 样品 Sample |
DNA残留量(ng/mg) DNA residue (ng/mg) |
脂肪含量(%) Fat content (%) |
α-Gal抗原含量(epitope/mg) α-Gal antigen content (epitope/mg) |
| 猪ADM | 6 110.10±660.55 | 5.58±0.45 | (13.4±7.6)×1013 |
| ADM/DCP复合支架 | 14.89±2.67 | 1.28±0.18 | (9.3±2.8)×1011 |
| 统计值 |
t=15.980 P=0.004 |
t=16.130 P=0.004 |
t=3.030 P=0.020 |
场发射扫描电镜观察示ADM/DCP复合支架具有多孔联通结构,猪真皮纤维上附着DCP颗粒(图1b)。压汞仪测得ADM/DCP复合支架的孔隙率为76.32%±1.63%。
X射线衍射分析示,两个图谱的衍射峰基本重合,与无水DCP相比,ADM/DCP复合支架的衍射峰未明显变宽(图1c)。表明ADM/DCP复合支架中的DCP晶相保持完整,ADM与DCP仅通过物理作用结合。
ADM/DCP复合支架溶解性检测示,与0 h相比,浸泡72 h内溶液pH值变化均<0.3,满足标准要求[23];钙离子浓度在24~72 h内较为稳定,且均低于8.0 μg/g。见图1d、e。
ADM/DCP复合支架在SBF中浸泡1周,材料表面生成大量细小羟基磷灰石晶核,铺满整个表面;2周,矿化形成的羟基磷灰石层与1周时相比存在起伏,部分晶体形成较大颗粒;4周,大量羟基磷灰石晶体形成较大颗粒,逐渐向成熟期转化;8周,羟基磷灰石层基本成熟,形成球形晶簇并互相融合形成板状磷灰石覆盖层。球形晶簇均生长在胶原纤维表面,由于纤维直径限制和纤维承重限制,球型晶簇直径最大为200~300 nm。
2.2. 兔股骨髁缺损修复实验
2.2.1. 大体观察
术后6周,实验动物手术部位均未出现血肿、水肿或囊腔,切口完全愈合,无骨痂、骨赘;左、右两侧均未见植入材料发生位移,有一定程度的骨性愈合。12周,切口完全愈合,无骨痂、骨赘,左、右两侧植入部位已完全愈合。
2.2.2. Micro-CT检测
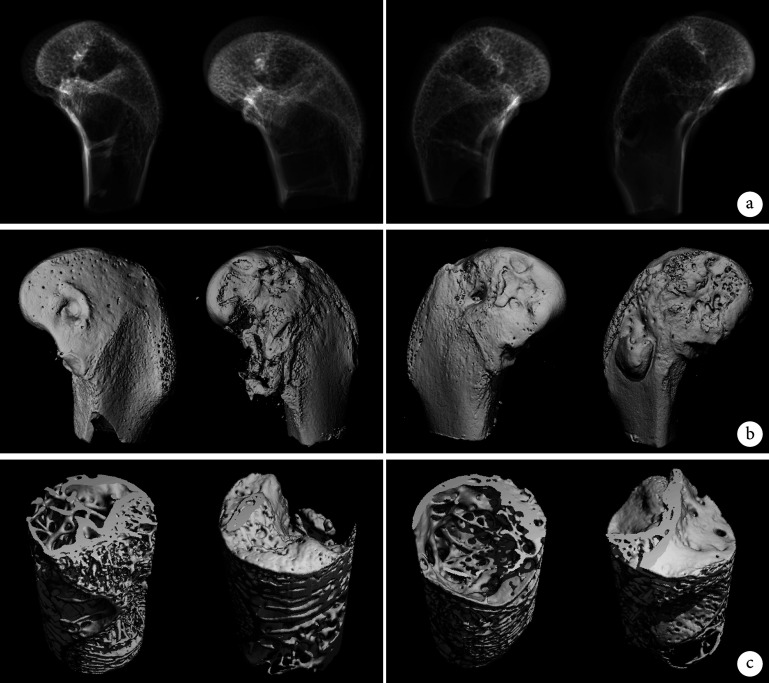
术后12周Micro-CT扫描观察示,两组骨缺损部位和宿主骨无明显边界,股骨髁表面无明显缺损边界,缺损部位生成大量新生骨组织,密度与周围骨组织无差异,两组材料成骨性能相当。见图2。
图 2.
Micro-CT scan and three-dimensional reconstruction of the experimental group (left) and control group (right) at 12 weeks after operation (the implanted sites of the femoral condyles of 2 animals in each group)
术后12周实验组(左)和对照组(右)Micro-CT扫描及三维重建观察(每组各展示2只动物股骨髁植入部位情况)
a. Micro-CT扫描;b. 股骨髁Micro-CT三维重建;c. 缺损部位Micro-CT三维重建
a. Micro-CT scan; b. Micro-CT three-dimensional reconstruction of femoral condyle; c. Micro-CT three-dimensional reconstruction of defect site
定量分析示,除实验组Tb.Sp 显著大于对照组,差异有统计学意义(P<0.05)外,两组BV、BV/TV、BS/BV、Tb.Th、Tb.N、BMD比较差异均无统计学意义(P>0.05)。见表2。两组新骨的BMD均已接近正常骨(871.595 mg HA/cc),说明新骨矿化程度高,具有正常骨的理化特点。
表 2.
Quantitative analysis results of Micro-CT in two groups at 12 weeks after operation (n=6, x±s)
术后12周两组Micro-CT定量分析结果(n=6,x±s)
| 指标 Indicator |
实验组 Experimental group |
对照组 Control group |
效应值(95%CI) Effect value (95%CI) |
P值 P value |
| BV(mm3) | 61.490±19.247 | 72.272±9.228 | MD=−10.78(−31.39,9.82) | 0.350 |
| BV/TV(%) | 0.212±0.066 | 0.249±0.318 | MD=−0.04(−0.11,0.03) | 0.350 |
| BS/BV(/mm) | 10.636±1.293 | 10.487±1.258 | MD=0.15(−1.52,1.82) | 0.696 |
| Tb.Th(mm) | 0.255±0.037 | 0.283±0.066 | MD=−0.03(−0.10,0.05) | 0.082 |
| Tb.N(/mm) | 0.908±0.257 | 1.141±0.122 | MD=−0.23(−0.51,0.04) | 0.103 |
| Tb.Sp(mm) | 1.237±0.294 | 0.860±0.118 | MD=0.38(0.06,0.69) | 0.023 |
| BMD(mg HA/cc) | 829.980±24.631 | 856.166±36.859 | MD=−26.20(−67.90,15.50) | 0.137 |
2.2.3. 组织学观察
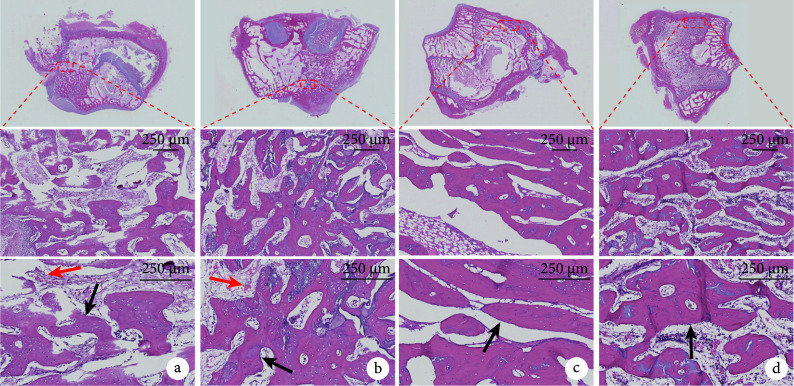
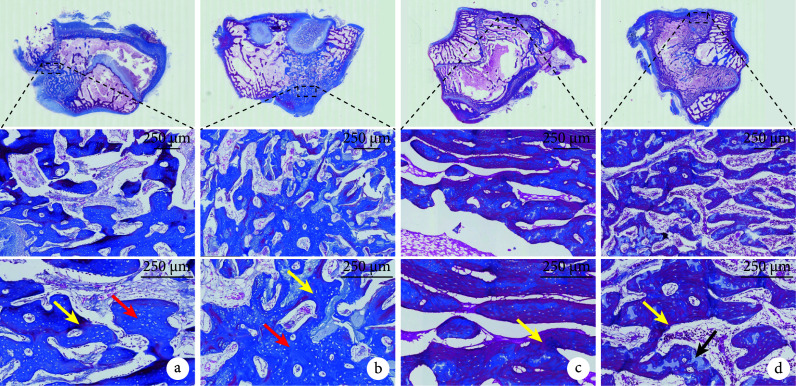
术后6周,HE染色示各组材料均大部分降解,植入部位无组织炎症反应,缺损处尚未完全愈合,缺损口和骨髓腔内有大量新生骨小梁和血管浸润;Masson染色示类骨质已开始成熟。术后12周,HE染色示缺损孔均已完全闭合,新生骨和自体骨融合良好;Masson染色呈红色,显示两组骨组织均趋于形成成熟松质骨。见图3、4。
图 3.
HE staining observation in both groups after operation
术后两组HE染色观察
从上至下依次为股骨髁切面以及虚线框局部放大(×20、×40);红箭头示血管结构及其内大量血细胞,黑箭头示骨小梁表面成骨细胞 a. 术后6周实验组;b. 术后6周对照组;c. 术后12周实验组;d. 术后12周对照组
From top to bottom for the femoral condyle section and the dotted box were enlarged (×20, ×40); the red arrow showed the vascular structure and a large number of blood cells in it, and the black arrow showed the osteoblasts on the surface of bone trabecula a. Experimental group at 6 weeks after operation; b. Control group at 6 weeks after operation; c. Experimental group at 12 weeks after operation; d. Control group at 12 weeks after operation
图 4.
Masson staining observation in both groups after operation
术后两组Masson染色观察
从上至下依次为股骨髁切面以及虚线框局部放大(×20、×40);红箭头示尚未成熟的类骨质,黄箭头示成熟骨基质,黑箭头示软骨类骨质 a. 术后6周实验组;b. 术后6周对照组;c. 术后12周实验组;d. 术后12周对照组
From top to bottom for the femoral condyle section and the dotted box were enlarged (×20, ×40); the red arrow showed the immature osteoid, the yellow arrow showed the mature bone matrix, and the black arrow showed the cartilage bone a. Experimental group at 6 weeks after operation; b. Control group at 6 weeks after operation; c. Experimental group at 12 weeks after operation; d. Control group at 12 weeks after operation
3. 讨论
基于天然材料的复合材料开发是骨组织工程支架的重要研究方向。本研究中,采用猪ADM和DCP复合,制备了具有良好生物活性、成骨性能的骨修复材料,并通过动物体内实验验证了其在该动物模型上具有与已上市产品相似的修复能力。
目前,ADM已广泛用于各类组织工程产品的开发,如皮肤修复、软骨修复和软组织补片等[26-28]。不同于提纯的胶原材料,ADM避免引入毒性试剂和破坏胶原结构成分,且保留了大量细胞外基质中的活性蛋白和因子,是促进细胞生成黏附的关键。
多种材料的复合技术也是制备复合支架的难点,常见复合技术大部分是液-液相或固-液相材料复合,天然脱细胞材料为固相,不再进行溶解、提纯等后续处理,且不宜引入其他化学合成方法和试剂,而是直接复合两种固相材料。基于此,我们开发了真皮基质的微纤维化技术,结合前期研究中探索的适宜微纤维化参数,本研究将两种固相成分物理混合;同时,此技术也成功将致密的真皮基质处理为具有微观多孔、高孔隙率结构的材料,拓展了真皮基质的应用空间。本研究所制备的ADM/DCP复合支架材料的DNA残留、脂肪残留和α-Gal抗原含量低,提示有较高的去核酸、去抗原效率,与对照组骼金®人工骨修复材料相比,可能具有更好的生物相容性。场发射扫描电镜和X射线衍射表征结果示,所制备的复合支架材料具有良好的均一性和较高孔隙率;溶解性检测和体外矿化实验也验证了DCP与ADM的稳定结合。
我们进一步将所制备的ADM/DCP复合支架植入兔股骨髁缺损处,并与骼金®人工骨修复材料进行比较,通过Micro-CT及组织学检查等进行评价。结果显示,植入材料12周后,Micro-CT分析示两组在成骨方面除Tb.Sp差异有统计学意义外,其他成骨性能无明显差异。组织学检测发现植入材料6周后,HE染色示两组材料均大部分降解,植入部位无组织炎症反应,缺损处尚未完全愈合,孔口和骨髓腔内有大量新生骨小梁和血管浸润,Masson染色示类骨质已开始成熟;植入后12周,缺损孔均已完全闭合,新生骨和自体骨融合良好。上述结果表明,ADM/DCP复合支架与骼金®人工骨修复材料修复兔股骨髁缺损具有相似效果,术后12周可实现缺损处完全修复。
综上述,本研究开发的ADM/DCP组织工程复合支架材料具有良好生物相容性,应用于兔股骨髁缺损模型具有与骼金®人工骨修复材料相似的修复效果,是骨修复领域具有较大应用潜力的新型支架材料。
利益冲突 在课题研究和文章撰写过程中不存在利益冲突;基金项目经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道
伦理声明 动物实验经浙江中医药大学动物实验伦理委员会批准(1ACUC-20180212-02);实验动物使用许可证号:SYXK(浙)2018-0012
作者贡献声明 蓝益南:研究设计、文章撰写;冉永峰:研究实施;张静逸:数据统计分析;薛德挺:起草文章、对文章的知识性内容作批评性审阅;蔡晓斌:行政支持,数据整理;江涛:经费支持、数据整理;李博:数据收集整理
Funding Statement
国家重点研发计划项目(2019YFA0110600);浙江省医药卫生科技计划项目(2024KY1850、2024KY1851);浙江省科技厅项目(2017C37181)
National Key Research and Development Plan Projects (2019YFA0110600); Zhejiang Medical and Health Science and Technology Plan Project (2024KY1850, 2024KY1851); Zhejiang Science and Technology Department Project (2017C37181)
References
- 1.Busch A, Wegner A, Haversath M, et al Bone substitutes in orthopaedic surgery: Current status and future perspectives. Z Orthop Unfall. 2021;159(3):304–313. doi: 10.1055/a-1073-8473. [DOI] [PubMed] [Google Scholar]
- 2.Busch A, Jäger M Synthetic bone replacement substances. Die Orthopädie. 2022;51(12):1023–1032. doi: 10.1007/s00132-022-04319-5. [DOI] [PubMed] [Google Scholar]
- 3.Ferraz MP Bone grafts in dental medicine: An overview of autografts, allografts and synthetic materials. Materials (Basel) 2023;16(11):4117. doi: 10.3390/ma16114117. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Wang J, Liu Q, Guo Z, et al Progress on biomimetic mineralization and materials for hard tissue regeneration. ACS Biomater Sci Eng. 2023;9(4):1757–1773. doi: 10.1021/acsbiomaterials.1c01070. [DOI] [PubMed] [Google Scholar]
- 5.van der Rest M, Garrone R Collagen family of proteins. FASEB J. 1991;5(13):2814–2823. doi: 10.1096/fasebj.5.13.1916105. [DOI] [PubMed] [Google Scholar]
- 6.Roth KE, Maier GS, Schmidtmann I, et al Release of antibiotics out of a moldable collagen-β-tricalciumphosphate-composite compared to two calcium phosphate granules. Materials (Basel) 2019;12(24):4056. doi: 10.3390/ma12244056. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Qiu ZY, Cui Y, Tao CS, et al Mineralized collagen: Rationale, current status, and clinical applications. Materials (Basel) 2015;8(8):4733–4750. doi: 10.3390/ma8084733. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Sheehy EJ. Collagen-based biomaterials for tissue regeneration and repair. Peptides and Proteins as Biomaterials for Tissue Regeneration and Repair, 2018.
- 9.Bose S, Li S, Mele E, et al Dry vs. wet: Properties and performance of collagen films. Part Ⅱ. Cyclic and time-dependent behaviours. J Mech Behav Biomed Mater. 2020;112:104040. doi: 10.1016/j.jmbbm.2020.104040. [DOI] [PubMed] [Google Scholar]
- 10.Brown B, Lindberg K, Reing J, et al The basement membrane component of biologic scaffolds derived from extracellular matrix. Tissue Eng. 2006;12(3):519–526. doi: 10.1089/ten.2006.12.519. [DOI] [PubMed] [Google Scholar]
- 11.Xie H, Wang Z, Zhang L, et al Extracellular vesicle-functionalized decalcified bone matrix scaffolds with enhanced pro-angiogenic and pro-bone regeneration activities. Sci Rep. 2017;7:45622. doi: 10.1038/srep45622. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Hussey GS, Dziki JL, Badylak SF Extracellular matrix-based materials for regenerative medicine. Nature Reviews Materials. 2018;3:159–173. doi: 10.1038/s41578-018-0023-x. [DOI] [Google Scholar]
- 13.Van Orden K, Santos J, Stanfield B, et al Bovine versus porcine acellular dermal matrix for abdominal wall herniorrhaphy or bridging. Eur J Trauma Emerg Surg. 2022;48(3):1993–2001. doi: 10.1007/s00068-021-01641-z. [DOI] [PubMed] [Google Scholar]
- 14.Tan YH, Helms HR, Nakayama KH Decellularization strategies for regenerating cardiac and skeletal muscle tissues. Front Bioeng Biotechnol. 2022;10:831300. doi: 10.3389/fbioe.2022.831300. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Fu XY, Jiang ZY, Zhang CY, et al New hope for esophageal stricture prevention: A prospective single-center trial on acellular dermal matrix. World J Gastrointest Endosc. 2023;15(12):725–734. doi: 10.4253/wjge.v15.i12.725. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Cole W, Samsell B, Moore MA Achilles tendon augmented repair using human acellular dermal matrix: A case series. J Foot Ankle Surg. 2018;57(6):1225–1229. doi: 10.1053/j.jfas.2018.03.006. [DOI] [PubMed] [Google Scholar]
- 17.Das P, Singh YP, Mandal BB, et al Tissue-derived decellularized extracellular matrices toward cartilage repair and regeneration. Methods Cell Biol. 2020;157:185–221. doi: 10.1016/bs.mcb.2019.11.005. [DOI] [PubMed] [Google Scholar]
- 18.Ko CL, Chen JC, Tien YC, et al Osteoregenerative capacities of dicalcium phosphate-rich calcium phosphate bone cement. J Biomed Mater Res A. 2015;103(1):203–210. doi: 10.1002/jbm.a.35167. [DOI] [PubMed] [Google Scholar]
- 19.国家食品药品监督管理总局. YY/T 0606. 25-2014 组织工程医疗产品 第25部分: 动物源性生物材料DNA残留量测定法: 荧光染色法. 2015-07-01.
- 20.中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.6-2016 食品安全国家标准 食品中脂肪的测定. 2017-06-23.
- 21.国家食品药品监督管理总局. YY/T 1561-2017 组织工程医疗器械产品 动物源性支架材料残留α-Gal抗原检测. 2018-04-01.
- 22.国家食品药品监督管理总局. YY/T 1465.5-2016 医疗器械免疫原性评价方法 第5部分: 用M86抗体测定动物源性医疗器械中α-Gal抗原清除率. 2017-06-01.
- 23.国家食品药品监督管理总局. YY/T 1558.3-2017/ISO 13175-3: 2012 外科植入物 磷酸钙 第3部分: 羟基磷灰石和β-磷酸三钙骨替代物. 2018-10-01.
- 24.Kokubo T, Takadama H. How useful is SBF in predicting in vivo bone bioactivity? Biomaterials, 2006, 27(15): 2907-2915.
- 25.Gilbert TW Strategies for tissue and organ decellularization. J Cell Biochem. 2012;113(7):2217–2222. doi: 10.1002/jcb.24130. [DOI] [PubMed] [Google Scholar]
- 26.Ye C, Chen J, Qu Y, et al Naringin in the repair of knee cartilage injury via the TGF-β/ALK5/Smad2/3 signal transduction pathway combined with an acellular dermal matrix. J Orthop Translat. 2021;32:1–11. doi: 10.1016/j.jot.2021.06.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Melkonyan KI, Popandopulo KI, Bazlov SB, et al Results of experimental hernioplasty with acellular dermal matrix. Bull Exp Biol Med. 2023;174(4):514–517. doi: 10.1007/s10517-023-05739-9. [DOI] [PubMed] [Google Scholar]
- 28.Xia W, Lin C, Tu Z, et al Preparation of laser microporous porcine acellular dermal matrix and observation of wound transplantation. Cell Tissue Bank. 2023;24(1):191–202. doi: 10.1007/s10561-022-10023-7. [DOI] [PMC free article] [PubMed] [Google Scholar]