Abstract
目的
分析抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibody,ANCA)相关性血管炎耳部受累的临床特点及治疗预后。
方法
回顾性分析解放军总医院第一医学中心诊治的40例ANCA相关性血管炎伴耳部症状患者的临床表现、实验室检查、纯音测听、声导抗检查、颞骨CT及治疗预后。
结果
以耳部表现为首发症状者11例(27.5%),其中最常见的耳部症状为听力下降,其余有耳闷、耳溢液以及耳鸣。40例患者中,有35例出现听力下降,传导性耳聋19例(47.5%)、感音神经性耳聋9例(22.5%)、混合性耳聋7例(17.5%);5例患者仅有耳闷、耳鸣,听力检查无异常(12.5%)。40例患者均有多器官受累,最常见于呼吸系统;且ANCA检查均阳性;治疗包括全身使用糖皮质激素、免疫抑制剂、生物制剂。经治疗后,3例听力恢复正常且无波动(7.5%),22例症状减轻(55.0%),6例听力反复波动(15.0%),9例无明显改善(22.5%)。
结论
ANCA相关性血管炎中耳炎(otitis media with AAV,OMAAV)疾病改变是动态过程:传导性耳聋(分泌性中耳炎)可以是前期表现,后期可出现双耳混合性耳聋。耳鼻喉科医生在诊治分泌性中耳炎反复发作的患者时,需考虑OMAAV诊断,多系统症状问诊及ANCA检查可帮助鉴别,早期全身用药及免疫抑制剂或生物制剂的应用可帮助患者听力恢复。
Keywords: 抗中性粒细胞胞浆抗体, 相关性血管炎, 中耳炎
Abstract
Objective
To analyze the clinical feature, diagnosis and treatment of Anca-associated vasculitis with ear symptoms.
Methods
In this retrospective study, we summarized the clinical and laboratory examination, pure tone audiometry, aural immittance measurement, CT scan of temporal bone and treatment of 40 patients in the First Medical Center of the PLA General Hospital.
Results
A total of 11 cases(27.5%) had the initial symptom in the ear. The most common symptoms were hearing loss, and the other symptoms included a sense of ear fullness, otorrhea and tinnitus. There were 35 cases with hearing loss: 19 cases with conductive hearing loss(47.5%), 9 cases with sensorineural hearing loss(22.5%), and 7 cases with mixed hearing loss(17.5%). 5 cases had a sense of ear fullness or tinnitus, and the results of the hearing test were normal(12.5%). All of the 40 patients had multi-system involvement, and respiratory system accounted for the most. All patients had a positive result of Anti-neutrophil cytoplasmic antibody(ANCA). Treatment included systemic hormonal, immunosuppressive, or biologic therapy. There were 3 cases recovered(7.5%), 22 cases with alleviated ear symptoms(55.0%), 6 cases with recurrent hearing loss(15%) and 9 cases had no significant improvement(22.5%).
Conclusion
Conductive deafness(secretory otitis media) can be the first manifestation in the early stage of otitis media with AAV(OMAAV), later it may turn to binaural mixed deafness. Otolaryngologists need to consider OMAAV diagnosis when diagnosing and treating patients with recurrent secretory otitis media. Multi-system symptom consultation and ANCA examination can help identify. Early systemic medication and the application of immunosuppressants or biological agents can help relieve the ear symptoms.
Keywords: anti-neutrophil cytoplasmic antibody, associated vasculitides, otitis media
抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibody,ANCA)相关性血管炎(associated vasculitides,AAV)是由ANCA介导的以血管壁炎症、内皮细胞受损、纤维素样坏死为特征的一类系统性炎症性疾病[1]。而ANCA绝大部分是由髓过氧化物酶(myeloperoxidase,MPO)和蛋白酶3(proteinase 3,PR3)组成。AAV的临床类型包括肉芽肿性多血管炎(granulomatosis with polyangiitis,GPA)、显微镜下多血管炎(microscopic polyangiitis,MPA)和嗜酸性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis,EGPA)3种。AAV临床表现复杂,表现为多系统受累,如神经系统、肺、肾、皮肤、耳鼻喉等。其中有80%~90%的GPA患者、20%~30%的MPA患者和近53%~70%的EGPA患者会在病程中出现耳鼻喉病变[2],耳部受累的发生率为19%~61%[3-4]。为重视耳部症状及治疗,国外学者提出ANCA相关性血管炎中耳炎(otitis media with AAV,OMAAV)的概念:是AAV的耳部临床症状,其中较常见的是顽固分泌性中耳炎,少数可表现为感音神经性耳聋、化脓性中耳炎,累及面神经者可表现为面神经麻痹。早期识别及早期治疗有助于患者恢复听力[3]。部分耳鼻喉科医生对于该病的认识不够,尤其是对于以耳部表现为首发症状的患者,常容易将其误诊。故本研究回顾分析我院伴有耳部症状的AAV患者的症状、治疗转归,以提高耳鼻喉科医生对该病的认识,减少误诊误治。
1. 资料与方法
1.1. 研究对象
纳入2020年1月1日—2022年12月31日在解放军总医院第一医学中心住院的伴有耳部症状的AAV患者40例。入选标准:①符合美国风湿病学会(ACR)-欧洲抗风湿病联盟(EULAR)提出的AAV分类标准;②伴有耳部症状,包括听力下降、耳聋、耳溢液、耳鸣、耳闷、耳痛等;③完善纯音测听、声导抗检查、颞骨CT检查,其中患者平均听阈取500、1 000、2 000和4 000 Hz频率的平均值。
OMAAV的诊断标准(参考日本耳科学会标准[5])需满足下列3项内容:①至少有1项下列的临床表现:a.伴有积液或肉芽的难治性中耳炎,抗生素治疗和鼓膜置管术无效;b.骨传导听力进行性下降。②至少有1项下列的特征:a.基于其他器官受累的情况,已诊断为AAV(GPA,MPA,EGPA);b.血清MPO-或PR3-ANCA阳性;c.组织病理学符合AAV,即主要影响小血管的坏死性血管炎,伴有或不伴血管外的肉芽肿性炎症。③至少有以下1项AAV相关的伴随体征/症状:a.除耳部以外的上呼吸道、巩膜、肺和(或)肾脏受累;b.面瘫;c.肥厚性硬脑膜炎;d.多发性单神经病;e.按(0.5~1.0) mg/kg剂量服用泼尼松龙进行治疗可暂时缓解症状/体征,停药后复发。需与下列疾病进行鉴别诊断:①中耳乳突胆脂瘤;②中耳乳突胆固醇肉芽肿;③嗜酸性中耳炎;④结核性中耳乳突炎;⑤恶性外耳道炎、颅底骨髓炎;⑥肿瘤(包括恶性肿瘤、炎性肌纤维母细胞瘤等);⑦除AAV以外的自身免疫性疾病和血管炎导致的中耳或内耳炎症。
1.2. 方法
收集患者基本人口学资料、临床表现、ANCA抗体、C-反应蛋白(CRP)、血沉(ESR)、纯音测听、声导抗检查结果、颞骨CT影像表现、药物使用情况。
1.3. 统计学处理
本研究的统计部分主要采用描述性分析,其中计量资料以X±S表示,计数资料采用%表示。使用IBM SPSS Statistic 22软件进行统计学分析,定性资料的相关性检验采用Spearman相关分析,P < 0.05为差异有统计学意义。
2. 结果
2.1. 临床特征
纳入研究的40例患者,其中男23例(57.5%),女17例(42.5%);年龄15~79岁,平均(56.8±15.0)岁;单侧耳听力下降者11例(27.5%),双侧耳听力下降者24例(60.0%),仅有耳部不适者5例(12.5%)。其中,传导性聋者19例、感音神经性聋者8例、混合性聋者8例,听力检查无异常者5例。所有患者均检测ANCA类型及滴度,其中MPO阳性患者19例(47.5%),平均滴度(160.70±63.04) RU/mL;PR3阳性患者21例(52.5%),平均滴度(109.45±83.23) RU/mL。所有患者炎症标志物(CRP、ESR)均升高,CRP平均值(6.67± 5.53) mg/dL。血沉平均值(58.03±34.96) mm/h。
以耳部表现为首发症状患者11例(27.5%),从症状出现到诊断OMAAV的平均时间是6个月。11例患者中,常见主诉依次是听力下降(5例)、耳闷(3例)、耳溢液(2例)以及耳鸣(1例),伴有鼻部症状4例。
分泌性中耳炎临床表现者23例,其中PR3阳性者12例,MPO阳性者11例。反复流脓流水者4例,其中PR3阳性者3例,MPO阳性者1例。
患者均有多系统受累,除耳部症状外,其他常见受累系统或症状依次是呼吸系统(29例)、发热(26例)、泌尿系统(20例)、眼(9例)、皮肤(9例)、神经系统(6例)、肌肉关节(6例)、消化系统(3例)及心脏(1例)。
40例患者均在我院完成治疗。2例患者接受免疫抑制治疗,30例患者接受激素+免疫抑制剂联合治疗,3例接受激素+免疫抑制剂+生物制剂联合治疗,4例接受激素+生物制剂联合治疗,1例接受激素+血浆置换治疗。免疫抑制剂是环磷酰胺、吗替麦考酚酯、来氟米特,生物制剂是利妥昔单抗。3例听力恢复正常且无波动(7.5%),22例听力部分提高(55.0%),6例听力反复波动(15.0%),9例无明显改善(22.5%)。其中,在MPO阳性患者中,2例听力痊愈,11例改善,3例反复波动,3例无效;在PR3阳性患者中,1例听力痊愈,11例改善,3例反复波动,6例无效,2组差异无统计学意义(P>0.05)。
2.2. 典型病例报告
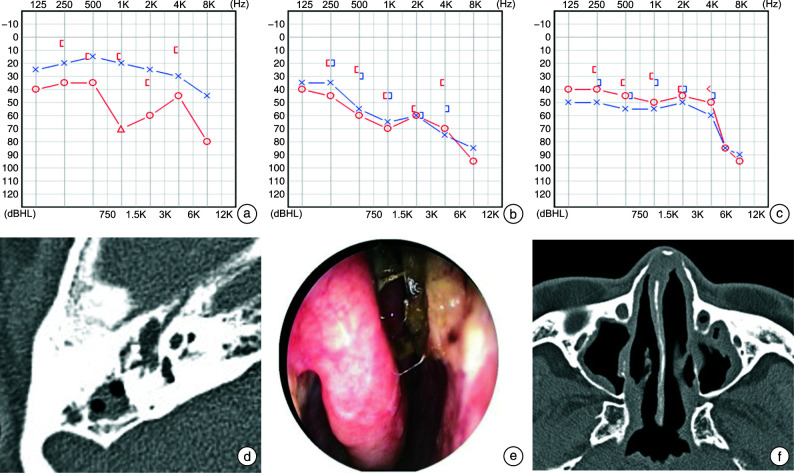
患者,男,62岁,主因“右耳闷伴听力下降2周”就诊,体检右侧鼓膜稍内陷(图 1)。完善听力检查提示右耳传导性耳聋(图 1a):平均听阈=52.5 dBHL,气骨导差33.8 dBHL;声导抗提示“B”型曲线。诊断“分泌性中耳炎(右)”,予鼻喷激素外用及黏液促排药物口服治疗。2个月后,患者复诊,诉用药后右耳症状仍反复,出现鼻塞、流涕症状,1周前出现左耳听力下降。复查听力检查提示双耳混合性耳聋:右耳平均听阈=65.0 dBHL,右耳气骨导差40.0 dBHL;左耳平均听阈=63.8 dBHL,气骨导差11.3 dBHL(图 1b)。颞骨CT检查提示中耳乳突液状影,听骨未见明显破坏(图 1d)。鼻内镜检查见鼻腔内干痂附着,中鼻道及嗅裂区见脓性分泌物,鼻咽部黏膜光滑(图 1e)。鼻窦CT提示鼻黏膜增厚,上颌窦液状影(图 1f)。行双耳鼓膜穿刺后,见分泌物无明显黏稠,未予置管,分泌物细菌培养阴性。按鼻窦炎治疗,增加抗生素治疗后,仍效果欠佳。患者1个月后出现关节疼痛伴视力下降,就诊于风湿科,化验PR3阳性,滴度>200 RU/mL,CRP1.44 mg/dL,血沉54 mm/h,诊断AAV。予甲泼尼龙片、硫酸羟氯喹片、注射用环磷酰胺治疗。1个月后复诊,症状较前减轻,复查听力检查示右耳听力较前提高:右耳平均听阈=47.5 dBHL,右耳气骨导差11.2 dBHL;左耳平均听阈=55.0 dBHL,气骨导差13.7 dBHL(图 1c)。半年后复诊分泌性中耳炎无加重。
图 1.
典型病例图
a:纯音测听检查结果右耳传导性聋;b:纯音测听检查结果双耳混合性聋;c:纯音测听检查结果双耳混合性聋,较前提高;d:颞骨高分辨率CT片:右侧中耳、乳突腔见软组织影,听骨链完整,未见骨质破坏;e:鼻内镜检查:鼻腔内干痂附着,中鼻道及嗅裂区见脓性分泌物,鼻咽部黏膜光滑;f:鼻窦CT片:鼻黏膜增厚,上颌窦液状影,未见骨质破坏。
3. 讨论
AAV是一种比较少见的坏死性血管炎,主要累及小动脉、微小动脉、微小静脉和毛细血管等小血管,常有多系统受累的病变表现,该病临床复杂多变,误诊率高,随病情发展易有重要器官受累,影响患者生存率[6]。既往研究显示AAV患者易从单系统症状进展成全身系统疾病,其中46%的患者在免疫抑制剂治疗后仍恶化或是复发[7],故早期发现和治疗非常重要。本研究的患者在病变发展过程中,均出现其他器官受累或全身症状,包括呼吸系统、肾脏受累以及发热等,所以类似的多器官受累表现对AAV的诊断有重要提示作用,耳鼻喉科医生接诊患者时需问诊除耳部表现外的其他临床症状。
患者以耳部症状为初始表现时,诊断常具有挑战性,易被耳鼻喉医师忽略。本研究的结果显示有耳部症状患者平均年龄约57岁,提示中老年人更易患此病。在耳部为首发症状的11例患者中,以听力下降、耳闷主诉为主,最初诊断分泌性中耳炎5例。此类症状主要是咽鼓管功能异常所致,造成此异常的原因可以是鼻咽部、鼻腔、咽鼓管的炎性病变,也可以是中耳、乳突黏膜细胞受累引起的炎性病变[8-9],单纯按照分泌性中耳炎予鼻喷激素外用及黏液促排药物口服治疗,效果往往欠佳,与张玉忠等[10]报道一致。耳鼻喉医师在出诊中遇到患者分泌性中耳炎反复发作、治疗过程中仍出现双耳受累或听力下降进行性加重等情况,除了排除鼻咽部占位,也需要将OMAAV纳入排除诊断的思维体系中。
其次,本研究对各中耳炎类型进行分类,进行横断面分析结果示:传导性耳聋19例(47.5%)、感音神经性耳聋8例(20.0%)、混合性耳聋8例(20.0%),提示中传导性耳聋占比例高。而日本学者Yoshida等[3]和Harabuchi等[5]提示混合性耳聋占大多数,后者总结的比例是69%。结论的差异可能与2个因素相关:①病例病变累及显微结构或疾病发展程度不同。结合典型病例分析,OMAAV的疾病改变是动态过程:在早期病变过程中,黏膜炎性渗出增加、黏膜肿胀使中耳引流不畅引起分泌性中耳炎,出现传导性耳聋。随着病情进展,患者出现混合性耳聋的临床表现,其可能的机制是内耳血管病变(耳蜗血管纹或毛细血管)导致供血不足、内耳细胞功能紊乱(影响内淋巴液钾离子的浓度)继而出现骨传导听力下降。②存在样本偏倚。Yoshida等[3]参考总结的病例中,有些病例属于病变晚期者或严重者,如Wierzbicka等[11]报导的7个病例中,1例1周后死亡、1例2个月后死亡;而本研究的病例发现比较早,从症状出现到确诊间隔的时间在2个月以内者有14例,均未出现提示预后不良的临床表现(面瘫、肥厚性硬脑膜炎、PR3和MPO抗体阴性)。样本偏倚问题的解决有待未来国内更大样本的收集。
临床工作中常采用间接免疫荧光法(indirect immunofluorescence,IIF)或PR3和MPO的抗原特异性酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测ANCA,其中PR3-ANCA和MPO-ANCA的ELISA检测更具特异性,并被认为是检测ANCA的一个必要组成部分[12]。本研究结果示MPO阳性者19例,PR3阳性者21例。GPA主要与PR3-ANCA相关(65%~75%),而MPA主要与MPO-ANCA相关(55%~65%)[13]。本研究所有患者ANCA抗体均为阳性,与此次研究的病例准入标准有关。GPA或MPA患者中有82%~94%为ANCA阳性,具体取决于疾病的严重程度[14-15]。但20%~30%的临床GPA或MPA患者为其他ANCA阳性,至少10%的患者为ANCA阴性[16-17]。即ANCA阴性不能完全排除OMAAV的诊断。本研究中以耳部为首发症状的患者从症状出现到诊断OMAAV的平均时间是6个月,最长12个月,国外有学者报导最长8年[3],警惕假阴性,定期随访非常重要。
未经治疗的AAV平均存活时间仅6个月[2],所以其诊治讲求时效性,治疗原则是:快速明确诊断、快速开始诱导治疗、早期诱导缓解。治疗分为诱导缓解和维持缓解两个阶段:诱导缓解阶段主要使用糖皮质激素联合免疫抑制剂治疗,目的是尽快使疾病达到缓解,避免器官不可逆损伤;维持缓解阶段主要使用小剂量激素联合一种免疫抑制剂治疗,目的是使疾病处于缓解状态,减少疾病复发[2]。本研究的患者经过系统治疗,77.1%耳部症状有改善或缓解,比Yoshida等[3]总结的67%改善率更好,考虑与本研究的患者发现早,及时获得治疗、全身症状控制理想有关。本研究显示有22.2%的患者出现听力反复波动。OMAAV患者病情复发率高[18],然而耳部受累的具体机制及高复发率原因目前并不十分清楚。既往研究提出感染及促炎因子释放导致的ANCA滴度升高是复发的诱因[19]。另外有学者报道在患者耳部分泌物中检测的MPO与听力阈值呈正相关[20],提示中耳感染可能是复发的因素之一。
本研究存在一些不足,该研究为回顾性研究,样本量相对较少,患者的治疗并不统一、耳科检查时有缺如,故不能深入探讨AAV伴耳部症状的治疗差异。另外本研究纳入的患者年龄偏大,而老年人的听力恢复本身就较青年者差。未来需要更大样本量及随机、对照研究来讨论耳部症状有别于其他部位的疗效差异,以及研究复发的相关危险因素,为临床诊治提供更严谨的证据。
Funding Statement
科技部国家重点研发计划(No:2019YFB1311805);国家自然科学基金(No:81970895);解放军总医院创新培育基金(No:CXPY202216)
Footnotes
利益冲突 所有作者均声明不存在利益冲突
References
- 1.Yaseen K, Mandell BF. ANCA associated vasculitis(AAV): a review for internists. Postgrad Med. 2023;135(sup1):3–13. doi: 10.1080/00325481.2022.2102368. [DOI] [PubMed] [Google Scholar]
- 2.田 新平, 赵 丽珂, 姜 振宇, et al. 抗中性粒细胞胞质抗体相关血管炎诊疗规范. 中华内科杂志. 2022;61(10):1128–1135. doi: 10.3760/cma.j.cn112138-20220318-00191. [DOI] [PubMed] [Google Scholar]
- 3.Yoshida N, Iino Y. Pathogenesis and diagnosis of otitis media with ANCA-associated vasculitis. Allergol Int. 2014;63(4):523–532. doi: 10.2332/allergolint.14-RAI-0774. [DOI] [PubMed] [Google Scholar]
- 4.Alam DS, Seth R, Sindwani R, et al. Upper airway manifestations of granulomatosis with polyangiitis. Cleve Clin J Med. 2012;79(Suppl 3):S16–21. doi: 10.3949/ccjm.79.s3.04. [DOI] [PubMed] [Google Scholar]
- 5.Harabuchi Y, Kishibe K, Tateyama K, et al. Clinical characteristics, the diagnostic criteria and management recommendation of otitis media with antineutrophil cytoplasmic antibody(ANCA)-associated vasculitis(OMAAV)proposed by Japan Otological Society. Auris Nasus Larynx. 2021;48(1):2–14. doi: 10.1016/j.anl.2020.07.004. [DOI] [PubMed] [Google Scholar]
- 6.Caravaca-Fontán F, Yerovi E, Delgado-Yagu EM, et al. Anti-neutrophil cytoplasmic antibody-associated vasculitis with renal involvement: Analysis of 89 cases. Med Clin(Barc) 2017;148(1):1–7. doi: 10.1016/j.medcli.2016.09.015. [DOI] [PubMed] [Google Scholar]
- 7.Holle JU, Gross WL, Holl-Ulrich K, et al. Prospective long-term follow-up of patients with localised Wegener's granulomatosis: does it occur as persistent disease stage? Ann Rheum Dis. 2010;69(11):1934–1939. doi: 10.1136/ard.2010.130203. [DOI] [PubMed] [Google Scholar]
- 8.陈 旻, 赵 明辉. 抗中性粒细胞胞浆抗体相关小血管炎的耳鼻咽喉损害. 中华耳科学杂志. 2009;7(4):267–270. doi: 10.3969/j.issn.1672-2922.2009.04.002. [DOI] [Google Scholar]
- 9.Ferlito A, Devaney KO, Anniko M, et al. Otological Wegener's granulomatosis at the time of initial presentation: a potential diagnostic dilemma. Acta Otolaryngol. 2003;123(6):675–677. doi: 10.1080/00016480310002447. [DOI] [PubMed] [Google Scholar]
- 10.张 玉忠, 赵 欢娣, 陈 耔辰, et al. 抗中性粒细胞胞质抗体相关血管炎性中耳炎. 临床耳鼻咽喉头颈外科杂志. 2022;36(8):630–635. doi: 10.13201/j.issn.2096-7993.2022.08.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Wierzbicka M, Szyfter W, Puszczewicz M, et al. Otologic symptoms as initial manifestation of wegener granulomatosis: diagnostic dilemma. Otol Neurotol. 2011;32(6):996–1000. doi: 10.1097/MAO.0b013e31822558fd. [DOI] [PubMed] [Google Scholar]
- 12.Bossuyt X, Cohen Tervaert JW, Arimura Y, et al. Position paper: Revised 2017 international consensus on testing of ANCAs in granulomatosis with polyangiitis and microscopic polyangiitis. Nat Rev Rheumatol. 2017;13(11):683–692. doi: 10.1038/nrrheum.2017.140. [DOI] [PubMed] [Google Scholar]
- 13.Yaseen K, Mandell BF. ANCA associated vasculitis(AAV): a review for internists. Postgrad Med. 2023;135(sup1):3–13. doi: 10.1080/00325481.2022.2102368. [DOI] [PubMed] [Google Scholar]
- 14.Guillevin L, Durand-Gasselin B, Cevallos R, et al. Microscopic polyangiitis: clinical and laboratory findings in eighty-five patients. Arthritis Rheum. 1999;42(3):421–430. doi: 10.1002/1529-0131(199904)42:3<421::AID-ANR5>3.0.CO;2-6. [DOI] [PubMed] [Google Scholar]
- 15.Finkielman JD, Lee AS, Hummel AM, et al. ANCA are detectable in nearly all patients with active severe Wegener's granulomatosis. Am J Med. 2007;120(7):643. e9–14. doi: 10.1016/j.amjmed.2006.08.016. [DOI] [PubMed] [Google Scholar]
- 16.Hagen EC, Daha MR, Hermans J, et al. Diagnostic value of standardized assays for anti-neutrophil cytoplasmic antibodies in idiopathic systemic vasculitis.EC/BCR Project for ANCA Assay Standardization. Kidney Int. 1998;53(3):743–753. doi: 10.1046/j.1523-1755.1998.00807.x. [DOI] [PubMed] [Google Scholar]
- 17.Savige J, Pollock W, Trevisin M. What do antineutrophil cytoplasmic antibodies(ANCA)tell us? Best Pract Res Clin Rheumatol. 2005;19(2):263–276. doi: 10.1016/j.berh.2004.10.003. [DOI] [PubMed] [Google Scholar]
- 18.Hosokawa Y, Okada M, Suemori K, et al. The association between ear involvement and clinical features and prognosis in ANCA-associated vasculitis. Auris Nasus Larynx. 2021;48(5):885–889. doi: 10.1016/j.anl.2021.01.023. [DOI] [PubMed] [Google Scholar]
- 19.Wilde B, van Paassen P, Witzke O, et al. New pathophysiological insights and treatment of ANCA-associated vasculitis. Kidney Int. 2011;79(6):599–612. doi: 10.1038/ki.2010.472. [DOI] [PubMed] [Google Scholar]
- 20.Morita S, Nakamaru Y, Nakazawa D, et al. The Diagnostic and Clinical Utility of the Myeloperoxidase-DNA Complex as a Biomarker in Otitis Media With Antineutrophil Cytoplasmic Antibody-associated Vasculitis. Otol Neurotol. 2019;40(2):e99–e106. doi: 10.1097/MAO.0000000000002081. [DOI] [PubMed] [Google Scholar]