Zusammenfassung
Ziel der Studie Ziel des Vorhabens ist die Untersuchung regionaler Unterschiede in der Konzentration von Thyreoidea-stimulierendem Hormon (TSH), freiem Thyroxin (fT4) und des Jodstatus in komparablen deutschen und europäischen Kohortenstudien.
Methodik Die geschlechts- und altersstratifizierten TSH-, fT4- und Urin-Jodkonzentrationen der anamnestisch schilddrüsengesunden Teilnehmer (Altersgruppe 45–75 Jahre) der HNR (Heinz Nixdorf Recall) Studie im Ruhrgebiet Deutschlands, der süddeutschen KORA (Kooperative Gesundheitsforschung in der Region Augsburg) und nordostdeutschen SHIP (Study of Health in Pomerania) Studie sowie der norwegischen HUNT (Nord-Trøndelag Health) Studie (Altersgruppe 40–79 Jahre), der englischen EPIC (European Prospective Investigation of Cancer)-Norfolk Studie und der niederländischen Rotterdam Studie wurden miteinander verglichen. Der TSH-Referenzbereich für die HNR Studienpopulation wurde berechnet und der KORA und SHIP Studie gegenübergestellt.
Ergebnisse Regionale Unterschiede zeigten in der Altersgruppe der 45- bis 75- Jährigen einen stärkeren Einfluss auf die TSH- und fT4-Konzentrationen als das Geschlecht und das Alter der Probanden. Die geschätzte Differenz der Mediane, gemessen an der HNR Studie, war mit −0,47 (95% KI: −0,53; −0,41) für die Männer und −0,41 (−0,53; −0,41) für die Frauen in der SHIP Studie am geringsten. Die Rotterdam Studie wies sowohl für Männer als auch Frauen die höchste Differenz der Mediane (Männer: 0,56 mit 0,44; 0,68 und Frauen: 0,62 mit 0,46; 0,78) auf. Die geringsten medianen TSH-Konzentrationen wurden, über alle betrachteten Alterskategorien, in den deutschen Kohorten beobachtet.
Schlussfolgerung Der Vergleich der Schilddrüsenfunktionsparameter und Jod bei älteren Probanden zwischen sechs vergleichbaren Kohortenstudien aus Deutschland und Europa zeigte einen bedeutenden Einfluss der Region, welcher die Geschlechts- und Altersabhängigkeit der Parameter überstieg.
Schlüsselwörter: Thyreoidea-stimulierendes Hormon, Jod, Referenzbereich, Alter, Geschlecht
Abstract
Aim of the study The aim of the project was to investigate regional differences in thyroid stimulating hormone (TSH), and free thyroxine (fT4) concentrations and iodine status in comparable German and European cohort studies.
Methods Sex- and age-stratified TSH, fT4, and urine iodine concentrations of thyroid-healthy participants (age group 45–75 years) of the HNR (Heinz Nixdorf Recall) Study in the Ruhr region of Germany, the southern German KORA (Cooperative Health Research in the Augsburg Region) and northeastern German SHIP (Study of Health in Pomerania) studies, as well as the Norwegian HUNT (Nord-Trøndelag Health) study (age group 40–79 years), the English EPIC (European Prospective Investigation of Cancer)-Norfolk study, and the Dutch Rotterdam study were compared. The TSH reference range for the HNR study population was calculated and compared to the KORA and SHIP studies.
Results Regional differences showed a stronger influence on TSH and fT4 concentrations than sex and age of the subjects in the 45- to 75-year age group. The estimated difference in medians, as measured by the HNR study, was lowest in the SHIP study, −0.47 (95% CI: −0.53; −0.41) for men and −0.41 (−0.53; −0.41) for women. The Rotterdam study had the highest difference in medians for both men and women (men: 0.56 with 0.44; 0.68 and women: 0.62 with 0.46; 0.78). The lowest median TSH concentrations, across all age categories considered, were seen in the German cohorts.
Conclusions Comparison of thyroid function parameters and iodine in elderly subjects between six comparable cohort studies from Germany and Europe showed a significant influence of region, which exceeded the sex and age dependence of the parameters.
Key words: thyroid stimulating hormone, iodine, reference range, age, sex
Einleitung
Zur Diagnostik von Schilddrüsenfunktionsstörungen dienen die im Blut zirkulierenden Schilddrüsenhormone Thyroxin (T4) bzw. Triiodthyronin (T3) und das Thyreoidea-stimulierende Hormon (TSH). Schilddrüsengesunde Personen können jedoch auch Variationen dieser Parameter aufweisen. Neben biologischen Komponenten, wie dem Geschlecht 1 und dem Alter 2 3 , können auch Umweltfaktoren, wie z. B. die alimentäre Jodaufnahme, Einfluss auf die Schilddrüsenfunktionsparameter nehmen. Für Erwachsene wird eine Jodzufuhr von 150 µg von der World Health Organization (WHO), UNICEF und dem International Council for the Control of Iodine Deficiency Disorders (ICCIDD) empfohlen 4 .
Ziel der Studie ist, neben der Ableitung und Einordnung des TSH-Referenzbereiches in der Heinz Nixdorf Recall Kohortenstudie, die Untersuchung regionaler Unterschiede in der Konzentration von TSH, fT4 und Jod bei schilddrüsengesunden Personen. Hierzu soll die deutsche Heinz Nixdorf Recall Kohortenstudie mit der deutschen KORA (Kooperative Gesundheitsforschung in der Region Augsburg) und SHIP (Study of Health in Pomerania) Studie sowie der norwegischen HUNT (Nord-Trøndelag Health) Studie, der englischen EPIC (European Prospective Investigation of Cancer)-Norfolk Studie und der niederländischen Rotterdam Studie verglichen werden.
Methodik
Kohortenstudien
Grundlage der Studie bilden die drei deutschen Kohortenstudien Heinz Nixdorf Recall (HNR) (Ruhrgebiet) 5 6 , KORA (Region Augsburg) und SHIP (Mecklenburg-Vorpommern) 7 , die englische EPIC-Norfolk Studie 8 , die niederländische Rotterdam Studie 9 und die norwegische HUNT Studie 10 . Für die Vergleichbarkeit der Studien wurde eine Altersspanne von 45 bis 75 Jahren zugrunde gelegt. Ausnahme bildete die HUNT Studie, hierfür standen nur TSH-Konzentrationen in 10-Jahres-Alterskategorien von 40- bis 79-Jährigen zur Verfügung. Des Weiteren wurden die TSH-Konzentrationen der SHIP Studie bereits für die Varianz der Labormethoden zwischen der KORA und SHIP Studie korrigiert. Von den Co-Autoren wurden zusätzliche Daten erhalten. In Tab. 1 sind alle betrachteten Studien hinsichtlich ihrer Einschlusskriterien für Probanden und Laborparameter dargestellt. Alle Teilnehmer gaben eine schriftliche Einverständniserklärung ab. Diese Studie steht im Einklang mit der Deklaration von Helsinki und wurde von den Ethikkommissionen der Universität Duisburg-Essen (HNR), der Bayerischen Landesärztekammer München (KORA), der Universität Greifswald (SHIP), der Norwich District Health Authority (EPIC-Norfolk), der Erasmus Universität (Rotterdam) sowie der regionalen Ethikkommission und norwegischen Datenaufsichtsbehörde (HUNT) genehmigt.
Tab. 1 Vergleich der Studienpopulationen.
| Studie | Region | Studiengröße | Erhebungs-zeitraum | Ausschluss von Probanden mit: | Eingeschlossene Laborparameter | Labormethoden |
|---|---|---|---|---|---|---|
| HNR | Bochum, Essen und Mülheim (Deutschland) | 2 168 | 2000–2003 |
|
TSH, fT4, Urin-Jod | TSH und fT4: Elektrochemilumineszenz-Immunoassay (ECLIA) von Modular Analytics E170 © Urin-Jod: photometrisch mittels Pharmacia Ultrospec 2000 |
| KORA 7 | Augsburg und Umgebung (Deutschland) | 1 439 | 2006–2008 |
|
TSH, Urin-Jod | TSH: Immunochemilumineszenz-Methode von Dimension Vista, Siemens Urin-Jod: photometrisch mittels Photometer ECOM 6122 |
| SHIP 7 | Vorpommern (Deutschland) | 1 428 | 2002–2006 |
|
TSH, Urin-Jod | TSH: Immunochemilumineszenz-Methode von Immulite 2000, Third generation, Diagnostic Products Corporation Urin-Jod: photometrisch mittels Photometer ECOM 6122 |
| HUNT 10 | Region Trøndelag (Norwegen) | 26 589* | 1995–1997 |
|
TSH | TSH: zeitaufgelöster Fluoroimmunoassay mittels DELFIA © hTSH Ultra |
| EPIC-Norfolk 8 | Norfolk (England) | 11 554 | 1993–1997 |
|
TSH, fT4 | TSH und fT4: zeitaufgelöster Fluoroimmunoassay von AutoDELFIA © |
| Rotterdam Study 9 | Rotterdam (Niederlande) | 7 406 | 1990–1993 2000–2001 2006–2008 |
|
TSH, fT4 | TSH und fT4: Elektrochemilumineszenz-Immunoassay (ECLIA) von Roche |
*Altersgruppe 40–79 Jahre.
Statistische Auswertung
Alters- (5-Jahresgruppen) und geschlechtsspezifische Mediane der Jod-, TSH- und fT4-Konzentrationen der HNR Studie wurden berechnet und den geschlechtsspezifischen Medianen der gleichen Altersgruppen der KORA, SHIP, EPIC-Norfolk, Rotterdam und HUNT Studie gegenübergestellt. Zur Quantifizierung der regionalen Unterschiede wurden geschlechtsspezifische Differenzen der medianen TSH-Konzentrationen zwischen den jeweiligen Studien und der HNR Studie (Referenz) mittels Quantilsregression berechnet. Hierfür wurden Mediane aus den alters- und geschlechtsspezifischen Medianen der jeweiligen Studie geschlechtsspezifisch berechnet und die Differenzen der Mediane sowie 95-%-Konfidenzintervalle ermittelt. Der Referenzbereich für TSH wurde aus der 2,5. und 97,5. Perzentile der Verteilung in der schilddrüsengesunden HNR Studienbevölkerung ermittelt. Die statistische Auswertung erfolgte mittels SAS 9.4 (SAS Institute Inc., Cary, NC, USA).
Ergebnisse
Die medianen Urin-Jodkonzentration sowie die mittleren TSH- und fT4-Konzentrationen der vorher benannten Kohortenstudien sind, nach Alter und Geschlecht stratifiziert, in Abb. 1 dargestellt. In der HNR und SHIP Studie wiesen die Männer jeweils höhere Urin-Jodkonzentrationen auf als die Frauen. Der Geschlechtsunterschied war in der SHIP Studie am deutlichsten ausgeprägt und in der KORA Studie vor allem in den mittleren Altersgruppen zu beobachten. Die TSH-Konzentration zeigte sowohl bei den Männern als auch bei den Frauen in allen eingeschlossenen Kohorten keine größeren Veränderungen im untersuchten Altersverlauf. Die Probanden der Rotterdam, EPIC-Norfolk und HUNT Studie wiesen die höchsten TSH-Konzentrationen auf, wohingegen in der SHIP Studie die niedrigsten TSH-Konzentrationen verzeichnet wurden. Innerhalb der Kohorten zeigten sich geringfügig höhere TSH-Konzentrationen bei den Frauen verglichen mit den Männern. Die medianen fT4-Konzentrationen in der HNR Studie zeigten keine Veränderungen im Altersverlauf der Studienpopulation, unterschiedliche Konzentrationen zwischen den Kohorten waren hingegen zu beobachten, wobei die HNR Studienteilnehmer die höchsten fT4-Konzentrationen aufwiesen. Frauen hatten in allen Alterskategorien tendenziell niedrigere Werte als die Männer. Altersunterschiede waren hingegen in allen drei Studienpopulationen nicht zu beobachten.
Abb. 1.
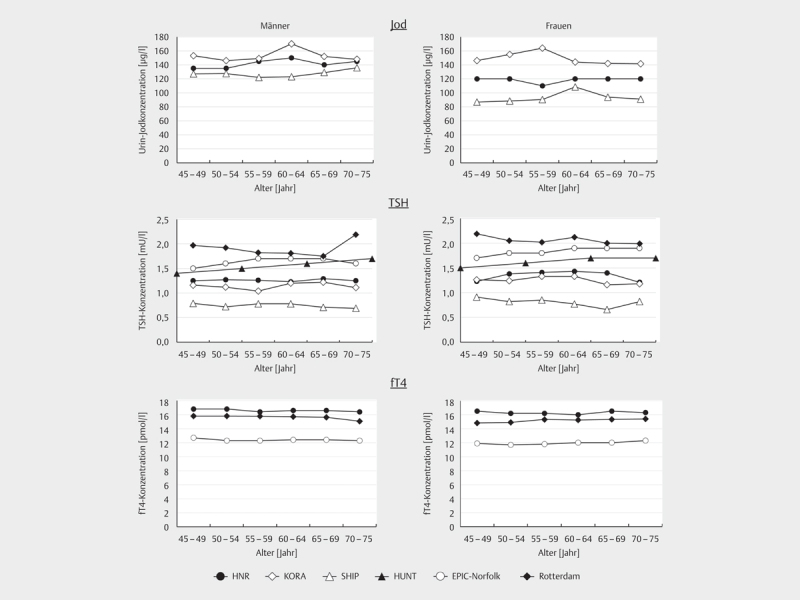
Mittlere Jod-, TSH- und fT4-Konzentrationen ausgewählter europäischer Kohortenstudien stratifiziert nach Alter und Geschlecht. Datenerhebungen erfolgten in den Jahren 2000–2003 für die HNR Studie, 2006–2008 für die KORA Studie, 2002–2006 für die SHIP Studie, 1995–1997 für die HUNT Studie, 1993–1997 für die EPIC-Norfolk Studie und 1990–1993, 2000–2001 sowie 2006–2008 für die Rotterdam Studie. Daten der HUNT Studie wurden aus 10-Jahres-Alterskategorien entnommen.
Zur genaueren Betrachtung und Quantifizierung der regionalen Unterschiede gegenüber den Unterschieden zwischen Männern und Frauen wurden die geschlechtsspezifischen Differenzen der Mediane der TSH-Konzentration und 95-%-Konfidenzintervalle aus den einbezogenen Studien, bezogen auf die HNR Studie, berechnet ( Abb. 2 ). Die SHIP Studie wies gegenüber der HNR Studie die geringsten medianen TSH-Konzentrationen auf, welche für Männer eine geschätzte Differenz der Mediane von −0,47 (95% Konfidenzintervall: −0,53 bis −0,41) und für Frauen von −0,56 (95% KI: −0,71 bis −0,41) ergab. Für die Rotterdam Studie wurde für beide Geschlechter hingegen die höchste Differenz der Mediane (Männer: 0,56 mit 95% KI: 0,44 bis 0,68; Frauen: 0,62 mit 95% KI: 0,46 bis 0,78) geschätzt. Bei dieser Auswertung der medianen TSH-Konzentration der Probanden war ein deutlicherer Studieneffekt gegenüber dem Geschlechtsunterschied zu beobachten.
Abb. 2.
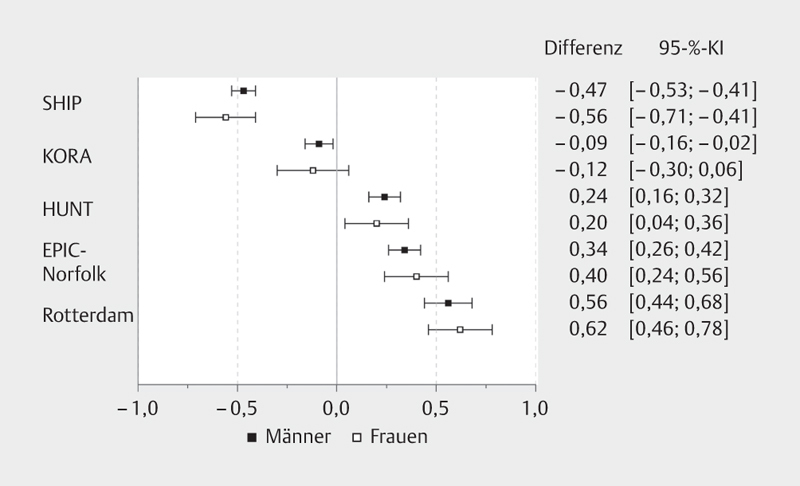
Differenzen der Mediane und 95%-Konfidenzintervall (95-%-KI) der TSH-Konzentration (in mU/l) bei Männern und Frauen. Referenz ist die HNR Studie.
Des Weiteren wurde der TSH-Referenzbereich für die HNR Studienpopulation berechnet, welcher, ähnlich dem Referenzbereich des Herstellers (0,27–4,2 mU/l), 0,34–4,39 mU/l ergab. Die Gegenüberstellung des ermittelten Referenzbereichs mit der SHIP- 11 und KORA-Kohorte 12 zeigt eine breitere Spanne des in der HNR Studie ermittelten Referenzbereichs und grundsätzlich niedrigere eingeschlossene TSH-Konzentrationen für den in SHIP ermittelten Referenzbereich ( Tab. 2 ).
Tab. 2 Ermittelte Referenzwerte für TSH aus drei deutschen Kohortenstudien.
| Studie | Studien-größe | Probandenalter (in Jahren) | Ermittelter Referenzbereich für TSH (in mU/l) | Messgerät | Funktionelle Sensitivität des Assays (in mUl/l) | Referenzbereich des Herstellers (in mU/l) |
|---|---|---|---|---|---|---|
| HNR | 2 168 | 45–75 | 0,34–4,39 | Elektrochemilumineszenz-Immunoassay (ECLIA) von Modular Analytics E170 © | 0,014 | 0,27–4,20 |
| SHIP 11 | 1 488 | 20–79 | 0,25–2,12 | Immunochemilumineszenz-Methode von Byk Sangtec Diagnostica GmbH | 0,02 | 0,3–3,0 |
| KORA 12 | 710 | 32–81 | 0,52–3,60 | Immunochemilumineszenz-Methode von Dimension Vista, Siemens | 0,005 | 0,358–3,74 |
Diskussion
Die vorliegende Studie zeigt deutliche regionale Unterschiede in der Konzentration der Schilddrüsenfunktionsparameter und Jod, welche, im Falle der TSH- und fT4-Konzentration, sowohl die Alters- als auch Geschlechtsabhängigkeit der Parameter in der Altersgruppe der 45- bis 75-Jährigen übersteigt.
Die Beobachtung der unterschiedlichen TSH- und fT4-Konzentrationen zwischen den betrachteten Kohortenstudien kann in der alimentären Jodaufnahme begründet sein, welche maßgeblich die Schilddrüsenhormone beeinflusst. Ein systematisches Review, welches Methoden zur Bestimmung des Jodstatus verglich, stellte neben Thyreoglobulin auch TSH und fT4 als gute Biomarker zur Evaluierung von Veränderungen des Jodstatus bei bestimmten Personengruppen heraus 13 . Die höchsten TSH-Konzentrationen wurden in unserer Studie in der Kohorte der Rotterdam Studie beobachtet. Im Vergleich zu den deutschen Kohorten sind die Niederlanden jedoch eine Region mit ausreichender Jodversorgung der Bevölkerung 14 , welche die starke Diskrepanz erklären kann. Die deutschen Kohorten wiesen in unserer Studie hingegen die niedrigsten TSH-Konzentrationen auf, mit den geringsten TSH-Konzentrationen in der SHIP Studie. Ausgehend von den Referenzwerten für die Urin-Jodkonzentration von 100–200 µg/l 15 lag die mittlere Urin-Jodkonzentration der HNR Studienpopulation im Jahr 2000 somit im optimalen Bereich, wobei dennoch 24,25% der Männer und 40,27% der Frauen Urin-Jodausscheidungen unter 100 µg/l aufwiesen. Bei den Probanden der SHIP Studie wurden die geringsten Urin-Jodkonzentrationen im Vergleich mit den deutschen Kohorten beobachtet, wobei die Frauen hier sogar im Mittel unter den von der WHO empfohlenen 100 µg/l Jod im Urin lagen 7 . Diese Ergebnisse decken sich mit einer dänischen Studie bei der die TSH-Konzentrationen von Bevölkerungsgruppen aus Regionen mit geringem und moderatem Jodmangel verglichen wurden. Hier zeigten sich geringere TSH-Konzentrationen in der Region mit moderatem Jodmangel insbesondere bei den Studienteilnehmern ab 40 Jahren 16 . Entgegen der Annahme, dass die Bevölkerung in Nordostdeutschland aufgrund der Meeresnähe eine bessere Jodversorgung aufweisen müsste, zeigten Meisinger, Ittermann, Wallaschofski, et al. 7 eine höhere Jodausscheidung der Probanden der KORA Studie im Süden Deutschlands. Diese Beobachtung lässt sich durch eine in der Vergangenheit schlechtere Jodversorgung Süddeutschlands 17 erklären, die durch Bestrebungen der Jodanreicherung von Lebensmitteln und ein möglicherweise stärkeres Bewusstsein zur Integrierung von Jod in den Speiseplan aufgehoben werden konnte. Hinzu kommt, dass die Datenerhebung der KORA Studie zu einem späteren Zeitpunkt stattfand, als bei der HNR und SHIP Studie. Die bessere Jodversorgung in Süddeutschland ist somit teilweise durch einen allgemeinen Anstieg der alimentären Jodaufnahme in der deutschen Bevölkerung in den Folgejahren erklärbar. Der Vergleich der Referenzbereiche für TSH zwischen den deutschen Kohorten 11 12 unterstützt die Beobachtung der stark regionalen Unterschiede hinsichtlich der Jodversorgung trotz gleicher Bestrebungen der Jodanreicherung von Lebensmitteln. Die zusätzlich zum Studieneffekt beobachteten Diskrepanzen zwischen den Geschlechtern lassen sich durch eine höhere Kalorienzufuhr bei den Männern und einen höheren Konsum von Fleisch- und Wursterzeugnissen erklären, welche einen Großteil des alimentär aufgenommenen Jods ausmachen 18 . Frauen wiesen in allen betrachteten Kohortenstudien geringfügig höhere mittlere TSH- und eine Tendenz zu niedrigeren fT4-Konzentrationen auf. Altersabhängige Veränderungen der TSH- und fT4-Konzentrationen wurden in unserem betrachteten Altersbereich in allen eingeschlossenen Studien kaum festgestellt, im Gegensatz zur NHANES III, einer großen amerikanischen Bevölkerungsstudie mit 16 533 Probanden, die mit zunehmendem Alter der Probanden einen Anstieg der TSH-Konzentration zeigte 1 . Eine Erklärung hierfür sind die betrachteten Alterskategorien. Deutlichere altersspezifische Veränderungen der TSH-Konzentrationen wurden für die SHIP, KORA und HUNT Studie erst in den höheren Altersbereichen ab 75 Jahren beschrieben 7 10 .
Die aktuelle Studie ist gekennzeichnet durch die großen Stichprobenzahlen der betrachteten Kohortenstudien und die Einordnung der Ergebnisse der einzelnen Studien hinsichtlich anderer vergleichbarer großer deutscher und europäischer Kohortenstudien. Diskrepanzen zwischen den betrachteten Schilddrüsenfunktionsparametern können in der teilweise unterschiedlichen Selektion der Probanden begründet sein. Zudem wurden unterschiedliche Labormethoden angewandt, welche zu den Diskrepanzen zwischen den Kohorten beitragen können. Untersuchungen zur Vergleichbarkeit der Referenzwerte verschiedener Labormethoden zeigten bei einem Großteil der TSH-Messungen Abweichungen von 10% 19 .
Für ein umfassenderes Bild des Einflusses der früheren und aktuellen Jodversorgung der Bevölkerung sowie weiterer Einflussfaktoren auf die Konzentration der Schilddrüsenfunktionsparameter sind weitere Studien im Zeitverlauf und mit aktuelleren Daten notwendig.
Danksagungen
Die Autoren danken allen Studienteilnehmern der Heinz Nixdorf Recall (HNR) Studie, dem Personal im Studienzentrum der HNR Studie, insbesondere U. Roggenbuck sowie der Investigator-Gruppe und allen ehemaligen Mitarbeitern der HNR Studie. Die Autoren danken auch dem wissenschaftlichen Beirat der HNR Studie: T. Meinertz, Hamburg (Vorsitzender); C. Bode, Freiburg; P. J. de Feyter, Rotterdam, Niederlande; B. Güntert, Hall i.T., Österreich; F. Gutzwiller, Bern, Schweiz; H. Heinen, Bonn; O. Hess (†), Bern, Schweiz; B. Klein (†), Essen; H. Löwel, Neuherberg; M. Reiser, München; G. Schmidt (†), Essen; M. Schwaiger, München; C. Steinmüller, Bonn; T. Theorell, Stockholm, Schweden und S. N. Willich, Berlin. Darüber hinaus danken die Autoren Prof. S. Siegrist und Prof. N. Dragano für die Erstellung der medizinsoziologischen Instrumente und der Kollegin Layal Chaker aus Rotterdam, die zusätzliche Daten aus der Rotterdam Studie beigetragen hat. Die Autoren danken der Heinz Nixdorf Stiftung (Vorsitzender: Martin Nixdorf; ehemaliger Vorsitzender: Dr. jur. G. Schmidt [†]), für ihre großzügige Unterstützung dieser Studie. Die Studie wurde ferner gefördert durch die Deutsche Forschungsgemeinschaft (DFG) [DFG-Projekt: EI 969/2–3, ER 155/6–1;6–2, HO 3314/2–1;2–2;2–3;4–3, INST 58219/32–1, JO 170/8–1, KN 885/3–1, PE 2309/2–1, SI 236/8–1;9–1;10–1,], dem Bundesministerium für Bildung und Forschung (BMBF) [BMBF-Projekt: 01EG0401, 01GI0856, 01GI0860, 01GS0820_WB2-C, 01ER1001D, 01GI0205], das Ministerium für Innovation, Wissenschaft, Forschung und Technologie, Nordrhein-Westfalen (MIWFT-NRW), die Else Kröner-Fresenius-Stiftung [Projekt: 2015_A119] und die Deutsche Gesetzliche Unfallversicherung [DGUV-Projekt: FF-FP295]. Weitere Förderung der Studie erfolgte durch das Kompetenznetzwerk für HIV/AIDS, das Dekanat des Universitätsklinikums und IFORES der Universität Duisburg-Essen, die Europäische Union, das Kompetenznetzwerk Herzinsuffizienz, Kulturstiftung Essen, das Protein Research Unit within Europe (PURE), die Dr. Werner Jackstädt-Stiftung und die folgenden Firmen: Celgene GmbH München, Imatron/GE-Imatron, Janssen, Merck KG, Philips, ResMed Foundation, Roche Diagnostics, Sarstedt AG&Co, Siemens HealthCare Diagnostics, Volkswagenstiftung.
Interessenkonflikt Die Autorinnen/Autoren geben an, dass kein Interessenkonflikt besteht.
geteilte Letztautorenschaft
Literatur
- 1.Hollowell J G, Staehling N W, Flanders W D et al. Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III) The Journal of clinical endocrinology and metabolism. 2002;87:489–499. doi: 10.1210/jcem.87.2.8182. [DOI] [PubMed] [Google Scholar]
- 2.Gesing A, Lewinski A, Karbownik-Lewinska M. The thyroid gland and the process of aging; what is new? Thyroid research. 2012;5:16. doi: 10.1186/1756-6614-5-16. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Surks M I, Hollowell J G. Age-specific distribution of serum thyrotropin and antithyroid antibodies in the US population: implications for the prevalence of subclinical hypothyroidism. The Journal of clinical endocrinology and metabolism. 2007;92:4575–4582. doi: 10.1210/jc.2007-1499. [DOI] [PubMed] [Google Scholar]
- 4.WHO Assessment of iodine deficiency disorders and monitoring their elimination: a guide for programme managers2nd ed. In:WHO; 2001 [Google Scholar]
- 5.Stang A, Moebus S, Dragano N et al. Baseline recruitment and analyses of nonresponse of the Heinz Nixdorf Recall Study: identifiability of phone numbers as the major determinant of response. European journal of epidemiology. 2005;20:489–496. doi: 10.1007/s10654-005-5529-z. [DOI] [PubMed] [Google Scholar]
- 6.Schmermund A, Möhlenkamp S, Stang A et al. Assessment of clinically silent atherosclerotic disease and established and novel risk factors for predicting myocardial infarction and cardiac death in healthy middle-aged subjects: Rationale and design of the Heinz Nixdorf RECALL Study. American Heart Journal. 2002;144:212–218. doi: 10.1067/mhj.2002.123579. [DOI] [PubMed] [Google Scholar]
- 7.Meisinger C, Ittermann T, Wallaschofski H et al. Geographic variations in the frequency of thyroid disorders and thyroid peroxidase antibodies in persons without former thyroid disease within Germany. European journal of endocrinology. 2012;167:363–371. doi: 10.1530/eje-12-0111. [DOI] [PubMed] [Google Scholar]
- 8.Boekholdt S M, Titan S M, Wiersinga W M et al. Initial thyroid status and cardiovascular risk factors: the EPIC-Norfolk prospective population study. Clinical endocrinology. 2010;72:404–410. doi: 10.1111/j.1365-2265.2009.03640.x. [DOI] [PubMed] [Google Scholar]
- 9.Chaker L, Korevaar T I, Medici M et al. Thyroid Function Characteristics and Determinants: The Rotterdam Study. Thyroid: official journal of the American Thyroid Association. 2016;26:1195–1204. doi: 10.1089/thy.2016.0133. [DOI] [PubMed] [Google Scholar]
- 10.Bjoro T, Holmen J, Kruger O et al. Prevalence of thyroid disease, thyroid dysfunction and thyroid peroxidase antibodies in a large, unselected population. The Health Study of Nord-Trondelag (HUNT) European journal of endocrinology. 2000;143:639–647. doi: 10.1530/eje.0.1430639. [DOI] [PubMed] [Google Scholar]
- 11.Volzke H, Alte D, Kohlmann T et al. Reference intervals of serum thyroid function tests in a previously iodine-deficient area. Thyroid: official journal of the American Thyroid Association. 2005;15:279–285. doi: 10.1089/thy.2005.15.279. [DOI] [PubMed] [Google Scholar]
- 12.Burkhardt K, Ittermann T, Heier M et al. TSH-reference range of adults: results from the population-based study KORA F4. Deutsche medizinische Wochenschrift (1946) 2014;139:317–322. doi: 10.1055/s-0033-1360046. [DOI] [PubMed] [Google Scholar]
- 13.Ristic-Medic D, Piskackova Z, Hooper L et al. Methods of assessment of iodine status in humans: a systematic review. The American journal of clinical nutrition. 2009;89:2052s–2069s. doi: 10.3945/ajcn.2009.27230H. [DOI] [PubMed] [Google Scholar]
- 14.Medici M, Ghassabian A, Visser W et al. Women with high early pregnancy urinary iodine levels have an increased risk of hyperthyroid newborns: the population-based Generation R Study. Clinical endocrinology. 2014;80:598–606. doi: 10.1111/cen.12321. [DOI] [PubMed] [Google Scholar]
- 15.Meng W, Scriba P C. Jodversorgung in Deutschland: Probleme und erforderliche Maßnahmen – Update 2002. Dtsch Arztebl International. 2002;99:2560. [Google Scholar]
- 16.Knudsen N, Bulow I, Jorgensen T et al. Comparative study of thyroid function and types of thyroid dysfunction in two areas in Denmark with slightly different iodine status. European journal of endocrinology. 2000;143:485–491. doi: 10.1530/eje.0.1430485. [DOI] [PubMed] [Google Scholar]
- 17.Hötzel D, Scriba P C. Jodversorgung in der Bundesrepublik Deutschland: Probleme und Lösungsmöglichkeiten. Vitamine, Mineralstoffe, Spurenelemente. 1987:25–33. [Google Scholar]
- 18.Anonym. Nationale Verzehrsstudie II. Ergebnisbericht, Teil 2: Die bundesweite Befragung zur Ernährung von Jugendlichen und Erwachsenen. 2008.
- 19.Thienpont L M, Van Uytfanghe K, Van Houcke S. Standardization activities in the field of thyroid function tests: a status report. Clinical chemistry and laboratory medicine. 2010;48:1577–1583. doi: 10.1515/cclm.2010.321. [DOI] [PubMed] [Google Scholar]


