Zusammenfassung
Digitale Interventionen (DI) zu gesundheitsbezogenen Themen gewinnen zunehmend an Bedeutung. Oftmals sind sie komplexe Interventionen, die in einem komplexen Versorgungskontext evaluiert und implementiert werden. Aufgrund der Merkmale digitaler Interventionen ist die Versorgungsforschung vor methodische Herausforderungen gestellt. Daher hat die Arbeitsgruppe Digital Health des Deutschen Netzwerks Versorgungsforschung (DNVF) ein Diskussionspapier erstellt. Darin wird diskutiert, welche Herausforderungen mit der Entwicklung und Evaluation von DI einhergehen. Es werden Lösungsansätze und zukünftige Forschungsbedarfe aufgezeigt.
Schlüsselwörter: Digital Health, digitale Interventionen, Evaluation, Implementierung, Versorgungsforschung, E-Health
Abstract
The development and application of digital interventions in health-related topics are gaining momentum in health service research. Digital interventions are often complex and need to be evaluated and implemented in complex settings. Due to their characteristics, this poses methodological challenges for health services research that have to be identified and addressed. Hence, the Working Group on Digital Health of the German Network for Health Services Research (DNVF) has prepared a discussion paper. This paper discusses methodological, practical and theoretical challenges associated with the development and evaluation of digital interventions from the perspective of health services research. Possible solutions are suggested and future research needs to address these methodological challenges are identified.
Key words: digital health, digital interventions, E-Health, evaluation, implementation, health services research
Einleitung
Die Entwicklung und Anwendung digitaler Interventionen (DI) zu gesundheitsbezogenen Themen gewinnen sowohl in der Forschung als auch in Politik und Gesellschaft zunehmend an Bedeutung 1 . Die Weltgesundheitsorganisation (WHO) definiert Digital Health Interventionen als “different ways in which digital and mobile technologies are being used to support health system needs.“ 2 . Die Anwendung von DI mit gesundheitlichem Bezug bzw. der Digitalisierung im Gesundheitswesen grundsätzlich, wird nicht als Selbstzweck verstanden, sondern sie dient dem Wohl der Patient*innen und Bürger*innen 3 .
Aus Perspektive der Versorgungsforschung ergeben sich verschiedene Herausforderungen im Kontext von DI: Erstens sind DI ein relevanter Gegenstand der Versorgungsforschung, da sie beispielsweise als komplexe Intervention für verschiedene Krankheitsbilder entwickelt, evaluiert und implementiert werden 4 5 . Zweitens stellen DI eine methodische, epistemologische und wissenschafts-ethische Herausforderung für die Evaluation – und damit einem der wichtigsten Betätigungsfelder der Versorgungsforschung – dar. Sie erfordern neue Analysemethoden, Datentypen und -quellen 4 5 .
Diese und weitere Herausforderungen bei der Evaluation 6 und Evidenzgenerierung 7 spiegeln sich in den Ergebnissen verschiedener Übersichtsarbeiten wider, die auf eine eingeschränkte bis moderate Evidenz hinweisen 8 9 . Dies bedeutet jedoch nicht, dass keine methodisch hochwertigen Studien durchgeführt wurden oder es keine Wirksamkeitsnachweise gibt 10 . Vielmehr sind bei der Vielzahl an Evaluationsstudien zu DI die methodischen Limitationen, wie meist geringe Fallzahlen, fast immer fehlende Verblindung, kurze Studiendauer sowie fehlende a priori veröffentlichte Studienprotokolle allgegenwärtig 11 .
Vor dem Hintergrund dieser Herausforderungen wird in diesem zweiteiligen Diskussionspapier aus Perspektive der Arbeitsgruppe Digital Health des Deutschen Netzwerks Versorgungsforschung (DNVF) erörtert, welche theoretischen, praktischen und methodischen Herausforderungen mit der Evaluation von DI einhergehen. Es werden Lösungsansätze und zukünftige Forschungsbedarfe zur Adressierung dieser Herausforderungen aufgezeigt.
In diesem ersten Teil werden die Merkmale und Anwendungsgebiete, die Besonderheiten bei der Entwicklung und der Einbindung von Nutzer*innen sowie die Besonderheiten bei der Evaluation von DI in den Mittelpunkt gestellt.
Eigenschaften und Anwendungsfelder digitaler Interventionen
Bislang besteht eine begriffliche Unklarheit in Bezug auf gesundheitsbezogene DI 1 . Dies hängt mit den vielfältigen beteiligten Disziplinen, Akteur*innen und Nutzer*innen und methodischen Zugangswegen 2 sowie mit der Dynamik der Digitalisierung im Gesundheitswesen zusammen 12 . Es bestehen vielfältige Begrifflichkeiten (z. B. E-Health, Gesundheitstelematik), deren Bedeutung sich im zeitlichen Verlauf zum Teil verändert hat oder aber Begriffe synonym verwendet werden. In Konsequenz lassen sich unter Digital Health zunächst alle Informations- und Kommunikationstechnologien (IKT) aus dem Gesundheitsbereich zusammenfassen 4 . Eine Abgrenzung ist jedoch mit Blick auf spezifische Anwendungsbereiche, -formate oder -ziele möglich 13 14 .
Die WHO differenziert den Einsatz und Nutzen von DI für verschiedene Gruppen: 1) Nutzer*innen (Klient*innten oder Patient*innen) entsprechender Anwendungen, 2) Professionelle aus dem Gesundheitswesen, 3) mit Gesundheitsschutz, Prävention und Gesundheitsmanagement beauftragte Abteilungen bzw. Organisationen (z. B. Öffentlicher Gesundheitsdienst) sowie 4) Anbieter*innen bzw. Institutionen zur Sammlung, Auswertung und Darstellung gesundheitsbezogener Daten 2 .
DI mit spezifischer Ausrichtung auf medizinische Versorgung sind der Telemedizin zuzuordnen. Diese wiederum kann hinsichtlich des medizinischen Fachgebiets (z. B. Telekardiologie, Teleradiologie) oder der genutzten Form der Anwendung (z. B. Telekonsultation, Telemonitoring) differenziert werden 15 . Telemedizin nutzt (1) IKT, (2) um eine Distanz zu überbrücken und (3) durch Leistungserbringende bei Patient*innen eine Versorgung (oder Schulung) durchzuführen 14 . Anwendungen im Bereich der psychiatrischen und psychotherapeutischen Versorgung werden mittlerweile auch als Ecological Momentary Interventions (EMIs) 16 , Just in Time Adaptive Interventions (JITAIs) 17 oder Internetgestützte und Mobilbasierte Interventionen (IMI) 18 bezeichnet. Weitere Bereiche stellen DI dar, die im Kontext von Prävention und Gesundheitsförderung eingesetzt werden 19 . Unter dem Einsatz mobiler gesundheitsbezogener Technologien (mHealth) ermöglichen Apps oder Sensoren im Smartphone das Bewegungs- oder Ernährungsverhalten kontinuierlich zu messen und zu beobachten. Diese Angebote haben in den letzten Jahren durch die Entwicklung von Gesundheits- bzw. Lifestyle-Apps und durch zertifizierte Medizin-Apps an Bedeutung zugenommen 4 .
Mit dem Digitale-Versorgung-Gesetz besteht die Möglichkeit, digitale Gesundheitsanwendungen (DiGA) auf Rezept zu verordnen. Bei DiGAs handelt es sich um Medizinprodukte (MP) niedriger Risikoklasse, deren Hauptfunktion wesentlich auf digitalen Technologien beruht (§ 33a Abs. 1 SGB V). Diese durchlaufen einen Begutachtungs- und Erprobungsprozess unter Aufsicht des Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), welcher als zügiger Fast-Track konzipiert ist.
Zusätzlich zu der Heterogenität von DI ist auch zu berücksichtigen, dass diese vielfach aus mehreren (teilweise interdependenten) Einzelkomponenten bestehen 20 und nicht solitär, sondern in Kombination mit weiteren (nicht-digitalen) Komponenten eingesetzt werden. Da viele DI zeit- und ortsunabhängig genutzt werden können 15 entfalten sie ihre Wirkung durch die Integration in komplexe soziale Systeme und Lebenswelten 21 22 . Somit sind DI selbst komplexe Interventionen oder zumindest in ebensolche eingebettet 19 . Dies hat Einfluss auf die Planung, Durchführung, Analyse und Interpretation von Evaluationen. 19 20
Entwicklung digitaler Interventionen
Die Entwicklung von DI ist komplex und planungsintensiv, insbesondere wenn ein Übergang in die Regelversorgung angestrebt wird. Hierbei besteht ein Spannungsfeld zwischen den Bedarfen und Wünschen zukünftiger Nutzer*innengruppen und dem technisch Möglichen 23 . Diesen Herausforderungen kann mit einem iterativen, nutzer*innenzentrierten und partizipativen Entwicklungsprozess begegnet werden 25 . Dieser orientiert sich an der ISO 9241–210:2019 und ist in vier Phasen untergliedert 25 . Mehrheitlich wird dieser Prozess mit dem Begriff User-Centered-Design bezeichnet, z.T. auch als Stakeholder-Centred Design.
Kontextanalyse: Zu Beginn erfolgt die Analyse des Versorgungs-Kontextes einer DI und wer die Nutzer*innengruppen mit ihren objektiven Bedarfen und subjektiven Bedürfnissen sind. Die multidisziplinäre Kontextanalyse ist essentiell, da sich Strukturen und Prozesse durch die Implementierung von DI stark verändern können 24 . In der Entwicklungsphase kommen vor allem qualitative (z. B. Fokusgruppen) und quantitative Erhebungsmethoden (z. B. Fragebogenerhebungen) sowie Feldbeobachtungen zum Einsatz 25 . Aber auch die Auswertung von Routinedaten kann wertvolle Hinweise liefern. Zu einer umfassenden Kontextanalyse gehört eine Prüfung, welche DI oder Interventionskomponenten bereits existieren. Hierdurch werden Doppelentwicklungen vermieden und es wird an bereits existierende Entwicklungen angeknüpft.
Anforderungsanalyse: Im zweiten Schritt werden die Anforderungen der Nutzer*innen an die DI definiert. Hierzu kommen u. a. Methoden wie sog. Personas (Nutzer*innenmodelle, die die Zielgruppe beschreiben) oder use cases (Beschreibung des Verhaltens eines Systems aus Anwender*innensicht) zum Einsatz 26 .
Gestaltung: Erst im Anschluss an die Analysen erfolgt der eigentliche Designprozess, u. a. mit Mock-ups (Anschauungsmodellen) und Card Sorting (Verfahren zur Entwicklung von Navigations- und Menüstrukturen), bis zum Prototypen 27 .
Evaluation : Nachdem Prototypen erstellt wurden, erfolgt eine erste formative Evaluation durch die potentiellen Nutzer*innen. Erfasst werden hier unter anderem die Effektivität und Effizienz sowie die allgemeine Zufriedenheit 24 . Hier kommen z. B. Usability-Tests (Test der Gebrauchstauglichkeit), Cognitive Walkthroughs (Evaluation eines Systems/Produkts aus Nutzer*innensicht durch Expert*innen) oder Thinking Aloud-Techniken (Methode zur Erfassung kognitiver Vorgänge bei der Bearbeitung von Testaufgaben) zum Einsatz 28 . Mit den Informationen aus der Evaluation wird die DI modifiziert und optimiert, anschließend erfolgt eine erneute Iteration der Evaluation ( Abb. 1 ) 25 .
Abb. 1.
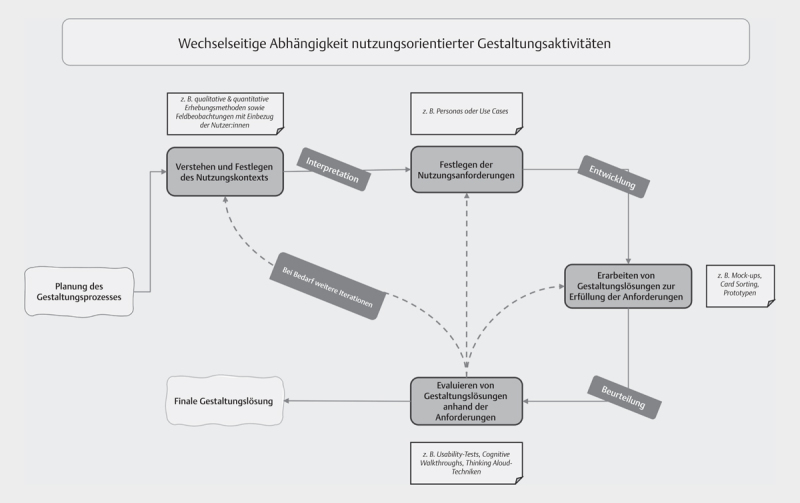
Wechselseitige Abhängigkeit nutzungsorientierter Gestaltungsaktivitäten (Eigene Darstellung nach 24 ).
Neben dieser vorrangig produktzentrierten Evaluation sollte bei DI eine versorgungszentrierte Evaluation erfolgen. Hierbei sollten sowohl Prozess- als auch Ergebnisparameter unter Berücksichtigung medizinischer, technischer, sozialer und ökonomischer Aspekte einfließen 29 . Die Wahl der hierfür passenden Outcomes und Methoden hängt vom Entwicklungsstand/Reifegrad der Intervention ab 29 30 . Beispielsweise sind in frühen Phasen der Entwicklung von DI eher akzeptanzorientierte Outcomes relevant, die oftmals mit qualitativen Methoden ermittelt werden. Hingegen sind in späteren Phasen eher Outcomes relevant, mit denen die Effektivität der Wirkung durch durch quantitative Methoden ermittelt werden (eine Vertiefung findet sich im nachfolgenden Absatz sowie in Teil II des Diskussionsartikels). Bei der Wahl der Methode sollte das der Risikostufe angemessene höchstmögliche Evidenzlevel gewählt werden 29 31 .
Ein Einbezug potentieller Nutzer*innengruppen sowie weiterer relevanter Akteur*innen, Interessengruppen und Entscheidungsträger von Anfang an ist eine wesentliche Voraussetzung für eine hohe Akzeptanz und damit die Wirksamkeit und nachhaltige Entwicklung und Implementierung von DI. Haupteinflussfaktoren der Akzeptanz sind entsprechend der etablierten Technologieakzeptanzmodelle, wie etwa der Unified Theory of Acceptance and Use of Technology oder Technology Acceptance Model, die empfundene Einfachheit der Nutzung sowie die empfundene Nützlichkeit/Zusatznutzen 32 . Ein Blick auf die aktuelle Studienlage zeigt jedoch, dass ein solches Vorgehen bei der Entwicklung digitaler Interventionen noch nicht die Regel ist. Ein Review von Maramba et al. 33 ergab, dass Usability-Studien nur für einen Teil der verfügbaren DI veröffentlicht sind. Zudem wurden bei der Mehrheit der eingeschlossenen Studien lediglich ein oder zwei Methoden im Rahmen der Evaluation eingesetzt, und zwar vorrangig quantitative Erhebungsmethoden. Dies restringiert eine umfassende Beurteilung und Berücksichtigung der Nutzer*innenanforderungen. Überdies fand bei der Mehrheit der Studien lediglich ein Iterationszyklus statt.
Ergänzend hierzu sollte bei der Entwicklung von DI von Beginn an eine potentielle Zertifizierung als MP und ein Übergang in die Regelversorgung berücksichtigt werden (siehe hierzu Teil II des Diskussionsartikels).
Evaluation digitaler Interventionen
Der Goldstandard für den Nutzennachweis von Interventionen sind prospektive randomisiert kontrollierte Studien (RCT) 34 . Sie stoßen aufgrund der genuinen Merkmale von DI teilweise an ihre Grenzen 35 . Die Durchführung von RCTs setzt das Vorhandensein einer stabilen, inhaltlich ausgereiften Intervention 36 sowie ein hohes Maß an Standardisierung externer Faktoren bzw. deren Adjustierung gegenüber Verzerrungen voraus 34 . Es sollte eine begründete Annahme bestehen, dass die Intervention mit einer hohen Wiedergabetreue (delivery) durchgeführt werden kann und dass ein bedeutsamer und theoretisch begründbarer klinischer Effekt zu erwarten ist 6 . Häufig werden Evaluationsstudien zu DI nicht als RCT durchgeführt 7 37 , sondern lediglich im Pre-Post-Design 35 . Darüber hinaus werden die in systematischen Übersichtsarbeiten eingeschlossenen RCTs oftmals mit einer geringen bis moderaten Qualität bewertet 7 38 . Faktoren, welche die Validität von RCT zu DI zusätzlich einschränken, sind kurze Beobachtungs- bzw. Interventionszeiträume 39 und hohe Drop-out-Raten 35 40 . Gründe für letzteres sind u. a., dass die Zugehörigkeit zu einer Kontrollgruppe eher als bei anderen Interventionen auffällt und insbesondere redundante Inhalte auf Dauer frustrierend wirken können 41 . Die Durchführung von RCTs wird zusätzlich dadurch erschwert, dass eine Verblindung für Nutzer*innen und Leistungserbringer*innen, schwierig zu realisieren ist 42 . Es besteht jedoch die Möglichkeit, mit reduzierten Varianten der DI (oder auch einer funktionslosen Scheinapp) in der Kontrollgruppe zu operieren 43 . Die Nutzung einer Scheinapp reduziert hierbei zudem den potentiellen Einfluss des digitalen Placebo-Effekts und die Dropoutraten, da beide Gruppen eine digitale Intervention erhalten 44 .
In Bezug auf die Charakteristika von RCT im Kontext DI wird kritisiert, dass diese mit den besonderen Merkmalen von DI schwer vereinbar sind 45 . Adaptive Studiendesigns, die ein größeres Maß an Variabilität und Individualisierung ermöglichen und der Entwicklungsdynamik gerecht werden, gelangen zunehmend in die Diskussion 3 46 . Ein Merkmal adaptiver Studiendesigns ist, dass während der Durchführung Interimsanalysen durchgeführt werden, die zu einer (a priori geplanten) Adaption führen. Anpassungen, die nach einer solchen Interimsanalyse vorgenommen werden können, sind die Adjustierung der Stichprobengröße oder des Zuweisungsverhältnisses zwischen Studienarmen 46 . In diesem Kontext sind auch sog. Drop-the-Loser-Designs zu nennen, bei denen während der Interimsanalyse nachweislich ineffektive Interventionskomponenten aus weiteren Analysen ausgeschlossen werden 47 . Werden digitale Interventionen in der Regelversorgung, etwa in mehreren Kliniken, getestet, so ist auch eine Cluster-Randomisierung der Kliniken statt individueller Randomisierung denkbar, welche zudem systematischen Bias aufgrund der Clusterzugehörigkeit ausschließt 48 . Die Frustration darüber, in der Kontrollgruppe gelandet zu sein, wird in Stepped-Wegde-Designs vermieden, in dem Proband:innen zu einem definierten Zeitpunkt von der Kontroll- in die Interventionsgruppe wechseln können 49 . Auch wenn hierbei eine Verblindung nicht durchzuhalten ist, können Stepped-Wegde-Designs dazu beitragen Dropoutraten zu minimieren 50 . Eine weitere Alternative bilden Studiendesigns, welche eine historische Kontrollgruppe, z. B. auf Basis der Abrechnungsdaten von Krankenkassen oder Daten aus krankheitsrelatierten Registern, bilden 51 .
Weitere alternative Studiendesigns , wie etwa „Continuous Evaluation of Evolving Behavioral Intervention Technologies“ (CEEBIT), „Multiphase Optimization Strategy“ (MOST), Sequential Multiple Assignment Randomized Trial‘‘ (SMART) und „Micro-Randomized Trial“ (MRT) werden ebenso diskutiert 45 . Es besteht die Ansicht, dass diese jedoch als nicht hinreichend für Wirksamkeits- und Nutzenbewertungen von DI angesehen werden, da sie nicht in der Lage sind einen der RCT vergleichbaren Evidenzgrad zu generieren 45 . Neben alternativen Studiendesigns ist eine stärkere Einbindung qualitativer Methoden in Parallelgruppen-Designs nützlich. Fokusgruppen vor und nach dem Abschluss von Interventionen könnten sich eignen, qualitative Veränderungen des medizinischen Nutzens (u. a. Gesundheitszustand und Lebensqualität) oder der Nutzenerwartung, etwa in Form von Patient-Reported Outcome Measure `(PROMs) und Patient Reported Experience Measures (PREMs), sowie hemmende und fördernde Faktoren der DI aus Sicht der Nutzer*innen abzubilden 52 . Dies kann auch im Rahmen von Prozessevaluationen und mit Hilfe von Mixed-Methods-Designs geschehen.
Zudem sollten die Qualität und Wirkung von DI auch nach der Entwicklung und Implementation betrachtet werden, so wie es bei MPs gefordert wird (Post-Market-Surveillance) 3 53 . Jedoch ist es auch für DI, die nicht als MP vorgesehen oder bereits zertifiziert sind, sinnvoll ein Monitoring der Wirkung und Qualität durchzuführen.
Obwohl RCTs der Goldstandard für die Wirksamkeitsprüfung von Interventionen im Gesundheitswesen sind, scheint bei der Vielzahl eine systematische Nutzenbewertung aller DI durch RCTs kaum praktikabel. Entscheidend sind die intendierten Funktionalitäten und das damit einhergehende Verhältnis von Nutzen und Schaden 54 . Das National Institute for Health and Care Excellence (NICE) hat hierzu das Evidence Standards Framework for Digital Health Technologies veröffentlicht (NICE-Framework), in dem DI nach Schaden- und Nutzenverhältnis in drei Evidenzstufen eingeordnet werden 31 .
Zusammenfassend lässt sich derzeit festhalten, dass RCTs noch immer als Goldstandard für den Nutzennachweis gelten. Für alternative Studiendesigns gilt, dass weitere Erfahrungen gesammelt werden müssen und deren Anwendung im Kontext von DI weiterzuentwickeln sind. Eine Erwägung alternativer Studiendesigns wird im Gutachten „Digitalisierung für Gesundheit“ des Sachverständigenrates zur Begutachtung der Entwicklung im Gesundheitswesen empfohlen und entsprechende Designs beschrieben 3 . Da adaptive Studiendesigns bis heute nur selten genutzt werden, ist zukünftig ebenso zu eruieren, wie sie zum Einsatz kommen können, ohne Abstufungen des Evidenzlevels in Kauf zu nehmen 55 . Das NICE-Framework kann für den deutschen Kontext ein Good-Practice-Beispiel darstellen 31 42 .
Schlussbetrachtung
Ziel dieses ersten Teils des Diskussionsartikels war es, aus Sicht der Versorgungsforschung zu diskutieren, welche Herausforderungen bei der Entwicklung und Evaluation von DI aufgrund deren spezifischen Eigenschaften existieren sowie Lösungsansätze und zukünftige Forschungsbedarfe aufzuzeigen.
Versorgungsforschung hat als Ziel, die Forschung zu Versorgungsstrukturen und Versorgungsprozessen in tatsächlichen und alltäglichen Abläufen zu adressieren 56 . Daraus folgt, dass eine kontinuierliche Auseinandersetzung mit der Evaluation von DI unabdingbar ist. Insbesondere die Komplexität sowie die spezifischen Möglichkeiten und Herausforderungen von DI stellen besondere Anforderungen an die Evaluation von DI. Betrachtet man jedoch die Empfehlungen zur Entwicklung und Evaluation komplexer Interventionen, so adressieren diese die diskutierten besonderen Eigenschaften von DI noch nicht hinreichend genug 6 57 .
In dem zweiten Teil des Diskussionsartikels werden weiterer Themenfelder diskutiert, die von Relevanz bei der Evaluation von DI sind. Hierzu zählen die Auswahl von Outcomes bei der Evaluation, dem Reporting von Studienergebnissen, der Synthese der Evidenz sowie der Implementierung von DI in den Versorgungsalltag.
Footnotes
Interessenkonflikt Die Autorinnen/Autoren geben an, dass kein Interessenkonflikt besteht.
Literatur
- 1.Zeeb H, Pigeot I, Schüz B. Digital Public Health – ein Überblick. Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz. 2020;63:137–144. doi: 10.1007/s00103-019-03078-7. [DOI] [PubMed] [Google Scholar]
- 2.WHO. Classification of Digital Health Interventions v1.0A shared language to describe the uses of digital technology for health [Internet]. 2018. Available from:http://apps.who.int/iris/bitstream/handle/10665/260480/WHO-RHR-18.06-eng.pdf;jsessionid=E06A96F29EE14D51614B4C25590A04D7?sequence=1
- 3.SVR-Gesundheit. Digitalisierung für Gesundheit Ziele und Rahmenbedingungen eines dynamisch lernenden Gesundheitssystems [Internet]. 2021. Available from:https://www.svr-gesundheit.de/fileadmin/Gutachten/Gutachten_2021/SVR_Gutachten_2021_online_.pdf
- 4.Kramer U, Borges U, Fischer F et al. DNVF-Memorandum – Gesundheits- und Medizin-Apps (GuMAs) Das Gesundheitswesen. 2019;81:e154–e170. doi: 10.1055/s-0038-1667451. [DOI] [PubMed] [Google Scholar]
- 5.Vollmar H, Kramer U, Müller H et al. Digitale Gesundheitsanwendungen – Rahmenbedingungen zur Nutzung in Versorgung, Strukturentwicklung und Wissenschaft – Positionspapier der AG Digital Health des DNVF. Das Gesundheitswesen. 2017;79:1080–1092. doi: 10.1055/s-0043-122233. [DOI] [PubMed] [Google Scholar]
- 6.Murray E, Hekler E B, Andersson G et al. Evaluating Digital Health Interventions Key Questions and Approaches. Am J Prev Med. 2016;51:843–851. doi: 10.1016/j.amepre.2016.06.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Byambasuren O, Sanders S, Beller E et al. Prescribable mHealth apps identified from an overview of systematic reviews. Npj Digital Medicine. 2018;1:12. doi: 10.1038/s41746-018-0021-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Kolasa K, Kozinski G. How to Value Digital Health Interventions? A Systematic Literature Review. Int J Environ Res Pu. 2020;17:2119. doi: 10.3390/ijerph17062119. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Tokgöz P, Hrynyschyn R, Hafner J et al. Digital health interventions in prevention, relapse, and therapy of mild and moderate depression: scoping review. JMIR Mental Health. 2021;8(04):e26268. doi: 10.2196/26268. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Mathews S, D’Arcey J, Tokgöz P et al. Digital Health Interventions in Prevention, Relapse, and Therapy of Mild and Moderate Depression: Scoping Review. Jmir Ment Heal. 2021;8:e26268. doi: 10.2196/26268. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Timpel P, Oswald S, Schwarz PE H et al. Mapping the Evidence on the Effectiveness of Telemedicine Interventions in Diabetes, Dyslipidemia, and Hypertension: An Umbrella Review of Systematic Reviews and Meta-Analyses. J Med Internet Res. 2020;22:e16791. doi: 10.2196/16791. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Shaw T, McGregor D, Brunner M et al. What is eHealth (6)? Development of a Conceptual Model for eHealth: Qualitative Study with Key Informants. J Med Internet Res. 2017;19:e324. doi: 10.2196/jmir.8106. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.WHO. National eHealth Strategy ToolkitOverview [Internet]. 2012. Available from:https://www.who.int/ehealth/publications/overview.pdf
- 14.Otto L, Harst L, Schlieter H et al. Towards a Unified Understanding of eHealth and Related Terms – Proposal of a Consolidated Terminological Basis. Proc 11th Int Jt Conf Biomed Eng Syst Technologies. 2018:533–539. [Google Scholar]
- 15.Fischer F, Aust V, Krämer A. eHealth in Deutschland, Anforderungen und Potenziale innovativer Versorgungsstrukturen. 2016:3–23. [Google Scholar]
- 16.Reininghaus U. Ambulatorische Interventionen in der Psychiatrie: das Momentum f?r Ver?nderung im allt?glichen sozialen Kontext. Psychiat Prax. 2018;45:59–61. doi: 10.1055/s-0044-101986. [DOI] [PubMed] [Google Scholar]
- 17.Nahum-Shani I, Smith S N, Spring B J et al. Just-in-Time Adaptive Interventions (JITAIs) in Mobile Health: Key Components and Design Principles for Ongoing Health Behavior Support. Ann Behav Med. 2016;52:1–17. doi: 10.1007/s12160-016-9830-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Lin J, Baumeister H. Internet- und Mobilebasierte Interventionen in der Psychotherapie. Public Heal Forum. 2015;23:176–179. [Google Scholar]
- 19.Fischer F. Digitale Interventionen in Prävention und Gesundheitsförderung: Welche Form der Evidenz haben wir und welche wird benötigt? Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz. 2020:1–7. doi: 10.1007/s00103-020-03143-6. [DOI] [PubMed] [Google Scholar]
- 20.Mühlhauser I, Lenz M, Meyer G.Bewertung von komplexen Interventionen: Eine methodische Herausforderung. 2012; 109 (1–2): A-22. Available from:https://www.aerzteblatt.de/int/article.asp?id=118129 [DOI] [PubMed]
- 21.Robert-Koch-Institut, Lebensmittelsicherheit BL für G und. Evaluation komplexer Interventionsprogramme in der Prävention: Lernende Systeme, lehrreiche Systeme? [Internet]. 2012. Available from:https://www.rki.de/DE/Content/Gesundheitsmonitoring/Gesundheitsberichterstattung/GBEDownloadsB/evaluation_praevention.pdf?__blob=publicationFile
- 22.Koppe G, Guloksuz S, Reininghaus U et al. Recurrent Neural Networks in Mobile Sampling and Intervention. Schizophrenia Bull. 2018;45:272–276. doi: 10.1093/schbul/sby171. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Dockweiler C, Razum O. Digitalisierte Gesundheit: neue Herausforderungen f?r Public Health. Das Gesundheitswesen. 2015;78:5–7. doi: 10.1055/s-0041-110679. [DOI] [PubMed] [Google Scholar]
- 24.ISO. ISO 9241-210:2019(en) Ergonomics of human-system interaction — Part 210: Human-centred design for interactive systems [Internet]. 2019. Available from:https://www.iso.org/obp/ui/#iso:std:iso:9241:-210:ed-2:v1:en
- 25.Diekmann A. 2020. [DOI] [PMC free article] [PubMed]
- 26.Goodman E, Kuniavsky M, Moed A. 2012.
- 27.Sherwin K.Card Sorting: Uncover Users’ Mental Models for Better Information Architecture. 2018; Available from:https://www.nngroup.com/articles/card-sorting-definition/
- 28.Baxter K, Courage C, Caine K. Understanding your Users. A Practical Guide to User Research Methods. 2015.
- 29.Arnold K, Scheibe M, Müller O et al. Principles for the evaluation of telemedicine applications: Results of a systematic review and consensus process. Zeitschrift Für Evidenz Fortbildung Und Qual Im Gesundheitswesen. 2016;117:9–19. doi: 10.1016/j.zefq.2016.04.011. [DOI] [PubMed] [Google Scholar]
- 30.Kowatsch T, Otto L, Harperink S et al. A design and evaluation framework for digital health interventions. Information Technology. 2020;61:253–263. [Google Scholar]
- 31.NICE. Evidence standards framework for digital health technologies. 2019. https://www.nice.org.uk/corporate/ecd7
- 32.Venkatesh V, Morris M, Davis G et al. User acceptance of information technology: Toward a unified view. MIS Quarterly. 2003;27:425–478. [Google Scholar]
- 33.Maramba I, Chatterjee A, Newman C. Methods of usability testing in the development of eHealth applications: A scoping review. Int J Med Inform. 2019;126:95–104. doi: 10.1016/j.ijmedinf.2019.03.018. [DOI] [PubMed] [Google Scholar]
- 34.Peiris D, Miranda J J, Mohr D C. Going beyond killer apps: building a better mHealth evidence base. Bmj Global Heal. 2018;3:e000676. doi: 10.1136/bmjgh-2017-000676. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Guo C, Ashrafian H, Ghafur S et al. Challenges for the evaluation of digital health solutions – A call for innovative evidence generation approaches. Npj Digital Medicine. 2020;3:110. doi: 10.1038/s41746-020-00314-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Henderson M, Donnachie C. Improving eHealth intervention development and quality of evaluations. The Lancet Digital Health. 2019;1:e194–e195. doi: 10.1016/S2589-7500(19)30106-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Pawloski P A, Brooks G A, Nielsen M E et al. A Systematic Review of Clinical Decision Support Systems for Clinical Oncology Practice. J Natl Compr Canc Ne. 2019;17:331–338. doi: 10.6004/jnccn.2018.7104. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Champion K E, Parmenter B, McGowan C et al. Effectiveness of school-based eHealth interventions to prevent multiple lifestyle risk behaviours among adolescents: a systematic review and meta-analysis. Lancet Digital Heal. 2019;1:e206–e221. doi: 10.1016/S2589-7500(19)30088-3. [DOI] [PubMed] [Google Scholar]
- 39.Vilardaga R, Casellas-Pujol E, McClernon J F et al. Mobile Applications for the Treatment of Tobacco Use and Dependence. Curr Addict Reports. 2019;6:86–97. doi: 10.1007/s40429-019-00248-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Linardon J, Fuller-Tyszkiewicz M. Attrition and Adherence in Smartphone-Delivered Interventions for Mental Health Problems: A Systematic and Meta-Analytic Review. J Consult Clin Psych. 2019;88:1–13. doi: 10.1037/ccp0000459. [DOI] [PubMed] [Google Scholar]
- 41.Reinhardt G, Schwarz P E, Harst L.Non-use of telemedicine: A scoping review Health Inform J. 20212714604582211043148 [DOI] [PubMed] [Google Scholar]
- 42.Neugebauer EA M, Rath A, Antoine S-L et al. Specific barriers to the conduct of randomised clinical trials on medical devices. Trials. 2017;18:427. doi: 10.1186/s13063-017-2168-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Timpel P, Cesena FH Y, da Silva Costa C et al. Efficacy of gamification-based smartphone application for weight loss in overweight and obese adolescents: study protocol for a phase II randomized controlled trial. Ther Adv Endocrinol Metabolism. 2018;9:167–176. doi: 10.1177/2042018818770938. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Stalujanis E, Neufeld J, Stalder M G et al. Induction of Efficacy Expectancies in an Ambulatory Smartphone-Based Digital Placebo Mental Health Intervention: Randomized Controlled Trial. Jmir Mhealth Uhealth. 2021;9:e20329. doi: 10.2196/20329. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Gensorowsky D, Lampe D, Hasemann L et al. „Alternative Studiendesigns“ zur Bewertung digitaler Gesundheitsanwendungen – eine echte Alternative? Zeitschrift Für Evidenz Fortbildung Und Qual Im Gesundheitswesen. 2021;161:33–41. doi: 10.1016/j.zefq.2021.01.006. [DOI] [PubMed] [Google Scholar]
- 46.Pallmann P, Bedding A W, Choodari-Oskooei B et al. Adaptive designs in clinical trials: why use them, and how to run and report them. Bmc Med. 2018;16:29. doi: 10.1186/s12916-018-1017-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Chen YH J, DeMets D L, Lan KK G. Some drop-the-loser designs for monitoring multiple doses. Stat Med. 2010;29:1793–1807. doi: 10.1002/sim.3958. [DOI] [PubMed] [Google Scholar]
- 48.Puffer S, Torgerson D J, Watson J. Cluster randomized controlled trials. J Eval Clin Pract. 2005;11:479–483. doi: 10.1111/j.1365-2753.2005.00568.x. [DOI] [PubMed] [Google Scholar]
- 49.Hussey M A, Hughes J P. Design and analysis of stepped wedge cluster randomized trials. Contemp Clin Trials. 2007;28:182–191. doi: 10.1016/j.cct.2006.05.007. [DOI] [PubMed] [Google Scholar]
- 50.Beard E, Lewis J J, Copas A et al. Stepped wedge randomised controlled trials: systematic review of studies published between 2010 and 2014. Trials. 2015;16:353. doi: 10.1186/s13063-015-0839-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.(BfArM) B für A und M. DiGA-Verzeichnis [Internet]. 2021. Available from:https://diga.bfarm.de/de
- 52.Ekeland A G, Bowes A, Flottorp S. Methodologies for assessing telemedicine: A systematic review of reviews. Int J Med Inform. 2012;81:1–11. doi: 10.1016/j.ijmedinf.2011.10.009. [DOI] [PubMed] [Google Scholar]
- 53.Wilson K, Bell C, Wilson L et al. Agile research to complement agile development: a proposal for an mHealth research lifecycle. Npj Digital Medicine. 2018;1:46. doi: 10.1038/s41746-018-0053-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Angelescu K, Sauerland S.Mobile Gesundheitsanwendungen: Welche Evidenz ist n-tig? Dtsch Arztebl International [Internet] 2019116A-1057 Available from:https://www.aerzteblatt.de/int/article.asp?id=207821 [Google Scholar]
- 55.Dick S, O’Connor Y, Heavin C. Approaches to Mobile Health Evaluation: A Comparative Study A mHealth Evaluation Comparison Study. Inform Syst Manage. 2019;37:1–18. [Google Scholar]
- 56.Philipp S-P.Digitalisierung der Versorgungsforschung – Versorgungsforschung zur Digitalisierung. In Berlin, Heidelberg Springer; Berlin Heidelberg: 2019. p175–184. [Google Scholar]
- 57.Moore G F, Evans R E, Hawkins J et al. From complex social interventions to interventions in complex social systems: Future directions and unresolved questions for intervention development and evaluation. Evaluation-us. 2019;25:23–45. doi: 10.1177/1356389018803219. [DOI] [PMC free article] [PubMed] [Google Scholar]


