Introducción
La hidatidosis es una infección parasitaria producida por el cestodo Echinococcus granulosus, endémica en algunas regiones de América Latina1. Sus localizaciones más frecuentes son el hígado y el pulmón, siendo muy rara la presentación cardiaca (0.5-2% de los casos), la cual puede ser altamente mortal2. Las características clínicas varían desde la presentación asintomática hasta la manifestación de complicaciones como rotura del quiste con embolia a distintos órganos, anafilaxia e incluso la muerte3. Presentamos un caso inusual de hidatidosis cardiaca complicada con embolia cerebral.
Presentación del caso
Mujer de 50 años procedente de Perú, con antecedente familiar de hidatidosis pulmonar, que ingresa a emergencia por trastorno del sensorio y déficit motor derecho, sin manifestaciones cardiovasculares asociadas. En la exploración física se encuentra hiporreactiva, escala de coma de Glasgow 10/15, bradipsiquia, bradilalia, hemiparesia derecha y Babinski (+) homolateral; presión arterial 134/70 mmHg y frecuencia cardiaca 58 latidos por minuto. A la auscultación, ruidos cardiacos rítmicos, sin soplos ni roce pericárdico. Exámenes complementarios: hemoglobina 17 g/dl (valores normales [VN]: 11.2-15.7 g/dl], leucocitos 10,240/(VN: 3980-10,040/), segmentados 85.5% (VN: 34-71.1%), eosinófilos 0.1% (VN: 0.7-5.8%), plaquetas 329,000/(VN: 182,000-369,000/), glucosa 133 mg/dl (VN: 70-110 mg/dl) y urea 32 mg/dl (VN: 10-50 mg/dl).
La tomografía computarizada (TC) espiral cerebral reveló múltiples imágenes hipodensas intraparenquimales, en número de ocho. La resonancia magnética (RM) cerebral mostró estructuras quísticas múltiples, hipointensas en ambos hemisferios cerebrales en T1 e hiperintensas en T2 (Fig. 1A). La TC espiral de tórax reveló una estructura intracardiaca hipodensa localizada en el interior del ventrículo izquierdo sin lesiones asociadas a nivel pulmonar; complementada con TC espiral de abdomen y pelvis, no se evidenció compromiso en otro órgano. Se realizó ecocardiografía transtorácica, que mostró una masa hiperecogénica de 42 × 20 mm con múltiples vesículas en su interior ubicada en la pared lateral del ventrículo izquierdo, asociada a hipocinesia de las regiones anterior y lateral. Función sistólica del ventrículo izquierdo preservada, con fracción de eyección ventricular izquierda (FEVI) del 67%. El electrocardiograma mostró ritmo sinusal y ondas T negativas en DI-AVL sin evidencia de arritmias (Fig. 2).
Figura 1.
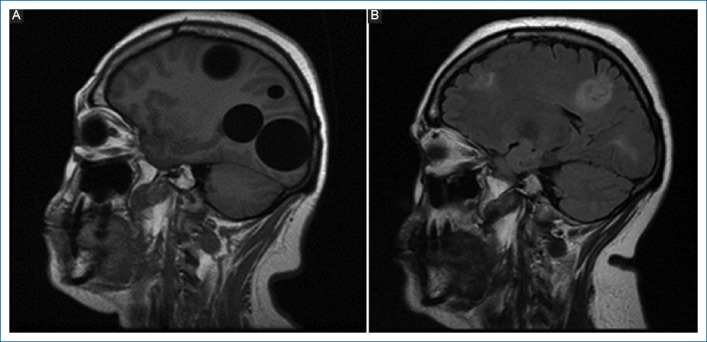
A: resonancia magnética cerebral en T1 que evidencia múltiples imágenes hipointensas univesiculares. B: resonancia magnética cerebral en T2 tras la cirugía en la que se observan las cicatrices de la exéresis de los quistes hidatídicos.
Figura 2.
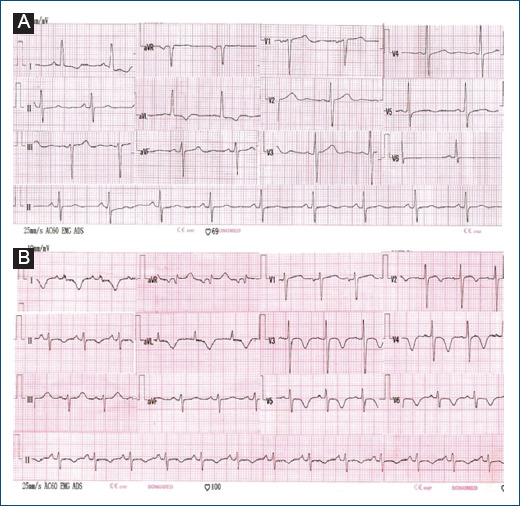
A: electrocardiograma, previo a la cirugía, con ritmo sinusal y signos de sobrecarga ventricular izquierda (ondas T negativas asimétricas en I y aVL), sin signos de isquemia. B: electrocardiograma posquirúrgico, con ritmo sinusal y ondas T negativas simétricas en las derivadas precordiales V2-V6, DI-II y aVL.
La RM cardiaca reveló una imagen multivesicular isointensa rodeada por un delgado anillo, envuelta por una capa gruesa hipointensa ocasionada por la reacción inflamatoria en la pared lateral del ventrículo izquierdo en T1; asimismo, en T2 se distinguió una estructura hiperintensa, y en secuencia FIESTA (Fast Imaging Employing Steady-State Acquisition) se evidenciaron con mejor resolución las múltiples vesículas en el interior del quiste (Fig. 3A). Se realizó la prueba Western Blot para hidatidosis, que resultó positiva.
Figura 3.
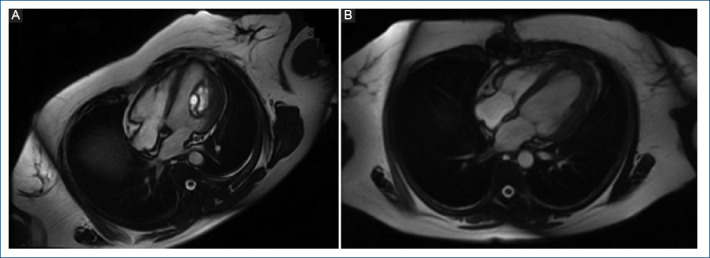
A: resonancia magnética cardiaca, plano de cuatro cámaras en secuencia FIESTA, previo a la cirugía, que muestra una estructura hiperintensa con múltiples vesículas hijas en su interior, con características de quiste hidatídico cardiaco adherido a la pared lateral del ventrículo izquierdo. B: resonancia magnética cardiaca, plano de cuatro cámaras en secuencia FIESTA, tras la cirugía, que muestra el ventrículo izquierdo sin presencia de quiste.
La paciente fue sometida a craneotomía de emergencia para extracción de quistes cerebrales (Fig. 4) y se pautó albendazol 400 mg dos veces al día. La evolución neurológica posoperatoria fue favorable, mejorando el estado del sensorio: lúcida, orientada en tiempo, espacio y persona, escala de coma de Glasgow 15/15, sin presencia de déficit motor. Corroborado con la RM cerebral de control (Fig. 1B). Cinco meses después se realizó una RM cardiaca de control que mostró la persistencia del quiste en el ventrículo izquierdo, de iguales dimensiones pero con mayor reacción tisular, por lo que fue sometida a cirugía cardiaca con la técnica de punción-aspiración, lavado con solución hipertónica y plicatura de la cápsula quística al ventrículo izquierdo. La evolución posoperatoria fue satisfactoria. El electrocardiograma de control mostró ritmo sinusal y ondas T negativas V2-V6. El ecocardiograma evidenció FEVI del 65%, motilidad global y segmentaria conservada, y aparato valvular preservado. Posteriormente se realizó otra RM cardiaca de control al tercer mes posoperatorio, que mostró un área de cicatriz en la cara anterior y lateral del ventrículo izquierdo sin evidencia de masas en su interior (Fig. 3B). La paciente permaneció asintomática desde el punto de vista cardiovascular, en clase funcional I, y continuó el tratamiento con albendazol hasta completar un año.
Figura 4.
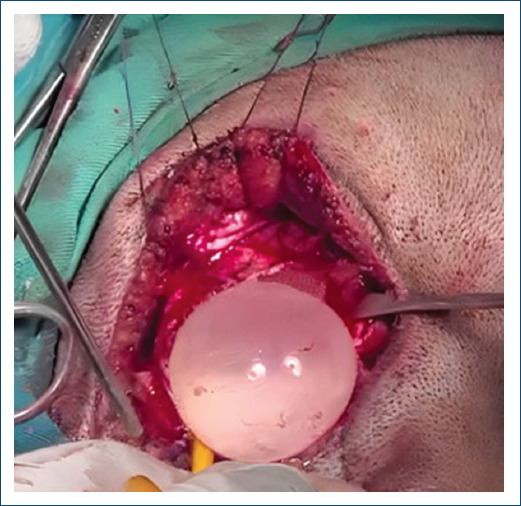
Exéresis de los quistes hidatídicos cerebrales.
Discusión
La hidatidosis cardiaca complicada con embolia cerebral es extremadamente rara y de pronóstico sombrío, habiéndose descrito pocos casos en todo el mundo y con diferentes formas de presentación1,4,5.
El caso presentado corresponde a una de las complicaciones de la hidatidosis cardiaca: la embolia en el cerebro condicionada por las microperforaciones y la migración de los escólex hacia el tejido cerebral, transformándose en quistes1, lo que se vio reflejado en la presentación de un déficit motor agudo debido al efecto de masa, que fue el motivo de ingreso de la paciente al hospital. La sintomatología que ocasiona el quiste hidatídico cardiaco es variable, pudiendo mantenerse asintomático debido a su crecimiento lento o manifestarse clínicamente, dependiendo de su tamaño y ubicación, como angina de pecho, arritmias o simulando una valvulopatía6; no obstante, nuestra paciente no manifestó sintomatología cardiovascular.
Los estudios serológicos de Western Blot (sensibilidad del 72-97% y especificidad del 96-100%)7, junto con los de imagenología, que incluyen ecocardiografía transtorácica, TC espiral y RM cardiaca, ayudan a diagnosticar la hidatidosis cardiaca.
La ecocardiografía transtorácica es la herramienta diagnóstica de primera línea, con una sensibilidad mayor del 90%8 que permite localizar, determinar el tamaño y describir algunas características del quiste hidatídico. Sin embargo, no brinda una clara diferenciación entre la amplia variedad de tumoraciones cardiacas9, y por ello la RM cardiaca representa una excelente técnica que, además de brindar precisión topográfica exacta para la evaluación quirúrgica posterior, complementa el diagnóstico diferencial10. Así, el quiste hidatídico se visualiza como una imagen hipointensa en T1, mientras que en T2 se muestra hiperintenso, rodeado de una capa periquística que aparece como un anillo hipointenso secundario a la reacción tisular del huésped6. Estas características lo distinguen de tumores como el mixoma, el lipoma, el rabdomioma y el rabdomiosarcoma11. No obstante, la presencia de vesículas en el interior del quiste es el signo característico que lo distingue de otras formaciones2. La clasificación imagenológica de la Organización Mundial de la Salud permite determinar la actividad y el riesgo de perforación de los quistes hidatídicos, facilitando la decisión terapéutica al agrupados en seis tipos3:
– CL (cystic lesion): quiste unilocular.
– CE1 (cystic echinococcosis 1): quiste en el que se aprecia la arenilla hidatídica.
– CE2: quiste multivesicular.
– CE3: quiste en el que se observa desprendimiento de membrana laminar en su interior.
– CE4: quiste de aspecto heterogéneo con componente solido sin presencia de vesículas en su interior.
– CE5: quiste con presencia de calcificaciones3.
En el presente caso, el tipo correspondiente fue CE2, lo que demuestra la actividad del quiste y el riesgo de perforación.
En los quistes hidatídicos cardiacos, la conducta terapéutica de elección es la exéresis quirúrgica asociada a tratamiento farmacológico con albendazol 400 mg dos veces al día, con una duración de 6-24 meses12. Aunque la terapia farmacológica enlentece el progreso en la evolución del quiste, no evita su posible perforación o rotura2, por lo que la cirugía está indicada incluso en pacientes asintomáticos. Este manejo terapéutico combinado fue el realizado en el presente caso, obteniendo buena respuesta y adecuada evolución de la paciente.
Conclusión
El quiste hidatídico cardiaco asociado a embolia cerebral es sumamente raro, pero en zonas endémicas debería ser parte del diagnóstico diferencial de masas intracardiacas y cerebrales. El uso de estudios imagenológicos multimodales y de pruebas serológicas permite el diagnóstico y el tratamiento precoces de esta patología.
Financiamiento
Los autores declaran no haber recibido financiamiento para este estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes. Además, los autores han reconocido y seguido las recomendaciones según las guías SAGER dependiendo del tipo y naturaleza del estudio.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Uso de inteligencia artificial para generar textos. Los autores declaran que no han utilizado ningún tipo de inteligencia artificial generativa en la redacción de este manuscrito ni para la creación de figuras, gráficos, tablas o sus correspondientes pies o leyendas.
Bibliografía
- 1.Turgut M, Benli K, Eryilmaz M. Secondary multiple intracranial hydatid cysts caused by intracerebral embolism of cardiac echinococcosis:an exceptional case of hydatidosis. Case report. J Neurosurg. 1997;86:714–8. doi: 10.3171/jns.1997.86.4.0714. [DOI] [PubMed] [Google Scholar]
- 2.Meimand SE, Sadeghpour A, Pakbaz M, Ghavidel AA, Pouraliakbar H, Kamali M, et al. Cardiac echinococcosis associated with other organ involvement:report of two challenging cases. CASE (Phila) 2021;5:33–8. doi: 10.1016/j.case.2020.09.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Kahlfuß S, Flieger RR, Roepke TK, Yilmaz K. Diagnosis and treatment of cardiac echinococcosis. Heart. 2016;102:1348–53. doi: 10.1136/heartjnl-2016-309350. [DOI] [PubMed] [Google Scholar]
- 4.Darwazah AK, Zaghari M, Eida M, Batrawy M. Left ventricular endocardial ecchinococcosis associated with multiple intracranial hydatid cysts. J Cardiothorac Surg. 2013;8:104. doi: 10.1186/1749-8090-8-104. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Ekici MA, Ekici A, Per H, Tucer B, Kumandaş S, Kurtsoy A. Concomitant heart and brain hydatid cyst without other organ involvement:a case report. Dusunen Adam The Journal of Psychiatry and Neurological Sciences. 2011;24:155–9. [Google Scholar]
- 6.Yılmaz R, Akpınar YE, Bayramoglu Z, Ozyavuz HI, Unal OF, Dursun M. Magnetic resonance imaging characteristics of cardiac hydatid cyst. Clin Imaging. 2018;51:202–8. doi: 10.1016/j.clinimag.2018.05.016. [DOI] [PubMed] [Google Scholar]
- 7.Hadipour M, Nazari M, Sanei B, Ghayour Z, Sharafi SM, Yazdani H, et al. Immunological diagnosis of human hydatid cyst using western immunoblotting technique. J Res Med Sci. 2016;21:130. doi: 10.4103/1735-1995.196612. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Mir H, McClure A, Thampinathan B, Chow C, Cusimano RJ, Bogoch II, et al. Echocardiographic features of cardiac echinococcal infection. CASE (Phila) 2021;5:26–32. doi: 10.1016/j.case.2020.10.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Moghul D, Hamidi H. Incidental finding of cardiac hydatid cysts, report of two cases. BMC Med Imaging. 2018;18:22. doi: 10.1186/s12880-018-0268-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Nasri S, Aichouni N, Lokman S, Ouafi N El, Kamaoui I, Skiker I. Cardiac hydatid cyst:2 case reports. Radiol Case Rep. 2021;16:3829–33. doi: 10.1016/j.radcr.2021.09.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Tyebally S, Chen D, Bhattacharyya S, Mughrabi A, Hussain Z, Manisty C, et al. Cardiac tumors:JACC CardioOncology State-of-the-Art Review. JACC CardioOncol. 2020;2:293–311. doi: 10.1016/j.jaccao.2020.05.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Banisefid E, Baghernezhad K, Beheshti R, Hamzehzadeh S, Nemati S, Samadifar Z, et al. Cardiac hydatid disease;a systematic review. BMC Infect Dis. 2023;23:600. doi: 10.1186/s12879-023-08576-3. [DOI] [PMC free article] [PubMed] [Google Scholar]


