RESUME
Introduction: La vitamine D joue un rôle immunomodulateur au cours de la réponse immunitaire et interviendrait probablement dans la physiopathologie de la maladie de Crohn (MC).Objectif: Evaluer le statut en vitamine D chez les patients atteints de la MC et chez les témoins sains, et déterminer les facteurs associés à la carence en vitamine D. Méthodes: Etude prospective sur 18 mois, incluant des patients atteints de MC et des témoins sains appariés selon l’âge et le sexe. Le déficit en vitamine D était défini par des taux sériques de 25OHD inférieurs à 30 ng/ml et subdivisé en : insuffisance vitaminique : 10 ng/ml < 25(OH)D < 30 ng/ml et carence vitaminique : 25(OH)D < 10 ng/ml.Résultats: Nous avons inclus 77 sujets (52 patients avec MC et 25 témoins) d’âge moyen de 38 ans± 11. Le déficit en vitamine D était fréquent chez les patients et les témoins (98% et 96% respectivement), représenté principalement par une carence vitaminique (75% et 67%, respectivement). En analyse univariée, la carence vitaminique était associée à une MC en poussée (p=0,001), à l’anémie (p=0,002), à l’hypoalbuminémie (p=0,002), à une protéine C-réactive élevée (p=0,003), à l’indice d’activité de la MC(CDAI) (p<0,001), à l’atteinte iléale (p=0,04) et au traitement immunosuppresseur (p=0,01). En analyse multivariée, seul le CDAI était significativement associé à la carence en vitamine D (p=0,003, OR=9,33).Conclusion: La carence en vitamine D était fréquente chez les patients tunisiens atteints de MC et associée à l’activité de la maladie.
ABSTRACT
Introduction: Vitamin D plays a role in regulating the immune response through an immunomodulatory effect, and is probably involved in the pathophysiology of Crohn's disease (CD). Aim: to assess vitamin D status in patients with CD as well as in healthy controls and to determine associated factors of vitamin D deficiency in patients with CD. Methods: We conducted a prospective study over 18 months, including CD patients with age and sex matched with healthy controls. Suboptimal vitamin D status was defined by vitamin D serum level < 30 ng/ml, vitamin insufficiency by vitamin D serum level between 10 and 30 ng/ml and vitamin deficiency serum level < 10 ng/ml. Results: We included 77 subjects (52 patients with CD and 25 controls) with mean age of 38 years± 11. Most patients and controls had suboptimal levels of vitamin D (98% and 96% respectively) including vitamin D deficiency in 75% and 67%, respectively and vitamin D insufficiency in 25% and 33%, respectively. In univariate analysis, vitamin D deficiency was associated with disease flare-up (p=0.001), anemia (p=0.002), hypo-albuminemia (p=0.002), elevated C-reactive protein (CRP) (p=0.003), Crohn’s Disease Activity Index (CDAI) (p<0.001), ileal location (p=0.04) and immunosuppressive therapy (p=0.01). In multivariate analysis, only CDAI was significantly associated with vitamin D deficiency (p=0.003, OR=9.33). Conclusion: Vitamin D deficiency is common in Tunisian CD patients as well as in controls and is associated with disease activity.
introduction
La maladie de Crohn (MC) constitue une maladie dont l’étiopathogénie est multifactorielle, faisant intervenir une dysbiose du microbiote, une dysfonction de la barrière intestinale et une dysrégulation de l’immunité innée et adaptative sur un terrain génétiquement prédisposé.
Cependant, des différences évolutives étaient notées d’un patient à un autre, faisant suspecter le rôle de facteurs environnementaux dont la vitamine D, qui a suscité ces dernières années, un grand intérêt depuis la découverte de récepteurs pour la vitamine D au niveau des cellules immunitaires ( 1 ).
Par ailleurs, la vitamine D interviendrait dans la MC audelà de l’éthiopathogénie. En effet, des taux vitaminiques faibles étaient corrélés avec une maladie plus active, des lésions endoscopiques plus graves, une fréquence plus élevée d’hospitalisations et de recours à la chirurgie (2-5)
Ces observations pourraient être expliquées par un effet régulateur de la vitamine D sur la réponse immunitaire et par un effet bénéfique sur la composition du microbiote intestinal (6 , 7 ).
Etant donné le manque de données concernant les sujets tunisiens, l’objectif de cette étude était de déterminer le statut vitaminique D chez les patients tunisiens ayant une MC ainsi que chez des témoins sains et de rechercher les facteurs associés à une carence vitaminique D chez les patients atteints de la MC
méthodes
Etude monocentrique prospective durant la période allant de Juin 2013 à Juillet 2014, incluant les patients suivis pour une MC au service de Gastroentérologie de l’hôpital Charles Nicolle ainsi qu’un groupe contrôle.
Le diagnostic de MC était posé sur un faisceau d’arguments cliniques, endoscopiques, radiologiques et histologiques.
Patients
Patients adultes âgés de plus de 17 ans au moment de l’inclusion ayant une MC, et ceci quel que soit l’âge au moment du diagnostic, la localisation et le phénotype de la maladie.
N’ont pas été inclus : les femmes ménopausées, les patients recevant un traitement oral par vitamine D, calcium, biphosphonates ou corticoides au moment de l’inclusion ou arrêtés depuis moins d’un mois et les patients présentant une insuffisance rénale chronique
Groupe contrôle
Le groupe contrôle était constitué de sujets volontaires sains, asymptomatiques, n’ayant pas d’antécédents personnels ou familiaux de MICI ou de maladies autoimmunes.
Nos témoins ont été choisis parmi le personnel médical et paramédical et étaient appariés aux patients selon l’âge et le sexe.
Recueil des données
Les caractéristiques générales des patients et des témoins ont été notées ainsi que la saison pendant laquelle les prélèvements ont été réalisés, a été également notée : saison hivernale (Novembre – Avril) ou estivale (Mai –Octobre).
Les caractéristiques de la MC ont été de même précisées à partir des dossiers médicaux: l’âge au moment du diagnostic, la localisation et la durée d’évolution de la maladie, l’étendue de l’atteinte iléale ainsi que le phénotype de la maladie selon la classification de Montréal, les traitements médicaux reçus et les antécédents de résection intestinale.
L’activité de la maladie au moment du prélèvement a été évaluée par l’indice d’activité de la MC (CDAI).
Prélèvement et dosage de la vitamine D
La 25 hydroxy vitamine D (25 OH D) plasmatique a été dosée, après un jeune de 12 heures, par une technique immunologique microparticulaire avec détection par chimiluminescence (ECLIA).
Ce dosage était concomitant au dosage des paramètres biochimiques suivants (PTH, Calcémie, albuminémie phosphorémie, CRP) et à la numération de la formule sanguine.
Un taux normal en vitamine D était défini par des taux de 25(OH)D supérieurs ou égal à 30 ng/ml.
Le déficit en vitamine D était défini par des taux inférieurs à 30 ng/ml et subdivisé en : insuffisance vitaminique : 10 ng/ml< 25(OH) D <30 ng/ml et carence vitaminique : 25 (OH) D <10 ng/ml.
Considérations éthiques
Un consentement éclairé oral et écrit des patients a été obtenu avant leur inclusion dans l’étude.
Les données de l’étude ont été traitées et sauvegardées dans le respect de l’anonymat.
Etude statistique
La saisie des données a été effectuée par le logiciel SPSS 13.0. La comparaison des moyennes a été réalisée par le test t de Student, et la comparaison des fréquences par le test du Chi 2.
L’établissement des valeurs seuils a été faite par les courbes ROC selon la sensibilité et la spécificité de chaque variable.
Une analyse univariée a été conduite, suivie par une analyse multivariée par un modèle de régression logistique incluant les variables dont le p était inférieur à 0,1.
Les différences étaient considérées comme étant statistiquement significatives lorsque la probabilité p était inférieure ou égale à 0,05.
résultats
Inclusion des patients
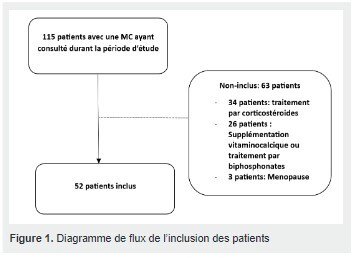
Au final, 52 patients ayant une MC et 25 témoins ont été inclus dans l’étude.
Le diagramme de flux des patients est représenté dans la figure 1.
Caractéristiques générales et saison de prélèvement
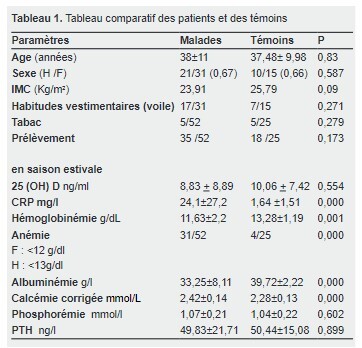
Les caractéristiques générales des patients et des témoins étaient comparables.
Le prélèvement était réalisé majoritairement au cours de la saison estivale pour les 2 groupes sans différence statistique (tableau 1).
Caractéristiques de la MC
La moitié des patients était en rémission. La moyenne d’évolution de la maladie était de 79,3 mois + 63,3[12- 324].
La MC était iléo-colique (L3) chez 50% des patients, iléale (L1) et colique (L2) dans respectivement 19 et 31% des cas.
Une atteinte étendue du grêle était observée chez 10% des patients.
Il s’agissait d’une forme inflammatoire (B1), sténosante (B2) et fistulisante (B3) dans respectivement 67, 33 et 31% des cas.
Une atteinte ano-périnéale (p) était retrouvée chez 25% des patients.
Une résection intestinale était notée chez 38,5% des patients.
Un traitement antérieur par corticothérapie orale et/ou intraveineuse a été retrouvé dans 48% des cas avec un nombre moyen de cures de corticoïdes qui était de 1,9[1– 4] et un délai moyen d’arrêt des corticoïdes de 32,4 mois [7-156].
Au moment de l’inclusion, 31 patients (60%) étaient sous traitement par salicylés, azathioprine et/ou anti-TNFα dans respectivement 21%, 33% et 6% des cas.
Résultats du dosage vitaminique
- Taux moyen de 25 (OH) D : Le taux moyen de la vitamine D était de 8,83 + 8,89 ng/ml [3,33- 58,53] chez le groupe des patients et de 10,06 + 7,42ng/ml [3,33- 30,01] chez le groupe des témoins (p=0.554)
- Déficit en vitamine D: Le déficit en vitamine D était retrouvé chez 98% des patients et 96% des témoins, représenté respectivement par une insuffisance vitaminique (25% et 33%) et une carence vitaminique (75% et 67%).(p=0,583)
- Carence vitaminique et activité de la MC : La carence vitaminique était observée chez 96% des patients en poussée et chez 54% des patients en rémission. (p< 0,05).
Résultats des autres paramètres sanguins
Les paramètres biologiques suivants étaient corrélés de façon significative au statut malade : le taux de la CRP, l’anémie, le taux d’albuminémie et la calcémie corrigée(tableau 1).
Facteurs prédictifs de la carence en vit D
Concernant les caractéristiques générales des patients, le sexe, l’âge, l’état nutritionnel, le voile vestimentaire ou la saison durant laquelle a été fait le prélèvement n’étaient pas associés à la carence en vitamine D.
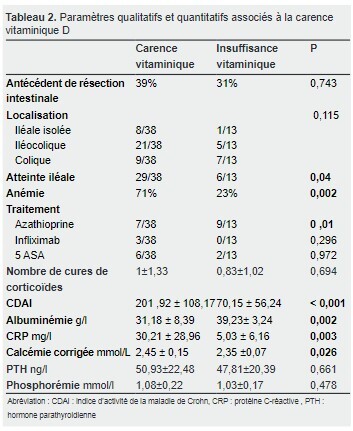
Les paramètres significativement associés en analyse univariée sont résumés dans le tableau 2.
En analyse multivariée, les paramètres qualitatifs et quantitatifs avec un p< 0,1 ont été inclus.
Ces paramètres sont représentés par : le sexe, l’atteinte axiale, l’anémie, l’atteinte iléale, l’absence de traitement par azathioprine, la taille, le CDAI, l’albuminémie, la CRP et la calcémie corrigée.
Cette étude a montré que seul le CDAI était un facteur prédictif de la carence vitaminique D (p = 0,003) avec un OR= 9,3 [2,12-40,94].
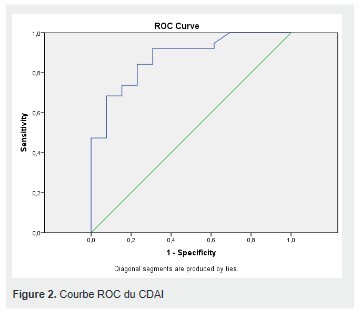
La valeur du CDAI retenue à partir de la courbe ROC était de 110 avec une spécificité de 23,1% et une sensibilité de 73,7%.
L’air sous la courbe(AUC) était de 0,877. (Figure 2)
discussion
Dans cette série, le déficit en vitamine D était fréquent au cours de MC et chez les témoins, représenté principalement par une carence vitaminique.
La carence vitaminique était associée de façon statistiquement significative avec la MC en poussée.
En analyse multivariée, le CDAI était le seul facteur prédictif de la carence vitaminique D (p = 0,003)avec un OR= 9,33 [2,12-40,94].
Cette étude, et au mieux de notre connaissance, représente la première étude tunisienne publiée qui a évaluée la prévalence du déficit en vitamine D au cours de la MC, et ce en la comparant à la population générale.
Elle a utilisé des critères de sélection très rigoureux, afin d’exclure les conditions pouvant interférer avec le métabolisme phosphocalcique et vitaminique et garantir ainsi une interprétation fiable des dosages vitaminiques.
Cependant, ces résultats pourraient être biaisés par le nombre faible d’effectifs inclus, et ce en raison de la pénurie du réactif utilisé pour le dosage vitaminique et de son délai de validité, ce qui nous a empêché d’étendre notre durée d’étude et d’élargir notre série.
De même, l’absence d’étude de l’effet de la supplémentation vitaminique D sur l’évolution des patients déficitaires constitue une limite à cette étude
Déficit en vitamine D et population générale
Le déficit en vitamine D semble constituer un problème de santé assez fréquent dans le monde ( 5 ).
En effet,un taux moyen de 21,6 ng/ml a été retrouvé dans une méta-analyse reprenant 394 études ayant évalué le statut vitaminique D chez des sujets sains( 8 ).
Ce déficit était considéré longtemps comme l’apanage des pays peu ensoleillés avec un gradient Nord-Sud.
En réalité, les données récentes ont montré qu’il s’agit d’un problème pandémique et que même les pays tropicaux et subtropicaux comme l’Amérique du sud, le Moyen-Orient (9,10) et l’Asie (11) sont aussi très largement touchés.
En Tunisie, on dispose de peu d’études ayant évalué la prévalence du déficit en vitamine D dans la population générale.
La première étude avait inclus 389 sujets âgés de 20 à 60 ans avec une prévalence globale de 47,6% touchant particulièrement les femmes (59,7%) et qui augmentait d’une façon significative avec l’âge (12).
Dans la population pédiatrique, une étude incluant des enfants actifs âgés de 7 à 15 ans retrouvait un déficit dans 40,9% des cas ( 13 ) et une autre avait montré que le déficit était significativement plus fréquent chez les enfants obèses (94% versus 80%) (14).
Concernant les femmes enceintes, des études plus récentes avaient trouvé une prévalence du déficit en vitamine D chez 96% des femmes enceintes entre 12 et 18 semaines de gestation ( 15 ), de 97% des femmes en post partum ainsi que 98% de leurs nouveau-nés ( 16 ).
Une étude du polymorphisme génétique du métabolisme de la vitamine D permettrait de mieux comprendre le mécanisme de ce déficit.
Déficit en vitamine D et maladie de Crohn
La prévalence du déficit en vitamine D chez les patients atteints de MC variait de 16 à 95% selon les études (2).
Cette disparité est expliquée d’une part par l’hétérogénéité sur le plan ethnique et géographique des patients inclus, la variabilité des seuils définissant le déficit vitaminique et par les caractéristiques de la MC : la chirurgie, l’apport alimentaire insuffisant et une exposition insuffisante au soleil en raison d’une maladie active, une absorption intestinale inadéquate, un hypercatabolisme et une excrétion excessive.
Dans notre étude, la prévalence du déficit vitaminique chez les patients atteints de MC était élevée (98,1%) et portant principalement sur une carence vitaminique.
Cette carence était corrélée, en analyse uni-variée, avec l’anémie microcytaire, l’atteinte iléale, l’absence de traitement immunosuppresseur, l’hypo albuminémie, le taux élevé de la CRP, de la calcémie et du CDAI.
En analyse multi-variée, le seul facteur retrouvé était la maladie active attesté par un CDAI élevé.
Ceci pourrait être expliqué par le fait que ces différents paramètres (l’anémie, l’hypo albuminémie et le taux élevé de CRP) sont des témoins biologiques d’une maladie active.
L’hypercalcémie est expliquée par l’état d’hyperparathyroïdie secondaire engendrée par le déficit vitaminique et l’hypocalcémie initiale.
L’association entre la carence vitaminique et l’activité de la maladie est en accord avec les données publiées de la littérature (2 –4).
La localisation de la MC, en particulier l’atteinte iléale et la localisation haute, ont été aussi rapportées comme facteurs corrélés au déficit et à la carence vitaminique D (17–21).
Ces résultats sont expliqués soit par une malabsorption directe de la vitamine D au niveau du duodéno-jéjunum, soit par une malabsorption des acides biliaires et des vitamines liposolubles au niveau de l’iléon terminal (22, 23).
Dans notre étude, la localisation proximale était rare, ne permettant pas la réalisation d’une étude statistique adéquate.
L’atteinte iléale était retrouvée comme facteur prédictif de carence vitaminique en analyse univariée.
Cependant, d’autres auteurs n’ont pas objectivé une corrélation statistiquement significative entre l’atteinte iléale et le déficit vitaminique D (24).
En fait, la source alimentaire de la vitamine D ne représente que 20% des réserves vitaminiques de l’organisme.
De même, Une concentration sérique plus basse de 25OHD peut être associée à une activité plus importante de la maladie (25, 26), des lésions endoscopiques plus sévères (27) et à une évolution moins favorable (28).
Une variation saisonnière du statut vitaminique D a été aussi observée dans des études portant sur des patients ayant une MC (18 ,29).
Globalement, la fréquence du déficit et de la carence en vitamine D était plus fréquente en hiver (50%) qu’en été (19%).
Dans notre étude, la saison hivernale n’était pas associée à la carence en vitamine D au cours de la MC.
Ceci est très probablement expliqué par l’importance de l’ensoleillement dans notre pays indépendamment de la saison.
Par ailleurs, plusieurs auteurs ont démontré que le traitement par Infliximab était associé à la carence en vitamine D(4,30) contrairement au traitement par azathioprine qui constitue un sujet de controverse ( 24,30).
En effet, le traitement par immunosuppresseurs et par biothérapie pourrait suggérer d’une part, un profil évolutif plus sévère de la MC et d’autre part pourrait témoigner d’un meilleur contrôle clinique et lésionnel de la maladie expliquant ainsi ces résultats controversés.
Dans notre étude, l’association du déficit vitaminique à un CDAI plus élevé était plutôt en faveur d’un mauvais contrôle de la MC.
De même, le traitement par azathioprine, mais pas par anti TNFα, était associé à un statut vitaminique adéquat, suggérant une maladie contrôlée.
Supplémentation vitaminique D au cours de la maladie de Crohn
Concernant la supplémentation vitaminique D, ses effets commencent à être bien établis (31), cependant des précisions concernant la dose et la forme de supplémentation vitaminique sont encore nécessaires (VD2 ou VD3 - forme inactive ou active de la vitamine D).
Lors du choix de la bonne stratégie de supplémentation, plusieurs facteurs doivent être pris en compte notamment l’activité de la maladie, le degré du déficit, la malabsorption et l’obésité ( 32 ).
Il est recommandé de viser une valeur cible de la (25 OH D) dans la plage de 75-125nmol / L ( 32 ).
La supplémentation en vitamine D aurait un fort effet immunomodulateur pour cette pathologie ( 33 ).
conclusion
Cette étude indique une forte prévalence du déficit et de la carence vitaminique D chez les sujets sains et les patients tunisiens atteints de MC, ainsi que l’association d’une carence vitaminique avec l’activité et la sévérité de la MC.
D’autres études sont nécessaires afin de caractériser les mécanismes du déficit vitaminique chez les sujets sains tunisiens ainsi que pour étudier l’effet de la supplémentation vitaminique D au cours de la MC.
References
- Provvedini DM, Tsoukas CD, Deftos LJ, Manolagas SC. 1,25-dihydroxyvitamin D3 receptors in human leukocytes. Science. 1983;221(4616):1181–1183. doi: 10.1126/science.6310748. [DOI] [PubMed] [Google Scholar]
- Mouli VP, Ananthakrishnan AN. Review article: Vitamin D and inflammatory bowel diseases. Aliment Pharmacol Ther. 2014;39(2):125–136. doi: 10.1111/apt.12553. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Dumitrescu G, Mihai C, Dranga M, Prelipcean CC. Serum 25-hydroxyvitamin D concentration and inflammatory bowel disease characteristics in Romania. World J Gastroenterol. 2014;20(9):2392–2396. doi: 10.3748/wjg.v20.i9.2392. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Butcher RO, Limdi JK. Vitamin D status in Inflammatory Bowel Disease: Are clinicians seeing the light? J Crohns Colitis. 2012;6(10):1039–1040. doi: 10.1016/j.crohns.2012.06.007. [DOI] [PubMed] [Google Scholar]
- Mithal A, Wahl DA, Bonjour JP, et al Global vitamin D status and determinants of hypovitaminosis D. Osteoporos Int. 2009;20(11):1807–1820. doi: 10.1007/s00198-009-0954-6. [DOI] [PubMed] [Google Scholar]
- Leskovar D, Meštrović T, Barešić A, et al The Role of Vitamin D in Inflammatory Bowel Disease - Assessing Therapeutic and Preventive Potential of Supplementation and Food Fortification. Food Technol Biotechnol. 2018;56(4):455–463. doi: 10.17113/ftb.56.04.18.5805. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Parizadeh SM, Jafarzadeh-Esfehani R, Hassanian SM, Mottaghi-Moghaddam A, Ghazaghi A, Ghandehari M, et al Vitamin D in inflammatory bowel disease: From biology to clinical implications. Complement Ther Med. 2019;47:102189. doi: 10.1016/j.ctim.2019.08.023. [DOI] [PubMed] [Google Scholar]
- Hagenau T, Vest R, Gissel TN, et al Global vitamin D levels in relation to age, gender, skin pigmentation and latitude: an ecologic meta-regression analysis. Osteoporos Int. 2009;20(1):133–140. doi: 10.1007/s00198-008-0626-y. [DOI] [PubMed] [Google Scholar]
- Holick MF. Vitamin D deficiency. N Engl J Med. 2007;357(3):266–281. doi: 10.1056/NEJMra070553. [DOI] [PubMed] [Google Scholar]
- Hassannia T, GhaznaviRad E, Vakili R, Taheri S, Rezaee SA. High Prevalence of Vitamin D Deficiency and Associated Risk Factors among Employed Women in a Sunny Industrial City. Int J Vitam Nutr Res. 2015;85(3-4):119–128. doi: 10.1024/0300-9831/a000231. [DOI] [PubMed] [Google Scholar]
- Kumar Trilok, Chugh R, Eggersdorfer M. Poor Vitamin D Status in Healthy Populations in India: A Review of Current Evidence. Int J Vitam Nutr Res. 2015;85(85):3–4. doi: 10.1024/0300-9831/a000228. [DOI] [PubMed] [Google Scholar]
- Meddeb N, Sahli H, Chahed M, Abdelmoula J, Feki M, Salah H, et al. Vitamin D deficiency in Tunisia. Osteoporos Int. 2005;16(2):180–183. doi: 10.1007/s00198-004-1658-6. [DOI] [PubMed] [Google Scholar]
- Bezrati I, Ben Fradj MK, Ouerghi N, Feki M, Chaouachi A, Kaabachi N. Vitamin D inadequacy is widespread in Tunisian active boys and is related to diet but not to adiposity or insulin resistance. Libyan J Med. 2016;11:31258. doi: 10.3402/ljm.v11.31258. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Yahyaoui S, Jmal L, Sammoud A, Abdenebi M, Jmal A, Boukthir S. Vitamin D deficiency is associated with metabolic syndrome in Tunisian children with obesity. Tunis Med. 2019;97(12):1353–1356. [PubMed] [Google Scholar]
- Fenina H, Chelli D, Ben Fradj MK, Feki M, Sfar E, Kaabachi N. Vitamin D deficiency is widespread in Tunisian pregnant women and inversely associated with the level of education. Clin Lab. 2016;62(5):801–806. doi: 10.7754/clin.lab.2015.150806. [DOI] [PubMed] [Google Scholar]
- Ayadi ID, Nouaili EBH, Talbi E, et al Prevalence of vitamin D deficiency in mothers and their newborns in a Tunisian population. Int J Gynaecol Obstet. 2016;133(2):192–195. doi: 10.1016/j.ijgo.2015.09.029. [DOI] [PubMed] [Google Scholar]
- Azzopardi N, Ellul P. Disease location and severity may predict vitamin D deficiency in Crohn’s. J Crohns Colitis. 2014;8(10):1336. doi: 10.1016/j.crohns.2014.04.001. [DOI] [PubMed] [Google Scholar]
- Gilman J, Shanahan F, Cashman KD. Determinants of vitamin D status in adult Crohn’s disease patients, with particular emphasis on supplemental vitamin D use. Eur J Clin Nutr. 2006;60(7):889–896. doi: 10.1038/sj.ejcn.1602395. [DOI] [PubMed] [Google Scholar]
- Pappa HM, Gordon CM, Saslowsky TM, et al Vitamin D Status in Children and Young Adults With Inflammatory Bowel Disease. Pediatrics. 2006;118(5):1950–1961. doi: 10.1542/peds.2006-0841. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Pappa HM, Langereis EJ, Grand RJ, Gordon CM. Prevalence and risk factors for hypovitaminosis D in young patients with inflammatory bowel disease. J Pediatr Gastroenterol Nutr. 2011;53(4):361–364. doi: 10.1097/MPG.0b013e3182250b3e. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Valentine JF, Sninsky CA. Prevention and treatment of osteoporosis in patients with inflammatory bowel disease. Am J Gastroenterol. 1999;94(4):878–883. doi: 10.1111/j.1572-0241.1999.981_d.x. [DOI] [PubMed] [Google Scholar]
- Tajika M, Matsuura A, Nakamura T, Suzuki T, Sawaki A, Kato T, et al. Risk factors for vitamin D deficiency in patients with Crohn’s disease. J Gastroenterol. 2004;39(6):527–533. doi: 10.1007/s00535-003-1338-x. [DOI] [PubMed] [Google Scholar]
- Leichtmann GA, Bengoa JM, Bolt MJ, Sitrin MD. Intestinal absorption of cholecalciferol and 25-hydroxycholecalciferol in patients with both Crohn’s disease and intestinal resection. Am J Clin Nutr. 1991;54(3):548–552. doi: 10.1093/ajcn/54.3.548. [DOI] [PubMed] [Google Scholar]
- Bruyn JR, van Heeckeren R, Ponsioen CY, et al. Vitamin D deficiency in Crohn’s disease and healthy controls: A prospective case-control study in the Netherlands. J Crohns Colitis. 2014;8(10):1267–1273. doi: 10.1016/j.crohns.2014.03.004. [DOI] [PubMed] [Google Scholar]
- Belen E, Aykan AC, Kalaycioglu E, Sungur MA, Sungur A, Cetin M. Low-level vitamin D is associated with atrial fibrillation in patients with chronic heart failure. Adv Clin Exp Med. 2016;25(1):51–57. doi: 10.17219/acem/34690. [DOI] [PubMed] [Google Scholar]
- Hausmann J, Kubesch A, Amiri M, Filmann N, Blumenstein I. Vitamin D deficiency is associated with increased disease activity in patients with inflammatory bowel disease. J Clin Med. 2019;8(9):1319. doi: 10.3390/jcm8091319. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Ye L, Lin Z, Liu J, Cao Q. Vitamin D Deficiency is associated with endoscopic severity in patients with Crohn’s disease. Gastroenterol Res Pract. 2017:4869718. doi: 10.1155/2017/4869718. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Mojto V, Kolcunova M, Rausova Z, Chrenova J, Dedik L. The nonskeletal effects of vitamin D3 and the threshold limit associated with the risk of health complications. Bratisl Lek Listy. 2016;117(3):133–136. doi: 10.4149/bll_2016_025. [DOI] [PubMed] [Google Scholar]
- Suibhne TN, Cox G, Healy M, O’Morain C, O’Sullivan M. Vitamin D deficiency in Crohn’s disease: prevalence, risk factors and supplement use in an outpatient setting. J Crohns Colitis. 2012;6(2):182–188. doi: 10.1016/j.crohns.2011.08.002. [DOI] [PubMed] [Google Scholar]
- Ulitsky A, Ananthakrishnan AN, Naik A, et al. Vitamin D deficiency in patients with inflammatory bowel disease: association with disease activity and quality of life. J Parenter Enteral Nutr. 2011;35(3):308–316. doi: 10.1177/0148607110381267. [DOI] [PubMed] [Google Scholar]
- Nielsen OH, Rejnmark L, Moss AC. Role of Vitamin D in the Natural History of Inflammatory Bowel Disease. J Crohns Colitis. 2018;12(6):742–752. doi: 10.1093/ecco-jcc/jjy025. [DOI] [PubMed] [Google Scholar]
- Nielsen OH, Hansen TI, Gubatan JM, Jensen KB, Rejnmark L. Managing vitamin D deficiency in inflammatory bowel disease. Frontline Gastroenterol. 2019;10(4):394–400. doi: 10.1136/flgastro-2018-101055. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Boccuzzi L, Infante M, Ricordi C. The potential therapeutic role of vitamin D in inflammatory bowel disease. Eur Rev Med Pharmacol Sci. 2023;27(10):4678–4687. doi: 10.26355/eurrev_202305_32479. [DOI] [PubMed] [Google Scholar]


