Abstract
Bei etwa der Hälfte aller Patienten mit akutem ischämischem Schlaganfall (AIS) dürfen erhöhte Werte des hochsensitiven kardialen Troponins (hs-cTn) erwartet werden. Diese Patienten sind von einer erhöhten Morbidität und Mortalität bedroht, die häufig auf eine kardiale Ursache zurückzuführen ist. Daher bedarf es einer adäquaten Aufarbeitung der zugrundeliegenden Ursache, die nur im Team aus Kardiologen und Neurologen gelingen kann. Da die Ursachen vielfältig, in ihrer klinischen Präsentation beim Patienten mit AIS atypisch oder stumm und einige wie ein begleitender Myokardinfarkt akut lebensbedrohlich sein können, sollte die Abklärung einem standardisierten Algorithmus zur Differenzialdiagnostik folgen. Die überwiegende Zahl der hs-cTn-Erhöhungen wird durch nichtischämische Myokardschäden im Zusammenhang mit dem AIS verursacht. Dieser Artikel stellt einen praxisorientierten Ansatz zur Differenzialdiagnostik mit dem Update des Mannheimer Algorithmus zu akutem ischämischem Schlaganfall und Troponinerhöhung vor.
Schlüsselwörter: Akuter Myokardschaden, Chronischer Myokardschaden, Myokardinfarkt, Schlaganfallinduzierter Herzschaden, Computertomographie-Koronarangiographie
Abstract
Elevated high-sensitivity cardiac troponin (hs-cTn) levels should be expected in about half of all patients with acute ischemic stroke (AIS). Since those patients are at risk of increased morbidity and mortality, often attributable to cardiac causes, an adequate work-up of the underlying etiology is required. This can only be achieved by a team of cardiologists and neurologists. Since underlying causes of hs-cTn elevation in AIS patients are diverse, often atypical or silent in their clinical presentation and some, such as an accompanying myocardial infarction, can be acutely life-threatening, the work-up should follow a standardized clinical algorithm. The vast majority of hs-cTn elevations are caused by non-ischemic myocardial injury associated with AIS. This work presents a practice-oriented approach to differential diagnosis with the update of the Mannheim clinical algorithm for acute ischemic stroke and troponin elevation.
Keywords: Acute myocardial injury, Chronic myocardial injury, Myocardial infarction, Stroke-induced heart injury, Coronary computed tomography angiography
Ein Anteil von 30 bis 60 % aller Patienten mit akutem ischämischem Schlaganfall (AIS) weist zum Diagnosezeitpunkt eine Erhöhung des hochsensitiven kardialen Troponins (hs-cTn) über dem 99. Perzentil der Allgemeinbevölkerung auf [35, 36]; hs-cTn ist ein laborchemischer Marker der Myokardzellnekrose. Nur für eine Minderheit dieser Myokardschädigungen ist bei AIS-Patienten eine Myokardinfarkt(MI)-assoziierte vulnerable Koronarplaque (sogenannte „culprit lesion“) verantwortlich [26, 31]. Im Gegensatz dazu liegt bei Patienten mit einem Nicht-ST-Strecken-Hebungs-MI („non-ST-elevation myocardial infarction“ [NSTEMI]) ohne AIS in 80 % der Fälle eine „culprit lesion“ vor [31]. Dennoch ist eine hs-cTn-Erhöhung bei AIS-Patienten ein signifikanter Prädiktor für ein schlechteres funktionelles Outcome und eine erhöhte Mortalität [2, 39], die häufig kardiovaskulär bedingt ist [7, 37].
Eine hs-cTn-Erhöhung ist bei AIS ein signifikanter Prädiktor für ein schlechteres Outcome
Die Wahrscheinlichkeit für akute kardiovaskuläre Ereignisse nach AIS ist unter den Geschlechtern vergleichbar [38]. Aus diesen Besonderheiten ergibt sich das Erfordernis einer gründlichen Abklärung des kardialen Aspekts, dem regelhaft nicht ein akutes Koronarsyndrom („acute coronary syndrome“ [ACS]) zugrunde liegt. Kriterien der ACS-Leitlinie der Europäischen Gesellschaft für Kardiologie (European Society of Cardiology [ESC]; [8]) können somit nicht unkritisch auf alle AIS-Patienten mit Erhöhung des hs-cTn-Werts angewendet werden, da unter anderem hs-cTn-Cut-off-Wert und -Dynamik für diese Situation nicht wissenschaftlich validiert sind. Die in dieser Patientengruppe nicht triviale Einordnung der hs-cTn-Erhöhung folgt der Systematik, dass sie A. Ausdruck eines relevanten zerebralen Ischämieareals mit ausgeprägtem Stresssignal entlang der Hirn-Herz-Achse (auch als „stroke-induced heart injury“ [SIHI] bezeichnet) sein kann oder B. Ausdruck einer vorbestehenden (bislang vielleicht subklinischen) strukturellen Herzerkrankung, die durch den Stressor AIS oder im Zusammenhang mit diesem klinisch apparent wird [4, 39].
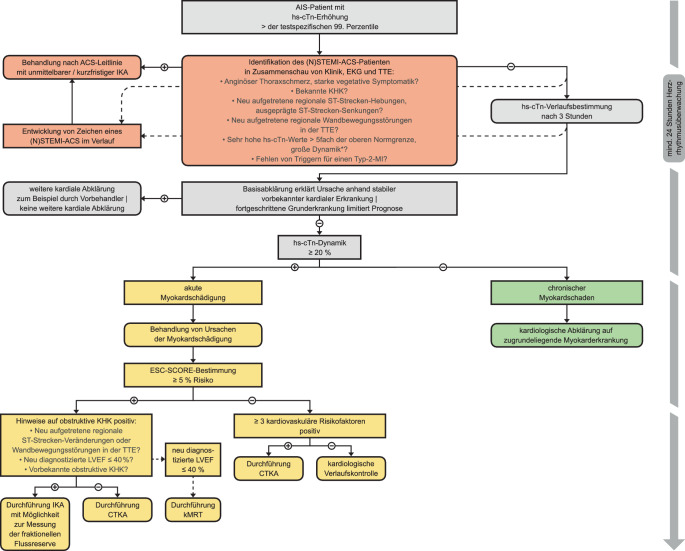
In seltenen Fällen des Typs B liegt die Koinzidenz eines AIS und eines MI mit Ruptur oder Erosion einer koronaren Plaque (Typ-1-MI) vor [8, 26, 42]. Es ist daraus ableitbar, dass es eines differenzierten und dennoch auf der Stroke Unit praktisch handhabbaren Algorithmus bedarf, um diejenigen Patienten zu identifizieren, die in der Akutphase nach AIS einer invasiven Koronarangiographie (IKA) mit Koronarintervention bedürfen – unter Umständen unter Inkaufnahme eines erhöhten Blutungs- oder periprozeduralen Risikos wie der Präzipitation eines Delirs [14]. Mit dem Algorithmus muss es zudem möglich sein, auch AIS-Patienten ohne MI einer rationalen Diagnostik zuzuführen, um relevante kardiale Begleiterkrankungen sensitiv erkennen und individuell behandeln zu können [21]. Eine spezifische Leitlinie für diese Situation existiert aufgrund fehlender Daten aus randomisierten, kontrollierten Studien bislang nicht. Einen praxisorientierten Ansatz zur Differenzialdiagnostik stellen wir hier mit dem ersten Update des Mannheimer Algorithmus zu akutem ischämischem Schlaganfall und Troponinerhöhung vor ([14]; Abb. 1).
Abb. 1.
Mannheimer Algorithmus zur Differenzialdiagnostik bei AIS und Troponinerhöhung. * Bei klinischer Wahrscheinlichkeit für ein NSTEMI-ACS Verlaufsbestimmung des hs-cTn-Werts je nach lokal verfügbarem Assay bereits nach 1 oder 2 h. Invasives Vorgehen im Fall eines (N)STEMI-ACS so früh wie durch die Nutzen-Risiko-Abwägung des Teams aus Kardiologen und Neurologen vertretbar; detaillierte Erläuterungen zum Vorgehen im Text. ACS „acute coronary syndrome“ (akutes Koronarsyndrom), AIS akuter ischämischer Schlaganfall, CTKA Computertomographie-Koronarangiographie, EKG Elektrokardiogramm, ESC „European Society of Cardiology“ (Europäische Gesellschaft für Kardiologie), hs-cTn „high-sensitivity cardiac troponin“ (hochsensitives kardiales Troponin), IKA invasive Koronarangiographie, KHK koronare Herzkrankheit, kMRT kardiale Magnetresonanztomographie, LVEF linksventrikuläre Ejektionsfraktion, MI Myokardinfarkt, (N)STEMI „(non‑)ST-elevation myocardial infarction“ ([Nicht-]ST-Strecken-Hebungs-Myokardinfarkt), TTE transthorakale Echokardiographie
Klassifikation der Ursache der Myokardschädigung
Beim Patienten mit ACS ist der Grund der ärztlichen Konsultation regelhaft eine akute Verschlechterung der kardialen Belastbarkeit, beispielsweise durch anginöse Thoraxschmerzen, Dyspnoe oder atypische Beschwerden. In der Folge wird zwischen „ST-elevation myocardial infarction“ (ST-Strecken-Hebungs-MI [STEMI]), NSTEMI, einer instabilen Angina pectoris oder einer Differenzialdiagnose zum ACS unterschieden, wobei auch der hs-cTn-Wert herangezogen wird [8]. Jene Patienten werden primär in kardiologischen Fachabteilungen behandelt. Der Auftrag an das Team der Stroke Unit ist davon abweichend, eine etwaige Erhöhung des leitliniengerecht im Rahmen der AIS-Aufnahmeroutine bestimmten hs-cTn-Werts (Klasse-I-Empfehlung) ex post zu interpretieren [17].
Identifikation von Patienten mit begleitendem (N)STEMI-ACS
Initial ist die Identifikation des AIS-Patienten mit begleitendem (N)STEMI-ACS und Typ-1-MI (in der Gesamtheit seltene, aber klinisch dennoch auftretende Konstellation [26, 28]) erforderlich, da dann bei hohem oder sehr hohem Risiko für Periinfarktkomplikationen eine unmittelbare bzw. binnen 24 h nach Erstkontakt durchgeführte IKA mit Interventionsbereitschaft notwendig ist (Tab. 1). Die sichere Identifikation eines Patienten mit (N)STEMI-ACS im Kontext einer anderen Akuterkrankung ist in der klinischen Praxis nicht immer einfach und bedarf einer umfangreichen klinisch-kardiologischen Expertise. Dies wird auch von der ESC-Leitlinienkommission anerkannt [8]. Ein (N)STEMI-ACS kann sowohl über den Mechanismus eines Typ-1-MI als auch bedingt durch eine relative Imbalance von Sauerstoffangebot und -bedarf am Myokard ohne Ruptur oder Erosion einer Koronarplaque (Typ-2-MI) entstehen. Diese Differenzierung ist selbst für erfahrene Kardiologen nicht trivial [19, 34]. Sie ist aber klinisch bedeutsam, da ein Typ-2-MI, der ebenso mit einer erhöhten Mortalität einhergeht, regelhaft keine unmittelbare Koronarintervention erfordert, insofern keine instabile Koronarplaque vorliegt [12, 42]. Vielmehr ist initial eine Behandlung der zugrundeliegenden Ursache erforderlich (Tab. 2).
Tab. 1.
Sehr hohes bzw. hohes Risiko für Periinfarktkomplikationen, verbunden mit der Indikation zur unmittelbaren invasiven Koronarangiographie bzw. invasiven Koronarangiographie binnen 24 h [8]
| Sehr hohes Risiko |
| ST-Strecken-Hebungs-Myokardinfarkt |
| Hämodynamische Instabilität oder kardiogener Schock |
| Wiederkehrender oder therapierefraktärer Thoraxschmerz |
| Akute Herzinsuffizienz im Zusammenhang mit anhaltender myokardialer Ischämie |
| Lebensbedrohliche Arrhythmie oder Herzstillstand nach Krankenhausaufnahme |
| Mechanische Komplikation (Ruptur der freien Wand, des interventrikulären Septums oder eines Papillarmuskels mit konsekutiver akuter Herzinsuffizienz) |
| Wiederkehrende dynamische EKG-Veränderungen, die auf eine Ischämie hinweisen (insbesondere mit wiederkehrenden ST-Strecken-Hebungen) |
| Hohes Risiko |
| Dynamische ST-Strecken- oder T‑Wellen-Veränderungen |
| Transiente ST-Strecken-Hebungen (≤ 20 min) |
| GRACE-Risikoscore ≥ 140 Punkte |
EKG Elektrokardiogramm, GRACE Global Registry for Acute Coronary Events
Tab. 2.
| Akute Herzinsuffizienz |
| (Schwere) Anämie |
| Dekompensierte Aortenklappenstenose |
| Arrhythmie |
| (Schwere) arterielle Hypertonie |
| (Schwere) arterielle Hypotonie |
| Hypoxie |
| Koronardissektion |
| Koronare Embolie |
| Koronarspasmus, koronare mikrovaskuläre Dysfunktion (auch im Rahmen eines Takotsubo-Syndroms) |
| (Ausgeprägte) linksventrikuläre Hypertrophie |
| Sepsis |
Der absolute hs-cTn-Wert ist allein kein ausreichender Prädiktor, um einen Typ-1-MI voherzusagen
Die absolute Höhe des hs-cTn-Werts ist kein ausreichender alleiniger Prädiktor, um einen Typ-1-MI abzugrenzen [31, 34]. Die Identifikation von (N)STEMI-ACS-Patienten mit Typ-1-MI gründet sich auf die Würdigung der klinischen Präsentation, die Interpretation von Veränderungen im Elektrokardiogramm (EKG), die klinische Untersuchung, die Berücksichtigung von Begleit- und Vorerkrankungen sowie eventuell auch eine Point-of-care-Echokardiographie [8]. Auf einen Typ-1-MI weisen dabei folgende Punkte hin, insbesondere wenn sie in Kombination vorliegen [8, 11]:
Anginöse Thoraxschmerzen oder eine starke vegetative Symptomatik
Bekannte koronare Herzkrankheit (KHK)
(Neu aufgetretene) regionale ST-Strecken-Hebungen am J-Punkt in ≥ zwei benachbarten Ableitungen (unter Berücksichtigung von V7 bis V9 und V3R/V4R), ausgeprägte ST-Strecken-Senkungen oder ein kompletter Schenkelblock (mit starker Symptomatik myokardialer Ischämie)
(Neu aufgetretene) regionale Wandbewegungsstörungen in der Echokardiographie
Sehr hohe hs-cTn-Werte (> 5faches der oberen Normgrenze) oder große Dynamik des hs-cTn-Werts in der seriellen Messung
Fehlen von Triggern für einen Typ-2-MI (vergleiche Tab. 2)
Neben dem Risiko, den (N)STEMI-ACS-Patienten nicht zu erkennen, besteht das diametrale Risiko einer zu großzügigen Zuführung von Patienten zur IKA mit möglicherweise folgender Intervention einer stabilen Koronarstenose, die als „culprit lesion“ eines ACS fehlinterpretiert wird [12]. Die weitere Diagnostik und Therapie unterscheiden sich beim (N)STEMI-ACS-Patienten mit AIS grundsätzlich nicht von allgemeinen Standards und es kommt die unlängst publizierte ESC-Leitlinie zur Anwendung [8]. Die Behandlung erfolgt jedoch nach Nutzen-Risiko-Abwägung innerhalb des Teams aus Kardiologen und Neurologen. Hierbei zu beachten ist die Empfehlung zum limitierten Einsatz von Prasugrel, da es bei AIS-Patienten aufgrund des erhöhten Blutungsrisikos kontraindiziert ist [3].
Myokardschädigung ohne Hinweis auf (N)STEMI-ACS
In der überwiegenden Zahl der Fälle kann die hs-cTn-Erhöhung nicht mit einem (N)STEMI-ACS erklärt werden [26, 29, 31]. Der Fokus muss dann darauf liegen, mittels rationaler und kosteneffektiver Diagnostik die Ursache der Myokardschädigung aufzudecken, um akute oder chronische Myokarderkrankungen zu differenzieren, optimal zu behandeln und damit die Prognose des Patienten zu verbessern. Bei der akuten Myokardschädigung kommen ischämische Mechanismen des Typ-2-MI im Zusammenhang mit der Stressreaktion durch den AIS ebenso infrage wie nichtischämische, rein neurogene SIHI-Mechanismen (akuter Myokardschaden; Ursachen in Tab. 3) bis zum Vollbild des Takotsubo-Syndroms [37].
Tab. 3.
| Kardial | Nichtkardial |
|---|---|
| Akute Herzinsuffizienz | (Starke körperliche) Anstrengung |
| Arrhythmie | Chemotherapie, Strahlentherapie |
| Defibrillation/Kardioversion | (Schwere systemische) Infektion, Sepsis |
| Kardialer Eingriff | Lungenarterienembolie |
| Kardiale Kontusion | Niereninsuffizienz |
| Myokarditis | Pulmonale Hypertonie |
| Takotsubo-Syndrom | „Stroke-induced heart injury“ |
Ein chronischer Myokardschaden ist bei annähernd 85 % der AIS-Patienten für die hs-cTn-Erhöhung verantwortlich [36]. Hierbei spielen insbesondere bislang inapparente Kardiomyopathien, aber auch Endo- oder (Peri‑)Myokarditiden eine Rolle, die wiederum Ursache eines kardioembolischen AIS sein können [24]. Eine KHK mit ≥ 50 %iger Stenose in mindestens einer epikardialen Koronararterie liegt insgesamt bei etwa einem Drittel der AIS-Patienten vor [18]. Akute Myokardschädigungen führen gegenüber chronischen Myokardschäden bei AIS-Patienten zu einer höheren Krankenhaussterblichkeit [35].
Im ersten Schritt dieser weiteren Differenzierung sollte dichotom zwischen akuter (nach der vierten universellen Definition des MI definiert als Positiv- oder Negativdynamik des hs-cTn-Werts von ≥ 20 % binnen eines 3 h-Intervalls) und chronischem Myokardschaden unterschieden werden [42]. Das 3 h-Messintervall des hs-cTn-Werts ist nicht mit dem 0/1(/2) h-Intervall zum Ein- oder Ausschluss im ACS-Algorithmus gleichzusetzen, der vorrangig einer schnellen Diagnosestellung beim MI-Patienten dient [8]. Wir führen daher bei allen AIS-Patienten mit hs-cTn-Erhöhung ohne Hinweise auf ein ACS auch weiterhin eine Verlaufsbestimmung nach exakt 3 h durch, was überdies angesichts der Initialmaßnahmen nach AIS (intravenöse Thrombolyse und/oder interventionelle Thrombektomie) als pragmatisches Zeitfenster erscheint.
Die Basisabklärung besteht aus der Erfassung vorausgehender kardialer Beschwerden (eigen- oder fremdanamnestisch), kardialer Vorbefunde und relevanter Begleiterkrankungen, einem EKG sowie einer Standardechokardiographie binnen 24 h. Wie im Abschnitt „Praktisches Vorgehen in der weiteren Differenzialdiagnostik“ ausgeführt, können durch diese Schlüsselmaßnahmen schon erste Rückschlüsse auf die Ursache der Myokardschädigung und die im Weiteren erforderlichen Maßnahmen abgeleitet werden.
Treten in diesem Verlauf Zeichen eines ACS auf, wird umgehend auf den ACS-Algorithmus der ESC gewechselt. Zahlreiche AIS-Patienten können aufgrund von neurologischen Symptomen wie Aphasie, Dysarthrie, Vigilanzminderung, Neglect/Anosognosie oder schlaganfallassoziiertem Delir ACS-Symptome nicht äußern oder sind in deren Perzeption eingeschränkt [6]. Zur sicheren Identifikation des Patienten mit AIS-(N)STEMI-ACS sollte in diesem Stadium der Observanz auf dynamische EKG-Veränderungen, unerwartete hämodynamische Instabilität oder Rhythmusinstabilität geachtet werden. Derart sollten auch Patienten mit Koronardissektion, Koronarembolie und Koronarspasmus identifiziert werden können; diese Erkrankungen werden dem Typ-2-MI-Mechanismus zugeordnet, stellen allerdings ebenso akut und interventionell zu therapierende Entitäten dar [8, 42].
Erweiterte Diagnostik auf eine strukturelle Herzerkrankung bei akuter und chronischer Myokardschädigung
Die weiterführende Diagnostik wird nach klinischer Stabilisierung des AIS, aber im zeitlichen Zusammenhang mit dem Indexaufenthalt auf der Stroke Unit durchgeführt. Falls in der Basisabklärung keine abschließende Erklärung für die hs-cTn-Erhöhung gefunden werden kann, kommen verschiedene bildgebende Verfahren in Betracht, um eine bisher klinisch inapparente strukturelle Herzerkrankung aufzudecken oder auszuschließen.
Computertomographische und invasive Koronarangiographie
In der DISCHARGE-Studie konnte bei Patienten mit einer stabilen Angina pectoris und einer mittleren Vortestwahrscheinlichkeit für eine KHK durch die alternative Anwendung einer Computertomographie-Koronarangiographie (CTKA) im Vergleich zur IKA ein vergleichbar niedriges Risiko schwerwiegender unerwünschter kardiovaskulärer und zerebrovaskulärer Ereignisse (hier: kardiovaskulärer Tod, MI oder AIS) von je < 5 % in einem medianen Follow-up-Zeitraum von 3,5 Jahren erreicht werden [40]. Die Durchführung einer unmittelbaren CTKA bei Patienten mit klinischem Verdacht auf ein NSTEMI-ACS und intermediärem KHK-Risiko führte zu einer Reduktion von IKA und verbesserte das Verhältnis von Koronarinterventionen zu durchgeführten IKA [15]. In der CTKA-Gruppe traten binnen eines Jahres nicht mehr Typ-1-MI, Typ-4b-MI (durch Stentthrombose) oder Todesfälle auf (5,8 % bei CTKA vs. 6,1 % bei Standardprozedere). Die CTKA kann damit bei AIS-Patienten mit hs-cTn-Erhöhung und niedriger Vortestwahrscheinlichkeit einer obstruktiven KHK als sinnvoller Torwächter zur IKA verstanden werden, um unnötige, nicht mit einer Koronarintervention verbundene invasive Prozeduren und damit potenzielle prozedurale Komplikationen in dieser vulnerablen Patientenpopulation zu vermeiden [44]. Dem kommt nicht zuletzt die immer weiter verbesserte Bildakquise moderner Systeme entgegen, die bei stark kalzifizierten Koronarplaques oder intrakoronaren Stents weniger anfällig sind und mit geringerer Strahlenbelastung einhergehen [20]. Weiterhin eingeschränkt ist die Aussagekraft der CTKA bei extremer Adipositas, ausgeprägter Arrhythmie, Tachykardie oder kooperationsunfähigen Patienten [16, 25].
Die CTKA kann in einem Schritt eine obstruktive KHK als Ursache der Myokardschädigung sensitiv ausschließen sowie gleichzeitig auch seltene alternative Ursachen wie kardiale Raumforderungen aufdecken [44]. Zudem ermöglicht sie eine Risikostratifizierung nichtobstruktiver Koronarplaques mithilfe des Agatston-Scores [5]. In Evaluation befinden sich aktuell CTKA-Verfahren, welche die hämodynamische Relevanz intermediärer Koronarstenosen unmittelbar klären [5].
Kardiale Magnetresonanztomographie
Die kardiale Magnetresonanztomographie (kMRT) ist besonders geeignet für die Feststellung inapparenter myokardialer Veränderungen und hat mit einer Belastungsuntersuchung eine hohe Sensitivität und Spezifität in der myokardialen Ischämiediagnostik [1, 27]. Die kMRT kommt daher zum Einsatz, um myokardiale Erkrankungen, wie hereditäre oder erworbene Kardiomyopathieformen, eine (Peri‑)Myokarditis oder eine kardiale Beteiligung bei Systemerkrankungen abzuklären. Durch medikamentöse Stressinduktion mit Adenosin oder Dobutamin (Belastungstest) können außerdem vermutete oder intermediär diagnostizierte Koronarstenosen auf ihre funktionelle Relevanz hin untersucht werden [25, 27]. Dabei ist zu beachten, dass bei AIS-Patienten mit KHK auch gehäuft Stenosen der A. carotis vorliegen [23]. Auch in der myokardialen Vitalitätsdiagnostik bei bekannter KHK ist die kMRT mit Bestimmung des „late gadolinium enhancement“ Mittel der Wahl [30]. Zudem liefert die kMRT wertvolle Zusatzinformationen bei der Detektion und Differenzialdiagnostik kardialer Raumforderungen (thrombotisch vs. maligne) und kann derart auch zur Aufklärung kardialer Emboliequellen bei embolischem AIS beitragen [1].
Praktisches Vorgehen in der weiteren Differenzialdiagnostik
In einigen Fällen kann bereits durch die Basisabklärung die Ursache der Myokardschädigung herausgearbeitet werden, insbesondere bei bekannter struktureller Herzerkrankung. Durch die (Fremd-)Anamnese auf eine (sub)akute Verschlechterung der kardialen Belastbarkeit wird in dieser Situation über die Dringlichkeit einer weiteren kardialen Abklärung entschieden. Patienten mit einem fortgeschrittenen Frailty-Syndrom oder einer fortgeschrittenen onkologischen Erkrankung, die nach Einschätzung der Behandler nicht von invasiven kardiologischen Therapien in der Folge einer weiteren Abklärung profitieren würden, können von dieser weiteren Diagnostik ausgenommen werden.
Patienten mit akuter Myokardschädigung ohne Hinweis auf ein (N)STEMI-ACS
Hier sollten die der akuten Myokardschädigung zugrundeliegenden Ursachen gemäß Tab. 2 und 3 behandelt und die Wahrscheinlichkeit eines tödlichen kardiovaskulären Ereignisses binnen 10 Jahren gemäß ESC SCORE bestimmt werden [33]. Bei einer Wahrscheinlichkeit < 5 % (Niedrigrisikogruppe) führen wir nur bei deutlich erhöhtem kardiovaskulärem Risiko (mindestens 3 Risikofaktoren, vergleiche Tab. 4) zum Ausschluss einer KHK eine CTKA mit CT-Koronarkalkscreening durch. Hier hat sich in der Praxis gezeigt, dass gehäuft nichtobstruktive Koronarplaques aufgedeckt werden können, die im Zusammenhang mit dem Gesamtrisikoprofil des Patienten gewürdigt werden. Ohne ein solches kardiovaskuläres Risikoprofil wird der Patient einer kurzfristigen ambulanten Nachsorge mit Echokardiographie unterzogen, um einen etwaigen dynamischen Prozess aufzudecken. Bei Patienten < 60 Jahren mit dieser Konstellation und ohne ausreichend erklärende Ursache in der Basisabklärung ergänzen wir eine kMRT, um etwaige inapparente Myokarderkrankungen zu detektieren (insbesondere aus dem inflammatorischen Formenkreis), die der Echokardiographie verborgen geblieben sind.
Tab. 4.
Kardiovaskuläre Risikofaktoren
| Adipositas |
| Alter > 70 Jahre |
| Arterieller Hypertonus (medikamentös behandelt) |
| Diabetes mellitus (medikamentös behandelt) |
| Dyslipoproteinämie (LDL-Cholesterin > 150 mg/dl oder medikamentös behandelt) |
| Positive Familienanamnese bezüglich kardiovaskulärer Erkrankung |
| Schädlicher Gebrauch von Tabak (aktiver Konsum oder zurückliegend ≥ 10 „pack years“) |
LDL Low-density-Lipoprotein
Bei akuter Myokardschädigung ist die Würdigung des kardiovaskulären Risikoprofils entscheidend
Bei einer Wahrscheinlichkeit ≥ 5 % (Hochrisikogruppe) führen wir in jedem Fall eine CTKA mit CT-Koronarkalkscreening durch. In dieser Risikogruppe können nach eigener Erfahrung regelhaft Koronarstenosen < 50 % aufgedeckt werden, die eine regelmäßige ambulante kardiologische Nachsorge nach sich ziehen sollten. Liegen in der Basisabklärung dieser Hochrisikopatienten bereits Hinweise auf eine obstruktive KHK vor, führen wir eine IKA mit Möglichkeit zur Messung der fraktionellen Flussreserve vor etwaiger Revaskularisation durch, sobald dies vonseiten des zerebralen Risikos vertretbar ist [25, 32]. Zu den Hinweisen auf das Vorliegen einer obstruktiven KHK zählen eine neu aufgetretene regionale Auffälligkeit im EKG bzw. in der Echokardiographie oder eine neu diagnostizierte linksventrikuläre Ejektionsfraktion (LVEF) ≤ 40 % sowie die vorbekannte KHK (≥ 50 %ige Stenose in mindestens einer epikardialen Koronararterie oder revaskularisierte KHK). Zu beachten ist, dass der Nutzen einer verzögerten Koronarrevaskularisation > 72 h nach Myokardschädigung hinsichtlich der Verhinderung kardialer Ereignisse im Verlauf unklar ist [22]. Daher ist es uns wichtig, die Ischämierelevanz einer Koronarstenose unter anderem durch die präprozedurale Bildgebung zu erfassen. Bei der Erstdiagnose einer systolischen Herzinsuffizienz wird zudem regelhaft eine kMRT ergänzt.
Patienten mit chronischem Myokardschaden
Die Ursache eines chronischen Myokardschadens liegt > 24 h zurück [41]. Keineswegs handelt es sich hierbei in allen Fällen um eine bereits bekannte strukturelle Herzerkrankung; auch ein mehrere Tage zurückliegender STEMI im subakuten Stadium (Stadium II) kann die formale Definition eines chronischen Myokardschadens erfüllen. In jedem Fall sollte im unmittelbaren Zusammenhang mit dem Indexaufenthalt auf der Stroke Unit eine patientenindividuelle Abklärung durch einen Kardiologen erfolgen. Eine vorausgehende Verschlechterung der kardialen Belastbarkeit, zu einer Herzinsuffizienz passende Befunde in der klinischen Untersuchung, neue regionale Auffälligkeiten im EKG oder in der Echokardiographie, eine neu diagnostizierte LVEF ≤ 40 % oder sehr hohe hs-cTn-Werte (> 5faches der oberen Normgrenze) geben Anlass zu einem frühzeitigen Vorgehen (sofern hinsichtlich des zerebralen Risikos vertretbar), gegebenenfalls noch im Rahmen des Indexaufenthalts.
Diskussion des Mannheimer Algorithmus anhand von Fällen aus der Praxis
Fall I: Akuter ischämischer Schlaganfall und nichtischämischer akuter Myokardschaden
Ein 65-jähriger Patient wurde mit in der Nacht aus dem Erwachen heraus akut aufgetretener sensomotorischer Hemiparese links zugewiesen. Aufgrund der initial schweren neurologischen Symptomatik habe er erst nach klinischer Besserung den Rettungsdienst verständigen können. Bei Vorstellung außerhalb des 4,5 h-Zeitfensters und fehlendem Nachweis eines akuten Verschlusses eines großen intrakraniellen Gefäßes bestand keine Option zur Schlaganfallakuttherapie mittels intravenöser Thrombolyse oder interventioneller Thrombektomie. Zum Vorstellungszeitpunkt persistierte lediglich eine Hemihypästhesie in der linken Körperhälfte (National-Institutes-of-Health-Stroke-Scale[NIHSS]-Score: 1 Punkt). In der kranialen MRT zeigte sich eine bereits in der Fluid-attenuated-inversion-recovery(FLAIR)-Sequenz demarkierte akute Ischämie im Stromgebiet der rechten A. cerebri media kortikal und parasagittal postzentral rechts.
Im Aufnahmelabor war der hs-cTn-I-Wert mit 0,081 µg/l (Normwert ≤ 0,045 µg/l) erhöht, in der Verlaufskontrolle nach 3 h lag er bei 0,154 µg/l (≥ 20 %iger Anstieg). Symptome einer verschlechterten kardialen Belastbarkeit oder ischämietypische EKG-Veränderungen lagen nicht vor. Kardiale Vorbefunde bestanden nicht. Die Echokardiographie zeigte eine normale LVEF ohne regionale Wandbewegungsstörungen. Die Wahrscheinlichkeit für ein tödliches kardiovaskuläres Ereignis lag gemäß ESC SCORE bei 6 % (Hochrisikogruppe).
Mittels CTKA wurde eine obstruktive KHK ausgeschlossen. Es fanden sich geringgradige Koronarplaques (< 25 %) in allen großen epikardialen Koronararterien (Abb. 2). Das CT-Koronarkalkscreening ergab ein nur leicht erhöhtes relatives Risiko für ein kardiales Ereignis (52. Perzentil).
Abb. 2.
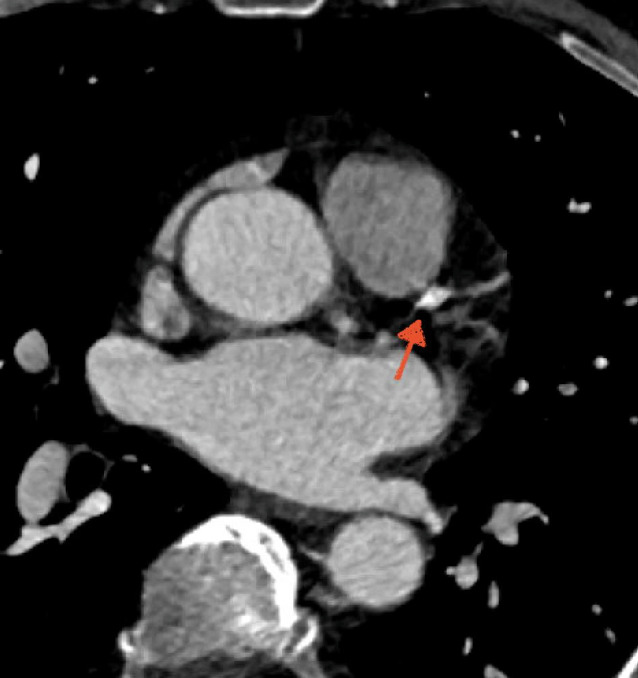
Koronare Computertomographie aus Fall I. Beispielhafte Darstellung einer kalziumreichen Koronarplaque im mittleren Ramus interventricularis anterior (Pfeil)
Dieser Fall demonstriert, dass eine dynamische hs-cTn-Erhöhung im Rahmen eines AIS nicht zwangsläufig auf eine obstruktive KHK oder gar einen MI zurückzuführen ist. Dank Durchführung der CTKA konnte eine IKA mit möglichen Interventionsrisiken vermieden werden. Vielmehr lag die Myokardschädigung letztlich am ehesten in den beschriebenen Mechanismen der Hirn-Herz-Achse begründet, die einen nichtischämischen akuten Myokardschaden im Sinne eines SIHI verursacht hatten.
Fall II: Akuter ischämischer Schlaganfall und Myokarditis bei vorbestehender Kardiomyopathie
Ein 59-jähriger Patient wurde mit akut aufgetretener, seit zwei Stunden bestehender Aphasie zugewiesen (NIHSS-Score: 6 Punkte). In der kranialen CT zeigte sich eine beginnende Ischämiedemarkation im hinteren Mediastromgebiet links. Es erfolgte eine intravenöse Thrombolyse.
Der hs-cTn-I-Wert war bei Aufnahme deutlich erhöht (5,23 µg/l; Normwert ≤ 0,045 µg/l) und stieg in der Verlaufskontrolle nach 3 h weiter an (6,36 µg/l; ≥ 20 %iger Anstieg). Symptome einer verschlechterten kardialen Belastbarkeit oder ischämietypische EKG-Veränderungen bestanden nicht. Fremdanamnestisch lag eine systolische Herzinsuffizienz unklarer Ätiologie vor. Eine KHK sei vor etlichen Jahren „ausgeschlossen“ worden. Allerdings war die Eigenanamnese erheblich durch die Aphasie eingeschränkt und es konnten nur rudimentäre, ältere kardiale Befunde über die Hausarztpraxis eingeholt werden. Die Wahrscheinlichkeit für ein tödliches kardiovaskuläres Ereignis binnen 10 Jahren lag gemäß ESC SCORE bei 2 % (Niedrigrisikogruppe). Die Echokardiographie zeigte eine mittelgradig eingeschränkte LVEF (etwa 35 %) ohne regionale Wandbewegungsstörungen.
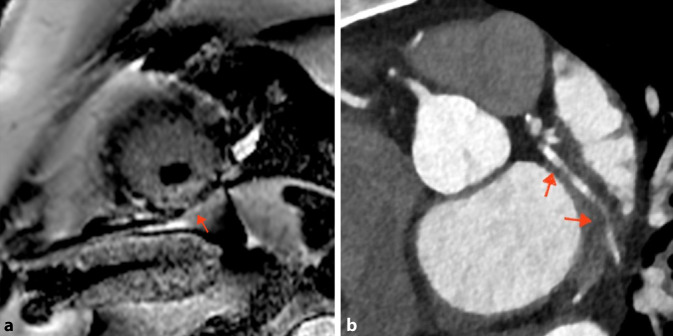
Zur Klärung der Kardiomyopathieätiologie und unter der Angabe, dass zurückliegend eine obstruktive KHK ausgeschlossen worden war, wurde zunächst eine kMRT durchgeführt. Hierbei zeigte sich eine subendokardiale ischämische Narbe im Versorgungsgebiet des Ramus circumflexus, ein streifiges „late gadolinium enhancement“ (Abb. 3a) als Hinweis auf eine Myokarditis sowie das Bild einer dilatativen Kardiomyopathie. Die LVEF zeigte sich in dieser Untersuchung sogar hochgradig eingeschränkt (28 %). Wegen der subendokardialen ischämiesuspekten Narbe wurde eine CTKA mit CT-Koronarkalkscreening ergänzt. Hierbei wurden Plaques des Ramus interventricularis anterior und des Ramus circumflexus (Abb. 3b) sowie eine mäßige Koronarsklerose (Agatston-Score: 170) nachgewiesen. Höhergradige Koronarstenosen mit Interventionsbedarf, eine Koronardissektion oder eine Koronarembolie konnten ausgeschlossen werden.
Abb. 3.
Kardiale Magnetresonanztomographie und Computertomographie-Koronarangiographie aus Fall II. a Subendokardiales „late gadolinium enhancement“ im Versorgungsgebiet des Ramus circumflexus (Pfeil). b Koronarplaques exemplarisch im Ramus circumflexus (Pfeile)
Dieser Fall veranschaulicht, dass selbst eine ausgeprägte dynamische hs-cTn-Erhöhung auf das > 100fache der oberen Normgrenze nicht zwingend eine IKA erforderlich macht. Die Basisabklärung erbrachte keine signifikanten klinischen Hinweise auf einen Typ-1-MI. Damit unterstreicht dieser Fall auch den Mehrwert nichtinvasiver Untersuchungstechniken in der Differenzialdiagnostik einer Myokardschädigung.
Fall III: Akuter ischämischer Schlaganfall und Myokardinfarkt
Eine 78-jährige Patientin wurde mit akut aufgetretener Hemiparese rechts und Dysarthrie zugewiesen (NIHSS-Score: 4 Punkte); das Zeitfenster war dabei unklar. Etwa 6 h zuvor war es zu einem Sturz auf der Straße gekommen, nach dem die Patientin aber noch eigenständig nach Hause gekommen war. Dort war dann ein erneuter Sturz mit oben beschriebener Symptomatik aufgetreten und es war der Rettungsdienst verständigt worden. In der initialen kranialen MRT zeigte sich eine akute Ischämie im Bereich der Capsula interna links, am ehesten mikroangiopathischer Genese. Bei Diffusion-weighted-imaging(DWI)-FLAIR-Mismatch wurde eine intravenöse Thrombolyse durchgeführt. Anschließend kam es jedoch zu einer weiteren klinischen Verschlechterung mit Plegie des rechten Arms und Aphasie (NIHSS-Score: 12 Punkte).
Im Rahmen der Aufnahmediagnostik fiel ein erhöhter hs-cTn-I-Wert von 1,52 µg/l (Normwert ≤ 0,045 µg/l) auf, der in der Verlaufskontrolle nach 3 h auf 5,81 µg/l anstieg. Die Patientin äußerte, eingeschränkt durch die Aphasie, keine kardialen Beschwerden. Im EKG lagen deszendierende ST-Strecken-Senkungen in I sowie V3–V5 vor. Eine in der Akutsituation durchgeführte Echokardiographie ergab eine mittelgradig eingeschränkte LVEF sowie eine apikale Hypokinesie. Die Wahrscheinlichkeit für ein tödliches kardiovaskuläres Ereignis lag gemäß ESC SCORE bei 2 % (Niedrigrisikogruppe).
Aufgrund der klinischen Hinweise auf eine obstruktive KHK wurde eine IKA innerhalb von 48 h durchgeführt. Hierbei zeigte sich eine visuell obstruktive Stenose des Ramus interventricularis anterior, die mit einem „drug-eluting stent“ behandelt wurde (Abb. 4). Eine Woche später erfolgte eine erneute Echokardiographie, in der eine nur noch leichtgradig eingeschränkte LVEF (48 %) ohne Hinweis auf eine regionale Wandbewegungsstörung zu sehen war. In der Zusammenschau ergab sich das Bild eines NSTEMI-ACS, am ehesten im Rahmen eines Typ-2-MI.
Abb. 4.
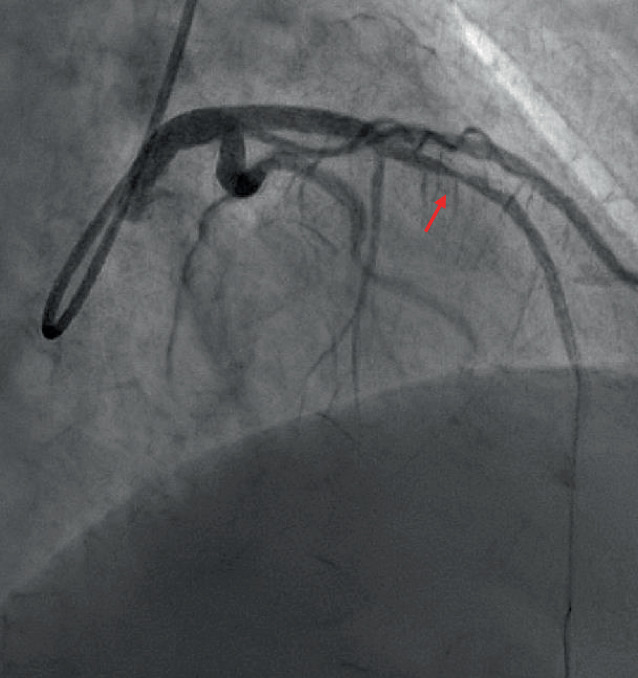
Invasive Koronarangiographie aus Fall III. Visuell obstruktive Stenose des Ramus interventricularis anterior (Pfeil)
Dieser Fall zeigt, dass gerade bei AIS-Patienten ein Myokardinfarkt klinisch inapparent verlaufen kann, da zum einen die AIS-Symptomatik eine kardiale Symptomatik potenziell „verdeckt“ und zum anderen Beschwerden aufgrund einer Aphasie oder Dysarthrie nicht geäußert werden können. Bei akuter Myokardschädigung sollte daher auch im Falle einer fehlenden Symptomatik schnellstmöglich mittels EKG und Echokardiographie nach Hinweisen auf eine obstruktive KHK gesucht werden, um die weitere Therapie nicht zu verzögern.
Fazit für die Praxis
Der prognostische Nutzen einer invasiven Koronarangiographie (IKA) abseits zwingender Indikationen (klinische Hinweise auf akutes Koronarsyndrom mit Typ-1-Myokardinfarkt, Koronardissektion, Koronarembolie, persistierender Koronarspasmus, kardiogener Schock) bleibt bei Patienten mit akutem ischämischem Schlaganfall und Erhöhung des hochsensitiven kardialen Troponins weiter unklar, sodass in der Mehrzahl der Fälle alternative Diagnostika zur ätiologischen Klärung angewendet werden können.
Zur evidenzbasierten Strukturierung eines risikoadaptierten Vorgehens kann der Mannheimer Algorithmus zu akutem ischämischem Schlaganfall und Troponinerhöhung herangezogen werden.
Die in Planung befindliche Studie „Prognostic Impact of Coronary Angiography in Patients with Acute Ischemic Stroke and Troponin Elevation“ (COAST) wird entscheidende neue Hinweise zum Stellenwert der IKA in dieser Population liefern und Einfluss auf das praktische Vorgehen haben.
Abkürzungen
- ACS
„Acute coronary syndrome“ (akutes Koronarsyndrom)
- AIS
Akuter ischämischer Schlaganfall
- CT(KA)
Computertomographie(-Koronarangiographie)
- EKG
Elektrokardiogramm
- ESC
„European Society of Cardiology“ (Europäische Gesellschaft für Kardiologie)
- FLAIR
„Fluid-attenuated inversion recovery“
- hs-cTn
„High-sensitivity cardiac troponin“ (hochsensitives kardiales Troponin)
- IKA
Invasive Koronarangiographie
- KHK
Koronare Herzkrankheit
- (k)MRT
(Kardiale) Magnetresonanztomographie
- LVEF
Linksventrikuläre Ejektionsfraktion
- MI
Myokardinfarkt
- NIHSS
National Institutes of Health Stroke Scale
- (N)STEMI
„(Non‑)ST-elevation myocardial infarction“ ([Nicht-]ST-Strecken-Hebungs-Myokardinfarkt)
- SIHI
„Stroke-induced heart injury“ (schlaganfallinduzierter Herzschaden)
Funding
Open Access funding enabled and organized by Projekt DEAL.
Einhaltung ethischer Richtlinien
Interessenkonflikt
L. Becker, A. Alonso, M. Kruska, S. Baumann, N. Grassl, H. Lesch, P. Eisele, T. Sieburg, M. Behnes, T. Schupp, H. Kayed, M. Platten, D. Duerschmied, K. Szabo, I. Akin und C. Fastner geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autor/-innen keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes

QR-Code scannen & Beitrag online lesen
Hinweis des Verlags
Der Verlag bleibt in Hinblick auf geografische Zuordnungen und Gebietsbezeichnungen in veröffentlichten Karten und Institutsadressen neutral.
Literatur
- 1.Achenbach S, Barkhausen J, Beer M et al (2012) Konsensusempfehlungen der DRG/DGK/DGPK zum Einsatz der Herzbildgebung mit Computertomographie und Magnetresonanztomographie. Kardiologe 6:105–125. 10.1007/s12181-012-0417-8 10.1007/s12181-012-0417-8 [DOI] [Google Scholar]
- 2.Ahn S‑H, Kim Y‑H, Lee J‑S et al (2019) Troponin I Levels and Long-Term Outcomes in Acute Ischemic Stroke Patients. J Am Coll Cardiol 73:525–526. 10.1016/j.jacc.2018.11.022 10.1016/j.jacc.2018.11.022 [DOI] [PubMed] [Google Scholar]
- 3.Ärzteblatt DÄG Redaktion Deutsches (2010) Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Arzneimittel-Richtlinie (AM-RL) in Anlage IV: Therapiehinweis zu Prasugrel. https://www.aerzteblatt.de/archiv/78881/Beschluss-des-Gemeinsamen-Bundesausschusses-ueber-eine-Aenderung-der-Arzneimittel-Richtlinie-(AM-RL)-in-Anlage-IV-Therapiehinweis-zu-Prasugrel. Zugegriffen: 30. Oktober 2023
- 4.Auer J (2015) Coronary evaluation in patients with stroke: Recognizing the risk. Atherosclerosis 238:427–429. 10.1016/j.atherosclerosis.2014.11.010 10.1016/j.atherosclerosis.2014.11.010 [DOI] [PubMed] [Google Scholar]
- 5.Baumann S, Overhoff D, Tesche C et al (2023) Morphologische und funktionelle Diagnostik der koronaren Herzkrankheit mittels Computertomographie. Herz 48:39–47. 10.1007/s00059-022-05098-7 10.1007/s00059-022-05098-7 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Biso SM, Lu M, De Venecia TA et al (2017) Clinical Characteristics, Management, and Outcomes of Suspected Poststroke Acute Coronary Syndrome. Cardiol Res Pract 2017:3762149. 10.1155/2017/3762149 10.1155/2017/3762149 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Buckley BJR, Harrison SL, Hill A et al (2022) Heart Syndrome: Incidence and Clinical Outcomes of Cardiac Complications Following Stroke. Stroke. Stroke 53:1759–1763. 10.1161/STROKEAHA.121.037316 10.1161/STROKEAHA.121.037316 [DOI] [PubMed] [Google Scholar]
- 8.Byrne RA, Rossello X, Coughlan JJ et al (2023) ESC Guidelines for the management of acute coronary syndromes: Developed by the task force on the management of acute coronary syndromes of the European Society of Cardiology (ESC). Eur Heart J 202(3):ehad191. 10.1093/eurheartj/ehad191 10.1093/eurheartj/ehad191 [DOI] [Google Scholar]
- 9.Chaulin A (2021) Elevation Mechanisms and Diagnostic Consideration of Cardiac Troponins under Conditions Not Associated with Myocardial Infarction. Part 1. Life 11:914. 10.3390/life11090914 10.3390/life11090914 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Chaulin AM (2021) Elevation Mechanisms and Diagnostic Consideration of Cardiac Troponins under Conditions Not Associated with Myocardial Infarction. Part 2. Life 11:1175. 10.3390/life11111175 10.3390/life11111175 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Collet J‑P, Thiele H, Barbato E et al (2021) 2020 ESC guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 42:1289–1367. 10.1093/eurheartj/ehaa575 10.1093/eurheartj/ehaa575 [DOI] [PubMed] [Google Scholar]
- 12.DeFilippis AP, Chapman AR, Mills NL et al (2019) Assessment and Treatment of Patients With Type 2 Myocardial Infarction and Acute Nonischemic Myocardial Injury. Circulation 140:1661–1678. 10.1161/CIRCULATIONAHA.119.040631 10.1161/CIRCULATIONAHA.119.040631 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Giannitsis E, Hamm CW, Zahn R, Katus HA (2019) Kommentar zur vierten Universellen Definition des Myokardinfarkts der gemeinschaftlichen ESC/ACCF/AHA/WHF Task Force. Kardiologe 13:337–345. 10.1007/s12181-019-00343-6 10.1007/s12181-019-00343-6 [DOI] [Google Scholar]
- 14.Grassl N, Baumann S, Kruska M et al (2021) Akuter ischämischer Schlaganfall und Troponinerhöhung: Diagnostische Abklärung und therapeutische Konsequenzen. DMW – Dtsch Med. Wochenschr, Bd. 146, S 534–541 10.1055/a-1308-7490 [DOI] [PubMed] [Google Scholar]
- 15.Gray AJ, Roobottom C, Smith JE et al (2021) Early computed tomography coronary angiography in patients with suspected acute coronary syndrome: randomised controlled trial. BMJ. 10.1136/bmj.n2106 10.1136/bmj.n2106 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Gueret P, Deux J‑F, Bonello L et al (2013) Diagnostic Performance of Computed Tomography Coronary Angiography (from the Prospective National Multicenter Multivendor EVASCAN Study). Am J Cardiol 111:471–478. 10.1016/j.amjcard.2012.10.029 10.1016/j.amjcard.2012.10.029 [DOI] [PubMed] [Google Scholar]
- 17.Guidelines for the Early Management of Patients With Acute Ischemic Stroke: 2019 Update to the 2018 Guidelines for the Early Management of Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. 10.1161/STR.0000000000000211
- 18.Gunnoo T, Hasan N, Khan MS et al (2016) Quantifying the risk of heart disease following acute ischaemic stroke: a meta-analysis of over 50 000 participants. Bmj Open 6:e9535. 10.1136/bmjopen-2015-009535 10.1136/bmjopen-2015-009535 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Gupta S, Vaidya SR, Arora S et al (2017) Type 2 versus type 1 myocardial infarction: a comparison of clinical characteristics and outcomes with a meta-analysis of observational studies. Cardiovasc Diagn Ther 7:348–358. 10.21037/cdt.2017.03.21 10.21037/cdt.2017.03.21 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Hagar MT, Soschynski M, Saffar R et al (2023) Accuracy of Ultrahigh-Resolution Photon-counting CT for Detecting Coronary Artery Disease in a High-Risk Population. Radiology 307:e223305. 10.1148/radiol.223305 10.1148/radiol.223305 [DOI] [PubMed] [Google Scholar]
- 21.He M, Panchangam S, Cruz B, Mukherjee D (2019) Underutilization of Cardiac Therapies in Patients with Acute Ischemic Stroke and Elevated Troponin. Cardiovasc Hematol Agents Med Chem 17:144–151. 10.2174/1871525717666191019115338 10.2174/1871525717666191019115338 [DOI] [PubMed] [Google Scholar]
- 22.Hochman JS, Lamas GA, Buller CE et al (2006) Coronary Intervention for Persistent Occlusion after Myocardial Infarction. N Engl J Med 355:2395–2407. 10.1056/NEJMoa066139 10.1056/NEJMoa066139 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Ileri C, Ozben B, Dogan Z et al (2021) Predictors of Concomitant Coronary Artery Disease and Major Cardiovascular Events in Patients with Acute Ischemic Stroke. Neurol India 69:916–922. 10.4103/0028-3886.323893 10.4103/0028-3886.323893 [DOI] [PubMed] [Google Scholar]
- 24.Incidence of stroke in patients with hypertrophic cardiomyopathy in stable sinus rhythm during long-term monitoring – International Journal of Cardiology. https://www.internationaljournalofcardiology.com/article/S0167-5273(23)00523-5/fulltext. Zugegriffen: 16. Januar 2024 [DOI] [PubMed]
- 25.Knuuti J, Wijns W, Saraste A et al (2020) 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J 41:407–477. 10.1093/eurheartj/ehz425 10.1093/eurheartj/ehz425 [DOI] [PubMed] [Google Scholar]
- 26.Kruska M, Kolb A, Fastner C et al (2022) Coronary Artery Disease in Patients Presenting With Acute Ischemic Stroke or Transient Ischemic Attack and Elevated Troponin Levels. Front Neurol 12:781553. 10.3389/fneur.2021.781553 10.3389/fneur.2021.781553 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Leiner T, Bogaert J, Friedrich MG et al (2020) SCMR Position Paper (2020) on clinical indications for cardiovascular magnetic resonance. J Cardiovasc Magn Reson 22:76. 10.1186/s12968-020-00682-4 10.1186/s12968-020-00682-4 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Liao J, O’Donnell MJ, Silver FL et al (2009) In-hospital myocardial infarction following acute ischaemic stroke: an observational study. Eur J Neurol 16:1035–1040. 10.1111/j.1468-1331.2009.02647.x 10.1111/j.1468-1331.2009.02647.x [DOI] [PubMed] [Google Scholar]
- 29.Litmeier S, Meinel TR, von Rennenberg R et al (2022) Coronary angiography in acute ischemic stroke patients: frequency and determinants of pathological findings in a multicenter cohort study. J Neurol 269:3745–3751. 10.1007/s00415-022-11001-5 10.1007/s00415-022-11001-5 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Mashayekhi K, Bufe A, Werner GS et al (2021) Behandlung von chronischen Koronarverschlüssen (CTO) – Positionspapier der Deutschen Gesellschaft für Kardiologie. Kardiologe 15:320–340. 10.1007/s12181-021-00486-5 10.1007/s12181-021-00486-5 [DOI] [Google Scholar]
- 31.Mochmann H‑C, Scheitz JF, Petzold GC et al (2016) Coronary Angiographic Findings in Acute Ischemic Stroke Patients With Elevated Cardiac Troponin: The Troponin Elevation in Acute Ischemic Stroke (TRELAS) Study. Circulation 133:1264–1271. 10.1161/CIRCULATIONAHA.115.018547 [DOI] [PubMed]
- 32.Neumann F‑J, Sousa-Uva M, Ahlsson A et al (2019) 2018 ESC/EACTS guidelines on myocardial revascularization. Eur Heart J 40:87–165. 10.1093/eurheartj/ehy394 10.1093/eurheartj/ehy394 [DOI] [PubMed] [Google Scholar]
- 33.Rücker V, Keil U, Fitzgerald AP et al (2016) Predicting 10-Year Risk of Fatal Cardiovascular Disease in Germany: An Update Based on the SCORE-Deutschland Risk Charts. PLoS ONE 11:e162188. 10.1371/journal.pone.0162188 10.1371/journal.pone.0162188 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Sabatine MS (2021) Differentiating Type 1 and Type 2 Myocardial Infarction: Unfortunately, Still More Art Than Science. JAMA Cardiol 6:781. 10.1001/jamacardio.2021.0693 [DOI] [PubMed]
- 35.Scheitz JF, Mochmann H‑C, Erdur H et al (2014) Prognostic relevance of cardiac troponin T levels and their dynamic changes measured with a high-sensitivity assay in acute ischaemic stroke: Analyses from the TRELAS cohort. Int J Cardiol 177:886–893. 10.1016/j.ijcard.2014.10.036 10.1016/j.ijcard.2014.10.036 [DOI] [PubMed] [Google Scholar]
- 36.Scheitz JF, Nolte CH, Doehner W et al (2018) Stroke-heart syndrome: clinical presentation and underlying mechanisms. Lancet Neurol 17:1109–1120. 10.1016/S1474-4422(18)30336-3 [DOI] [PubMed]
- 37.Sposato LA, Hilz MJ, Aspberg S et al (2020) Post-Stroke Cardiovascular Complications and Neurogenic Cardiac Injury: JACC State-of-the-Art Review. J Am Coll Cardiol 76:2768–2785. 10.1016/j.jacc.2020.10.009 [DOI] [PubMed]
- 38.Sposato LA, Lam M, Allen B et al (2020) First-Ever Ischemic Stroke and Incident Major Adverse Cardiovascular Events in 93 627 Older Women and. Men Stroke 51:387–394. 10.1161/STROKEAHA.119.028066 10.1161/STROKEAHA.119.028066 [DOI] [PubMed] [Google Scholar]
- 39.Stengl H, Ganeshan R, Hellwig S et al (2022) Frequency, associated variables, and outcomes of acute myocardial injury according to the fourth Universal Definition of Myocardial Infarction in patients with acute ischemic stroke. Eur Stroke J 7:413–420. 10.1177/23969873221120159 10.1177/23969873221120159 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.The DISCHARGE Trial Group, Maurovich-Horvat P, Bosserdt M et al (2022) CT or Invasive Coronary Angiography in Stable Chest Pain. N Engl J Med 386:1591–1602. 10.1056/NEJMoa2200963 10.1056/NEJMoa2200963 [DOI] [PubMed] [Google Scholar]
- 41.The ESC Textbook of Cardiovascular Medicine | ESC Publications | Oxford Academic. https://academic.oup.com/esc/book/35489. Zugegriffen: 18. Oktober 2023
- 42.Thygesen K, Alpert JS, Jaffe AS et al (2019) Fourth universal definition of myocardial infarction (2018). Eur Heart J 40:237–269. 10.1093/eurheartj/ehy462 10.1093/eurheartj/ehy462 [DOI] [PubMed] [Google Scholar]
- 43.Wang G (2019) A systematic review on the triggers and clinical features of type 2 myocardial infarction. Clin Cardiol 42:1019–1027. 10.1002/clc.23230 10.1002/clc.23230 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Wang K‑L, Meah MN, Bularga A et al (2022) Computed tomography coronary angiography in non-ST-segment elevation myocardial infarction. Br J Radiol 95:20220346. 10.1259/bjr.20220346 10.1259/bjr.20220346 [DOI] [PMC free article] [PubMed] [Google Scholar]