Abstract
目的
探究2型登革病毒 (DENV-2)感染人脐静脉内皮细胞(HUVECs)对细胞自噬的影响及黄芩苷(BA)抗DENV-2感染的具体作用机制。
方法
HUVECs体外培养,设置对照组:HUVECs正常培养;DENV-2感染组:HUVECs+DENV-2;黄芩苷组:HUVECs+DENV-2+BA。用DENV-2感染HUVECs通过透射电镜观察自噬;Western blotting检测细胞自噬相关蛋白LC3、P62的表达,采用溶酶体红色荧光探针染色法观察DENV-2感染后HUVECs内溶酶体的pH变化;蛋白质组学筛查DENV-2感染HUVECs后差异蛋白的表达情况;使用CCK-8法测定黄芩苷对HUVECs活性的影响; RT-qPCR检测细胞内病毒RNA的复制情况;检测病毒NS1蛋白的表达情况;通过透射电镜观察细胞自噬;采用Lyso-Tracker Red染色法观察黄芩苷对DENV-2感染后HUVECs内溶酶体酸化的影响;检测细胞自噬相关蛋白ATG5、Beclin-1、LC3、P62的表达,自噬小体和溶酶体融合的关键蛋白STX17、SNAP29、VAMP8表达情况及PI3K/AKT信号通路相关蛋白的表达。
结果
DENV-2感染可诱导细胞自噬小体的形成;DENV-2感染后LC3 Ⅱ/LC3 I表达逐渐增高,48 h达到峰值(P<0.05);p62表达水平在感染前中期无明显变化,48 h后降低(P<0.05);Lysotracker red染色结果显示DENV-2感染组红色亮点较多,且染色明亮。CCK-8结果显示50 μg/mL被视为黄芩苷对HUVECs细胞的最大无毒剂量。RT-qPCR结果显示随着黄芩苷浓度增加药物对病毒的抑制作用增强。黄芩苷可降低DENV-2 NS1蛋白的表达(P<0.001)。与DENV-2组相比,经过黄芩苷(50 μg/mL)处理后,自噬减少,加入黄芩苷后抑制溶酶体酸化。黄芩苷组48 h LC3 II/LC3 I比值降低(P<0.05),48 h时p62表达增加(P<0.05)。经过黄芩苷处理后DENV-2诱导的自噬相关蛋白Beclin-1、ATG 5、STX17、SNAP29和VAMP8的表达下调(P<0.01)。蛋白组学结果显示PI3K-AKT通路在DENV的发病机制中可能发挥重要作用。加入PI3K抑制剂(LY294002)后,DENV-2的RNA表达水平降低,各组p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白相对表达水平的蛋白表达水平降低(P<0.01)。用黄芩苷处理后,DENV-2感染组PI3K、AKT的mRNA表达水平均显著降低(P<0.05),而mTOR mRNA表达无明显变化。DENV-2感染组上调的p-PI3K、p-AKT的蛋白表达水平均降低(P<0.05),而p-mTOR表达无明显变化。DENV-2诱导的LC3、P62蛋白表达降低(P<0.05);在黄芩苷治疗组中也抑制了病毒诱导的自噬。
结论
DENV-2感染可促进HUVECs细胞自噬的发生,黄芩苷可抑制DENV-2的RNA和NS1蛋白的表达,可能通过抑制自噬发生及自噬体和溶酶体融合,降低DENV-2诱导的自噬,其作用机制可能是通过PI3K/AKT信号通路调控。
Keywords: 登革病毒, 黄芩苷, 自噬, PI3K/AKT, 人脐静脉内皮细胞
Abstract
Objective
To investigate the effect of type 2 dengue virus (DENV-2) infection on autophagy in human umbilical vein endothelial cells (HUVECs) and the mechanism mediating the inhibitory effect of baicalin against DENV-2 infection.
Methods
Cultured HUVECs with DENV-2 infection were treated with different concentrations of baicalin, and the changes in autophagy of the cells were detected using transmission electron microscopy. Lyso Tracker Red staining was used to examine pH changes in the lysosomes of the cells, and the expressions of ATG5, beclin-1, LC3, P62, STX17, SNAP29, VAMP8, and PI3K/AKT signaling pathway-related proteins were detected by Western blotting. DENV-2 replication in the cells were evaluated using RT-qPCR. The differentially expressed proteins in DENV-2-infected HUVECs were identified by proteomics screening.
Results
Treatment with baicalin did not significantly affect the viability of cultured HUVECs. Proteomic studies suggested that the PI3K-AKT pathway played an important role in mediating cell injury induced by DENV-2 infection. The results of RT-qPCR demonstrated that baicalin dose-dependently inhibited DENV-2 replication in HUVECs and produced the strongest inhibitory effect at the concentration of 50 μg/mL. Transmission electron microscopy, Lyso Tracker Red staining, RT-qPCR, and Western blotting all showed significant inhibitory effect of baicalin on DENV-2-induced autophagy in HUVECs. DENV-2 infection of HUVECs caused increased cellular expressions of LC3 and P62 proteins, which were significantly lowered by treatment with LY294002 (a PI3K inhibitor).
Conclusion
Baicalin inhibits DENV-2 replication in HUVECs and suppresses DENV-2-induced cell autophagy by inhibiting the PI3K/AKT signaling pathway.
Keywords: dengue virus, baicalin, autophagy, PI3K/AKT signaling, human umbilical vein endothelial cells
登革热(DF)是最常见的蚊媒病毒性传染病之一[1],目前在128个热带和亚热带国家流行[2]。该病由登革热病毒(DENV)引起,临床表现广泛,从导致急性发热的DF到危及生命的登革出血热或登革休克综合征[3]。登革热病毒属于黄病毒科黄病毒属,是一种正链RNA病毒,病毒基因组的长度约为10.7 kb,编码一个开放的阅读框,可转化为3种结构蛋白(C、pr M、E)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)[4]。DENV有4种不同的血清型(DENV-1、2、3和4),人群普遍易感,其中DENV-2流传最为广泛[5,6]。近几十年来,DF的发病率急剧上升[7]。据世界卫生组织估计,全球每年有100亿~400亿例感染病例,全球近一半的人口面临感染风险[8]。DF的发病机制尚不清楚,目前尚无针对该病的特效治疗药物[9]。
近年来,许多研究人员将重点放在植物及其衍生物上,以开发新的抗病毒药物。黄芩苷(BA)是一种从黄芩根中分离得到的天然黄酮类化合物,具有抗病毒、抑菌、抗肿瘤和抗氧化作用[10, 11]。研究表明黄芩苷对DENV-2具有较好的抗病毒活性,包括预防、抗吸附、抑制细胞内的病毒复制和直接杀灭细胞外的病毒颗粒,并影响DENV与宿主细胞的病毒附着[10, 12]。然而,黄芩苷的确切作用机制尚不清楚,一定程度上限制了该药的应用,故需要进行深入的研究[13]。
自噬是一种依赖溶酶体的细胞降解程序,可响应各种环境和细胞应激,有助于细胞处理各种有害或过剩的细胞内容物,如蛋白质聚集体、功能失调/寿命长的细胞器、细胞内病原体和储存的营养物质(糖原和脂滴)等[14]。研究表明,已知DENV可诱导自噬,有益于病毒复制[15-17]。PI3K抑制剂可减少自噬体形成和DENV复制[15, 18]。因此,靶向PI3K/AKT可作为一种有前途的抗登革热治疗。据报道,黄芩苷通过PI3K/AKT信号通路调节自噬[19, 20]。但目前未见黄芩苷参与调控PI3K/AKT信号通路与DENV-2感染之间关系的报道。本研究拟在分析黄芩苷对DENV-2抑制作用的基础上,进一步探究黄芩苷对宿主细胞自噬的影响及PI3K/AKT信号通路的调控作用,明晰黄芩苷抗DENV-2感染的作用机制,为黄芩苷在DENV-2临床上的应用及相关靶点药物的研究提供理论依据。
1. 材料和方法
1.1. 材料
人皮静脉内皮细胞(HUVECs)(Scien cell)。C6/36细胞和DENV NGC毒株由本实验室于液氮保存。黄芩苷(北京索莱宝科技有限公司),ECM培养基(Scien cell)。Lyso-Tracker Red(溶酶体红色荧光探针)(碧云天生物科技),Real time PCR仪器(Thermo quantstudio 3),酶标仪(Bio-RAD),超微量紫外可见分光光度计(Thermo)。
1.2. 方法
1.2.1. 细胞和病毒的培养
HUVECs和C6/26细胞复苏后分别加入ECM完全培养基(10% FBS+1% PS+1% ECGS+88% ECM培养基)和1640完全培养基(10% FBS+1% PS+89% 1640培养基),放入37 ℃和28 ℃,5% CO2培养。待细胞生长至90%融合度时,加入适量0.25%胰蛋白酶(含0.02% EDTA)消化,1000 r/min,5 min收集细胞,重悬后在培养箱中继续培养。
1.2.2. DENV-2的扩增
待C6/36细胞长成90%左右融合。弃去原培养液加入DENV-2毒液500 μL,置于28 ℃、5% CO2培养箱中培养2 h,摇晃1次/30 min,吸弃毒液后用Hanks液洗涤3次,加入5 mL 2% 1640维持液(2% FBS, 1% P/S)置于37 ℃、5% CO2培养箱中继续培养,每天观察细胞病变情况,出现明显细胞病变现象(空泡、拉丝、融合)时,收集毒液。于液氮中保存。
1.2.3. DENV-2的毒力测定
向C6/36细胞中加入适量不同浓度的病毒液(10-3~10-10),每个浓度设置8个复孔,37 ℃,5% CO2培养箱中孵育2 h,弃上清,Hanks液洗涤3次,每孔添加200 μL 2%维持液继续培养,每天观察并记录细胞病变情况。利用Reed-Muench法计算DENV-2对C6/36细胞的毒力,具体公式:距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数)。LgTCID50=距离比例×稀释度对数之间的差+高于50%病变率的稀释度的对数。
1.2.4. CCK-8法测黄芩苷对HUVEC细胞活性影响
将HUVECs细胞按2×104/孔接种于96孔板中,于37 ℃ 5% CO2中培养。待细胞长至80%~90%融合时,弃去原培养基,加入不同浓度的黄芩苷(6.25、12.5、25、50、100、200 μg/mL),每个浓度设置3个复孔,并设置空白对照组。培养48 h后吸弃原培养基,PBS清洗2遍。每孔加入10 μL CCK-8溶液和100 μL 2% ECM完全培养基,37 ℃培养基2 h后,用酶标仪检测450 nm处A值,取3孔均值计算细胞存活率(%)。
细胞存活率(%)=(A 药物处理组-A 空白对照组)/(A 无药物处理组-A 空白对照组) ×100%
1.2.5. RT-qPCR检测细胞中mRNA表达水平
Trizol法提取细胞RNA,采取染料法进行RT-qPCR检测,反应体系(20 μL):2× ChamQ SYBR qPCR Master Mix 4 μL,上、下游引物各0.4 μL,50× ROX Reference Dye 1 0.4 μL,cDNA 1 μL,ddH2O 7.8 μL。反应条件:95 ℃预变性30 s;95 ℃,10 s,60 ℃,30 s,共40个循环。随后95 ℃反应15 s、60 ℃反应60 s,95 ℃反应15 s绘制熔解曲线。以上所有体系分析均设置3个重复,结果采用2-ΔΔCt方法进行数据处理。DENV-2引物序列上游序列为5'-GATGTAGACCTCGGAAGCGG-3',下游序列为5'- TCGGTTCTTGGGTTCTCGTG-3';PI3K引物序列上游序列为5'-CGGTGACTGTGTGGGACTTATTGAG-3',下游序列为5'- TGTAGTGTGTGGCTGTTGAACTGC-3';AKT引物序列上游序列为5'-GCAGGATGT GGACCAACGTGAG-3',下游序列为5'-GCAGGCAG CGGATGATGAAGG-3';mTOR引物序列上游序列为5'-GCCGAGAGCACCGAGAACAG-3',下游序列为5'-ACAAGGAGATGGAACGGAAGAAGC-3';β-actin引物序列上游序列为5'-CCTTCCTGGGCATGGA GTC-3',下游序列为5'-TGATCTTCATTGTGCTGG GTG-3'。
1.2.6. 透射电镜检测自噬小体
使用黄芩苷处理DENV-2感染的HUVECs,0.25%胰酶消化细胞,1000 r/min 离心5 min后收集细胞沉淀。加入3%戊二醛预固定细胞后,加入1%四氧化锇再固定,使用丙酮按浓度梯度(30%→50%→70%→80%→90%→95%→100%(100%浓度3次))逐级脱水。并利用Epon812包埋后采用超薄切片机制备大约60~90 nm的超薄切片、展片。醋酸铀染色10~15 min,柠檬酸铅室温染色1~2 min,最后透射电镜拍摄自噬小体。
1.2.7. Western blotting检测细胞中相关蛋白表达水平
使用裂解液提取细胞总蛋白,经SDS-PAGE电泳分离蛋白后转至PVDF膜上,5% BSA室温封闭2 h,加入一抗4 ℃孵育过夜,1×TBST洗膜;加入辣根过氧化物酶标记的二抗(1∶8000)室温孵育2 h,1×TBST洗膜,用ECL发光液显影。使用Image-J软件分析灰度,计算蛋白的相对表达量。
1.2.8. Lyso-Tracker Red检测细胞溶酶体
将HUVECs以4.5×105/孔接种于六孔板,感染DENV-2后加入黄芩苷处理。以1 mL/孔加入Lyso-Tracker Red工作液(Lyso-Tracker Red:培养液=1:13333)37 ℃孵育1 h,去除Lyso-Tracker Red工作液,加入1 mL 稀释的Hoechst33342染色液(Hoechst 33342 染色液:培养基=1∶100),37 ℃孵育10 min,吸除培养基,PBS洗2遍,加入新鲜培养基,倒置荧光显微镜观察溶酶体。
1.2.9. 样品质谱分析
将感染后的细胞裂解,提取总蛋白,采用串联质谱标签(TMT)标记联合液相色谱-串联质谱技术(LC-MS/MS)进行蛋白质组学分析,鉴定DENV-2干预的差异蛋白并进行KEGG富集分析。
1.3. 统计学分析
利用GraphPad Prism Version 9.0版本对实验数据进行分析,所有实验均独立重复3次。组间差异通过单因素方差分析进行比较,两组间差异通过t检验进行比较,结果以均数±标准差表示,以P<0.05表示差异有统计学意义。
2. 结果
2.1. DENV-2的感染及病毒滴度测定
DENV-2感染C6/36细胞后利用倒置显微镜拍摄其病变现象,可见C6/36细胞出现明显的细胞空泡、融合等病变现象(图1)。根据Reed-Muench法计算DENV-2对C6/36细胞的毒力,结果为TCID50=10-6.67/0.1 mL,即将DENV-2稀释106,接种100 μL可使50%的细胞发生病变(表1)。
图1.

DENV-2感染C6/36细胞病变图
Fig.1 Pathological changes of C6/36 cells infected by DENV-2 (Original magnification: ×100). A: Blank control cells. B: DENV-2-infected cells.
表1.
DENV-2病毒滴度结果统计表
Tab.1 Virulence of DENV-2 virus at different titers in C6/36 cells
| Dilution of virus solution | Number of CPE occurrences | No CPE count | Total number | % of CPE holes present | |
|---|---|---|---|---|---|
| Number of CPE holes | No CPE count | ||||
| 10-3 | 8 | 0 | 34 | 0 | 100 |
| 10-4 | 8 | 0 | 26 | 0 | 100 |
| 10-5 | 8 | 0 | 18 | 0 | 100 |
| 10-6 | 8 | 0 | 10 | 2 | 100 |
| 10-7 | 2 | 6 | 2 | 6 | 25 |
| 10-8 | 0 | 8 | 0 | 14 | 0 |
| 10-9 | 0 | 8 | 0 | 22 | 0 |
| 10-10 | 0 | 8 | 0 | 30 | 0 |
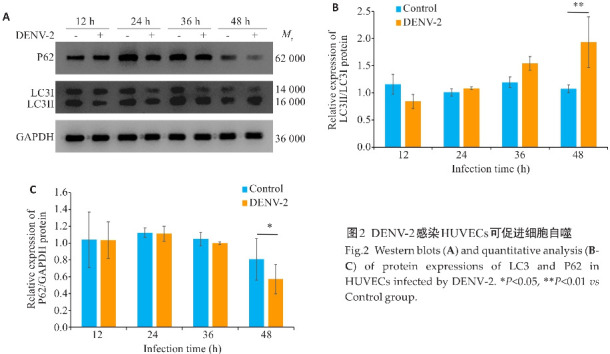
2.2. DENV-2的感染增加HUVECs自噬水平
采用DENV-2感染HUVECs 12、24、36、48 h后Western blotting检测自噬标志性蛋白LC3、P62的表达变化(图2),从12 h DENV-2的LC3 Ⅱ/LC3 Ⅰ水平逐渐升高,48 h达到峰值;与空白组相比,48 h DENV-2组LC3-Ⅱ表达显著增加(P<0.01);DENV-2组HUVECs内P62蛋白表达逐渐降低,48 h DENV-2组P62表达显著降低(P<0.05)。
2.3. 透射电子显微镜观察DENV-2的感染促进HUVECs自噬发生
采用DENV-2感染HUVECs 48 h后,透射电子显微镜结果提示,与空白组相比,DENV-2感染组有较多自噬发生,可以观察到更多的自噬体和自噬溶酶体(图3)。
图3.
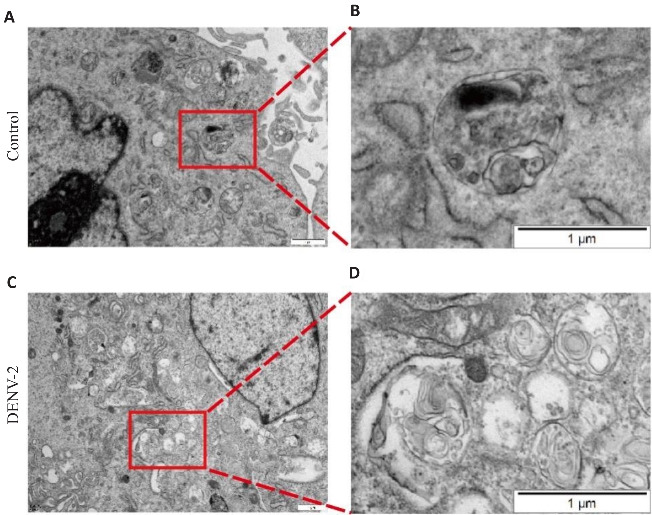
DENV-2感染HUVECs诱导细胞自噬的发生
Fig.3 DENV-2 infection induces autophagy in HUVECs (×15000, n=3). A, B: Control group. C, D: DENV-2 group.
2.4. 倒置荧光显微镜检测DENV-2感染HUVECs后溶酶体功能升高
倒置荧光显微镜结果提示,Control组细胞质中颜色黯淡,红色亮点少,而DENV-2感染组红色亮点较多,且染色明亮(图4)。
图4.
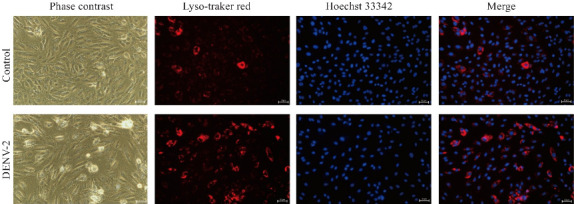
DENV-2感染HUVECs后溶酶体的功能增强
Fig.4 DENV-2 infection enhances lysosomal function in HUVECs (Lyso-tracker Red staining, ×400, n=3).
2.5. 不同浓度黄芩苷对HUVECs细胞活性的影响
利用CCK8法检测黄芩苷对HUVECs细胞活性的影响,结果显示,黄芩苷对HUVECs的半数毒性浓度(TCID50)为118.5 μg/mL。黄芩苷在稀释至50 μg/mL时,HUVECs细胞存活率为(89±5.62)%,且随着浓度降低,黄芩苷对HUVECs细胞活性无明显影响,而100 μg/mL和200 μg/mL浓度对HUVECs细胞活性具有明显抑制作用(图5)。因此50 μg/mL浓度被视为黄芩苷对HUVECs细胞的最大无毒剂量。故黄芩苷浓度设置为6.25、12.5、25、50 μg/mL。
图5.
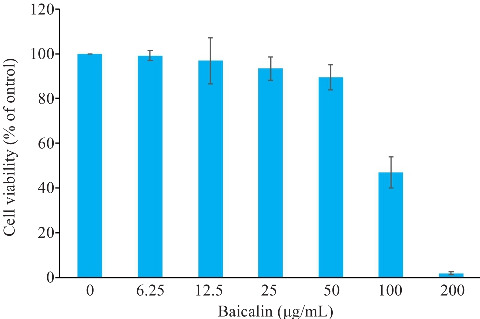
黄芩苷对HUVECs细胞活性的影响
Fig.5 Effect of Baicalin on viability of HUVECs cells (n=3).
2.6. 黄芩苷降低DENV-2感染HUVECs细胞的DENV RNA表达
通过测定DENV-2 RNA的相对表达量确定黄芩苷最佳使用浓度。结果表示,使用黄芩苷处理DENV-2感染的HUVECs,使DENV基因拷贝数量降低,呈剂量依赖性。黄芩苷浓度为6.25、12.5、25 μg/mL时DENV-2 RNA相对表达量分别为0.84±0.06、0.57±0.06、0.49±0.02,差异具有统计学意义(P<0.05)。其中黄芩苷50 μg/mL组抑制效果最为显著,与DENV-2组相比,黄芩苷处理后DENV-2 RNA相对表达为0.39±0.05,差异具有统计学意义(P<0.001,图6)。黄芩苷50 μg/mL浓度时效果最佳。
图6.
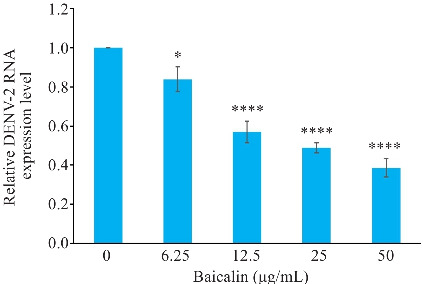
黄芩苷降低DENV-2感染HUVECs的DENV-2 RNA相对表达量
Fig.6 Baicalin reduces relative expression of DENV-2 RNA in infected HUVECs. *P<0.05, ****P<0.001 vs 0 μg/mL group (n=3).
2.7. 黄芩苷抑制DENV-2 NS1蛋白表达
用DENV-2处理HUVECs细胞后,加入50 μg/mL的黄芩苷进行处理,Western blotting检测NS1蛋白的表达水平。结果显示,与DENV-2组相比,加入黄芩苷后NS1蛋白表达显著降低,差异具有统计学意义(P<0.001,图7)。
图7.
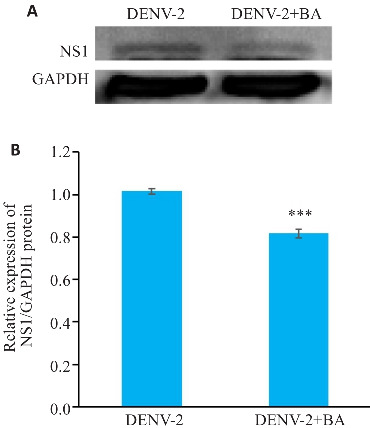
黄芩苷抑制DENV-2 NS1蛋白表达水平
Fig.7 Western blots (A) and quantitative analysis (B) of the protein expressions of DENV-2 NS1 protein in HUVECs infected by DENV-2. ***P<0.001 vs DENV-2 group (n=3).
2.8. 黄芩苷抑制DENV-2诱导的自噬发生
透射电子显微镜结果显示,与空白组相比,DENV-2感染组有较多自噬发生,而经过黄芩苷处理后自噬发生减少(图8D)。Western blotting检测LC3、P62的表达变化显示,48 h时与空白组相比,DENV-2组LC3II/LC3I比值显著增加(P<0.01,图8A、B)。经过黄芩苷处理后,与DENV-2组相比,48 h LC3II/LC3I比值显著降低(P<0.05)。p62表达量的检测结果显示,在12、24、36、48 h 时,与空白组相比,DENV-2组的表达量均显著降低,其中黄芩苷处理后p62表达与DENV-2组相比均显著增加,其中24、48 h差异具有统计学意义(P<0.05,图8C)。
图8.
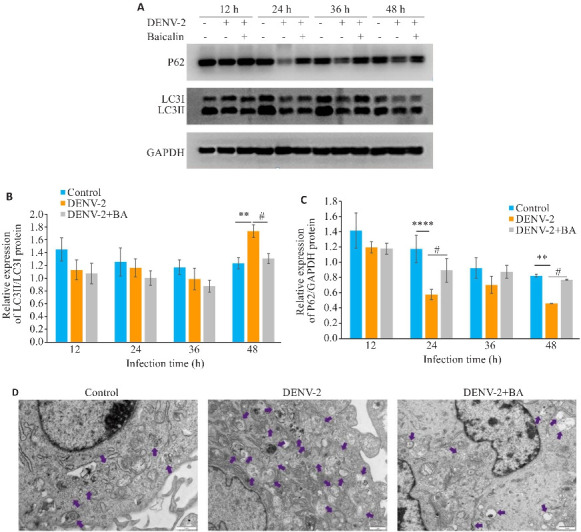
黄芩苷抑制DENV-2感染HUVEs诱导的自噬
Fig.8 Baicalin inhibits autophagy induced by DENV-2 infection in HUVECs. A-C: Western blotting of protein expressions of LC3 and P62 in HUVECs infected by DENV-2. D: Transmission electron microscopy showing autophagy of HUVECs infected with DENV-2 after baicalin treatment (×15000). **P<0.01, ****P<0.001 vs Contorl group. # P<0.05 vs DENV-2 group (n=3).
2.9. 黄芩苷抑制DENV-2诱导的自噬通量
倒置荧光显微镜结果提示,与空白组相比,DENV-2感染组红色亮点较多,且染色明亮,而加入黄芩苷后红色亮点明显减少,颜色较暗(图9)。
图9.
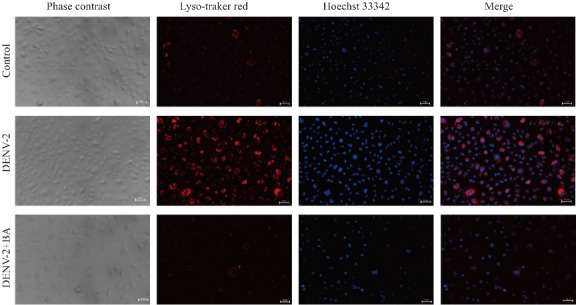
黄芩苷抑制DENV-2感染HUVECs后溶酶体的酸化
Fig.9 Baicalin inhibits lysosomal acidification in DENV-2-infected HUVECs (×400, n=3).
2.10. 黄芩苷抑制DENV-2诱导的自噬通量
Western blotting结果显示,与空白组相比,DENV-2感染后可上调自噬相关蛋白Beclin-1、ATG 5、STX17、SNAP29和VAMP8的表达,差异有统计学意义(P<0.01);与DENV-2组相比,经过黄芩苷处理后均能下调自噬相关蛋白Beclin-1、ATG 5、STX17、SNAP29和VAMP8的表达,差异有统计学意义(P<0.01,图10)。
图10.
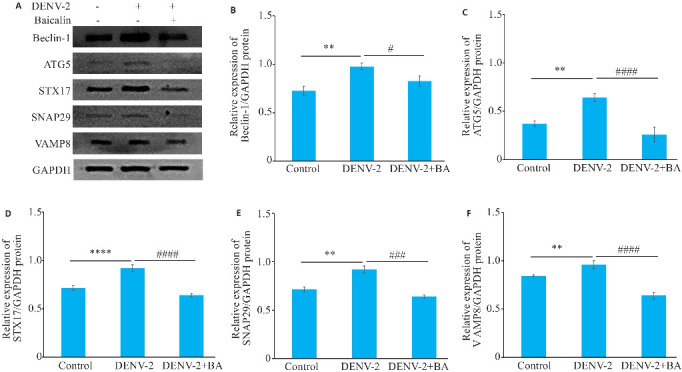
黄芩苷抑制DENV-2感染HUVECs后自噬相关蛋白水平
Fig.10 Baicalin inhibits expressions of autophagy-related proteins in HUVECs infected with DENV-2. A: Western blotting of Beclin-1, ATG 5, STX17, SNAP29 and VAMP8 proteins. B-F: Relative expression levels of Beclin-1, ATG 5, STX17, SNAP29 and VAMP8 proteins. **P<0.01, ****P<0.001. # P<0.05, ### P<0.01, #### P<0.001 (n=3).
2.11. DENV-2感染HUVECs后差异蛋白分析
将空白组与DENV组(DENV-2感染HUVECs)的样本进行蛋白质组学筛查,运用Human数据库进行检索二级质谱数据,共鉴定出5178种蛋白质,表达具有显著差异的蛋白质有962种。共489个蛋白表达下调(图11A)。将得到的数据进行KEGG通路分析(图11B),富集到24条信号通路,即PI3K-AKT信号通路、P53信号通路、TNF信号通路、ECM受体相互作用等通路。其中PI3K-AKT信号通路上富集的差异蛋白最多,为18个。
图11.
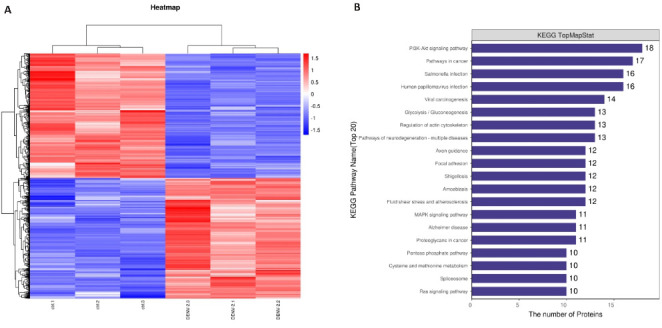
DENV-2感染后HUEVCs蛋白质组学分析
Fig.11 Proteomic analysis of HUEVCs with DENV-2 infection. A: Heat map of differential proteins in healthy adults and patients with bronchial asthma. B: KEGG signaling pathways enrichment analysis.
2.12. DENV-2的复制依赖于PI3K/AKT信号通路的调节
与DENV-2感染组相比,经LY294002处理后,细胞DENV-2的 RNA表达水平显著降低,差异具有统计学意义(P<0.001,图12)。
图12.
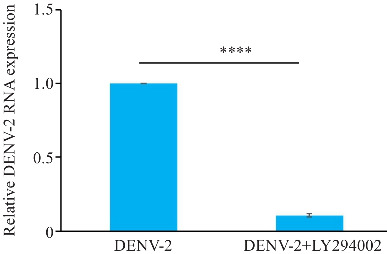
LY294002降低DENV-2感染HUVECs的DENV-2 RNA相对表达量
Fig.12 LY294002 reduces relative expression of DENV-2 RNA in HUVECs infected with DENV-2. ****P<0.001 (n=3).
2.13. 黄芩苷调控DENV-2感染HUVECs细胞中PI3K/AKT的表达
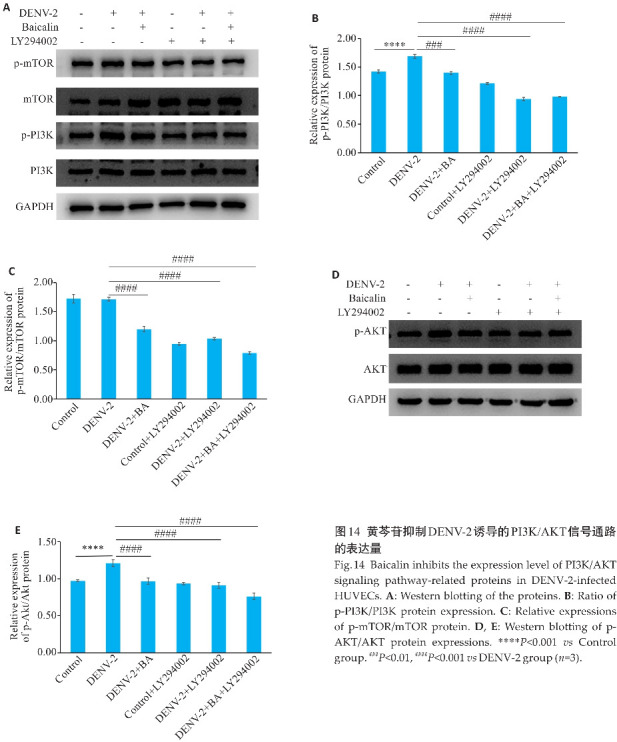
RT-qPCR结果显示,DENV-2感染会提高细胞PI3K、AKT的mRNA表达水平(P<0.05),用黄芩苷处理后,PI3K、AKT的mRNA表达水平均显著降低(P<0.01),而p-mTOR/mTOR表达无明显变化,差异无统计学意义(图13A)。Western blotting结果显示(图13B~E),与空白对照组相比,p-PI3K/PI3K、p-AKT/AKT蛋白相对表达水平升高(P<0.01),用黄芩苷处理后,p-PI3K/PI3K、p-AKT/AKT蛋白相对表达水平降低(P<0.05)。而p-mTOR/mTOR表达变化不明显。
图13.
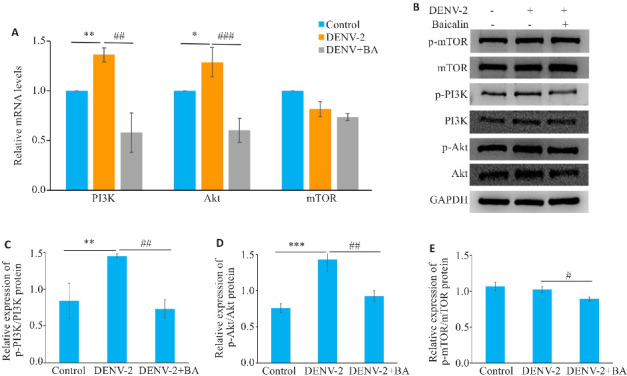
黄芩苷抑制DENV-2诱导的PI3K/AKT信号通路的表达量
Fig.13 Baicalin inhibits the expression level of PI3K/AKT signaling pathway in DENV-2-infected HUVECs. A: Baicalin reduces the relative expressions of PI3K, AKT and mTOR mRNA in DENV-2-infected HUVECs. B: Baicalin inhibits the expression levels of PI3K/AKT signaling pathway-related proteins in DENV-2-infected HUVECs. C: Ratio of p-PI3K/PI3K protein expression. D: Ratio of p-AKT/AKT protein expression. E: Relative expressions of p-mTOR/mTOR protein. *P<0.05, **P<0.01, ***P<0.001; # P<0.05, ## P<0.01, ### P<0.001 (n=3).
2.14. 黄芩苷下调DENV-2感染HUVECs细胞中PI3K/AKT的表达
Western blotting结果显示(图14A),与空白对照组相比,DENV-2感染组p-PI3K/PI3K、p-AKT/AKT蛋白相对表达水平升高(P<0.01),用黄芩苷处理后,p-PI3K/PI3K、p-AKT/AKT蛋白相对表达水平降低(P<0.01)。而p-mTOR/mTOR表达无明显变化,差异无统计学意义。加入LY294002后各组p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白相对表达水平降低(P<0.01, 图14D)。
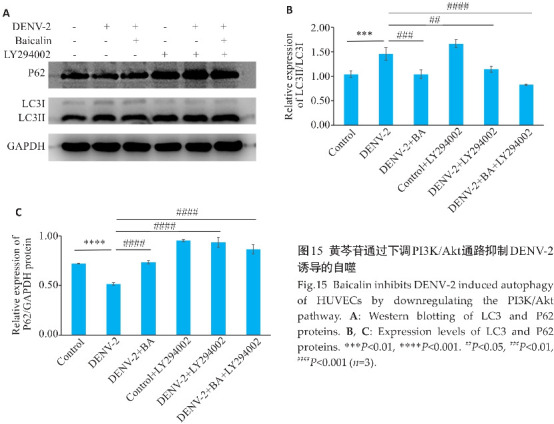
2.15. 黄芩苷通过下调PI3K/AKT通路抑制DENV-2诱导的自噬
Western blotting结果显示,与DENV-2感染组相比,加入LY294002下调了DENV-2诱导的LC3Ⅱ/LC3Ⅰ的表达,上调了P62的表达(P<0.001)。与加入LY294002结果一致,用黄芩苷处理后,下调了DENV-2诱导的LC3Ⅱ/LC3Ⅰ的表达,并使P62表达水平增加(P<0.01)。与DENV-2+BA组相比,DENV+BA+LY294002组明显抑制了LC3Ⅱ的表达水平,增加了P62的表达,抑制效果更加显著(P<0.01,图15)。
3. 讨论
近年来登革热的发病率急剧增加。研究表明,全球DENV感染的年发病估计为3.9亿例。在39亿DENV感染风险人群中,其中疾病负担主要集中在亚洲,约占疾病负担的70%[21]。目前尚无DF的可行治疗方法[22]。因此,开发一种新型抗病毒药物以有效对抗DENV感染是迫切且不可或缺的需求。
DENV感染人体的发病机制非常复杂,其发病机制与多种病毒和宿主因素有关[23]。DENV感染可激活先天免疫应答使机体产生抗病毒效应,激活的先天免疫途径包括I型干扰素、补体、细胞凋亡和自噬等[24]。DENV感染会诱导自噬,从而增强病毒复制和囊泡释放,从而逃避免疫系统的监视[25]。本研究使用DENV-2感染HUVECs后经透射电子显微镜可观察到细胞内有较多的自噬小体形成,且Western blotting结果显示,与空白组相比,DENV-2感染组细胞LC3Ⅱ表达水平从12 h开始逐渐升高,48 h达到峰值,P62蛋白感染早期无明显差变化,48 h表达水平降低;Lyso-Tracker Red的染色结果显示,DENV-2感染后HUVECs的溶酶体可正常酸化,这表明DENV-2感染可以诱导HUVECs细胞自噬的发生。了解DENV-2对不同细胞株的影响,有助于进一步探究DENV的发病机制。
黄芩苷是从中药材黄芩的干燥根中分离得到的具有生物活性的黄酮苷之一,具有抗病毒特性[11]。近年来,人们广泛研究黄芩苷的抗病毒活性,探索其分子作用机制。黄芩苷处理的Vero细胞的细胞培养上清液中的ZIKV RNA水平降低了50%,黄芩苷主要作用于ZIKV生命周期的初始阶段[26]。黄芩苷对DENV体外复制具有抗登革热活性,黄芩苷可直接杀灭游离DENV颗粒,降低其感染性;影响DENV与宿主细胞的病毒附着步骤,并干扰DENV感染的Vero细胞内病毒复制,但是其靶向的分子和细胞内途径尚未明确[10]。血管内皮细胞是DENV感染中的第一道屏障,感染后VEC的结构破坏是导致血管内皮屏障功能改变的重要原因[27,28]。本研究在DENV-2感染的HUVECs细胞模型上证明,黄芩苷可抑制HUVECs内的DENV-2 RNA复制,其抑制程度与黄芩苷浓度呈剂量依赖性,故黄芩苷浓度为50 μg/mL时效果最为显著。DENV-2非结构蛋白1(NS1)在病毒RNA复制中起重要作用,NS1的表达水平可用于表示细胞内DENV-2复制的水平[29]。黄芩苷也降低了HUVECs内的DENV-2 NS1蛋白的表达。这为开发有效的抗DENV病毒药物提供了新的参考,进一步拓宽了黄芩苷在抗病毒方面的应用。
黄芩苷通过下调mTOR来阻碍自噬体的形成并抑制了H3N2诱导的细胞自噬,导致病毒复制减少[30]。用黄芩苷处理的CHIKV感染细胞中感染相关自噬的下调可能会最终限制病毒的复制[31]。有研究表明,CVB3感染后可诱导宿主细胞形成大量的自噬体,而黄芩苷可通过降低细胞脂类代谢,减少病毒感染后自噬体形成,从而干扰病毒复制,继而减少病毒对细胞的破坏[32]。溶酶体是在自噬流结束时降解的酸性细胞器。溶酶体缺陷干扰自噬底物的降解,导致自噬体的积累[33, 34]。本研究发现,透射电子显微镜结果显示与DENV-2感染组相比,黄芩苷处理48 h后细胞内仅可见少量自噬小体、自噬溶酶体,细胞内LC3Ⅱ/LC3Ⅰ表达水平降低,说明黄芩苷可以抑制DENV诱导的HUVECs细胞自噬发生。并且LC3Ⅱ降低的同时伴随着P62的升高,同时Lyso-Tracker Red的染色结果显示,加入黄芩苷后溶酶体酸化异常,提示黄芩苷可能使DENV诱导的细胞自噬通量受损。研究表明,可溶性N-乙基马来酰亚胺敏感因子附着蛋白受体是介导自噬体和溶酶体融合的关键。STX17(定位于自噬体)结合SNAP29(定位于核内体)和VAMP8(定位于溶酶体)形成SNARE复合物促进自噬体和溶酶体的融合[35]。本实验发现黄芩苷能下调DENV-2诱导的自噬相关蛋白Beclin-1、ATG 5、STX17、SNAP29和VAMP8的表达。推测黄芩苷可能通过SNAREs复合体通路,抑制自噬体和溶酶体融合,从而阻断了DENV-2诱导的细胞自噬。
通过对空白组与DENV组(DENV-2感染HUVECs)的样本进行蛋白质组学筛查,将得到的数据进行KEGG通路分析,其中PI3K-AKT信号通路上富集的差异蛋白最多。PI3K(磷脂酰肌醇激酶)是由调节亚基p85和催化亚基p110组成的二聚体[36]。PI3K/AKT通路是一条经典的通路,它能够整合来自细胞环境的其他信号通路,最终调节细胞自噬反应[37]。据报道,DENV触发PI3K/AKT通路,抑制caspase介导的细胞凋亡,以维持受感染细胞的存活,用LY294002(PI3K抑制剂)治疗,加速病毒诱导的细胞凋亡[38]。同时可减少自噬体形成和DENV复制[15, 18]。本研究使用DENV-2感染HUVECs并加入LY294002后,病毒RNA复制显著减少,与上述文献报道一致。研究表明,黄芩苷通过PI3K/AKT信号通路调节自噬[19, 39]。本研究发现,加入LY294002后DENV-2感染的HUVECs细胞中p-PI3K、p-AKT表达水平降低。与DENV-2感染组相比,加入黄芩苷后DENV-2感染的HUVECs细胞中p-PI3K、p-AKT表达水平降低,p-mTOR表达水平无明显变化。与加入抑制剂结果一致。进一步研究发现,加入LY294002后DENV-2感染的HUVECs细胞中LC3表达下降,P62表达升高。加入黄芩苷后与抑制剂结果一致,并且DENV-2+BA+抑制剂组对自噬的抑制作用更强。结果表明DENV-2感染HUVECs细胞可诱导PI3K/Akt依赖性自噬发生。因此,我们推测黄芩苷可能是通过抑制DENV诱导的PI3K/Akt信号通路,调控自噬流,从而抑制DENV的增殖。
综上所述,本研究证实了黄芩苷可抑制DENV-2 RNA的表达和NS1蛋白的表达,黄芩苷下调DENV-2诱导的HUVECs细胞自噬的发生,阻断自噬流,其作用机制可能是通过调控PI3K/AKT信号通路,发挥抗登革病毒的作用。进一步揭示了黄芩苷在体外抗DENV的作用机制,这为黄芩苷应用于临床及生活中防治DENV感染提供了实验依据,也为防控DENV有效抗病毒药物的研发提供了参考。
基金资助
国家自然科学基金(81873194)
Supported by National Natural Science Foundation of China (81873194).
参考文献
- 1. Rodriguez DM, Major CG, Sánchez-González L, et al. Dengue vaccine acceptability before and after the availability of COVID-19 vaccines in Puerto Rico[J]. Vaccine, 2023, 41(24): 3627-35. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Sarker A, Dhama N, Gupta RD. Dengue virus neutralizing antibody: a review of targets, cross-reactivity, and antibody-dependent enhancement[J]. Front Immunol, 2023, 14: 1200195. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Roy SK, Bhattacharjee S. Dengue virus: epidemiology, biology, and disease aetiology[J]. Can J Microbiol, 2021, 67(10): 687-702. [DOI] [PubMed] [Google Scholar]
- 4. El Sahili A, Lescar J. Dengue virus non-structural protein 5[J]. Viruses, 2017, 9(4): 91. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Medeiros AS, Costa DMP, Branco MSD, et al. Dengue virus in Aedes aegypti and Aedes albopictus in urban areas in the state of Rio Grande do Norte, Brazil: importance of virological and entomological surveillance[J]. PLoS One, 2018, 13(3): e0194108. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Yu L, Wen YF, Xiang MR, et al. The limitation of rapid tests for DENV2 infection in host with unique immune status: low NS1 antigenemia and deficient antibody responses[J]. Virol Sin, 2020, 35(4): 478-80. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Li N, Li HD, Chen ZJ, et al. Estimating dengue transmission intensity in China using catalytic models based on serological data[J]. Trop Med Infect Dis, 2023, 8(2): 116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Brady OJ, Hay SI. The global expansion of dengue: how Aedes aegypti mosquitoes enabled the first pandemic arbovirus[J]. Annu Rev Entomol, 2020, 65: 191-208. [DOI] [PubMed] [Google Scholar]
- 9. Lun XC, Yang R, Lin LH, et al. Effects of the source of information and knowledge of dengue fever on the mosquito control behavior of residents of border areas of Yunnan, China[J]. Parasit Vectors, 2023, 16(1): 311. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Moghaddam E, Teoh BT, Sam SS, et al. Baicalin, a metabolite of baicalein with antiviral activity against dengue virus[J]. Sci Rep, 2014, 4: 5452. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Bao M, Ma Y, Liang M, et al. Research progress on pharmacological effects and new dosage forms of baicalin[J]. Vet Med Sci. 2022, 8(6): 2773-84. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Zandi K, Teoh BT, Sam SS, et al. Novel antiviral activity of baicalein against dengue virus[J]. BMC Complement Altern Med, 2012, 12: 214. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Dhiman M, Sharma L, Dadhich A, et al. Traditional knowledge to contemporary medication in the treatment of infectious disease dengue: a review[J]. Front Pharmacol, 2022, 13: 750494. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Chun Y, Kim J. Autophagy: an essential degradation program for cellular homeostasis and life[J]. Cells, 2018, 7(12): E278. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Lee YR, Lei HY, Liu MT, et al. Autophagic machinery activated by dengue virus enhances virus replication[J]. Virology, 2008, 374(2): 240-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Panyasrivanit M, Khakpoor A, Wikan N, et al. Co-localization of constituents of the dengue virus translation and replication machinery with amphisomes[J]. J Gen Virol, 2009, 90(Pt 2): 448-56. [DOI] [PubMed] [Google Scholar]
- 17. Heaton NS, Randall G. Dengue virus-induced autophagy regulates lipid metabolism[J]. Cell Host Microbe, 2010, 8(5): 422-32. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. McLean JE, Wudzinska A, Datan E, et al. Flavivirus NS4A-induced autophagy protects cells against death and enhances virus replication[J]. J Biol Chem, 2011, 286(25): 22147-59. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Zhang QW, Sun JX, Wang YL, et al. Antimycobacterial and anti-inflammatory mechanisms of baicalin via induced autophagy in macrophages infected with Mycobacterium tuberculosis [J]. Front Microbiol, 2017, 8: 2142. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Kang CY, Wang LB, Kang MY, et al. Baicalin alleviates 6-hydroxydopamine-induced neurotoxicity in PC12 cells by down-regulation of microRNA-192-5p[J]. Brain Res, 2019, 1708: 84-92. [DOI] [PubMed] [Google Scholar]
- 21.WHO [(accessed on 17 March 2023)]. Available online: https://www.who.int/news-room/fact-sheets/detail/dengue-and-severe-dengue. [Google Scholar]
- 22. Yi BW, Chew BXZ, Chen HX, et al. Antiviral activity of catechin against dengue virus infection[J]. Viruses, 2023, 15(6): 1377. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23. Bhatt P, Sabeena SP, Varma M, et al. Current understanding of the pathogenesis of dengue virus infection[J]. Curr Microbiol, 2021, 78(1): 17-32. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24. Uno N, Ross TM. Dengue virus and the host innate immune response[J]. Emerg Microbes Infect, 2018, 7(1): 167. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25. Wu SY, Chen YL, Lee YR, et al. The autophagosomes containing dengue virus proteins and full-length genomic RNA are infectious[J]. Viruses, 2021, 13(10): 2034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Oo A, Teoh BT, Sam SS, et al. Baicalein and baicalin as Zika virus inhibitors[J]. Arch Virol, 2019, 164(2): 585-93. [DOI] [PubMed] [Google Scholar]
- 27. Tramontini Gomes de Sousa Cardozo F, Baimukanova G, Lanteri MC, et al. Serum from dengue virus-infected patients with and without plasma leakage differentially affects endothelial cells barrier function in vitro [J]. PLoS One, 2017, 12(6): e0178820. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Anasir MI, Poh CL. Discovery of B-cell epitopes for development of dengue vaccines and antibody therapeutics[J]. Med Microbiol Immunol, 2022, 211(1): 1-18. [DOI] [PubMed] [Google Scholar]
- 29. Mackenzie JM, Jones MK, Young PR. Immunolocalization of the dengue virus nonstructural glycoprotein NS1 suggests a role in viral RNA replication[J]. Virology, 1996, 220(1): 232-40. [DOI] [PubMed] [Google Scholar]
- 30. Zhu HY, Han L, Shi XL, et al. Baicalin inhibits autophagy induced by influenza A virus H3N2[J]. Antiviral Res, 2015, 113: 62-70. [DOI] [PubMed] [Google Scholar]
- 31. Oo A, Rausalu K, Merits A, et al. Deciphering the potential of baicalin as an antiviral agent for Chikungunya virus infection[J]. Antiviral Res, 2018, 150: 101-11. [DOI] [PubMed] [Google Scholar]
- 32. 金 跃, 李 祥, 王晓丽, 等. 黄芩苷体外抑制柯萨奇病毒B组3型感染的机制研究[J]. 南京医科大学学报: 自然科学版, 2019, 39(2): 196-200. [Google Scholar]
- 33. Yu L, Chen Y, Tooze SA. Autophagy pathway: cellular and molecular mechanisms[J]. Autophagy, 2018, 14(2): 207-15. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34. Fisher RA, Gollan B, Helaine S. Persistent bacterial infections and persister cells[J]. Nat Rev Microbiol, 2017, 15: 453-64. [DOI] [PubMed] [Google Scholar]
- 35. Tian X, Teng J, Chen J. New insights regarding SNARE proteins in autophagosome-lysosome fusion[J]. Autophagy, 2021, 17(10): 2680-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36. Xie YB, Shi XF, Sheng K, et al. PI3K/akt signaling transduction pathway, erythropoiesis and glycolysis in hypoxia (review)[J]. Mol Med Rep, 2019, 19(2): 783-91. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37. Wang BY, Zhong Y, Li QJ, et al. Autophagy of macrophages is regulated by PI3k/Akt/mTOR signalling in the development of diabetic encephalopathy[J]. Aging, 2018, 10(10): 2772-82. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38. Lee CJ, Liao CL, Lin YL. Flavivirus activates phosphatidylinositol 3-kinase signaling to block caspase-dependent apoptotic cell death at the early stage of virus infection[J]. J Virol, 2005, 79(13): 8388-99. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39. Kang CY, Wang LB, Kang MY, et al. Baicalin alleviates 6-hydroxydopamine-induced neurotoxicity in PC12 cells by down-regulation of microRNA-192-5p[J]. Brain Res, 2019, 1708: 84-92. [DOI] [PubMed] [Google Scholar]


