Abstract
目的
总结肾血管平滑肌脂肪瘤(renal angiomyolipoma, RAML)合并下腔静脉(inferior vena cava, IVC)瘤栓患者的临床特点,并探讨该类患者行肾部分切除术和瘤栓取出术的可行性。
方法
选取北京大学第三医院泌尿外科2014年4月至2023年3月诊断为RAML合并IVC瘤栓患者的病例资料进行回顾性分析,记录人口统计学和围手术期资料,包括年龄、性别、手术方式、随访时间等,并比较经典型血管平滑肌脂肪瘤(classical angiomyolipoma, CAML)合并IVC瘤栓患者与上皮样血管平滑肌脂肪瘤(epithelioid angiomyolipoma, EAML)合并IVC瘤栓患者的临床特点。
结果
共纳入11例患者,其中CAML合并IVC瘤栓患者7例,EAML合并IVC瘤栓患者4例。女性9例(9/11, 81.8%),男性2例(2/11, 18.2%),平均年龄(44.0±17.1)岁。9例患者(9/11, 81.8%)出现临床症状,包括腰痛、血尿、腹部包块等局部症状及体质量减轻、发热等系统性症状,2例(2/11, 18.2%)RAML合并IVC瘤栓患者没有出现临床症状,由体检发现。11例患者中10例行根治性肾切除术伴IVC瘤栓取出术,其中开腹手术3例(3/10, 30.0%),腹腔镜手术2例(2/10, 20.0%),机器人辅助腹腔镜手术5例(5/10, 50.0%);另外1例患者行开放性肾部分切除术和瘤栓取出术。EAML合并IVC瘤栓的患者相较于CAML合并IVC瘤栓患者出现系统性临床症状(100% vs. 0%,P=0.003)的比例更高,术中出血量[400 (240, 3 050) mL vs. 50 (50, 300) mL,P =0.036]更多,并且出现肿瘤坏死(75% vs. 0%,P=0.024)的比例更高,但手术时间[(415.8±201.2) min vs. (226.0±87.3) min,P=0.053]两组间差异无统计学意义。
结论
与CAML伴IVC瘤栓患者相比,EAML伴IVC瘤栓患者出现系统性症状和肿瘤坏死的比例更高。此外,对于特定的CAML伴IVC瘤栓患者可以进行肾部分切除术和瘤栓取出术以更好地保留肾功能。
Keywords: 肾血管平滑肌脂肪瘤, 瘤栓, 肾部分切除术, 瘤栓取出术
Abstract
Objective
To summarize the clinical characteristics of patients with renal angiomyolipoma (RAML) combined with inferior vena cava (IVC) tumor thrombus, and to explore the feasibility of partial nephrectomy and thrombectomy in this series of patients.
Methods
The clinical data of patients diagnosed with RAML combined with IVC tumor thrombus in the Department of Urology of the Peking University Third Hospital from April 2014 to March 2023 were retrospectively analyzed, and demographic and perioperative data of RAML patients with IVC tumor thrombus were recorded and collected from Electronic Medical Record System, including age, gender, surgical methods, and follow-up time, etc. The clinical characteristics between classic angiomyolipoma (CAML) patients with IVC tumor thrombus and epithelioid angiomyolipoma (EAML) patients with IVC tumor thrombus were compared to determine the clinical characteristics of these patients.
Results
A total of 11 patients were included in this study, including 7 patients with CAML with IVC tumor thrombus and 4 patients with EAML with IVC tumor thrombus. There were 9 females (9/11, 81.8%) and 2 males (2/11, 18.2%), with an average age of (44.0±17.1) years. 9 patients (9/11, 81.8%) experienced clinical symptoms, including local symptoms including abdominal pain, hematuria, abdominal masses, and systemic symptoms including weight loss and fever; 2 patients (2/11, 18.2%) with RAML and IVC tumor thrombus did not show clinical symptoms, which were discovered by physical examination. Among the 11 patients, 10 underwent radical nephrectomy with thrombectomy, of whom, 3 underwent open surgery (3/10, 30.0%), 2 underwent laparoscopic surgery (2/10, 20.0%), and 5 underwent robot-assisted laparoscopic surgery (5/10, 50.0%). In addition, 1 patient underwent open partial nephrectomy and thrombectomy. The patients with EAML combined with IVC tumor thrombus had a higher proportion of systemic clinical symptoms (100% vs. 0%, P=0.003), more intraoperative bleeding [400 (240, 3 050) mL vs. 50 (50, 300) mL, P =0.036], and a higher proportion of tumor necrosis (75% vs. 0%, P=0.024) compared to the patients with CAML combined with IVC tumor thrombus. However, there was no statistically significant difference in operation time [(415.8±201.2) min vs. (226.0±87.3) min, P=0.053] between the two groups.
Conclusion
Compared with the patients with CAML and IVC tumor thrombus, the patients with EAML and IVC tumor thrombus had a higher rate of systemic symptoms and tumor necrosis. In addition, in the selected patients with CAML with IVC tumor thrombus, partial nephrectomy and tumor thrombectomy could be performed to better preserve renal function.
Keywords: Renal angiomyolipoma, Tumor thrombus, Partial nephrectomy, Thrombectomy
肾血管平滑肌脂肪瘤(renal angiomyolipoma,RAML)是一种常见的肾良性间质肿瘤,人群发病率约为0.1%~2.2%[1-2],其主要由成熟的脂肪细胞、血管和平滑肌组成[3]。在此类患者中,不伴有结节性硬化症(tuberous sclerosis syndrome,TSS)的病例约占80%~90%[3-4]。尽管RAML是一种良性肾肿瘤,但同恶性肾肿瘤一样具有侵犯肾静脉或下腔静脉(inferior vena cava,IVC)的倾向,只是同恶性肾肿瘤相比这种可能性更低。Kutcher等[5]于1982年报道了第一个RAML合并IVC瘤栓病例,随后更多的类似病例被报道[6-10]。然而,目前关于RAML合并IVC瘤栓手术治疗的系统病例研究较少,且局限于开放手术和腹腔镜手术,缺乏机器人辅助腹腔镜手术的报道。此外,由于瘤栓手术风险大、出血风险高,且瘤栓脱落可能导致肺栓塞等不良后果,既往对于RAML合并IVC瘤栓患者通常采取根治性肾切除及瘤栓取出术,关于保留肾单位的手术报道较少[10]。本研究通过总结北京大学第三医院泌尿外科近十年来收治的RAML合并IVC瘤栓患者的病例资料,总结此类患者的临床特点,并探讨在特定患者中行肾部分切除术合并瘤栓取出术的可行性。
1. 资料与方法
1.1. 病例选择
收集北京大学第三医院泌尿外科于2014年4月至2023年3月收治的肾肿瘤合并IVC瘤栓患者的临床数据并进行回顾性分析。入组标准:(1)年龄介于18~65岁;(2)术前影像学检查示肾肿物合并IVC瘤栓,考虑为RAML;(3)接受手术治疗,包括根治性肾切除术和瘤栓取出术或肾部分切除术和瘤栓取出术;(4)术后组织病理学信息可用,并被诊断为RAML,包括经典型血管平滑肌脂肪瘤(classical angiomyolipoma, CAML)与上皮样血管平滑肌脂肪瘤(epithelioid angiomyolipoma, EAML);(5)实验室检查包括血常规、肝肾功能等信息可用;(6)手术资料包括手术时间、手术出血量、输血量等信息可用;(7)术后接受完整随访,随访信息包括是否发生肿瘤复发或肿瘤特异性死亡。排除标准:(1)存在严重心肺功能不全或存在麻醉禁忌证;(2)未进行手术治疗;(3)临床关键资料缺失。经筛选本研究共纳入11例患者,所有患者术前均通过增强CT诊断为肾肿瘤伴IVC瘤栓,并通过磁共振成像(magnetic resonance imaging,MRI)评估瘤栓的解剖特征。使用Mayo分级对IVC瘤栓进行分级[11];使用美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级评估患者手术前的一般身体状况[12];使用血肌酐(serum creatinine,Scr)评估患者围手术期的肾功能。本研究已经过北京大学第三医院医学科学研究伦理委员会批准(批准号:M2019404)。
1.2. 手术方式
1.2.1. 手术方式选择
根据RAML的位置及IVC瘤栓的解剖学特征选取最适合患者的手术方式,包括根治性肾切除术和瘤栓取出术以及肾部分切除术和瘤栓取出术。手术入路包括开放手术、腹腔镜手术和机器人辅助腹腔镜手术。
1.2.2. 开放入路肾部分切除术和瘤栓取出术
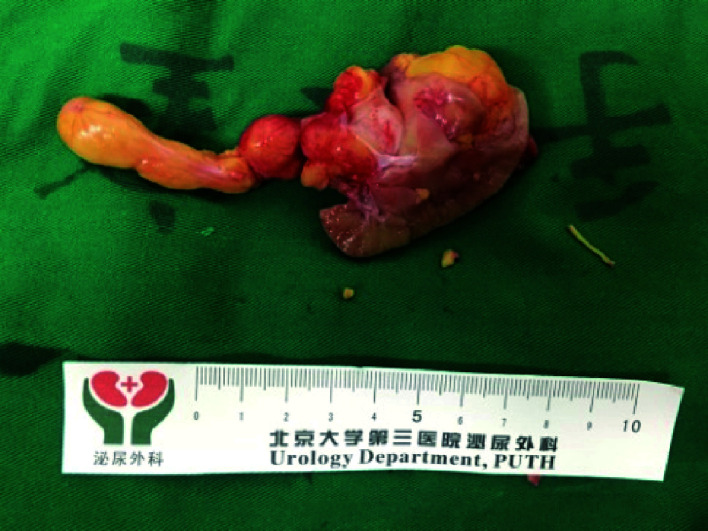
患者经全身麻醉后取仰卧位,常规消毒铺单后于右肋缘下2 cm处做约15 cm长纵行切口,切开皮肤、皮下组织和肌肉组织后打开腹膜。沿Toldt线切开结肠旁沟处腹膜,随后切断右肝结肠韧带。为暴露下腔静脉和肾门,将结肠肝曲和十二指肠向内侧游离。断扎肾蒂周围淋巴管后游离出肾静脉,并牵开以暴露肾动脉,随后将肾脏与周围组织分离。待暴露出肾表面肿瘤病变后,可观察到黄色瘤栓于肾静脉及下腔静脉内漂浮;随后使用动脉夹阻断肾动脉,将下腔静脉内瘤栓向肾静脉内推挤,即“Milking”技术,此过程中使用侧壁钳部分阻断下腔静脉以减少下腔静脉血流,并防止瘤栓脱落进入右心房或肺动脉。使用“Milking”技术将瘤栓完全推入肾静脉后,使用剪刀于病变边缘约1 cm处楔形切除肿瘤及部分肾组织,此过程中切口沿肾门方向进行,并随之打开肾静脉,经此口取出瘤栓。随后结扎肾周小动脉分支,并使用3-0可吸收线缝合剖面基底、肾集合系统及出血点,完成缝合后松开侧壁钳开放下腔静脉。使用3-0可吸收线缝合肾脏创面,解除肾动脉阻断,解除肾动脉阻断后未见术区明显出血。术后标本见图 1。
图 1.
肾部分切除术和瘤栓取出术后大体标本
Specimens of the patients receiving partial nephrectomy and thrombectomy
1.2.3. 腹腔镜根治性肾切除术和瘤栓取出术
腹腔镜根治性肾切除术和瘤栓取出术手术方式同北京大学第三医院泌尿外科既往报道[13]。
1.2.4. 机器人辅助腹腔镜下根治性肾切除术和瘤栓取出术
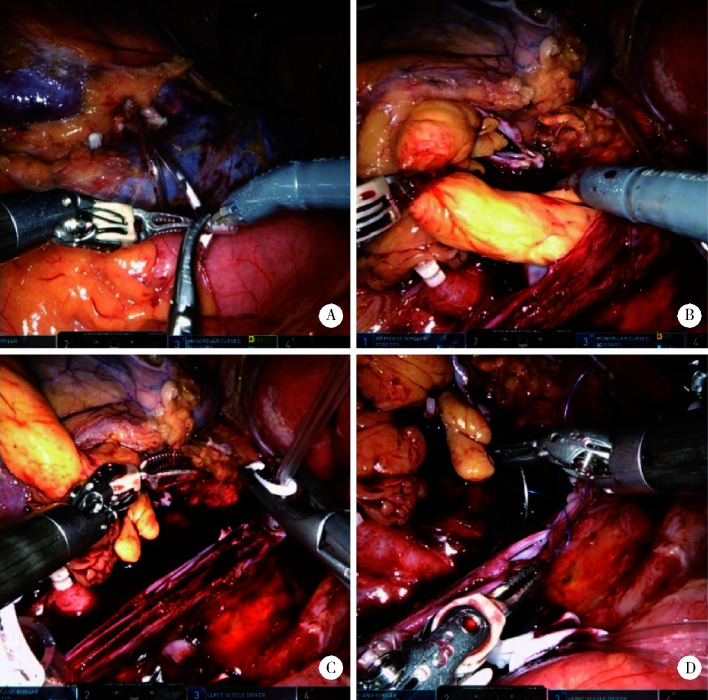
患者经全身麻醉后取左侧卧位,升高腰桥,向背侧倾斜30°。常规消毒铺单后于脐上方纵行做2 cm左右切口,气腹针穿刺成功后注气建立CO2气腹,将气腹压调整为15 mmHg。在切口右侧外上方11肋水平腹直肌旁穿刺置入8 mm的Trocar穿刺针,在腹腔镜镜头监视下分别于同侧腹直肌旁肋缘下、髂嵴内上方4 cm处穿刺置入2个8 mm的Trocar穿刺针,另在脐部切口处及其上方约8 cm处分别穿刺放置12 mm的Trocar穿刺针。将气腹压调整为12 mmHg,置入机器人器械,进行手术操作。探查腹腔无明显异常后于结肠肝曲上外侧切开后腹膜,将结肠肝曲推向下内侧,切断肾脏与结肠间结缔组织,离断肝结肠韧带,向上顶起肝脏,显露右肾周筋膜前叶。随后游离肾周组织,找到输尿管后沿输尿管向上游离暴露出肾门找到肾动脉,电灼动脉周围淋巴管后分离出肾动脉,采用Hem-o-lok夹闭动脉两端后切断。继续向下游离输尿管,在髂血管分叉水平处用钛夹夹闭输尿管后切断。沿解剖层次游离出肾脏及肾上腺,沿肾动脉前方暴露肾静脉及下腔静脉,观察静脉内瘤栓情况。游离并阻断远心端下腔静脉(图 2A),其次阻断左肾静脉,随后提升气腹压至约20 mmHg,不阻断下腔静脉近心端。用剪刀在肾静脉与下腔静脉入口的背侧沿下腔静脉长轴剪开下腔静脉壁(图 2B),将肾脏与瘤栓完整切除,术中视野未显示出血(图 2C)。随后采用3-0 Prolene血管线缝合下腔静脉(图 2D),将气腹压力从20 mmHg降至12 mmHg, 并依次松开阻断带,首先松开肾静脉阻断钳,随后松开下腔静脉远心端阻断带。待肾脏完全游离后取出肾脏及瘤栓。
图 2.
机器人辅助腹腔镜下根治性肾切除术和瘤栓取出术
Robot-assisted laparoscopic radical nephrectomy and thrombectomy
A, block the distal inferior vena cava; B, free the inferior vena cava at the lesion site for opening inferior vena cava and removing the tumor thrombus; C, no significant bleeding in the surgical field after removing the tumor thrombus; D, suture the inferior vena cava.
1.3. 统计学分析
采用SPSS 21.0软件进行数据分析,采用Shapiro-Wilk test检验数据是否符合正态分布,符合正态分布的连续性变量以均数±标准差表示,不符合正态分布的连续性变量以M(Min, Max)表示,分类型变量以n(%)表示。连续性变量组间比较采用成组t检验或Mann-Whitney U检验,分类性变量组间比较采用Fisher精确检验。P < 0.05为差异有统计学意义。
2. 结果
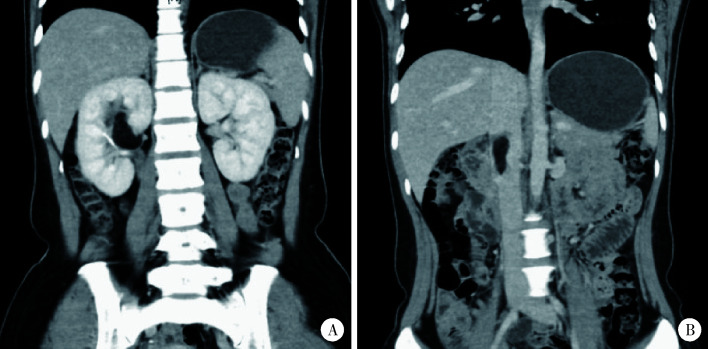
共11例患者纳入本研究,其中CAML合并IVC瘤栓7例,EAML合并IVC瘤栓4例。11例患者中女性9例(9/11,81.8%),男性2例(2/11,18.2%)。9例患者(9/11, 81.8%)患者出现临床症状,包括腰痛、血尿、腹部包块等局部症状及体质量减轻、发热等系统性症状,2例(2/11, 18.2%)RAML合并IVC瘤栓患者没有出现临床症状,由体检发现。在开放性肾部分切除术和瘤栓取出术中,肾脏热缺血时间为19 min,该患者的CT影像如图 3所示。
图 3.
血管平滑肌脂肪瘤合并瘤栓患者冠状位CT影像
Coronal CT image of the patient with renal angiomyolipoma and tumor thrombus
A, CT shows right renal angiomyolipoma; B, CT shows tumor thrombus invading the inferior vena cava.
进一步比较CAML合并IVC瘤栓患者和EAML合并IVC瘤栓患者的临床资料(表 1),两组间人口统计学资料和围手术期检验指标差异均无统计学意义。EAML合并IVC瘤栓患者相较于CAML合并IVC瘤栓患者出现临床症状的比例更高,术中出血量更多,出现肿瘤坏死的比例更高,但手术时间两组间差异无统计学意义。在进行淋巴结清扫的3例EAML合并IVC瘤栓患者中,术后病理均未提示淋巴结转移。此外,两组间在瘤栓侵犯血管壁方面差异无统计学意义。
表 1.
所有患者的人口统计学和围手术期资料
Patients' demographic data and perioperative data
| Items | Total (n=11) | CAML (n=7) | EAML (n=4) | P value |
| * P < 0.05. CAML, classical angiomyolipoma; EAML, epithelioid angiomyolipoma; BMI, body mass index; IVC, inferior vena cava; Scr, serum creatine. Local symptom, including abdominal pain, hematuria or abdominal mass; Systemic symptom, including fever or weight loss; Comorbidity, including diabetes, hypertension, coronary heart disease. | ||||
| Age/years, x±s | 44.0±17.1 | 45.7±19.8 | 41.0±13.4 | 0.684 |
| Gender, n(%) | 0.109 | |||
| Male | 2 (18.2) | 0 (0) | 2 (50.0) | |
| Female | 9 (81.8) | 7 (100.0) | 2 (50.0) | |
| BMI/(kg/m2), x±s | 23.3±2.6 | 24.9±2.6 | 24.0±2.9 | 0.556 |
| Local symptom, n(%) | 9 (81.8) | 5 (71.4) | 4 (100) | 0.491 |
| Systemic symptom, n(%) | 4 (36.4) | 0 (0) | 4 (100) | 0.003* |
| Comorbidity, n(%) | 3 (27.3) | 2 (28.6) | 1 (25.0) | 0.999 |
| Preoperative Scr /(μmoI/L), M(Min, Max) | 65 (51, 87) | 62 (51, 87) | 80 (59, 83) | 0.215 |
| Hemoglobin/(g/L), x±s | 122.4±20.6 | 116.9±17.1 | 132.0±25.2 | 0.262 |
| Platelet/(×109/L),x±s | 278.6±124.7 | 260.9±114.4 | 309.8±153.8 | 0.560 |
| Albumin/ (g/L), M(Min, Max) | 41.3 (24.8, 47.1) | 41.2 (33.0, 47.1) | 41.9 (24.8, 44.6) | 0.927 |
| Blood urea nitrogen/ (mmoI/L),x±s | 3.8±1.1 | 3.4±1.2 | 4.5±0.58 | 0.154 |
| Postoperative Scr /(μmoI/L), M(Min, Max) | 67 (51, 100) | 67 (59, 99) | 73 (51, 100) | 0.679 |
| Side, n(%) | 0.999 | |||
| Left | 2 (18.2) | 1 (14.3) | 1 (25.0) | |
| Right | 9 (81.8) | 6 (85.7) | 3 (75.0) | |
| Tumor diameter/cm, x±s | 7.0±4.2 | 5.8±4.4 | 9.1±3.5 | 0.232 |
| Mayo grade, n | 0.062 | |||
| 0 | 1 | 1 | 0 | |
| 1 | 1 | 1 | 0 | |
| 2 | 7 | 5 | 2 | |
| 3 | 2 | 0 | 2 | |
| Operation approach | 0.474 | |||
| Open, n(%) | 4 (36.4) | 2 (28.6) | 2 (50.0) | |
| Laparoscopy, n(%) | 2 (18.2) | 2 (28.6) | 0 (0) | |
| Robot-assisted laparoscopy, n(%) | 5 (45.5) | 3 (42.9) | 2 (50.0) | |
| IVC resection, n(%) | 1 (9.1) | 0 (0) | 1 (25.0) | 0.364 |
| Operation time/min, x±s | 295.0±160.9 | 226.0±87.3 | 415.8±201.2 | 0.053 |
| Estimated blood loss/mL, M(Min, Max) | 220 (50, 300) | 50 (50, 300) | 400 (240, 3 050) | 0.036* |
| Blood transfusion, n(%) | 4 (36.4) | 2 (28.6) | 2 (50.0) | 0.576 |
| Venous wall involvement, n(%) | 2 (18.2) | 0 (0) | 2 (50.0) | 0.109 |
| Lymphadenectomy, n(%) | 3 (27.3) | 0 (0) | 3 (75.0) | 0.024* |
| Adhesion, n(%) | 2 (18.2) | 0 (0) | 2 (50.0) | 0.109 |
| Necrosis, n(%) | 3 (27.3) | 0 (0) | 3 (75.0) | 0.024* |
| Complications, n(%) | 3 (27.3) | 2 (28.6) | 1 (25.0) | 0.999 |
| Postoperative hospital stay/d, x±s | 8.1±5.4 | 8.9±6.7 | 6.8±1.7 | 0.563 |
患者术后并发症及术后住院天数差异无统计学意义。所有患者的中位随访时间为9个月,期间均未发现肿瘤复发及肿瘤特异性死亡。
3. 讨论
RAML是一种常见的肾脏良性肿瘤,其起源于肾间质组织[14],在所有肾肿瘤中约占3%[2]。RAML的典型症状包括腹痛、腹部肿块和血尿,在肿瘤直径超过4 cm的患者中,约90%的患者出现这些临床症状[15],但小体积RAML患者出现这些临床症状的概率并不高[16]。尽管RAML是一种良性肾肿瘤,但同恶性肾肿瘤一样具有侵犯静脉系统的倾向,约62%侵犯静脉系统的患者表现出典型的RAML症状,比例显著高于无静脉侵犯的患者[10]。RAML合并IVC瘤栓相较于单纯RAML,由于瘤栓影响下腔静脉回流,导致下肢水肿、静脉血栓甚至布-加综合征(Budd-Chiari syndrome)的风险升高,因此,手术治疗成为此类患者的标准治疗方式,但是由于RAML合并IVC瘤栓发病率低,关于此类病例行手术治疗的系统报道较少。此外,由于RAML合并IVC瘤栓的手术治疗的术区范围大、出血风险高,且存在瘤栓脱落导致肺栓塞的可能,对于RAML合并IVC瘤栓通常采取根治性肾切除及瘤栓取出术,国内暂无肾部分切除术和瘤栓取出术的报道。
Kutcher等[5]于1982年报告了第一例RAML合并IVC瘤栓的病例后,Tan等[10]回顾了35例伴有静脉侵袭的RAML,其中11.4%累及右心房;此外,Que等[17]回顾了1982年至2013年45例患者的临床资料,发现77.8%的肿瘤位于右侧,15.6%位于左侧,6.6%位于双侧,这可能同右侧肾静脉较为短直相关。本研究中9例患者(81.8%)的瘤栓位于右侧,比例与文献[17]类似,因此,我们建议对右侧直径大于4 cm的RAML,应仔细阅读CT或MRI图像,以评估是否存在瘤栓。在大多数RAML合并IVC瘤栓病例中,即使患者无症状,手术也被认为是必要的,因为此类患者的瘤栓通常由质地较软的脆性脂肪组织构成,相较于恶性肾肿瘤,瘤栓碎裂或脱落导致脂肪性肺栓塞的风险更高,因此,更积极的干预是必要的。由于RAML通常被认为是一种良性肿瘤,对单纯RAML患者行肾部分切除术的相关研究已被广泛报道[18-19],但一些学者认为尽管RAML具有良性特征,当瘤体向静脉系统生长时,意味着局部复发、远处转移甚至死亡的风险更高,因此,根治性肾切除术伴下腔静脉瘤栓取出术成为此类患者标准的手术方式[7, 20]。
值得注意的是,CAML患者和EAML患者的临床特征不尽相同,本研究中发现EAML合并IVC瘤栓患者出现系统性症状的概率更高,这可能是由于EAML作为一种良恶交界性肿瘤,其恶性程度较CAML更高,更易影响机体代谢。Nese等[21]在2011年提出了EAML的5个预后不良因素,即TSC 1/2基因缺失、肿瘤坏死、直径大于7 cm、肾外延伸或静脉系统受累,以及癌样生长模式。因此,对于EAML合并IVC瘤栓的患者,应进行更积极的手术治疗,并进行严格的随访和术后复查,以提高此类患者预后。本研究中,术后经泌尿病理学专家进行切片分析,发现EAML合并IVC瘤栓患者相较于CAML合并IVC瘤栓患者发生肿瘤坏死的风险较高,这也提示了患者的不良预后。此外,Lei等[22]提出,对于肿瘤直径大于9 cm、静脉系统受累、上皮样细胞大于70%或非典型细胞大于60%,以及存在肿瘤坏死的EAML患者,密切随访是必不可少的。一般认为静脉系统受累是EAML进展的标志,考虑到EAML具有远处转移、肿瘤坏死、细胞学异型性等恶性肿瘤学特性,通常对EAML伴IVC瘤栓患者采取根治性肾切除术伴下腔静脉瘤栓取出术。
同EAML不同,CAML通常是一种无远处转移的良性肿瘤,考虑到瘤栓侵犯了静脉系统,既往研究[9-10, 20]认为对于CAML伴IVC瘤栓患者同样应行根治性肾切除术伴下腔静脉瘤栓取出术。然而,当CAML患者合并双侧静脉受累、对侧恶性肾肿瘤等情况时,根治性手术存在一定的局限性。此外,对于术前合并肾功能不全的患者,根治性肾切除术应该慎重考虑,以防止术后患者肾功能进一步恶化。本研究中探讨了在特定患者中行肾部分切除术和瘤栓取出术的可行性,该种手术方式可有效保留患者的肾功能,减少术后肾功能不全及血液透析的风险。此外,该手术方式未进行下腔静脉切开,减少了术中出血及大血管受损。然而,考虑到肾部分切除可能导致肿瘤残留和肿瘤复发,因此,此类手术更适用于直径较小的CAML患者或病变突出肾脏表面的患者[2]。
此外,本研究探讨了在取栓前不阻断近心端下腔静脉技术(delayed occlusion of the proximal inferior vena cava,DOPI)在RAML合并IVC瘤栓患者中的应用。如果超声提示瘤栓与血管壁无粘连,即观察到瘤栓在下腔静脉内波动,则可行DOPI技术。由于在切开下腔静脉前,瘤栓上方的下腔静脉没有被阻断,因此,无需分离和暴露近心端下腔静脉,可在术中将气腹压力升高至15~25 mmHg,以避免游离肝门区域。此外,如果手术过程中存在活动性出血,气腹压的升高有助于止血[13, 19]。然而需要注意的是,由于腹腔镜手术或机器人辅助腹腔镜手术的可操作空间有限,外科医生必须精通腹腔镜血管缝合技术,以便在静脉阻断的安全时间限制内进行手术。本研究中,我们完成了RAML伴IVC瘤栓患者的机器人辅助腹腔镜下根治性肾切除术伴瘤栓取出术,因此,当病灶区的解剖结构适合时,由富有经验的外科医生进行此类手术操作是安全有效的。
本研究存在一定局限性:第一,为回顾性研究,且由于RAML伴IVC瘤栓为罕见病,本研究纳入的样本量较少,后期需要大样本多中心研究以进一步验证结论;第二,本研究的所有患者均来自同一临床医院,可能会产生不可控制的混杂因素和固有的选择偏倚,未来可通过与其他临床医院的医生合作以避免这一限制;第三,患者的临床症状通过病史采集得到,但只能推断出这些典型的临床症状和AML伴瘤栓相关,无法证明因果性,关于病变导致的临床症状的因果关系有赖于后续更进一步的研究。
综上所述,与CAML伴IVC瘤栓患者相比,EAML伴IVC瘤栓患者出现系统性症状和肿瘤坏死的比例更高。此外,对于特定的CAML伴IVC瘤栓患者可以进行肾部分切除术和瘤栓取出术以更好地保留肾功能。
Funding Statement
国家自然科学基金(82273389)和北京市自然科学基金(7232212)
Supported by the National Natural Science Foundation of China (82273389), and the Beijing Natural Science Foundation(7232212)
Footnotes
利益冲突 所有作者均声明不存在利益冲突。
作者贡献声明 陈克伟:收集、分析数据,撰写论文;刘茁:修改论文;邓绍晖、张帆:设计研究方案;叶剑飞、王国良:整理数据,提出研究思路;张树栋:提出研究思路,总体把关和审定论文。
References
- 1.Fujii Y, Ajima J, Oka Ke, et al. Benign renal tumors detected among healthy adults by abdominal ultrasonography. Eur Urol. 1995;27(2):124–127. doi: 10.1159/000475142. [DOI] [PubMed] [Google Scholar]
- 2.Rule AD, Sasiwimonphan K, Lieske JC, et al. Characteristics of renal cystic and solid lesions based on contrast-enhanced computed tomography of potential kidney donors. Am J Kidney Dis. 2012;59(5):611–618. doi: 10.1053/j.ajkd.2011.12.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Sivalingam S, Nakada SY. Contemporary minimally invasive treatment options for renal angiomyolipomas. Curr Urol Rep. 2013;14(2):147–153. doi: 10.1007/s11934-013-0311-3. [DOI] [PubMed] [Google Scholar]
- 4.Rakowski SK, Winterkorn EB, Paul E, et al. Renal manifestations of tuberous sclerosis complex: Incidence, prognosis, and predictive factors. Kidney Int. 2006;70(10):1777–1782. doi: 10.1038/sj.ki.5001853. [DOI] [PubMed] [Google Scholar]
- 5.Kutcher R, Rosenblatt R, Mitsudo SM, et al. Renal angiomyolipoma with sonographic demonstration of extension into the inferior vena cava. Radiology. 1982;143(3):755–756. doi: 10.1148/radiology.143.3.7079506. [DOI] [PubMed] [Google Scholar]
- 6.Riviere A, Bessede T, Patard JJ. Nephron sparing surgery for renal angiomyolipoma with inferior vena cava thrombus in tuberous sclerosis. Case Rep Urol. 2014;2014:285613. doi: 10.1155/2014/285613. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Cornman-Homonoff J, Li D, Schiffman M. Pre-operative renal artery embolization and suprarenal IVC filter placement for prevention of fat embolization in renal angiomyolipoma with venous extension. Clin Imaging. 2017;43:24–27. doi: 10.1016/j.clinimag.2017.01.012. [DOI] [PubMed] [Google Scholar]
- 8.Cittadini G, Jr., Pozzi-Mucelli F, Danza FM, et al. "Aggressive" renal angiomyolipoma. Acta Radiol. 1996;37(6):927–932. doi: 10.3109/02841859609175471. [DOI] [PubMed] [Google Scholar]
- 9.Li HM, Yeh LR, Lu K. Renal angiomyolipoma with coexistent hemorrhagic aneurysm formation and fatty thrombus in inferior vena cava: A rare presentation. Abdom Imaging. 2013;38(1):180–183. doi: 10.1007/s00261-012-9886-2. [DOI] [PubMed] [Google Scholar]
- 10.Tan YS, Yip KH, Tan PH, et al. A right renal angiomyolipoma with IVC thrombus and pulmonary embolism. Int Urol Nephrol. 2010;42(2):305–308. doi: 10.1007/s11255-009-9612-3. [DOI] [PubMed] [Google Scholar]
- 11.Blute ML, Leibovich BC, Lohse CM, et al. The Mayo Clinic experience with surgical management, complications and outcome for patients with renal cell carcinoma and venous tumour thrombus. BJU Int. 2004;94(1):33–41. doi: 10.1111/j.1464-410X.2004.04897.x. [DOI] [PubMed] [Google Scholar]
- 12.Davenport DL, Bowe EA, Henderson WG, et al. National Surgical Quality Improvement Program (NSQIP) risk factors can be used to validate American Society of Anesthesiologists Physical Status Classification (ASA PS) levels. Ann Surg. 2006;243(5):636–641. doi: 10.1097/01.sla.0000216508.95556.cc. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Liu Z, Hong P, Zhu G, et al. Pure retroperitoneal laparoscopic radical nephrectomy and thrombectomy with delayed occlusion of the proximal inferior vena cava (DOPI) technique for renal tumor with level Ⅱ-Ⅲ venous tumor thrombus. BMC Cancer. 2021;21(1):627. doi: 10.1186/s12885-021-08392-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Bissler JJ, Kingswood JC. Renal angiomyolipomata. Kidney Int. 2004;66(3):924–934. doi: 10.1111/j.1523-1755.2004.00838.x. [DOI] [PubMed] [Google Scholar]
- 15.Oesterling JE, Fishman EK, Goldman SM, et al. The management of renal angiomyolipoma. J Urol. 1986;135(6):1121–1124. doi: 10.1016/S0022-5347(17)46013-7. [DOI] [PubMed] [Google Scholar]
- 16.Dickinson M, Ruckle H, Beaghler M, et al. Renal angiomyolipoma: Optimal treatment based on size and symptoms. Clin Nephrol. 1998;49(5):281–286. [PubMed] [Google Scholar]
- 17.Que X, Zhu Y, Ye C, et al. Invasive epithelioid angiomyolipoma with tumor thrombus in the inferior vena cava: A case report and literature review. Urol Int. 2017;98(1):120–124. doi: 10.1159/000434648. [DOI] [PubMed] [Google Scholar]
- 18.Byrd GF, Lawatsch EJ, Mesrobian HG, et al. Laparoscopic cryoablation of renal angiomyolipoma. J Urol. 2006;176(4 Pt 1):1512–1516. doi: 10.1016/j.juro.2006.06.013. [DOI] [PubMed] [Google Scholar]
- 19.Simmons MN, Chung BI, Gill IS. Perioperative efficacy of laparoscopic partial nephrectomy for tumors larger than 4 cm. Eur Urol. 2009;55(1):199–207. doi: 10.1016/j.eururo.2008.07.039. [DOI] [PubMed] [Google Scholar]
- 20.Fernandez-Pello S, Gonzalez-Rodriguez I, Villamil LR, et al. Laparoscopic management of right renal angiomyolipoma with involvement of the inferior vena cava: Case report and review of the literature. Scand J Urol. 2013;47(4):340–344. doi: 10.3109/00365599.2012.747563. [DOI] [PubMed] [Google Scholar]
- 21.Nese N, Martignoni G, Fletcher CD, et al. Pure epithelioid PEComas (so-called epithelioid angiomyolipoma) of the kidney: A clinicopathologic study of 41 cases: detailed assessment of morphology and risk stratification. Am J Surg Pathol. 2011;35(2):161–176. doi: 10.1097/PAS.0b013e318206f2a9. [DOI] [PubMed] [Google Scholar]
- 22.Lei JH, Liu LR, Wei Q, et al. A four-year follow-up study of renal epithelioid angiomyolipoma: A multi-center experience and literature review. Sci Rep. 2015;5:10030. doi: 10.1038/srep10030. [DOI] [PMC free article] [PubMed] [Google Scholar]