Abstract
ОБОСНОВАНИЕ
ОБОСНОВАНИЕ. Первичный гиперпаратиреоз (ПГПТ) — эндокринное заболевание, характеризующееся избыточной секрецией паратиреоидного гормона (ПТГ) при верхне-нормальном или повышенном уровне кальция крови вследствие первичной патологии околощитовидных желез (ОЩЖ). ПГПТ является редкой патологией для детей, распространенность составляет 2–5:100 000 детского населения. В связи с неспецифичностью клинических проявлений в дебюте (тошнота, рвота, боли в животе, эмоциональная лабильность) заболевание может длительное время оставаться не диагностированным.
ЦЕЛЬ
ЦЕЛЬ. Изучить особенности течения и молекулярно-генетическую основу первичного гиперпаратиреоза у детей.
МАТЕРИАЛЫ И МЕТОДЫ
МАТЕРИАЛЫ И МЕТОДЫ. Ретроспективное наблюдательное исследование 49 пациентов с диагнозом «Первичный гиперпаратиреоз». Всем проведено комплексное лабораторно-инструментальное и молекулярно-генетическое исследование в Институте детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России в период 2014–2022 гг.
РЕЗУЛЬТАТЫ
РЕЗУЛЬТАТЫ. Первые клинические симптомы ПГПТ отмечались в возрасте 13,8 года [10,6; 15,2], среди которых наиболее часто встречались утомляемость, головные боли, диспепсия, боли в нижних конечностях, переломы. Возраст постановки диагноза составил 15,81 года [13,1; 16,8], у всех детей выявлен высокий уровень ПТГ, общего и ионизированного кальция, при этом гипофосфатемия была у 93,9% пациентов (n=46), гиперкальциурия у 43% (n=21). У 5 из 49 пациентов (10,2%) выявлена эктопия ОЩЖ: 3 пациента — интратиреоидное расположение ОЩЖ и 2 пациента — эктопия в средостении. При проведении молекулярно-генетического исследования патогенные варианты выявлены у 32,7% пациентов (n=16, ДИ (21; 47)), наиболее часто встречались мутации в гене MEN1 (n=11). У 3 пациентов выявлены патогенные варианты в гене CDC73, в 2 случаях — в гене RET. Прооперировано 39 пациентов, аденома ОЩЖ выявлена в 84,6% случаев (n=33), гиперплазия — в 7,7% (n=3), атипическая аденома — в 5,1% (n=2), карцинома — в 5,1% случаев (n=2).
ЗАКЛЮЧЕНИЕ
ЗАКЛЮЧЕНИЕ. В работе представлены особенности течения и результаты молекулярно-генетического исследования ПГПТ у детей. Данная выборка является самой крупной среди опубликованных в Российской Федерации.
Keywords: первичный гиперпаратиреоз, гиперкальциемия, дети, генетическое исследование, аденома паращитовидной железы
Abstract
BACKGROUND
BACKGROUND: Primary hyperparathyroidism (PHPT) is an endocrine disorder characterized by excessive secretion of parathyroid hormone (PTH) with upper-normal or elevated blood calcium levels due to primary thyroid gland pathology. PHPT is a rare pathology in children, with a prevalence of 2–5:100,000 children according to the literature. Due to the non-specificity of clinical manifestations at onset (nausea, vomiting, abdominal pain, emotional lability), the disease may remain undiagnosed for a long time.
AIM
AIM: To study the features of the course and molecular genetic basis of primary hyperparathyroidism in children.
MATERIALS AND METHODS
MATERIALS AND METHODS: Retrospective observational study of 49 patients diagnosed with primary hyperparathyroidism. All patients underwent a comprehensive laboratory-instrumental and molecular genetic study at the Institute of Pediatric Endocrinology, Endocrinology Research Center of Russia in the period 2014–2022.
RESULTS
RESULTS: The first clinical symptoms of PHPT were noted at the age of 13.8 years [10.6; 1 5.2], among which fatigue, headaches, dyspepsia, lower limb pain, and fractures were the most common. The age of diagnosis was 15.81 years [13.1; 16.8], all children were found to have high levels of PTH, total and ionized calcium, with hypophosphatemia in 93.9% of patients (n=46) and hypercalciuria in 43% (n=21). Five out of 49 patients (10.2%) were found to have ectopy of the thyroid: 3 showed an intrathyroidal location, 2 in the mediastinal region. Molecular genetic study revealed mutations in 32.7% of patients (n=16, CI (21; 47)), mutations in MEN1 being the most frequent (n=11). Pathogenic variants in CDC73 were detected in 3 patients, RET — in 2. Among the operated 39 patients, adenoma of the thyroid was detected in 84.6% of cases (n=33), hyperplasia in 7.7% (n=3), atypical adenoma in 5.1% (n=2), carcinoma in 5.1% of cases (n=2).
CONCLUSION
CONCLUSION: The paper presents the peculiarities of the course and the results of molecular genetic study of pediatric PHPT. This sample is the largest among those published in the Russian Federation.
Обоснование
Первичный гиперпаратиреоз (ПГПТ) — эндокринное заболевание, характеризующееся избыточной секрецией ПТГ при верхне-нормальном или повышенном уровне кальция крови вследствие первичной патологии околощитовидных желез (ОЩЖ) [1]. В общей популяции распространенность ПГПТ составляет около 0,86–1% [1][2]. По результатам анализа 1914 пациентов с ПГПТ (Российский регистр пациентов с первичным гиперпаратиреозом) на декабрь 2017 г. распространенность по Москве составила 13 случаев на 100 000 взрослого населения [1]. У детей ПГПТ является крайне редкой патологией, в работах отечественных авторов имеются немногочисленные описания пациентов [3–8]. По данным зарубежных авторов, распространенность среди детей составляет 2–5:100 000 [9–11].
Около 90–95% случаев ПГПТ являются спорадическими [12]. На долю генетических форм приходится 5–10%, где ПГПТ является одним из компонентов наследственных синдромов, таких как синдром множественных эндокринных неоплазий 1, 2A и 4 типов, синдром гиперпаратиреоза с опухолью челюсти, обусловленные мутациями в генах MEN1, RET, CDKN1B и CDC73 соответственно [12][13][14]. Инактивирующие мутации в гене CASR приводят к развитию тяжелого неонатального гиперпаратиреоза, являющегося жизнеугрожающим состоянием [15][16][17]. В 85–90% случаев ПГПТ отмечается поражение одной ОЩЖ, множественные аденомы или гиперплазии встречаются в 5–10%, и менее 1% случаев представлены карциномой ОЩЖ [1][4][18][19].
Данные о ПГПТ у детей ограничены одноцентровыми исследованиями или отдельными клиническими случаями [3][10][20][21].
В связи с неспецифичностью клинических проявлений в дебюте (тошнота, рвота, боли в животе, эмоциональная лабильность) заболевание может длительное время оставаться не диагностированным [20].
Цель ИССЛЕДОВАНИЯ
Изучить особенности течения и молекулярно-генетическую основу первичного гиперпаратиреоза у детей.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Анализ данных проведен у пациентов, проходивших обследование и лечение в Институте детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России за период с сентября 2014-го по декабрь 2022 г.
Изучаемые популяции (одна или несколько)
Популяция: пациенты от 10 до 17 лет с первичным гиперпаратиреозом.
Критерии включения: наличие гиперкальциемии на фоне высокого уровня ПТГ.
Критерии исключения: хроническая почечная недостаточность, вторичный и третичный гиперпаратиреоз, опухолевые и гранулематозные заболевания.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Сплошной способ формирования выборки.
Дизайн исследования
Одноцентровое ретроспективное одновыборочное исследование, включавшее 49 детей с первичным гиперпаратиреозом.
Методы
Протокол исследования включал в себя оценку жалоб, подробный сбор анамнеза жизни и заболевания, данных наследственного анамнеза, клинический осмотр с оценкой антропометрических данных и наличия костных деформаций.
Гормональные и биохимические исследования проводились в клинико-диагностической лаборатории ФГБУ «НМИЦ эндокринологии» Минздрава России и включали оценку уровня ПТГ, кальция общего и ионизированного в сыворотке крови; исследование уровня кальция в разовой и/или суточной порциях мочи.
Ультразвуковое исследование (УЗИ) проводилось на ультразвуковом сканере (Voluson E8, GE Healthcare, Австрия) с использованием линейного датчика с частотой 10–12 Мгц и включало поиск образования ОЩЖ в виде дополнительного гипоэхогенного образования в местах типичной/атипичной локализации с интранодулярной васкуляризацией, а также исследование почек и органов брюшной полости для диагностики осложнений заболевания в виде мочекаменной (МКБ) и желчнокаменной болезней (МКБ).
Планарная сцинтиграфия ОЩЖ с Тс-99m-технетрилом (MIBI) и ОФЭКТ-КТ проводилась в отделении радионуклидной терапии ФГБУ «НМИЦ эндокринологии» Минздрава России. Визуализация образований проводилась через 15 и 90 минут после введения внутривенного контраста (Тс-99m-технетрил (MIBI)) с оценкой накопления радиофармпрепарата, а также проведение ОФЭКТ-КТ в позднюю фазу (без контраста).
Мультиспиральная компьютерная томография (МСКТ) органов шеи и средостения с внутривенным контрастированием проводилась в отделении диагностики ФГБУ «НМИЦ эндокринологии» с целью уточнения локализации образований ОЩЖ.
Оценка костных деформаций верхних и/или нижних конечностей проводилась с помощью рентгенографии в прямой проекции по стандартной методике.
Для исследования минеральной плотности костной ткани (МПК) проводилась денситометрия поясничного отдела с использованием аппарата Lunar iDXA с оценкой критерия Z-score (стандартное отклонение фактической плотности кости по отношению к соответствующему средневозрастному показателю), где Z-score до -1 SD — норма, менее -1 SD — остеопения.
Молекулярно-генетическое исследование проводилось в лаборатории генетики моногенных эндокринных заболеваний ФГБУ «НМИЦ эндокринологии» Минздрава России: секвенирование по Сэнгеру гена MEN1 и гена CCND1; секвенирование следующего поколения (NGS) панели генов, содержащей праймеры для мультиплексной ПЦР и секвенирования кодирующих последовательностей генов: AIP, AP2S1, CASR, CDC73, CDKN1A, CDKN1B, CDKN1C, CDKN2A, CDKN2C, CDKN2D, DICER1, FAM111A, GATA3, GCM2, GNA11, GNAS, MEN1, POU1F1, PRKAR1A, PRKCA, PTEN, PTTG2, SDHA, SDHB, SDHC, SDHD, TBCE, RET. Оценка патогенности вариантов нуклеотидной последовательности проводилась согласно международным и российским рекомендациям [22][23].
Статистический анализ
Расчет данных производился с помощью статистического пакета Statistica 8 (StatSoft inc., США), MS Exel 2016 (Microsoft, США). Количественные результаты представлены в виде медианы (Ме) и квартилей [Q1; Q3], соответствующих 25 и 75 перцентилям. Для оценки достоверности различий между изучаемыми подгруппами использовались критерий Манна-Уитни. Критический уровень значимости различий принимали ≤0,05.
Доверительный интервал (ДИ) 95% для относительных частот рассчитан с помощью метода Клоппера-Пирсона.
Этическая экспертиза
Проведение исследования одобрено Локальным этическим комитетом ФГБУ «НМИЦ эндокринологии» Минздрава России 12.10.2022 г.
Результаты
В исследование включено 49 пациентов (23 мальчика, 26 девочек) с ПГПТ, обследованных в период с сентября 2014-го по декабрь 2022 г. Возраст проявления первых симптомов ПГПТ составил 13,8 года [ 10,6; 15,2]. Медиана возраста установки диагноза ПГПТ составила 15,8 года [ 13,1; 16,8]. Наиболее частыми клиническими симптомами при постановке диагноза были утомляемость, головные боли, диспепсия, боли в нижних конечностях, 16,3% пациентов имели в анамнезе переломы (рис. 1). У 12 детей (24,5%) жалоб на момент постановки диагноза не отмечалось, и основанием для обследования 3 из них был отягощенный семейный анамнез по МЭН1, у 5 — выявленное в ходе УЗИ по месту жительства образование щитовидной железы, у 3 — случайно выявленная гиперкальциемия и у 1 — гиперкальциурия.
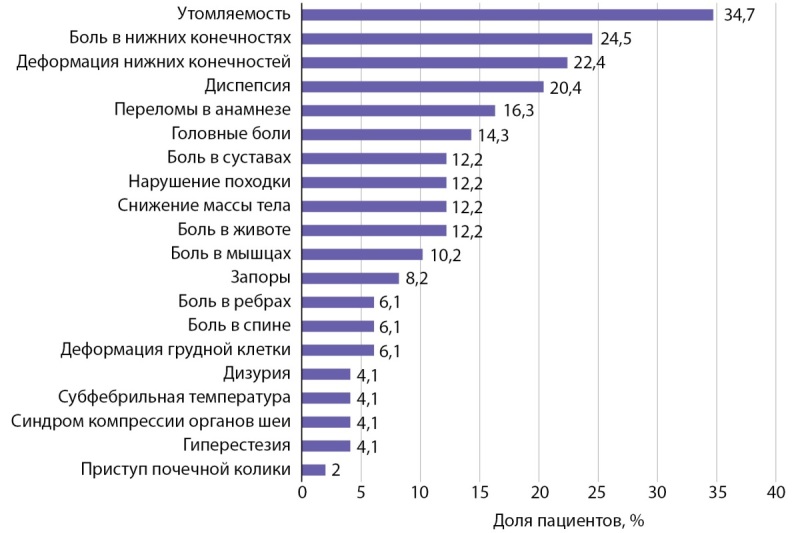
Рисунок 1. Частота встречаемости симптомов на момент постановки диагноза.
Уровни гормонально-биохимических показателей у детей на момент диагностики заболевания представлены в табл. 1. У всех пациентов отмечалось повышение ПТГ, общего и ионизированного кальция. Гипофосфатемия выявлена у 93,9 % пациентов (n=46), гиперкальциурия — у 43% детей (n=21) ДИ (30; 57). Гендерных различий ни по одному из лабораторных параметров выявлено не было.
Таблица 1. Лабораторные показатели у детей с ПГПТ на момент постановки диагноза
| Параметры | Число пациентов | Медиана | Референсные значения |
| ПТГ (пг/мл) | 49 | 148,1 [ 87,0; 532,9] | 15–65 |
| Общий кальций крови (ммоль/л) | 49 | 2,97 [ 2,73; 3,2] | 2,1–2,55 |
| Ионизированный кальций крови (ммоль/л) | 49 | 1,37 [ 1,3; 1,49] | 1,03–1,29 |
| Фосфор (ммоль/л) | 49 | 1,05 [ 0,91; 1,26] | 1,45–1,78 |
| Кальций в разовой порции мочи (ммоль/л) | 23 | 8,35 [ 4,44; 11,5] | 1,7–5,3 |
| Кальций в суточной порции мочи (ммоль/сут) | 26 | 7,6 [ 4,6; 10] | 2,5–8 |
Длительная гиперкальциемия является причиной поражения органов-мишеней. На момент обследования ЖКБ выявлена у 2 пациентов, МКБ у 14. С диагнозом «Гастрит» наблюдались 19 детей, у 4 пациентов были эпизоды острого панкреатита. Денситометрия проведена 25 пациентам, у 19 из них выявлено снижение МПК.
УЗИ по месту жительства было проведено у 30 пациентов, среди которых только у 17 выявлена патология ОЩЖ, а у 9 пациентов образование ОЩЖ было расценено как узел щитовидной железы (ЩЖ).
По результатам УЗИ в ФГБУ «НМИЦ эндокринологии» у 43 пациентов (93,5%) выявлено изменение одной ОЩЖ, множественные поражения выявлены у 3 обследованных, из них у 2 пациентов — образования трех ОЩЖ, у 1 — изменение двух ОЩЖ. У 3 пациентов изменений ОЩЖ, по данным УЗИ, выявлено не было. Наиболее часто новообразования отмечались в области левой нижней (n=18, 40,9%) и правой нижней ОЩЖ (n=16, 36,4%). Образования левой верхней ОЩЖ встречались в 25% случаев (n=11), правой верхней в 13,6% (n=6).
Сцинтиграфия с ОФЭКТ-КТ проведена 33 пациентам, среди них у 26 человек данные сцинтиграфии совпали с результатами УЗИ. У 2 детей по результатам сцинтиграфии выявлены множественные образования ОЩЖ, которые не визуализировались на УЗИ. У 5 пациентов выявлено эктопическое расположение образования ОЩЖ (табл. 2): у 3 пациентов образование было локализовано в ткани щитовидной железы (табл. 2, рис. 2), у 2 — в средостении. У одного из них (пациент №3, рис. 3) данные УЗИ были интерпретированы как образования нижних ОЩЖ, однако при выполнении сцинтиграфии аденома располагалась в области средостения.
Таблица 2. Локализация эктопированных образований ОЩЖ при различных методах топической диагностики
| Пациенты | УЗИ | Сцинтиграфия с Тс-99m-технетрилом с ОФЭКТ-КТ | Мультиспиральная компьютерная томография |
| 1 | В правой доле ЩЖ | Средняя треть правой доли ЩЖ | Не проводилась |
| 2 | Не визуализировалась | Центральный отдел средостения | Передний отдел нижнего средостения |
| 3 | Аденома левой нижней ОЩЖ (?);гиперплазия правой нижней ОЩЖ (?) | Верхнее средостение слева | В переднем средостении в паренхиме тимуса |
| 4 | В левой доле ЩЖ | Средняя треть левой доли ЩЖ | Не проводилась |
| 5 | В правой доле ЩЖ | В правой доле ЩЖ | Не проводилась |
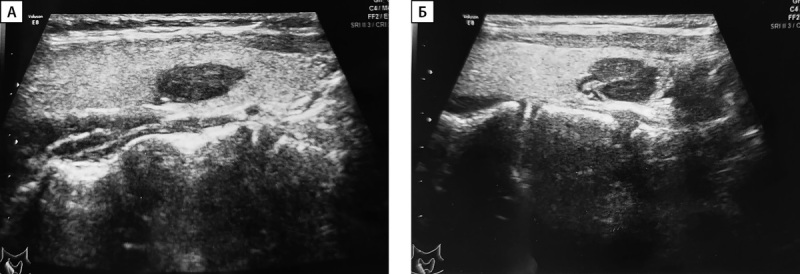
Рисунок 2 (А, Б). Ультразвуковое исследование аденом околощитовидных желез, эктопированных в ткань щитовидной железы.А — пациент №1; Б — пациент №5.
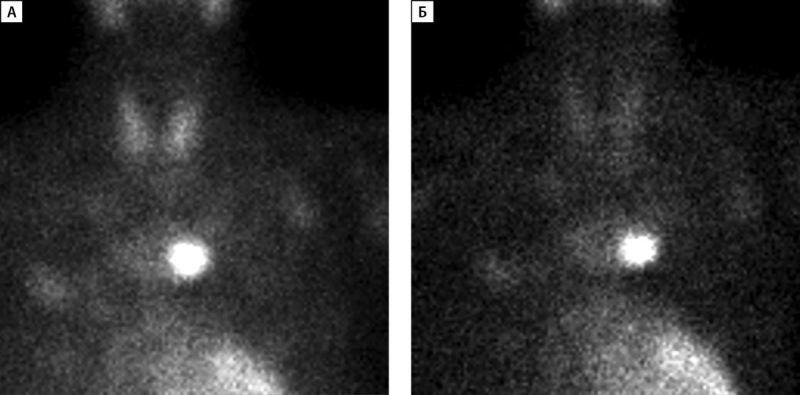
Рисунок 3 (А, Б). Планарная сцинтиграфия образования околощитовидной железы, эктопированного в средостение.А — Через 15 минут после введения контраста; Б — через 90 минут после введения контраста.
В качестве дополнительного метода диагностики у 10 пациентов проведена МСКТ, данные совпали с результатами сцинтиграфии.
Отягощенный наследственный анамнез по МЭН1 был у 8 детей — 16,3% (ДИ 8; 29), 2 пациента имели родственников с ПГПТ.
Секвенирование гена MEN1 проведено 49 пациентам, секвенирование NGS панели генов проведено 22 пациентам. Генетическая основа заболевания установлена у 16 пациентов (32,7% ДИ (21; 47)) (табл. 3). Среди них варианты в гене MEN1 выявлены у 11 пациентов (22%), в гене CDC73 — у 3 (6%), в RET — у 2 (4%). В последние годы изучается роль гена CCND1 в развитии ПГПТ, в связи с чем проведено его исследование у 10 детей — мутации не выявлены.
Таблица 3. Молекулярно-генетическое исследование пациентов с ПГПТ
Примечание. * — на основании ASMG (American College of Medical Genetics and Genomics) и российского руководства по интерпретации МПС; Het — гетерозиготный вариант, П — патогенный; ВП — вероятно патогенный; НКЗ — неопределенная клиническая значимость.
| № пациента | Ген (транскрипт) | Положение кДНК (замена аминокислотного остатка), HG38 | Тип варианта* | Зиготность | Описан/не описан |
| 1 | MEN1 | NM_130799.2:c.628_631delACAG (p.Thr210Serfs*13) | П | Het | описан |
| 2 | MEN1 | NM_130799.2:c.666C>A(p.Tyr222*) | П | Het | описан |
| 3 | MEN1 | NM_130799.2:c.1252G>T(p.Asp418Tyr) | П | Het | описан |
| 4 | MEN1 | NM_130799.2:с.202_206delGCCCC (p.Ala68Argfs*47) | П | Het | не описан |
| 5 | MEN1 | NM_130799.2:с.744С>G(р.Ile248Мet) | НКЗ | Het | не описан |
| NM_130799.2:с.734_745delCTTCCATTGACC (р.Рro245_Asp248del) | НКЗ | не описан | |||
| 6 | MEN1 | NM_130799.2:с.1546delC (p.Arg516Glyfs*43) | П | Het | описан |
| 7 | MEN1 | NM_130799.2:c.1340_1350delTTGAGGGACAG (р.Phe447Cysfs*80) | ВП | Het | не описан |
| 8 | MEN1 | NM_130799.2:c.1646delC (p.Pro549Glnfs*10) | ВП | Het | не описан |
| 9 | MEN1 | NM_130799.2:c.959C>G (p.Pro320Arg) | П | Het | описан |
| 10 | MEN1 | NM_130799.2:c.398_436del (p.Tyr133_Ser145del) | ВП | Het | не описан |
| 11 | MEN1 | NM_130799.2:с.654+1G>A | П | Het | описан |
| 12 | RET | NM_020975.6:c.1901G>A (p.Cys634Tyr) | П | Het | описан |
| 13 | RET | NM_020975.6:c.2556C>G (p.Ile852Met) | НКЗ | Het | описан |
| 14 | CDC73 | NM_024529.5:c.1418delT (p.Ala475Profs*3) | П | Het | не описан |
| 15 | CDC73 | NM_024529:с.176С>Т (р.Ser59Phe) | НКЗ | Het | описан |
| 16 | CDC73 | NM_024529:c.78delC (p.Phe27Serfs*10) | П | Het | не описан |
Среди всех обследованных паратиреоидэктомия проведена 39 пациентам. По результатам морфологического исследования удаленных ОЩЖ выявлено: 33 аденомы (84,6%), 3 гиперплазии ОЩЖ (7,7%), 2 атипические аденомы (5,1%) и 2 карциномы (5,1%). Сопоставление морфологического и молекулярно-генетического исследования пациентов с ПГПТ представлено в табл. 4.
Таблица 4. Молекулярно-генетические и морфологические сопоставления у пациентов с ПГПТ
Примечание. n — количество образований.
| Морфология ОЩЖ | Ген (транскрипт) | Положение кДНК (замена аминокислотного остатка) | Число пациентов |
| Аденома (n=33) | MEN1(NM_130799.2) | c.628_631delACAG(p.Thr210Serfs*13) | 8 |
| c.666C>A(p.Tyr222*) | |||
| c.1252G>T(p.Asp418Tyr) | |||
| с.202_206delGCCCC(p.Ala68Argfs*47) | |||
| RET(NM 020975.6) | c.1901G>A(p.Cys634Tyr) | ||
| c.2556C>G(p.Ile852Met) | |||
| CDC73(NM_024529) | с.176С>Т(р.Ser59Phe) | ||
| c.1418delT(p.Ala475Profs*3) | |||
| Мутации не выявлены | 25 | ||
| Атипическая аденома (n=2) | Мутации не выявлены | 2 | |
| Гиперплазия (n=3) | MEN1(NM_130799.2) | с.654+1G>A | 2 |
| с.202_206delGCCCC(p.Ala68Argfs*47) | |||
| Мутации не выявлены | 1 | ||
| Карцинома (n=2) | CDC73(NM_024529) | c.78delC(p.Phe27Serfs*10) | 1 |
| Мутации не выявлены | 1 |
Обсуждение
Первичный гиперпаратиреоз является редкой патологией в детском возрасте. Медиана возраста начала клинических проявлений в нашей группе составила 13,8 [ 10,6; 15,2] года, диагноз был установлен в среднем через 2 года, что может быть связано с неспецифичностью клинических проявлений, таких как утомляемость, диспепсия, головные боли. Медиана возраста диагностики ПГПТ в проведенном исследовании составила 15,8 [ 13,1; 16,8] года, что сопоставимо с работами зарубежных авторов, таких как Josh Kollars et al. и Wenbo Wang et al., где возраст диагностики ПГПТ варьировал от 14 до 17 лет [10][20].
В 85–90% случаев ПГПТ обусловлен поражением одной ОЩЖ, у 5–10% пациентов изменениям подвергаются несколько желез [1][18]. В проведенном исследовании изолированная аденома выявлена у 93,5% пациентов (n=43), множественное поражение ОЩЖ отмечалось в 6% случаев (n=3). У всех пациентов множественные образования ОЩЖ были обусловлены мутациями в гене MEN1.
В работах Hani Z. et al. и Sirmen Kızılcan Çetin et al. [24][25] наиболее часто встречались изменения нижних ОЩЖ, что отмечалось и в нашем исследовании: у 18 детей (40,9%) имелось образование левой нижней ОЩЖ, у 16 (36,4%) — правой нижней.
Ввиду анатомических особенностей топическая диагностика аденом ОЩЖ в ряде случаев может быть затруднена. В проведенном исследовании у 9 пациентов при выполнении УЗИ на амбулаторном этапе по месту жительства образование ОЩЖ было расценено как узел ЩЖ. В своей работе Гостимский А.В. и соавт. отмечали, что часто УЗИ является неинформативным для определения точной локализации образований ОЩЖ [3]. Особую трудность диагностики представляют эктопические образования ОЩЖ. По данным литературы, распространенность эктопий ОЩЖ в детской популяции варьирует от 5 до 26% [26]. Наиболее частыми локализациями являются паренхима тимуса и ткань ЩЖ, реже встречается эктопия в пространстве около пищевода и средостения [27]. В настоящем исследовании эктопия ОЩЖ отмечалась в ткани ЩЖ (n=3), в области средостения (n=1) и паренхиме тимуса (n=1).
У одного из пациентов (табл. 2, пациент №3) при проведении УЗИ ОЩЖ выявлены образования левой и правой нижних ОЩЖ, однако, по результатам сцинтиграфии и МСКТ, образование ОЩЖ располагалось в области средостения (рис. 3). Таким образом, сцинтиграфия с ОФЭКТ-КТ, а в некоторых случаях и МСКТ являются предпочтительными методами визуализации образований ОЩЖ.
На долю генетических форм ПГПТ приходится около 5–10%, среди которых наиболее распространенными являются варианты в гене MEN1 [28][29]. В нашем исследовании патогенные варианты выявлены в 32,7% случаев (n=16), самые частые — в гене MEN1 (n=11). Варианты в CCND1 встречаются при спорадических аденомах ОЩЖ [30]. Ген кодирует циклин D1, участвующий в регуляции клеточного цикла [29]. В проведенном исследовании CCND1 исследован у 10 пациентов — патогенные варианты не найдены, что, вероятно, связано с небольшой выборкой изучаемых пациентов.
Ген CDC73 (известный также как HRPT2) кодирует белок парафибромин и до 80% случаев ассоциирован со спорадической карциномой ОЩЖ [31]. Варианты в CDC73 приводят к развитию редкого синдрома гиперапаратиреоза с опухолью челюсти с аутосомно-доминантным наследованием, включающего в себя оссифицирующие опухоли челюсти, опухоли матки и кисты почек [30]. Синдром наиболее часто ассоциируется с карциномами ОЩЖ [30]. В работе A. Rahimi et al. представлены обобщенные данные, опубликованные с 1972-го по 2020 гг. о 18 случаях карцином ОЩЖ у детей, среди которых отмечались варианты в CDC73 [32]. В нашем исследовании патогенные варианты в CDC73 выявлены у 3 пациентов. На момент обследования дополнительных компонентов синдрома выявлено не было (только ПГПТ), что требует дальнейшего динамического наблюдения. В проведенном исследовании среди оперированных пациентов у 2 (5,4% ДИ (0; 19)) выявлена карцинома ОЩЖ, одна из которых обусловлена патогенным вариантом в CDC73.
Синдром МЭН2А, в рамках которого встречается ПГПТ, развивается вследствие мутаций в гене RET, кодирующем протонкоген. Основными компонентами синдрома являются медуллярный рак щитовидной железы (МРЩЖ) и феохромоцитома [33]. ПГПТ при МЭН2А развивается в 10–30% случаев и имеет легкое течение [33]. В проведенном исследовании варианты в гене RET выявлены у 2 человек. У одного пациента, помимо ПГПТ, диагностирован МРЩЖ, обусловленный патогенным вариантом c.1901G>A (p.Cys634Tyr). У другого пациента выявлен гетерозиготный вариант c.2556C>G (p.Ile852Met) с неопределенной клинической значимостью (НКЗ), дополнительных компонентов синдрома выявлено не было. В статье Andreas Machens et al. описана семья с вариантом p.Ile852Met в RET [34]. У пациентов не отмечалось признаков феохромоцитомы или ПГПТ, однако некоторые из них имели достоверное повышение кальцитонина крови [34], что требует динамического наблюдения.
Удаление образований ОЩЖ является единственным радикальным методом лечения ПГПТ. При проведении морфологического исследования наиболее часто выявлялись аденомы ОЩЖ (84,6%). Особый интерес представляют атипические аденомы (АА) ОЩЖ, которые имеют промежуточное морфологическое строение между аденомой и карциномой ОЩЖ и обладают неопределенным злокачественным потенциалом [35][36]. Распространенность АА составляет от 0,5 до 4,4% случаев среди оперированных пациентов по поводу ПГПТ [37]. В отличие от аденомы, атипическая аденома может иметь ряд морфологических характеристик, схожих с карциномой, при этом не соответствовать абсолютным критериям злокачественности, таким как инвазивный рост в окружающие ткани, сосудистая инвазия, высокая митотическая активность (>5/10), фиброзные тяжи, некроз опухоли, клеточная атипия [35][36]. Атипическая аденома отличается от рака ОЩЖ отсутствием однозначной инвазии в капсулу на всю толщину, сосудистой/периневральной или инвазией в соседние структуры [37]. В настоящем исследовании АА ОЩЖ выявлена у двух детей. Среди морфологических особенностей отмечались: широкие фиброзные септы, митотическая активность (3/10), отсутствие инвазивного роста. Дифференциация АА от карциномы имеет особые трудности. Для наиболее точной диагностики необходимо динамическое наблюдение.
ЗАКЛЮЧЕНИЕ
ПГПТ у детей — редкая патология. Ввиду неспецифичности клинических проявлений заболевание диагностируется у детей в среднем через 2 года после возникновения первых симптомов. Для выявления образований ОЩЖ необходимо проведение сцинтиграфии с ОФЭКТ-КТ, что позволит наиболее точно определить локализацию образования, особенно это касается эктопических форм. Для определения причины ПГПТ, а также для исключения синдромальной патологии необходимо проведение молекулярно-генетического анализа у детей.
Ограничения исследования
В ходе исследования могли возникнуть смещения результатов по причине недостаточного объема выборки в связи с низкой встречаемостью заболевания.
Дополнительная информация
Источники финансирования. Работа выполнена при содействии Фонда поддержки и развития филантропии «КАФ».
Конфликт интересов. Авторы декларируют отсутствие конфликта интересов.
Участие авторов. Бенина А.Р., Колодкина А.А., Безлепкина О.Б., Калинченко Н.Ю., Шеремета М.С. — поисково-аналитическая работа и подготовка финальной версии статьи; Бровин Д.Н., Аниеев А.В. — проведение оперативного лечения; Тюльпаков А.Н., Захарова В.В., Солодовникова Е.Н. — проведение молекулярно-генетического исследования, редактирование текста.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Biographies
Бенина Анастасия Романовна, детский эндокринолог, аспирант
117036, Москва, ул. Дм. Ульянова, д. 11
Колодкина Анна Александровна, к.м.н.
Москва
Тюльпаков Анатолий Николаевич, д.м.н., профессор, врач-детский эндокринолог РДКБ ФГАОУ ВО РНИМУ им. Н.И. Пирогова; заведующий кафедрой генетики эндокринных заболеваний ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова»
Москва
Калинченко Наталья Юрьевна, к.м.н.
Москва
Бровин Дмитрий Николаевич, к.м.н.
Москва
Аникиев Александр Вячеславович, к.м.н.
Москва
Даниленко Олег Сергеевич, к.м.н.
Москва
Шеремета Марина Сергеевна, к.м.н.
Москва
Захарова Виктория Витальевна, к.м.н.
Москва
Солодовникова Екатерина Николаевна, врач-лабораторный генетик медицинской и молекулярной генетики
Москва
Безлепкина Ольга Борисовна, д.м.н., профессор
Москва
Footnotes
The authors declare that there are no conflicts of interest present.
Contributor Information
Бенина А. Р., Email: ifeel1996@mail.ru.
Колодкина А. А., Email: anna_kolodkina@mail.ru.
Тюльпаков А. Н., Email: ant@endocrincentr.ru.
Калинченко Н. Ю., Email: kalinnat@rambler.ru.
Бровин Д. Н., Email: brovin-dn@yandex.ru.
Аникиев А. В., Email: anikieal70@gmail.com.
Даниленко О. С., Email: oleg.danilenco@yandex.ru.
Шеремета М. С., Email: marina888@yandex.ru.
Захарова В. В., Email: zaharova.victoriya@endocrincentr.ru.
Солодовникова Е. Н., Email: solodovnikova.ekaterina@endocrincentr.ru.
Безлепкина О. Б., Email: olgabezlepkina@mail.ru.
References
- Мокрышева Н.Г., Еремкина А.К., Мирная С.С. и др. Клинические рекомендации по первичному гиперпаратиреозу, краткая версия // Проблемы эндокринологии. — 2021. — Т. 67. — №4. — С. 94-124. doi: https://doi.org/10.14341/probl12801
- Khan AA, Hanley DA, Rizzoli R, et al. Primary hyperparathyroidism: review and recommendations on evaluation, diagnosis, and management. A Canadian and international consensus. Osteoporos Int. 2017;28(1):1-19. doi: https://doi.org/10.1007/s00198-016-3716-2 [DOI] [PMC free article] [PubMed]
- Гостимский А.В., Матвеева З.С., Романчишен А.Ф., Карпатский И.В., Кузьмичев А.С., Передереев С.С., Махароблишвили Д.В. Особенности диагностики первичного гиперпаратиреоза у детей // Эндокринная хирургия. — 2021. — Т. 15. — № 4. — С. 32-37. doi: https://doi.org/10.14341/serg12758
- Krupinova J, Mokrysheva N, Petrov V, et al. Serum circulating miRNA‐342‐3p as a potential diagnostic biomarker in parathyroid carcinomas: A pilot study. Endocrinol Diabetes Metab. 2021;4(4). doi: https://doi.org/10.1002/edm2.284 [DOI] [PMC free article] [PubMed]
- Гостимский А.В., Матвеева З.С., Романчишен А.Ф., и др. Первичный гиперпаратиреоз в детском возрасте // Педиатр. – 2017. – Т. 8. – № 5. – С. 20–24. doi: https://doi.org/10.17816/PED8520-24
- Mamedova E, Kolodkina A, Vasilyev E V., Petrov V, Belaya Z, Tiulpakov A. Successful Use of Denosumab for Life-Threatening Hypercalcemia in a Pediatric Patient with Primary Hyperparathyroidism. Horm Res Paediatr. 2020;93(4):272-278. doi: https://doi.org/10.1159/000510625 [DOI] [PubMed]
- Mamedova E, Mokrysheva N, Vasilyev E, et al. Primary hyperparathyroidism in young patients in Russia: High frequency of hyperparathyroidism-jaw tumor syndrome. Endocr Connect. 2017. doi: https://doi.org/10.1530/EC-17-0126 [DOI] [PMC free article] [PubMed]
- Орехова Е.А., Чугунова О.Л., Блох С.П. и др. Первичный гиперпаратиреоз как причина нефрокальциноза и нефролитиаза у подростка // Педиатрия им. Г.Н. Сперанского. — 2023. — Т. 102. — №4. — С. 186–193. doi: https://doi.org/10.24110/0031-403X-2023-102-4-186-193
- Tuli G, Munarin J, Tessaris D, Buganza R, Matarazzo P, De Sanctis L. “Primary Hyperparathyroidism (PHPT) in Children: Two Case Reports and Review of the Literature.” Mastrandrea L, ed. Case Rep Endocrinol. 2021;2021:1-6. doi: https://doi.org/10.1155/2021/5539349 [DOI] [PMC free article] [PubMed]
- Wang W, Kong J, Nie M, et al. Primary hyperparathyroidism in Chinese children and adolescents: A single‐centre experience at Peking Union Medical College Hospital. Clin Endocrinol (Oxf). 2017;87(6):865-873. doi: https://doi.org/10.1111/cen.13453 [DOI] [PubMed]
- Jamshidi R, Egan JC. Pediatric parathyroid disease. Semin Pediatr Surg. 2020 Jun;29(3):150923. doi: https://doi.org/10.1016/j.sempedsurg.2020.150923 [DOI] [PubMed]
- Горбачева А.М., Еремкина А.К., Мокрышева Н.Г. Наследственные cиндромальные и несиндромальные формы первичного гиперпаратиреоза // Проблемы эндокринологии. — 2020. — Т. 66. — №1. — С. 23-34. doi: https://doi.org/10.14341/probl10357 [DOI] [PubMed]
- Cetani F, Saponaro F, Borsari S, Marcocci C. Familial and Hereditary Forms of Primary Hyperparathyroidism. In: Frontiers of Hormone Research. 2019:40-51. doi: https://doi.org/10.1159/000491037 [DOI] [PubMed]
- Giusti F, Cavalli L, Cavalli T, Brandi ML. Hereditary Hyperparathyroidism Syndromes. J Clin Densitom. 2013. doi: https://doi.org/10.1016/j.jocd.2012.11.003 [DOI] [PubMed]
- Shaukat M, Ahmad HM, Shafiq MU. Neonatal severe hyperparathyroidism: A case report. J Pak Med Assoc. 2022. doi: https://doi.org/10.47391/JPMA.4195 [DOI] [PubMed]
- Sadacharan D, Mahadevan S, Rao S, et al. Neonatal severe primary hyperparathyroidism: A series of four cases and their long-term management in India. Indian J Endocrinol Metab. 2020;24(2):196. doi: https://doi.org/10.4103/ijem.IJEM_53_20 [DOI] [PMC free article] [PubMed]
- Stokes VJ, Nielsen MF, Hannan FM, Thakker R V. Hypercalcemic Disorders in Children. J Bone Miner Res. 2017. doi: https://doi.org/10.1002/jbmr.3296 [DOI] [PMC free article] [PubMed]
- Blau JE, Simonds WF. Familial Hyperparathyroidism. Front Endocrinol (Lausanne). 2021;12. doi: https://doi.org/10.3389/fendo.2021.623667 [DOI] [PMC free article] [PubMed]
- Мамедова Е.О. и др. , Молекулярно-генетические особенности первичного гиперпаратиреоза у пациентов молодого возраста // Проблемы Эндокринологии. — 2016. — T.62. — №(2) — С.4-11. doi: https://doi.org/10.14341/probl20166224-11
- Kollars J, Zarroug AE, van Heerden J, et al. Primary Hyperparathyroidism in Pediatric Patients. Pediatrics. 2005;115(4):974-980. doi: https://doi.org/10.1542/peds.2004-0804 [DOI] [PubMed]
- El Allali Y, Hermetet C, Bacchetta J, et al. Presenting features and molecular genetics of primary hyperparathyroidism in the paediatric population. Eur J Endocrinol. 2021. doi: https://doi.org/10.1530/EJE-20-1119 [DOI] [PubMed]
- Рыжкова О.П. и др. Руководство по интерпретации данных последовательности ДНК человека, полученных методами массового параллельного секвенирования (MPS) (редакция 2018, версия 2). — 2019. — С. 3–23. doi: https://doi.org/10.25557/2073-7998.2019.02.3-23
- Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015;17(5):405-424. doi: https://doi.org/10.1038/gim.2015.30 [DOI] [PMC free article] [PubMed]
- Marzouki HZ, Chavannes M, Tamilia M, et al. Location of parathyroid adenomas: 7-Year experience. J Otolaryngol - Head Neck Surg. 2010. doi: https://doi.org/10.2310/7070.2010.090251 [PubMed]
- Kizilcan Cetin S, Siklar Z, Aycan Z, et al. Clinical Profile of Parathyroid Adenoma in Children and Adolescents: A Single-Center Experience. Turkish Arch Pediatr. 2023;58(1):56-61. doi: https://doi.org/10.5152/TurkArchPediatr.2022.22180 [DOI] [PMC free article] [PubMed]
- Flokas ME, Ganieva G, Grieco A, et al. AACE Clinical Case Reports Ectopic Parathyroid Adenoma in an 11-Year-Old Girl : Case Report and Literature Review. AACE Clin. Case Reports, 2021;7(1):pp. 51–56. doi: https://doi.org/10.1016/j.aace.2020.11.013 [DOI] [PMC free article] [PubMed]
- Мокрышева Н.Г., Крупинова Ю.А., Воронкова И.А. Околощитовидные железы: нормальное развитие, анатомическое и гистологическое строение // Эндокринная хирургия. — 2018. — Т. 12. — №4. — С. 178-187. doi: https://doi.org/10.14341/serg10039
- Roizen J, Levine MA. Primary hyperparathyroidism in children and adolescents. J Chin Med Assoc. 2012 Sep;75(9):425-34. doi: https://doi.org/10.1016/j.jcma.2012.06.012. [DOI] [PMC free article] [PubMed]
- Brewer K, Costa-Guda J, Arnold A. Molecular genetic insights into sporadic primary hyperparathyroidism. Endocr Relat Cancer. 2019 Feb 1;26(2):R53-R72. doi: https://doi.org/10.1530/ERC-18-0304. [DOI] [PubMed]
- Simonds WF, Branch MD, Diseases K. HHS Public Access. Genetics. 2018:pp. 1-16. doi: https://doi.org/10.1016/j.ecl.2017.01.006
- Dutta A., et al. Pediatric Parathyroid Carcinoma: A Case Report and Review of the Literature. 2019;3. doi: https://doi.org/10.1210/js.2019-00081 [DOI] [PMC free article] [PubMed]
- Rahimi A, Shahbazi R, Nikuei P, et al. A Pediatric Parathyroid Carcinoma: An Unusual Clinical Presentation and Mini-review. Int J Endocrinol Metab. 2021 Jan 25;19(1):e110234. doi: https://doi.org/10.5812/ijem.110234. [DOI] [PMC free article] [PubMed]
- Magalhães PKR, Antonini SRR, De Paula FJA, De Freitas LCC, MacIel LMZ. Primary hyperparathyroidism as the first clinical manifestation of multiple endocrine neoplasia type 2A in a 5-year-old child. Thyroid. 2011. doi: https://doi.org/10.1089/thy.2010.0336 [DOI] [PubMed]
- MacHens A, Spitschak A, Lorenz K, Pützer BM, Dralle H. Germline RET sequence variation I852M and occult medullary thyroid cancer: Harmless polymorphism or causative mutation? Clin Endocrinol (Oxf). 2011. doi: https://doi.org/10.1111/j.1365-2265.2011.04158.x [DOI] [PubMed]
- Boro H, Alam S, Kubihal V, et al. Atypical parathyroid adenoma: Severe manifestations in an adolescent girl. Pediatr Endocrinol Diabetes Metab. 2022;28(1):91-100. doi: https://doi.org/10.5114/pedm.2021.109127 [DOI] [PMC free article] [PubMed]
- Мокрышева Н.Г., Еремкина А.К., Слащук К.Ю. и др. Атипическая аденома околощитовидной железы с клинически агрессивным течением первичного гиперпаратиреоза: наблюдение из практики // Эндокринная хирургия. — 2018. — Т. 12. — №1. — С. 55–63. doi: https://doi.org/10.14341/serg9587
- WHO Classification of Tumor Editional Board. Endocrine and neuroendocrine tumors. Lyon (France): Inrenational Agency for Research on Cancer, 2022. (WHO classification of tumor series, 5th ed.; vol. 10).


