Abstract
近年来,随着全球人口的激增和资源的大量消耗,人类对极地、太空、深海、深地、高原等极端环境的探索活动变得日益频繁。这种对外界环境的深度探索,以及随之而来的生活方式巨大变化,对人类的基本生命活动——睡眠,产生了不容忽视的影响。睡眠作为生物体为适应环境而进化出的基本生命活动,它与睡眠稳态和内源性节律紧密相关。然而,极端环境下的外界环境变化和生活方式的转变,对人类的睡眠模式和质量造成了显著的影响。这种影响可进一步导致多种生理和心理问题,对人类健康构成巨大的威胁。本文将深入探讨不同极端自然环境和生活环境对睡眠的具体影响,包括这些环境如何改变人的睡眠模式和质量。同时,我们还将总结极端环境下人类睡眠的变化,以期更深入地理解这些特定环境对人类睡眠影响的机制。通过这些研究,我们希望能够为优化极端环境下的长期生存策略提供坚实的理论基础,帮助人类更好地适应和克服极端环境带来的挑战。
Keywords: 极端环境, 睡眠, 生物节律, 影响因素, 干预措施
Abstract
Recently, with the rapid growth of the global population and the exhaustion of resources, exploration activities in extreme environments such as the polar regions, the outer space, the deep sea, the deep underground and highlands are becoming increasingly more frequent. This in-depth exploration of the external environment and the consequent dramatic changes in lifestyles impact on sleep, a basic life activity of humans, in ways that cannot be overlooked. the basic life activity of human beings. Sleep, a basic life activity and the result of the evolution of organisms to adapt to their environment, is closely associated with sleep homeostasis and endogenous rhythms. However, external environmental changes and lifestyle shifts in extreme environments have had a significant impact on the patterns and the quality of sleep in humans. Furthermore, this impact can lead to many physiological and psychological problems, posing a great threat to human health. In this review, we delved into the specific effects of different extreme natural environments and enclosed environments on sleep, elaborating on how these environments alter the patterns and the quality of sleep in humans. In addition, we summarized the changes in human sleep under extreme environments to help gain a better understanding of the mechanisms by which these specific environments impact human sleep. It is expected that this review will provide a solid theoretical foundation for optimizing long-term survival strategies in extreme environments and help humans adapt to and overcome the challenges posed by extreme environments more effectively.
Keywords: Extreme environments, Sleep, Biological rhythm, Influencing factors, Interventions
睡眠是一种重要的生命现象,表现为持续、可逆并伴随反应能力减弱和主动行为消失的行为状态。良好的睡眠对维持生命的正常代谢、机体免疫、认知功能、记忆巩固、损伤修复等至关重要[1]。在进化过程中,人类形成了一整套精密而复杂的睡眠-觉醒调控机制,以最大程度适应外部生存环境。
然而,在某些极端环境下诸如长期处于极昼极夜的两极地区、氧气含量低且气温变化无常的高原地区、常年不见阳光的深海和完全脱离地球自然环境和重力的太空,包括光照在内的其他环境因素会对整个机体的节律产生影响。此外,社会环境封闭、活动空间受限引起的情绪改变,高强度或高精度的工作需求造成的压力等,进一步导致了极端环境下的人群生活及行为方式的巨大变化。当环境发生剧烈改变时,睡眠将不可避免地受到损害,进而对人体的生理、心理造成不良影响。
随着全球人口的增长、资源的大量消耗,现有生存空间及各类资源愈发紧张,常规陆地以外的探索活动日益频繁,越来越多的人群将面临极端环境引发的睡眠问题。然而,目前极端环境对人类睡眠影响的具体机制尚不清楚[1-2]。深入该特殊领域进行睡眠医学研究,对于保障极端环境下工作人员的生产、生活具有重要意义,亦是人类后续进行地外探索必须面对的问题。因此,本文就极端环境对人类睡眠的影响以及可能的机制进行综述,以期为未来应对策略的制定奠定理论基础。
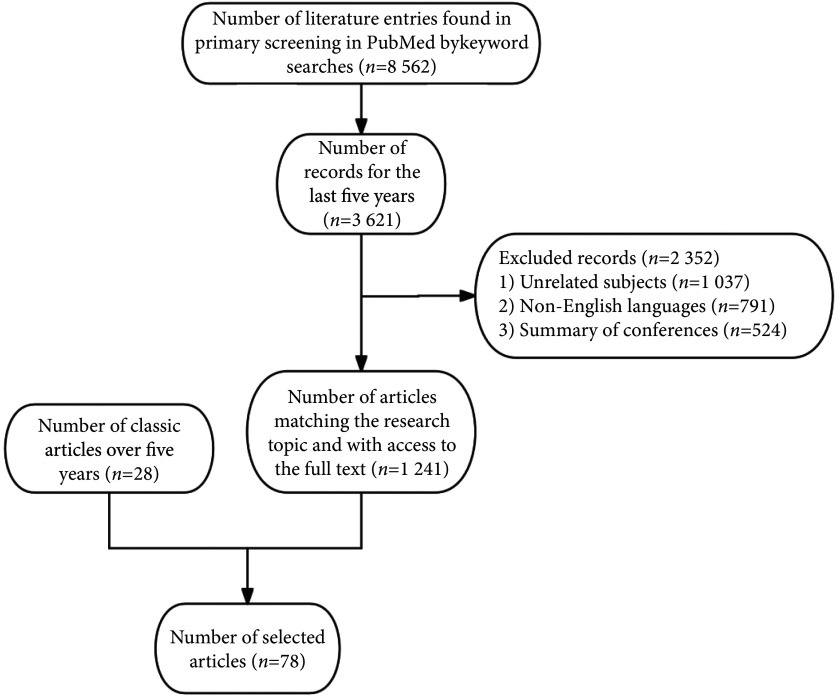
文章以“Sleep* OR circadian rhythms OR insomnia* OR hypersomnia*”“environmental disrupt* OR isolated environment* OR confine* OR extreme environment* OR ice environment* OR high latitude OR latitude OR submarine OR subterranean OR antarctic* OR arctic OR artic OR social isolate* OR space flight OR microgravity”为检索词,在pubmed、web of science、embase、中国知网、万方数据库、维普数据库等主要数据库中进行文献检索,重点选取近5年的文献以及过往经典文献进行分析(图1)。
图 1.
Literature screening process
文献筛选流程
1. 睡眠的调节
1.1. 稳态对睡眠的调节
经典的睡眠研究理论认为,睡眠由非快速眼动期(non-rapid eye movement, NREM)和快速眼动期(rapid eye movement, REM)构成。睡眠过程主要受睡眠稳态和昼夜节律的调控。睡眠稳态是指随着觉醒期持续时间的延长,睡眠压力会逐渐累积,直至进入睡眠期后睡眠压力逐渐释放,如此周期性往复[3]。现有研究表明,NREM期睡眠中的脑电慢波活动可以准确地反映睡眠压力[4]。觉醒持续时间越长,入睡时NREM期的慢波活动幅度越高,且在第一个睡眠周期最明显;随着睡眠时间的增加,慢波活动逐次减少。这一现象在前额叶最为显著和恒定。因此,慢波睡眠(slow wave sleep,SWS)也成为评价睡眠质量的重要参数之一。
1.2. 昼夜节律对睡眠的调节
除睡眠稳态以外,睡眠还受到昼夜节律的调控。地球自转引起了环境的周期性变化,在进化过程中生物为保证进食、代谢、营养等基本生理活动,产生的与之相适应的内在节律,通常接近24 h。该内在节律的产生依赖于一组能编码特殊蛋白的基因。这些基因所编码蛋白能通过负反馈机制周期性抑制自身转录,就如循环的时钟一样,故被称为时钟基因。人体的昼夜节律又称生物钟,是一种源于细胞内部的计时系统,在人类长期进化过程中产生近24 h的节律,包括体温、激素释放、认知功能和睡眠-觉醒周期[5]。睡眠-觉醒周期受到下丘脑前部的视交叉上核(suprachiasmatic nucleus, SCN)调控,SCN通过适应性唤醒机制实现对睡眠觉醒的调节。例如,即使觉醒的时间相同,在夜晚保持觉醒比白天困难得多[6]。值得注意的是,昼夜节律是细胞功能的基本特性,不依赖于外部环境独立存在,但可受到各种内、外源信号的调节。人类某一时刻的睡眠倾向取决睡眠稳态和昼夜节律的共同调控。
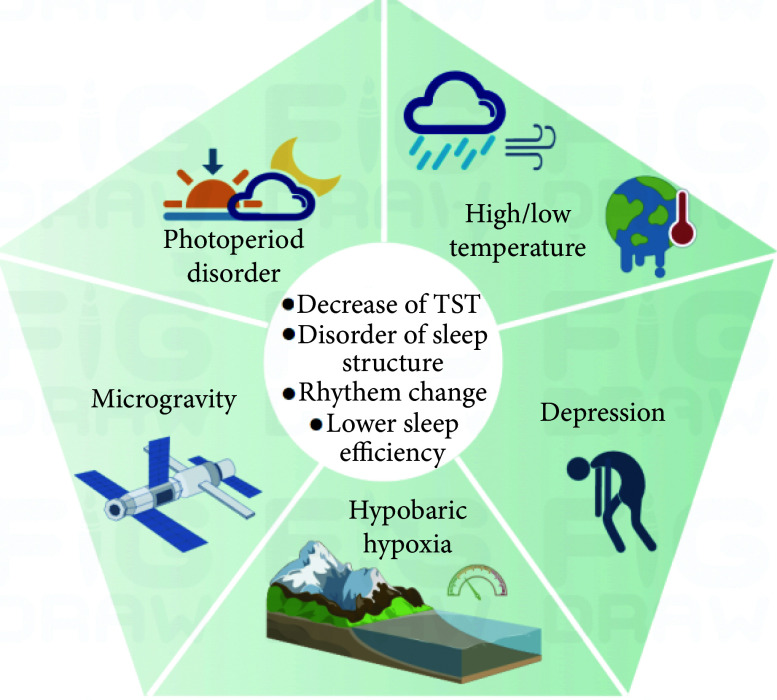
总体上看,在极地、太空、深海、深地、高原等极端环境下,人类睡眠生理改变的整体趋势为昼夜节律紊乱、总睡眠时间(total sleep time, TST)减少、睡眠结构紊乱、睡眠效率降低、夜间觉醒次数增多等。这些睡眠问题的产生可归结于物理环境以及生活环境的剧烈改变(图2)。
图 2.
Schematic diagram of the impact of the external physical environments and isolated environments in extreme environments on sleep
极端环境对外部物理环境及封闭环境对睡眠的影响示意图
TST: total sleep time.
2. 极端自然环境和社会环境对睡眠的影响
2.1. 极端自然环境对睡眠的影响
极端环境中的光照周期紊乱,环境温度改变(寒冷或过热)、压强改变(大气压或水压)、微重力环境、本底辐射强度变化等[7]因素可导致体内睡眠调节相关体液因子的分泌异常,从而破坏睡眠稳态。这些因素也可能通过干扰机体内在昼夜节律影响睡眠。在各类物理因素中,光照周期紊乱和温度变化是最广泛且影响最深远的。
2.1.1. 光照周期紊乱对睡眠的影响
人体内源性昼夜节律大约是24.15 h[5],与环境的24 h周期并不一致,因此机体需要每天调整内部昼夜节律以保持同步。这种调整机制称为节律同步系统,其外部环境因素被称为授时因子(Zeitgeber)。人体的节律同步系统包括中枢和外周两部,而光照、温度、运动以及进食等因素都是重要的授时因子。其中,光照是最强的授时因子之一,在控制人类昼夜节律为24 h或接近24 h方面发挥重要作用[8] 。
在哺乳动物中,位于下丘脑前部的SCN是内源性生物节律的起搏点,光照通过影响SCN的功能来调节人体与外界24 h昼夜变化的同步[9]。不同时间段的光照对昼夜节律相位转换的方向及幅度产生不同影响,早晨的光照有助于“拨快”节律时钟,而傍晚的光照则有助于“减慢”节律时钟,从而实现外界环境与机体昼夜节律的同步。
针对极端环境对人体的影响,以极地地区的光照周期紊乱对睡眠的影响研究最为系统。极昼和极夜是北极圈以北、南极圈以南的地区特有的自然现象。在长期缺乏日光的极夜期间,视网膜对蓝光的敏感性增加,昼夜节律稳定性降低,睡眠觉醒周期出现延迟[10]。值得注意的是,光暴露时间过长可能比极夜对生物钟的影响更严重。内源性生物钟由昼夜节律起搏器神经元组成,而持续的光照会使这些神经元去同步化,从而导致昼夜节律紊乱[11]。北极夏季日照时间增加,白天暴露在阳光下的时间变长,这可能会导致睡眠时间减少[12]。而夜间暴露在阳光下会使昼夜节律系统发生延迟,加强松果体的抑制信号,进而导致褪黑素的产生和清除发生延迟,使人在早晨感到疲倦的时间延长。这种效应如果持续存在,可能导致昼夜节律出现明显的相位后移,进而引起入睡困难和认知功能下降[13]。
除了对昼夜节律的影响外,光照周期紊乱也会直接影响情绪。夜间光线能通过光敏视网膜神经节细胞投射到涉及情感的大脑区域,影响情绪调节,导致下丘脑-垂体-肾上腺轴失调,增加皮质醇相关情绪障碍的患病率,最终影响睡眠[14-15]
2.1.2. 环境温度改变对睡眠的影响
体温是是保证人类周期性睡眠的重要组成部分,是另一个重要的授时因子,通过外周时钟元件参与昼夜节律的调控。体温调节中枢位于下丘脑的视前区(preoptic area, POA),其昼夜节律受到SCN的调控[9]。在正常的睡眠周期中,体温的变化大致经历3个阶段:①在傍晚随着核心体温到达峰值,褪黑素分泌增加,温觉神经元被激活以启动核心体温的降低,为正常入睡做准备;②褪黑素同时引起皮肤血管扩张,肢体远端外周体温逐渐上升,直至与核心体温接近,此时进入睡眠状态;③随后,由于产热的增加及温度的保存导致外周体温进一步上升,促进觉醒。体温调节活动在NREM期睡眠非常活跃,可通过改变皮肤血流量、出汗、肌肉颤动等方式完成微调。然而,一旦进入REM期,这种调节能力会明显下降[16]。由此可见,昼夜节律紊乱理论上仅影响睡眠的发生时间(即入睡),但入睡后环境温度的改变,尤其是皮肤周围的局部环境温度,无论过冷或过热,都会影响睡眠质量,导致睡眠中断或碎片化[17]。
极端环境条件下,温度对睡眠的影响可表现在睡眠期和觉醒期两方面。在睡眠期,环境温度改变可影响睡眠潜伏期长度, REM/NREM期睡眠的比例,即睡眠结构及效率,甚至睡眠中断[4]。温度对睡眠的影响受其改变幅度及速度有关。理想的睡眠环境温度是30~32.5°C,研究表明,在受试者半裸无遮盖时,当周围温度变化超过0.8 ℃/min时,约50%的受试者会觉醒[18]。这些影响可被视为温度对睡眠的即时效应。
在觉醒期间,长期寒冷或过热的环境对睡眠的影响更多表现为累积效应。如在寒冷应激情况下,机体会发生适应性的代谢和神经内分泌变化。在低于10℃的环境下连续工作超过2 h,可观察到明显的生理变化和认知障碍[16]。寒冷适应性反应表现为下丘脑-垂体-肾上腺轴和下丘脑-垂体-甲状腺轴的变化。下丘脑-垂体-肾上腺轴变化以去甲肾上腺素升高为主,其导致血清皮质醇长期维持于较高水平;下丘脑-垂体-甲状腺轴变化以游离T3的降低为主,长期处于低游离T3状态可引发极地T3综合征(即长期居住于极地的人群易出现抑郁、愤怒、疲劳、警觉性降低、反应时间延长、难以入睡和睡眠不深的现象)。游离T3的变化常与情绪波动有关,可引起焦虑、抑郁等表现[14-15]。在高温环境下,睡眠潜伏期明显延长,虽然REM期睡眠时长无明显变化,但平均持续时间缩短,REM期睡眠的稳定性随时间减弱[19]。这种变化可能与位于中枢神经系统不同水平的温觉反应神经元的激活有关,具体机制尚不清楚[20]。因此,在生理和心理的双重压力作用下,长期处于极端温度环境可能引起持续的睡眠障碍。
2.1.3. 低压缺氧环境对睡眠的影响
大量研究表明,氧气水平或缺氧状态对生物节律有明显影响[21]。随着海拔升高,地球气压下降,低气压导致动脉氧分压和组织中氧气利用度的降低,刺激呼吸中枢并引发适应过程,这一过程通常在进入低氧环境后数天到数周内发生。环境氧分压的降低会改变呼吸模式,增加呼吸暂停次数,导致周期性呼吸(periodic breathing, PB),即呼吸加强加快与减弱减慢交替出现[22]。PB是由缺氧导致的呼吸调节中枢不稳定或对二氧化碳的异常反应引起的[23]。夜间PB可导致频繁觉醒,破坏睡眠结构。低气压缺氧(hypobaric hypoxia, HH)对夜间呼吸和睡眠结构的影响比常压缺氧(hypomobaric hypoxia, NH)更显著,更容易引起PB[24]。
2.1.4. 微重力对睡眠的影响
研究表明,地球上的生命在进化中适应了向下的重力矢量。重力因素对REM睡眠的发生产生明显影响。如两栖类动物在重力影响被削弱的水中生活时,其REM睡眠减少,而在陆地生活时REM睡眠则类似于陆生哺乳动物[25]。目前,在地球上模拟太空微重力环境常采用头朝下卧床(head-down bed rest, HDBS)训练方法。在训练过程中,宇航员在倾斜6°左右的床头朝下休息数天至数月,肢体活动减少和血液流动不畅导致的骨骼脱钙、肌肉萎缩以及心血管变化,较好地模拟了太空中微重力环境影响。目前已有5项研究使用PSG进行微重力模拟条件对睡眠影响的研究,其中1次持续长达60 d[25]。研究者们推测这与模拟训练引发的应激及皮质激素水平升高[26]、炎症细胞因子的增多有关[27]。此外,有报道指出,在飞行中生活和工作空间的限制可能与微重力导致的负面影响有协同作用[25]。在动物实验中,处于失重环境大鼠的SCN对昼夜节律调控的能力减弱,果蝇的节律基因表达受影响并导致睡眠减少,但其具体机制有待进一步探索[28]。
2.2. 极端环境下的生活环境对睡眠的影响
极端环境的另一特点是狭小的生活空间及与世隔绝的社会环境。由于外部生存条件恶劣和建设成本限制,极端环境下人为构建的生活空间往往非常有限,导致活动范围减小、缺乏隐私保护等问题[29]。长期居住于这些条件下的人群往往承担特殊的任务,受工作要求限制,可能需完成高强度工作或轮班制度,这进一步打乱了他们的日常作息节律[30]。长期处于空间受限及社会隔离的生活环境容易导致心理压力累积,从而诱发焦虑、抑郁等情绪障碍,最终影响睡眠。
目前,针对封闭环境导致的情绪障碍对睡眠的影响已有较为丰富的基础研究。首先,从生理学角度看,长期社会隔离诱发的情绪障碍会激活下丘脑-垂体-肾上腺皮质轴,使机体皮质醇维持在高水平状态,导致睡眠碎片化、记忆障碍、免疫抑制等不良后果[31]。其次,情绪障碍会导致松果体体积减小,影响调节昼夜节律起搏器活动的时钟基因,进而引发睡眠问题[32]。此外,磁共振等影像学技术已证实睡眠调节和焦虑的神经回路之间存在区域重叠,这与丘脑在NREM感觉处理能力的下降以及慢波活动的产生有关。研究表明,睡眠中断是焦虑相关疾病的核心特征,而焦虑通常又会进一步恶化睡眠质量[33-34]。从分子水平来看,最新的分子影像学研究解释了情绪和睡眠共享回路中由多巴胺、血清素和腺苷等多种神经调节因子共同形成的受体系统网络,对情绪-觉醒-睡眠进行精细调控[33]。
生活环境改变对睡眠的影响主要包括SWS和REM睡眠的减少、睡眠片段化增加、睡眠效率下降和总觉醒次数增加[1]。一项为期4年涉及16156人次的研究结果表明,即使在外界物理条件正常的情况下,孤立的居住环境本身就可导致明显的睡眠障碍[35]。然而,关于睡眠结构如何改变研究的结果却并不一致。这可能是因为真实世界中很难单独研究“心理”“情绪”等变量,因为它们往往和其他睡眠影响因素有关。 总之,极端环境下生活方式及居住条件的改变带来的情绪应激及压力产生,是导致睡眠障碍的另一重要因素。
3. 极端环境中睡眠的特征、影响因素以及干预措施
在各类极端环境中,包括极地、太空、深海和深地,相似的自然环境和生活环境都对睡眠产生深远影响。然而,这些环境所处空间自然环境和生活条件不同,各自具有独特之处,其对睡眠的改变、可能的机制以及应对策略均有差异。
3.1. 极地环境
极地环境通常是指北纬66°34'以北(北极)和南纬66°34'以南(南极)的地区。大部分表面常年被冰雪覆盖,极地环境的特殊性体现在光照周期紊乱、气候极度严寒、高海拔及低气压(仅限南极),以及居住空间受限等。
3.1.1. 极地环境的睡眠特征
极地环境对睡眠的影响主要包括睡眠节律改变及睡眠质量下降。睡眠节律的变化可通过睡眠日记及尿液中褪黑素代谢产物-6羟基硫酸褪黑素(6-sulfatoxymelatonin, aMT6s)的含量监测。研究表明,在极夜条件下,人类昼夜节律会推迟约1.5 h[36]。此外,在极地环境普遍存在入睡困难,即睡眠潜伏期延长的情况[37-38]。在睡眠质量方面,极地人员普遍出现TST减少、慢波睡眠比例降低、REM睡眠增加、觉醒次数增多及醒后疲劳感增加等特征[38]。人类在早期的极地探险中就意识到睡眠的重要性,并提出了“the big eye”这一专有名词来描述极地失眠现象[39]。极地睡眠障碍通常伴有头痛、轻度抑郁、易怒、认知功能下降以及对社会或身体刺激的敏感性增加等现象,从而影响工作效率。尽管近年来极地考察站的生活设施逐渐改善,但科考人员仍普遍存在睡眠障碍。因此,深入研究南极北和极地区人类的睡眠问题,并提出相应解决措施具有重要的现实意义。
3.1.2. 极地睡眠障碍的影响因素及干预措施
目前认为,极地睡眠障碍主要受光照周期及寒冷的影响外,长时间与社会隔离、体育运动的减少[40]也是影响睡眠-觉醒周期及睡眠结构的影响因素。除以上因素外,高海拔环境是南极另一特殊环境。高海拔环境的低大气压、低氧分压环境会导致睡眠的碎片化,诱发睡眠障碍[41]。
在极地地区,针对睡眠问题可以采取以下措施,首先,在冬季日照减少的情况下,科学的人工光照射有助于减轻昼夜节律紊乱[42]。早晨增加1 h的高强度广谱白光照射有助于改善夜间睡眠[43]。同时,使用富含蓝光的光照可延长睡眠时间,提高睡眠质量,尤其对节律紊乱导致入睡延迟有显著疗效[44]。在极昼时期,则应制定符合昼夜节律的工作和生活计划,避免过多的光暴露。适量的体育锻炼可以改善睡眠不足、工作效率低下、情绪低落等问题[16]。针对高海拔阻塞性睡眠呼吸障碍患者(obstructive sleep apnea, OSA)患者影响的研究显示,夜间睡眠吸氧可改善高原时OSA的严重程度[45]。但这一策略南极地区的适用性尚有待进一步验证。总之,科学干预光照条件、增加日间活动量等方式,有望为治疗极地睡眠障碍问题提供思路。
3.2. 太空环境
太空泛指在地球大气极限以外的宇宙空间。航空医学对睡眠问题的研究相较于极地睡眠问题,起步较晚。在太空环境中,国际空间站每天环绕地球飞行数周会引起昼夜节律紊乱;同时,长期受微重力、强辐射、持续噪音等的影响,宇航员会出现明显的睡眠障碍问题。睡眠不足会导致易疲劳和认知功能受损,增加人为失误和事故的风险,对长期执行精密太空飞行任务的人员构成潜在的威胁。随着我国载人航空技术的发展和空间站的建立,航空医学越来越关注包括睡眠障碍在内的太空生理变化。揭示太空中睡眠障碍的原因并提出行之有效的解决方案具有重要意义,可为将来进一步开展更遥远的外太空探索甚至星际旅行提供理论支持。
3.2.1. 太空环境对睡眠的影响
太空环境对人类睡眠的影响主要表现为睡眠结构改变和觉醒次数增多。针对总睡眠时间是否减少的问题,不同研究存在较大差异[46]。不同持续时间的太空飞行对睡眠的影响存在差异。在短期航天飞行中,与执飞前的基线数据相比,宇航员主要出现REM睡眠潜伏期下降,同时伴有睡眠碎片化和SWS延迟[47]。这种睡眠结构改变主要出现在飞行任务的早期,随着飞行时间的延长逐渐接近基线水平,这可能与宇航员的环境适应有关。由于短期航天飞行中任务指令更密集,现有研究尚无法证实睡眠时间减少是由于外界环境影响还是既定任务特点导致[48]。
在长期太空飞行中,昼夜节律的变化表现得尤为明显。PETIT等[49]对国际空间站宇航员的睡眠情况进行了为期6个月的研究。该团队通过主观调查和客观指标分析睡眠压力,发现宇航员在觉醒状态下的睡眠稳态及昼夜节律均出现偏移。多数研究显示,睡眠改变主要集中在REM睡眠和SWS的减少,与短期飞行任务存在明显差异[47]。这提示太空环境对人类睡眠的短期和长期影响可能同时存在。短期影响包括机体面对极端环境挑战时的快速调整和初步适应,而某些特定因素可能需要长期累积才能表现出对睡眠生理的影响,如情绪、心理以及微重力等因素。
3.2.2. 影响太空环境睡眠障碍的因素及干预措施
太空环境中引起睡眠障碍问题的因素主要包括光照周期的改变、生活空间封闭性、微重力等[29]。由于太空环境的特殊性,宇航员的光照依赖于人造光源,光照作为重要的授时因子,导致宇航员的昼夜节律产生紊乱。此外,宇航员生活空间有限,而长期失重的环境也会降低睡眠质量。总体来看,微重力环境对睡眠的影响表现为SWS及REM睡眠的减少,Ⅰ期或Ⅱ期睡眠增多,以及睡眠节律紊乱[29]。
最近针对光照紊乱问题的研究对宇航员睡眠提出了解决方案。在为期45 d的太空模拟任务中,研究采用动态照明模式,不同时段给予不同光照强度及白光/蓝光组合光谱,以维持宇航员与地球相似的昼夜节律研究表明,相较于传统的静态照明,动态照明系统更好地维持人体内的昼夜节律,从而稳定睡眠质量[50]。此外,外源性褪黑素在稳定昼夜节律方面起着重要作用,与光照调节联合使用对昼夜节律的调控可获得更好的疗效。苯二氮䓬类药物[51]、唑吡坦[52]等也常用于航天任务中。尽管安眠药物可缩短睡眠潜伏期并改善主观睡眠质量,但客观数据显示平均睡眠效率仅提高了1.3%。然而在太空特殊环境中服用安眠药物可能会对太空作业带来严重风险,如被紧急警报从睡眠中唤醒,药物会导致宇航员的警觉性降低影响应激反应及反应时间等。因此,对安眠药物的使用需谨慎考虑,以避免依赖、记忆力减退、精神问题等健康风险[53],减少宇航员太空作业的安全隐患。
3.3. 深海环境
深海大多是指1000 m以下的海洋,其环境特征包括黑暗无光、低温(通常低于4 ℃)、高压强等。深海被认为是极端环境之一,也是地球上最大的未开发的生态研究前沿。随着地表资源的消耗,全球对深海研究的积极性也逐渐上升。
3.3.1. 深海环境对睡眠的影响
对深海睡眠的研究目前较少,过去主要通过记录潜水员的睡眠来进行分析,其睡眠问题随着下潜深度的改变而变化。深海中睡眠障碍问题表现为睡眠时间减少,睡眠质量下降,觉醒次数增加,睡眠结构改变。
长期以来,深海被认为是一个无节律的环境,由于海水对光的吸收和折射,1000 m以下无光存在,而上层海域也只有480 nm的蓝光可以毫无变化地存在。因此,海洋中缺失陆地上维持昼夜节律的因素。然而,近期研究表明深海也具有一定的节律性,如内潮和惯性流等以半天/一天为周期变化的潮汐节律可能是海底生物唯一的授时因子[53],但具体规律尚不清楚[54]。Nagashima邀请15名潜水员进行30 m含氮潜水模拟,利用PSG连续记录262 d夜间的数据。研究显示,第5天到第17天夜间出现睡眠潜伏期延长,总睡眠时间减少,而其他睡眠结构并未出现明显变化[7]。潜水深度增加至40 m时,清醒期、NREM的Ⅰ期和Ⅱ期的时间增加,Ⅲ期和Ⅳ期睡眠时间减少,REM期睡眠表现不稳定[1]。进一步的潜水实验表明,在150、180、230 m深度,随着潜水深度的增加,睡眠潜伏期逐渐延长,且NREM的Ⅰ期睡眠进一步增加,Ⅳ期睡眠时间减少[55]。此外,一项为期67 d的军事潜艇任务发现,尽管下水深度仅为6.6 m,却出现严重的睡眠障碍[56]。潜艇任务中工作人员采用6 h轮班制,即工作6 h休息6 h。在0:00至6:00休息的工作人员睡眠时间较长(4~5 h),而12:00–18:00休息的工作人员睡眠总时长不足2 h,睡眠质量亦下降[57]。以上研究提示,下潜至深海可能会带来更严重的睡眠障碍。
3.3.2. 影响深海环境睡眠障碍因素及干预措施
潜艇环境与太空环境非常相似,因此导致睡眠障碍的原因大体相同;导致睡眠问题的因素主要包括环境压力的增加、心理压力、疲劳、光周期、浸泡以及寒冷等,与其他极端环境也有相似性。环境压力的增加可能是最主要的因素。在潜水员减压后,发现睡眠总时间延长,觉醒次数减少,但具体机制尚不清楚[54, 58]。一些早期研究认为吸入的气体混合物的成分可能在睡眠障碍中发挥一定作用,睡眠障碍也可能与相关调节的神经化学过程中断有关[59]。在深度方面,研究表明在200 m深度的潜水中,虽然发现了频繁觉醒引起的轻微睡眠障碍,但基本的睡眠机制未受影响[1]。对海洋中哺乳动物海豹的研究发现,在深海中睡眠时间较短[60],且出现自发的阻塞性睡眠呼吸暂停,可能与血液中一氧化氮的升高有关[61]。然而,现有研究对象均为经过专业训练的潜水员,因此研究结论对总体人群并不具有普适性,深海环境引起机体变化的具体机制仍不清楚。
总之,针对深海环境对睡眠影响的研究还处于起步阶段,更大规模人群、更长持续时间的研究有望进一步解释在这种复杂外界环境下对睡眠的影响。目前并无有效措施,但降低环境压力,提供规律的光照周期和适宜的温度可能是今后改善深海睡眠障碍的研究方向。
3.4. 深地环境
深地指地表以下的部分。研究开发地下深处空间和资源已经成为国家支持的未来科技发展关键方向[62]。随着在地下深层空间长期居住或工作的人口不断增加,了解地下深层环境因素对生命系统的影响变得尤为迫切。然而,目前我们对地下生物以及生存条件知之甚少。2018年,谢和平院士提出深地医学(deep underground medicine, DUGM)的理念,旨在确定可能对人体造成影响的深地环境因素[63]。
深地环境的特殊性在于低本底辐射、气压、岩石环境、微生物以及其他未知因素,这些因素都可能会影响人类的健康。除了地下洞穴,深地环境还包括地表岩层覆盖下的空间,如我国雅砻江流域内的锦屏地下实验室。该实验室垂直岩层覆盖厚度达2400 m,位于全长约17.5 km的锦屏山隧道内,建成后将成为全球岩石覆盖厚度最深、宇宙射线通量最小、可用空间最大的国际一流地下实验平台[63]。
3.4.1. 深地环境对睡眠的影响
目前,深地环境影响人类睡眠的研究主要依赖于对深地作业矿工的主观调查[64],尚有许多方面有待深入探索。既有研究表明,矿工睡眠障碍问题主要表现为入睡困难、睡眠质量下降等[62]。一项针对男性矿工进行的睡眠调查显示,与白班矿工相比,夜班矿工存在明显的入睡困难、TST缩短以及白天困倦等问题[65]。
3.4.2. 深地环境导致睡眠障碍的因素及干预措施
深地环境与太空有许多相似之处,如空间狭窄、资源有限以及光周期不规律等[66]。因此,导致睡眠障碍的因素也具有相似性。除此之外,导致睡眠障碍的因素可能与糖酵解代谢增强、兴奋性神经递质的增加以及炎症相关。研究显示,睡眠质量好的矿工体内L-苯丙氨酸、酪氨酸、L-谷氨酰胺、2-羟基戊二酸水平升高,而乙酰乙酸水平降低。
此外,高温和高湿是深地最常见的不利因素。随着深度的增加,二氧化碳浓度、气压、温度以及相对湿度升高,光照强度及总γ辐射量降低,这些环境会对矿工的身心健康产生负面影响[67-68],进而影响睡眠质量[69]。而高温和潮湿也会直接影响睡眠,导致入睡困难和睡眠质量下降,而二氧化碳浓度和气压的增加会增加这两个因素对睡眠的影响[70]。此外,本底辐射强度变化可能通过影响节律调控基因(如Prok2等)直接影响睡眠节律[69]。因此,加强矿井通风,提供更干燥的空气、明亮的视野和适宜的温度,以及探索长期低本底辐射下的适应策略,可能有助于改善睡眠质量,但目前尚无相关研究。
3.5. 高原环境
目前全球生活在海拔1500 m以上地区的人超过4亿,其中超过1.4亿人生活在海拔2500 m以上的地区[71]。此外,越来越多的人因工作和旅行前往高原地区[72]。高原环境的高海拔、低气压、低氧环境会直接影响呼吸,进而影响睡眠质量[73]。研究高原环境下睡眠对于改善高原地区人群的睡眠健康和生活质量具有重要意义。
3.5.1. 高原环境对睡眠的影响
高原地区对睡眠的影响主要包括缺氧导致的TST、睡眠效率、SWS和REM期睡眠下降、觉醒时间和觉醒频率增加[74]。在高原地区,大多数人出现睡眠质量差或失眠问题,尤其是进入高原的早期[75]。睡眠障碍会影响白天的认知能力,引起全身不适,促进急性高原反应(acute mountain sickness, AMS)的发生,进一步加重焦虑、抑郁等负面情绪。研究表明,进入高原后机体面临急剧的低氧低压环境,睡眠时会出现以中枢型呼吸暂停为主的睡眠呼吸障碍(sleep disordered breathing, SDB)。对于阻塞性睡眠呼吸障碍患者(obstructive sleep apnea, OSA)而言,急进高原后SDB情况会更加严重,其呼吸暂停低通气指数(apnea/hypopnea index, AHI)将增加至8.9~15.9次/h,且增加程度与海拔高度差正相关[76]。
3.5.2. 影响高原环境睡眠障碍因素及干预措施
高海拔地区导致睡眠障碍的影响因素主要包括气温、低压以及缺氧等。大气压下降引起的缺氧可能是高原地区导致睡眠障碍的最主要原因。由于低气压和低氧引起睡眠问题已成为高海拔地区人群的普遍问题,对个人的身心健康产生负面影响[77]。因此,氧疗可能是改善高海拔地区夜间呼吸困难及其他因高海拔引起的健康问题。除少数药物茶碱和乙酰唑胺有助于增加通气量,有效降低PB[78]外,多数用于改善海平面睡眠的药物并不适用于高海拔地区。
4. 总结及展望
本文重点总结了极端自然环境(如极地、太空、深海、深地、高原)和社会环境对人类睡眠的影响。睡眠节律、睡眠结构和睡眠效率会受到自然环境和生活环境变化的影响。光线是重要的授时因子,光照节律紊乱会影响生理功能,包括睡眠、代谢和激素分泌。体温也是调控节律的关键因素,环境温度变化会影响睡眠质量。低压缺氧和微重力会改变呼吸模式和激素水平,进而影响睡眠,其具体机制尚需进一步研究。此外,社会环境的改变会引起内分泌和情绪变化,导致睡眠障碍。
在应对极端环境导致的睡眠问题时,我们需关注多种环境因素的共同作用。在改善居住空间条件(如光照、温度、压强、重力和辐射)的同时,也要提升通讯、运动、社会活动等条件。睡眠受极端环境影响可能存在个体差异,受遗传背景、表观特征、性别、年龄等因素影响。研究结果不一致可能因样本量偏小,缺乏普遍代表性。建议建造模拟训练场地、开发可穿戴设备多元采集睡眠数据,深入研究个体差异因素,促进极端环境下睡眠医学领域发展。
* * *
作者贡献声明 白亚宁负责论文构思、研究方法、初稿写作和审读与编辑写作,孙晓茹负责论文构思、研究方法和审读与编辑写作,文巧、吴江和邹剑负责论文构思和审读与编辑写作,王海洋负责论文构思、初稿写作和审读与编辑写作。所有作者已经同意将文章提交给本刊,且对将要发表的版本进行最终定稿,并同意对工作的所有方面负责。
Author Contribution BAI Yaning is responsible for conceptualization, methodology, writing--original draft, and writing--review and editing. SUN Xiaoru is responsible for conceptualization, methodology, and writing--review and editing. WEN Qiao,WU Jiang, and ZOU Jian are responsible for conceptualization and writing--review and editing. WANG Haiyang is responsible for conceptualization, writing--original draft, and writing--review and editing. All authors consented to the submission of the article to the Journal. All authors approved the final version to be published and agreed to take responsibility for all aspects of the work.
利益冲突 所有作者均声明不存在利益冲突
Declaration of Conflicting Interests All authors declare no competing interests.
Funding Statement
四川省科技计划项目(No. 2022NSFSC1298、No. 23QYCX0115)、成都市科学技术局项目(No. 2022-YF05-01274-SN)和四川省卫生健康委员会项目(No. 21PJ022)资助
References
- 1.Van Den BERG N H, MICHAUD X, PATTYN N, et al How sleep research in extreme environments can inform the military: advocating for a transactional model of sleep adaptation. Curr Psychiatry Rep. 2023;25(2):73–91. doi: 10.1007/s11920-022-01407-3. [DOI] [PubMed] [Google Scholar]
- 2.DUFFY J F, ABBOTT S M, BURGESS H J, et al Workshop report. Circadian rhythm sleep-wake disorders: gaps and opportunities. Sleep. 2021;44(5):zsaa281. doi: 10.1093/sleep/zsaa281. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.ANDRILLON T, OUDIETTE D What is sleep exactly? Global and local modulations of sleep oscillations all around the clock. Neurosci Biobehav Rev. 2023;155:105465. doi: 10.1016/j.neubiorev.2023.105465. [DOI] [PubMed] [Google Scholar]
- 4.LIU D, DAN Y A motor theory of sleep-wake control: arousal-action circuit. Annu Rev Neurosci. 2019;42:27–46. doi: 10.1146/annurev-neuro-080317-0618131. [DOI] [PubMed] [Google Scholar]
- 5.LANE J M, QIAN J, MIGNOT E, et al Genetics of circadian rhythms and sleep in human health and disease. Nat Rev Genet. 2023;24(1):4–20. doi: 10.1038/s41576-022-00519-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.DEANTONI M, REYT M, BERTHOMIER C, et al Association between circadian sleep regulation and cortical gyrification in young and older adults. Sleep. 2023;46(9):zsad094. doi: 10.1093/sleep/zsad094. [DOI] [PubMed] [Google Scholar]
- 7.ZIVI P, De GENNARO L, FERLAZZO F Sleep in Isolated, Confined, and Extreme (ICE): a review on the different factors affecting human sleep in ICE. Front Neurosci. 2020;14:851. doi: 10.3389/fnins.2020.00851. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.BURKE T M, MARKWALD R R, CHINOY E D, et al Combination of light and melatonin time cues for phase advancing the human circadian clock. Sleep. 2013;36(11):1617–1624. doi: 10.5665/sleep.3110. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.COLWELL C S Linking neural activity and molecular oscillations in the SCN. Nat Rev Neurosci. 2011;12(10):553–569. doi: 10.1038/nrn3086. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.KAWASAKI A, WISNIEWSKI S, HEALEY B, et al Impact of long-term daylight deprivation on retinal light sensitivity, circadian rhythms and sleep during the Antarctic winter. Sci Rep. 2018;8(1):16185. doi: 10.1038/s41598-018-33450-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.OHTA H, YAMAZAKI S, MCMAHON D G Constant light desynchronizes mammalian clock neurons. Nat Neurosci. 2005;8(3):267–269. doi: 10.1038/nn1395. [DOI] [PubMed] [Google Scholar]
- 12.LUBAS M M, MADURO R S, SZKLO-COXE M An exploratory study examining the associations between sunlight exposure, sleep behaviours and sleep outcomes during an Arctic summer. Int J Circumpolar Health. 2019;78(1):1574698. doi: 10.1080/22423982.2019.1574698. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.PATTYN N, MAIRESSE O, CORTOOS A, et al Sleep during an Antarctic summer expedition: new light on "polar insomnia". J Appl Physiol (1985) 2017;122(4):788–794. doi: 10.1152/japplphysiol.00606.2016. [DOI] [PubMed] [Google Scholar]
- 14.WALKER W H, WALTON J C, DEVRIES A C, et al Circadian rhythm disruption and mental health. Transl Psychiatry. 2020;10(1):28. doi: 10.1038/s41398-020-0694-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.TUBBS A S, FERNANDEZ F X, GRANDNER M A, et al The mind after midnight: nocturnal wakefulness, behavioral dysregulation, and psychopathology. Front Netw Physiol. 2022;1:830338. doi: 10.3389/fnetp.2021.830338. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.SPINELLI E, WERNER JUNIOR J Human adaptative behavior to Antarctic conditions: a review of physiological aspects. WIREs Mech Dis. 2022;14(5):e1556. doi: 10.1002/wsbm.1556. [DOI] [PubMed] [Google Scholar]
- 17.TROYNIKOV O, WATSON C G, NAWAZ N Sleep environments and sleep physiology: A review. J Therm Biol. 2018;78:192–203. doi: 10.1016/j.jtherbio.2018.09.012. [DOI] [PubMed] [Google Scholar]
- 18.Le BON O Relationships between REM and NREM in the NREM-REM sleep cycle: a review on competing concepts. Sleep Med. 2020;70:6–16. doi: 10.1016/j.sleep.2020.02.004. [DOI] [PubMed] [Google Scholar]
- 19.BUGUET A, REIS J, RADOMSKI M W Sleep and global warming: How will we sleep when the Earth is hotter? J Neurol Sci. 2023;454:120859. doi: 10.1016/j.jns.2023.120859. [DOI] [PubMed] [Google Scholar]
- 20.BACH V, TELLIEZ F, LIBERT J P The interaction between sleep and thermoregulation in adults and neonates. Sleep Med Rev. 2002;6(6):481–492. doi: 10.1053/smrv.2001.0177. [DOI] [PubMed] [Google Scholar]
- 21.EGG M, KÖBLITZ L, HIRAYAMA J, et al Linking oxygen to time: the bidirectional interaction between the hypoxic signaling pathway and the circadian clock. Chronobiol Int. 2013;30(4):510–529. doi: 10.3109/07420528.2012.754447. [DOI] [PubMed] [Google Scholar]
- 22.WEIL J V Sleep at high altitude. High Alt Med Biol. 2004;5(2):180–189. doi: 10.1089/1527029041352162. [DOI] [PubMed] [Google Scholar]
- 23.SAN T, POLAT S, CINGI C, et al Effects of high altitude on sleep and respiratory system and theirs adaptations. Sci World J. 2013;2013:241569. doi: 10.1155/2013/241569. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.HEINZER R, SAUGY J J, RUPP T, et al Comparison of sleep disorders between real and simulated 3450-m altitude. Sleep. 2016;39(8):1517–1523. doi: 10.5665/sleep.6010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.FRANTZIDIS C A, DIMITRIADOU C K, CHRISKOS P, et al Cortical connectivity analysis for assessing the impact of microgravity and the efficacy of reactive sledge jumps countermeasure to NREM 2 sleep. Acta Astronaut. 2020;166:579–589. doi: 10.1016/j.actaastro.2018.11.043. [DOI] [Google Scholar]
- 26.FUJITA S I, RUTTER L, ONG Q, et al Integrated RNA-seq analysis indicates asynchrony in clock genes between tissues under spaceflight. Life (Basel, Switzerland) 2020;10(9):196. doi: 10.3390/life10090196. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.李华玉, 时萧寒, 张新蕊, 等 203例胶质瘤患者睡眠障碍与炎症细胞因子的关联分析. 山东大学学报(医学版) 2022;60(12):26–30. doi: 10.6040/j.issn.1671-7554.0.2022.0567. [DOI] [Google Scholar]; LI H Y, SHI X H, ZHANG X R, ey al Association between sleep disturbance and inflammatory cytokines in 203 patients with glioma. J Sichuan Univ (Med Sci) 2022;60(12):26–30. doi: 10.6040/j.issn.1671-7554.0.2022.0567. [DOI] [Google Scholar]
- 28.ZHANG H, WANG Y, ZHANG Z, et al Alterations in the activity and sleep of Drosophila melanogaster under simulated microgravity. NPJ Microgravity. 2021;7(1):27. doi: 10.1038/s41526-021-00157-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.GARRETT-BAKELMAN F E, DARSHI M, GREEN S J, et al The NASA Twins Study: a multidimensional analysis of a year-long human spaceflight. Science. 2019;364(6436):eaau8650. doi: 10.1126/science.aau8650. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.JONES C W, BASNER M, MOLLICONE D J, et al Sleep deficiency in spaceflight is associated with degraded neurobehavioral functions and elevated stress in astronauts on six-month missions aboard the International Space Station. Sleep. 2022;45(3):zsac006. doi: 10.1093/sleep/zsac006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.CACIOPPO J T, CACIOPPO S, CAPITANIO J P, et al The neuroendocrinology of social isolation. Annu Rev Psychol. 2015;66:733–767. doi: 10.1146/annurev-psych-010814-015240. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.SPERA V, MAIELLO M, PALLUCCHINI A, et al Adult attention-deficit hyperactivity disorder and clinical correlates of delayed sleep phase disorder. Psychiatry Res. 2020;291:113162. doi: 10.1016/j.psychres.2020.113162. [DOI] [PubMed] [Google Scholar]
- 33.CHELLAPPA S L, AESCHBACH D Sleep and anxiety: from mechanisms to interventions. Sleep Med Rev. 2022;61:101583. doi: 10.1016/j.smrv.2021.101583. [DOI] [PubMed] [Google Scholar]
- 34.EMENS J S, BERMAN A M, THOSAR S S, et al Circadian rhythm in negative affect: implications for mood disorders. Psychiatry Res. 2020;293:113337. doi: 10.1016/j.psychres.2020.113337. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.ZHANG D, LIN Z, CHEN F, et al What could interfere with a good night's sleep? The risks of social isolation, poor physical and psychological health among older adults in China. Res Aging. 2022;44(7/8):519–530. doi: 10.1177/01640275211065103. [DOI] [PubMed] [Google Scholar]
- 36.ARENDT J Biological rhythms during residence in polar regions. Chronobiol Int. 2012;29(4):379–394. doi: 10.3109/07420528.2012.668997. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.BHATTACHARYYA M, PAL M S, SHARMA Y K, et al Changes in sleep patterns during prolonged stays in Antarctica. Int J Biometeorol. 2008;52(8):869–879. doi: 10.1007/s00484-008-0183-2. [DOI] [PubMed] [Google Scholar]
- 38.SLETTEN T L, SULLIVAN J P, ARENDT J, et al The role of circadian phase in sleep and performance during Antarctic winter expeditions. J Pineal Res. 2022;73(2):e12817. doi: 10.1111/jpi.12817. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.PATTYN N, Van PUYVELDE M, FERNANDEZ-TELLEZ H, et al From the midnight sun to the longest night: Sleep in Antarctica. Sleep Med Rev. 2018;37:159–172. doi: 10.1016/j.smrv.2017.03.001. [DOI] [PubMed] [Google Scholar]
- 40.CHEN N, WU Q, XIONG Y, et al Circadian rhythm and sleep during prolonged antarctic residence at Chinese Zhongshan Station. Wilderness Environ Med. 2016;27(4):458–467. doi: 10.1016/j.wem.2016.07.004. [DOI] [PubMed] [Google Scholar]
- 41.MORAES M M, MARQUES A L, BORGES L, et al Sleep impairment and altered pattern of circadian biomarkers during a long-term Antarctic summer camp. Sci Rep. 2023;13(1):15959. doi: 10.1038/s41598-023-42910-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.SIVERTSEN B, FRIBORG O, PALLESEN S, et al Sleep in the land of the midnight sun and polar night: the Tromso study. Chronobiol Int. 2021;38(3):334–342. doi: 10.1080/07420528.2020.1845191. [DOI] [PubMed] [Google Scholar]
- 43.CORBETT R W, MIDDLETON B, ARENDT J An hour of bright white light in the early morning improves performance and advances sleep and circadian phase during the Antarctic winter. Neurosci Lett. 2012;525(2):146–151. doi: 10.1016/j.neulet.2012.06.046. [DOI] [PubMed] [Google Scholar]
- 44.MOTTRAM V, MIDDLETON B, WILLIAMS P, et al. The impact of bright artificial white and 'blue-enriched' light on sleep and circadian phase during the polar winter. J Sleep Res, 2011, 20(1 Pt 2): 154-161.
- 45.TAN L, LI T, LUO L, et al Clinical, polysomnographic, and heart rate variability in highland obstructive sleep apnea patients responding to one-night nocturnal oxygen supplementation: a post-hoc analysis from a randomized, crossover trial. Sleep Med. 2023;110:146–153. doi: 10.1016/j.sleep.2023.08.003. [DOI] [PubMed] [Google Scholar]
- 46.KOLLER D P, KASANIN V, FLYNN-EVANS E E, et al Altered sleep spindles and slow waves during space shuttle missions. NPJ Microgravity. 2021;7(1):48. doi: 10.1038/s41526-021-00177-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.BUGUET A Sleep under extreme environments: effects of heat and cold exposure, altitude, hyperbaric pressure and microgravity in space. J Neurol Sci. 2007;262(1/2):145–152. doi: 10.1016/j.jns.2007.06.040. [DOI] [PubMed] [Google Scholar]
- 48.BOSCHERT A L, ELMENHORST D, GAUGER P, et al Sleep is compromised in -12° head down tilt position. Front Physiol. 2019;10:397. doi: 10.3389/fphys.2019.00397. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.PETIT G, CEBOLLA A M, FATTINGER S, et al Local sleep-like events during wakefulness and their relationship to decreased alertness in astronauts on ISS. NPJ Microgravity. 2019;5:10. doi: 10.1038/s41526-019-0069-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.RAHMAN S A, KENT B A, GRANT L K, et al Effects of dynamic lighting on circadian phase, self-reported sleep and performance during a 45-day space analog mission with chronic variable sleep deficiency. J Pineal Res. 2022;73(4):e12826. doi: 10.1111/jpi.12826. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.BARGER L K, FLYNN-EVANS E E, KUBEY A, et al Prevalence of sleep deficiency and use of hypnotic drugs in astronauts before, during, and after spaceflight: an observational study. Lancet Neurol. 2014;13(9):904–912. doi: 10.1016/S1474-4422(14)70122-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.BASNER M, DINGES D F Lost in space: sleep. Lancet Neurol. 2014;13(9):860–862. doi: 10.1016/S1474-4422(14)70176-0. [DOI] [PubMed] [Google Scholar]
- 53.GIRARD F, LITVIN S Y, SHERMAN A, et al Phenology in the deep sea: seasonal and tidal feeding rhythms in a keystone octocoral. Proc Biol Sci. 2022;289(1985):20221033. doi: 10.1098/rspb.2022.1033. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.MAT A M, SARRAZIN J, MARKOV G V, et al Biological rhythms in the deep-sea hydrothermal mussel Bathymodiolus azoricus. Nat Commun. 2020;11(1):3454. doi: 10.1038/s41467-020-17284-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.BERENJI ARDESTANI S, BALESTRA C, BOUZINOVA E V, et al Evaluation of divers' neuropsychometric effectiveness and high-pressure neurological syndrome via computerized test battery package and questionnaires in operational setting. Front Physiol. 2019;10:1386. doi: 10.3389/fphys.2019.01386. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.NIEUWENHUYS A, DORA J, KNUFINKE-MEYFROYT M, et al "20, 000 leagues under the sea": Sleep, cognitive performance, and self-reported recovery status during a 67-day military submarine mission. Appl Ergon. 2021;91:103295. doi: 10.1016/j.apergo.2020.103295. [DOI] [PubMed] [Google Scholar]
- 57.Van PUYVELDE M, RIETJENS G, HELMHOUT P, et al The submariners' sleep study: a field investigation of sleep and circadian hormones during a 67-day submarine mission with a strict 6-h-on/6-h-off watch routine. J Appl Physiol (1985) 2022;132(4):1069–1079. doi: 10.1152/japplphysiol.00130.2021. [DOI] [PubMed] [Google Scholar]
- 58.BEALE A D, WHITMORE D, MORAN D Life in a dark biosphere: a review of circadian physiology in "arrhythmic" environments. J Comp Physiol B. 2016;186(8):947–968. doi: 10.1007/s00360-016-1000-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.BLIZNYUK A, GROSSMAN Y, MOSKOVITZ Y The effect of high pressure on the NMDA receptor: molecular dynamics simulations. Sci Rep. 2019;9(1):10814. doi: 10.1038/s41598-019-47102-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.KENDALL-BAR J M, WILLIAMS T M, MUKHERJI R, et al Brain activity of diving seals reveals short sleep cycles at depth. Science. 2023;380(6642):260–265. doi: 10.1126/science.adf0566. [DOI] [PubMed] [Google Scholar]
- 61.PONGANIS P J State of the art review: from the seaside to the bedside: insights from comparative diving physiology into respiratory, sleep and critical care. Thorax. 2019;74(5):512–518. doi: 10.1136/thoraxjnl-2018-212136. [DOI] [PubMed] [Google Scholar]
- 62.LIU J, MA T, LIU Y, et al History, advancements, and perspective of biological research in deep-underground laboratories: a brief review. Environ Int. 2018;120:207–214. doi: 10.1016/j.envint.2018.07.031. [DOI] [PubMed] [Google Scholar]
- 63.谢和平, 刘吉峰, 高明忠, 等 深地医学研究进展及构想. 四川大学学报(医学版) 2018;49(2):163–168. doi: 10.13464/j.scuxbyxb.2018.02.001. [DOI] [PubMed] [Google Scholar]; XIE H P, LIU J F, GAO M Z, et al The resrarch advancement and conceotion of the deep-underground medicine. J Sichuan Univ (Med Sci) 2018;49(2):163–168. doi: 10.13464/j.scuxbyxb.2018.02.001. [DOI] [PubMed] [Google Scholar]
- 64.WEN Q, ZHOU J, SUN X, et al Urine metabolomics analysis of sleep quality in deep-underground miners: a pilot study. Front Public Health. 2022;10:969113. doi: 10.3389/fpubh.2022.969113. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.ZHAO X, HAN K, GAO Y, et al Effects of shift work on sleep and cognitive function among male miners. Psychiatry Res. 2021;297:113716. doi: 10.1016/j.psychres.2021.113716. [DOI] [PubMed] [Google Scholar]
- 66.STRAPAZZON G, PILO L, BESSONE L, et al CAVES as an environment for astronaut training. Wilderness Environ Med. 2014;25(2):244–245. doi: 10.1016/j.wem.2013.12.003. [DOI] [PubMed] [Google Scholar]
- 67.LI L, WANG S, HUANG L, et al The impacts of workplace environment on coal miners' emotion and cognition depicted in a mouse model. Front Behav Neurosci. 2022;16:896545. doi: 10.3389/fnbeh.2022.896545. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.LI X, YANG X, SUN X, et al Associations of musculoskeletal disorders with occupational stress and mental health among coal miners in Xinjiang, China: a cross-sectional study. BMC Public Health. 2021;21(1):1327. doi: 10.1186/s12889-021-11379-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.FINNBERG N, WAMBI C, KENNEDY A R, et al The effects of antioxidants on gene expression following gamma-radiation (GR) and proton radiation (PR) in mice in vivo. Cell Cycle. 2013;12(14):2241–2247. doi: 10.4161/cc.25324. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 70.LIU J, LIU Y, MA T, et al Subjective perceptions and psychological distress associated with the deep underground: a cross-sectional study in a deep gold mine in China. Medicine (Baltimore) 2019;98(22):e15571. doi: 10.1097/MD.0000000000015571. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.WOOLCOTT O O, ADER M, BERGMAN R N Glucose homeostasis during short-term and prolonged exposure to high altitudes. Endocr Rev. 2015;36(2):149–173. doi: 10.1210/er.2014-1063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.TAYLOR A T High-altitude illnesses: physiology, risk factors, prevention, and treatment. Rambam Maimonides Med J. 2011;2(1):e0022. doi: 10.5041/RMMJ.10022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.LU H, ZHANG H, JIANG Y Methazolamide in high-altitude illnesses. Eur J Pharm Sci. 2020;148:105326. doi: 10.1016/j.ejps.2020.105326. [DOI] [PubMed] [Google Scholar]
- 74.TSENG C, LIN F, CHAO H, et al Impact of rapid ascent to high altitude on sleep. Sleep Breath. 2015;19(3):819–826. doi: 10.1007/s11325-014-1093-7. [DOI] [PubMed] [Google Scholar]
- 75.ANDERSON P J, WOOD-WENTZ C M, BAILEY K R, et al Objective versus self-reported sleep quality at high altitude. High Alt Med Biol. 2023;24(2):144–148. doi: 10.1089/ham.2017.0078. [DOI] [PubMed] [Google Scholar]
- 76.GRIMM M, SEGLIAS A, ZIEGLER L, et al Sleep apnea in school-age children living at high altitude. Pulmonology. 2023;29(5):385–391. doi: 10.1016/j.pulmoe.2023.02.008. [DOI] [PubMed] [Google Scholar]
- 77.TAN L, LI Y, CHEN H, et al Sleep at high altitude: a bibliometric study and visualization analysis from 1992 to 2022. Heliyon. 2024;10(1):e23041. doi: 10.1016/j.heliyon.2023.e23041. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 78.KONG F, LIU G, XU J Pharmacological agents for improving sleep quality at high altitude: a systematic review and meta-analysis of randomized controlled trials. Sleep Med. 2018;51:105–114. doi: 10.1016/j.sleep.2018.06.017. [DOI] [PubMed] [Google Scholar]