Abstract
目的
制备一种基于Salphen结构,具备高效仿过氧化物酶(peroxidase, POD)能力及声敏性的Fe-N2O2@C材料,用于声动力(SDT)协同化学动力(CDT)治疗肿瘤。
方法
通过水热法合成Fe-N2O2,通过掺入科琴黑碳基底制备Fe-N2O2@C,并表征该材料的形貌、结构、成分、仿酶产活性氧(ROS)能力及声敏性。通过体外实验探索Fe-N2O2@C实现SDT协同CDT杀伤4T1小鼠乳腺癌细胞的能力与机制。通过构建皮下4T1荷瘤小鼠模型探索Fe-N2O2@C联合超声辐照杀伤肿瘤的能力。
结果
Fe-N2O2@C与Fe-N2O2均为形貌不规则纳米球,平均粒径分别为25.9 nm及36.2 nm;经XRD、FTIR及XPS分析证实Fe-N2O2及Fe-N2O2@C具备M-N2O2配位的Salphen共价有机框架结构,且科琴黑负载对该结构无明显影响。相较于Fe-N2O2,Fe-N2O2@C具备高效的仿POD酶活性及声敏性,Km从19.32降低至5.82 mmol/L,vmax从2.51×10−8提升至8.92×10−8 mol/(L·s)。Fe-N2O2@C协同超声辐照可实现细胞内大量产生ROS进而导致线粒体膜电位明显下降,从而诱导TEM可观测的线粒体损伤并导致细胞凋亡和死亡。体内实验表明Fe-N2O2@C协同超声辐照可以有效地抑制4T1皮下荷瘤鼠模型瘤体生长,且不具备明显的体内毒性。
结论
本实验制备了一种基于Salphen结构的Fe-N2O2@C材料,该材料生物相容性好,可联合超声辐照实现SDT协同CDT杀伤肿瘤细胞,抑制肿瘤生长,在多模态肿瘤治疗中具有良好的应用前景。
Keywords: 共价有机框架, 肿瘤杀伤, 仿酶制剂, 化学动力治疗, 声动力治疗
Abstract
Objective
To synthesize a Salphen-based Fe-N2O2@C material with high peroxidase (POD)-mimicking activity and sonosensitivity for the synergistic sonodynamic (SDT) and chemodynamic (CDT) therapy of tumors.
Methods
Fe-N2O2 was synthesized via the hydrothermal method, and Fe-N2O2@C was prepared by incorporating a ketjen black substrate. The morphology, structure, composition, enzyme mimic activity for reactive oxygen species (ROS) production, and sonosensitivity of the material were characterized. The ability and mechanism of Fe-N2O2@C to perform synergistic SDT and CDT killing of 4T1 mouse breast cancer cells were explored through in vitro experiments. The in vivo tumor-killing ability of Fe-N2O2@C combined with ultrasound irradiation was investigated using a subcutaneous 4T1 tumor-bearing mouse model.
Results
FFe-N2O2 and Fe-N2O2@C were both irregularly shaped nanospheres with average particle sizes of 25.9 nm and 36.2 nm, respectively. XRD, FTIR, and XPS analyses confirmed that both Fe-N2O2 and Fe-N2O2@C possessed a Salphen covalent organic framework structure with M-N2O2 coordination, and the ketjen black loading had no significant impact on this structure. Compared to Fe-N2O2, Fe-N2O2@C exhibited high POD-mimicking activity (with Km reduced from 19.32 to 5.82 mmol/L and vmax increased from 2.51×10−8 to 8.92×10−8 mol/[L·s]) and sonosensitivity. Fe-N2O2@C in combination with ultrasound irradiation could produce a large amount of ROS within cells and a subsequent significant decrease in mitochondrial membrane potential, thereby inducing TEM-observable mitochondrial damage and causing cell apoptosis and death. In addition, in vivo experiments showed that Fe-N2O2@C in combination with ultrasound irradiation could effectively inhibit tumor growth in a 4T1 subcutaneous tumor-bearing mouse model without significant in vivo toxicity.
Conclusion
In this study, we prepared a Salphen-based Fe-N2O2@C material with good biocompatibility, which can be used in combination with ultrasound irradiation to achieve SDT and CDT synergistic killing of tumor cells and inhibit tumor growth. This Salphen-based Fe-N2O2@C nanomaterial shows promising potential for multimodal tumor therapy.
Keywords: Covalent organic framework, Tumor killing, Enzyme mimetic materials, Chemodynamic therapy, Sonodynamic therapy
当前肿瘤的主要治疗策略包括放疗、化疗以及手术治疗,但这些手段在临床应用中仍然存在局限性和挑战。为提高患者的生存率,研究人员一直在寻找新的治疗策略。基因治疗[1]、光动力疗法(photodynamic therapy, PDT)[2]、声动力疗法(sonodynamic therapy, SDT)[3]和免疫疗法[4]等新型治疗方法在肿瘤治疗中展现出巨大的潜力。然而,由于肿瘤的异质性和复杂性,单一治疗模式的疗效有限。因此,结合多种治疗模式进行综合治疗是当前肿瘤治疗研究的重点方向[5]。
基于肿瘤微环境(tumor microenvironment, TME)开发的治疗手段是近年来的研究重点。TME具备微酸性及富含H2O2的化学特征[6]。化学动力疗法(chemodynamic therapy, CDT)就是通过开发具备高催化活性的仿酶纳米制剂,利用TME特性大量催化产活性氧(reactive oxygen species, ROS),进而打破肿瘤局部细胞氧化—还原平衡,引起肿瘤细胞死亡而实现抗肿瘤[7-8]。相较于传统化疗及放疗,CDT具备选择性强,全身毒副作用小的特点。SDT则是利用超声辐照激活声敏剂,并在辐照局部组织内实现大量产ROS[7-9]。然而,目前临床应用的声敏剂(如:血卟啉单甲醚[10],纳米二氧化钛[11]等)仅具备SDT单一效能,它们的CDT效率相对较低,治疗效果欠佳。而传统的仿酶材料多基于金属氧化物、金属纳米颗粒及金属掺杂碳材料等无机材料[12]。这些材料虽具备较高的仿酶活性,但其或无法实现SDT或生物相容性较差。因此,设计一个具有同时具备CDT及SDT效能且生物相容性好的纳米治疗平台以实现化学-声学联合肿瘤治疗仍然是研究难题。
金属有机框架(mental-organic framework, MOF)因其多孔性,可修饰性,以及低毒性等优点被广泛应用于抗肿瘤治疗中。MOF离子配位结构的特点导致了其稳定性较差[13],这可能影响其仿酶催化活性,崩解后的MOF仿酶产ROS效应降低或持续时间短从而影响治疗效果。近年来,共价有机框架(covalent organic framework, COF)的开发给肿瘤纳米治疗提供了更多可能。其共价键结构提供了极强的材料稳定性,同时也具备较好的生物相容性,易修饰性等功能[14]。然而,多数基于COF的治疗方案设计依旧离不开抗肿瘤活性物质的封装或掺杂,如何使COF框架本身即具备治疗效应存在一定的挑战。Salphen是一种由羟基苯甲醛和亚苯基胺前体缩合制备成的四齿席夫碱配体[15],具有较强的金属配位能力。且由于该结构中的N2O2与金属离子络合后会形成一个具有大共轭电子结构且与常见的氧化还原酶具备类似的配位结构从而使得Salphen基材料具备潜在的仿酶能力。而基于Salphen结构的COF(salphen-based covalent organic framework, SCOF)材料相较于Salphen基MOF则具备共价键提供的结构稳定性[16]。因此,新型仿酶SCOF的开发有望为抗肿瘤治疗提供高效,稳定,长时的CDT效应。
既往研究发现将COF基催化剂负载在碳材料,如石墨烯[17-19]及碳纳米管[20-21]上已被证明可以显著改善催化剂的电子传导效率,进而提高催化活性。因此本研究尝试引入科琴黑(Ketjen black, KB)负载SCOF——Fe-N2O2以制备具有高催化活性的Fe-N2O2@C纳米治疗平台,通过化学结构及成分表征证明了其原子Fe-N2O2的配位网络。另一方面,通过仿酶活性检测证明其具备过氧化物酶(peroxidase,POD)活性,可利用H2O2催化产ROS。同时其具备声敏活性,可协同POD仿酶能力实现对肿瘤细胞的多模态杀伤。本研究通过体内实验也证明Fe-N2O2@C可明显抑制肿瘤生长。我们相信,本研究创新性地证实了SCOF负载于碳基底上具备高效的仿酶活性及声敏效应,为新型的纳米治疗药物开发及多模态肿瘤治疗提供了新的前景。
1. 材料与方法
1.1. 仪器和材料
1.1.1. 主要试剂和材料
KB购自科路得;N,N-二甲基甲酰胺(DMF)购自优思福;2,4,6 -三甲酰基间苯三酚购自安耐吉化学;邻苯二胺、四氢呋喃(THF)、3,3′,5,5′-4甲基联苯胺(TMB)、醋酸钠(NaOAc)、醋酸(HOA)以及过氧化氢(H2O2)购自Aladdin;乙酸铁及9,10-二苯蒽醌(DPA)购自麦克林。
小鼠乳腺癌细胞4T1购自ATCC。1640培养基、胎牛血清、PBS、胰酶以及双抗购自Gibco。CCK-8细胞活性检测试剂购自索莱宝。活/死染色液、活性氧检测试剂盒(DCFH-DA)以及JC-1染色试剂盒购自碧云天。Annexin-V/PI细胞凋亡染液购自四正柏。8周龄Balb/c雌性小鼠购自北京华阜康(动物实验伦理批号:20220302062)。
1.1.2. 主要仪器
扫描电子显微镜(SEM,Regulus8220,Hitachi Limited),透射电子显微镜(TEM,Talos F200X,美国 FEI 公司),球差校正透射电镜(JEM ARM 200F,日本JEOL公司),X射线衍射仪(DX-2700BH,丹东浩元仪器有限公司),X射线光电子能谱仪(K-Alpha,美国赛默飞世尔科技公司),光吸收全波长酶标仪(ReadMax1900,上海闪谱生物科技有限公司),pH计(PHS-2F,中国雷磁仪器公司),倒置荧光显微镜(Ti2,Nikon),流式细胞分析分选仪(FACSAriaIII,BD)。
1.2. 实验方法
1.2.1. 仿酶材料的制备
Fe-N2O2@C的制备(图1):首先将63.75 mg KB分散于4.5 mL DMF中。然后向溶液中加入21 mg 2,4,6-三甲酰基间苯三酚(0.1 mmol)和16.2 mg邻苯二胺(0.15 mmol),搅拌10 min。然后将26.09 g乙酸铁(0.15 mmol)溶于1 mL DMF中。缓慢滴加乙酸铁(Ⅱ)溶液,搅拌10 min。最后,将所得溶液转移到聚四氟乙烯内衬的高压反应釜中,于120 ℃下加热3 d。通过过滤收集黑色粉末,并用THF、DMF和乙醇抽滤洗涤,然后在80 ℃真空下干燥。Fe-N2O2的制备方法同上,但不加KB。
图 1.

Preparation of Fe-N2O2@C
Fe-N2O2@C的制备
1.2.2. 仿POD活性测试
通过TMB显色反应检测POD仿酶活性。分别量取25 µL H2O2(0.1 mol/L)和25 µL TMB(10 mg/mL,溶剂:DMF)添加到含1940 µL醋酸/醋酸钠(NaOAc/HOA)缓冲液(pH=4.5,0.1 mol/L)的离心管中,接着添加10 µL AMEs分散液(10 mg/mL,溶剂:NaOAc/HOA缓冲溶液),混合均匀,反应5 min后,用酶标仪测定反应后溶液的吸光度(λ=652 nm)。
1.2.3. 催化稳态动力学
通过改变H2O2的浓度研究仿酶能力的稳态动力学。将不同体积的H2O2(0.1 mol/L)、25 µL TMB(10 mg/mL,溶剂:DMF)和10 µL Fe-N2O2或Fe-N2O2@C分散液(10 mg/mL)混合于2 mL离心管中,用NaOAc/HOA缓冲液定容到2 mL,混合均匀后常温反应5 min,用酶标仪测定反应后溶液的吸光度(λ=652 nm)。
同理,通过在一定H2O2浓度条件下,改变CB、NaCl和TMB浓度,进行测定Fe-N2O2或Fe-N2O2@C相应的稳态动力学。
酶促动力学参数分析:首先基于朗伯比尔定律(Lambert-Beer law)进行吸光度与底物浓度的关系换算,转换关系方程如下:
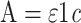 |
1 |
式(1)中:A代表吸光度;ε=39000 mol/(L·cm)(TMB);c为TMB浓度(mol/L),l代表比色皿反应池的长度(cm)。
然后,利用米氏(Michaelis–Menten)方程将催化反应速率(v)和不同底物(H2O2或TMB)浓度[S]进行拟合。米氏方程如下:
 |
2 |
式(2)中:v0代表初始反应速率;vmax代表最大反应速率;Km代表米氏常数。
接着,利用双倒数曲线(Lineweaver-Burk plot)进一步求得vmax和Km,双倒数方程如下:
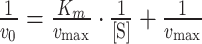 |
3 |
最后,通过方程(4)计算仿酶材料催化活性TON。
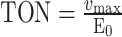 |
4 |
其中,TON(s−1)代表单位催化活性中心对底物的最大转换数量;E0代表催化活性中心摩尔浓度。
1.2.4. 声敏效应测试
使用9,10-二苯蒽醌(DPA)测试Fe-N2O2@C的声敏性。超声辐照激发1O2产生后,DPA被氧化为DPO2导致其在大约378 nm处的特征吸收峰逐渐减弱。将30 μL DPA (1 mg/mL)、5 μL Fe-N2O2@C(2 mg/mL)或5 μL Fe-N2O2(2 mg/mL)或5 μL PBS以及165 μL PBS混合均匀后,对溶液施加超声辐照(1 W/cm2,30%占空比,1 MHz,1 min),然后迅速使用酶标仪测定反应后上述溶液光谱曲线(300~500 nm)。
1.2.5. Fe-N2O2@C的细胞毒性检测
将4T1细胞按照8.0×103/孔的密度接种于96孔板(1640培养基,10%FBS,1%双抗;采用盐酸调节培养基pH值至6.5作为酸性诱导环境)。12 h后将Fe-N2O2或Fe-N2O2@C纳米粒按照0、20、40、60、80、100、150、200 μg/mL的质量浓度添加至孔板中。24 h后加入10%CCK-8试剂,于1.5 h后通过酶标仪检测OD450以计算各组细胞活性。
1.2.6. Fe-N2O2@C协同超声的细胞杀伤效率检测
本实验及后续细胞实验分组设置为①PBS组,②Fe-N2O2组(100 μg/mL),③Fe-N2O2@C组(100 μg/mL)以及④Fe-N2O2@C+US组(100 μg/mL,1 W/cm2,30%占空比,1 min)。将4T1细胞按照4.0×104/孔的密度接种于24孔板。12 h后添加Fe-N2O2或Fe-N2O2@C纳米粒。另12 h后对Fe-N2O2@C+US组进行超声辐照。12 h后使用Calcein-AM/PI细胞活性与细胞毒性检测试剂盒进行染色,染色方式参照说明书。用倒置荧光显微镜观察各组细胞活/死情况,使用Image J软件统计各组活/死细胞个数。
1.2.7. 细胞TEM观察Fe-N2O2@C纳米粒吞噬及线粒体损伤
将4T1细胞按照1.5×105/孔的密度接种于6孔板。12 h后将Fe-N2O2@C纳米粒按照100 μg/mL的质量浓度添加至各孔,PBS组不添加材料干预。24 h后用胰酶消化收集细胞,300×g离心3 min后采用1 : 5(3%戊二醛 : PBS)重悬细胞沉淀并于4 ℃固定细胞5 min。在TEM观察前采用3%戊二醛保存细胞沉淀。
1.2.8. Fe-N2O2@C协同超声的促胞内ROS富集效果探索
采用DCFH-DA探针标记细胞内ROS。将4T1细胞按照8.0×103/孔的密度接种于96孔板。12 h后将100 μg/mLFe-N2O2或100 μg/mL Fe-N2O2@C纳米粒添加至各组。12 h后加入10 μmol/L的DCFH-DA。孵育30 min后对Fe-N2O2@C+US组进行超声辐照,参数同上。30 min后将染液换为无血清培养基,用倒置荧光显微镜观察各组细胞荧光水平,使用Image J软件统计DCFH-DA阳性细胞个数。
1.2.9. Fe-N2O2@C协同超声导致细胞内线粒体损伤检测
采用JC-1试剂盒对细胞内线粒体膜电位(mitochondrial membrane potential,MMP)进行染色标记。将4T1细胞按照8.0×103/孔的密度接种于96孔板。12 h后将Fe-N2O2或Fe-N2O2@C纳米粒按照100 μg/mL的质量浓度添加至各组。12 h后对Fe-N2O2@C+US组进行超声辐照,参数同上。另等12 h后每孔加入100 μL JC-1染色工作液,于细胞培养箱中37 ℃孵育20 min。染色结束后更换为完全培养基,用倒置荧光显微镜观察各组细胞荧光水平,使用Image J软件统计各组平均荧光强度(mean fluorescence intensity, MFI)。
1.2.10. Fe-N2O2@C协同超声促进细胞凋亡检测
将4T1细胞按照1.5×105/孔的密度接种于6孔板。12 h后将Fe-N2O2或Fe-N2O2@C纳米粒按照100 μg/mL的质量浓度添加至各组。12 h后对Fe-N2O2@C+US组进行超声辐照,参数同上。另等12 h后消化收集细胞,采用Annexin-V/PI染色试剂盒标记凋亡细胞,并经FACSAriaIII流式分析仪进行细胞筛选,经FlowJo软件对细胞进行分群。
1.2.11. Fe-N2O2@C协同超声的体内抗肿瘤研究
将12只雌性4周龄Balb/c小鼠随机分为4组:①PBS,②Fe-N2O2,③Fe-N2O2@C以及④Fe-N2O2@C+US组。用胰岛素针于鼠背部皮下注射4T1细胞,待瘤体长至约100 mm3时对肿瘤进行治疗。采用瘤内注射的方式将Fe-N2O2或Fe-N2O2@C纳米粒注射至瘤内(100 μL,1 mg/mL)。待12 h后对瘤体进行超声辐照,参数设置为2.0 W/cm2,30%占空比,1 MHz,辐照时间5 min。按照此方式治疗3次,治疗期间记录肿瘤大小变化及小鼠体质量变化,第15天将小鼠安乐死并剖出肿瘤及脏器。对离体肿瘤进行测重,采用HE染色观察脏器组织及细胞结构。
1.3. 统计学方法
文中数据统计及分析使用Graphpad prism(ver. 9.5.0)完成,计量资料符合正态分布均以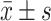 表示,文中数据服从正态分布,各实验结局指标的多组比较选择单因素方差分析,进一步的两两比较的P值矫正方法选择 Tukey 法。P<0.05 为差异有统计学意义。
表示,文中数据服从正态分布,各实验结局指标的多组比较选择单因素方差分析,进一步的两两比较的P值矫正方法选择 Tukey 法。P<0.05 为差异有统计学意义。
2. 结果
2.1. Fe-N2O2及Fe-N2O2@C的形貌及成分表征
本研究制备出的Fe-N2O2的形貌为不规则小球(图2A),其粒径约为25.9 nm(图2B),元素Mapping结果表明Fe、N和O元素均匀分布于C元素基底上(图2C)。负载科琴黑后,Fe-N2O2 @C形貌表现出与科琴黑基体类似的形貌(图2D),其粒径约为36.2 nm(图2E),元素mapping结果同样说明Fe、N和O元素均匀分布于C元素基底上(图2F)。高分辨率TEM照片未出现明显的亮点,说明无明显金属颗粒生成(图2G)。球差透射电镜进一步说明Fe元素呈原子级分散在基底上(图2H),初步说明成功合成了Fe-N2O2及Fe-N2O2@C仿酶纳米制剂。
图 2.

Structure, morphology, and component characterization of Fe-N2O2 and Fe-N2O2@C
Fe-N2O2及Fe-N2O2@C形貌及成分表征
A, SEM image of Fe-N2O2; B, size distribution of Fe-N2O2; C1-C5, elemental mapping of Fe-N2O2; D, SEM image of Fe-N2O2@C; E, size distribution of Fe-N2O2@C; F1-F5, elemental mapping of Fe-N2O2@C; G, HR-TEM image of Fe-N2O2@C; H, spherical aberration electron microscope image of Fe-N2O2@C.
2.2. Fe-N2O2及Fe-N2O2@C的配位结构分析
如图3A所示,Fe-N2O2及Fe-N2O2@C的谱图中均未出现明显的金属铁吸收峰,仅在25°处出现了典型碳吸收峰,说明材料结构中无明显单质Fe,再次说明Fe元素呈单原子状态分布[22]。通过红外光谱测试(图3B)发现,反应后单体1,2邻苯二胺中的氨基(-NH2, 3385 cm−1和3364 cm−1)及2,4,6-三醛基间苯三酚上的酮基(-C=O)完全消失,在1617 cm−1和1537 cm−1处出现了新的C=O和C=C伸缩振动吸收峰,同时在1316 cm−1处出现了C=N的吸收峰,这些特征峰的消失和出现明确说明水热过程生成了Salphen结构[16]。XPS结果说明材料由C、N、O、Fe四种元素构成(图3C)。其中,Fe-N2O2中C、N、O、Fe的原子百分比分别为70.42%、11.70%、14.96%、2.92%;Fe-N2O2@C中分别为80.61%、7.93%、9.56%、1.90%,C含量明显升高,说明碳基底的成功负载,同时说明负载的Fe-N2O2层较薄(图3D和图3E)。对元素价态进行分析可知,Fe元素主要以高价态,即Fe2+/Fe3+形式存在,进一步说明Fe元素以原子形式存在(图3F和图3G)。N元素主要以3种结构存在,分别对应Fe-N和两种形式存在的C-N(图3H和图3I)。对Fe-N2O2和Fe-N2O2@C中Fe及N元素化学价态分析可知(图3J),碳负载对Fe、N、O及C的配位结构及Fe-N2O2的化学结构无明显影响。
图 3.
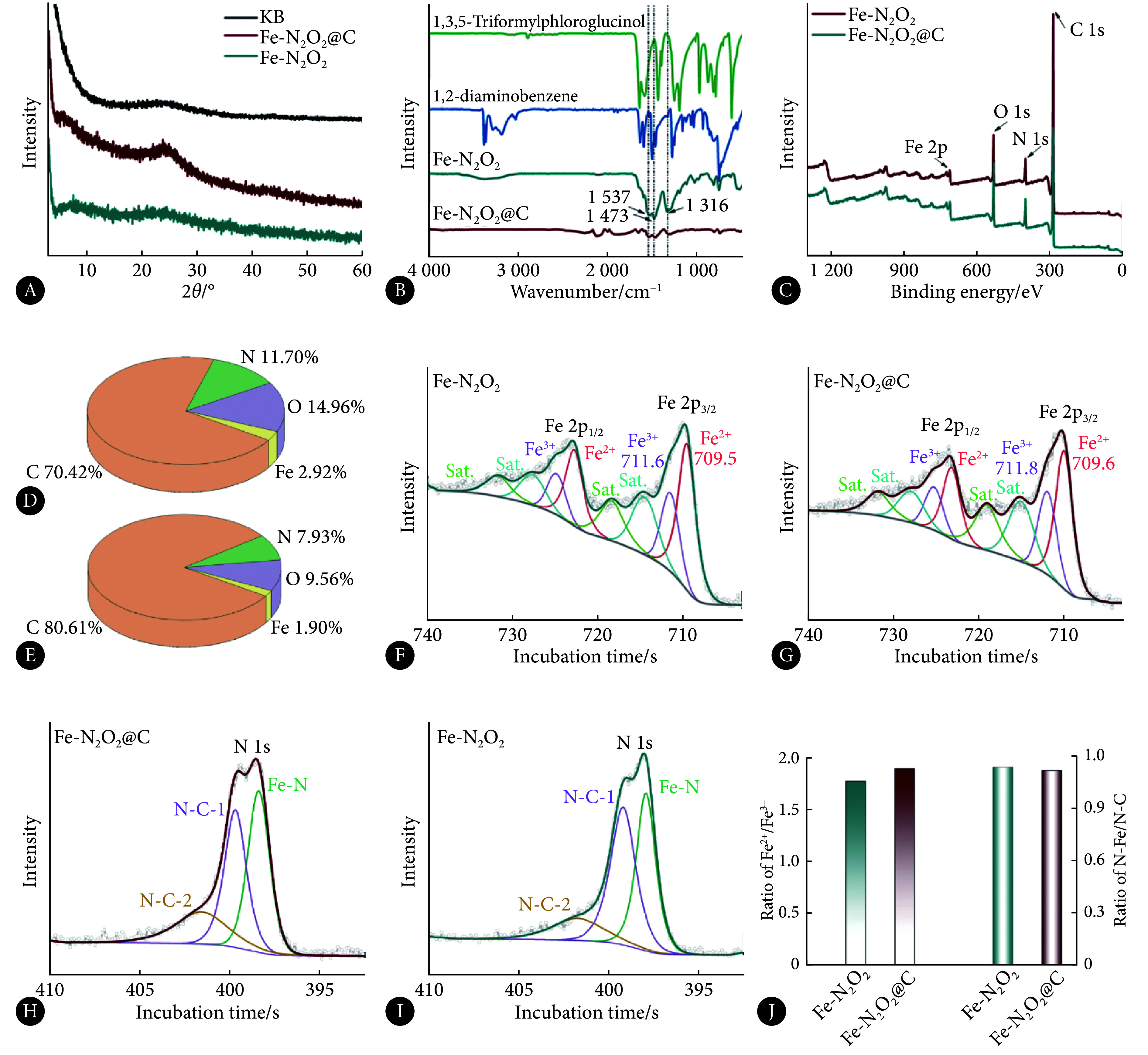
Analysis of the coordination structure of Fe-N2O2 and Fe-N2O2@C
Fe-N2O2和Fe-N2O2@C的配位结构分析
A, XRD spectrum; B, FTIR spectrum; C, XPS spectrum; D (Fe-N2O2) and E (Fe-N2O2@C), atomic percentage of every element calculated by XPS; F (Fe-N2O2) and G (Fe-N2O2@C), XPS spectrum of Fe element; H (Fe-N2O2@C) and I (Fe-N2O2), XPS spectrum of N element; J, content ratio of different chemical states of elements calculated by XPS peaking.
2.3. Fe-N2O2@C的仿酶活性及声敏性检测
仿酶活性检测表明(图4A和图4B),相较于Fe-N2O2,Fe-N2O2@C可高效仿POD酶活性将H2O2氧化使TMB明显变色而呈现出深蓝色。Fe-N2O2检测试管仅表现为淡蓝色。为了解释碳负载提高导电性和POD酶活性的机理,本研究对Fe-N2O2和Fe-N2O2 @C的仿酶催化动力学进行了分析,结果如表1所示。负载科琴黑后,材料对反应底物——H2O2的亲和力明显提高(Km从19.32降低至5.82 mmol/L),同时对TMB的催化转化能力也明显增强,vmax从2.51×10−8 mol/(L·s) 提升至8.92×10−8 mol/(L·s),因此,Fe-N2O2 @C表现出较高的仿POD催化产ROS活性。本研究通过四探针法对科琴黑负载前后材料的导电性进行了测试,结果表明,纯Fe-N2O2仿酶制剂的电阻较大,超出了设备的测试范围,而Fe-N2O2@C具有良好的导电性,其电导率-压强关系如图4C所示。导电性的优化被认为可以显著改善催化剂的电子传导效率,进而提高催化活性。因此Fe-N2O2@C的优异仿酶活性应与导电性的优化有关[17, 20, 23]。另一方面,声敏性检测表明(图4D),经超声辐照后,DPA光谱扫描曲线吸光度值显著下降,提示DPA被超声辐照产生的1O2氧化,证实Fe-N2O2@C具备声敏性。因此,本实验结果支持Fe-N2O2@C用于SDT协同CDT治疗肿瘤,为后续体内外验证打下基础。
图 4.
Characterization of the enzyme-mimetic ability and sonosensitivity of Fe-N2O2@C
Fe-N2O2@C的仿酶活性及声敏性验证
A, UV–vis absorption spectra and the absorbance values of the catalyzed oxidation of TMB as catalyzed by control, Fe-N2O2, and Fe-N2O2@C; B, quantitative analysis of absorbance values at λ=652 nm; C, conductivity-pressure curve of Fe-N2O2@C; D, Sono-stimulated catalytic oxidation of DPA (the arrow indicates that there is a downward trend in the spectrum after scanning).
表 1. Enzyme-mimicking catalytic kinetics of Fe-N2O2 and Fe-N2O2@C.
Fe-N2O2和Fe-N2O2@C的仿酶催化动力学
| Enzyme-like material | Substrate | Km/(mmol/L) | vmax/(mol/(L·s)) |
| Fe-N2O2@C | H2O2 | 5.82 | 7.60×10−8 |
| Fe-N2O2@C | TMB | 3.35 | 8.92×10−8 |
| Fe-N2O2 | H2O2 | 19.32 | 8.90×10−8 |
| Fe-N2O2 | TMB | 1.12 | 2.51×10−8 |
2.4. Fe-N2O2@C的体外抗肿瘤实验
为了验证Fe-N2O2@C对肿瘤细胞的杀伤功效,本研究进行了体外细胞实验。如图5A所示,在将Fe-N2O2纳米粒与4T1小鼠乳腺癌细胞培养24 h后,经CCK-8实验测试发现,无论是在酸性环境(经盐酸调整pH6.5的完全培养基)还是常规培养环境下,4T1细胞活力出现了一定程度的下降,在200 μg/mL Fe-N2O2的刺激下活力下降到50.8%(pH=7.5)以及49.6%(pH=6.5)。然而,将Fe-N2O2@C与4T1细胞培养24 h后发现(图5B),在低质量浓度(20 μg/mL)刺激后细胞活力即可出现明显抑制,pH=7.5时54.2%,pH=6.5时57.2%。而在200 μg/mL Fe-N2O2@C刺激下,细胞活力下降到了21.8%(pH=7.5)及7.6%(pH=6.5)。这证明了Fe-N2O2@C具备远优于Fe-N2O2的肿瘤细胞杀伤性能,与其所具备的更高效的酸响应仿POD酶产ROS性能相符合。此外,为了验证其生物安全性,本研究将相同梯度浓度的Fe-N2O2 和Fe-N2O2@C材料与HUVEC细胞系进行共培养。如图5C所示,在0~100 μg/mL时,Fe-N2O2和Fe-N2O2@C均未对细胞活力产生影响(P均大于0.05)。而在150 μg/mL时Fe-N2O2@C干预使HUVEC细胞活力部分下降(81.4%),在200 μg/mL时下降至75.5%。因此,后续实验中采用100 μg/mL Fe-N2O2或Fe-N2O2@C对肿瘤细胞进行干预。
图 5.

The killing effect of Fe-N2O2@C+US on 4T1 cells
Fe-N2O2@C协同超声针对4T1细胞的杀伤效果
A and B, The killing effect of Fe-N2O2 and Fe-N2O2@C on 4T1 cells assessed by CCK-8 assay (n=3 per group. * P<0.05, ** P<0.01, *** P<0.001, **** P<0.0001); C, the biocompatability of Fe-N2O2 and Fe-N2O2@C on HUVEC cells assessed by CCK-8 assay; D, live/dead staining of 4T1 cells after different treatments, bar=50 μm; E, live/dead cell counts ( n=3 per group. ** P<0.01, *** P<0.001, **** P<0.0001, compared with PBS).
另一方面,本研究使用Calcein-AM/PI染色法对不同干预后的4T1细胞进行活(绿色荧光细胞)/死(红色荧光细胞)染色探索其对细胞的杀伤效率。染色结果(图5D和图5E)表明,PBS组以及Fe-N2O2组内均未发现明显的死亡细胞,但Fe-N2O2组活细胞数量出现一定程度下降,可能是Fe-N2O2影响了肿瘤细胞的增殖效率所导致。在Fe-N2O2@C组中出现较为明显的死细胞(37.0 vs. 3.0,P=0.005),同时活细胞稀疏可见(70.3 vs. 212.0 P=0.001)。在Fe-N2O2@C+US组中,活细胞几乎不可见(19.0 vs. 212.0,P=0.0001),而死细胞数量明显增加(66.0 vs. 3.0,P<0.0001)。本实验进一步验证了Fe-N2O2@C具备良好的肿瘤细胞杀伤效应。同时,在联合超声辐照的基础上,杀伤效果进一步放大。
2.5. Fe-N2O2@C的细胞杀伤机制探索
Fe-N2O2@C主要通过仿POD酶联合超声辐照实现大量细胞内产ROS而杀伤细胞。如图6A所示,本研究通过细胞TEM观察发现,PBS组4T1细胞形态结构正常,细胞内线粒体细长,显色度均一。另一方面,Fe-N2O2@C干预的4T1细胞内可见内吞的Fe-N2O2@C纳米粒(红色剪头所指)。同时细胞质内出现大量空泡,并且线粒体缩小,密度增高,为典型的线粒体损伤表现[24]。
图 6.

Exploring the cellular killing mechanism of Fe-N2O2@C in 4T1 cells
Fe-N2O2@C杀伤4T1细胞的机制探索
A, Bio-TEM observation of 4T1 cells after different treatment. The red arrow indicates internalized Fe-N2O2@C; B, intracellular ROS assessed by DCFH-DA probe, bar=50 μm; C, ROS positive cell counts; D, JC-1 staining of 4T1 cells after different treatments, bar=50 μm; E, MFI of JC-1 aggregate and JC-1 monomer in JC-1 staining; F, flowcytometry analysis after Annexin-V/PI staining; G, apoptotic cell ratios calculated by Q2 plus Q3 cell ratios in flowcytometry analysis. In the above experiments, n=3 per group. * P<0.05, ** P<0.01, *** P<0.001, **** P<0.0001, compared with PBS.
接下来本研究通过DCFH-DA探针来标记细胞内的ROS水平。如图6B所示,染色结果表明,PBS组内出现极个别细胞内表达染色可见的ROS。在Fe-N2O2组中,DCFH-DA阳性染色的细胞出现增多(图6C,17 vs. 2.3,P=0.0335),而在Fe-N2O2@C组内则更明显(30.7 vs. 2.3,P=0.0007)。在Fe-N2O2@C + US组中,大量出现阳性染色细胞(69.7 vs. 2.3,P<0.0001)。该实验结果证实,Fe-N2O2@C干预联合超声辐照可以高效地促进细胞内ROS产生。
ROS导致的细胞杀伤主要表现为细胞内线粒体的损伤,而MMP则是反映线粒体状态的有效指标[7]。当ROS损伤细胞导致细胞凋亡后,MMP则会出现明显下降,而使用JC-1染色剂可以有效反映这一过程。在线粒体膜电位较高时,JC-1可聚集于线粒体基质内而形成聚合物(J-aggregates)而产生红色荧光;相反,在线粒体膜电位较低时,JC-1无法聚集于线粒体基质而作为单体存在(J-monomer)并表现为绿色荧光。如图6D所示,本研究采用JC-1染料对不同干预后的4T1细胞进行了染色。结果表明,PBS组J-aggregates的MFI最高,而Fe-N2O2干预后出现下降(图6E,37.7 vs. 51.5,P=0.0446)。在Fe-N2O2@C(27.1 vs. 51.5,P=0.0018)以及Fe-N2O2@C+US(12.9 vs. 51.5,P<0.0001)组中,只可见微弱的红色荧光,MFI明显降低。另一方面,PBS组的J-monomer MFI较低,而Fe-N2O2可部分提高J-monomer含量但差异无统计学意义(19.8 vs. 7.5,P=0.1079)。Fe-N2O2@C的干预均可显著提高J-monomer含量(33.2 vs. 7.5,P=0.0024)。在此基础上,联合超声辐照后Fe-N2O2@C+US组细胞表现出最强的J-monomer MFI(39.0 vs. 7.5,P=0.0006)。这一实验表明,Fe-N2O2@C联合超声辐照可以显著降低4T1细胞的MMP水平,符合ROS诱导的细胞损伤特征。
高水平的胞内ROS主要通过引起细胞凋亡而实现肿瘤杀伤[25]。因此,本研究使用Annexin-V/PI染色标记凋亡细胞,并通过流式细胞学分析各部分细胞比例以探索Fe-N2O2@C的促凋亡功效。如图6F所示,Annexin-V染色阳性即为凋亡细胞。其中,PBS组内凋亡细胞占5.97%,Fe-N2O2刺激将凋亡细胞比例提升至16.2%但差异无统计学意义(图6G,P=0.0506)。Fe-N2O2@C组内则存在29.01%的凋亡细胞(P=0.0004)。而在Fe-N2O2+US组中,凋亡细胞比例达到了74.65%(P<0.0001)。上述系列实验证明Fe-N2O2@C纳米粒可被肿瘤细胞顺利内吞,在联合超声辐照时实现胞内高水平ROS富集,引起细胞线粒体损伤以及细胞凋亡。
2.6. Fe-N2O2@C的体内抑瘤效果探索
在对皮下荷瘤鼠进行治疗后第15天分离肿瘤后,图7A可见Fe-N2O2@C+US小鼠皮下瘤体积最小。对肿瘤体积的统计结果显示(图7B),PBS组瘤体持续快速增长;Fe-N2O2对肿瘤具备一定的抑制作用,但在第15天对比PBS组瘤体大小差异无统计学意义(P=0.420)。另一方面,Fe-N2O2@C的干预显著抑制了瘤体(P=0.042),而联合超声辐照后,Fe-N2O2@C+US组内肿瘤体积被进一步抑制(P<0.001),组内肿瘤生长缓慢。对肿瘤质量统计结果显示(图7C), 在结局时间点,Fe-N2O2@C+US组内肿瘤质量最低(P=0.003),此外,其相较于Fe-N2O2(P=0.053)或Fe-N2O2@C(P=0.036)治疗差异均有统计学意义。在治疗过程中,各组小鼠体质量变化均无明显差异(图7D)。而针对脏器的HE染色发现(图7E),接受Fe-N2O2@C治疗的小鼠脏器未发现明显病变,证实其具备良好的生物安全性。
图 7.

The in vivo anti-tumor effects of Fe-N2O2@C+US
Fe-N2O2@C协同超声辐照的体内抗肿瘤效果
A, Digital photos of the tumor xenograft after excision; B, the tumor volume change; C, tumor mass after excision; D, mouse body mass; E, HE staining of the main organs from different groups. In the above experiments, n=3 per group. * P<0.05, ** P<0.01, *** P<0.001, compared with PBS.
3. 讨论
放疗和化疗的出现是肿瘤治疗史上的里程碑,极大改善了患者的生存率。然而,由之引起的一系列副作用使研究者们依旧在探索更优异的替代疗法。PDT及SDT近年来发展飞速并成功应用于多种肿瘤治疗,其主要通过使用532~805 nm的光照刺激光敏剂(如血卟啉,吲哚菁绿等)[26]或采用超声波辐照声敏剂(血卟啉,二氧化钛)[27]促使肿瘤局部产生ROS以造成肿瘤细胞杀伤。类似的是,CDT作为TME响应治疗,可利用肿瘤局部富H2O2及微酸性环境产ROS实现抑瘤治疗。上述多种手段相较于传统的放化疗具备较低的全身毒性,优异的肿瘤选择性以及低成本等优势。然而,目前这些治疗手段也存在诸多期待解决的短板,如:SDT及CDT所采用的无机物、金属化合物以及金属基仿酶制剂等难以被机体代谢,可能造成严重的积累毒性;而有机介质如卟啉等虽易于代谢但仅具备光/声敏性,存在治疗效率较差的问题。因此,多途径、高效能的实现TME特异性产ROS一直是研究重点。
近年来,COF结构纳米材料被广泛开发应用[14]。这些材料主要是通过轻质元素(H、B、C、N、Si和O)的不同动态共价键连接组装而成的,例如偶氮(N=N)、苯硅氧硼烷(B-O-Si)、硼酸酯(B-O-C)、硼氧烷(B-O-B)和酰亚胺(C=N)。它们的独特性质,如多孔性、共轭链、易于修饰/功能化和稳定性,使它们可通过CDT、SDT、PDT以及载药和肿瘤靶向等多种功能实现高效而稳定的肿瘤杀伤。近年来,Slaphen结构COF推陈出新,其M-N2O2的结构成功引入金属单原子掺杂实现高效仿酶应用,相较于传统的金属氧化物或金属团簇仿酶制剂具备更优异的生物相容性,并且相较于传统金属有机框架具备更强的材料稳定性[16]。并且SCOF的肿瘤治疗应用目前鲜有报道。因此,本实验通过引入Fe单原子以制备Fe-N2O2 SCOF纳米材料以实现CDT效应。与Salphen基MOF相比,本实验合成的Fe-N2O2 SCOF结构中的Salphen结构通过共价键连接,具有更高的结构稳定性,同时,以2,4,6-三甲酰基间苯三酚和邻苯二胺为聚合单体,其具有全π共轭结构和高密度的活性位点,进而具有较高的催化活性。在此基础上,本研究通过引入科琴黑掺杂得到Fe-N2O2@C改善材料导电性以提高其仿酶活性。既往研究中对单原子纳米材料的声敏性探索中认为[28],M-N4的结构与卟啉相符,并且该研究也证实此类结构的材料具备SDT。而本研究所提供的SCOF具备与M-N4类似的M-N2O2结构,同时,C的掺杂被证实可以通过改善导电性优化仿酶催化能力。因此,Fe-N2O2@C可能通过其M-N2O2的类卟啉结构以及较好的电子传导能力而具备声敏性。因此,本研究通过引入超声辐照实现SDT效应,最终通过SDT协同CDT高效杀伤肿瘤细胞。
本研究通过详细的结构及成分表征证实了Fe-N2O2以及Fe-N2O2@C的Salphen结构并且Fe以单原子形态存在。另一方面,Fe-N2O2@C相较于Fe-N2O2具备更强的仿POD酶活性,证实导电性的改善可以实现更优异的仿酶产ROS,而声敏性检测结果也支持Fe-N2O2@C应用于SDT协同CDT治疗肿瘤。体外实验证明细胞可以顺利吞噬Fe-N2O2@C材料,且Fe-N2O2@C相较于Fe-N2O2表现出更强的针对4T1细胞的杀伤效率。在机制探索的过程中,本研究观察到了内吞Fe-N2O2@C的细胞表现出了明显的线粒体固缩,内质网肿胀等典型ROS损伤表现。并且JC-1染色也证明了Fe-N2O2@C+US治疗可以导致明显的线粒体膜电位下降。而流式细胞分析最终也证明,Fe-N2O2@C+US可大量上调细胞凋亡比例,证实了Fe-N2O2@C可通过SDT协同CDT杀伤肿瘤细胞的能力。最终,动物实验证明4T1皮下瘤瘤体生长速度被Fe-N2O2@C+US显著抑制。同时该方案也被证实无明显体内生物毒性。本文创新性地提出利用SCOF实现SDT协同CDT治疗肿瘤,在具备一定应用潜力的同时,也为未来多途径协同抗肿瘤纳米平台的设计及应用打下了基础。
* * *
作者贡献声明 容逍负责论文构思、数据审编、正式分析、经费获取、调查研究、研究方法、研究项目管理、软件、验证和可视化,李哲轩负责调查研究、研究方法、研究项目管理、验证、可视化和初稿写作,左妍负责调查研究、研究方法、研究项目管理、验证和审读与编辑写作,邱逦负责经费获取、提供资源、监督指导和审读与编辑写作。所有作者已经同意将文章提交给本刊,且对将要发表的版本进行最终定稿,并同意对工作的所有方面负责。
Author Contribution RONG Xiao is responsible for conceptualization, data curation, formal analysis, funding acquisition, investigation, methodology, project administration, software, validation, and visualization. LI Zhexuan is responsible for investigation, methodology, project administration, validation, visualization, and writing--original draft. ZUO Yan is responsible for investigation, methodology, project administration, validation, and writing--review and editing. QIU Li is responsible for funding acquisition, resources, supervision, and writing--review and editing. All authors consented to the submission of the article to the Journal. All authors approved the final version to be published and agreed to take responsibility for all aspects of the work.
利益冲突 所有作者均声明不存在利益冲突
Declaration of Conflicting Interests All authors declare no competing interests.
Funding Statement
国家自然科学基金项目(No. 82202187)及四川省科技厅项目(No. 2022YFH0111)资助
Contributor Information
逍 容 (Xiao RONG), Email: rongxiaous@163.com.
逦 邱 (Li QIU), Email: qiulihx@scu.edu.cn.
References
- 1.SONG X, LIU C, WANG N, et al Delivery of CRISPR/Cas systems for cancer gene therapy and immunotherapy. Adv Drug Deliv Rev. 2021;168:158–180. doi: 10.1016/j.addr.2020.04.010. [DOI] [PubMed] [Google Scholar]
- 2.KOLARIKOVA M, HOSIKOVA B, DILENKO H, et al Photodynamic therapy: innovative approaches for antibacterial and anticancer treatments. Med Res Rev. 2023;43(4):717–774. doi: 10.1002/med.21935. [DOI] [PubMed] [Google Scholar]
- 3.SONG X, ZHANG Q, CHANG M, et al Nanomedicine-enabled sonomechanical, sonopiezoelectric, sonodynamic, and sonothermal therapy. Adv Mater. 2023;35(31):e2212259. doi: 10.1002/adma.202212259. [DOI] [PubMed] [Google Scholar]
- 4.PERI A, SALOMON N, WOLF Y, et al The landscape of T cell antigens for cancer immunotherapy. Nat Cancer. 2023;4(7):937–954. doi: 10.1038/s43018-023-00588-x. [DOI] [PubMed] [Google Scholar]
- 5.FAN W, YUNG B, HUANG P, et al Nanotechnology for multimodal synergistic cancer therapy. Chem Rev. 2017;117(22):13566–13638. doi: 10.1021/acs.chemrev.7b00258. [DOI] [PubMed] [Google Scholar]
- 6.UTHAMAN S, HUH K M, PARK I K Tumor microenvironment-responsive nanoparticles for cancer theragnostic applications. Biomater Res. 2018;22:22. doi: 10.1186/s40824-018-0132-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.DU F, LIU L, WU Z, et al Pd-single-atom coordinated biocatalysts for chem-/sono-/photo-trimodal tumor therapies. Adv Mater. 2021;33(29):e2101095. doi: 10.1002/adma.202101095. [DOI] [PubMed] [Google Scholar]
- 8.XIANG X, PANG H, MA T, et al Ultrasound targeted microbubble destruction combined with Fe-MOF based bio-/enzyme-mimics nanoparticles for treating of cancer. J Nanobiotechnology. 2021;19(1):92. doi: 10.1186/s12951-021-00835-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.FENG Z, XIANG X, HUANG J, et al Intelligent Sonocatalytic nanoagents for energy conversion-based therapies. Advanced Functional Materials. 2023;33(45):2302579. doi: 10.1002/adfm.202302579. [DOI] [Google Scholar]
- 10.ZHANG H, LIU X, LIU Y, et al Effect of hematoporphyrin monomethyl ether-sonodynamic therapy (HMME-SDT) on hypertrophic scarring. PLoS One. 2014;9(1):e86003. doi: 10.1371/journal.pone.0086003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.ZIENTAL D, CZARCZYNSKA-GOSLINSKA B, MLYNARCZYK D T, et al. Titanium dioxide nanoparticles: prospects and applications in medicine. Nanomaterials (Basel), 2020, 10(2):387.
- 12.ALIZADEH N, SALIMI A Multienzymes activity of metals and metal oxide nanomaterials: applications from biotechnology to medicine and environmental engineering. J Nanobiotechnol. 2021;19(1):26. doi: 10.1186/s12951-021-00771-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.VELÁSQUEZ-HERNÁNDEZ M D J, RICCO R, CARRARO F, et al Degradation of ZIF-8 in phosphate buffered saline media. CrystEngComm. 2019;21(31):4538–4544. doi: 10.1039/C9CE00757A. [DOI] [Google Scholar]
- 14.KHAN N, SLATHIA G, KALIYA K, et al Recent progress in covalent organic frameworks for cancer therapy. Drug Discov Today. 2023;28(6):103602. doi: 10.1016/j.drudis.2023.103602. [DOI] [PubMed] [Google Scholar]
- 15.GAUR A, SHRIVASTAVA B, SRIVASTAVA K, et al XAFS investigations of copper (Ⅱ) complexes with tetradentate schiff base ligands. X‐Ray Spectrometry. 2012;41(6):384–392. doi: 10.1002/xrs.2418. [DOI] [Google Scholar]
- 16.YAN S, GUAN X, LI H, et al Three-dimensional Salphen-based covalent-organic frameworks as catalytic antioxidants. J Am Chem Soc. 2019;141(7):2920–2924. doi: 10.1021/jacs.9b00485. [DOI] [PubMed] [Google Scholar]
- 17.ZUO Q, CHENG G, LUO W A reduced graphene oxide/covalent cobalt porphyrin framework for efficient oxygen reduction reaction. Dalton Trans. 2017;46(29):9344–9348. doi: 10.1039/C7DT01694H. [DOI] [PubMed] [Google Scholar]
- 18.GUO J, LIN C Y, XIA Z, et al A pyrolysis-free covalent organic polymer for oxygen reduction. Angew Chem Int Ed Engl. 2018;57(38):12567–12572. doi: 10.1002/anie.201808226. [DOI] [PubMed] [Google Scholar]
- 19.ZHAO C X, LI B Q, LIU J N, et al Transition metal coordinated framework porphyrin for electrocatalytic oxygen reduction. Chin Chem Lett. 2019;30(4):911–914. doi: 10.1016/j.cclet.2019.03.026. [DOI] [Google Scholar]
- 20.HIJAZI I, BOURGETEAU T, CORNUT R, et al Carbon nanotube-templated synthesis of covalent porphyrin network for oxygen reduction reaction. J Am Chem Soc. 2014;136(17):6348–6354. doi: 10.1021/ja500984k. [DOI] [PubMed] [Google Scholar]
- 21.JIA H, SUN Z, JIANG D, et al An iron porphyrin-based conjugated network wrapped around carbon nanotubes as a noble-metal-free electrocatalyst for efficient oxygen reduction reaction. Inorg Chem Front. 2016;3(6):821–827. doi: 10.1039/C5QI00198F. [DOI] [Google Scholar]
- 22.CAO S, ZHAO Z, ZHENG Y, et al A library of ROS-catalytic metalloenzyme mimics with atomic metal centers. Adv Mater. 2022;34(16):2200255. doi: 10.1002/adma.202200255. [DOI] [PubMed] [Google Scholar]
- 23.GUO J, XING Z, LIU L, et al Antioxidase-like nanobiocatalysts with ultrafast and reversible redox-centers to secure stem cells and periodontal tissues. Adv Funct Mater. 2023;33(15):2211778. doi: 10.1002/adfm.202211778. [DOI] [Google Scholar]
- 24.KAMOGASHIRA T, HAYASHI K, FUJIMOTO C, et al Functionally and morphologically damaged mitochondria observed in auditory cells under senescence-inducing stress. NPJ Aging Mech Dis. 2017;3:2. doi: 10.1038/s41514-017-0002-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.NAKAMURA H, TAKADA K Reactive oxygen species in cancer: current findings and future directions. Cancer Sci. 2021;112(10):3945–3952. doi: 10.1111/cas.15068. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.方立坤, 陈露, 李嘉宇, 等 光动力疗法及其临床的主要应用. 沈阳药科大学学报. 2023;40(9):1265–1276. doi: 10.14066/j.cnki.cn21-1349/r.2021.0751. [DOI] [Google Scholar]; FANG L K, CHEN L, LI J Y, et al Photodynamic therapy and its main therapeutic fields. J Shenyang Pharmace Univ. 2023;40(9):1265–1276. doi: 10.14066/j.cnki.cn21-1349/r.2021.0751. [DOI] [Google Scholar]
- 27.蒋恩琰, 王丹, 张照霞, 等 声动力疗法的机制研究进展. 临床超声医学杂志. 2023;25(8):677–680. doi: 10.3969/j.issn.1008-6978.2023.08.024. [DOI] [Google Scholar]; JIANG E Y, WANG D, ZHANG Z X, et al Research progress on mechanical mechanism of sonodynamic therapy. J Clin Ultra Med. 2023;25(8):677–680. doi: 10.3969/j.issn.1008-6978.2023.08.024. [DOI] [Google Scholar]
- 28.PAN X, BAI L, WANG H, et al Metal-organic-framework-derived carbon nanostructure augmented sonodynamic cancer therapy. Adv Mater. 2018;30(23):e1800180. doi: 10.1002/adma.201800180. [DOI] [PubMed] [Google Scholar]



