Abstract
目的
探讨川崎病(Kawasaki disease, KD)急性期患儿的血清氧化磷脂(oxidized phospholipids, OxPLs)和内皮一氧化氮合酶(endothelial nitric oxide synthase, eNOS)水平的变化,分析血清OxPLs和eNOS水平与冠状动脉病变(coronary artery lesion, CAL)的相关性,并探讨其临床意义。
方法
前瞻性选择95例急性期KD患儿作为KD组,根据是否合并CAL分为CAL亚组和非冠状动脉病变(non-coronary artery lesion, NCAL)亚组;另外选取同期30例仅下呼吸道感染发热患儿作为发热组,30例健康体检儿童作为健康对照组。比较各组一般资料及血清OxPLs、eNOS等实验室指标的差异,分析血清OxPLs和eNOS的相关性。
结果
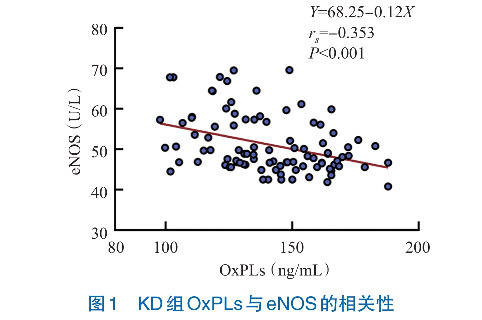
KD组OxPLs水平高于发热组及健康对照组(P<0.05),eNOS水平低于发热组及健康对照组(P<0.05)。KD患儿治疗后较治疗前血清OxPLs下降,血清eNOS上升(P<0.05)。CAL亚组血清OxPLs高于NCAL亚组(P<0.05),血清eNOS水平低于NCAL亚组(P<0.05)。KD组患儿OxPLs与eNOS水平呈负相关(rs =-0.353, P<0.05)。
结论
KD急性期血清OxPLs、eNOS参与了CAL发展,可成为预测KD患儿发生CAL的生物标志物。
Keywords: 川崎病, 冠状动脉病变, 血清型氧化磷脂, 内皮一氧化氮合酶, 儿童
Abstract
Objective
To investigate the changes in the serum levels of oxidized phospholipids (OxPLs) and endothelial nitric oxide synthase (eNOS) and their association with coronary artery disease (CAL) in children in the acute stage of Kawasaki disease (KD), as well as the clinical significance of OxPLs and eNOS.
Methods
A prospective study was conducted on 95 children in the acute stage of KD (KD group). According to the presence of absence of CAL, the KD group was further divided into a CAL subgroup and a non-CAL (NCAL) subgroup. Thirty children with fever due to lower respiratory tract infection were enrolled as the fever group. Thirty healthy children who underwent physical examination were enrolled as the healthy control group. The above groups were compared in terms of general information and serum levels of OxPLs, eNOS and other laboratory indexes, and the correlation between OxPLs level and eNOS level was analyzed.
Results
The KD group had a significantly higher level of OxPLs and a significantly lower level of eNOS compared with the fever group and the healthy control group (P<0.05). After treatment, the children with KD had a significantly decreased OxPLs level and a significantly increased eNOS level (P<0.05). Compared with the NCAL subgroup, the CAL subgroup had a significantly higher level of OxPLs and a significantly lower level of eNOS (P<0.05). Among the children of KD, the level of OxPLs was negatively correlated with that of eNOS (rs =-0.353, P<0.05).
Conclusions
Serum OxPLs and eNOS in the acute stage of KD may be involved in the development of CAL in children with KD, and therefore, they may be used as the biomarkers to predict CAL in these children.
Keywords: Kawasaki disease, Coronary artery lesion, Serum oxidized phospholipid, Endothelial nitric oxide synthase, Child
川崎病(Kawasaki disease, KD)最严重的危害是冠状动脉扩张和冠状动脉瘤的形成。近几年研究发现,脂质代谢紊乱是引起成人及儿童心血管疾病的重要病理生理过程[1]。在KD急性期患儿的血清学检查中发现,大部分患儿体内存在明显血脂代谢异常,合并冠状动脉病变(coronary artery lesion, CAL)者脂质代谢紊乱表现更突出。本团队前期研究发现,KD急性期存在显著的甘油三酯(triglyceride, TG)和低密度脂蛋白(low-density lipoprotein, LDL)等异常,并与CAL及严重程度有一定的相关性[2]。有研究表明,氧化磷脂 (oxidized phospholipids, OxPLs)作为一种氧化应激生物标志物[3],在许多心血管疾病的发生发展中起着重要作用。Tsimikas等[4]研究表明OxPLs水平与冠状动脉疾病风险增加有关,且可作为心血管危险因素提供累积的预测价值。Yu等[5]通过对KD死亡患儿的冠状动脉瘤血管进行病理免疫组织化学分析显示,内皮细胞中存在内皮一氧化氮合酶 (endothelial nitric oxide synthase, eNOS)免疫反应性,并与冠状动脉壁损伤的严重程度和KD急性期CAL的进展相关,同时发现血管内皮细胞eNOS表达明显低于健康对照组,提示在KD中内皮细胞eNOS表达受到抑制。
那么,KD急性期LDL等成分升高,尤其在KD急性期的氧化应激异常活跃的前提下,是否会导致氧化脂质分子OxPLs增加,目前关于这方面的研究不多。与OxPLs一样处于KD急性期的eNOS,是否与OxPLs有关联,是否协同加剧CAL的发生,尚未见文献报道。故本研究通过前瞻性分析KD急性期患儿OxPLs、eNOS的表达水平,初步探讨OxPLs、eNOS是否存在相关性。
1. 资料与方法
1.1. 研究对象
前瞻性选择湖南师范大学附属第一医院儿科2022年9月—2023年9月住院的95例急性期KD患儿作为KD组,根据是否合并CAL分为CAL亚组和非冠状动脉病变(non-coronary artery lesion, NCAL)亚组。同时选取同期仅下呼吸道感染发热患儿30例作为发热组,30例健康体检儿童作为健康对照组。
KD组纳入标准:(1)根据2022年中国KD诊治专家共识[6]诊断为KD;(2)基本信息、病史资料、实验室数据与相关辅助资料完整;(3)处于KD急性期(起病<2周)。排除标准:(1)合并先天性心脏大血管发育异常、先天性或其他继发性血脂异常疾病、遗传代谢病等可能影响研究结果的基础疾病;(2)患儿急性期存在肝脏转氨酶显著增高(谷丙转氨酶或谷草转氨酶>正常值2倍)。
发热组纳入标准:(1)仅存在下呼吸道感染;(2)处于发热急性期;(3)外院未予以抗感染治疗。排除标准:(1)伴有其他心血管疾病、遗传代谢病、血液病、肿瘤等;(2)已接受抗生素或丙种球蛋白治疗;(3)病历资料不完整;(4)病因不明。
健康对照组纳入标准:(1)体格检查、实验室检查、影像学检查结果均无异常的健康儿童;(2)近4周无感染病史;(3)既往无心脏病、风湿性疾病、KD、血液系统疾病;(4)近4周未使用过丙种球蛋白、糖皮质激素、抗血小板药物。
本研究通过我院伦理委员会批准(审批号:2024-135)。
1.2. OxPLs、eNOS检测
所有KD组患儿在入院时,以及治疗后10 d各采血1次;发热组患儿于入院时采血1次;健康对照组儿童于体检时采血1次。收集外周静脉血标本2 mL,注入血清分离管,1 500 r/min离心20 min,吸取上清液0.5 mL于EP管,置于-80℃保存,集中检测。采用上海恒远生物科技有限公司酶联试剂盒检测血清OxPLs、eNOS水平(半定量)。
1.3. 临床资料收集
(1)收集3组研究对象的就诊时间、性别、年龄;(2)收集3组研究对象的实验室检查结果,包括白细胞(white blood cell, WBC)计数、中性粒细胞计数(absolute neutrophil count, ANC)、血小板(platelet, PLT)计数、C反应蛋白(C-reactive protein, CRP)、红细胞沉降率(erythrocyte sedimentation rate, ESR)、血清总胆固醇(total cholesterol, TC)、TG、LDL、高密度脂蛋白(high-density lipoprotein, HDL);(3)收集所有KD患儿急性期心脏彩超结果。
1.4. 心脏彩超检查
应用经胸心脏超声评估KD患儿治疗前和治疗后心脏情况,包括测定左、右冠状动脉主干内径等,以任一支扩张满足下列其中一条标准[7]即判定为CAL:(1)年龄<5岁,主干直径>3 mm;年龄≥5岁,主干直径>4 mm。(2)局部内径较邻近处明显扩大1.5倍以上。(3)内径Z值≥2.0。
1.5. 统计学分析
应用SPSS 26.0软件进行数据分析。正态分布计量资料采用均数±标准( )描述,两组间比较采用两样本t检验,多组间采用单因素方差分析,组间两两比较采用LSD法;非正态分布计量资料采用中位数(四分位数间距)[M(P 25,P 75)]描述,两组间比较采用曼-惠特尼U检验或Wilcoxon秩和检验,多组间比较采用Kruskal-Wallis H检验,组间两两比较采用事后检验。计数资料采用例数和构成比或率(%)描述,组间比较采用卡方检验。相关性分析采用Spearman秩相关法。以P<0.05为差异有统计学意义。
2. 结果
2.1. 3组一般资料比较
KD组、发热组、健康对照组性别、年龄比较差异无统计学意义(P>0.05)。KD组与发热组发热时间比较差异无统计学意义(P>0.05)。见表1。
表1.
3组一般资料比较
| 组别 | 例数 | 性别 (男/女, 例) | 年龄 [M(P 25, P 75), 月] | 发热时间 [M(P 25, P 75), d] |
|---|---|---|---|---|
| 健康对照组 | 30 | 17/13 | 36(19, 75) | - |
| 发热组 | 30 | 17/13 | 30(20, 60) | 5.1±1.0 |
| KD组 | 95 | 58/37 | 28(15, 48) | 5.5±1.6 |
| 2/H/t值 | 0.293 | 5.596 | 1.221 | |
| P值 | 0.864 | 0.061 | 0.226 |
注:[KD]川崎病。
2.2. 3组实验室指标比较
KD组的OxPLs、WBC计数、ANC、PLT计数、CRP、ESR、TG、LDL水平高于发热组和健康对照组,HDL、eNOS水平低于发热组和健康对照组(P<0.05)。发热组与健康对照组OxPLs、eNOS水平比较差异无统计学意义(P>0.05)。见表2。
表2.
3组实验室指标比较
| 项目 | 健康对照组 (n=30) | 发热组 (n=30) | KD组 (n=95) | H/F值 | P值 |
|---|---|---|---|---|---|
| OxPLs [M(P 25, P 75), ng/mL] | 74.05(65.75, 82.05) | 87.80(78.95, 90.47) | 140.50(125.30, 159.80)a,b | 108.330 | <0.001 |
| eNOS [M(P 25, P 75), U/L] | 77.95(71.32, 82.97) | 80.41(75.42, 84.75) | 48.90(46.20, 56.50)a,b | 107.721 | <0.001 |
| WBC计数 ( , ×109/L) | 7.5±0.4 | 11.0±0.8 | 13.3±0.4a,b | 24.970 | <0.001 |
| ANC ( , ×109/L) | 2.97±0.23 | 6.13±0.76 | 9.45±0.41a,b | 38.708 | <0.001 |
| PLT计数 [M(P 25, P 75), ×109/L] | 315(260, 353) | 333(285, 390) | 347(289, 409)a,b | 7.235 | 0.027 |
| CRP [M(P 25, P 75), mg/L] | 0.5(0.3, 2.1) | 17.2(3.4, 33.7) | 67.0(51.0, 82.8)a,b | 99.013 | <0.001 |
| ESR [M(P 25, P 75), mm/h] | 8.5(4.0, 13.0) | 16.5(13.0, 26.0) | 64.0(45.0, 81.0)a,b | 101.797 | <0.001 |
| TG [M(P 25, P 75), mmol/L] | 0.92(0.88, 0.97) | 0.91(0.89, 0.94) | 1.36(1.24, 1.45)a,b | 101.335 | <0.001 |
| TC [M(P 25, P 75), mmol/L] | 3.54(3.29, 3.64) | 3.54(3.53, 3.64) | 3.54(3.26, 3.69) | 0.577 | 0.749 |
| HDL [M(P 25, P 75), mmol/L] | 1.07(1.01, 1.10) | 1.23(1.19, 1.28) | 0.77(0.73, 0.82)a,b | 103.188 | <0.001 |
| LDL [M(P 25, P 75), mmol/L] | 2.05(2.03, 2.09) | 2.07(2.03, 2.09) | 2.44(2.34, 2.65)a,b | 88.127 | <0.001 |
注:a示与健康对照组比较,P<0.05;b示与发热组比较,P<0.05。[OxPLs]氧化磷脂;[eNOS]内皮一氧化氮合酶;[WBC]白细胞;[ANC]中性粒细胞计数;[PLT]血小板;[CRP]C反应蛋白;[ESR]红细胞沉降率;[TG]甘油三酯;[TC]总胆固醇;[HDL]高密度脂蛋白;[LDL]低密度脂蛋白。
2.3. KD急性期CAL亚组与NCAL亚组实验室指标比较
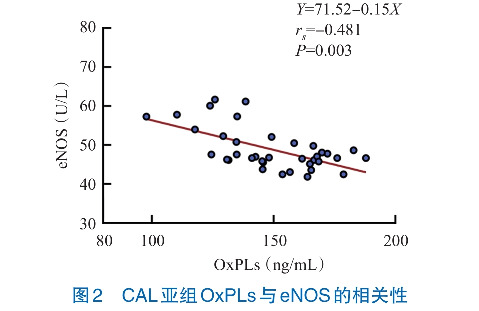
与NCAL亚组相比,CAL亚组OxPLs、CRP和LDL水平升高,而eNOS水平降低(P<0.05),余实验室指标WBC计数、ANC、PLT计数、ESR、TG、TC、HDL比较差异无统计学意义(P>0.05)。见表3。
表3.
KD急性期CAL亚组与NCAL亚组的实验室指标比较
| 项目 | NCAL亚组 (n=58) | CAL亚组 (n=37) | Z/t值 | P值 |
|---|---|---|---|---|
| OxPLs [M(P 25, P 75), ng/mL] | 124.2(105.2, 138.2) | 127.3(117.3, 145.7) | -2.874 | 0.004 |
| eNOS [M(P 25, P 75), U/L] | 50.0(46.8, 57.6) | 47.0(45.9, 51.4) | -2.225 | 0.026 |
| WBC计数 ( , ×109/L) | 13±4 | 14±4 | -1.243 | 0.217 |
| ANC ( , ×109/L) | 10±4 | 9±4 | 0.484 | 0.629 |
| PLT计数 ( , ×109/L) | 333±97 | 334±136 | -0.024 | 0.981 |
| CRP [M(P 25, P 75), mg/L] | 62±25 | 78±30 | -2.462 | 0.014 |
| ESR [M(P 25, P 75), mm/h] | 48.8(30.4, 62.0) | 38.0(27.2, 66.0) | -0.851 | 0.395 |
| TG [M(P 25, P 75), mmol/L] | 1.23(1.16, 1.34) | 1.34(1.21, 1.38) | -0.065 | 0.948 |
| TC [M(P 25, P 75), mmol/L] | 3.19(3.02, 3.55) | 3.32(3.10, 3.54) | -0.057 | 0.954 |
| HDL [M(P 25, P 75), mmol/L] | 0.73(0.69, 0.77) | 0.72(0.64, 0.76) | -0.676 | 0.499 |
| LDL [M(P 25, P 75), mmol/L] | 2.32(2.23, 2.43) | 2.36(2.30, 2.52) | -6.021 | <0.001 |
注:[OxPLs]氧化磷脂;[eNOS]内皮一氧化氮合酶;[WBC]白细胞;[ANC]中性粒细胞计数;[PLT]血小板;[CRP]C反应蛋白;[ESR]红细胞沉降率;[TG]甘油三酯;[TC]总胆固醇;[HDL]高密度脂蛋白;[LDL]低密度脂蛋白。
2.4. KD组治疗前后OxPLs和eNOS水平比较
予以静脉注射免疫球蛋白等治疗后,KD组患儿血清OxPLs水平较治疗前下降[94.2(85.3, 108.9)ng/mL vs 140.5(125.3, 159.8)ng/mL, Z=-8.463, P<0.001],血清eNOS水平升高[76.0(69.8, 80.9)U/L vs 48.9(46.2, 56.5)U/L, Z=-8.350, P<0.001]。
2.5. KD组CAL亚组、NCAL亚组OxPLs与eNOS相关性分析
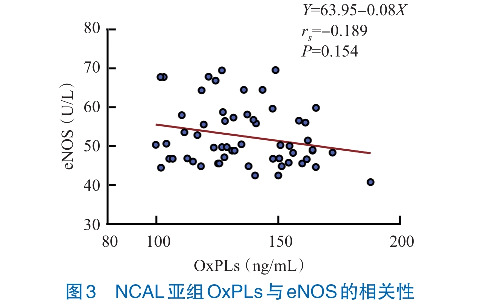
Spearman秩相关性分析结果显示,KD组患儿OxPLs与eNOS水平呈负相关性(rs =-0.353, P<0.001),CAL亚组OxPLs与eNOS水平呈负相关性(rs =-0.481, P=0.003),NCAL亚组OxPLs与eNOS水平无相关性(rs =-0.189, P=0.154)。见图1~3。
3. 讨论
KD的一个显著特征是免疫系统的异常激活,KD急性期免疫反应强烈,如WBC计数升高,包括中性粒细胞增多和嗜酸性粒细胞计数升高,同时还会出现强烈的炎症反应,如CRP、降钙素原、ESR、谷丙转氨酶和谷氨酰转移酶的升高[8]。本研究同样发现在KD急性期WBC计数、ANC、PLT计数、CRP、ESR明显升高,而KD急性期CAL亚组CRP明显高于NCAL亚组,这一结论与国内外研究结果[9-10]一致。
OxPLs和eNOS在心血管疾病中发挥着重要作用,OxPLs已确定为成人冠心病的高危因素,OxPLs可激发内皮功能障碍和血管炎症等生物分子过程进而导致动脉粥样硬化[11],而eNOS是一种血管内皮保护因子,对于心血管系统的正常功能有保护作用。本研究结果显示,KD急性期OxPLs升高,eNOS下降,这可能为KD急性期CAL的临床预防提供一个新的观察点。
KD急性期LDL增加,在氧化应激的条件下,促进氧化低密度脂蛋白的生成,而OxPLs作为氧化低密度脂蛋白的主要活性成分,也随之升高。KD急性期OxPLs大量产生,并激活先天免疫细胞和血管细胞,产生一系列促炎分子,如细胞因子、趋化因子、蛋白酶和活性氧(reactive oxygen species, ROS),而过多的ROS和炎症刺激导致内皮功能障碍的进展[12]。目前已有研究发现KD急性期血液中OxPLs明显升高,并与KD的血管炎有关[13]。而本研究结果也表明,在KD急性期,OxPLs显著升高,且在KD的CAL亚组中,OxPLs升高更显著。
KD急性期氧化应激的加速,是否导致eNOS的下降?研究表明,在氧化应激条件下,eNOS可能会功能失调,导致超氧化物和过氧亚硝酸盐产生,超氧化物水平升高导致eNOS去磷酸化,从而降低eNOS酶的活性,过氧亚硝酸盐升高导致eNOS的专属底物L-精氨酸的内皮转运减少,从而引起eNOS减少[14-15]。Yu等[5]通过对KD患儿冠状动脉瘤病理检查发现,血管eNOS表达低于健康对照组。eNOS解偶联或失活,会引起NO表达或活性的丧失,从而导致血管内皮障碍。本研究结果显示,KD患儿血清eNOS水平低于发热组和健康对照组儿童,且CAL亚组降低更显著。
KD急性期OxPLs升高与eNOS下降是否有关联?是否协同加剧CAL的发生?在成人的动脉粥样硬化研究[16]中发现,OxPLs可通过介导内皮细胞损伤、诱导解偶联和抑制eNOS降低和NO的产生,损害内皮血管的舒缩功能,导致血管功能障碍。本研究结果显示KD组,尤其是CAL亚组,血清OxPLs水平升高显著,eNOS下降明显;相关性分析显示,两者呈负相关性,其病理生理机制可能为:OxPLs通过抑制Akt-eNOS信号通路和激活PKC-βII/P70S6K-eNOS信号通路,抑制eNOS活化和NO产生,致使血管扩张障碍及超氧阴离子产生增加,诱导内皮紊乱和内皮细胞凋亡[17-18]。但是这种负相关,与KD CAL的发生发展的关系还需进一步探索。
本研究中KD组患儿在急性期予以静脉注射免疫球蛋白等治疗后,血清OxPLs水平下降,血清eNOS水平升高,在一定程度上反映丙种球蛋白可改善氧化应激和炎症反应,但研究发现丙种球蛋白并不能缓解KD后期的慢性炎症和持续的内皮功能障碍[19],因此需要进一步深入的研究。研究发现他汀类药物具有抗氧化、抗免疫、改善内皮功能障碍、改善血管重塑等多效性作用[20]。他汀类药物治疗可减少血管系统中的OxPLs,同时恢复降低的eNOS表达[21-22]。这为KD早期和后期的治疗提供了新的思路。
综上所述,KD急性期OxPLs升高,eNOS降低。OxPLs和eNOS的异常变化,可能加剧血管内皮细胞功能障碍,促进KD CAL的发生与发展。如果在KD急性期通过药物治疗来抑制OxPLs的产生,改善血管氧化应激和eNOS水平,可能对减轻KD的CAL有一定作用。然而,这两个生物标志物的临床价值,还需要进行多中心、大样本、长时间的深入研究。
基金资助
长沙市科技计划项目(No.kq1801091)。
利益冲突声明
所有作者均声明无利益冲突。
作者贡献
朱柳蓉负责数据分析、论文撰写;袁勇华、夏晓辉、袁浩负责数据收集、整理和分析;何学华负责文章的构思、设计与修改。
参 考 文 献
- 1. Förstermann U, Xia N, Li H. Roles of vascular oxidative stress and nitric oxide in the pathogenesis of atherosclerosis[J]. Circ Res, 2017, 120(4): 713-735. DOI: 10.1161/CIRCRESAHA.116.309326. [DOI] [PubMed] [Google Scholar]
- 2. 何方园, 何学华, 袁勇华, 等. 川崎病急性期血脂与年龄、冠状动脉病变及严重程度的关系[J]. 临床儿科杂志, 2023, 41(6): 455-458. DOI: 10.12372/jcp.2023.22e1030. [DOI] [Google Scholar]
- 3. Dunn S, Vohra RS, Murphy JE, et al. The lectin-like oxidized low-density-lipoprotein receptor: a pro-inflammatory factor in vascular disease[J]. Biochem J, 2008, 409(2): 349-355. DOI: 10.1042/BJ20071196. [DOI] [PubMed] [Google Scholar]
- 4. Tsimikas S, Mallat Z, Talmud PJ, et al. Oxidation-specific biomarkers, lipoprotein(a), and risk of fatal and nonfatal coronary events[J]. J Am Coll Cardiol, 2010, 56(12): 946-955. DOI: 10.1016/j.jacc.2010.04.048. [DOI] [PubMed] [Google Scholar]
- 5. Yu X, Hirono K I, Ichida F, et al. Enhanced iNOS expression in leukocytes and circulating endothelial cells is associated with the progression of coronary artery lesions in acute Kawasaki disease[J]. Pediatr Res, 2004, 55(4): 688-694. DOI: 10.1203/01.PDR.0000113464.93042.A4. [DOI] [PubMed] [Google Scholar]
- 6. 中华医学会儿科学分会心血管学组, 中华医学会儿科学分会风湿学组, 中华医学会儿科学分会免疫学组, 等. 川崎病诊断和急性期治疗专家共识[J]. 中华儿科杂志, 2022, 60(1): 6-13. DOI: 10.3760/cma.j.cn112140-20211018-00879. [DOI] [PubMed] [Google Scholar]
- 7. 中华医学会儿科学分会心血管学组, 中华儿科杂志编辑委员会 . 川崎病冠状动脉病变的临床处理建议(2020年修订版)[J]. 中华儿科杂志, 2020, 58(9): 718-724. DOI: 10.3760/cma.j.cn112140-20200422-00421. [DOI] [PubMed] [Google Scholar]
- 8. 周翠臻, 宋思瑞, 陈丽琴, 等. 川崎病合并冠状动脉瘤危险因素分析[J]. 临床儿科杂志, 2023, 41(7): 498-501. DOI: 10.12372/jcp.2023.23e0285. [DOI] [Google Scholar]
- 9. 刘翠, 刘小红, 吴岳, 等. 川崎病儿童冠脉病变的影响因素分析[J]. 西安交通大学学报(医学版), 2022, 43(6): 845-849. DOI: 10.7652/jdyxb202206008. 35878643 [DOI] [Google Scholar]
- 10. Borzutzky A, Gutiérrez M, Talesnik E, et al. High sensitivity C-reactive protein and endothelial function in Chilean patients with history of Kawasaki disease[J]. Clin Rheumatol, 2008, 27(7): 845-850. DOI: 10.1007/s10067-007-0808-6. [DOI] [PubMed] [Google Scholar]
- 11. 赵敏, 刘伯言, 秦树存. 氧化磷脂与动脉粥样硬化[J]. 生理学报, 2021, 73(1): 69-81. DOI: 10.13294/j.aps.2020.0057. [DOI] [PubMed] [Google Scholar]
- 12. Lubrano V, Balzan S. LOX-1 and ROS, inseparable factors in the process of endothelial damage[J]. Free Radic Res, 2014, 48(8): 841-848. DOI: 10.3109/10715762.2014.929122. [DOI] [PubMed] [Google Scholar]
- 13. Nakashima Y, Sakai Y, Mizuno Y, et al. Lipidomics links oxidized phosphatidylcholines and coronary arteritis in Kawasaki disease[J]. Cardiovasc Res, 2021, 117(1): 96-108. DOI: 10.1093/cvr/cvz305. [DOI] [PubMed] [Google Scholar]
- 14. Wu F, Wilson JX. Peroxynitrite-dependent activation of protein phosphatase type 2A mediates microvascular endothelial barrier dysfunction[J]. Cardiovasc Res, 2009, 81(1): 38-45. DOI: 10.1093/cvr/cvn246. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Łuczak A, Madej M, Kasprzyk A, et al. Role of the eNOS uncoupling and the nitric oxide metabolic pathway in the pathogenesis of autoimmune rheumatic diseases[J]. Oxid Med Cell Longev, 2020, 2020: 1417981. DOI: 10.1155/2020/1417981. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Law SH, Chan ML, Marathe GK, et al. An updated review of lysophosphatidylcholine metabolism in human diseases[J]. Int J Mol Sci, 2019, 20(5): 1149. DOI: 10.3390/ijms20051149. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. Gharavi NM, Baker NA, Mouillesseaux KP, et al. Role of endothelial nitric oxide synthase in the regulation of SREBP activation by oxidized phospholipids[J]. Circ Res, 2006, 98(6): 768-776. DOI: 10.1161/01.RES.0000215343.89308.93. [DOI] [PubMed] [Google Scholar]
- 18. Gradinaru D, Borsa C, Ionescu C, et al. Oxidized LDL and NO synthesis: biomarkers of endothelial dysfunction and ageing[J]. Mech Ageing Dev, 2015, 151: 101-113. DOI: 10.1016/j.mad.2015.03.003. [DOI] [PubMed] [Google Scholar]
- 19. Agarwal S, Agrawal DK. Kawasaki disease: etiopathogenesis and novel treatment strategies[J]. Expert Rev Clin Immunol, 2017, 13(3): 247-258. DOI: 10.1080/1744666X.2017.1232165. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Yu D, Liao JK. Emerging views of statin pleiotropy and cholesterol lowering[J]. Cardiovasc Res, 2022, 118(2): 413-423. DOI: 10.1093/cvr/cvab032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Chen WH, Chen CH, Hsu MC, et al. Advances in the molecular mechanisms of statins in regulating endothelial nitric oxide bioavailability: interlocking biology between eNOS activity and L-arginine metabolism[J]. Biomed Pharmacother, 2024, 171: 116192. DOI: 10.1016/j.biopha.2024.116192. [DOI] [PubMed] [Google Scholar]
- 22. Philippova M, Resink T, Erne P, et al. Oxidised phospholipids as biomarkers in human disease[J]. Swiss Med Wkly, 2014, 144: w14037. DOI: 10.4414/smw.2014.14037. [DOI] [PubMed] [Google Scholar]


