Abstract
目的
探究邻苯二甲酸酯类增塑剂邻苯二甲酸二(2-乙基)己酯(DEHP)亚急性暴露对小鼠子宫内膜蜕膜反应和流产风险的影响。
方法
分别选取300、1000、3000 mg·kg-1·d-1三个浓度梯度的DEHP对CD1小鼠进行经口亚急性暴露28 d。建立DEHP亚急性暴露小鼠早期自然妊娠模型和人工诱导假孕小鼠蜕膜反应模型,分别取自然妊娠第7天子宫组织和人工诱导蜕膜反应小鼠妊娠第8天诱导侧子宫组织,通过苏木精-伊红染色(HE染色)、Masson染色、TUNEL检测、蛋白质印迹法检测DEHP亚急性暴露对小鼠蜕膜反应的影响。构建300 mg·kg-1·d-1 DEHP亚急性暴露小鼠自然流产模型,观察妊娠第10天的妊娠结局,探究蜕膜反应受损对小鼠妊娠的影响。
结果
与空白对照组比较,DEHP大剂量组受孕率显著性降低(P<0.05);HE染色显示DEHP小剂量组和中剂量组蜕膜基质细胞排列杂乱、细胞核形态不规则、胞浆染色不均、多核细胞数显著降低;Masson染色显示DEHP小剂量组和中剂量组蜕膜组织的胶原纤维分布更多、数量增多、排列杂乱;TUNEL检测显示暴露组蜕膜组织细胞凋亡增加;蛋白质印迹法检测显示暴露组子宫内膜蜕膜反应标志分子BMP2蛋白表达水平显著降低(P<0.05或P<0.01);在米非司酮流产刺激下DEHP小剂量组小鼠流产率、胚胎吸收率显著升高,胚胎数、子宫湿重、子宫面积、胎盘湿重显著减少(P<0.05或P<0.01)。
结论
DEHP亚急性暴露导致小鼠子宫内膜蜕膜反应受损加重小鼠妊娠流产风险。
Keywords: 邻苯二甲酸二(2-乙基)己酯, 蜕膜反应, 米非司酮, 流产, 小鼠
Abstract
Objective
To investigate the effect of subacute exposure of Di (2-ethylhexyl) phthalate (DEHP) on endometrial decidualization and early pregnancy miscarriage in mice.
Methods
CD1 mice were orally administrated with 300 (low-dose group), 1000 (medium-dose group), or 3000 mg·kg-1·d-1 DEHP (1/10 LD50, high-dose group) for 28 days, respectively. An early natural pregnancy model and an artificially induced decidualization model were established. The uterine tissues were collected on D7 of natural pregnancy and D8 of artificially induced decidualization, respectively. The effects of a subacute exposure to DEHP on the decidualization of mice were detected by HE staining, Masson staining, TUNEL assay, and Western blotting. A model of spontaneous abortion was constructed in mice after subacute exposure to 300 mg·kg-1·d-1 DEHP, and the effect of impaired decidualization on pregnancy was investigated by observing the pregnancy outcome on the 10th day of gestation.
Results
Compared with the control group, the conception rate was significantly decreased in the high-dose DEHP subacute exposure group (P<0.05). HE staining showed that, compared with the control group, the decidual stromal cells in the low- and medium-dose exposure groups were disorganized, the nuclei of the cells were irregular, the cytoplasmic staining was uneven, and the number of polymorphonuclear cells was significantly reduced. Masson staining showed that compared with the control group, the collagen fibers in the decidua region of the DEHP low-dose group and the medium-dose group were more distributed, more abundant and more disorderly. TUNEL assay showed increased apoptosis in the decidua area compared to the control group. Western blotting showed that the expression of BMP2, a marker molecule for endometrial decidualization, was significantly reduced (P<0.05 or P<0.01). The abortion rate and embryo resorption rate were increased, and the number of embryos, uterine wet weight, uterine area and placenta wet weight were decreased in DEHP low-dose group compared to the control group stimulated by mifepristone, an abortifacient drug (P<0.05 or P<0.01).
Conclusion
Subacute exposure to DEHP leads to impaired endometrial decidualization during early pregnancy and exacerbates the risk of adverse pregnancy outcomes in mice.
Keywords: Di (2-ethylhexyl) phthalate, Decidual reaction, Mifepristone, Abortion, Mice
邻苯二甲酸酯是邻苯二甲酸的二烷基或烷基芳基酯生成的衍生物,在工业生产中被用作增塑剂[1],由于其巨大的消费需求导致全球每年产量高达300亿吨[2]。邻苯二甲酸酯种类繁多,其中DEHP使用广泛。由于DEHP与化合物主体以非共价键结合,稳定性较差,很容易从主体中分离出来释放到环境中,造成环境中普遍累积的现象。DEHP通过呼吸道、消化道、皮肤接触等各种途径进入人体,再经血液循环进入肝脏、肾脏、卵巢、睾丸等组织,一部分以原型吸收,另一部分在组织内分解形成代谢产物,可在人体内长期蓄积产生毒性效应[3]。目前,国内外出现了大量关于DEHP毒性的研究报告,这些研究报告表明DEHP急性毒性虽然很小,但其亚急性毒性不容忽视。多项研究通过亚急性动物毒性试验发现DEHP暴露能导致小鼠睾丸、肝脏、肾脏、脾脏、神经组织损伤[4-7]。
在子宫内膜发生蜕膜反应时,子宫内膜基质细胞广泛增殖和分化,转变为细胞体积大、胞体圆、胞质丰富、核大、多核的蜕膜细胞,并伴随着大量血管生成,为胚胎发育提供支持营养的场所,促进母体与胎儿的物质交换,是胚胎着床延续和完成的保障[4-5]。蜕膜反应异常可能导致反复流产、不孕、胎儿发育不良、早产等[6]。目前,国内外关于DEHP对子宫蜕膜反应的毒理研究大多采用妊娠期短期暴露的动物实验模型,如本课题组前期研究发现妊娠早期1000 mg·kg-1·d-1 DEHP短期暴露会导致小鼠子宫内膜容受性受损,但小鼠子宫组织中内膜蜕膜标志蛋白MMP2和HOXA10表达并未出现明显差异[7]。由于环境介质中DEHP超标现象普遍存在以及长期膳食摄入的慢性积累,人群暴露于DEHP存在反复性和长期性的特点,妊娠期的短期暴露对于探讨DEHP对蜕膜反应的影响存在一定的局限性。本研究通过DEHP亚急性暴露的动物实验模型探究DEHP暴露对子宫蜕膜反应的潜在毒性效应,为全面评估DEHP毒理学作用及其对人类和动物生殖系统的潜在危害提供依据。
1. 材料与方法
1.1. 实验动物及主要试剂
CD1小鼠购自北京维通利华实验动物技术有限公司,饲养于重庆医科大学实验动物中心。小鼠于(22±2)℃、12 h光照/12 h黑暗、自由摄水和饮食条件下饲养,所有动物实验均通过重庆医科大学伦理委员会审查(IACUC-CQMU-2023-0383)。DEHP为上海阿拉丁生化科技股份有限公司产品;HRP-羊抗兔IgG和HRP-羊抗小鼠IgG为武汉博士德生物工程有限公司产品;HE染色试剂盒、PBS粉末、封闭用羊血清、小鼠单克隆抗体β-actin、Masson染色试剂盒为北京中杉金桥生物技术有限公司产品;兔多克隆抗体BMP2为英国Abcam公司产品;TUNEL检测试剂盒(显色法)、RIPA裂解液均为上海碧云天生物技术有限公司产品;含DEHP小鼠饲料购自北京科澳协力饲料有限公司;米非司酮粉末为美国MedChemExpress公司产品;丙二醇为索莱宝科技有限公司产品;PBST 为PBS与吐温-20的混合液(1000∶1),其中吐温-20为上海生工生物工程股份有限公司产品;玉米油为美国Sigma公司产品。
1.2. 构建DEHP亚急性暴露小鼠妊娠模型
按照亚急性毒性试验剂量的设置方法[8],以DEHP半数致死量[9]的1/10作为大剂量(3000 mg·kg-1·d-1),递减剂量组间距按照三分之一分别设置中剂量(1000 mg·kg-1·d-1)和小剂量(300 mg·kg-1·d-1)。将3~4周龄无特定病原体级雌性 CD-1小鼠随机分为四组:DEHP小剂量组、DEHP中剂量组、DEHP大剂量组和基础饲料空白对照组。各组小鼠饱食投喂含有对应DEHP浓度的饲料(成年小鼠进食量3~7 g/d),连续投喂28 d后与正常或结扎雄鼠交配(见1.3和1.4),妊娠期间连续暴露处理直到进行生物取材。观察并记录小鼠体重增长的变化,根据小鼠体重变化每五天调整DEHP的投喂量,除空白对照组外,DEHP小、中、大各剂量组饲料中DEHP浓度分别为1.46、4.95、15.05 mg/g。
1.3. 构建DEHP亚急性暴露早期自然妊娠小鼠模型
将空白对照组、DEHP小剂量组、DEHP中剂量组、DEHP大剂量组各15只与同系正常雄鼠按3∶1进行合笼,次日清晨有阴道栓的雌鼠记为自然妊娠第1天,在自然妊娠第7天早上9时收集成功建模小鼠的双侧子宫组织,进行拍照、称重及包埋,剩余组织在-80 ℃冰箱中保存备用。
1.4. 构建DEHP亚急性暴露人工诱导蜕膜反应小鼠模型
参考文献[10-11]中的方法构建假孕小鼠体内人工诱导蜕膜反应模型:将空白对照组、DEHP小剂量组、DEHP中剂量组各10只与双侧输精管结扎的雄鼠按3∶1进行合笼,次日清晨有阴道栓的雌鼠记为假孕第1天。假孕第4天早上9时对雌鼠一侧子宫给予子宫角注射玉米油处理即诱导侧,另一侧不给予任何处理即对照侧。于假孕第8天收集成功建模小鼠双侧子宫组织拍照、称重及包埋,剩余组织在-80 ℃冰箱中保存备用。
1.5. 构建DEHP亚急性暴露自然流产小鼠模型
参考文献[12]中的方法构建小鼠体内自然流产模型:将空白对照组、DEHP小剂量组各15只与正常同系雄鼠按3∶1的比例进行合笼,次日清晨有阴道栓的雌鼠记为妊娠第1天。妊娠第8天早上9时,按照1.5 μg/kg的剂量腹腔注射米非司酮(RU486)丙二醇溶液,于妊娠第10天收集成功建模小鼠的子宫和胎盘组织,观察妊娠状况。
1.6. HE染色观察组织病理学改变
将组织切片放进二甲苯1、2中浸泡脱蜡各1 h(56 ℃)后依次置于100%、100%、95%、85%、75%乙醇中浸泡5 min,流水浸泡5 min。之后置于苏木精染液中浸染2 min 进行细胞核染色,流水冲洗去除多余蓝色染液;盐酸乙醇分色1 s,饱和碳酸锂返蓝8 s;伊红染液浸泡30 s进行细胞质染色,流水冲洗去除多余红色染液后于显微镜下观察染色情况。将玻片置于37 ℃烤箱中烘烤30 min,再放于二甲苯中透明5 min。最后使用中性树胶封片,室温晾干后保存。
1.7. Masson染色观察基质细胞转化情况
将组织切片进行常规脱蜡和水化,置于Bouin液室温作用一晚进行媒染;流水冲洗至切片上的黄色消失。用天青石蓝染色液滴染3 min后流水冲洗。Mayer苏木素染色液滴染2 min后流水冲洗。酸性乙醇分化液分化5 s后流水冲洗10 min。经丽春红酸性品红染色液滴染10 min后用蒸馏水稍冲洗。切片入磷钼酸溶液浸泡10 min后弃去表面液体不用水洗直接滴染苯胺蓝溶液5 min;流水冲洗。经弱酸工作液(蒸馏水∶弱酸溶液=2∶1)洗2 min;95%乙醇快速脱水。无水乙醇脱水三次,每次10 s。二甲苯透明三次,每次2 min,未转化的基质细胞会分泌大量胶原纤维。中性树胶封片后于显微镜下观察代表子宫内膜基质细胞的蓝色胶原纤维数并拍照。
1.8. TUNEL检测观察蜕膜细胞凋亡情况
收集子宫组织进行固定包埋,将组织脱蜡,浸入无水乙醇5 min、90%乙醇2 min、70%乙醇2 min,蒸馏水2 min。滴加20 μg/mL不含DNA酶的蛋白酶K,20~37 ℃中孵育15~30 min。PBS洗涤三次后在内源性过氧化物酶强力封闭液(P0100B)中室温孵育20 min。在样品上滴加生物素标记液,37 ℃避光孵育60 min,用PBS洗涤一次,滴加0.1~0.3 mL标记反应终止液,室温孵育10 min。在样品上滴加50 μL streptavidin-HRP工作液室温孵育30 min,用PBS洗涤三次后滴加0.2~0.5 mL DAB显色液,室温孵育45 min,发生凋亡的阳性细胞会在DAB显色液的作用下呈棕色。中性树胶封片后于显微镜下观察并拍照。
1.9. 蛋白质印迹法检测蜕膜标志蛋白BMP2表达
收集子宫内膜组织后加入蛋白裂解液提取蛋白,根据目的蛋白相对分子质量配制相应浓度的SDS聚丙烯酰胺凝胶电泳凝胶并调整电压至60 V进行预电泳30 min。在凝胶中加入蛋白样品后调整电压至80 V进行电泳。电泳结束后将凝胶转移至PVDF膜上,调整电流至250 mA进行电转,电转时间根据目的蛋白相对分子质量而定(蛋白相对分子质量∶电转时间=1∶1.0~1.5)。电转结束后取出PVDF膜并浸泡于5%脱脂牛奶中,于37 ℃摇床封闭1.5 h。接着,将PVDF膜浸没于相应一抗中于4 ℃下孵育过夜。次日使用PBST清洗PVDF膜三次后,加入相应二抗并于37 ℃摇床上孵育1 h。PBST摇床清洗三次后,采用化学发光法进行凝胶成像仪显色与图像采集,采用QuantityOne 4.5.0进行灰度值分析。
1.10. 统计学方法
采用SPSS 26.0软件进行统计分析。正态分布的计量资料以均数±标准差( ±s)表示,两组间比较采用t检验,多组间比较采用方差分析;计数资料以例数(百分比)[n(%)]表示,组间比较采用χ 2检验。P<0.05表示差异具有统计学意义。
2. 结 果
2.1. DEHP亚急性暴露对胚胎着床的影响
观察DEHP亚急性暴露小鼠自然妊娠第7天的胚胎情况,与空白对照组比较,DEHP大剂量组受孕率显著降低,其受孕成功率仅18.18%(P<0.05),见表1,后续实验对DEHP大剂量组未作进一步观察。结果显示,DEHP小剂量组和中剂量组胚胎数与空白对照组并无明显差异,但DEHP中剂量组胚胎在子宫两侧分布不均,见图1。与空白对照组比较,DEHP中剂量组子宫湿重显著降低,DEHP小剂量组和DEHP中剂量组胚胎直径均显著减小(均P<0.05),见表1。以上结果提示DEHP亚急性暴露可能导致小鼠胚胎着床损伤。
表1.
各组胚胎着床指标比较
| 组 别 | n | 成功受孕(只) | 胚胎数 | 子宫湿重(mg) | 胚胎直径(cm) |
|---|---|---|---|---|---|
| 空白对照组 | 9 | 7 | 13.0±2.2 | 316±90 | 0.35±0.03 |
| DEHP小剂量组 | 8 | 7 | 12.1±3.0 | 273±48 | 0.31±0.03* |
| DEHP中剂量组 | 7 | 6 | 12.8±0.8 | 243±19* | 0.31±0.03* |
| DEHP大剂量组 | 11 | 2 | — | — | — |
—:无相关数据;与空白对照组比较,* P<0.05. DEHP:邻苯二甲酸二(2-乙基)己酯.
±s
图1. DEHP亚急性暴露小鼠自然妊娠第7天的子宫形态图.

空白对照组胚胎分布均匀无拥挤生长,而DEHP暴露组小鼠胚胎在子宫两侧分布不均. 标尺=1 cm. DEHP:邻苯二甲酸二(2-乙基)己酯.
2.2. DEHP亚急性暴露对小鼠蜕膜反应的影响
在DEHP亚急性暴露小鼠自然妊娠第7天的子宫组织中,HE染色结果显示空白对照组蜕膜组织细胞排列紧密均匀、细胞核大而圆、细胞质丰富且染色均匀;DEHP小剂量组和中剂量组蜕膜组织细胞排列杂乱、细胞核较小且形态不规则、细胞质染色不均匀(图2),且两组子宫组织多核细胞数相比空白对照组明显减少(均P<0.01),见表2。Masson染色结果显示,与空白对照组比较,DEHP小剂量组和中剂量组胶原纤维数较多,且分布不均、排列杂乱,表明DEHP小剂量组和中剂量组小鼠蜕膜组织中仍有较多基质细胞尚未转化为蜕膜细胞,蜕膜反应较缓慢,见图3。蜕膜细胞的凋亡有助于滋养细胞的侵袭,在发生蜕膜反应的过程中也伴随着凋亡发生。TUNEL检测结果显示,与空白对照组比较,DEHP小剂量组和中剂量组蜕膜组织细胞凋亡增加,见图4。蛋白质印迹法检测结果显示,与空白对照组比较,DEHP小剂量组和中剂量组自然妊娠第7天蜕膜标志分子BMP2蛋白表达水平呈剂量依赖性显著降低,见图5和表2。以上结果提示,DEHP亚急性暴露导致小鼠蜕膜反应受损。
图2. DEHP亚急性暴露小鼠自然妊娠第7天子宫组织病理学改变(HE染色).
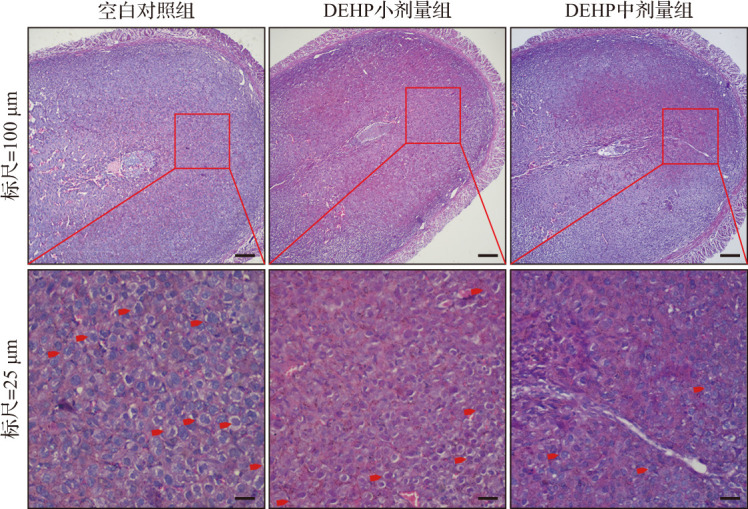
红色箭头所指为多核细胞. 空白对照组蜕膜组织细胞排列紧密均匀、细胞核大而圆、细胞质染色均匀;DEHP亚急性暴露小鼠蜕膜组织细胞排列杂乱、细胞核较小且形态不规则、细胞质染色不均,多核细胞较少. DEHP:邻苯二甲酸二(2-乙基)己酯;HE染色:苏木精-伊红染色.
表2.
各组多核细胞数、BMP2表达和子宫组织湿重比值比较
| 组 别 | 自然妊娠第7天 | 人工诱导蜕膜反应小鼠妊娠第8天 | |||
|---|---|---|---|---|---|
|
多核细胞 数(n=3) |
BMP2 (n=6) |
子宫组织湿重比#(n=7) | 多核细胞数(n=3) |
BMP2 (n=4) |
|
| 空白对照组 | 51.3±14.5 | 2.01±0.72 | 16±5 | 93.0±20.1 | 1.86±0.49 |
| DEHP小剂量组△ | 20.3±4.0** | 0.81±0.66* | 7±5** | 75.0±16.5 | 1.00±0.12** |
| DEHP中剂量组 | 16.7±2.5** | 0.44±0.19** | 9±6* | 25.3±6.7** | 0.43±0.31** |
与空白对照组比较,* P<0.05,** P<0.01. #诱导侧与对照侧的湿重比;△该组BMP2统计例数为7例,子宫组织湿重比统计例数为8例. DEHP:邻苯二甲酸二(2-乙基)己酯;BMP:骨形成蛋白.
±s
图3. DEHP亚急性暴露小鼠自然妊娠第7天蜕膜细胞转化情况(Masson染色).
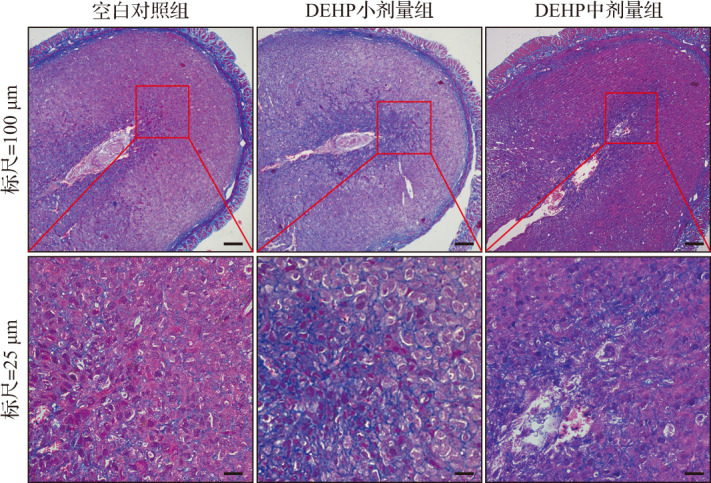
空白对照组蜕膜组织中蓝色胶原纤维数少,排列均匀;DEHP亚急性暴露小鼠蜕膜组织胶原纤维数较多,且分布不均、排列杂乱. DEHP:邻苯二甲酸二(2-乙基)己酯.
图4. DEHP亚急性暴露小鼠自然妊娠第7天蜕膜组织细胞凋亡情况(TUNEL检测).
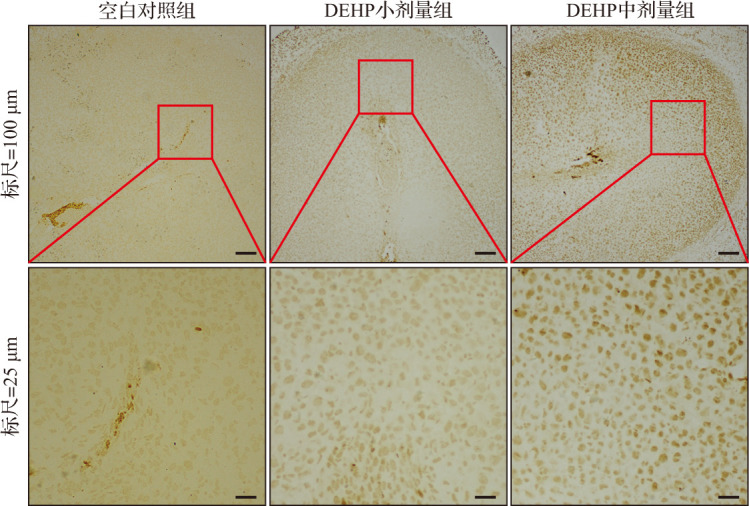
DEHP亚急性暴露小鼠蜕膜组织细胞中发生凋亡的阳性细胞多于空白对照组. DEHP:邻苯二甲酸二(2-乙基)己酯.
图5. DEHP亚急性暴露小鼠自然妊娠第7天蜕膜组织BMP2蛋白电泳图.
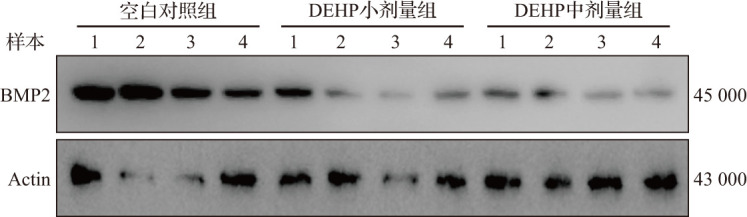
DEHP:邻苯二甲酸二(2-乙基)己酯;BMP:骨形成蛋白.
在DEHP亚急性暴露人工诱导蜕膜反应小鼠妊娠第8天,与空白对照组比较,DEHP小剂量组和中剂量组诱导侧子宫角体积有所减小,诱导侧/非诱导侧子宫角湿重比值显著减少,见图6和表2。HE染色结果显示,空白对照组小鼠蜕膜组织细胞排列规则、细胞核大而圆、胞浆染色均匀;DEHP小剂量组和中剂量组小鼠子宫蜕膜组织细胞排列杂乱、细胞核较小且形态不规则、胞浆染色不均(图7),且DEHP中剂量组多核细胞数显著减少,见表2。Masson染色显示,与空白对照组比较,DEHP小剂量组和中剂量组小鼠蜕膜组织胶原纤维分布更广、排列更紧密,纤维数更多(图8),表明DEHP亚急性暴露会减缓小鼠蜕膜反应。TUNEL检测结果显示,与空白对照组比较,DEHP小剂量组和中剂量组小鼠蜕膜组织细胞凋亡增加,见图9。各组诱导侧子宫组织的蛋白质印迹法检测结果显示,与空白对照组比较,DEHP小剂量组和中剂量组小鼠诱导侧子宫组织中蜕膜标志分子 BMP2表达呈剂量依赖性显著性降低,见图10和表2。这些结果表明,在排除胚胎的影响下,DEHP亚急性暴露同样能导致小鼠蜕膜反应损伤。
图6. 人工诱导蜕膜反应小鼠妊娠第8天子宫形态图.
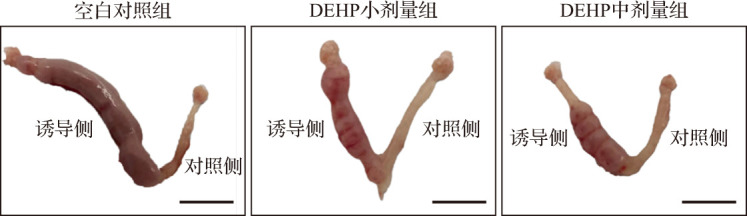
与对照侧子宫比较,诱导侧子宫体积变大;与空白对照组比较,DEHP亚急性暴露小鼠诱导侧子宫,体积减小. 标尺=1 cm. DEHP:邻苯二甲酸二(2-乙基)己酯.
图7. 人工诱导蜕膜反应小鼠妊娠第8天子宫组织病理学改变(HE染色).
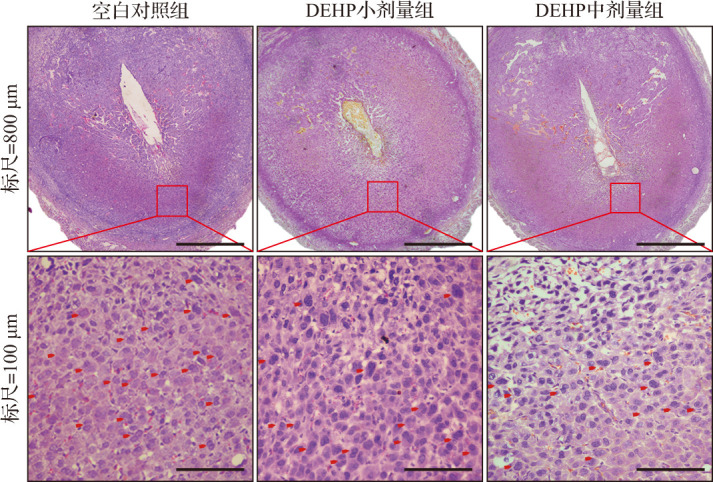
红色箭头所指为多核细胞. 空白对照组小鼠蜕膜组织细胞排列规则、细胞核大而圆、胞浆染色均匀,DEHP 亚急性暴露小鼠子宫蜕膜组织细胞排列杂乱、细胞核较小且形态不规则、胞浆染色不均且多核细胞数较少. DEHP:邻苯二甲酸二(2-乙基)己酯;HE染色:苏木精-伊红染色.
图8. 人工诱导蜕膜反应小鼠妊娠第8天蜕膜细胞转化情况(Masson染色).
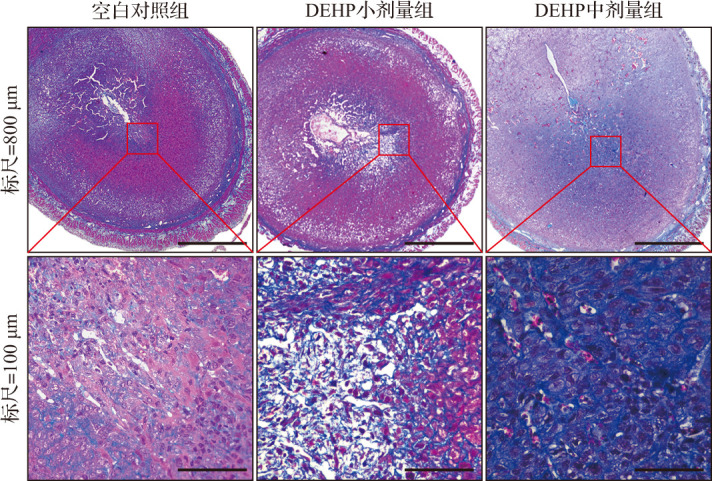
与空白对照组比较,DEHP亚急性暴露小鼠蜕膜组织蓝色胶原纤维分布更广、排列更紧密,纤维数更多. DEHP:邻苯二甲酸二(2-乙基)己酯.
图9. 人工诱导蜕膜反应小鼠妊娠第8天蜕膜组织细胞凋亡情况(TUNEL检测).

DEHP亚急性暴露小鼠蜕膜组织细胞中发生凋亡的阳性细胞多于空白对照组. DEHP:邻苯二甲酸二(2-乙基)己酯.
图10. 人工诱导蜕膜反应小鼠妊娠第8天蜕膜组织BMP2蛋白电泳图.
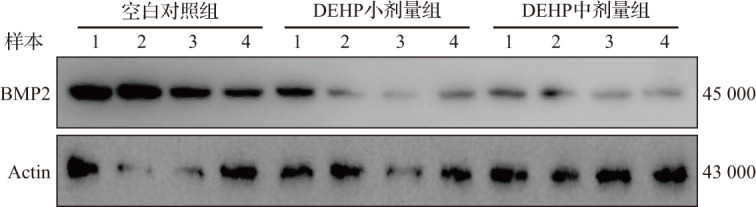
DEHP:邻苯二甲酸二(2-乙基)己酯;BMP:骨形成蛋白.
2.3. DEHP亚急性暴露导致蜕膜反应损伤对小鼠不良妊娠的影响
基于成功构建的DEHP亚急性暴露小鼠自然流产模型发现,与空白对照组比较,DEHP小剂量组小鼠流产率、胚胎吸收率显著性升高,胚胎数、子宫湿重、子宫面积、胎盘湿重均显著减少,见表3。结果表明,DEHP亚急性暴露导致蜕膜反应损伤增加小鼠不良妊娠风险,加重小鼠流产风险。
表3.
是否DEHP亚急性暴露小鼠不良妊娠发生比较
| 组 别 | n | 流 产 |
胚胎吸 收率(%) |
胚胎数 |
子宫湿重 (mg) |
子宫面积 (cm2) |
胎盘湿重 (mg) |
|---|---|---|---|---|---|---|---|
| 空白对照组 | 13 | 4(30.8) | 4.83 | 14.3±2.3 | 1150±235 | 3.9±0.7 | 20.2±2.6 |
| DEHP小剂量组 | 12 | 9(75.0)* | 17.42** | 11.0±3.2** | 818±326** | 2.9±0.9** | 16.8±2.8** |
与空白对照组比较,* P<0.05,** P<0.01. DEHP:邻苯二甲酸二(2-乙基)己酯.
©The author(s) 2024. This is an open access article under the CC BY-NC-ND 4.0 License (https://creativecommons.org/licenses/by-nc-nd/4.0/)
n(%)或 ±s
3. 讨 论
自二十世纪二十年代开始应用邻苯二甲酸酯作为增塑剂以来,邻苯二甲酸酯类物质全球年产量稳步增长[13-14]。人类通过摄入、皮肤接触和吸入直接暴露于邻苯二甲酸酯,胎儿和新生儿在妊娠和哺乳期间通过母亲接触间接暴露[15-16]。有研究分析了我国不同地区食品中DEHP的含量,结果显示人体DEHP的日暴露量为1595~18 100 ng/kg,不同地区居民通过饮食途径对DEHP的暴露量存在较大差别,且越发达的地区DEHP污染越严重[17-19]。
大量的流行病学研究发现,我国孕妇体内DEHP的暴露现象极为普遍,这种暴露对孕期质量和新生儿健康均有较大影响[20]。在胚胎着床和胎盘形成的过程中,子宫内膜的蜕膜反应是生殖过程中短暂的一个环节,但其对于成功妊娠至关重要。若蜕膜反应出现异常,可能导致早产、胎儿流产等不良妊娠结局风险增加[21-23]。为探究DEHP对子宫内膜蜕膜反应的影响,本研究构建了DEHP亚急性暴露下的小鼠自然妊娠模型和人工诱导蜕膜反应模型,并对小鼠子宫蜕膜相关指标进行了检测。结果显示,3000 mg·kg-1·d-1 DEHP暴露组小鼠受孕率明显降低,300和1000 mg·kg-1·d-1 DEHP暴露组小鼠着床点直径则显著减小。通过对小鼠自然妊娠第7天和人工诱导蜕膜反应小鼠妊娠第8天的蜕膜组织形态检测发现,DEHP导致小鼠子宫内膜蜕膜组织中的多核细胞数减少,蜕膜反应减缓,且蜕膜组织细胞凋亡增加。进一步分析发现,在不同浓度的暴露下,BMP2表达水平显著降低。
本研究中小鼠自然妊娠第7天子宫湿重和假孕小鼠第8天子宫诱导侧与对照侧子宫湿重比显著降低,这一结果与已有研究结果[7, 24]基本一致,表明DEHP暴露可以导致子宫湿重下降。已有研究发现DEHP暴露组的胚胎数显著减少[7, 24],而在本文资料中并未发现此现象。妊娠期对小鼠灌胃可能会导致小鼠胚胎吸收,在本研究中采用拌饲法进行DEHP暴露,最大限度地减少了对小鼠肠胃的物理损伤刺激和精神刺激,这可能是导致本文结果与已有研究结果差异的原因。沈盺[25]发现,DEHP暴露浓度的增加会导致蜕膜组织内多核蜕膜细胞数的减少,这一现象在所有DEHP暴露组中均可观察到,与本研究结果相吻合。这一发现揭示了DEHP暴露可能导致内膜基质细胞异常,干扰基质细胞分化。袁柳等[24]通过建立体外细胞模型模拟了DEHP对孕鼠子宫内膜基质细胞的影响,发现DEHP暴露组小鼠中内膜基质细胞向蜕膜细胞的形态转化被明显抑制。本研究中,小鼠自然妊娠第7天和人工诱导蜕膜反应小鼠妊娠第8天蜕膜组织Masson染色结果显示DEHP暴露组有较多的基质细胞尚未转化为蜕膜细胞,这与袁柳等[24]的体外研究结果一致,表明DEHP暴露可能会干扰子宫内膜基质细胞向蜕膜细胞的转变过程,从而导致蜕膜反应缺陷。
米非司酮乃临床流产用药,可以通过使内膜分泌性发育异常损伤子宫内膜从增生期过渡到分泌期,最终导致蜕膜细胞变性坏死,内膜剥离并伴随出血,同时也影响绒毛的健康状况[26-28]。大量研究使用米非司酮构建流产模型[29-35]。研究表明,通过米非司酮构建流产的小鼠其血清雌、孕激素水平变化模式与人类自然流产患者一致[36-37]。基于这些特点,米非司酮成为研究流产或宫内生长受限等病理妊娠常见动物模型的构建方式[35, 37]。本研究使用米非司酮构建流产模型来观察DEHP亚急性暴露是否损伤小鼠蜕膜反应并增加小鼠不良妊娠风险。研究结果显示,与空白对照组比较,DEHP暴露组小鼠胚胎数、子宫湿重、子宫面积、胎盘湿重显著降低,胚胎吸收率、流产率显著升高,表明DEHP亚急性暴露可导致小鼠体内胎儿生长受限,从而增加小鼠不良妊娠风险。其对胎儿的影响是否会进一步造成成年子代的生长发育损伤还需进一步探索。
综上所述,之前相关研究主要集中在短期暴露对蜕膜反应的影响,本研究则扩展到了长期暴露的影响,并发现这种长期暴露会导致小鼠子宫组织中蜕膜标志蛋白BMP2表达减少,蜕膜反应进程减缓,以及蜕膜组织细胞凋亡数增加。此外,长期暴露于DEHP的小鼠胎儿生长受限,不良妊娠风险增加。这些发现为理解DEHP对生殖健康的潜在影响提供了新的视角,也突显长期暴露于环境化学物质可能带来的健康风险。
Acknowledgments
研究得到重庆医科大学未来医学青年创新团队发展支持计划(W0039)支持
Acknowledgments
This study was supported by the Future Medical Youth Innovation Team Development Support Program of Chongqing Medical University (W0039)
[缩略语]
邻苯二甲酸二(2-乙基)己酯[di(2-ethylhexyl) phthalate,DEHP];辣根过氧化物酶(horseradish peroxidase,HRP);免疫球蛋白G(immunoglobulin G,IgG);苏木精-伊红染色(hematoxylin and eosin staining,HE染色);磷酸盐缓冲液(phosphate buffered saline,PBS);骨形成蛋白(bone morphogenetic protein,BMP);含吐温-20的磷酸盐缓冲液(phosphate buffered saline with Tween-20, PBST);辣根过氧化物酶标记的链霉亲和素(streptomyces avidin labeled with horseradish peroxidase,streptavidin-HRP);聚偏二氟乙烯(polyvinylidene fluoride,PVDF)
利益冲突声明
所有作者均声明不存在利益冲突
Conflict of Interests
The authors declare that there is no conflict of interests
参考文献(References)
- 1.PURI M, GANDHI K, KUMAR M S. The occurrence, fate, toxicity, and biodegradation of phthalate esters: an overview[J/OL]. Water Environ Res, 2023, 95(1): e10832. 10.1002/wer.10832 [DOI] [PubMed] [Google Scholar]
- 2.WANG Z, MA J, WANG T, et al. Environmental health risks induced by interaction between phthalic acid esters (PAEs) and biological macromolecules: a review[J]. Chemo-sphere, 2023, 328: 138578. 10.1016/j.chemosphere.2023.138578 [DOI] [PubMed] [Google Scholar]
- 3.LI X N, LI H X, YANG T N, et al. Di-(2-ethylhexyl) phthalate induced developmental abnormalities of the ovary in quail (Coturnix japonica) via disruption of the hypothalamic-pituitary-ovarian axis[J]. Sci Total Environ, 2020, 741: 140293. 10.1016/j.scitotenv.2020.140293 [DOI] [PubMed] [Google Scholar]
- 4.GELLERSEN B, BROSENS J J. Cyclic decidualization of the human endometrium in reproductive health and failure[J]. Endocr Rev, 2014, 35(6): 851-905. 10.1210/er.2014-1045 [DOI] [PubMed] [Google Scholar]
- 5.NG S W, NORWITZ G A, PAVLI-CEV M, et al. Endometrial decidua-lization: the primary driver of pre-gnancy health[J]. Int J Mol Sci, 2020, 21(11): 4092. 10.3390/ijms21114092 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.SALKER M, TEKLENBURG G, MOLOKHIA M, et al. Natural selec-tion of human embryos: impaired decidualization of endometrium dis-ables embryo-maternal inter-actions and causes recurrent pregnancy loss[J/OL]. PLoS One, 2010, 5(4): e10287. 10.1371/journal.pone.0010287 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.LI R, YU C, GAO R, et al. Effects of DEHP on endometrial receptivity and embryo implantation in pregnant mice[J]. J Hazard Mater, 2012, 241-242: 231-240. 10.1016/j.jhazmat.2012.09.038 [DOI] [PubMed] [Google Scholar]
- 8.农业部农药检定所 . GB/T 15670.10—2017农药登记毒理学试验方法 第10部分: 短期重复经口染毒(28天)毒性试验[S]. 北京: 中华人民共和国国家质量监督检验检疫总局/中国国家标准化管理委员会, 2017: 8. [Google Scholar]; Pesticide Inspection and Quarantine Institute of the Ministry of Agriculture . GB/T 15670.10—2017 Toxicological test methods for pesticide registration Part 10: short-term repeated oral toxicity test (28 days)[S]. Beijing: General Admini-stration of Quality Supervision, Inspection and Quaran-tine of the People’s Republic of China, Standardization Administration of the People’s Republic of China, 2017: 8 (in Chinese) [Google Scholar]
- 9.ROIDL E, FREHSE B, HÖGER R. Emotional states of drivers and the impact on speed, acceleration and traffic violations—a simulator study[J]. Accid Anal Prev, 2014, 70: 282-292. 10.1016/j.aap.2014.04.010 [DOI] [PubMed] [Google Scholar]
- 10.BROSENS I, PUTTEMANS P, BENAGIANO G. Placental bed research: Ⅰ. The placental bed: from spiral arteries remodeling to the great obstetrical syndromes[J]. Am J Obstet Gynecol, 2019, 221(5): 437-456. 10.1016/j.ajog.2019.05.044 [DOI] [PubMed] [Google Scholar]
- 11.TONG J, ZHAO W, LV H, et al. Transcriptomic profiling in human decidua of severe preeclampsia detected by RNA sequencing[J]. J Cell Biochem, 2018, 119(1): 607-615. 10.1002/jcb.26221 [DOI] [PubMed] [Google Scholar]
- 12.杨倩, 郁琳, 顾艳, 等. 米非司酮导致孕激素功能不足的自然流产小鼠模型的建立及其评价[J]. 实验动物与比较医学, 2016, 36(5): 327-333. 10.3969/j.issn.1674-5817.2016.05.001 [DOI] [Google Scholar]; YANG Qian, YU Lin, GU Yan, et al. Establishment and evaluation of spontaneous abortion mouse models of progesterone insufficiency induced by mifepristone[J]. Laboratory Animal and Comparative Medicine, 2016, 36(5): 327-333. (in Chinese) 10.3969/j.issn.1674-5817.2016.05.001. 10.3969/j.issn.1674-5817.2016.05.001 [DOI] [Google Scholar]
- 13.ROUSE C E, ECKERT L O, BABARINSA I, et al. Spontaneous abortion and ectopic pregnancy: case definition & guidelines for data collection, analysis, and presentation of maternal immunization safety data[J]. Vaccine, 2017, 35(48 Pt A): 6563-6574. 10.1016/j.vaccine.2017.01.047 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.CHAN Y Y, JAYAPRAKASAN K, TAN A, et al. Reproductive outcomes in women with congenital uterine anomalies: a systematic review[J]. Ultrasound Obstet Gynecol, 2011, 38(4): 371-382. 10.1002/uog.10056 [DOI] [PubMed] [Google Scholar]
- 15.MUSTIELES V, ROLLAND M, PIN I, et al. Early-life exposure to a mixture of phenols and phthalates in relation to child social behavior: applying an evidence-based prioritization to a cohort with improved exposure assessment[J]. Environ Health Perspect, 2023, 131(8): 87006. 10.1289/ehp11798 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.HLISNÍKOVÁ H, PETROVIČOVÁ I, KOLENA B, et al. Effects and mechanisms of Phthalates’ action on reproductive processes and reproductive health: a liter-ature review[J]. Int J Environ Res Public Health, 2020, 17(18): 6811. 10.3390/ijerph17186811 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.GUO Y, ZHANG Z, LIU L, et al. Occurrence and profiles of phthalates in foodstuffs from China and their implications for human exposure[J]. J Agric Food Chem, 2012, 60(27): 6913-6919. 10.1021/jf3021128 [DOI] [PubMed] [Google Scholar]
- 18.LI Z Y, LIU H, LIU H, et al. Dietary exposure and risk assessment of phthalic acid esters through a total diet study in Shenzhen, South China[J]. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2022, 39(9): 1591-1603. 10.1080/19440049.2022.2094474 [DOI] [PubMed] [Google Scholar]
- 19.叶雅真, 朱宝平, 洪华荣, 等. 2012年厦门市售婴幼儿配方奶粉及辅助食品中邻苯二甲酸酯类物质监测结果分析[J]. 中国卫生检验杂志, 2013, 23(1): 218-219. [Google Scholar]; YE Yazhen, ZHU Baoping, HONG Huarong, et al. Investigation and analysis of phthalates in infant formula and supplementary foods in Xiamen in 2012[J]. Chinese Journal of Health Laboratory Tech-nology, 2013, 23(1): 218-219. (in Chinese) [Google Scholar]
- 20.刘慧杰. 育龄期妇女体内邻苯二甲酸酯污染及其与新生儿出生质量关系的研究[D]. 重庆: 第三军医大学, 2003. [Google Scholar]; LIU Huijie. Study on relations between pollution of phthalic acid esters in child-bearing period women and newborn quality[D]. Chongqing: The Third Military Medical University, 2003. (in Chinese) [Google Scholar]
- 21.SCHATZ F, GUZELOGLU-KAYISLI O, ARLIER S, et al. The role of decidual cells in uterine hemostasis, menstruation, inflammation, adverse pregnancy outcomes and abnormal uterine bleeding[J]. Hum Reprod Update, 2016, 22(4): 497-515. 10.1093/humupd/dmw004 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.BLOIS S M, KLAPP B F, BARRIENTOS G. Decidua-lization and angiogenesis in early pregnancy: unravelling the functions of DC and NK cells[J]. J Reprod Im-munol, 2011, 88(2): 86-92. 10.1016/j.jri.2010.11.002 [DOI] [PubMed] [Google Scholar]
- 23.ACHACHE H, TSAFRIR A, PRUS D, et al. Defective endometrial prostaglandin synthesis identified in patients with repeated implantation failure undergoing in vitro fertilization[J]. Fertil Steril, 2010, 94(4): 1271-1278. 10.1016/j.fertnstert.2009.07.1668 [DOI] [PubMed] [Google Scholar]
- 24.袁柳, 谭丽萍, 孙智芳, 等. 孕早期增塑剂DEHP暴露降低长链非编码RNA RP24-315D19.10表达影响子宫内膜蜕膜反应[J]. 浙江大学学报(医学版), 2023, 52(1): 1-12. 10.3724/zdxbyxb-2022-0669 [DOI] [PMC free article] [PubMed] [Google Scholar]; YUAN Liu, TAN Liping, SUN Zhifang, et al. Plasticizer DEHP exposure in early pregnancy affects the endo-metrial decidualization in mice through reducing lncRNA RP24-315D19.10 expression[J]. Journal of Zhejiang University (Medical Sciences), 2023, 52(1): 1-12. (in Chinese) 10.3724/zdxbyxb-2022-0669. 10.3724/zdxbyxb-2022-0669 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.沈 昕. DEHP对子宫蜕膜反应的影响及其作用机制研究[D]. 南昌: 南昌大学, 2021. [Google Scholar]; SHEN Xin. Effect and mechanism of DEHP on the decidualization of uterus[D]. Nanchang: Nanchang University, 2021. (in Chinese) [Google Scholar]
- 26.MENG W, TA N, WANG F. Add-on effect of Guizhi Fuling formula to mifepristone for endometriosis: a meta-analysis of randomized controlled trials[J/OL]. Medicine (Baltimore), 2019, 98(33): e16878. 10.1097/md.0000000000016878 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.SITRUK-WARE R. Mifepristone and misoprostol sequential regimen side effects, complications and safety[J]. Contraception, 2006, 74(1): 48-55. 10.1016/j.contraception.2006.03.016 [DOI] [PubMed] [Google Scholar]
- 28.GEMZELL-DANIELSSON K, WESTLUND P, JOHA-NNISSON E, et al. Effect of low weekly doses of mifepristone on ovarian function and endometrial deve-lopment[J]. Hum Reprod, 1996, 11(2): 256-264. 10.1093/humrep/11.2.256 [DOI] [PubMed] [Google Scholar]
- 29.ZHANG L, WANG S, MA Y, et al. Shoutai Wan regulates glycolysis imbalance at the maternal-fetal interface in threatened abortion mice[J]. J Ethnophar-macol, 2023, 312: 116502. 10.1016/j.jep.2023.116502 [DOI] [PubMed] [Google Scholar]
- 30.BI S J, HUANG Y X, FENG L M, et al. Network pharmacology-based study on immunomodulatory mech-anism of danggui-yimucao herb pair for the treatment of RU486-induced abortion[J]. J Ethnopharmacol, 2022, 282: 114609. 10.1016/j.jep.2021.114609 [DOI] [PubMed] [Google Scholar]
- 31.LI X, WANG B, LI Y, et al. The Th1/Th2/Th17/Treg paradigm induced by stachydrine hydrochloride reduces uterine bleeding in RU486-induced abortion mice[J]. J Ethnopharmacol, 2013, 145(1): 241-253. 10.1016/j.jep.2012.10.059 [DOI] [PubMed] [Google Scholar]
- 32.HUANG J, XUE M, ZHANG J, et al. Protective role of GPR120 in the maintenance of pregnancy by promoting decidualization via regulation of glucose metabolism[J]. EBioMedicine, 2019, 39: 540-551. 10.1016/j.ebiom.2018.12.019 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.LI X, ZHANG M, WANG B, et al. Shenghua Decoction reduces uterine bleeding and regulates T-cell paradigm in human deciduas of RU486 medical abortion[J]. J Ethnopharmacol, 2013, 150(3): 907-917. 10.1016/j.jep.2013.09.033 [DOI] [PubMed] [Google Scholar]
- 34.LIU M, MAO J, ZHANG S. Effect of intervention of probiotics in advance on Treg/Th17 in premature mice[J]. Biomed Res Int, 2022, 2022: 6131069. 10.1155/2022/6131069 [DOI] [PMC free article] [PubMed] [Google Scholar] [Retracted]
- 35.丁璇, 黄芩抗RU486诱导小鼠流产作用的研究[D]. 长沙: 湖南中医药大学, 2010. [Google Scholar]; DING Xuan. Anti-abortion effects of scutellaria baica-lensis on RU486-induced abortive mice[D]. Changsha: Hunan University of Chinese Medicine, 2010. (in Chinese) [Google Scholar]
- 36.CRITCHLEY H O, KELLY R W, BRENNER R M, et al. Antiprogestins as a model for progesterone withdrawal[J]. Steroids, 2003, 68(10-13): 1061-1068. 10.1016/j.steroids.2003.07.001 [DOI] [PubMed] [Google Scholar]
- 37.CAMILLERI C, SAMMUT S. Progesterone-mediated reversal of mifepristone-induced pregnancy termination in a rat model: an exploratory investigation[J]. Sci Rep, 2023, 13(1): 10942. 10.1038/s41598-023-38025-9 [DOI] [PMC free article] [PubMed] [Google Scholar]


