Abstract
水凝胶是一种可降解亲水聚合物,但亲水性过大导致体积变大、弹性模量降低以及结构松散,影响其使用;尤其是在生物医学工程领域,水凝胶的过分溶胀会压迫神经,且降解速率过快,导致释放的离子与组织生长不匹配等问题。因此,抗溶胀的水凝胶是近年来的研究热点,本文综述了抗溶胀水凝胶的近期研究进展,从水凝胶的溶胀机制和制备方法出发,详细阐述其在生物医学工程领域的应用发展,以期为抗溶胀水凝胶领域的研究者提供一些参考与借鉴。
Keywords: 水凝胶, 亲水性, 抗溶胀, 生物医学
Abstract
Hydrogel is a kind of degradable hydrophilic polymer, but excessive hydrophilicity leads to larger volume, lower elastic modulus and looser structure, which further affect its use. Especially in the field of biomedical engineering, excessive swelling of the hydrogel can compress the nerves and improve degradation rate resulting in mismatch of tissue growth and released ions. Therefore, anti-swelling hydrogel has been a research hotspot in recent years. This paper reviews the recent research progress on anti-swelling hydrogel, and expounds the application mechanism and preparation method of hydrogel in biomedical engineering, aiming to provide some references for researchers in the field of anti-swelling hydrogel.
Keywords: Hydrogel, Hydrophilicity, Anti-swelling, Biomedicine
0. 引言
水凝胶是一种亲水性聚合物,在众多学科领域中应用广泛,以生物医学工程领域为例,其在如软体机器人、人造器官、再生医学等方向都具有较大的应用潜力[1-2]。2020年中国医用水凝胶市场规模达到了5.5亿元,预计2026年将达到7.14亿元,年增长率约为4.6%[3]。
水凝胶,作为一种三维的网络交联结构高分子聚合物,具有高弹性、稳定性、高吸水性、保水性和可溶胀等特性[4],其吸水性可以达到自身重量数百倍。但过分的溶胀会导致分子链结构破坏,机械性能下降,降解率提高,使用受限。因此,有研究者提出抗溶胀水凝胶概念[5],通过调控分子孔隙结构和交联度来控制水凝胶的溶胀比,以期提升水凝胶的性能。基于此,本文综述了近年来抗溶胀水凝胶的制备及在生物医学工程领域的发展应用,以期为抗溶胀水凝胶的研究者们提供借鉴和参考。
1. 水凝胶溶胀机制
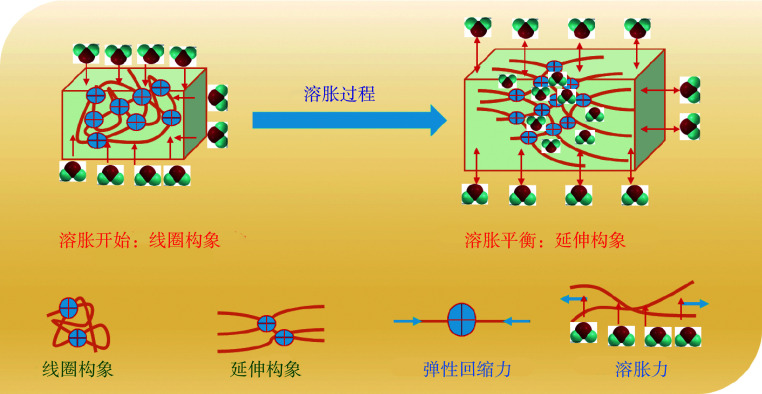
影响水凝胶溶胀的三个主要因素是:① 聚合物与水分子之间的相互作用,即聚合物分子链的亲水性越强,聚合物与水分子的相互作用就越强。② 内外渗透压,即如果水凝胶分子链中包含离子基团,则水凝胶内部和外部溶液的离子浓度差将产生渗透压使其溶胀,离子浓度差越大,渗透压就越大。③ 静电作用,水凝胶表面的静电相互作用会引起水分子向水凝胶表面移动,也能促使水凝胶发生溶胀[6]。三者的相互作用,导致水凝胶的溶胀和回缩相互制约,相互依赖。如图1所示,随着分子链网络的溶胀逐渐从线圈构象变为延伸构象,弹性回缩力不断增加,溶胀力不断减少,最后趋于溶胀平衡。
图 1.
Schematic diagram of hydrogel swelling
水凝胶的溶胀示意图
2. 抗溶胀水凝胶的制备方法
基于水凝胶溶胀机制,抗溶胀水凝胶的制备主要是交联成型,如化学交联法、物理交联法和物理/化学交联法[7-8];研究者们通过不同材料的特性和交联度,以获得不同结构的抗溶胀水凝胶。如:化学交联法,可以实现两亲性共分子链结构的抗溶胀水凝胶[9];物理交联法,可以获得单分子链高密度孔隙结构的抗溶胀水凝胶[10];物理/化学交联法,可以获得双交联(dual-cross-linked,DC)结构的抗溶胀水凝胶等[8]。按照三种不同的交联方式,抗溶胀水凝胶特点如表1所示。
表 1. Characteristics of anti-swelling hydrogels by different crosslinked methods.
不同交联形式的抗溶胀水凝胶特点
| 交联方法 | 抗溶胀机制 | 优点 | 缺点 |
| 物理交联法 | 分子网络密度、孔隙结构密度、分子间作用力 | 交联过程简单、易交联、动态可逆 | 抗溶胀性能差、降解不受控 |
| 化学交联法 | 共价键的形成、交联点稳固、赋予水凝胶稳定的 三维结构 |
抗溶胀效果好、易调控溶胀比、 降解速率稳定 |
交联不可逆、大部分需交联剂、 交联剂毒性难以去除 |
| 物理/化学交联法 | 共价键与非共价键相互作用 | 具有物理和化学交联的优点 | 交联制备复杂、实验环境要求高 |
2.1. 基于物理交联法的抗溶胀水凝胶
物理交联法,是通过材料分子间的非共价键相互作用,如氢键、静电、疏水缔合、π-π键和范德华力等,形成交错的三维网络结构[11-12]。例如,Wang等[13]通过在聚丙烯酸/铁离子(polyacrylic acid/ferric ionic,PAA/Fe3+)中加入2-羟丙基三甲基氯化铵壳聚糖(2-hydroxypropyltrimethyl ammonium chloride chitosan,HACC),以物理交联法制备了水凝胶。由于该水凝胶体系中存在静电、离子配位和氢键共3种非共价键力相互作用,赋予了水凝胶优异的抗溶胀性能。Dai等[14]报道了二氨基三嗪-二氨基三嗪(diaminotriazine-diaminotriazine,DAT-DAT)氢键增强水凝胶,水凝胶内形成了稳定的DAT-DAT氢键域,表现出高拉伸和高压缩强度,且在水溶液中不溶胀。Qi等[15]利用之前得到的聚丙烯酸共聚甲基丙烯酸月桂酯 (polyacrylic acid and lauryl methacrylate,PAA-co-LMA)与高浓度阳离子十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)以物理交联法制备了超分子水凝胶。由于网络中CTAB和PAA-co-LMA共聚物链的疏水缔合作用,该水凝胶表现出优异的抗溶胀能力。
2.2. 基于化学交联法的抗溶胀水凝胶
化学交联法,是通过添加交联剂以化学反应形成共价键交联结构。例如,Pi等[16]通过加入热引发剂过硫酸铵(ammonium persulfate,APS)激活过渡金属碳/氮化物(MXene)和锆离子(Zr4+)诱导交联,成功制备了聚丙烯酸(polyacrylic acid,PAA)与明胶(gelatine,Gel)的复合水凝胶。该水凝胶交联反应时间短,交联密度高,抗溶胀性能好。但是,大部分化学交联法中使用的化学交联剂难以根除,其残留物将影响水凝胶使用,因此不添加交联剂即可完成交联的方法备受关注,如:希夫碱反应,通过胺对羰基的亲核加成,经脱水可以形成亚胺键(-C=N-),从而获得致密的交联网络。希夫碱反应形成的水凝胶其优势在于可快速形成交联结构,如Pang等[17]通过甲壳素纳米晶须(chitin nano-whiskers,CtNWs)与羧甲基壳聚糖(carboxymethyl chitosan,CMCS)和右旋糖酐二甲醛(dextran dialdehyde,DDA)的希夫碱交联,构建出一种机械性能增强的组织黏合剂水凝胶。该研究通过调节水凝胶中CtNWs的浓度,即能使水凝胶表现出灵活的抗溶胀性能。除此之外,还有其他各种加成反应的化学交联也可以达到抗溶胀效果。
2.3. 基于物理/化学交联法的抗溶胀水凝胶
物理/化学交联法,是通过分子链上的共价键和非共价键共同交联的结果。虽然该交联方式对实验环境及控制要求相对较高,但是能使所制备的水凝胶避免上述单一交联方式产生的缺点,使其具有非常显著的抗溶胀性能。如Fan等[18]提出的DC水凝胶,即是将聚乙烯醇(polyvinyl alcohol,PVA)和聚丙烯酰胺(polyacrylamide,PAAm)化学交联,然后将水凝胶浸入聚合物-单宁酸(polymer−tannic acid,TA)溶液中进行物理交联,最终转化为DC水凝胶。这种交联机制有效抑制了水凝胶溶胀,表现出高机械强度和强韧性。Lu等[19]通过白光加热APS将牛血清白蛋白(bovine serum albumin,BSA)和三(2, 2’-联吡啶)二氯化钌[Ru(Ⅱ)]化学交联成型,然后再将水凝胶水浴加热(60~90 ℃)诱导BSA变性形成物理交联,使水凝胶在去离子水中表现出优异的抗溶胀特性。
3. 抗溶胀水凝胶在生物医学中的应用
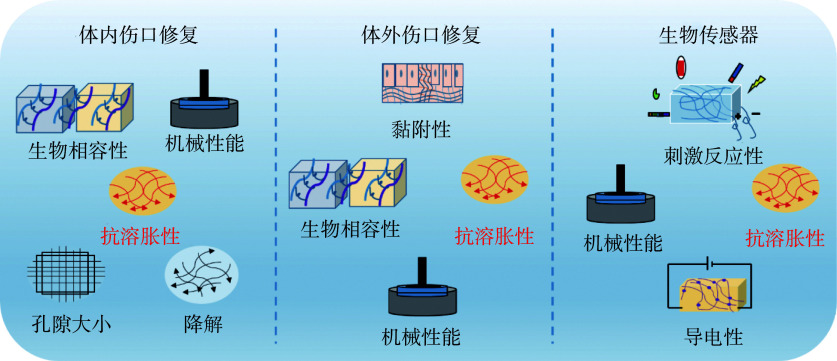
水凝胶广泛应用于伤口愈合、组织黏合和组织再生等生物医学领域[20],如体内外伤口敷料、生物传感器和可注射的促软体组织再生等。人体的复杂性对水凝胶结构特性要求极高,这就要求材料的设计及功能性要相匹配,其中涉及的几个基础设计理念如图2所示。
图 2.
Demand for hydrogel anti-swelling properties in the biomedical field
生物医学领域对水凝胶抗溶胀性能的需求
3.1. 体内伤口修复的应用
3.1.1. 口腔组织修复
口腔中的微生物菌群约有500多种,牙科手术中伤口处理不当将会引起菌群的破坏及病理环境的改变[21]。若以口腔敷料处理伤口,唾液的流动和潮湿环境对伤口的愈合是巨大的挑战,传统的治疗方式是采用棉球、纱布配合缝线止血;而水凝胶有类似于天然细胞外基质的生物特征,是口腔内伤口敷料的首选。Wu等[22]报道了一种用于拔牙槽窝伤口的新型水凝胶敷料,采用化学交联法将PAA和去质子化京尼平交联的壳聚糖(genipin chitosan,G-CS)交联,然后搭载抗生素,成功合成了水凝胶敷料。该敷料具有良好的抗溶胀性能和抗炎效果,能快速修复受损的组织。理想的口腔敷料在口腔中不仅需要具有稳定的黏附性和优越的韧性,还应该具有止血、杀菌、消炎和促进细胞增殖等功能。Zhu等[23]通过物理/化学交联法,将甲基丙烯酸化明胶(gelatin methacrylate,GelMA)与纳米黏土(nanoclay)化学交联后,将水凝胶浸入TA溶液中进行物理交联,成功制备了具备低溶胀、止血、杀菌、消炎和促细胞增殖多功能一体的水凝胶,可用于治疗口腔全层黏膜缺损,效果显著。
3.1.2. 血管移植
目前,大多数水凝胶制备的血管移植物具有多孔的双重网络结构和稳定的力学性能,直径在2~6 mm,但抗溶胀性欠佳,面向临床应用还不成熟[24]。Hou等[25]通过化学交联法制备了两亲性抗疲劳有机水凝胶,无论是在油还是在水介质中,该有机水凝胶的直径和溶胀比保持平衡不变,且满足血管的生物特征,具有与血管匹配的抗疲劳和机械性能。Wang等[26]用化学交联法构建了双网络(dual network,DN)水凝胶,通过光引发自由基聚合普朗尼克F127二丙烯酸酯(di-acrylated Pluronic F127,F127DA)和甲基丙烯酸化透明质酸(methacrylated hyaluronic acid,HAMA),再引入GelMA和甲基丙烯酰化肝素(heparin methacryloyl,HepMA)赋予了该水凝胶优异的力学性能和生物学特征;该水凝胶表现出优异的抗溶胀性能,从其爆破压力、半渗透性和顺应性测试结果显示具有与血管相匹配的参数,证明了该空心水凝胶管可作为人工心血管替代品的潜在材料。
3.1.3. 内部软组织修复
内部软组织缺损通常是由手术切除、软组织感染等引起的[27]。在体内微环境中,能促进组织愈合并具有抗溶胀特性的水凝胶,是理想的细胞外基质修复材料。Liang等[28]开发了一种新型生物相容性多孔聚乙烯醇水凝胶(janus porous polyvinyl alcohol,JPVA),通过物理交联法制备,实现了内部软组织受损后的有效修复,JPVA具有独特的抗溶胀性能(最大溶胀比:6.4%),显示出高效修复内部软组织特性。Chen等[29]利用化学交联法合成了耐酸水凝胶(acid-tolerant hydrogel,ATGel)生物黏合剂,该黏合剂具有无缝封闭和缓解炎症的作用,还展现出抑制纤维化和促进血管生成效果,通过28 d的大鼠胃穿孔修复模型实验证实,该水凝胶黏合剂表现出较好的抗溶胀性能。
3.1.4. 骨组织修复
水凝胶作为骨缺损修复的材料,可为新骨组织生长提供桥梁,并为细胞和生长因子提供平台;但是常规水凝胶固有的溶胀特性必然会压迫软组织,对其他组织或者器官造成继发性损伤[30],因此开发抗溶胀水凝胶是必要的。Zhang等[31]将聚γ-谷氨酸(poly (γ-glutamic acid),γ-PGA)水凝胶浸泡在氯化镧(LaCl3)水溶液中,以物理/化学交联法制备了一种抗溶胀和高强度的La3+-γ-谷氨酸水凝胶,通过调节LaCl3溶液浓度及浸泡时间,可有效调节La3+-γ-谷氨酸水凝胶的溶胀率及力学性能,体外成骨细胞实验表明La3+-γ-PGA水凝胶具备良好的生长环境,可用于促进软骨修复和再生。You等[30]通过化学交联法构建了一种磷酸氢根离子(HPO42-)交联的生物聚合物水凝胶。该水凝胶表现出可控的溶胀比,体内外实验表明该水凝胶显著促进成骨细胞分化,加速新骨生成,是作为骨修复的优选材料。Wu等[32]通过物理/化学交联法制备出一种抗溶胀水凝胶,首先通过化学交联将明胶/聚乙二醇二丙烯酸酯/2-(二甲基氨基)甲基丙烯酸乙酯(gelatin/polyethylene glycol diacrylate/2-(dimethylamino)ethyl methacrylate,GPEGD)交联成型,然后在GPEGD上物理交联骨形态发生蛋白2(bone morphogenetic protein-2,BMP-2)负载多巴胺/肝素纳米颗粒(BMP-2 loaded polydopamine/heparin nanoparticles, BPDAH),成功制备复合水凝胶,该水凝胶机械性能可与颌骨相匹配。由于有共价和非共价键作用,该水凝胶具有优异的抗溶胀性能,还具有生物降解性和聚多巴胺持续释放性能。体内外实验结果表明,该水凝胶能显著促进细胞分化及矿化沉积,可作为下颌骨修复材料以促进组织再生。
3.2. 体外伤口修复的应用
体外创伤和手术伤口的高发率推动体外伤口敷料的快速发展,传统的缝合线和缝合钉会对组织造成二次伤害。亲水性粘合剂水凝胶具有高含水量和适宜的机械性能,可以提供潮湿的微环境且具备促进细胞增殖等功能,可作为体外伤口敷料[33],但其易过分的溶胀导致体积增大、内聚力减弱和黏附性下降,也有引起伤口再次破裂和出血的风险[34]。因此,开发具备快速黏附和抗溶胀性为一体的水凝胶是外科手术中有利辅助。Bian等[35]利用化学交联法开发了一种热敏收缩纳米胶束复合小分子黏附基团凝胶剂,成功制备了抗溶胀性能的可注射水凝胶(rapid-adhesion and anti-swelling properties,RAAS),该水凝胶在紫外照射下2 s内实现湿黏附,并在整个降解过程中表现出优异的抗溶胀性能;小鼠实验表明,该水凝胶具有快速止血和密封伤口的作用,且伤口修复效果良好。糖尿病溃疡导致皮肤溃烂的伤口修复是一大难题,Wei等[36]通过化学交联法开发了一种具有大孔结构和抗溶胀性能的新型海绵状大孔水凝胶(sponge-like macro-porous,SM),孔径约为200~300 μm,并且在SM中引入甲基丙烯酰胺多巴胺和丙烯酸,获得了具有生物学特征的复合水凝胶。该复合水凝胶在为期14 d的动物实验中表现出卓越的抗溶胀性能,对糖尿病引发的皮肤溃烂伤口有很好的修复效果。
3.3. 生物传感器的应用
随着导电水凝胶的快速发展,现已逐步应用于健康监测、人体运动检测、人机界面及软机器人等方向[37],然而大多数水凝胶传感器在液体中会溶胀,这使得将其作为植入式传感器使用受到影响。
为解决植入式水凝胶传感器溶胀的问题,Xia等[38]采用化学交联法制备了互穿聚合物网络(interpenetrating polymer network,IPN)水凝胶,由于IPN中特殊的芳基乙酰化物主链,该水凝胶具有电子传导、抗菌、抗溶胀性和组织黏附性能;当植入大鼠心脏区域时,该水凝胶电极显示心外膜心电图的原位记录,同时信号稳定,四周无信号衰减,该水凝胶的开发为植入式传感器开辟了新领域。Gao等[39]通过物理交联法制备了水凝胶传感器,由于PVA和支链淀粉(amylopectin,Amy)之间致密的氢键网络和氯化钠(NaCl)诱导的盐析效应,使该水凝胶在各种液体介质中表现出显著的抗溶胀性能(如在海水中的溶胀率=3.55%),结果表明该种含Amy质量百分比为4%的水凝胶具有稳定的导电性能和抗溶胀性能,可用于植入式传感器实时检测。Di等[40]通过物理/化学交联法制备了DN水凝胶。由于该水凝胶浸入三价铁离子(Fe3+)生成了过渡态双交联配位水凝胶,且引入了疏水单体和氢键作用,赋予了该水凝胶优异的抗溶胀性能,而动态离子(Fe3+、Na+、Cl-)使得水凝胶表现出快速响应(47.4 ms)和高灵敏度,可用于体内健康监测、运动识别和信息加密传输等领域。
4. 总结与展望
随着抗溶胀水凝胶的研究发展,其在生物医学领域发展的空间越来越大,包括组织工程和再生医学、组织移植物和植入式人工器官、医用密封剂和生物粘合剂、生物传感器和生物电子等方向。然而,面对个性化的设计要求,复杂的生理环境,包括pH、温度、湿度、伤口等变化的不确定性,开发综合优异的抗溶胀水凝胶仍然是一个巨大的挑战。未来,尚需在以下方面寻求突破和改善:首先,需要进一步优化材料特性,包括控制其在微环境中受温度、湿度和pH等因素影响的稳定性;其次,为符合临床转化的需求,需确保抗溶胀水凝胶的生物相容性和安全性;最后,还需对抗溶胀水凝胶的溶胀可控性、降解性和黏附性等相互之间的参数进行优化,以满足个性化医学的需求,实现精准化治疗。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突。
作者贡献声明:宋昌隆为本文框架构思、文章撰写人;付翔、唐璐负责相关文献资料收集整理;董志红负责论文选题以及指导、修改和审校。
Funding Statement
四川省科技厅科技成果转化示范项目(2023ZHCG0051);省级大学生创新创业训练计划创业实践与创业训练项目(S202311079008X);四川省教育厅高等教育人才培养质量和教学改革项目(JG2021-1111);成都大学CC国家众创空间创新创业教育专项项目(ccyg202301003)
Sichuan Provincial Department of Science and Technology; Sichuan Provincial Department of Education; Sichuan Provincial Department of Education; Chengdu University CC National Crowd Space
References
- 1.Feinle A, Elsaesser M S, Huesing N Sol–gel synthesis of monolithic materials with hierarchical porosity. Chem Soc Rev. 2016;45(12):3377–3399. doi: 10.1039/C5CS00710K. [DOI] [PubMed] [Google Scholar]
- 2.Ullah F, Othman M B, Javed F, et al Classification, processing and application of hydrogels: A review. Mater Sci Eng C Mater Biol Appl. 2015;57:414–433. doi: 10.1016/j.msec.2015.07.053. [DOI] [PubMed] [Google Scholar]
- 3.Cai M H, Chen X Y, Fu L Q, et al Design and development of hybrid hydrogels for biomedical applications: recent trends in anticancer drug delivery and tissue engineering. Front Bioeng Biotechnol. 2021;9:630943. doi: 10.3389/fbioe.2021.630943. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Li L, Scheiger J M, Levkin P A Design and applications of photoresponsive hydrogels. Adv Mater. 2019;31(26):e1807333. doi: 10.1002/adma.201807333. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Kaunisto E, Marucci M, Borgquist P, et al Mechanistic modelling of drug release from polymer-coated and swelling and dissolving polymer matrix systems. Int J Pharm. 2011;418(1):54–77. doi: 10.1016/j.ijpharm.2011.01.021. [DOI] [PubMed] [Google Scholar]
- 6.Zhan Y, Fu W, Xing Y, et al Advances in versatile anti-swelling polymer hydrogels. Mater Sci Eng C Mater Biol Appl. 2021;127:112208. doi: 10.1016/j.msec.2021.112208. [DOI] [PubMed] [Google Scholar]
- 7.Oryan A, Kamali A, Moshiri A, et al. Chemical crosslinking of biopolymeric scaffolds: current knowledge and future directions of crosslinked engineered bone scaffolds. Int J Biol Macromol, 2018, 107(Pt A): 678-688.
- 8.Hennink W E, van Nostrum C F Novel crosslinking methods to design hydrogels. Adv Drug Deliv Rev. 2012;64:223–236. doi: 10.1016/j.addr.2012.09.009. [DOI] [PubMed] [Google Scholar]
- 9.Huang H, Shen J, Wan S, et al Wet-adhesive multifunctional hydrogel with anti-swelling and a skin-seamless interface for underwater electrophysiological monitoring and communication. ACS Appl Mater Interfaces. 2023;15(9):11549–11562. doi: 10.1021/acsami.2c21595. [DOI] [PubMed] [Google Scholar]
- 10.Muir V G, Burdick J A Chemically modified biopolymers for the formation of biomedical hydrogels. Chem Rev. 2021;121(18):10908–10949. doi: 10.1021/acs.chemrev.0c00923. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Huang G, Tang Z F, Peng S W, et al Modification of hydrophobic hydrogels into a strongly adhesive and tough hydrogel by electrostatic interaction. Macromolecules. 2021;55(1):156–165. [Google Scholar]
- 12.Saunders L, Ma P X Self-healing supramolecular hydrogels for tissue engineering applications. Macromol Biosci. 2019;19(1):e1800313. doi: 10.1002/mabi.201800313. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Wang T, Ren X, Bai Y, et al Adhesive and tough hydrogels promoted by quaternary chitosan for strain sensor. Carbohydr Polym. 2021;254:117298. doi: 10.1016/j.carbpol.2020.117298. [DOI] [PubMed] [Google Scholar]
- 14.Dai X, Zhang Y, Gao L, et al A Mechanically strong, highly stable, thermoplastic, and self-healable supramolecular polymer hydrogel. Adv Mater. 2015;27(23):3566–3571. doi: 10.1002/adma.201500534. [DOI] [PubMed] [Google Scholar]
- 15.Qi C, Dong Z, Huang Y, et al Tough, anti-swelling supramolecular hydrogels mediated by surfactant–polymer interactions for underwater sensors. ACS Appl Mater Interfaces. 2022;14(26):30385–30397. doi: 10.1021/acsami.2c06395. [DOI] [PubMed] [Google Scholar]
- 16.Pi M H, Qin S H, Wen S H, et al Rapid gelation of tough and anti-swelling hydrogels under mild conditions for underwater communication. Adv Funct Mater. 2023;33(1):2210188. doi: 10.1002/adfm.202210188. [DOI] [Google Scholar]
- 17.Pang J, Bi S, Kong T, et al Mechanically and functionally strengthened tissue adhesive of chitin whisker complexed chitosan/dextran derivatives based hydrogel. Carbohydr Polym. 2020;237:116138. doi: 10.1016/j.carbpol.2020.116138. [DOI] [PubMed] [Google Scholar]
- 18.Fan H L, Wang J H, Jin Z X Tough, swelling-resistant, self-healing, and adhesive dual-cross-linked hydrogels based on polymer–tannic acid multiple hydrogen bonds. Macromolecules. 2018;51(5):1696–1705. doi: 10.1021/acs.macromol.7b02653. [DOI] [Google Scholar]
- 19.Lu S, Zhu L, Wang Q, et al High-strength albumin hydrogels with hybrid cross-linking. Front Chem. 2020;8:106. doi: 10.3389/fchem.2020.00106. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Mackey A L, Kjaer M Connective tissue regeneration in skeletal muscle after eccentric contraction-induced injury. J Appl Physiol (1985) 2017;122(3):533–540. doi: 10.1152/japplphysiol.00577.2016. [DOI] [PubMed] [Google Scholar]
- 21.Gendron R, Grenier D, Maheu-Robert L The oral cavity as a reservoir of bacterial pathogens for focal infections. Microbes Infect. 2000;2(8):897–906. doi: 10.1016/S1286-4579(00)00391-9. [DOI] [PubMed] [Google Scholar]
- 22.Wu J, Pan Z, Zhao Z Y, et al Anti-swelling, robust, and adhesive extracellular matrix-mimicking hydrogel used as intraoral dressing. Adv Mater. 2022;34(20):e2200115. doi: 10.1002/adma.202200115. [DOI] [PubMed] [Google Scholar]
- 23.Zhu J, Li Y, Xie W, et al Low-swelling adhesive hydrogel with rapid hemostasis and potent anti-inflammatory capability for full-thickness oral mucosal defect repair. ACS Appl Mater Interfaces. 2022;14(48):53575–53592. doi: 10.1021/acsami.2c18664. [DOI] [PubMed] [Google Scholar]
- 24.Fleischer S, Tavakol D N, Vunjak-Novakovic G From arteries to capillaries: approaches to engineering human vasculature. Adv Funct Mater. 2020;30(37):1910811. doi: 10.1002/adfm.201910811. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Hou J, Zhang X, Wu Y, et al Amphiphilic and fatigue-resistant organohydrogels for small-diameter vascular grafts. Sci Adv. 2022;8(30):eabn5360. doi: 10.1126/sciadv.abn5360. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Wang Xuebin, Mao Huanv, Xiang Yanxin, et al Preliminary study on acrylated Pluronic F127-based hydrogels as artificial blood vessel materials. J Mater Sci. 2022;57(37):17735–17750. doi: 10.1007/s10853-022-07718-3. [DOI] [Google Scholar]
- 27.Gu Y, Wang P, Li H, et al Chinese expert consensus on adult ventral abdominal wall defect repair and reconstruction. Am J Surg. 2021;222(1):86–98. doi: 10.1016/j.amjsurg.2020.11.024. [DOI] [PubMed] [Google Scholar]
- 28.Liang W, He W, Huang R, et al Peritoneum-inspired Janus porous hydrogel with anti-deformation, anti-adhesion, and pro-healing characteristics for abdominal wall defect treatment. Adv Mater. 2022;34(15):e2108992. doi: 10.1002/adma.202108992. [DOI] [PubMed] [Google Scholar]
- 29.Chen X, Zhang J, Chen G, et al Hydrogel bioadhesives with extreme acid-tolerance for gastric perforation repairing. Adv Funct Mater. 2022;32(29):2202285. doi: 10.1002/adfm.202202285. [DOI] [Google Scholar]
- 30.You Z, Yu Y, Wang T H, et al Divalent anion-induced biohydrogels with high strength, anti-swelling, and bioactive capability for enhanced skull bone regeneration. ACS Appl Mater Interfaces. 2023;15(26):31243–31255. doi: 10.1021/acsami.3c04729. [DOI] [PubMed] [Google Scholar]
- 31.Zhang C, Wu H, Chen J, et al La3+ modified poly (γ-glutamic acid) hydrogels with high strength and anti-swelling property for cartilage regeneration. J Appl Polym Sci. 2021;138(38):50978. doi: 10.1002/app.50978. [DOI] [Google Scholar]
- 32.Wu Y, Li X, Sun Y, et al Multiscale design of stiffening and ROS scavenging hydrogels for the augmentation of mandibular bone regeneration. Bioact Mater. 2023;20:111–125. doi: 10.1016/j.bioactmat.2022.05.021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Zhao Y, Song S, Ren X, et al Supramolecular adhesive hydrogels for tissue engineering applications. Chem Rev. 2022;122(6):5604–5640. doi: 10.1021/acs.chemrev.1c00815. [DOI] [PubMed] [Google Scholar]
- 34.Sun J, Xiao L, Li B, et al Genetically engineered polypeptide adhesive coacervates for surgical applications. Angew Chem Int Ed Engl. 2021;60(44):23687–23694. doi: 10.1002/anie.202100064. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Bian S Q, Hao L Z, Qiu X, et al An injectable rapid-adhesion and anti-swelling adhesive hydrogel for hemostasis and wound sealing. Adv Funct Mater. 2022;32(46):2207741. doi: 10.1002/adfm.202207741. [DOI] [Google Scholar]
- 36.Wei C, Tang P, Tang Y, et al Sponge-like macroporous hydrogel with antibacterial and ROS scavenging capabilities for diabetic wound regeneration. Adv Healthc Mater. 2022;11(20):e2200717. doi: 10.1002/adhm.202200717. [DOI] [PubMed] [Google Scholar]
- 37.Zhu T, Ni Y, Biesold G M, et al Recent advances in conductive hydrogels: classifications, properties, and applications. Chem Soc Rev. 2023;52(2):473–509. doi: 10.1039/D2CS00173J. [DOI] [PubMed] [Google Scholar]
- 38.Xia X, Liang Q, Sun X, et al Intrinsically electron conductive, antibacterial, and anti-swelling hydrogels as implantable sensors for bioelectronics. Adv Funct Mater. 2022;32(48):2208024. doi: 10.1002/adfm.202208024. [DOI] [Google Scholar]
- 39.Gao Y, Wang Y, Dai Y, et al Amylopectin based hydrogel strain sensor with good biocompatibility, high toughness and stable anti-swelling in multiple liquid media. Eur Polym J. 2022;164:110981. doi: 10.1016/j.eurpolymj.2021.110981. [DOI] [Google Scholar]
- 40.Di X, Hou J, Yang M, et al A bio-inspired, ultra-tough, high-sensitivity, and anti-swelling conductive hydrogel strain sensor for motion detection and information transmission. Mater Horiz. 2022;9(12):3057–3069. doi: 10.1039/D2MH00456A. [DOI] [PubMed] [Google Scholar]