Abstract
目的
合成新型补骨脂酚氨基胍衍生物,并探讨其对人三阴性乳腺癌MDA-MB-231细胞死亡的影响。
方法
以补骨脂酚为起始化合物,通过甲酰化和席夫碱反应获得补骨脂酚衍生物1、2,并经氢谱、碳谱和高分辨质谱鉴定其结构;用噻唑蓝(MTT)法检测补骨脂酚及其衍生物对细胞存活率的影响;利用荧光显微镜、Anexxin V/PI双染结合流式细胞术法检测补骨脂酚及其衍生物对MDA-MB-231细胞凋亡的影响;蛋白质印迹法检测凋亡相关蛋白的表达;JC-1试剂盒检测细胞线粒体膜电位;DCFH-DA法检测细胞内的活性氧水平。
结果
根据波谱数据的分析,本研究合成获得1个新结构的补骨脂酚氨基胍衍生物,其化学名为2-{(E)-5- [(S,E)-3,7-dimethyl-3-vinylocta-1,6-dien-1-yl]-2-hydroxybenzylidene} hydrazine-1-carboximidamide(衍生物2)。MTT法结果显示,补骨脂酚及其衍生物对MDA-MB-231细胞均表现出一定的细胞毒性,其中衍生物2对MDA-MB-231细胞显示较强的细胞毒性,其作用24、48、72 h的IC50值分别为(13.11±1.09)、(6.91±1.78)和(2.23±1.32)μmol/L,但对小鼠正常肝细胞AML-12毒性较低,作用72 h的IC50值为(31.23±1.58)μmol/L。荧光显微镜下观察和流式细胞术检测结果显示,衍生物2诱导乳腺癌细胞凋亡,且呈浓度依赖性。进一步研究发现,衍生物2作用后的MDA-MB-231细胞中Bax/Bcl-2比值增加,细胞色素C蛋白表达水平上调,胱天蛋白酶3激活,线粒体膜电位下降、细胞内活性氧水平显著增高。
结论
新型补骨脂酚氨基胍衍生物可诱导MDA-MB-231细胞发生凋亡,且对正常肝细胞的毒性较小,可作为抗三阴性乳腺癌的先导化合物。
Keywords: 补骨脂酚, 氨基胍, 三阴性乳腺癌, 凋亡, 线粒体功能
Abstract
Objective
To synthesize new bakuchiol aminoguanidine derivatives and test their effect on viability and apoptosis of human triple-negative breast cancer (TNBC) cells.
Methods
Two bakuchiol derivatives 1 and 2 were obtained by formylation and Shiff base reaction of bakuchol. The structures of derivatives 1 and 2 were identified by 1H-NMR, 13C-NMR, and high-resolution electrospray ionization mass spectrometry (HR-ESI-MS) analysis. Human TNBC MDA-MB-231 cells were treated with bakuchiol and its derivatives and cell viability was measured by MTT assay. Apoptosis was detected by fluorescence microscopy and flow cytometry with Annexin V-FITC/PI staining. The expressions of apoptosis-related proteins were analyzed with Western blotting. The JC-1 and reactive oxygen species (ROS) assay kits were used to determine the effect of new bakuchiol derivatives on mitochondrial function.
Results
Based on spectroscopic analysis, a new bakuchiol schiff base derivative was elucidated as 2-{(E)-5-[(S, E)-3, 7-dimethyl-3-vinylocta-1, 6-dien-1-yl]-2-hydroxylbenzylidene} hydrazine-1-carboximidamide (derivative 2). Bakuchiol and its derivatives 1 and 2 all showed cytotoxic activity against the MDA-MB-231 cells. Derivative 2 exhibited the most potent cytotoxic activity to MDA-MB-231 cell with IC50 of (13.11±1.09), (6.91±1.78), and (2.23±1.32) μmol/L after 24, 48, and 72 h. It had low toxicity to normal mouse liver (AML-12) cells with IC50 of (31.23±1.58) μmol/L at 72 h. Fluorescence microscopy and flow cytometry demonstrated apoptosis in breast cancer cells after treating with derivative 2 in a concentration dependent manner. Western blotting showed that after derivative 2 treatment, the expression of apoptosis-related proteins cytochrome C, cleaving caspase-3 and Bax/Bcl-2 radio in MDA-MB-231 cells increased; in addition, apoptosis was associated with the decreased mitochondrial membrane potential and increased reactive oxygen species accumulation.
Conclusion
The novel bakuchiol aminoguanidine derivative (derivative 2) is capable of inducing apoptosis in MDA-MB-231 cells, but has low toxicity to normal liver cells, suggesting that it may be used as a lead compound for an anti-TNBC agent.
Keywords: Bakuchiol, Aminoguanidine, Triple-negative breast cancer, Apoptosis, Mitochondrial function
乳腺癌是最常见的女性恶性肿瘤之一,严重危害着女性的生命和健康[1-2]。乳腺癌通常分为luminal A型、luminal B型、Her-2阳性型和三阴性型四种分子类型,其中TNBC约占乳腺癌的15%[3]。相比于其他亚型,TNBC具有恶性程度高、发病年龄轻、易发生转移和复发、预后不良等临床特点[4]。目前,临床上治疗TNBC的方案主要是手术、辅助化疗和放疗[5],迫切需要研究及开发能有效治疗TNBC的化疗药物。
相比于合成化疗药物,天然产物具有结构多样和新颖、多靶点以及低毒性等优势,已逐渐成为发掘抗肿瘤创新药物的重要来源之一[6]。补骨脂酚(bakuchiol)是传统中药补骨脂(Psoralea corylifolia L.)的有效成分之一,含量高达1%~7%,其化学结构属于单萜酚类化合物[7]。研究表明,补骨脂酚具有抗肿瘤、抗氧化、抗菌、抗炎等多种药理作用,特别是在抗肿瘤方面具有较好的潜在应用前景[8-10]。近年来,药物化学家们对补骨脂酚的化学结构进行结构修饰和改造,显著提高了其抗肿瘤活性,同时阐明了其作用机制,为补骨脂酚的持续研究奠定了较好的基础[11-15]。然而,补骨脂酚也与大多数天然产物一样具有活性强度不足、水溶性差等缺点,严重限制其临床应用。天然产物或先导化合物结构中引入氨基胍基团、含氮杂环等,可提高母体化合物的水溶性,增强药理活性及改善药代动力学性质[16-18]。本研究将以补骨脂酚为母体化合物,半合成制备补骨脂酚氨基胍衍生物,探讨其诱导人TNBC细胞死亡的作用及初步机制。
1. 材料与方法
1.1. 细胞、主要仪器与试剂
乳腺癌细胞(MDA-MB-231)和小鼠正常肝细胞(AML-12)购自中国科学院上海细胞库,并保存于液氮中。将实验中所需的细胞复苏后,用含10%胎牛血清的DMEM高糖培养,在5%二氧化碳、37 ℃的饱和湿度无菌培养箱中培养、传代。
XP205电子天平为瑞士梅特勒托利多科技有限公司产品;BioTek多功能酶标仪为美国BioTek公司产品;BD FACSVerse流式细胞仪为美国BD公司产品;IX-71荧光显微镜为日本Olympus公司产品;Bruker Avance Ⅱ核磁共振仪为德国Bruker公司产品;LTQ OrbitrapXL型质谱仪为美国Bruker公司产品;补骨脂酚由本课题组从补骨脂甲醇浸膏中提取分离得到,纯度高于95%[7];氨基胍碳酸盐、多聚甲醛、碳酸氢钠为上海麦克林生化科技有限公司产品;乙酸、三乙胺、氯化镁、z-VAD-FMK、NAC为德国Sigma-Aldrich公司产品;石油醚、乙酸乙酯、二氯甲烷、甲醇等有机溶剂为上海泰坦科技股份有限公司产品;硅胶、薄层层析色谱为青岛海洋化工有限公司产品;DMEM高糖培养液、0.25%胰蛋白酶、胎牛血清为美国Gibco公司产品;RIPA裂解液、蛋白分子量标准、BCA蛋白定量试剂盒、Annexin V-FITC细胞凋亡检测试剂盒、线粒体膜电位检测试剂盒、活性氧检测试剂盒为上海碧云天生物技术有限公司产品;DMSO、MTT为德国Sigma公司产品;Bax一抗、Bcl-2一抗为美国Proteintech公司产品;Cyt C一抗、caspase-3一抗为法国Abclonal公司产品;ELC发光液、PVDF膜为美国Millipore公司产品。
1.2. 补骨脂酚衍生物的合成
1.2.1. 合成衍生物1
根据文献[19]中的方法,称取补骨脂酚(5.0 g,19.5 mmol)、多聚甲醛(5.27 g,58.5 mmol)、氯化镁(5.56 g,20 mmol)、三乙胺(5.91 g,58.5 mmol)及无水四氢呋喃(80 mL),在氮气保护下加热回流反应4 h,并用薄层层析色谱监控反应。待反应结束后,用稀盐酸调节酸碱度至酸性,并用乙酸乙酯萃取两次,减压浓缩得到乙酸乙酯提取浸膏。乙酸乙酯浸膏经硅胶柱色谱(300~400目),用石油醚-乙酸乙酯进行梯度洗脱,获得衍生物1(5.2 g)。
1.2.2. 合成衍生物2
称取衍生物1(568 mg,2 mmol)、氨基胍碳酸盐(150 mg,2 mmol)溶于无水乙醇(40 mL),在50 ℃搅拌反应4 h,并用薄层层析色谱监控反应。待反应结束后,加入适量碳酸氢钠溶液洗涤,并用乙酸乙酯萃取两次,减压浓缩。将获得的乙酸乙酯浸膏经硅胶柱色谱,用石油醚-乙酸乙酯进行梯度洗脱,获得衍生物2(595.9 mg)。
1.3. MTT法检测细胞活性
取处于对数生长期的细胞,按5000个/孔密度接种于96孔板中,培养过夜。待细胞贴壁后,每孔加入不同浓度的化合物(0、5、10、20、40、80 μmol/L),分别继续培养24、48、72 h。然后,每孔加入5 mg/mL MTT溶液继续孵育4 h,吸去培养液,每孔加入DMSO溶液100 μL,并置于37 ℃烘箱中继续孵育15 min。采用多功能酶标仪在490 nm波长下检测各孔的吸光度值,计算细胞存活率,以化合物浓度为横坐标、细胞存活率为纵坐标绘制细胞生长曲线,并计算其IC50值。
1.4. 荧光显微镜观察细胞凋亡水平
取乳腺癌细胞按2.5×105个/孔的密度接种于六孔板中,继续培养过夜至贴壁。用不同浓度的衍生物2(0、10、20、40 μmol/L)处理后继续培养24 h,然后用PBS清洗两次,各孔加入4%多聚甲醛固定液1 mL,在室温固定15 min。然后,吸去固定液,避光条件下加入FITC结合液100 μL、PI染液5 μL和Annexin-FITC染液5 μL,室温下孵育30 min,并利用荧光显微镜观察细胞荧光强度的变化。
1.5. 流式细胞术检测细胞凋亡率
取乳腺癌细胞按2.5×105个/孔的密度接种于六孔板中,待细胞贴壁后用不同浓度的衍生物2(0、10、20、40 μmol/L)处理,继续培养24 h。培养结束后,细胞经PBS清洗三次、胰蛋白酶消化、离心后,转移至离心管。然后,每个离心管分别加入缓冲液500 μL和Annexin V-FITC染液5 μL混匀15 min后,再加入PI染液5 μL,在室温条件下避光孵育20 min,并使用流式细胞术进行检测分析。
1.6. 蛋白质印迹法检测细胞凋亡相关蛋白的表达
取乳腺癌细胞按1×106个/孔密度接种于直径10 cm的培养皿中,培养过夜至贴壁后,用不同浓度的衍生物2(0、10、20、40 μmol/L)处理继续培养24 h。培养结束后,将培养皿中的细胞转移至15 mL离心管中,并以1006×g离心10 min,倒掉上清液后,加入蛋白裂解液80 μL,裂解细胞30 min。待裂解结束,将细胞以13 400×g离心30 min,用BCA试剂盒测定蛋白质浓度。确定蛋白质上样量为30 μg、上样体积为10 μL,进行SDS聚丙烯酰胺凝胶电泳,PVDF转膜,用5%脱脂奶粉封闭4 h。PVDF膜用TBST溶液清洗四次,在4 ℃下一抗(Bax、Bcl-2、Cyt C、caspase-3等)孵育12 h。待一抗孵育结束后,用TBST清洗PVDF膜三次,每次5 min,并在室温下相应二抗孵育2.5~4.0 h后,经ECL曝光液显影,通过凝胶成像系统采集图像分析吸光度值。
1.7. JC-1试剂盒检测细胞线粒体膜电位
取乳腺癌细胞按2.5×105个/孔密度接种于六孔板中培养,待每孔细胞贴壁后,每孔加入不同浓度(0、10、20、40 μmol/L)的衍生物2后,再放入培养箱中继续培养。培养24 h后,用胰蛋白酶消化细胞,离心,用PBS洗涤三次,收集细胞。加入JC-1染色工作液500 μL,将细胞悬浮,并置于细胞培养箱中孵育20 min。待孵育结束后,再用PBS清洗三次,不同浓度样品的细胞中加入PBS缓冲液500 μL并转移至流式管中,用流式细胞仪检测分析。
1.8. DCFH-DA法检测细胞活性氧水平
将收集到的细胞用稀释好的DCFH-DA液(按1∶1000比例用无血清DMEM培养基稀释DCFH-DA,使其终浓度为10 μmol/L)悬浮细胞,置于细胞培养箱孵育20 min,每隔5 min轻轻颠倒混匀。待孵育结束后,再次离心、清洗,不同浓度样品的细胞中加入500 μL PBS并转移至流式管中,利用流式细胞仪检测活性氧的含量。
1.9. 统计学方法
采用ImageJ、ZEN、FlowJo软件进行数据分析,并用GraphPad Prism 9软件进行图表制作。实验结果以均值+标准差( ±s)描述,多组间比较采用单因素方差分析,P<0.05表示差异具有统计学意义。
2. 结果
2.1. 补骨脂酚衍生物的结构
以补骨脂酚为起始母体化合物,通过甲酰化反应制备了补骨脂酚醛基化衍生物(衍生物1)。进一步以衍生物1为中间体通过席夫碱反应合成得到补骨脂酚氨基胍衍生物(衍生物2),见图1。
图1. 补骨脂酚的化学结构及其衍生物的合成路线.
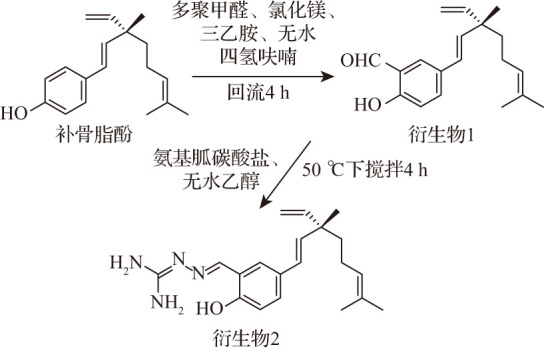
衍生物1为黄绿色油状物,收率为93.9%。1H-NMR(300 mHz,DMSO-d6 )结果为:δ H 10.72(1H,s,4-OH)、10.24(1H,s,-CHO)、7.65(1H,s,H-2)、7.60(1H,dd,J=8.4、3.0 Hz,H-6)、6.94(1H,d,J=8.4 Hz,H-5)、6.28(1H,d,J=16.5 Hz,H-7)、6.16(1H,d,J=16.5,H-8)、5.90(1H,dd,J=17.5、10.5 Hz,H-17)、5.09(1H,t,J=7.3 Hz,H-12)、5.02(m,H-18)、1.90(m,H-11)、1.62(3H,s,H-14)、1.53(3H,s,H-15)、1.46(m,H-10)、1.16(3H,s,H-16)。13C-NMR(75 mHz,DMSO-d6 )结果为:δ C 191.6、159.9、145.7、136.2、133.9、130.6、129.1、126.4、125.5、124.7、122.2、117.6、112.1、42.3、40.9、25.5、22.9、17.6。HR-ESI-MS显示准分子离子峰m/z[M+Na]+ 307.1668。根据以上波谱数据,衍生物1鉴定为已知化合物(S,E)-5-(3,7-dimethyl-3-vinylocta-1,6-dien-1-yl)-2-hydroxybenzaldehyde[19]。
衍生物2为黄绿色油状物,收率为87.6%。1H-NMR(300 mHz,DMSO-d6 )结果为:δ H 11.34(1H,s,4-OH)、8.18(1H,s,H-19)、7.41(1H,s,H-2)、7.21(1H,dd,J=8.4、2.1 Hz,H-6)、6.78(1H,d,J=8.4 Hz,H-5)、6.22(1H,d,J=16.2 Hz,H-7)、6.11(1H,d,J=16.2,H-8)、5.89(1H,dd,J=17.5、10.8 Hz,H-17)、5.80(2H,s,H-25)、5.62(2H,s,H-24)、5.10(1H,t,J=6.3 Hz,H-12)、5.01(2H,m,H-18)、1.90(2H,m,H-11)、1.63(3H,s,H-14)、1.53(3H,s,H-15)、1.45(2H,m,H-10)、1.16(3H,s,H-16)。13C-NMR(75 mHz,DMSO-d6 )结果为:δ C 159.22(C-23)、156.26(C-2)、150.67(C-20)、146.71(C-18)、145.88(C-8)、134.74(C-14)、130.57(C-13)、128.50(C-4)、126.65、126.28、120.79、120.38、115.83、111.94、42.21、40.96、25.52、23.06、22.91、17.53。HR-ESI-MS显示准分子离子峰m/z 363.2152[M+Na]+(计算C20H28N4ONa+为363.2155),推测衍生物2的分子式为C20H28N4O;经SciFinder查询,衍生物2为新化合物,其化学名命名为2-{(E)-5-[(S,E)-3,7-dimethyl-3-vinylocta-1,6-dien-1-yl]-2-hydroxyben-zylidene}hydrazine-1-carboximidamide。
2.2. 补骨脂酚及其衍生物抑制乳腺癌细胞生长
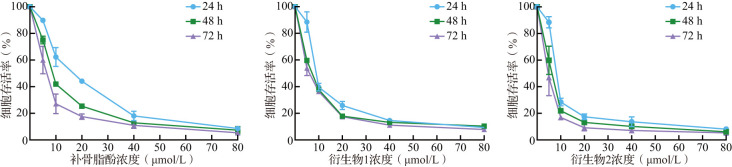
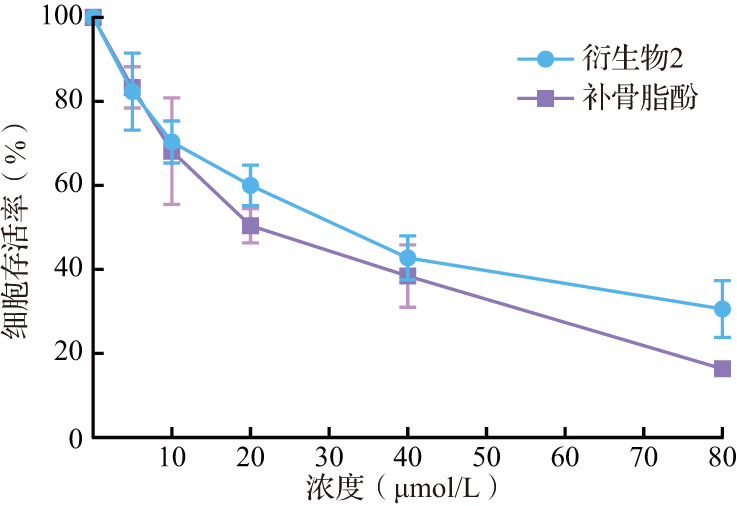
MTT结果显示,随着补骨脂酚及其衍生物给药浓度增加和作用时间延长,乳腺癌细胞存活率逐渐降低,其中衍生物2作用24、48、72 h的IC50值分别为(13.11±1.09)、(6.91±1.78)、(2.23±1.32)μmol/L(图2)。另外,衍生物2对小鼠正常肝细胞(AML-12)毒性较低,作用72 h的IC50值为(31.23±1.58)μmol/L(图3)。上述结果提示,相比补骨脂酚和衍生物1,衍生物2抑制乳腺癌细胞增殖的效果最好,且对于小鼠正常肝细胞(AML-12)杀伤较小。
图2. 乳腺癌细胞在不同浓度补骨脂酚及其衍生物作用下的存活曲线.
图3. 不同浓度补骨脂酚及其衍生物2作用于小鼠正常肝细胞72 h的细胞存活曲线.
2.3. 衍生物2诱导乳腺癌细胞凋亡
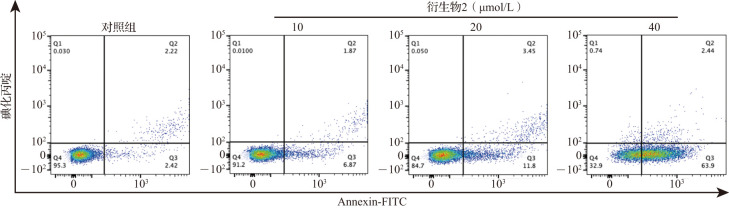
荧光显微镜结果显示,随着衍生物2给药浓度(10、20、40 μmol/L)增加,细胞早期凋亡和晚期凋亡均增强(图4)。流式细胞术检测结果进一步显示,对照组细胞凋亡率为4.64%,而不同浓度衍生物2均可导致细胞凋亡率增加(图5),10、20和40 μmol/L衍生物2作用24 h后的细胞凋亡率分别为8.74%、15.25%和66.34%,40 μmol/L衍生物2作用后的细胞凋亡率均高于其他三组(均P<0.05),而20 μmol/L时细胞凋亡率高于10 μmol/L时的细胞凋亡率。结果提示,衍生物2具有诱导乳腺癌MDA-MB-231细胞凋亡的作用,且这种作用与浓度存在一定的相关性。
图4. 乳腺癌细胞在衍生物2作用24 h后荧光显微镜观察结果.
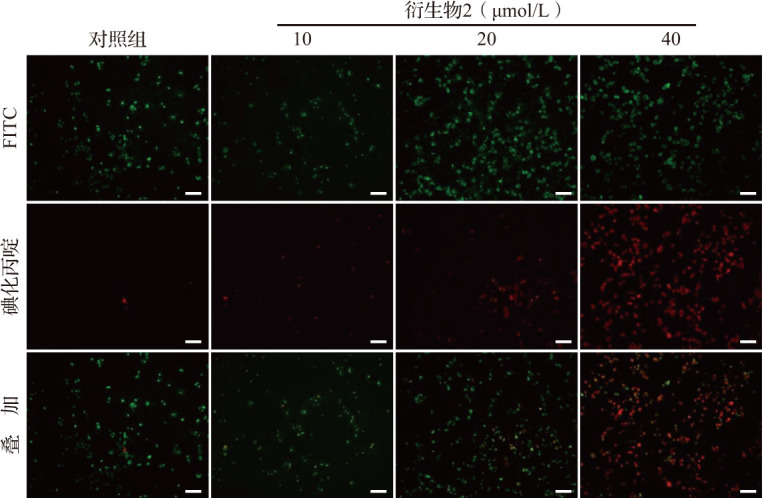
对照组可看见大量绿色荧光,但未见明显红色荧光. 而10 μmol/L衍生物2作用后可见绿色荧光减少但红色荧光增加,20、40 μmol/L衍生物2作用后均可见红色荧光大量增多,其中以40 μmol/L衍生物2作用更明显且绿色荧光几乎消失,提示凋亡细胞大量产生. 标尺=100 μm. FITC:异硫氰酸荧光素.
图5. 乳腺癌细胞在衍生物2作用24 h后流式细胞术检测结果.
FITC:异硫氰酸荧光素.
2.4. 衍生物2诱导乳腺癌细胞发生caspase-3依赖性凋亡
与对照组比较,随着衍生物2给药浓度的增加,乳腺癌细胞内抗凋亡蛋白Bcl-2的表达量逐渐降低,而促凋亡蛋白Bax表达量逐渐升高,从而使Bax/Bcl-2的比值也显著升高;线粒体凋亡信号通路被激活,即细胞内Cyt C蛋白表达量逐渐升高,并激活caspase-3剪切。见图6和表1。MTT实验结果显示,衍生物2与z-VAD-FMK(pan-caspase抑制剂,40 µmol/L)合用后细胞存活率为28.94%,明显高于单用衍生物2(40 µmol/L)时的细胞存活率(16.21%,P<0.05)。结果提示,衍生物2可诱导乳腺癌细胞发生caspase-3依赖性凋亡。
图6. 各组乳腺癌细胞内凋亡相关蛋白电泳图.

Bcl:B细胞淋巴瘤蛋白;Bax:Bcl-2关联X蛋白;actin:肌动蛋白;Cyt C:细胞色素C;caspase:胱天蛋白酶.
表1.
不同浓度衍生物2作用于乳腺癌细胞后的凋亡相关蛋白表达水平比较
| 衍生物2浓度(µmol/L) | Bax | Bcl-2 | Cyt C | caspase-3 |
|---|---|---|---|---|
| 0 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 | 1.00±0.00 |
| 10 | 1.38±1.48* | 0.88±0.57 | 1.61±1.24 | 0.91±0.47 |
| 20 | 2.08±0.93* | 0.72±0.84** | 2.60±1.02** | 0.84±0.92* |
| 40 | 2.33±1.03* | 0.53±1.26** | 2.84±0.87** | 0.64±0.68** |
与0 µmol/L浓度比较,* P<0.05,** P<0.01. Bcl:B细胞淋巴瘤蛋白;Bax:Bcl-2关联X蛋白;Cyt C:细胞色素C;caspase:胱天蛋白酶.
±s,n=3
2.5. 衍生物2抑制乳腺癌细胞线粒体功能
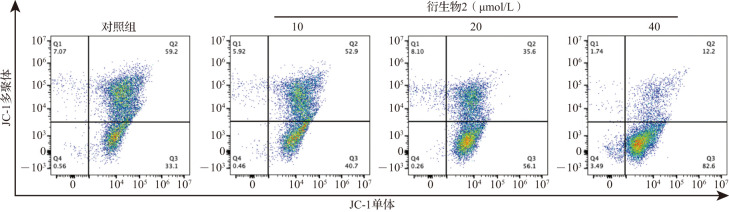
JC-1染色结合流式细胞术结果显示,随着衍生物2浓度的升高,MDA-MB-231细胞线粒体膜电位逐渐降低,见图7。细胞内活性氧含量随衍生物2浓度呈依赖性地升高,当衍生物2的浓度为10、20和40 μmol/L时细胞内活性氧水平均增高(均P<0.05),见表2。此外,以对照组细胞内活性氧为1.00±0.00,衍生物2与抗氧化剂NAC(20 µmol/L)预处理组的细胞内活性氧相对荧光强度显著低于单用衍生物2(40 µmol/L)组(分别为1.68±0.52和2.46±0.69,P<0.05)。以上结果提示,衍生物2导致乳腺癌细胞线粒体功能受损。
图7. 各组乳腺癌细胞线粒体膜电位流式细胞术检测结果.
表2.
不同浓度衍生物2作用于乳腺癌细胞的线粒体功能比较
|
衍生物2浓度 (µmol/L) |
n | 活性氧相对荧光强度 | 线粒体膜电位比值 |
|---|---|---|---|
| 0 | 3 | 1.00±0.00 | 1.78±0.87 |
| 10 | 3 | 4.18±1.15** | 1.31±1.02** |
| 20 | 3 | 5.13±0.96** | 0.63±0.91** |
| 40 | 3 | 5.79±1.23** | 0.15±0.78** |
与0 µmol/L浓度比较,** P<0.01.
±s
3. 讨论
在药物化学研究领域中,以天然产物为先导化合物,经过结构修饰与优化,提高其药效和降低毒性,往往可以衍生出一系列先导化合物或新药[20-21]。氨基胍衍生物显示出较好的抗细菌、抗真菌、抗炎等多种药理作用,逐渐成了药物化学领域研究的焦点,氨基胍可成为提高生物活性的药效团[22-24]。此外,Wang等[25]报道了查尔酮氨基胍衍生物具有较强的抑制人肝癌细胞HepG2和SMMC-7721增殖的活性。因此,本研究基于增强化合物的药理活性为总目标,以补骨脂酚为母体化合物,利用甲酰化反应和席夫碱反应在酚羟基的邻位引入氨基胍基团获得了1个新化合物,即新型补骨脂酚氨基胍衍生物(衍生物2),为今后持续研究提供了具有潜在应用前景的化合物。
人乳腺癌MDA-MB-231细胞是TNBC细胞系之一。因此,本研究以MDA-MB-231细胞为模型,以期为TNBC的临床治疗提供研究基础。细胞活性检测结果显示,随着给药浓度的增加,衍生物2抑制乳腺癌细胞存活的作用明显增强,作用72 h的IC50值为(2.23±1.32)μmol/L,而补骨脂酚作用72 h的IC50值为(14.86±1.07)μmol/L,比母体化合物的活性增强了6.66倍,并且呈现浓度和时间依赖性。相比对乳腺癌细胞较强的细胞毒性,衍生物2对小鼠正常肝细胞显示出较低的毒性。这些结果证实,氨基胍基团的引入不仅丰富了天然产物的结构多样性,而且增强了化合物的生物活性,与之前报道的研究结果基本一致[18,26]。
多年来,化疗一直是治疗TNBC主要辅助手段之一,而化疗耐药性及毒副作用是TNBC患者在化疗过程中所面临的难题[27-28]。本研究发现,新型补骨脂酚氨基胍衍生物(衍生物2)在体外对TNBC具有较好的抗癌活性,并且诱导乳腺癌细胞发生凋亡。凋亡是程序性细胞死亡方式之一,在维持细胞增殖和死亡的平衡中发挥着关键作用,已成为抗肿瘤药物研究的重要靶标[29]。caspase是广泛表达的半胱氨酸蛋白酶,在肿瘤细胞凋亡中发挥重要作用,如抗癌药物可通过激活caspase-3、caspase-8和caspase-9剪切诱导肿瘤细胞发生线粒体依赖性凋亡[30-31]。本文资料显示,随着衍生物2给药浓度的增加,乳腺癌细胞内Bcl-2蛋白表达逐渐下调,而Bax和Cyt C蛋白表达逐渐上调,caspase-3被激活,进而诱导细胞发生凋亡。此外,凋亡抑制剂z-VAD-FMK可以逆转衍生物2诱导的乳腺癌细胞凋亡。
线粒体作为真核细胞产生能量和活性氧的细胞器,在肿瘤细胞的能量代谢、维持氧化还原平衡以及细胞凋亡的调节过程中发挥着关键作用[32]。当线粒体功能发生障碍时,线粒体膜电位下降,肿瘤细胞内的活性氧水平显著升高,使细胞内氧化应激与抗氧化之间的平衡失调,导致细胞发生凋亡、程序性坏死等[33-35]。本研究结果证实,衍生物2诱导的乳腺癌细胞凋亡与线粒体功能失调密切相关。随着衍生物2给药浓度增加,乳腺癌细胞线粒体膜电位逐渐降低,而细胞内的活性氧水平显著升高。此外,NAC预处理可显著降低衍生物2诱导产生的细胞内活性氧水平。
综上所述,本文资料表明新型补骨脂酚氨基胍衍生物(衍生物2)能显著抑制TNBC细胞系MDA-MB-231增殖,同时诱导细胞凋亡,其主要通过上调Bax/Bcl-2比值和Cyt C蛋白表达、激活caspase-3剪切、同时细胞内产生和积累过量的活性氧实现。然而,衍生物2的体内抗TNBC活性以及诱导其他TNBC细胞死亡的作用及机制仍需要进一步研究。
Acknowledgments
研究得到安徽省高校自然科学研究项目(2022AH 051523)、蚌埠医学院512人才培育计划(By51202202)的支持. 感谢蚌埠医科大学安徽省生化药物技术研究中心提供的科研平台,感谢审稿专家及编辑的帮助
Acknowledgments
This work was supported by the Natural Scientific Research Project of Anhui Provincial University (2022AH051523), 512 Talent Development Program of Bengbu College (By51202202). We would like to thank the Anhui Province Biochemical Pharmaceutical Engineering Technology Research Center for providing a research platform, and thank the reviewers and editors for the help
[缩略语]
人表皮生长因子受体(human epidermal growth factor receptor,Her);三阴性乳腺癌(triple-negative breast cancer,TNBC);N-乙酰半胱氨酸(N-acetylcysteine,NAC);二甲基亚砜(dimethyl sulfoxide,DMSO);噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT);B细胞淋巴瘤蛋白(B-cell lymphoma,Bcl);Bcl-2关联X蛋白(Bcl-2 associated X protein,Bax);细胞色素C(cytochrome C,Cyt C);胱天蛋白酶(cysteine aspartic acid specific protease,caspase);增强化学发光(enhanced chemilu-minescence,ECL);聚偏二氟乙烯(polyvinylidene fluoride,PVDF);半抑制浓度(half maximal inhibitory concentration,IC50);磷酸盐缓冲液(phosphate buffered saline,PBS);异硫氰酸荧光素(fluorescein isothiocyanate,FITC);碘化丙啶(propidium iodide,PI);含吐温-20的Tris缓冲液(Tris buffered saline with Tween-20,TBST);2',7'-二氯荧光素二乙酸酯(2',7'-dichlorodihydrofluorescein diacetate,DCFH-DA);氢-1核磁共振波谱法(nuclear magnetic resonance spectroscopy,1H-NMR);碳-13核磁共振(13C nuclear magnetic resonance,13C-NMR);高分辨电喷雾电离质谱(high-resolution electrospray ionization mass spectrometry,HR-ESI-MS)
利益冲突声明
所有作者均声明不存在利益冲突
Conflict of Interests
The authors declare that there is no conflict of interests
参考文献(References)
- 1.SIEGEL R L, MILLER K D, WAGLE N S, et al. Cancer statistics, 2023[J]. CA Cancer J Clin, 2023, 73(1): 17-48. 10.3322/caac.21763 [DOI] [PubMed] [Google Scholar]
- 2.GIAQUINTO A N, SUNG H, MILLER K D, et al. Breast cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(6): 524-541. 10.3322/caac.21754 [DOI] [PubMed] [Google Scholar]
- 3.ANDERS C K, CAREY L A. Biology, metastatic patterns, and treatment of patients with triple-negative breast cancer[J]. Clin Breast Cancer, 2009, 9 (Suppl 2): S73-81. 10.3816/cbc.2009.s.008 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.YIN L, DUAN J J, BIAN X W, et al. Triple-negative breast cancer molecular subtyping and treatment progress[J]. Breast Cancer Res, 2020, 22(1): 61. 10.1186/s13058-020-01296-5 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.LI Y, ZHANG H, MERKHER Y, et al. Recent advances in therapeutic strategies for triple-negative breast cancer[J]. J Hematol Oncol, 2022, 15(1): 121. 10.1186/s13045-022-01341-0 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.NEWMAN D J, CRAGG G M. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019[J]. J Nat Prod, 2020, 83(3): 770-803. 10.1021/acs.jnatprod.9b01285 [DOI] [PubMed] [Google Scholar]
- 7.WU C Z, HONG S S, CAI X F, et al. Hypoxia-inducible factor-1 and nuclear factor-kappaB inhibitory mero-terpene analogues of bakuchiol, a constituent of the seeds of Psoralea corylifolia [J]. Bioorg Med Chem Lett, 2008, 18(8): 2619-2623. 10.1016/j.bmcl.2008.03.028 [DOI] [PubMed] [Google Scholar]
- 8.XIN Z, WU X, JI T, et al. Bakuchiol: a newly discovered warrior against organ damage[J]. Pharmacol Res, 2019, 141: 208-213. 10.1016/j.phrs.2019.01.001 [DOI] [PubMed] [Google Scholar]
- 9.CHOPRA B, DHINGRA A K, GREWAL A S, et al. Bakuchiol: a potential anticancer compound from Psoralea corylifolia Linn [J]. Anticancer Agents Med Chem, 2023, 23(9): 989-998. 10.2174/1871520623666230130102910 [DOI] [PubMed] [Google Scholar]
- 10.GUPTA N, SANGWAN P L, SHANKAR R, et al. Recent advances in the chemistry and biology of bakuchiol and its derivatives: an updated review[J]. Anticancer Agents Med Chem, 2023, 23(7): 747-764. 10.2174/1871520622666220812113057 [DOI] [PubMed] [Google Scholar]
- 11.MAJEED R, REDDY M V, CHINTHAKINDI P K, et al. Bakuchiol derivatives as novel and potent cytotoxic agents: a report[J]. Eur J Med Chem, 2012, 49: 55-67. 10.1016/j.ejmech.2011.12.018 [DOI] [PubMed] [Google Scholar]
- 12.CHA M R, CHOI C W, LEE J Y, et al. Anti-proliferative effect of synthesized bakuchiol analogues on cultured human tumor cell lines[J]. Bull Korean Chem Soc, 2012, 33(7): 2378-2380. 10.5012/bkcs.2012.33.7.2378 [DOI] [Google Scholar]
- 13.GAUTAM L N, LING T, LANG W, et al. Anti-prolif-erative evaluation of monoterpene derivatives against leukemia[J]. Eur J Med Chem, 2016, 113: 75-80. 10.1016/j.ejmech.2016.02.034 [DOI] [PubMed] [Google Scholar]
- 14.WU C Z, LIU D C, GUO X, et al. Synthesis and eval-uation of bakuchiol derivatives as potential anticancer agents[J]. Molecules, 2018, 23(3): 515. 10.3390/molecules23030515 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.LI H, LIU J, LIU C F, et al. Design, synthesis, and biological evaluation of membrane-active bakuchiol derivatives as effective broad-spectrum antibacterial agents[J]. J Med Chem, 2021, 64(9): 5603-5619. 10.1021/acs.jmedchem.0c02059 [DOI] [PubMed] [Google Scholar]
- 16.栗增, 王江, 周宇, 等. 先导化合物结构优化策略(三)——通过化学修饰改善水溶性[J]. 药学学报, 2014, 49(9): 1238-1247. [PubMed] [Google Scholar]; LI Zeng, WANG Jiang, ZHOU Yu, et al. Lead compound optimization strategy (3)—structure modification strat-egies for improving water solubility[J]. Acta Pharma-ceutica Sinica, 2014, 49(9): 1238-1247. (in Chinese) [PubMed] [Google Scholar]
- 17.DENG X, SONG M. Synthesis, antibacterial and anti-cancer activity, and docking study of aminoguanidines containing an alkynyl moiety[J]. J Enzyme Inhib Med Chem, 2020, 35(1): 354-364. 10.1080/14756366.2019.1702654 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.LI BH, MA H, ZHU J, et al. Semisynthesis and anti-cancer properties of novel honokiol derivatives in human nasopharyngeal carcinoma CNE-2Z cells[J]. J Enzyme Inhib Med Chem, 2023, 38(1): 2244694. 10.1080/14756366.2023.2244694 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.CHEN H, DU X, TANG W, et al. Synthesis and structure-immunosuppressive activity relationships of bakuchiol and its derivatives[J]. Bioorg Med Chem, 2008, 16(5): 2403-2411. 10.1016/j.bmc.2007.11.054 [DOI] [PubMed] [Google Scholar]
- 20.CHEN J, LI W, YAO H, et al. Insights into drug discovery from natural products through structural modification[J]. Fitoterapia, 2015, 103: 231-241. 10.1016/j.fitote.2015.04.012 [DOI] [PubMed] [Google Scholar]
- 21.HALLAND N, BRÖNSTRUP M, CZECH J, et al. Novel small molecule inhibitors of activated thrombin activat-able fibrinolysis inhibitor (TAFIa) from natural product anabaenopeptin[J]. J Med Chem, 2015, 58(11): 4839-4844. 10.1021/jm501840b [DOI] [PubMed] [Google Scholar]
- 22.GADAD A K, MAHAJANSHETTI C S, NIMBALKAR S, et al. Synthesis and antibacterial activity of some 5-guanylhydrazone/thiocyanato-6-arylimidazo[2, 1-b]-1, 3, 4-thiadiazole-2-sulfonamide derivatives[J]. Eur J Med Chem, 2000, 35(9): 853-857. 10.1016/s0223-5234(00)00166-5 [DOI] [PubMed] [Google Scholar]
- 23.MALVAR DDO C, FERREIRA R T, DE CASTRO R A, et al. Antinociceptive, anti-inflammatory and anti-pyretic effects of 1.5-diphenyl-1H-Pyrazole-3-carbohy-drazide, a new heterocyclic pyrazole derivative[J]. Life Sci, 2014, 95(2): 81-88. 10.1016/j.lfs.2013.12.005 [DOI] [PubMed] [Google Scholar]
- 24.DESAI N C, RAJPARA K M, JOSHI V V. Synthesis of pyrazole encompassing 2-pyridone derivatives as antibacterial agents[J]. Bioorg Med Chem Lett, 2013, 23(9): 2714-2717. 10.1016/j.bmcl.2013.02.077 [DOI] [PubMed] [Google Scholar]
- 25.WANG Y, LI L, MA T, et al. Design, synthesis, and apoptosis-promoting effect evaluation of chalcone deriv-atives containing aminoguanidine units[J]. Anticancer Agents Med Chem, 2022, 22(11): 2116-2124. 10.2174/1871520621666211026091226 [DOI] [PubMed] [Google Scholar]
- 26.CHEN J, ZHAO L, XU M F, et al. Novel isobava-chalcone derivatives induce apoptosis and necroptosis in human non-small cell lung cancer H1975 cells[J]. J Enzyme Inhib Med Chem, 2024, 39(1): 2292006. 10.1080/14756366.2023.2292006 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.LEE A, DJAMGOZ M. Triple negative breast cancer: Emerging therapeutic modalities and novel combination therapies[J]. Cancer Treat Rev, 2018, 62: 110-122. 10.1016/j.ctrv.2017.11.003 [DOI] [PubMed] [Google Scholar]
- 28.葛贤明, 周巧, 张语涵, 等. EGFR酪氨酸激酶抑制剂HS-10296诱导三阴性乳腺癌MDA-MB-231细胞发生自噬和凋亡[J]. 南方医科大学学报, 2020, 40(7): 981-987. [DOI] [PMC free article] [PubMed] [Google Scholar]; GE Xianming, ZHOU Qiao, ZHANG Yuhan, et al. EGFR tyrosine kinase inhibitor HS-10296 induces autophagy and apoptosis in triple negative breast cancer MDA-MB-231 cells[J]. Journal of Southern Medical Univer-sity, 2020, 40(7): 981-987. (in Chinese) [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.CARNEIRO B A, EL-DEIRY W S. Targeting apoptosis in cancer therapy[J]. Nat Rev Clin Oncol, 2020, 17(7): 395-417. 10.1038/s41571-020-0341-y [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.YU J, LIU C, JI H Y, et al. The caspases-dependent apoptosis of hepatoma cells induced by an acid-soluble polysaccharide from Grifola frondosa [J]. Int J Biol Macromol, 2020, 159: 364-372. 10.1016/j.ijbiomac.2020.05.095 [DOI] [PubMed] [Google Scholar]
- 31.HUANG Y C, KUO C L, LU K W, et al. 18α-Glycyr-rhetinic acid induces apoptosis of HL-60 human leukemia cells through caspases- and mitochondria-dependent signaling pathways[J]. Molecules, 2016, 21(7): 872. 10.3390/molecules21070872 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.LUO Y, MA J, LU W. The significance of mitochondrial dysfunction in cancer[J]. Int J Mol Sci, 2020, 21(16): 5598. 10.3390/ijms21165598 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.TULI H S, KAUR J, VASHISHTH K, et al. Molecular mechanisms behind ROS regulation in cancer: a bal-ancing act between augmented tumorigenesis and cell apoptosis[J]. Arch Toxicol, 2023, 97(1): 103-120. 10.1007/s00204-022-03421-z [DOI] [PubMed] [Google Scholar]
- 34.HSU S K, CHANG W T, LIN I L, et al. The role of necroptosis in ROS-mediated cancer therapies and its promising applications [J]. Cancers (Basel), 2020, 12(8): 2185. 10.3390/cancers12082185 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.NAKAMURA H, TAKADA K. Reactive oxygen species in cancer: current findings and future directions[J]. Cancer Sci, 2021, 112(10): 3945-3952. 10.1111/cas.15068 [DOI] [PMC free article] [PubMed] [Google Scholar]