Abstract
目的
通过网络药理学与分子对接技术探讨金银花对阿霉素(DOX)肝脏损伤的保护作用和机制,并运用DOX诱导小鼠肝脏损伤实验进行验证。
方法
通过网络药理学方法获得金银花靶点与疾病靶点之间的交集基因。利用STRING数据库构建交集基因PPI网络,利用Cytoscape软件进行分析,筛选核心靶点。采用DAVID数据库进行生物信息学分析,分子对接技术对核心成分和核心靶点进行验证。运用DOX诱导小鼠肝脏损伤验证网络药理学的预测结果。检测小鼠血清ALT、AST水平和肝脏组织HYP、ROS水平,HE染色和Masson染色观察肝脏组织病理变化,ELISA检测肝脏组织TNF-α、IL-6、COL-IV水平,Western blotting检测肝脏组织P53蛋白表达水平。
结果
从交集的43个基因中筛选出12个核心靶点,涉及癌症通路、IL-17信号通路、TNF等信号通路。分子对接结果显示,10个核心成分可以与不同的核心靶点结合。小鼠实验显示,与Sham组相比,DOX组血清AST和ALT水平升高(P<0.001);HE和Masson染色显示肝脏损伤和肝脏纤维化,ROS、TNF-α、IL-6、HYP、COL-IV和P53蛋白水平升高(P<0.001)。与DOX组相比,金银花处理组血清AST和ALT水平降低(P<0.001),肝脏损伤和肝脏纤维化改善,肝脏组织ROS、TNF-α、IL-6、HYP和COL-IV水平和P53蛋白表达降低(P<0.001),肝脏组织氧化应激、炎症和纤维化均减轻。
结论
金银花可通过作用于Trp53、TNF、IL-6靶点减轻肝脏氧化应激、炎症和纤维化程度,减轻DOX诱导的肝脏损伤。
Keywords: 网络药理学, 金银花, 阿霉素, 肝脏损伤, 氧化应激, 肝脏纤维化, 炎症
Abstract
Objective
To explore the mechanism underlying the protective effect of Lonicerae japonicae flos (LJF) extract against doxorubicin (DOX)-induced liver injury in mice.
Methods
Network pharmacology methods were used to obtain the intersection genes between LJF targets and disease targets, based on which the protein-protein interaction (PPI) network was constructed using STRING database for screening the core targets using Cytoscape software. DAVID database was used for bioinformatics analysis, and the core components and core targets were verified using molecular docking study. In a mouse model of DOX-induced liver injury, the effect of LJF extract on liver pathologies, serum levels of ALT and AST, and hepatic expressions of HYP, ROS, TNF-α, IL-6, COL-IV and P53 proteins were evaluated using HE and Masson staining, ELISA, and Western blotting.
Results
We identified 12 core targets from 43 intersection genes involving cancer pathway, IL-17 signaling pathway, and TNF signaling pathways. Molecular docking study suggested that 10 core components of LJF could bind to different core targets. The mice with DOX-induced liver injury showed elevated serum AST and ALT levels with obvious liver injury and fibrosis, increased ROS content, and enhanced expressions of TNF-α, IL-6, HYP, COL-IV and P53 proteins in the liver tissue. All these changes in the mouse models were significantly alleviated by treatment with LJF extract, suggesting obviously lowered levels of oxidative stress, inflammation and fibrosis in the liver tissues.
Conclusion
LJF extract is capable of alleviating DOX-induced liver injury in mice by downregulating Trp53, TNF and IL-6 to reduce liver oxidative stress, inflammation and fibrosis.
Keywords: network pharmacology, Lonicerae japonicae flos, doxorubicin, liver damage, oxidative stress, liver fibrosis, inflammation
阿霉素又名多柔比星(DOX),是一种强效且广谱的抗肿瘤药物,在对抗急性白血病、恶性淋巴瘤和各种实体瘤的治疗中发挥着重要作用,但同时存在一定器官组织的毒副作用。有研究表明,DOX可促进心脏和骨骼肌、肝脏、肾脏和其他部位的氧化应激和炎症反应[1-4],其中对肝脏的毒副作用是DOX治疗癌症中需考虑的重要临床因素之一。在接受DOX治疗的患者中,有多达30%的患者出现肝功能损伤[5]。虽然DOX诱导肝脏损伤的确切机制尚不完全清楚,但氧化应激和炎症因子的产生已被认为是DOX诱导肝脏损伤的重要诱发因素[6]。有文献报道DOX可引起肝脏抗氧化酶水平降低、肝脏纤维化、细胞凋亡、炎症和线粒体功能障碍[7-10]。因此,迫切需要寻找新的药物来减轻DOX对肝脏的毒副作用。
金银花(LJF)具有清热解毒、祛风解热的功效。现代药理学研究揭示金银花具有多样化的药理作用,有研究显示其不仅具有抗菌和抗炎的特性,还能发挥出色的抗氧化和抗病毒效果[11-16]。基于此,我们推测金银花在治疗DOX诱导的肝脏损伤及肝脏纤维化方面具有巨大的潜力。但是,目前金银花对DOX肝脏损伤的保护作用和相关机制报道较少,缺乏金银花的有效成分靶点与疾病相关靶点相互作用的研究。
因此,本研究运用网络药理学方法和分子对接技术,探索预测金银花对DOX肝脏损伤保护作用的有效成分靶点,并构建DOX诱导小鼠肝脏损伤实验模型进行验证。
1. 材料和方法
1.1. 主要材料与试剂
金银花提取物(新乡博凯生物科技公司);盐酸阿霉素(大连美仑生物技术有限公司);天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、羟脯氨酸(HYP)(南京建成生物工程研究所);白介素6(IL-6)ELISA试剂盒、肿瘤坏死因子-α(TNF-α)ELISA试剂盒、Ⅳ型胶原蛋白(COL-Ⅳ)ELISA试剂盒(江苏晶美生物科技有限公司);超氧化物阴离子荧光探针(DHE)、BCA蛋白试剂盒、PMSF、DAPI染液,5×蛋白上样缓冲液(碧云天);PVDF膜(Merck Millipore);PAGE凝胶试剂盒、无蛋白快速封闭液(雅酶生物公司);兔抗小鼠P53抗体(沈阳万类生物科技有限公司);兔抗小鼠GAPDH抗体、山羊抗兔二抗IgG-HRP(Biosharp)。
1.2. 实验动物
C57BL/6小鼠30只(SPF级,雄性)购自杭州子源实验动物科技有限公司(许可证号:SCXK(浙)2019-0004),6~8周龄,体质量18~22 g。在标准清洁环境中饲养,可自由进食和饮水,恒温22⁓25 ℃,保持12 h暗/光循环。本研究在进行动物实验操作时,严格遵循蚌埠医科大学所规定的伦理准则和要求(伦理审批号:[2022]第024号)。
1.3. 金银花、阿霉素肝脏损伤和肝脏纤维化靶点的预测
通过Herb数据库(http://herb.ac.cn/)对关键词金银花进行检索,得到金银花对应的成分靶点。同时以“Adriamycin induced liver injury” 和“hepatic fibrosis”作为检索词在OMIM数据库(https://www.omim.org/)、GeneCards基因数据库(https://www.genecards.org/)进行检索得到相关靶点。
1.4. 蛋白-蛋白相互作用(PPI)网络的构建以及核心靶点的筛选
将金银花、阿霉素肝脏损伤和肝脏纤维化靶点利用微生信网站(https://www.bioinformatics.com.cn/)导出,取交集后绘制Venn图,得到金银花抗阿霉素肝脏损伤的潜在靶点。将上述靶点导入至STRING数据库(https://cn.string-db.org/)中进行分析,将生物种类设定为“Mus musculus”,将其TSV文件导入Cytoscape3.7.2软件中进行可视化。通过centiscape2.2获得degree、closeness、betweenness值筛选关键靶点进行作图分析。
1.5. GO富集与KEGG通路分析
利用DAVID数据库(https://david.ncifcrf.gov/summary.jsp)将药物成分与疾病交集的靶点导入,进行GO功能注释分析和KEGG通路富集分析。通过GO分析可以了解靶基因在生物过程(BP)、分子功能(MF)和细胞组成(CC)的富集,KEGG通路分析靶基因所涉及的信号通路。筛选排名靠前的基因功能及通路,应用微生信平台(http://www.bioinformatics.com.cn/)的气泡图进行可视化分析。
1.6. 分子对接验证
通过TCMSP数据库(https://old.tcmsp-e.com/tcmsp.php)查找金银花化学成分并以口服利用度(OB)≥30%及类药性(DL)≥0.18为条件进行筛选,筛选出主要成分。再通过TCMSP数据库获取各主要成分分子结构图,借助NovoPro工具(https://novopro.cn/)获得其分子结构,借助Swiss ADME平台(http://www.swissadme.ch/)进行筛选,以GI absorption得分为high和Druglike-ness至少通过2个Yes进行筛选,筛选出主要核心成分。通过PDB数据库(https://www.rcsb.org/)获取对应蛋白质结构,并通过autodock4将其与各活性成分对接,并进行可视化。结合能数值越低,受体与配体的对接效果越理想,即相互作用更稳定有效。
1.7. 动物实验
1.7.1. 阿霉素诱导小鼠肝脏损伤模型制备
雄性C57BL/6小鼠适应性喂养1周,随机分成正常对照组(Sham组)、阿霉素肝脏损伤组(DOX组)、金银花低剂量组(DOX+LJF,0.2 g/kg)、金银花中剂量组(DOX+LJF,0.4 g/kg)、金银花高剂量组(DOX+LJF,0.8 g/kg)[17],6只/组。Sham组小鼠尾静脉注射等量生理盐水及等量蒸馏水灌胃处理;DOX组小鼠在造模第3、5、10、12天尾静脉注射DOX,2.5 mg/(kg·次),共计4次,累计达到10 mg/kg,并给予等量蒸馏水灌胃处理,建立小鼠DOX肝脏损伤模型[18]。DOX+LJF低、中、高剂量组小鼠分别给予0.2、0.4、0.8 g/kg的金银花进行灌胃处理,1次/d,共计2周[17]。
1.7.2. 标本采集
小鼠末次灌胃后,禁食12 h,用异氟烷麻醉小鼠,然后小鼠眼球采血置离心管内凝固30 min,4 ℃条件3000 r/min离心10 min收集上层血清,-20 ℃冰箱保存用于AST、ALT检测。取血完成后将各组小鼠处死,留取各组小鼠相同部位的肝脏组织用O.C.T包埋,并立即放入液氮中速冻固定后在-80 ℃冰箱保存不超过1周,用于DHE荧光探针检测。部分肝脏以4%多聚甲醛固定,用于HE及Masson染色;剩余肝组织用于ELISA、HYP及Western blotting检测。
1.7.3. 血清AST和ALT检测
根据试剂盒说明书制作AST和ALT标准曲线,取AST或ALT测定基质液预热37 ℃,取20 μL加入96孔板,加入血清和不加入血清分别设置测定孔和对照孔。37 ℃水浴锅中反应30 min,各孔加入20 μL 2,4-二硝基苯肼液,对照组加入5 μL各组小鼠血清,在37 ℃水浴锅中反应20 min。所有孔中加入0.4 mol/L氢氧化钠溶液200 μL,轻轻水平摇动96孔板混匀,室温放置15 min,波长510 nm,酶标仪测定各孔OD值。根据AST/ALT活力(U/L)=OD绝对(OD测定-OD对照)代入标准曲线得AST/ALT活力(卡门氏单位)×0.482×样本前稀释倍数,计算各组小鼠血清中AST以及ALT的活力值。
1.7.4. 肝脏组织病理学观察
各组肝脏组织4%多聚甲醛固定48 h以上,石蜡包埋、切片后进行HE及Masson染色。HE染色:切片置染预处理液处理1 min后使用苏木素染液染色5 min,洗去染液,置入分化液中分化、洗净,返蓝液处理并流水冲洗,95%酒精脱水1 min,伊红染液染色15 s,依次用80%、90%、95%、100%的梯度无水乙醇进行脱水,正丁醇和二甲苯透明化处理,中性树胶封片。Masson染色:切片置于Masson A液浸泡、冲洗,浸入Masson B液和Masson C液混合染液1 min、清洗,分化液分化、冲洗,Masson D液浸染6 min、漂洗,Masson E液浸染1 min、沥干,Masson F液染色30 s,1%醋酸漂洗和分化,无水乙醇中脱水,二甲苯透明处理,中性树胶封片。镜下观察肝脏组织的形态并采集HE及Masson图像。
1.7.5. DHE检测肝脏组织ROS水平
制备各组肝脏组织切片,37 ℃避光条件下,置于10 μmol/L的DHE染液染色45 min,PBS洗涤3次,加入浓度5 μg/mL DAPI染液避光37 ℃孵育10 min,PBS洗涤3次,滴加抗荧光淬灭封片剂、盖玻片封片。蔡司荧光显微镜观察并记录各组切片的荧光强度。使用ZEN软件对记录的荧光图像进行分析和处理,以定量评估荧光强度的变化。
1.7.6. ELISA检测肝脏组织TNF-α、IL-6和COL-Ⅳ含量
根据相应试剂盒说明书制作TNF-α、IL-6和COL-Ⅳ的标准曲线,取各组肝脏组织20 mg研磨制成组织匀浆,4 ℃下3000 r/min离心10 min取上清,BCA法测定蛋白浓度。板条上设置标准品孔和样本孔,分别加入标准品50 μL和待测样本10 μL,加入100 μL辣根过氧化物酶(HRP)标记的检测抗体,37 ℃孵育60 min,弃去孔中液体、拍干,洗涤液洗涤、拍干,每孔加入底物A和底物B各50 μL,37 ℃避光孵育15 min,加入50 μL终止液,酶标仪450 nm波长测定各孔OD值,将OD值代入对应标准曲线后×对应的稀释倍数/对应的蛋白浓度既可得到各组小鼠肝脏组织中TNF-α、IL-6和COL-Ⅳ的含量。
1.7.7. 肝脏组织HYP检测
各组肝脏组织80 mg,加入1 mL水解液混匀,95 ℃水浴锅水解反应20 min,冷水冲洗冷却至室温,加入10 μL指示剂并充分混合,加入1 mL调pH甲液、充分混合,逐滴加入调pH乙液并混合均匀,直至试管中液体颜色从红色变为黄绿色,加入双蒸水至总体积达到10 mL并混合均匀,加入30 mg活性炭混合均匀后,3500 r/min离心10 min,吸取1 mL上清液作为最终检测样本。设置空白管、标准管和测定管。空白管加入1 mL双蒸水和0.5 mL试剂一;标准管加入1 mL标准应用液和0.5 mL试剂一;测定管加入1 mL检测样本和0.5 mL试剂一。混匀后静置10 min,加入0.5 mL试剂二静置5 min,加入0.5 mL试剂三快速混匀,60 ℃水浴15 min。冷却至室温,3500 r/min离心10 min取上清液550 nm波长测定每个孔的A值,根据羟脯氨酸含量(μg/mg)=(A 测定-A 空白)/(A 标准-A 空白)×5 μg/mL×0.125 mL/mg 计算出各组小鼠肝脏组织羟脯氨酸的含量。
1.7.8. Western blotting法检测各组小鼠肝组织P53蛋白表达
各组肝组织10 mg裂解后,4 ℃,12 000 r/min离心15 min取上清液即为总蛋白提取物,BCA法测定总蛋白浓度。SDS-PAGE凝胶进行电泳分离组织中的蛋白质,湿转法转移蛋白至PVDF膜,快速封闭液封闭。然后将膜与P53(稀释比例为1∶1000)和GAPDH(稀释比例为1∶7000)的一抗在4 ℃条件下孵育过夜,TBST洗涤3次,10 min/次,室温孵育山羊抗兔二抗IgG-HRP(稀释比例为1∶10 000)2 h,TBST洗涤3次,10 min/次,ECL发光法来检测膜上的蛋白。使用ImageJ软件对其灰度值进行分析,以GAPDH为内参计算相对含量。
1.8. 统计学方法
使用GraphPad Prism 8.0软件进行统计分析,实验数据均以均数±标准差表示,多组比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2. 结果
2.1. 金银花抗阿霉素肝脏损伤和肝脏纤维化的靶点的筛选
通过Herb数据库得到金银花对应的成分靶点共计118个。通过OMIM数据库和GeneCards基因数据库得到疾病相关靶点8477个。将上述靶点取交集绘制Venn图,获得金银花抗阿霉素肝脏损伤和肝脏纤维化的潜在靶点43个(图1)。
图1.
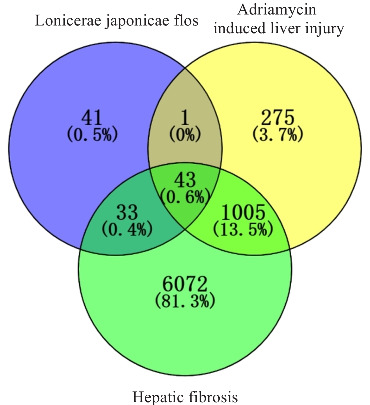
金银花靶点、阿霉素肝脏损伤和肝脏纤维化相关靶点维恩图
Fig.1 Venn diagram of Lonicerae japonicae flos, Adriamycin-induced liver injury and hepatic fibrosis-related targets.
2.2. PPI网络的构建与核心靶点的筛选
从Degree、Closeness、Betweenness进行筛选并得到共同靶点PPI网络(图2A)并取平均数再次进行筛选得到肿瘤抑制基因子(TrP53)、肿瘤坏死因子(TNF)、白细胞介素-6(IL-6)等12个核心靶点(图2B)。
图2.
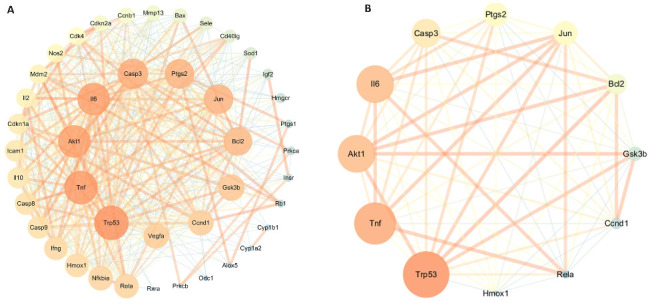
PPI网络图和核心靶点网络图
Fig.2 PPI network diagram (A) and core targets network diagram (B).
2.3. GO和KEGG富集分析
GO分析共富集到241个GO条目,包括细胞成分(CC)18个、生物学过程(BP)197个、分子功能(MF)26个。将BP、CC、MF中P值排名前10的条目进行可视化呈现,结果显示,BP主要涉及平滑肌细胞增殖的正向调节、凋亡过程的负向调节、凋亡过程的正向调节等;CC主要与大分子复合物、胞浆、转录阻遏蛋白复合物等有关;MF主要与酶结合、蛋白质结合、蛋白酶结合等有关(图3A)。KEGG通路分析共富集到112条信号通路,取P值前15的信号通路进行可视化呈现,主要包括癌症信号通路、IL-17信号通、TNF信号通路等(图3B)。
图3.
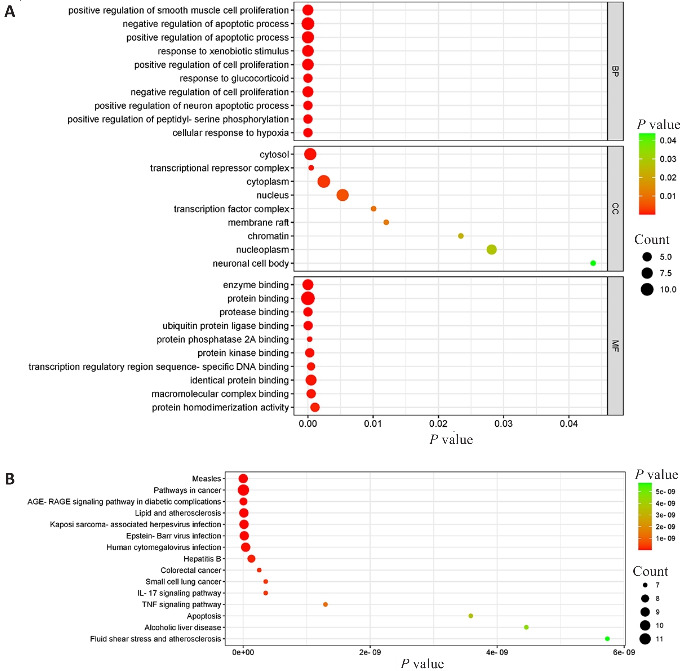
GO和KEGG富集分析
Fig.3 GO (A) and KEGG (B) enrichment analysis.
2.4. 分子对接结果
通过TCMSP数据库及Swiss ADME平台最终筛选出10个金银花的核心成分(表1)。这10个核心成分与核心靶点TrP53、TNF、IL-6进行分子对接(表2),结果显示,筛选得到的核心成分与核心靶点TrP53、TNF、IL-6呈现不同程度的结合活性,结合能<-5.0 kcal/mol提示有较好的结合活性,其中木犀草素(Mol ID: MOL000006)、槲皮素(Mol ID: MOL000098)和山奈酚(Mol ID: MOL000422)与TNF具有较好的结合活性,黄烷酮(Mol ID: MOL002914)与TrP53和TNF具有较好的结合活性,(-)-(3R,8S,9R,9aS,10aS)-9-乙烯基-8-(beta-D-吡喃葡萄糖基氧基)-2,3,9a,10,10a-六氢-5-氧代-5H,8H-吡喃并[4,3-d]恶唑并[3,2-a]吡啶-3-羧酸acid_qt((-)-(3R,8S,9R,9aS,10aS)-9-ethenyl-8-(beta-D-glucopyranosyloxy)-2,3,9,9a,10,10a-hexahydro-5-oxo-5H,8H-pyrano[4,3-d]oxazolo[3,2-a]pyridine-3-carboxylic acid_qt, Mol ID: MOL003006)与TNF和IL-6具有较好的结合活性,大黄醇(Mol ID: MOL003044)与 TrP53、TNF、IL-6这3个核心均有较好的结合活性,选取部分结合结果进行可视化(图4)。
表1.
金银花核心成分
Tab.1 Core components of Lonicerae japonicae flos
| Mol ID | Molecule | OB | DL |
|---|---|---|---|
| MOL000006 | luteolin | 36.16 | 0.25 |
| MOL000098 | quercetin | 46.43 | 0.28 |
| MOL000422 | kaempferol | 41.88 | 0.24 |
| MOL002914 | Eriodyctiol (flavanone) | 41.35 | 0.24 |
| MOL003006 | (-)-(3R,8S,9R,9aS,10aS)-9-ethenyl-8-(beta-D-glucopyranosyloxy)-2,3,9,9a,10,10a-hexahydro-5-oxo-5H,8H-pyrano[4,3-d]oxazolo[3,2-a]pyridine-3-carboxylic acid_qt | 87.47 | 0.23 |
| MOL003014 | secologanic dibutylacetal_qt | 53.65 | 0.29 |
| MOL003044 | Chryseriol | 35.85 | 0.27 |
| MOL003095 | 5-hydroxy-7-methoxy-2-(3,4,5-trimethoxyphenyl)chromone | 51.96 | 0.41 |
| MOL003111 | Centauroside_qt | 55.79 | 0.5 |
| MOL003117 | Ioniceracetalides B_qt | 61.19 | 0.19 |
OB: Oral bioavail-ability; DL: Drug-likeness.
表2.
核心靶点与核心成分结合能
Tab.2 Binding energy of the core targets and core ingredients (kcal/mol)
| Mol ID | TrP53 Binding energy | TNF Binding energy | IL-6 Binding energy |
|---|---|---|---|
| MOL000006 | -4.49 | -5.8 | -3.93 |
| MOL000098 | -3.93 | -5.6 | -4.24 |
| MOL000422 | -4.85 | -5.62 | -4.59 |
| MOL002914 | -5.61 | -5.09 | -4.75 |
| MOL003006 | -4.7 | -6.97 | -5.31 |
| MOL003014 | -2.53 | -2.96 | -0.83 |
| MOL003044 | -5.02 | -5.99 | -5.1 |
| MOL003095 | -4.7 | -4.9 | -3.59 |
| MOL003111 | -2.85 | -4.11 | -3.23 |
| MOL003117 | -4.94 | -4.79 | -4.24 |
图4.
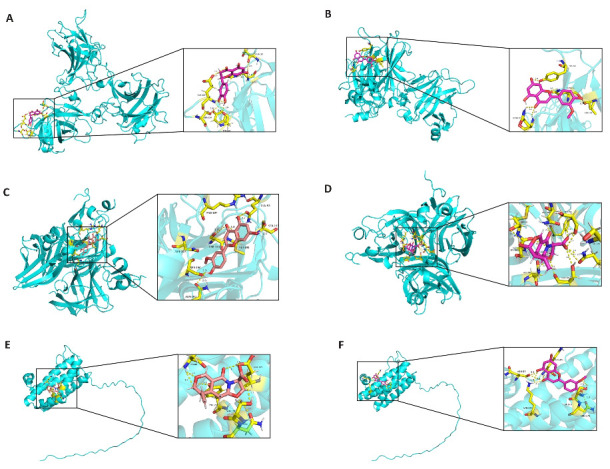
分子对接可视化结果
Fig.4 Visualization of molecular docking results. A: Potential interaction between MOL002914 and Trp53. B: Potential interaction between MOL003044 and Trp53. C: Potential interaction between MOL003044 and TNF. D: Potential interaction between MOL003006 and TNF. E: Potential interaction between MOL003006 and IL-6. F: Potential interaction between MOL003044 and IL-6.
2.5. 动物实验结果
2.5.1. 金银花降低阿霉素诱导的小鼠血清AST、ALT的水平
与Sham组比较,DOX组血清中AST、ALT水平显著升高(P<0.001);与DOX组比较,DOX+LJF(0.2 g/kg)、DOX+LJF(0.4 g/kg)、DOX+LJF(0.8 g/kg)组AST、ALT水平显著降低(P<0.001);且随LJF浓度增加,ALT水平降低更明显(P<0.001,P<0.01);LJF(0.8 g/kg)组、LJF(0.4 g/kg)组与LJF(0.2 g/kg)组干预相比,AST降低更明显(P<0.01,P<0.05,图5)。
图5.
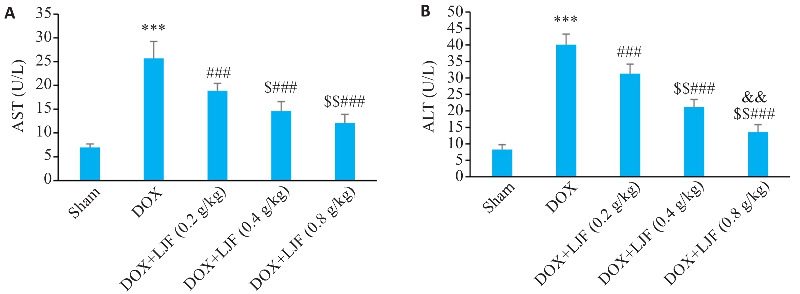
各组小鼠血清AST和ALT水平
Fig.5 Serum levels of AST (A) and ALT (B) in mice in each group (Mean±SD, n=6). ***P<0.001 vs Sham; ### P<0.001 vs DOX; $ P<0.05, $$ P<0.01 vs DOX+LJF (0.2 g/kg); && P<0.01 vs DOX+LJF (0.4 g/kg).
2.5.2. 各组小鼠肝脏组织HE染色
HE染色结果显示,Sham组小鼠肝脏小叶结构均匀完整,肝脏细胞排列清晰整齐且未见纤维组织增生。相比于Sham组,DOX组小鼠肝脏细胞排列紊乱,肝脏细胞点状坏死增加及炎性细胞浸润和气球样变,纤维化明显。与DOX组相比,DOX+LJF(0.2 g/kg)、DOX+LJF(0.4 g/kg)、DOX+LJF(0.8 g/kg)组对DOX所致小鼠肝脏组织中肝脏小叶结构完整性、炎症坏死及纤维化病变均有所改善(图6)。
图6.
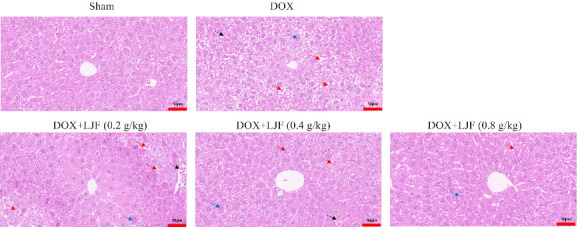
各组小鼠肝脏HE染色结果
Fig.6 HE staining of mouse liver tissues in each group (Original magnification: ×40). Black arrows indicate erythrocyte exudates, red arrows indicate hepatocyte ballooning, and blue arrows indicate inflammatory cell infiltration.
2.5.3. 各组小鼠肝脏组织Masson染色
Masson染色结果显示,Sham组小鼠肝脏组织仅在汇管区有少许蓝染胶原纤维,未见病理性改变。而DOX组明显可见广泛致密蓝色胶原沉积,肝脏汇管区和中央静脉周围纤维组织增生明显,且纤维间隔增厚,肝脏细胞排列紊乱,并呈气球样变,部分已出现假小叶及胶原纤维束。与DOX组相比,DOX+LJF(0.2 g/kg)、DOX+LJF(0.4 g/kg)、DOX+LJF(0.8 g/kg)组中DOX所致小鼠肝脏损伤有不同程度的改善与逆转,胶原纤维增生范围显著减少(图7)。
图7.
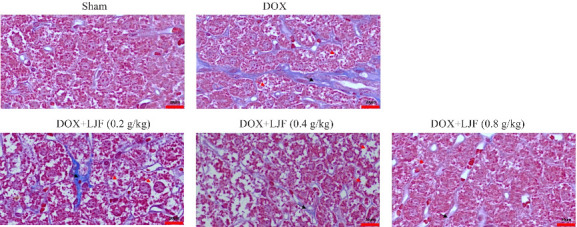
各组小鼠肝脏Masson染色结果
Fig.7 Masson staining of mouse liver tissue in each group (×120). The black arrows indicate fibrotic hyperplasia and the red arrows indicate hepatocyte balloons.
2.5.4. 金银花降低阿霉素模型小鼠肝脏组织的ROS水平
与Sham组比较,DOX组肝脏组织DHE红色荧光强度明显升高,肝脏组织ROS水平明显升高(P<0.001);与DOX组比较,DOX+LJF(0.2 g/kg)、DOX+LJF(0.4 g/kg)、DOX+LJF(0.8 g/kg)组肝脏组织ROS水平降低(P<0.001),金银花各剂量组间降低ROS效应的差异均有统计学意义(P<0.001,P<0.01,图8)。
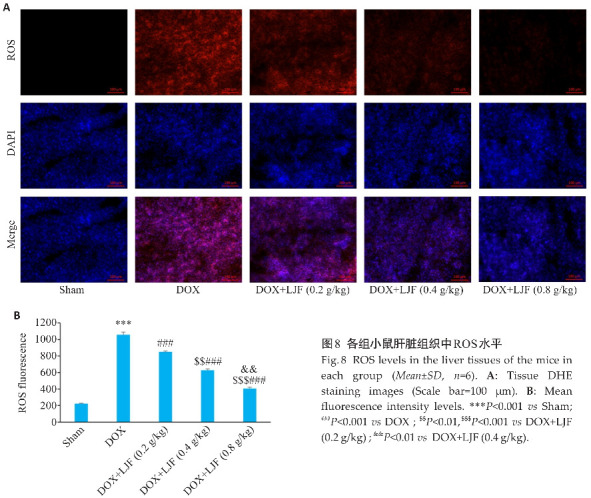
2.5.5. 金银花降低阿霉素模型小鼠肝脏组织IL-6、TNF-α的表达
ELISA结果显示,与Sham组相比,DOX组血清中TNF-α、IL-6表达增高(P<0.001);与DOX组比较,DOX+LJF(0.2 g/kg)、DOX+LJF(0.4 g/kg)、DOX+LJF(0.8 g/kg)组TNF-α、IL-6表达降低(P<0.001),金银花各剂量组间的差异有统计学意义(P<0.001,P<0.01,图9)。
图9.
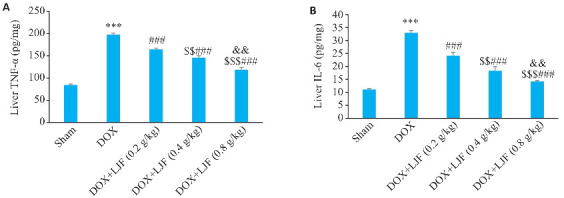
各组小鼠肝脏组织中TNF-α和IL-6水平
Fig.9 TNF-α (A) and IL-6 (B) levels in mouse liver tissues in each group (Mean±SD, n=6). ***P<0.001 vs Sham; ### P<0.001 vs DOX; $$ P<0.01, $$$ P<0.001 vs DOX+LJF (0.2 g/kg) ; && P<0.01 vs DOX+LJF (0.4 g/kg).
2.5.6. 金银花降低阿霉素模型小鼠肝脏组织HYP含量和COL-Ⅳ的表达
与Sham组相比较,DOX组肝脏组织中羟脯氨酸(HYP)含量和Ⅳ型胶原蛋白(COL-Ⅳ)表达显著增高(P<0.001);与DOX组比较,DOX+LJF(0.2 g/kg)、DOX+LJF(0.4 g/kg)、DOX+LJF(0.8 g/kg)组HYP含量和COL-Ⅳ 表达降低(P<0.001);金银花各剂量组间有统计学差异(P<0.001,P<0.01,图10)。
图10.
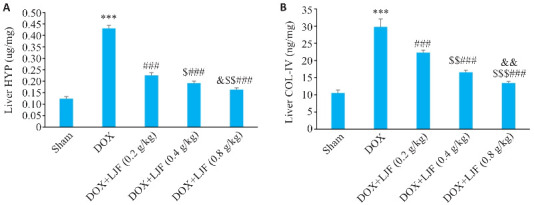
各组小鼠肝脏组织中HYP和COL-Ⅳ水平
Fig.10 HYP (A) and COL-IV (B) levels in mouse liver tissues in each group (Mean±SD, n=6). ***P<0.001 vs Sham; ### P<0.001 vs DOX; $ P<0.05, $$ P<0.01, $$$ P<0.001 vs DOX+LJF (0.2 g/kg) ; & P<0.05, && P<0.01 vs DOX+LJF (0.4 g/kg).
2.5.7. 金银花降低阿霉素模型小鼠肝脏组织P53蛋白的表达
Western blotting结果显示,与Sham组相比较,DOX组小鼠肝脏组织P53蛋白相对表达量增高(P<0.001);与DOX组比较,DOX+LJF(0.2 g/kg)、DOX+LJF(0.4 g/kg)、DOX+LJF(0.8 g/kg)组P53蛋白相对表达量降低(P<0.05,P<0.01,P<0.001);与DOX+LJF(0.8 g/kg)组与DOX+LJF(0.2 g/kg)组相比,P53蛋白降低更明显(P<0.05),金银花高、中、低剂量组效应之间的差异均无统计学意义(图11)。
图11.
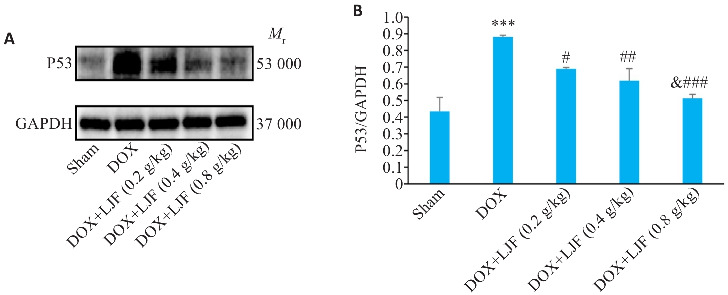
各组小鼠肝脏组织中P53蛋白表达水平
Fig.11 Protein expression level of P53 in mouse liver tissue in each group (Mean±SD, n=6). A: P53 protein expression detected by Western blotting in each group. B: Quantitative data of P53 expression. ***P<0.001 vs Sham; ### P<0.001, ## P<0.01, # P<0.05 vs DOX; & P<0.05 vs DOX+LJF (0.2 g/kg).
3. 讨论
本研究结果显示,DOX组小鼠血清AST、ALT水平明显升高;HE和Masson染色显示肝细胞排列紊乱、肝细胞点状坏死、炎性细胞浸润、气球样变及肝脏纤维化等改变,提示DOX可诱导肝脏损伤。有研究显示,DOX诱导的肝脏损伤与炎症因子和氧化应激等有关[19, 20]。而目前如何减轻DOX诱导的肝脏损伤报道较少,因此迫切需要探索减轻DOX诱导肝脏损伤的靶点和药物。中草药因其低毒性、低副作用、多靶点等优势成为研究热点。有研究显示金银花可以减轻大鼠的溃疡性结肠炎的炎症反应[21];还可降低氧化应激减轻阿霉素诱导的心脏毒性[22];以及减轻四氯化碳诱导的小鼠肝脏纤维化[17]。这表明金银花具有抗炎、抗氧化、抗纤维化等特性[23]。我们推测金银花可能对DOX诱导的肝脏损伤发挥保护作用。但金银花是否能够减轻DOX诱导的肝脏损伤未见报道。
网络药理学是寻找药物与疾病相关靶点的有效方法[24, 25]。本研究通过网络药理学筛选得到TrP53、TNF、IL-6等12个核心靶点,这12个核心靶点可能是金银花对DOX诱导的肝脏损伤和纤维化起保护作用的关键靶点。本文实验结果也显示DOX组小鼠肝脏组织中炎症因子TNF-α、IL-6水平升高、ROS水平上升以及P53蛋白表达升高。已有研究显示,P53可通过调控多种信号通路如MiR-34a/SIRT1/p53、P53/p66Shc等[26, 27]调节肝脏损伤及肝脏纤维化;TNF-α作为TNF信号通路的主要成员,可激活多种纤维化相关因子,调控肝脏损伤及肝脏纤维化进程[28],TNF-α还可诱导细胞产生IL-6;IL-6作为白细胞介素家族的成员也是IL-17信号通路的主要成员,可诱导肝脏发生炎症反应,加剧肝脏纤维化进展[29]。薯蓣皂苷明显降低TNF-α、IL-1β和IL-6 mRNA水平,抑制炎症反应,同时下调P53表达水平抑制细胞凋亡减轻DOX诱导的肝脏损伤[30]。本研究应用金银花干预DOX组小鼠后,结果显示,金银花各剂量组不同程度降低了肝脏组织TNF-α、IL-6水平,降低肝脏纤维化指标HYP含量以及COL-Ⅳ表达,同时降低肝脏组织P53蛋白表达。以上相关靶点在肝脏疾病的相关文献分析和本实验中的结果均提示,金银花可能通过上述关键靶点减轻DOX诱导的肝脏损伤。GO分析结果主要包括平滑肌细胞增殖的正向调节、凋亡过程的负向调节、凋亡过程的正向调节、对异生素刺激的反应等,有研究表明金银花可通过调节细胞凋亡[31]等多个生物学过程发挥作用;KEGG分析结果包括癌症通路、IL-17信号通路、TNF等信号通路等,提示金银花可能通过作用于多个信号通路调控肝脏损伤及肝脏纤维化的发展。
有关中草药如何减轻DOX诱导的肝脏损伤的相关报道较少,有研究显示柚皮素可通过降低氧化应激和炎症减轻DOX诱导的肝脏损伤[32],但未分析具体的有效成分及其对应靶点。为探究金银花减轻DOX诱导的肝脏损伤的具体有效成分及对应靶点,我们进一步通过分子对接获得了金银花发挥保护作用的核心成分和对应靶点,分子对接结果提示木犀草素、槲皮素、山奈酚、黄烷酮、(-)-(3R,8S,9R,9aS,10aS)-9-乙烯基-8-(beta-D-吡喃葡萄糖基氧基)-2,3,9a,10,10a-六氢-5-氧代-5H,8H-吡喃并[4,3-d]恶唑并[3,2-a]吡啶-3-羧酸acid_qt、大黄醇等核心成分可能通过与3个不同核心靶点结合来减轻DOX诱导的肝脏损伤。文献已报道木犀草素、黄烷酮、大黄醇等金银花的核心成分具有抗炎抗氧化作用[33, 34],但是以上作用缺乏有效成分靶点与疾病相关靶点相互作用的研究,本实验较系统深入地建立了金银花核心成分与疾病靶点之间的相互关系,为金银花的临床应用提供了理论依据。结合本研究结果和既往的文献研究分析,提示金银花可能通过相关核心成分与P53、TNF和IL-6核心靶点的相互作用,减轻DOX诱导的肝脏损伤。
综上所述,本研究基于网络药理学、分子对接技术和DOX诱导小鼠肝脏损伤实验初步探究了金银花对DOX诱导的肝脏损伤的保护作用和可能机制。结果表明金银花相关核心成分可能与Trp53、TNF、IL-6核心靶点结合,通过减轻氧化应激、抑制炎症因子分泌,调节胶原的合成与分解,减轻DOX诱导的肝脏损伤。
基金资助
蚌埠医学院512人才项目(by51201102);安徽省优秀科研创新团队项目(2022AH010083)
参考文献
- 1. Powers SK, Duarte JA, Le Nguyen B, et al. Endurance exercise protects skeletal muscle against both doxorubicin-induced and inactivity-induced muscle wasting[J]. Pflugers Arch, 2019, 471(3): 441-53. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Li DK, Zhang W, Fu H, et al. DL-3-n-butylphthalide attenuates doxorubicin-induced acute cardiotoxicity via Nrf2/HO-1 signaling pathway[J]. Heliyon, 2024, 10(5): e27644. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Chen MY, Yi YD, Chen BX, et al. Metformin inhibits OCTN1- and OCTN2-mediated hepatic accumulation of doxorubicin and alleviates its hepatotoxicity in mice[J]. Toxicology, 2024, 503: 153757. [DOI] [PubMed] [Google Scholar]
- 4. Badi RM, Khaleel EF, Satti HH, et al. Eriodictyol attenuates doxorubicin-induced nephropathy by activating the AMPK/Nrf2 signalling pathway[J]. J Tradit Complementary Med, 2024, 14(2): 203-14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Liu PP, Wu J, Yu XY, et al. Metabolomics and network analyses reveal phenylalanine and tyrosine as signatures of anthracycline-induced hepatotoxicity[J]. Pharmaceuticals, 2023, 16(6): 797. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Wali AF, Rashid S, Rashid SM, et al. Naringenin regulates doxorubicin-induced liver dysfunction: impact on oxidative stress and inflammation[J]. Plants, 2020, 9(4): 550. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. AlAsmari AF, Alharbi M, Alqahtani F, et al. Diosmin alleviates doxorubicin-induced liver injury via modulation of oxidative stress-mediated hepatic inflammation and apoptosis via NfkB and MAPK pathway: a preclinical study[J]. Antioxidants, 2021, 10(12): 1998-2013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Shati AA, Eid RA, El-Kott AF, et al. Curcumin attenuates doxorubicin-induced cardiotoxicity via suppressing oxidative Stress, preventing inflammation and apoptosis: Ultrastructural and computational approaches[J]. Heliyon, 2024, 10(5): e27164-75. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Morsy MA, El-Daly M, Kamel BA, et al. Pregnenolone protects the liver against doxorubicin-induced cellular injury by anti-inflammatory, antioxidant, and antiapoptotic mechanisms: role of Keap1/Nrf2/HO-1 and P-glycoprotein[J]. Eur Rev Med Pharmacol Sci, 2023, 27(10): 4718-34. [DOI] [PubMed] [Google Scholar]
- 10. Metwally AA, Ganguly S, Biomi N, et al. Cationic vitamin E-TPGS mixed micelles of berberine to neutralize doxorubicin-induced cardiotoxicity via amelioration of mitochondrial dysfunction and impeding apoptosis[J]. Molecules, 2024, 29(5): 1155. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. 李康宁, 宋志领, 贾利龙, 等. 金银花提取物对LPS诱导的急性前部葡萄膜炎小鼠的抗炎作用及其机制[J]. 吉林大学学报: 医学版, 2021, 47(4): 978-83. [Google Scholar]
- 12. 周慧敏, 马秀梅, 曾海生, 等. 金银花醇提物抗炎、降血脂作用实验研究[J]. 中医药导报, 2022, 28(7): 5–10. [Google Scholar]
- 13. 汤菲菲, 马 兰. 不同剂量金银花口服液对风热症患儿症状积分改善及预后的影响[J]. 中国医学创新, 2022, 19(26): 77-80. [Google Scholar]
- 14. 单贺珍, 董 石, 李晓瑞, 等. 金银花提取物增强抗CD19 CAR-T细胞肿瘤杀伤活性[J]. 中南药学, 2022, 20(7): 1545-9. [Google Scholar]
- 15. Lin YL, Wu YH S, Chao MY, et al. An alleviative effect of Lonicerae japonicae flos water extract against liver fibrogenesis in vitro and in vivo [J]. Environ Toxicol, 2024, 39(5): 2881-92. [DOI] [PubMed] [Google Scholar]
- 16. Zhang YN, Zhu GH, Liu W, et al. Discovery of the covalent SARS-CoV-2 Mpro inhibitors from antiviral herbs via integrating target-based high-throughput screening and chemoproteomic approaches[J]. J Med Virol, 2023, 95(11): e29208. [DOI] [PubMed] [Google Scholar]
- 17. Miao H, Zhang Y, Huang ZL, et al. Lonicera japonica attenuates carbon tetrachloride-induced liver fibrosis in mice: molecular mechanisms of action[J]. Am J Chin Med, 2019, 47(2): 351-67. [DOI] [PubMed] [Google Scholar]
- 18. Tao RH, Kobayashi M, Yang YZ, et al. Exercise inhibits doxorubicin-induced damage to cardiac vessels and activation of hippo/YAP-mediated apoptosis[J]. Cancers, 2021, 13(11): 2740. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Santos-Alves E, Rizo-Roca D, Marques-Aleixo I, et al. Physical exercise positively modulates DOX-induced hepatic oxidative stress, mitochondrial dysfunction and quality control signaling[J]. Mitochondrion, 2019, 47: 103-13. [DOI] [PubMed] [Google Scholar]
- 20. Bilgic S, Ozgocmen M. The protective effect of misoprostol against doxorubicin induced liver injury[J]. Biotech Histochem, 2019, 94(8): 583-91. [DOI] [PubMed] [Google Scholar]
- 21. Zhou XN, Lu QQ, Kang XZ, et al. Protective role of a new polysaccharide extracted from Lonicera japonica thunb in mice with ulcerative colitis induced by dextran sulphate sodium[J]. Biomed Res Int, 2021, 2021: 8878633. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. Zhang JM, Li WL, Xue SM, et al. Qishen granule attenuates doxorubicin-induced cardiotoxicity by protecting mitochondrial function and reducing oxidative stress through regulation of Sirtuin3[J]. J Ethnopharmacol, 2024, 319(Pt 1): 117134. [DOI] [PubMed] [Google Scholar]
- 23. 郝梦超, 姚 甜, 刘二奴, 等. 忍冬中的活性成分及其药理活性研究现状[J]. 药物分析杂志, 2024, 44(2): 195–213. [Google Scholar]
- 24. 张 倩, 张梅奎, 刘颖璐, 等. 六味酸枣汤治疗围绝经期失眠的作用机制: 基于网络药理学与动物实验[J]. 南方医科大学学报, 2023, 43(9): 1536-47. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25. 陈君洁, 黄传兵, 李 明. 健脾滋肾方抑制系统性红斑狼疮患者的足细胞自噬: 基于网络药理学和临床研究[J]. 南方医科大学学报, 2024, 44(3): 465-73. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Song L, Chen TY, Zhao XJ, et al. Pterostilbene prevents hepatocyte epithelial-mesenchymal transition in fructose-induced liver fibrosis through suppressing miR-34a/Sirt1/p53 and TGF‑β1/Smads signalling[J]. Br J Pharmacol, 2019, 176(11): 1619-34. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. 李亚龙. CNPY2介导p53/p66Shc通路在有氧运动干预非酒精性脂肪肝中的作用研究[D]. 成都: 成都体育学院, 2022. [Google Scholar]
- 28. Zhao J, Han M, Zhou L, et al. TAF and TDF attenuate liver fibrosis through NS5ATP9, TGFβ1/Smad3, and NF‑κB/NLRP3 inflammasome signaling pathways[J]. Hepatol Int, 2020, 14(1): 145-60. [DOI] [PubMed] [Google Scholar]
- 29. 王咏兰, 陶柏楠, 陈明环, 等. 基于JAK2/STAT3信号通路探究鬼箭羽醇提物抗CCl4诱导C57BL/6J小鼠肝纤维化作用机制[J]. 中国药理学通报, 2023, 39(5): 875-81. [Google Scholar]
- 30. Song SS, Chu L, Liang HF, et al. Protective effects of dioscin against doxorubicin-induced hepatotoxicity Via regulation of Sirt1/FOXO1/NF-κb signal[J]. Front Pharmacol, 2019, 10: 1030-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31. Wan HQ, Ge LL, Li JM, et al. Effects of a novel biflavonoid of Lonicera japonica flower buds on modulating apoptosis under different oxidative conditions in hepatoma cells[J]. Phytomedicine, 2019, 57: 282-91. [DOI] [PubMed] [Google Scholar]
- 32. Cenacchi V, Furlanis G, Menichelli A, et al. Co-ultraPEALut in subjective cognitive impairment following SARS-CoV-2 infection: an exploratory retrospective study[J]. Brain Sci, 2024, 14(3): 293. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33. Lou JT, Wu F, He WH, et al. Hesperidin activates Nrf2 to protect cochlear hair cells from cisplatin-induced damage[J]. Redox Rep, 2024, 29(1): 2341470-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34. Aon-Im P, Monthakantirat O, Daodee S, et al. Evaluation of the impact of Alternanthera philoxeroides (mart.) Griseb. extract on memory impairment in D-galactose-induced brain aging in mice through its effects on antioxidant enzymes, neuroinflammation, and telomere shortening[J]. Molecules, 2024, 29(2): 503-16. [DOI] [PMC free article] [PubMed] [Google Scholar]


