Abstract
Introducción.
Los modelos asistenciales desarrollados para el manejo rápido de pacientes con accidente isquémico transitorio (AIT) son seguros, eficaces y disminuyen las tasas de recurrencia. El objetivo es conocer la prevalencia de eventos cardiovasculares a 90 días.
Pacientes y métodos.
Estudio observacional, analítico y transversal. Se analiza a pacientes adultos de ambos sexos atendidos en urgencias mediante el ‘protocolo AIT’ entre enero de 2016 y diciembre de 2019. Se recogen variables clínicas, pruebas complementarias, tratamiento y eventos cardiovasculares (ictus/AIT, síndrome coronario agudo o muerte por causa cardiovascular) a los 90 días. El estudio fue aprobado por el Comité Ético de Investigación de Aragón.
Resultados.
Se realizó el protocolo AIT a 163 de 591 pacientes diagnosticados de AIT en urgencias. Se realizó una tomografía computarizada cerebral y una neurosonología al 100%, y un Holter-electrocardiograma de 24 horas al 52,1%, y se detectó fibrilación auricular (FA) en el 3,6%. Se hizo una resonancia magnética cerebral al 78,4%, y se demostró lesión isquémica aguda en secuencias de difusión (DWI+) en un 13,5%. La prevalencia de eventos cardiovasculares a los 90 días fue del 4,9% (8): ictus, el 3,1% (cinco AIT); síndrome coronario agudo, el 0,6% (uno), y muerte por causa cardiovascular, el 1,2% (dos). Los eventos adversos cardiovasculares mayores se asociaron de forma significativa al antecedente de cardiopatía isquémica (p = 0,014). La muerte por causa cardiovascular se asoció al antecedente de FA (p = 0,008), anticoagulación al alta (p = 0,007) y no antiagregación al alta (p = 0,012), y hubo una tendencia a la asociación con antecedente de diabetes mellitus de tipo 2 (p = 0,05).
Conclusiones.
Los protocolos AIT de actuación rápida permiten una atención precoz y evitan ingresos hospitalarios, sin implicar un incremento en la incidencia de eventos cardiovasculares o recurrencia de ictus o AIT a los 90 días.
Palabras clave: Accidente isquémico transitorio, Eventos adversos cardiovasculares mayores, Pronóstico, Protocolo, Resonancia magnética, Restricción a la difusión
Abstract
Introduction.
Care models developed for the rapid management of patients with transient ischaemic attack (TIA) are safe, effective and reduce recurrence rates. The aim is to determine the prevalence of cardiovascular events at 90 days.
Patients and methods.
An observational, analytical, cross-sectional study was conducted. Adult male and female patients seen in the emergency department using the ‘TIA protocol’ between January 2016 and December 2019 were analysed. Data were collected on clinical variables, complementary tests, treatment and cardiovascular events (stroke/TIA, acute coronary syndrome or death due to cardiovascular causes) at 90 days. The study was approved by the Research Ethics Committee of Aragón.
Results.
The TIA protocol was performed on 163 out of 591 patients diagnosed with TIA in the emergency department. Brain CT and neurosonology scans were performed in 100% and a 24-hour Holter-electrocardiogram was carried out in 52.1%; atrial fibrillation (AF) was detected in 3.6% of them. An MRI brain scan was performed in 78.4% and acute ischaemic injury was seen in diffusion sequences (DWI+) in 13.5%. The prevalence of cardiovascular events at 90 days was 4.9% (8): stroke, 3.1% (five TIAs); acute coronary syndrome, 0.6% (one); and death from cardiovascular causes, 1.2% (two). Major adverse cardiovascular events were significantly associated with a history of ischaemic heart disease (p = 0.014). Cardiovascular death was associated with a history of AF (p = 0.008), anticoagulants at discharge (p = 0.007) and no antiplatelet therapy at discharge (p = 0.012), and there was a tendency towards an association with a history of type 2 diabetes mellitus (p = 0.05).
Conclusions.
Rapid TIA protocols allow early care and avoid hospital admissions, without increasing the incidence of cardiovascular events or recurrence of stroke or TIA at 90 days.
Key words: Diffusion restriction, Magnetic resonance, Major adverse cardiovascular events, Prognosis, Protocol, Transient ischaemic attack
Introducción
Existe un creciente interés por el tratamiento de los accidentes isquémicos transitorios (AIT) debido a su elevada prevalencia y morbimortalidad vascular. La definición clásica de AIT, ‘déficit neurológico de menos de 24 horas’, ha sido aceptada durante años. Sin embargo, con el desarrollo de nuevas tecnologías, como la resonancia magnética cerebral, ha quedado claro que esta definición resulta inadecuada para discernir entre AIT e infarto cerebral. Por ello, se ha propuesto una nueva definición: ‘disfunción neurológica por isquemia cuyos síntomas tienen una duración inferior a una hora y sin evidencia de infarto tras realizar neuroimagen’. La nueva definición pone en énfasis la ausencia de lesión y no el tiempo de evolución. Pasamos a hablar en términos de lesión tisular en lugar de cronológicos [1].
Los AIT requieren una atención precoz y especializada, dado que el riesgo de recurrencia es elevado. Se han registrado tasas del 10,5% en los siguientes 90 días, y la mitad de los casos son en las primeras 48 horas [1,2].
Los síntomas referidos por los pacientes pueden ser poco específicos, pero no por ello deben ser menos valorados [3]. Alrededor del 12-30% de los pacientes presentan síntomas no localizadores. Éstos se han asociado a estenosis u oclusión en arterias de la circulación posterior y mayor riesgo de síndrome coronario agudo [4].
Hasta hace unos años, la atención de estos pacientes recaía sobre médicos de urgencias [5] o atención primaria [6]. Históricamente, los pacientes con sospecha de AIT han sido atendidos en el marco del ingreso hospitalario. Sin embargo, esa tendencia ha ido cambiando hacia una atención más precoz y completa en los servicios de urgencias, evitando la hospitalización de los pacientes de bajo o moderado riesgo de recurrencia [7]. Para la valoración de éste, disponemos de escalas como la ABCD2, que, aunque se ha utilizado ampliamente, recientemente se ha cuestionado su utilidad. La escala ABCD3-I incorpora nuevos ítems con valor pronóstico que mejoran su capacidad predictiva [8]. La formación de los médicos de urgencias en este sentido es fundamental para discriminar a los pacientes que se beneficiarían del ingreso hospitalario frente a los que no [9].
Se han analizado distintos modelos de atención de AIT desde urgencias. Todos ellos han sido probados como seguros y eficaces, con menor riesgo de recurrencia a los 90 días en comparación con los datos descritos previamente [10]. El TIA Registry observó que un 78,4% de los pacientes con AIT fue valorado por especialistas en 24 horas y las tasas de ictus a los 2, 7, 30, 90 y 365 días fueron del 1,5, el 2,1, el 2,8, el 3,7 y el 5,1%, respectivamente. Esto apoyaba la evidencia de que los programas de atención urgente del AIT eran efectivos. Finalmente, los modelos de atención ‘híbrida’, que incluyen observación en urgencias < 24 horas, también reducen las tasas de ictus a corto y medio plazo con un menor coste hospitalario [2].
En este contexto, los servicios de neurología, urgencias, radiología y cardiología desarrollaron un procedimiento clínico para el manejo de estos pacientes en urgencias, conocido como ‘protocolo AIT’ (Figs. 1 y 2).
Figura 1.
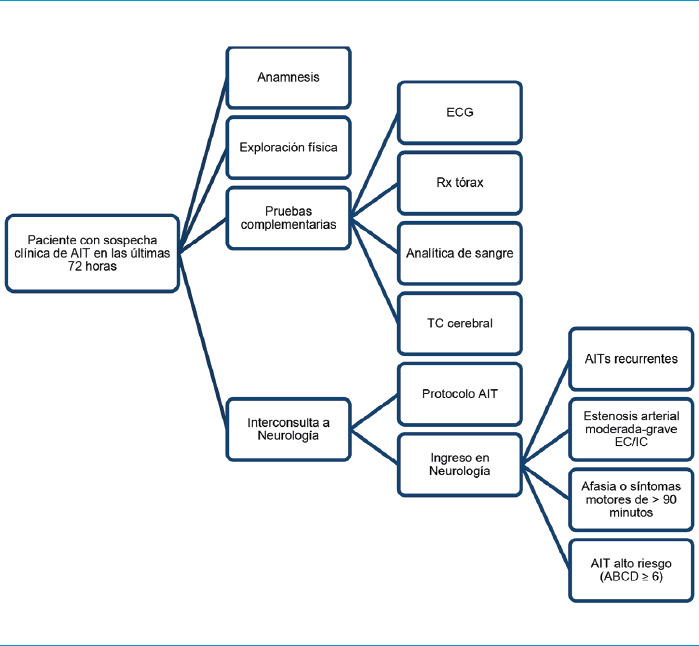
Esquema de manejo desde Urgencias (I). Ante sospecha de AIT, se realizará anamnesis, exploración física y se solicitará analítica, electrocardiograma, Rx tórax y TC cerebral con posterior valoración por Neurología. AIT: accidente isquémico transitorio; EC: extra-craneal; ECG: electrocardiograma; IC: intracraneal; Rx: radiografía.
Figura 2.
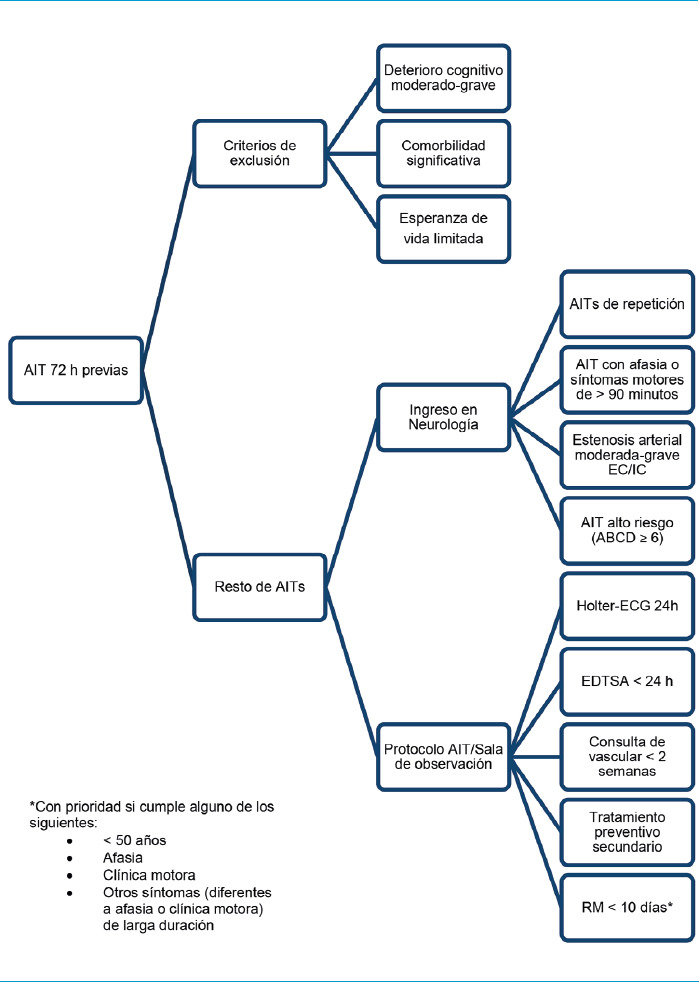
Esquema de manejo desde Urgencias (II). Neurología valorará los pacientes candidatos al protocolo. Estarán en observación en Urgencias 24 horas, tras realizar EDTSA. Se citarán en consultas y, con RM cerebral, se iniciará el tratamiento adecuado. Los pacientes seleccionados serán dados de alta con Holter-ECG 24 h. AIT: accidente isquémico transitorio. ECG: electrocardiograma. EDTSA: Eco-doppler de troncos supraaórticos. RM: resonancia magnética.
Nuestra hipótesis es que el protocolo AIT permite una valoración precoz y adecuada que disminuye el número de eventos cardiovasculares sin precisar ingreso hospitalario. El objetivo principal era conocer la prevalencia de ictus isquémico, síndrome coronario agudo o muerte por causa cardiovascular a los 90 días.
Pacientes y métodos
Es un estudio observacional, descriptivo y transversal retrospectivo. Se incluyó a pacientes atendidos en urgencias mediante el protocolo AIT entre enero de 2016 y diciembre de 2019. El estudio fue aprobado por el Comité Ético de Investigación de Aragón. Se incluyó a adultos de ambos sexos que acudieron a urgencias por déficit neurológico transitorio sucedido en las últimas 72 horas.
Se excluyó a pacientes con esperanza de vida limitada, comorbilidad o discapacidad importante, pacientes con causa conocida y tratada o pacientes con criterios de ingreso.
Se definió el AIT como ‘déficit neurológico focal brusco de origen presumiblemente vascular < 24 horas’ y MACE como ‘eventos adversos cardiovasculares mayores’, incluyendo ictus/AIT, síndrome coronario agudo o muerte por causa cardiovascular.
En relación con el estudio neurosonológico, los grados de ateromatosis y estenosis se definieron según el estudio de González et al [11]. Se consideró un estudio normal cuando no había presencia de placas ateromatosas; ateromatosis leve cuando había una placa pequeña < 30% del diámetro del vaso; ateromatosis moderada, con placas de mediano tamaño o múltiples pequeñas, y ateromatosis grave, con placas grandes o múltiples incluyendo al menos una mediana. Se consideró estudio normal o sin estenosis cuando la velocidad pico sistólica de la arteria carótida interna era < 130 cm/s, sin placas y con la velocidad diastólica final < 40; estenosis leve (< 50%), con velocidad pico sistólica < 130 cm/s y velocidad diastólica final < 40 cm/s; estenosis moderada (50-70%), con velocidad pico sistólica de 130-230 cm/s y velocidad diastólica final 40-100 cm/s; y estenosis grave (> 70%), con velocidad pico sistólica > 230 cm/s y velocidad diastólica final > 100 cm/s.
Basándonos en Hosier et al [12], calculamos el tamaño muestral necesario para obtener resultados estadísticamente significativos. Según la fórmula: n = Z2 × P × Q/d2, eran precisos 62 pacientes, donde n era el tamaño muestral; Z, con un intervalo de confianza al 95%, era 1,96; P, la proporción esperada de eventos [12]; Q, la probabilidad de fracaso (1 – p); y d, la precisión deseada al 5%. Por lo tanto, quedó de la siguiente manera: 1,962 × 0,042 × (1 – 0,042)/0,055 = 61,82.
A través del acceso a la historia clínica, se recogieron las variables de interés. La historia clínica electrónica permite revisar evolutivos e informes de atención primaria y de otros sectores de salud dentro de la misma provincia.
Para el análisis estadístico se utilizó el programa informático SPSS versión 21. Se estudió la normalidad de las variables mediante el test de Kolmogorov-Smirnov y la tabla Lilliefors. Se utilizaron test paramétricos. Las variables cuantitativas con distribución normal se expresaron como media y desviación estándar. Las variables dicotómicas se expresaron como porcentajes y se compararon con la prueba de χ2 o la exacta de Fisher. Se compararon variables cualitativas y cuantitativas con distribución normal mediante la prueba t de Student para datos no pareados. Se valoró la relación lineal entre variables cuantitativas mediante el estudio de la p de Pearson. Un valor bilateral de p < 0,05 se consideró indicativo de significación estadística.
Resultados
Durante el período referido, el diagnóstico de accidente isquémico transitorio lo realizó el servicio de urgencias en 591 pacientes. Se realizó el protocolo AIT a 163 (36,25%) (Fig. 3). El porcentaje de pacientes valorados mediante protocolo AIT se detalla en la tabla I.
Figura 3.
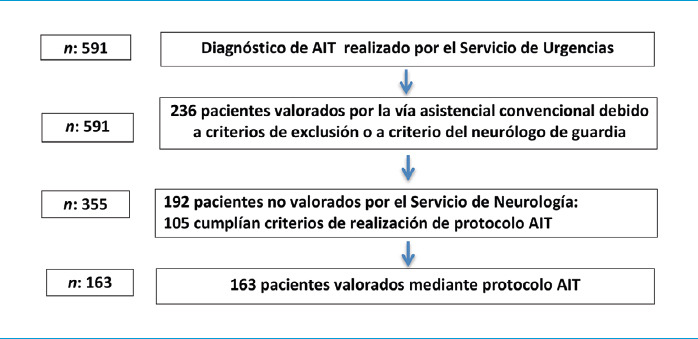
Diagrama de flujo de los pacientes incluidos en el protocolo AIT. Se muestra el proceso de inclusión de los pacientes en el protocolo AIT.
Tabla I.
Proporción de pacientes candidatos al protocolo AIT.
| Proporción de pacientes candidatos al protocolo AIT | Porcentaje | |
|---|---|---|
| 2016 | 28/79 | 35,44% |
|
| ||
| 2017 | 31/84 | 36,9% |
|
| ||
| 2018 | 39/91 | 42,85% |
|
| ||
| 2019 | 65/87 | 74,71% |
|
| ||
| Total | 347/347 | 100% |
AIT: accidente isquémico transitorio.
La edad media fue de 67,14 ± 11,6 años. Las principales variables se muestran en la tabla II. El 65% de las tomografías computarizadas cerebrales fue normal, el 34% presentaba infartos lacunares crónicos y el 1% mostró un infarto territorial previo. El estudio neurosonológico fue normal en el 43%; el 29% presentó ateromatosis leve; el 26%, ateromatosis moderada; el 1%, estenosis moderada; y el 1%, estenosis intracraneal. Se colocó un Holter-electrocardiograma de 24 horas a 85 pacientes (52,1%), que detectó FA en tres (3,6%). El número de FA diagnosticadas en 90 días fue de 23 (14,1%). El 64% de las resonancias magnéticas fue normal; el 20% presentaba lagunas de hiperseñal; el 14%, leucoaraiosis; y el 2%, ictus isquémicos previos. Se demostró lesión isquémica aguda en secuencias de difusión (DWI) en 17 pacientes (13,5%). La media de días para realizar una resonancia magnética cerebral fue de 13,83 ± 13,22. La puntuación media de la escala ABCD2 fue de 3,85 ± 1,25, y la de la ABCD3-I, de 4,16 ± 1,48. Se revisó en consulta al 14,9% de los pacientes en < 15 días, y al resto, en < 30 días. La prevalencia de MACE a los 90 días fue del 4,9% (ocho pacientes): el 63%, AIT; el 25%, muerte cardiovascular; y el 12%, síndrome coronario agudo. La tabla III resume los resultados del análisis bivariante.
Tabla II.
Características clínicas.
| n = 163 | % | IC al 95% | |
|---|---|---|---|
| Sexo | |||
| Varón | 85 | 52 | (44,33-59,67) |
| Mujer | 78 | 48 | (40,33-55,67) |
|
| |||
| FRCV | |||
| HTA | 97 | 59,5 | (51,96-67,04) |
| DLP | 66 | 40,5 | (32,96-48,03) |
| DM2 | 37 | 22,7 | (16,27-29,13) |
| FA | 15 | 9,2 | (4,76-13,64) |
| EAP | 5 | 3,1 | (0,44-5,76) |
| CI | 12 | 7,4 | (3,38-11,42) |
| Ictus previo | 18 | 11 | (6,2-15,8) |
| SBP | 7 | 4,3 | (1,18-7,41) |
|
| |||
| Síntomas | |||
| Afasia | 54 | 33 | (25,78-40,22) |
| Déficit motor | 16 | 9 | (4,6-13,39) |
| Déficit sensitivo | 19 | 11 | (6,2-15,8) |
| Disartria + déficit motor | 21 | 13 | (7,83-18,16) |
| Disartria aislada | 17 | 10 | (5,39-14,60) |
| Otros | 35 | 24 | (17,44-30,55) |
|
| |||
| Duración de los síntomas | |||
| < 30 min | 90 | 56,3 | (48,68-63,92) |
| 30-60 min | 17 | 10,6 | (5,87-15,32) |
| > 60 min | 53 | 33,1 | (25,87-40,32) |
|
| |||
| Perfil clínico del AIT | |||
| Indeterminado | 29 | 17,8 | (11,93-23,67) |
| Aterotrombótico | 18 | 11 | (6,2-15,08) |
| Embólico | 59 | 36,2 | (28,82-43,57) |
| Lacunar | 57 | 35 | (27,67-42,32) |
| n = 163 | % | IC al 95% | |
|
| |||
| Pruebas complementarias durante la estancia en urgencias | |||
| AS | 163 | 100 | (100) |
| ECG | 163 | 100 | (100) |
| Rx de tórax | 163 | 100 | (100) |
| TC cerebral | 161 | 100 | (100) |
| EDTSA/DTC | 158 | 100 | (100) |
|
| |||
| Observación en urgencias | 138 | 84,7 | (79,17-90,23) |
|
| |||
| Monitorización electrocardiográfica en urgencias | 14 | 8,6 | (4,29-12,9) |
|
| |||
| Valoración cardiológica en urgencias | 5 | 3,1 | (0,43-5,76) |
|
| |||
| Pruebas complementarias | |||
| Holter-ECG de 24 horas | 85 | 52,1 | (44,43-59,77) |
| RM cerebral | 127 | 77,9 | (71,53-84,27) |
|
| |||
| Consulta neurovascular | 163 | 100 | (100) |
|
| |||
| Tratamiento | |||
| Antiagregante | 145 | 89 | (84,2-93,8) |
| Anticoagulante | 14 | 8,6 | (4,29-12,9) |
| Estatina | 138 | 84,7 | (79,17-90,23) |
|
| |||
| MACE a los 90 días | 8 | 4,9 | (1,59-8,21) |
| AIT | 5 | 3,1 | (0,43-5,76) |
| SCA | 1 | 0,6 | (–1,171-1,79) |
| Muerte CV | 2 | 1,2 | (–0,943-2,87) |
AIT: accidente isquémico transitorio; AS: analítica de sangre; CI: cardiopatía isquémica; CV: cardiovascular; DLP: dislipidemia; DM2: diabetes mellitus de tipo 2; DTC: Doppler transcraneal; EAP: enfermedad arterial periférica; ECG: electrocardiograma; EDTSA: eco-Doppler de troncos supraaórticos; FA: fibrilación auricular; FRCV: factor de riesgo cardiovascular; HTA: hipertensión arterial; IC 95%: intervalo de confianza al 95%; MACE: eventos adversos cardiovasculares mayores; RM: resonancia magnética; Rx: radiografía; SBP: sobrepeso; SCA: síndrome coronario agudo; TC: tomografía computarizada.
Tabla III.
Análisis bivariante.
| Variable dependiente: Muerte a los 90 días (n = 2) | Variable independiente | Sí | No | χ 2 | Valor de p |
|
| |||||
| Anticoagulación | 2 (14,3%) | 0 (0%) | 21,55 | 0,007a | |
|
| |||||
| Antiagregación | 0 (0%) | 2 (11,1%) | 16,311 | 0,012a | |
|
| |||||
| Fibrilación auricular | 2 (13,3%) | 0 (0%) | 19,978 | 0,008a | |
|
| |||||
| Diabetes mellitus de tipo 2 | 2 (5,4%) | 0 (0%) | 6,895 | 0,05b | |
|
| |||||
| Sobrepeso | 2 (100%) | 0 (0%) | 1,78 | 0,49 | |
|
| |||||
| Cardiopatía isquémica | 1 (50%) | 1 (50%) | 5,4 | 0,142 | |
|
| |||||
| Enfermedad arterial periférica | 0 (0%) | 2 (100%) | 0,064 | 1 | |
|
| |||||
| Ictus previo | 1 (50%) | 1 (50%) | 3,13 | 0,209 | |
|
| |||||
| Hipertensión arterial | 2 (100%) | 0 (0%) | 1,39 | 0,515 | |
|
| |||||
| Dislipidemia | 1 (50%) | 1(50%) | 0,076 | 1 | |
|
| |||||
| Sexo varón | 2 (100%) | 0 (0%) | 1,858 | 0,498 | |
|
| |||||
| Variable dependiente: MACE a los 90 días (n = 8) | Cardiopatía isquémica | 3 | 5 | 11,2 | 0,014a |
|
| |||||
| Sexo varón | 3 (37,5%) | 5 (62,5%) | 0,723 | 0,481 | |
|
| |||||
| Fibrilación auricular | 2 (25%) | 6 (75%) | 0,823 | 0,314 | |
|
| |||||
| Anticoagulación alta | 2 (25%) | 6 (75%) | 2,88 | 0,142 | |
|
| |||||
| Antiagregación alta | 6 (75%) | 2 (25%) | 1,67 | 0,216 | |
|
| |||||
| Lesión DW+ en la RM cerebral | 0 (0%) | 4 (50%) | 0,644 | 1 | |
|
| |||||
| Sobrepeso | 6 (75%) | 2 (25%) | 1,609 | 0,285 | |
|
| |||||
| Enfermedad arterial periférica | 0 (0%) | 8 (100%) | 0,266 | 1 | |
|
| |||||
| Ictus previo | 1 (12,5%) | 7 (87,5%) | 0,018 | 1 | |
|
| |||||
| Hipertensión arterial | 5 (62,5%) | 3 (37,5%) | 0,031 | 1 | |
|
| |||||
| Dislipidemia | 4 (50%) | 4 (50%) | 0,316 | 0,716 | |
|
| |||||
| Diabetes mellitus de tipo 2 | 2 (25%) | 6 (75%) | 0,025 | 1 | |
|
| |||||
| Variable dependiente: DW+ RM cerebral (N = 17) | Variable independiente | Sí | No | Valor de p (t de Student) | IC |
|
| |||||
| Puntuación en la escala ABCD2 | 17 | 109 | 0,023* | [–1,388, –0,104] | |
|
| |||||
| Puntuación en la escala ABCD3-I | 17 | 109 | 0,000* | [–2,881, –1,078] | |
|
| |||||
| Duración de los síntomas (minutos) | 16 | 99 | 0,170 | [–209,6, 40,4] | |
|
| |||||
| Variable dependiente: DW+ RM cerebral (n = 17) | Variable independiente | Sí | No | Valor de p (t de Student) | IC |
|
| |||||
| Puntuación en la escala ABCD2 | 17 | 109 | 0,023* | [–1,388, –0,104] | |
|
| |||||
| Puntuación en la escala ABCD3-I | 17 | 109 | 0,000* | [–2,881, –1,078] | |
|
| |||||
| Duración de los síntomas (minutos) | 16 | 99 | 0,170 | [–209,6, 40,4] | |
Se encontró asociación entre muerte por causa cardiovascular a los 90 días con anticoagulación al altaa, no antiagregacióna, fibrilación auriculara y la tendencia a la asociación con diabetes mellitusb. Los MACE a los 90 días se asociaron con el antecedente de cardiopatía isquémicaa. No se encontró asociación entre la duración de los síntomas y la presencia de lesión isquémica aguda en secuencias de difusión. No hubo relación entre MACE a los 90 días, ictus/accidente isquémico transitorio, síndrome coronario agudo o muerte cardiovascular a los 90 días con el resto de las variables estudiadas. DW+: restricción a la difusión; MACE: eventos adversos cardiovasculares mayores; RM: resonancia magnética.
Discusión
Los AIT son trastornos muy frecuentes tanto en los servicios de urgencias como en atención primaria. Entre enero de 2016 y diciembre de 2019, se diagnosticó desde el servicio de urgencias a 591 pacientes con accidente isquémico transitorio y se realizaron 163 protocolos AIT. Si bien un grupo de pacientes fue atendido mediante vía convencional pese a ser candidatos al protocolo, los procedimientos que se implementan en un hospital están sometidos a una curva de aprendizaje por parte de los facultativos. Aunque el protocolo se realizó a menos del 50% de los pacientes, a lo largo de estos cuatro años pudimos observar una tendencia ascendente en el número de protocolos puestos en marcha, especialmente a partir del cuarto año. Se incluyó a pacientes con síntomas en las últimas 72 horas, dado que el riesgo de recurrencia es mayor en los primeros días [1,2].
Los pacientes con etiología conocida y correctamente tratada fueron valorados de forma convencional con los estudios pertinentes y fueron remitidos a consultas de neurología con estudio ambulatorio completo, dado que estos pacientes podrían estar en riesgo de recurrencia en caso de existir un origen indeterminado por causas coexistentes o bien por una causa etiológica reconocida, pero no controlada. Sin embargo, no se incluyeron en el protocolo AIT per se. Efectivamente, esto puede implicar un sesgo de selección a la hora de analizar los resultados y dificultar la inferencia a la población diana. Los pacientes seleccionados para el protocolo AIT son derivados de forma preferente para valoración multidisciplinar. Debido a la alta demanda asistencial y la falta de recursos, fue preciso priorizar y seleccionar los casos susceptibles. Por otro lado, la exclusión de pacientes con comorbilidades significativas o valorados sólo por el servicio de urgencias también limita los datos extraíbles de este análisis, aunque parte de ellos presentaba síntomas de naturaleza inespecífica, poco localizadora y no claramente sugestivos de causa vascular.
Pese a todo, los protocolos de actuación rápida parecen ser eficaces, seguros y de fácil reproductibilidad, sin perder de vista que estos pacientes requieren una valoración multidisciplinar. Debido a su alta incidencia, todo ello podría derivar en una sobrecarga asistencial, por lo que la selección de los pacientes debe ir dirigida al perfil de pacientes presentado con el fin de optimizar los recursos disponibles. Su implementación podría beneficiar a los hospitales, evitando ingresos innecesarios, así como garantizar una atención precoz en centros donde no se dispone de neurólogo de guardia [7,10]. Esta iniciativa ya ha sido validada en centros de diversos países, como se recoge en el estudio francés SOSTIA [13], que disminuyó un 26% de los ingresos entre 2003 y 2005, y también la tasa de recurrencias. De forma paralela, el estudio EXPRESS [14] realizado en el Reino Unido implementó una consulta de atención a las 24 horas del evento con resultados similares. Cereda et al [15] afirman que estos protocolos suponen un mejor perfil coste-beneficio frente a la hospitalización de los pacientes, ingresando solo a los de alto riesgo que se puedan beneficiar de un rápido acceso a la terapia de revascularización en caso de fluctuaciones clínicas. Najib et al [16] realizaron en 2019 una revisión sistemática objetivando resultados favorables, y encontraron un riesgo de ictus del 3,1% a las 48 horas.
A pesar de que inicialmente se plantearon 15 días como tiempo de espera óptimo para ser valorado en la consulta de patología neurovascular, 30 días parece un tiempo más asumible y realista, por lo que se ha propuesto su modificación.
Hasta hace unos años, la necesidad de realizar una resonancia magnética a estos pacientes había sido motivo de controversia. Actualmente se considera el estudio de elección [17] asociando lesiones en DWI con mayor riesgo de recurrencia [18], y los porcentajes de pacientes con lesión en DWI alcanzan el 22% [19], el 32% [20] o incluso el 50% [21]. En nuestro centro, se realizó una resonancia magnética al 77,9%, y se objetivó lesión aguda en el 13,5%. Debido a su relevancia clínica, se ha propuesto la inclusión en escalas como la ABCD3-I y las de la American Heart Association y la American Stroke Association [1,22]. Dado el volumen de pacientes asistidos por AIT, se ha cuestionado si la realización de una resonancia magnética cerebral es coste-efectiva, con resultados favorables [23].
Aunque algunos grupos como Graham et al [24] abogan por el empleo de la angiotomografía computarizada cerebral urgente, consideramos que la neurosonología puede ser suficiente y adecuada para una primera valoración de estos pacientes en urgencias, que se puede completar con una angiotomografía computarizada en los casos pertinentes.
El estudio del ritmo cardíaco es necesario, ya que la FA se diagnostica frecuentemente tras sufrir un ictus o un AIT [25]. En nuestra serie, se solicitó un Holter-electrocardiograma de 24 horas aproximadamente a la mitad de los pacientes, y se detectó un 3,6% de casos con FA. Sin embargo, el número de FA diagnosticadas a los 90 días fue del 14,1%, datos ligeramente inferiores a los descritos por Sposato et al [26]. Parece razonable realizar un seguimiento de los casos con etiología incierta, sopesando la utilización de otras herramientas, como los dispositivos implantables.
Por nuestra parte, se inició tratamiento con anticoagulantes de acción directa a todos los pacientes diagnosticados de FA de novo. A pesar de la controversia existente y de las limitaciones en su prescripción [27], la evidencia científica y las guías europeas de fibrilación auricular de 2016 de novo indican los anticoagulantes de acción directa de forma preferible a los antagonistas de la vitamina K para el tratamiento preventivo de estos pacientes con nivel de evidencia IA [28].
Encontramos una prevalencia de MACE a los 90 días del 4,9%, similar a la notificada por Hosier et al (4,2%) [12]. El estudio RAVEN [29] incluía una valoración por neurología y un estudio neurovascular en 24 horas. Mostró una recurrencia de AIT del 4,9% y de ictus del 0,9%, Nuestra prevalencia de AIT a los 90 días fue del 3,1%, ligeramente inferior a la señalada por el estudio RAVEN, aunque superior a las descritas por los estudios SOSTIA [13] y EXPRESS [14]. La prevalencia de síndrome coronario agudo y de muerte por causa cardiovascular en nuestro estudio fue del 0,6 y el 1,2% respectivamente. Boulanger et al [30] realizaron una revisión sistemática analizando la incidencia de infarto de miocardio e ictus tras un AIT, y objetivaron una incidencia del 1,67 y del 4,26%, respectivamente. Observaron que el riesgo de MACE era el doble en varones con antecedente de hipertensión arterial, síndrome coronario agudo o enfermedad arterial periférica. En nuestra serie, también observamos una relación entre MACE y antecedente de cardiopatía isquémica. No obstante, estas asociaciones no demuestran causalidad y deben interpretarse con precaución, dado que se trata de un análisis bivariante no estratificado y puede estar sujeto a sesgos de confusión. En relación con la prevalencia de MACE a 90 días, éstos son entidades graves y es poco frecuente que pasen inadvertidos. Sin embargo, es posible que algunos pacientes no consultaran o lo hicieran fuera de la provincia, afectando a los resultados de nuestra serie.
Como conclusión, los protocolos de actuación rápida para manejo de AIT son seguros y eficaces, y evitan ingresos hospitalarios sin aumentar el riesgo de recurrencia de ictus o eventos cardiovasculares mayores. Algunos antecedentes, como cardiopatía isquémica, FA, anticoagulación y posiblemente diabetes mellitus, podrían implicar un peor pronóstico. Si bien nuestro estudio presenta algunas limitaciones en relación con el perfil de pacientes no incluidos, nuestro objetivo era analizar el riesgo de recurrencia y eventos cardiovasculares a los 90 días en pacientes candidatos a este protocolo y no un análisis de tasa de recurrencia de AIT de forma global. Podría ser interesante realizar un estudio comparativo entre los pacientes valorados en urgencias por AIT mediante una asistencia convencional frente al protocolo AIT con el fin de esclarecer la existencia de diferencias pronósticas.
Agradecimientos:
Agradecer la colaboración de todos los compañeros de los servicios implicados: urgencias, neurología, cardiología y radiodiagnóstico del Hospital Clínico Lozano Blesa.
Bibliografía
- 1.Bellolio MF, Poblete R, Cabrera D, Latha S, Sergio AC, Peñafiel S. Evaluación y manejo del paciente con accidente isquémico transitorio. Rev Chilena Med Intensiv. 2007;22:35–44. [Google Scholar]
- 2.Joundi RA, Saposnik G. Organized outpatient care of patients with transient ischemic attack and minor stroke. Semin Neurol. 2017;37:383–90. doi: 10.1055/s-0037-1603510. [DOI] [PubMed] [Google Scholar]
- 3.Cruz-Flores S. Acute stroke and transient ischemic attack in the outpatient clinic. Med Clin N Am. 2017;101:479–94. doi: 10.1016/j.mcna.2017.01.001. [DOI] [PubMed] [Google Scholar]
- 4.Ishihara T, Sato S, Uehara T, Ohara T, Hayakawa M, Kimura K, et al. Significance of nonfocal symptoms in patients with transient ischemic attack:the PROMISE-TIA study. Stroke. 2018;49:99–100. doi: 10.1161/STROKEAHA.118.022009. [DOI] [PubMed] [Google Scholar]
- 5.Behrouz R. Transient ischemic attack:a diagnosis of convenience. Am J Emerg Med. 2017;35:1979–81. doi: 10.1016/j.ajem.2017.06.045. [DOI] [PubMed] [Google Scholar]
- 6.Bose P, Tarrant C, Mistri AK, Wilson A. Managing uncertainty:a qualitative study of GPs'views on the diagnosis and immediate management of transient ischaemic attack and the potential of a diagnostic tool. Fam Pract. 2018;35:738–43. doi: 10.1093/fampra/cmy024. [DOI] [PubMed] [Google Scholar]
- 7.Palomeras Soler E, Fossas Felip P, Cano Orgaz AT, Sanz Cartagen P, Casado Ruiz V, Muriana Batista D. Evaluación rápida del ataque isquémico transitorio en un hospital sin guardias de neurología. Neurol. 2015;30:325–330. doi: 10.1016/j.nrl.2013.12.021. [DOI] [PubMed] [Google Scholar]
- 8.Song B, Fang H, Zhao L, Gao Y, Tan S, Lu J, et al. Validation of the ABCD3-I score to predict stroke risk after transient ischemic attack. Stroke. 2013;44:1244–8. doi: 10.1161/STROKEAHA.113.000969. [DOI] [PubMed] [Google Scholar]
- 9.Oostema JA, Brown MD, Reeves M. Emergency department management of transient ischemic attack:a survey of emergency physicians. J Stroke Cerebrovasc. 2016;25:1517–23. doi: 10.1016/j.jstrokecerebrovasdis.2016.02.028. [DOI] [PubMed] [Google Scholar]
- 10.Ranta A, Barber PA. Transient ischemic attack service provision. A review of available service models. Neurology. 2016;86:1–7. doi: 10.1212/WNL.0000000000002339. [DOI] [PubMed] [Google Scholar]
- 11.González A, Arrieta T, Solís L, Pérez M, Ramírez MR. Estudio con ultrasonido Doppler color en la caracterización de la enfermedad aterosclerótica carotídea oclusiva sintomática. Rev Chil Radiol. 2009;15:110–21. [Google Scholar]
- 12.Hosier GW, Phillips SJ, Doucette SP, Magee KD, Gubitz GJ. Transient ischemic attack:management in the emergency department and impact of an outpatient neurovascular clinic. CJEM. 2016;1:9. doi: 10.1017/cem.2016.3. [DOI] [PubMed] [Google Scholar]
- 13.Lavallée PC, Meseguer E, Abboud H, Cabrejo L, Olivot JM, Simon O, et al. A transient ischemic attack clinic with round-the-clock access (SOS-TIA):feasibility and effects. Lancet Neurol. 2007;6:953–60. doi: 10.1016/S1474-4422(07)70248-X. [DOI] [PubMed] [Google Scholar]
- 14.Rothwell PM, Giles MF, Chandratheva A, Masquardt L, Geraghty O, Redgrave JNE, et al. Effect of urgent treatment of transient ischaemic attack and minor stroke on early recurrent stroke (EXPRESS study):a prospective population-based sequential comparison. Lancet. 2007;370:1432–42. doi: 10.1016/S0140-6736(07)61448-2. [DOI] [PubMed] [Google Scholar]
- 15.Cereda CW, Olivot JM. Emergency department (ED) triage for transient ischemic attack (TIA) Curr Atheroscler Rep. 2018;20:56. doi: 10.1007/s11883-018-0755-5. [DOI] [PubMed] [Google Scholar]
- 16.Najib N, Magin P, Lasserson D, Quain D, Attia J, Oldmeadow C, et al. Contemporary prognosis of transient ischemic attack patients:a systematic review and metaanalysis. Int J Stroke. 2019;14:460–7. doi: 10.1177/1747493018823568. [DOI] [PubMed] [Google Scholar]
- 17.Chalela J. Manejo del accidente isquémico transitorio. Capítulo 8. [Fecha última consulta:05.01.2021]. URL:http: //www.acnweb.org/guia/g5cap8.pdf .
- 18.Coutts SB. Diagnosis and management of transient ischemic attack. Continuum. 2017;23:82–92. doi: 10.1212/CON.0000000000000424. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Jarhult SJ, Howell ML, Barnaure-Nachbar I, Chang Y, White BA, Amantangelo M, et al. Implementation of a Rapid, protocol based TIA management pathway. West J Emerg Med. 2018;19:216–23. doi: 10.5811/westjem.2017.9.35341. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Al-Khaled M, Eggers J. Hallazgos en RM y riesgo de accidente cerebrovascular en pacientes con AIT con diferente duración sintomática. Neurology. 2013;80:1920–6. [Google Scholar]
- 21.Aiba Y, Sakakibara R, Tateno F, Ogata T, Nagao T, Terada H, et al. Transient ischemic attack:which determines diffusion- weighted imagen positivity? J Stroke Cerebrovasc. 2019;28:104397. doi: 10.1016/j.jstrokecerebrovasdis.2019.104397. [DOI] [PubMed] [Google Scholar]
- 22.Sehatzadeh S. Is transient ichemic attack a medical emergency?An evidence-based analysis. Ont Health Technol Assess Ser. 2015;15:1–45. [PMC free article] [PubMed] [Google Scholar]
- 23.Parody Rúa E, Pedraza Gutierrez S, Caminal Homar J, García Gil MM, Serena Leal J, Dávalos Errando A. Influencia del diagnóstico precoz con resonancia magnética el infarto cerebral agudo en la función global de salud y en los costes de la atención al paciente. Gest y Eval Cost Sanit. 2013;14:409–18. [Google Scholar]
- 24.Graham BR, Menon BK, Coutts SB, Goyal M, Demchuk AM. Computed tomographic angiography in stroke and high-risk transient ischemic attack:do not leave the emergency department without it! J Stroke. 2018;13:673–86. doi: 10.1177/1747493018764172. [DOI] [PubMed] [Google Scholar]
- 25.Cerasuolo JO, Cipriano LE, Sposato LA. The complexity of atrial fibrillation newly diagnosed after ischemic stroke and transietnt ischemic attack:advances and uncertainties. Curr Opin Neurobiol. 2017;30:28–37. doi: 10.1097/WCO.0000000000000410. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Sposato LA, Cipriano LE, Saposnik G, Ruiz Vargas E, Riccio PM, Hachinski V. Diagnosis of atrial fibrillation after stroke and transient ischaemic attack:a systematic review and meta-analysis. Lancet Neurol. 2015;14:377–87. doi: 10.1016/S1474-4422(15)70027-X. [DOI] [PubMed] [Google Scholar]
- 27.Cosin Sales J, Olalla JJ. Tratamiento farmacológico de la fibrilación auricular. Antiarrítmicos y anticoagulantes orales. Rev Esp Cardiol Supl. 2016;16:33–9. [Google Scholar]
- 28.Kirchhof P, Benussi S, Kotecha D, Ahlsson A, Atar D, Casadei B, et al. Guía ESC 2016 sobre el diagnóstico y tratamiento de la fibrilación auricular, desarrollada en colaboración con la EACTS. Rev Esp Cardiol. 2016;70:43.e1–84. [Google Scholar]
- 29.Chang BP, Rostanski S, Willey J, Miller EC, Shapiro S, Mehendale R, et al. Safety and feasibility of a rapid outpatient management strategy for transient ischemic attack and minor stroke:the rapid Access vascular evaluation-neurology (RAVEN) approach. Ann Emerg Med. 2019;74:562–71. doi: 10.1016/j.annemergmed.2019.05.025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Boulanger M, Béjot Y, Rothwell PM, Touz E. Long-term risk of myocardial infarction compared to recurrent stroke after transient ischemic attack and ischemic stroke:systematic review and meta-analysis. J Am Heart Assoc. 2018;7:e007267. doi: 10.1161/JAHA.117.007267. [DOI] [PMC free article] [PubMed] [Google Scholar]


