Abstract
Introducción.
Dado que la vacunación contra el SARS-CoV-2 está en curso en México y se han notificado casos de Guillain-Barré, es necesaria la validación de los criterios de Brighton en México. La epidemiología de Guillain-Barré en México difiere de la de los países europeos y norteamericanos.
Objetivo.
Describir las características clínicas, cerebroespinales y electrodiagnósticas en pacientes mexicanos con diagnóstico de Guillain-Barré y clasificarlos según los criterios diagnósticos del Brighton Collaboration Group.
Pacientes y métodos.
Se realizó un estudio de cohorte ambispectivo. Se incluyó a pacientes que cumplen con los criterios del National Institute of Neurological Disorders and Stroke para el síndrome de Guillain-Barré (SGB). Se clasificó a los pacientes según los niveles de certeza del Brighton Collaboration Group para el SGB.
Resultados.
El 68% de los pacientes eran hombres. De los 248 pacientes incluidos, el 58,4% tenía antecedentes de infección previa. La media desde el inicio de los síntomas hasta el ingreso fue de 5 (1-30) días, y la puntuación media de la suma del Medical Research Council, de 30,3 ± 15,5. El nivel 1 de certeza según los criterios del Brighton Collaboration Group se cumplió en el 54,6% de los pacientes; el nivel 2, en el 45%; y el nivel 4, en el 0,6%. Los pacientes que alcanzaron el nivel 2 de certeza se debieron principalmente a hallazgos normales en el líquido cefalorraquídeo o a hallazgos en estudios de neuroconducción que no cumplen los criterios de ninguna variante de SGB.
Conclusión.
El SGB es una neuropatía autoinmune frecuente que se ha asociado con infecciones previas y con campañas de vacunación. Para la campaña de vacunación contra el SARS-CoV-2 en México es necesaria la validación de los criterios de Brighton. Aunque la epidemiología del SGB en México ha ido cambiando a lo largo de los últimos años, este estudio proporciona datos similares en comparación con otros países.
Palabras clave: Autoinmune, Criterios de Brighton, México, Polineuropatía, Síndrome de Guillain-Barré, Validación
Introducción
El síndrome de Guillain-Barré (SGB) es la causa más común de parálisis flácida aguda en todo el mundo [1]. Actualmente, existe la idea errónea de que el SGB es una enfermedad benigna, ya que el 20% de los pacientes no puede caminar de forma independiente a los seis meses y el 5% muere [2].
Los primeros criterios de diagnóstico de SGB fueron propuestos por el National Institute of Neurological and Communicative Disorders and Stroke en 1978 como respuesta a la creciente frecuencia de SGB en personas vacunadas contra el virus de la gripe de origen porcino [3]. Estos criterios fueron reevaluados por Asbury et al en 1990, hasta que el Brighton Collaboration Group propuso criterios de diagnóstico basados en las características clínicas, el análisis del líquido cefalorraquídeo (LCR), y los hallazgos electrofisiológicos y clasificados en niveles de certeza [4]. Estos nuevos criterios se propusieron en respuesta a la mayor frecuencia del SGB durante la campaña de vacunación contra la gripe porcina H1N1. Estas nuevas definiciones de casos de Brighton ya han sido validadas en los Países Bajos [5], Bangladés [6], Malasia [7], Dinamarca [8], Irán [9], Japón [10] e India [11].
Dado que la vacunación contra el SARS-CoV-2 está en curso en México y se han notificado casos de SGB, es necesaria la validación de los criterios de Brighton en México. Además, la epidemiología del SGB en México difiere de la de los países europeos y norteamericanos. El objetivo del presente estudio es describir las características clínicas, del LCR y electrodiagnósticas en población mexicana diagnosticada con SGB y clasificarlas según los criterios diagnósticos del Brighton Collaboration Group.
Pacientes y métodos
Pacientes
Este estudio se basó en una cohorte ambispectiva de 248 pacientes ingresados en el Instituto Nacional de Neurología y Neurocirugía en la Ciudad de México entre enero de 2016 y agosto de 2021. Incluimos a pacientes que cumplieron con los criterios de diagnóstico del National Institute of Neurological Disorders and Stroke para el SGB y que fueron evaluados por un neurólogo. Se incluyó a pacientes que no podían caminar de forma independiente, que presentaban una progresión rápida de la debilidad o insuficiencia respiratoria, o los que tenían disfunción autonómica o deglutoria grave. También se incluyó a pacientes con debilidad leve que aún progresaban y que ingresaron para observación. Se excluyó a pacientes menores de 18 años, con diagnóstico de Miller-Fisher, de encefalitis del tronco encefálico de Bickerstaff o de polineuropatía desmielinizante inflamatoria crónica, o a pacientes con un episodio previo de SGB.
Recopilamos datos clínicos y demográficos mediante un protocolo estandarizado que incluye edad, sexo, momento de aparición de los síntomas en el momento del diagnóstico, antecedentes de infección previa, afectación de los nervios craneales, disfunción autonómica y tipo de tratamiento. La debilidad se evaluó mediante el sistema de puntuación del Medical Research Council (MRC) en el momento del diagnóstico y el punto más bajo, que va de 0 a 60 [12]. El nadir se definió como el momento con la mayor puntuación de discapacidad por la Global Deterioration Scale (GDS) o la puntuación más baja de la suma del MRC. La gravedad clínica se evaluó mediante la GDS, con un rango de 0 (normal) a 6 (muerte) [13]. La debilidad también se clasificó como simétrica y asimétrica. La debilidad simétrica se definió como una diferencia de cinco o menos en las puntuaciones de la suma del MRC entre las extremidades izquierda y derecha.
La duración de la fase de meseta se definió como el número de días entre el nadir y la mejora de cinco o más puntos en la puntuación total del MRC o uno o más puntos en la puntuación de discapacidad del síndrome de Guillain-Barre. Las fluctuaciones relacionadas con el tratamiento se definieron como un cambio en la puntuación de la GDS de 1 o más que ocurría dentro de las ocho semanas posteriores al inicio del tratamiento después de una mejoría o estabilización [14].
Se registró la presencia de disfunción autonómica en cualquier momento de la evolución del paciente y se definió como la variabilidad de la frecuencia cardíaca o de la presión arterial no explicada por otras causas. El tipo de tratamiento que recibió cada paciente lo definió un neurólogo en función de la disponibilidad del tratamiento y las comorbilidades de los pacientes. Los pacientes recibieron inmunoglobulina intravenosa 2 g/kg en cinco días consecutivos o plasmaféresis 200 mL/kg en cinco sesiones en días alternos.
Se recolectó líquido cefalorraquídeo en el ingreso y se clasificó como normal un nivel de proteína ≤ 45 mg/dL, un recuento de células ≤ 5 células/µL y una glucosa ≥ dos tercios de la glucosa sérica o dentro de los rangos normales. La disociación albuminocitológica se definió como la presencia de elevación de proteínas > 45 mg/dL con un recuento de células en el LCR ≤ 50 células/µL. Además, el recuento de células en el LCR ≥ 5 células/µL se consideró como pleocitosis. Los estudios de conducción nerviosa los realizó un neurofisiólogo experimentado y se definieron como axonales, desmielinizantes, equívocos, inexcitables y normales según los criterios electrofisiológicos de Hadden [15].
Los pacientes de este estudio se clasificaron según los criterios del Brighton Collaboration Group para el SGB (Tabla I). El estudio fue aprobado por nuestro comité de ética local y todos los pacientes dieron su consentimiento informado por escrito.
Tabla I.
Criterios del Brighton Collaboration Group para el síndrome de Guillain-Barré.
| 1 | 2 | 3 | 4 | |
|---|---|---|---|---|
| Debilidad bilateral y flácida de las cuatro extremidades | + | + | + | +/– |
|
| ||||
| Hipo/arreflexia en las extremidades débiles | + | + | + | +/– |
|
| ||||
| Curso monofásico y tiempo entre el inicio de los síntomas y el nadir de 12 horas a 28 días | + | + | + | +/– |
|
| ||||
| Cuenta celular en el LCR < 50 /µL | + | +a | – | +/– |
|
| ||||
| Concentración de proteínas en el LCR > normal | + | +/–a | – | +/– |
|
| ||||
| Estudios de neuroconducciones consistentes con algún subtipo de Guillain-Barré | + | +/–a | – | +/– |
|
| ||||
| Ausencia de diagnósticos alternativos | + | + | + | + |
+: presente; –: ausente; LCR: líquido cefalorraquídeo; NCS: estudios de conducción nerviosa.
Si no se recolecta LCR o los resultados no están disponibles, los resultados neurofisiológicos deben ser consistentes con el diagnóstico de síndrome de Guillain-Barré.
Análisis estadístico
Para el análisis descriptivo se determinó la distribución de las variables continuas con la prueba de Kolmogorov-Smirnov. Las variables se describieron como medias y desviación estándar si se distribuían normalmente o medianas y rangos intercuartílicos si no se distribuían normalmente. Las variables categóricas se describieron como frecuencias y porcentajes. Para buscar diferencias entre grupos se utilizó la prueba t de Student para comparar medias y la prueba U de Mann-Whitney para comparar medianas. Se consideró estadísticamente significativo un valor de p < 0,05. Se utilizó SPSS Statistics 22.0 para los análisis estadísticos.
Resultados
Características clínicas
Los datos clínicos y demográficos de los 248 pacientes con SGB incluidos en este estudio se presentan en la tabla II. El 68% de los pacientes eran hombres y la mediana de edad en el ingreso fue de 46 años. De los 248 pacientes incluidos, el 58,4% tenía antecedentes de infección previa, ya sea gastrointestinal o respiratoria. El promedio de tiempo desde el inicio de los síntomas hasta el ingreso fue de 5 (1-30) días.
Tabla II.
Características clínicas y demográficas de los pacientes con síndrome de Guillain-Barré.
| n (%) | |
|---|---|
| Sexo masculino | 168 (67,7) |
|
| |
| Edad, mediana (mín.-máx.) | 46 (18-86) |
|
| |
| Infección precedente | |
|
| |
| Diarrea | 92 (37,1) |
|
| |
| Infección respiratoria | 53 (21,4) |
|
| |
| Puntuación de la GDS en el ingreso | |
|
| |
| 2 | 26 (10,4) |
|
| |
| 3 | 37 (14,9) |
|
| |
| 4 | 110 (44,3) |
|
| |
| 5 | 75 (30,2) |
|
| |
| Síntomas sensitivos | 154 (62) |
|
| |
| Implicación de los nervios del cráneo | 135 (54,4) |
|
| |
| Disfunción autonómica | 67 (27) |
|
| |
| Tratamiento | |
|
| |
| Recambio plasmático | 65 (26,2) |
|
| |
| Inmunoglobulina intravenosa | 141 (56,9) |
|
| |
| Tratamiento de soporte únicamente | 42 (16,9) |
GDS: Global Deterioration Scale.
La figura 1 muestra el día de máxima debilidad durante la evolución del paciente. El 94,7% presentó debilidad tanto en las extremidades superiores como en las inferiores, y el 94% presentó disminución de los reflejos de estiramiento muscular y una puntuación media de la suma de la MRC de 30,3 ± 15,5. Los pacientes con reflejos de estiramiento muscular disminuidos tenían mayor debilidad a través de la escala de puntuación del MRC frente a los pacientes con reflejos de estiramiento muscular normales (29,7 ± 15,5 frente a 41,7 ± 12,5 puntos; p = 0,009). En el 80% de los pacientes, el tiempo desde el inicio de los síntomas hasta el nadir fue de 4 (1-24) días. En el nadir, sólo el 3,2% presentó reflejos de estiramiento muscular normales y la puntuación en la escala de puntuación del MRC fue de 28,5 ± 1,5. Casi el 98% de los pacientes tuvo un curso monofásico. De los 141 pacientes que fueron tratados con inmunoglobulina intravenosa, seis (4,2%) presentaron fluctuaciones relacionadas con el tratamiento (Tabla III).
Figura 1.
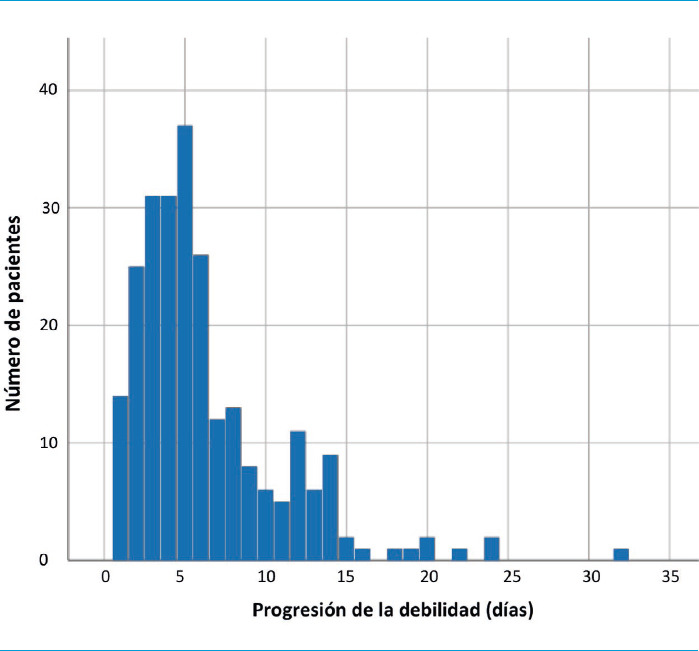
Evolución de la debilidad (días) a la llegada de los pacientes a urgencias.
Tabla III.
Características diagnósticas para los pacientes con síndrome de Guillain-Barré.
| Características clínicas en el ingreso | n (%) | |
|---|---|---|
| Fuerza normal | 5 (2) | |
|
| ||
| Debilidad unilateral | 0 (0) | |
|
| ||
| Debilidad en las extremidades superiores e inferiores | 235 (94,7) | |
|
| ||
| Debilidad exclusiva en las extremidades inferiores | 5 (2) | |
|
| ||
| Debilidad exclusiva en las extremidades superiores | 3 (1,2) | |
|
| ||
| Gravedad de la debilidad (puntuación de la suma del MRC), media ± DE | 30,3 ± 15,5 | |
|
| ||
| Hipo/arreflexia | 233 (94) | |
|
| ||
| Reflejos normales en las extremidades superiores afectadas | 9 (3,6) | |
|
| ||
| Reflejos normales en las extremidades inferiores afectadas | 6 (2,4) | |
|
| ||
| Duración de la fase progresiva | Número de días entre el inicio de los síntomas y el ingreso | 5 (1-30) |
|
| ||
| Número de días entre el inicio de los síntomas y el nadir | 4 (1-24) | |
|
| ||
| Síntomas neurológicos en el nadir | Debilidad en las extremidades superiores e inferiores | 239 (96,3) |
|
| ||
| Debilidad exclusiva en las extremidades inferiores | 3 (1,2) | |
|
| ||
| Debilidad exclusiva en las extremidades superiores | 1 (0,4) | |
|
| ||
| Hipo/arreflexia | 242 (97,6) | |
|
| ||
| Reflejos normales en las extremidades afectadas | 6 (2,4) | |
|
| ||
| Gravedad de la debilidad (puntuación de la suma del MRC) | 28,5 ± 16,5 | |
|
| ||
| Fluctuaciones en el curso clínico | Curso monofásico | 242 (97,5) |
|
| ||
| Fluctuaciones asociadas a tratamiento en las primeras ocho semanas | 6/141 (4,1) | |
|
| ||
| Análisis del LCR (n = 182) | Recuento celular < 5 µL | 158 (86,8) |
|
| ||
| Recuento celular entre 5 y 10 µL | 15 (8,2) | |
|
| ||
| Recuento celular entre 10 y 30 µL | 4 (2,2) | |
|
| ||
| Recuento celular entre 30 y 50 µL | 2 (1) | |
|
| ||
| Recuento celular > 50 µL | 3 (1,6) | |
|
| ||
| Elevación de proteínas > 45 mg/dL | 100 (54,9) | |
|
| ||
| Estudio electrofisiológico (n = 229) | subtipo desmielinizante | 105 (45,8) |
|
| ||
| subtipo azonal | 102 (44,5) | |
|
| ||
| Inexcitable | 10 (4,4) | |
|
| ||
| Equívoco | 9 (3,9) | |
|
| ||
| Normal | 3 (1,3) | |
DE: desviación estándar; LCR: líquido cefalorraquídeo; MRC: Medical Research Council.
Análisis del líquido cefalorraquídeo
Se realizó una punción lumbar a 182 (73,3%) de los 248 pacientes incluidos. La mediana del intervalo de tiempo entre el inicio de los síntomas y el análisis del LCR fue de 6 (RIC 6-9) días. Se realizó una punción lumbar dentro de los siete días desde el inicio de los síntomas a 119 pacientes (65,3%). La mediana de la concentración de proteínas fue de 49,5 –rango intercuartílico (RIC): 32-87,5– mg/dL, el 54,9% tenía una concentración de proteínas elevada y el 86,8% tenía < 5 células/µL (Fig. 2). Ningún paciente presentó > 50 células/µL en el análisis del LCR. Las punciones lumbares realizadas > 7 días después del inicio de los síntomas tuvieron mayor concentración de proteínas que las realizadas ≤ 7 días –48 (40,3%) frente a 53 (84,1%); p ≤ 0,001–.
Figura 2.
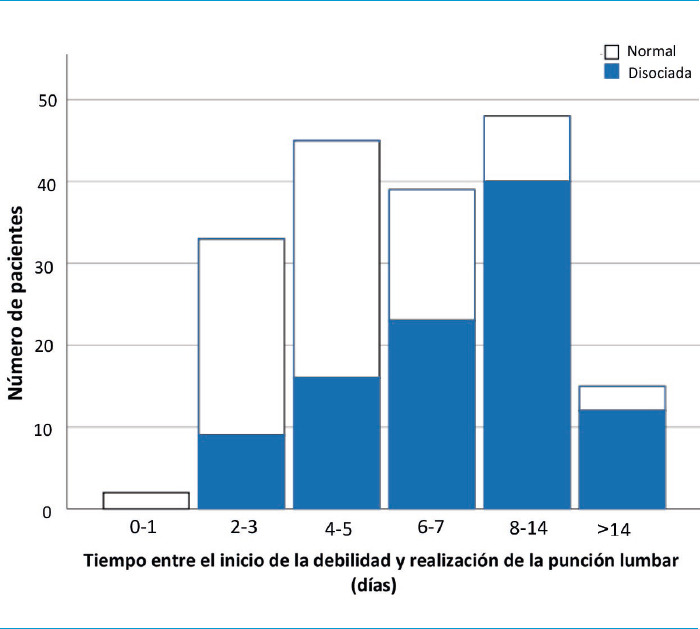
Tiempo entre el inicio de la debilidad y la realización de la punción lumbar.
Estudios de conducción nerviosa
Se realizaron estudios de conducción nerviosa en 229 (92,3%) de los 248 pacientes incluidos. La mediana de tiempo desde el inicio de los síntomas y la exploración del estudio de conducción nerviosa fue de 5 (RIC 5-11) días. De los 229 pacientes con estudios de conducción nerviosa, el 45,8% cumplía los criterios de Hadden para polineuropatía desmielinizante inflamatoria aguda, el 44,5% para variante axonal, el 4,4% para inexcitables y el 3,9% para equívocos. Sólo el 1,3% tenía estudios de conducción nerviosa normales. No realizamos un segundo estudio en nuestros pacientes.
Validación de los criterios de Brighton
Los datos clínicos completos estaban disponibles para 248 pacientes, pero sólo 173 (70%) pacientes tenían datos completos que incluían el curso clínico, los estudios de conducción nerviosa y el análisis del líquido cefalorraquídeo. Para estos 173 pacientes, el nivel 1 de certeza según los criterios del Brighton Collaboration Group se cumplió en el 54,6% de los pacientes, el nivel 2 en el 45% y el nivel 4 en el 0,6%. Los pacientes que alcanzaron el nivel 2 de certeza se debieron principalmente a hallazgos normales en el LCR o hallazgos en los estudios de neuroconducción que no concuerdan con ninguna variante (Tabla IV).
Tabla IV.
Clasificación de los pacientes con síndrome de Guillain-Barré de acuerdo con los criterios del Brighton Collaboration Group.
| Información completa (n = 173) | Todos los pacientes (n = 248) | |
|---|---|---|
| Nivel 1 | 94 (54,4) | 94 (38) |
|
| ||
| Nivel 2 | 78 (45) | 141 (57) |
|
| ||
| VCN normales | 3 (1,7) | 3 (1,2) |
|
| ||
| Concentración de proteínas en el LCR normal | 75 (43,3) | 75 (30,2) |
|
| ||
| VCN faltantes | 0 (0) | 8 (3,2) |
|
| ||
| LCR faltante y VCN consistentes con SGB | 0 (0) | 55 (22,1) |
|
| ||
| Nivel 3 | 0 (0) | 12 (4,8) |
|
| ||
| VCN y LCR faltantes | 0 (0) | 11 (4,4) |
|
| ||
| VCN normales y LCR faltante | 0 (0) | 1 (0,4) |
|
| ||
| Nivel 4 | 1 (0,6) | 1 (0,4) |
|
| ||
| Fase progresiva de 28 días | 1 (0,6) | 1 (0,4) |
|
| ||
| Sin curso monofásico | 0 (0) | 0 (0) |
LCR: líquido cefalorraquídeo; SGB: síndrome de Guillain-Barré; VCN: velocidades de conducción nerviosa.
Para los pacientes que cumplieron con el nivel 1 de certeza, tanto el tiempo para realizar la punción lumbar –8 (RIC: 5-12) frente a 4 (RIC: 3-6) días; p ≤ 0,001– como los estudios de conducción nerviosa –9 (RIC: 6,75-14) frente a 6 (RIC: 4-8) días; p ≤ 0,001– fueron mayores que el tiempo en los pacientes que cumplían criterios para otro nivel de certeza.
Si se tienen en cuenta los 248 pacientes (incluidos los que no tenían análisis de estudios de neuroconducción y LCR), se considera que el 38% cumple el nivel 1 de certeza y el 57% el nivel 2.
Discusión
Hasta este momento, ésta es la mayor cohorte de SGB en nuestro país. Ciento setenta y tres (70%) pacientes cumplieron con los criterios de inclusión, incluidos los datos del curso clínico, el análisis del LCR y los estudios de conducción nerviosa. Al igual que otras poblaciones, existe un ligero predominio masculino [16]. Los estudios han demostrado que la incidencia de SGB aumenta con la edad. Encontramos en nuestra población una mediana de edad de 46 años, en comparación con otras poblaciones en las que las medianas de edad oscilaron entre 50 y 60 años [17]. Esto puede deberse a una mayor cantidad de población joven en nuestro país y a una mayor incidencia de infecciones. El SGB está precedido por una infección en dos tercios de los casos, que puede ser gastrointestinal o respiratoria [18]. El 58% de nuestros pacientes tuvieron una infección de dos a cinco semanas antes del inicio de los síntomas, con una mayoría gastrointestinal (37,1%). Los estudios locales han demostrado una mayor incidencia en verano debido a las altas tasas de infecciones gastrointestinales, que en su mayoría están relacionadas con la neuropatía axonal motora aguda [19]. Suponemos que ésta es la razón por la cual neuropatía axonal motora aguda fue en los años anteriores la variante electrofisiológica más frecuente en nuestro país. Actualmente, nuestra epidemiología está cambiando, ya que la polineuropatía desmielinizante idiopática aguda se está convirtiendo en la variante más frecuente en México observada en nuestros pacientes. Las políticas de salud mexicanas han cambiado y las infecciones gastrointestinales están disminuyendo en nuestro país, mientras que las infecciones respiratorias están aumentando [20].
Durante las campañas extensivas de vacunación, especialmente de vectores virales, existe una mayor preocupación a medida que aumentan los casos de SGB. Esto se ha tenido muy en cuenta, ya que se han notificado casos de SGB con diferentes vacunas contra el SARS-CoV-2, como BNT162b2, aunque poco frecuentes (0,43 por cada 100.000) [21]. La validación de los criterios de Brighton en México es necesaria, ya que más del 50% de nuestra población ha recibido una vacuna y los casos de SGB están aumentando en nuestro país.
Todos nuestros pacientes alcanzaron el punto más bajo de la enfermedad en cuatro semanas. El 75% de nuestros pacientes tenía una puntuación en la GDS ≥ 4 en el ingreso, lo que se correlaciona con la gravedad de la presentación. Además, la mayoría de nuestros pacientes ingresó dentro del día 5 del inicio de los síntomas y alcanzó la debilidad máxima en la primera semana. Por otro lado, los pacientes con una puntuación en la GDS de 1 rara vez buscan atención médica en México debido a la leve gravedad de los síntomas. La mitad de nuestros pacientes tenía afectación de los nervios craneales, y la parálisis facial bilateral fue la más frecuente, lo que concuerda con otras cohortes [22].
Según la disponibilidad de tratamiento en México, se trató a la mayoría de los pacientes con inmunoglobulina intravenosa. Un metaanálisis reciente no demostró diferencias entre el intercambio de plasma y la inmunoglobulina intravenosa para pacientes con SGB [23]. Aproximadamente, el 96% de nuestros pacientes tenía debilidad simétrica bilateral, incluidas las extremidades superiores e inferiores en el momento de la presentación, así como reflejos tendinosos profundos disminuidos o ausentes (94%). Esto es prácticamente igual que en el estudio de Asbury y Cornblath, quienes notiicaron un 5% de pacientes con reflejos normales [24].
Los pacientes que cumplieron con los criterios de certeza del nivel 1 tuvieron más tiempo desde el inicio de los síntomas hasta la punción lumbar o los estudios de conducción nerviosa en comparación con otros niveles. Esto puede explicarse porque el 50% de los pacientes a los que se les realiza una punción lumbar dentro de la primera semana desde el inicio de los síntomas presenta una concentración elevada de proteínas en el LCR (> 45 mg/dL), frente al 80% cuando se realiza dentro de las dos semanas [25]. Probablemente, si el análisis del LCR se hubiera realizado más tarde, nuestros pacientes con nivel 2 habrían cumplido los criterios para el nivel 1 de certeza. El mismo principio se aplica a los estudios de conducción nerviosa. En el estudio de Hadden et al, para estudios de conducción nerviosa realizados en pacientes dentro de los 15 días desde el inicio de los síntomas, un número considerable de pacientes cumplió con los criterios de hallazgos equívocos. Además, un pequeño número de pacientes que cumplieron los criterios de variante axonal en un primer estudio cumplió los criterios de variante desmielinizante en un segundo estudio realizado cuatro semanas después del primero [15]. Como algunos de nuestros pacientes cumplieron criterios equívocos basados en los criterios de Hadden, se clasificaron en el nivel 2 de certeza. Se han propuesto otros criterios para definir las variantes axonales o desmielinizantes en estadios tempranos, especialmente en los primeros siete días desde el inicio de los síntomas. Los criterios de Rajabally y Uncini pueden incluirse además en los criterios del Brighton Collaboration Group, ya que han demostrado un mejor rendimiento si se realizan en la primera semana desde el inicio de los síntomas [26,27]. No realizamos estudios seriados en ninguno de nuestros pacientes.
La mayoría de los pacientes que caen en el nivel 3 de certeza se encuentra en países de bajos ingresos, en los que sólo se consideran criterios clínicos y no se dispone de estudios complementarios. De toda nuestra cohorte, sólo el 4,8% caía en el nivel 3 de certeza, y, en esos casos, el motivo de no tener análisis del LCR o estudios de conducción nerviosa se asoció a la indisponibilidad transitoria de ambos. Sólo un paciente se clasificó en el nivel 4 de certeza, ya que los resultados no estaban disponibles. Nuestra tasa de nivel 3 y 4 es más baja que en otras cohortes, ya que la mayoría de nuestros pacientes tienen análisis del LCR y estudios de conducción nerviosa completos [28].
Seis de nuestros pacientes (4,1%) presentaron fluctuaciones relacionadas con el tratamiento.
En conclusión, esta incidencia es menor que la notificada en otras poblaciones, y varía del 8 al 16% [14]. Esos pacientes se beneficiaron de un segundo curso de inmunoglobulina intravenosa con mejoría adicional.