Zusammenfassung
Hintergrund Für die Surveillance von Diabetes bedarf es aktueller Daten zur Prävalenz des Diabetes und seiner Komplikationen im zeitlichen Verlauf. Hierbei werden zunehmend Daten der gesetzlichen Krankenversicherung (GKV) genutzt, da diese zeitnah zur Verfügung stehen und die Fallzahlen detaillierte Schätzungen auch von Diabeteskomplikationen erlauben. Ziel der vorliegenden Studie war die Entwicklung und interne Validierung von Falldefinitionen für die Prävalenzschätzung der diabetischen Retinopathie (DRP), der diabetischen Polyneuropathie (DPN) und des diabetischen Fußsyndroms (DFS).
Methodik Datengrundlage der Studie bilden Personen mit Diabetes unterschieden nach Typ-1-, Typ-2- und sonstigem Diabetes in einer alters- und geschlechtsstratifizierten Stichprobe von Barmer Versicherten im Jahr 2018 (n=72.744). Ausgehend von den zentralen ICD-Codes für die mikrovaskulären Komplikationen (DRP: H36.0; DPN: G63.2; DFS: E1X.74/.75) wurden Falldefinitionen unter Einbezug weiterer ICD-Codes, die die Komplikation ohne direkten Diabetesbezug verschlüsseln, entwickelt. Anschließend wurden die Falldefinitionen intern validiert. Hierfür wurden eine Codierung im stationären (m1S) oder wiederholt im ambulanten Bereich (m2Q) sowie eine Codierung spezifischer Leistungen (EBM, OPS) und Arzneimittelverordnungen oder durch relevante Facharztgruppen betrachtet. Abschließend wurde das Vorliegen der Diagnosen in den Vorjahren analysiert.
Ergebnisse Im Jahr 2018 betrug die Prävalenz der zentralen ICD-Codes der DRP (H36.0) 8,4%, der DPN (G63.2) 18,9% und des DFS (E1X.74/.75) 13,4%. Unter Einbezug weiterer ICD-Codes in die Falldefinitionen erhöhten sich die Prävalenzen für DRP (9,6%) und DPN (20,7%) deutlich, für DFS kaum (13,5%). Die interne Validierung bestätigte den Großteil der Diagnosen (DRP: 96,7%; DPN: 96,5% DFS: 95,8%) und m2Q stellte das relevanteste Kriterium dar. Bei Berücksichtigung von bis zu vier Vorjahren fielen die Prävalenzen für DPN und DFS um bis zu 30% und für DRP um bis zu 64% höher aus.
Schlussfolgerung Der Einbezug zusätzlicher ICD-Codes in die Falldefinition von mikrovaskulären Komplikationen des Diabetes erscheint sinnvoll, da diese die Sensitivität der Prävalenzschätzung erhöht. Die interne Validierung deutet darauf hin, dass die dokumentierten Diagnosen plausibel sind. Allerdings wird ein Teil der Diagnosen nicht jährlich dokumentiert, was zu einer Unterschätzung in der querschnittlichen Betrachtung eines Jahres führt.
Schlüsselwörter: Diabetes mellitus, Komplikationen, Routinedaten, Retinopathie, Polyneuropathie
Abstract
Background Surveillance of diabetes requires up-to-date information on the prevalence of diabetes and its complications over time. For this purpose, statutory health insurance (SHI) data is being increasingly used, as the data is available in a timely fashion and case numbers enable detailed estimates also of diabetes complications. The aim of the present study was the development and internal validation of case definitions for the prevalence estimation of diabetic retinopathy (DRP), diabetic polyneuropathy (DPN) and diabetic foot syndrome (DFS).
Methods Persons with diabetes differentiated by type 1, type 2, and other diabetes in an age- and sex-stratified sample of persons insured by Barmer SHI in 2018 (n=72,744) comprised the study popuation. Based on the central ICD codes for microvascular complications (DRP: H36.0; DPN: G63.2; DFS: E1X.74/.75), case definitions were developed including additional ICD codes for complications without direct diabetes reference. Subsequently, the case definitions were internally validated. For the validation, coding in the inpatient setting (m1S) or repeatedly in the outpatient setting (m2Q) as well as coding of specific procedures (EBM, OPS) and drug prescriptions or by relevant specialists were considered. Additionally, we analysed the documentation of the diagnoses in the previous years.
Results In 2018, the prevalence of the central ICD codes was 8.4% for DRP (H36.0), 18.9% for DPN (G63.2) and 13.4% for DFS (E1X.74/.75). After inclusion of additional ICD codes in the case definition, prevalence increased significantly for DRP (9.6%) and DPN (20.7%), and barely for DFS (13.5%). Internal validation confirmed the majority of diagnoses (DRP: 96.7%; DPN: 96.5% DFS: 95.8%) and m2Q represented the most relevant criterion. When up to four previous years were considered, prevalences were up to 30% higher for DPN and DFS and up to 64% higher for DRP.
Conclusion The inclusion of additional ICD codes in the case definition of microvascular complications of diabetes appears meaningful, as this increases the sensitivity of the prevalence estimate. Internal validation suggests that the documented diagnoses are plausible. However, not all diagnoses are documented annually, leading to an underestimation of the prevalence using a cross-sectional study design of one year.
Key words: diabetes mellitus, complications, routine data, retinopathy, polyneuropathy
Einleitung
Neben Primärdaten aus Gesundheitsbefragungs- und Untersuchungsstudien werden zunehmend Sekundärdaten insbesondere der gesetzlichen Krankenversicherung (GKV) für die Beantwortung von epidemiologischen Fragestellungen genutzt. So werden die Daten für deskriptive Analysen zur Schätzung der Inzidenz, Prävalenz und Mortalität von Krankheiten verwendet 1 , aber auch zur Beantwortung kausaler Fragestellungen wie beispielsweise der Entstehung des Diabetes nach einer COVID-19-Erkrankung 2 .
Bei den meisten Analysen stehen dabei die Diagnosedaten aus dem ambulanten und stationären Sektor verschlüsselt gemäß der Internationalen statistischen Klassifikation der Krankheiten und verwandter Gesundheitsprobleme (ICD) im Fokus 3 . Da diese Daten jedoch primär zu Abrechnungszwecken und nicht für epidemiologische Fragestellungen erhoben werden, ist es von großer Bedeutung die Qualität der Daten hinsichtlich systematischer Dokumentationsfehler zu prüfen 1 . Neben der aufwendigen externen Validierung von Diagnosedaten, welche eine Verknüpfung von Primär- und Sekundärdaten voraussetzt, ermöglicht die interne Diagnosevalidierung unter Einbezug weiterer Informationen zu Medikation, erbrachten Leistungen, Facharztkennungen, Einschreibungen in Disease-Management-Programmen oder auch Diagnosemuster die Dokumentationsqualität einzuschätzen 4 . So wird zum Beispiel bei den meisten Analysen von Diagnosedaten im ambulanten Sektor das m2Q-Kriterium verwendet, welches die Codierung einer ambulant gesicherten Diagnose in mindestens zwei Quartalen eines Jahres fordert 5 .
Auch für die Surveillance von Diabetes am Robert Koch-Institut stellen Routinedaten eine wichtige Ergänzung dar, da diese im Vergleich zu Surveydaten zumeist zeitnah zur Verfügung stehen, häufig wiederkehrende Analysen ermöglichen und keine Verzerrung durch eine geringere Teilnahme spezifischer Gruppen besteht 6 . Im Kontext von Diabetes werden Routinedaten bereits für die Schätzung der Prävalenz, Inzidenz und Mortalität genutzt 7 8 9 10 . Die hohe Fallzahl in den GKV-Daten ermöglicht dabei auch die Schätzung der Häufigkeit von Komplikationen des Diabetes in hoher zeitlicher und räumlicher Auflösung sowie stratifiziert nach Altersgruppen, welche beispielsweise für die Berechnung von Indikatoren zur Krankheitslast wie disability-adjusted life years (DALY) im Rahmen des BURDEN 2020-Studie verwendet werden 11 . Allerdings zeigte sich bei der Analyse von mikrovaskulären Komplikationen in den Daten aller gesetzlichen Krankenversicherten nach Datentransparenzverordnung (DaTraV-Daten), eine mögliche Unterschätzung der Prävalenz von diabetischen Komplikationen, insbesondere der diabetischen Retinopathie und Polyneuropathie, in den höheren Altersgruppen 12 .
Ziel der vorliegenden Studie ist daher aufbauend auf der vorangegangenen Analyse die Weiterentwicklung und interne Validierung von Falldefinitionen für die mikrovaskulären Komplikationen: diabetische Retinopathie, diabetische Polyneuropathie und diabetisches Fußsyndrom, welche zukünftig in Auswertungen der Diabetes-Surveillance zur Anwendung kommen sollen.
Methodik
Studienpopulation
Die Analyse basiert auf einer alters- und geschlechtsstratifizierten Zufallsstichprobe von Versicherten der Barmer Krankenversicherung, die von 2010 oder von Geburt (nach 2010) bis 2018 durchgängig versichert waren 13 . Die Stichprobe in Höhe von 1% der Bevölkerung (n=830.192) entspricht in ihrer Alters- und Geschlechtsverteilung der Bevölkerung des Jahres 2018 14 . Die Daten umfassen Stammdaten zu Alter, Geschlecht und Versicherungszeit sowie zu ambulanten und stationären Diagnosen, die gemäß der Internationalen statistischen Klassifikation der Krankheiten und verwandter Gesundheitsprobleme (ICD-10) codiert sind 3 . Weiterhin sind Arzneimittelverordnungen gemäß der Anatomisch-Therapeutisch-Chemischen (ATC) Klassifikation dokumentiert und Leistungsdaten zu Operationen und Prozeduren (OPS) sowie verschlüsselt nach dem einheitlichen Bewertungsmaßstab (EBM) enthalten 3 15 16 .
In der vorliegenden Analyse wurden nur Personen mit Diabetes gemäß der folgenden Definition eingeschlossen. Basierend auf einer vorausgehenden Analyse wurde bei Vorliegen mindestens einer ICD-Diagnose E10.- bis E14.- in mindestens zwei Quartalen im ambulanten Sektor (m2Q), in nur einem Quartal bei zusätzlicher Verordnung eines Antidiabetikums (ATC-Code A10) oder mindestens einer Diagnose E10.- bis E14.- im stationären Sektor, als Arbeitsunfähigkeitsdiagnose oder im Bereich des ambulanten Operierens im Jahr 2018 ein Diabetes angenommen 13 . Anschließend wurden anhand eines Algorithmus zur Typenunterscheidung, welcher ICD-Diagnosen, Arzneimittelverordnung unterschieden nach Insulin und anderen Antidiabetika sowie das Alter berücksichtigt, Personen mit Diabetes dem Typ-1-Diabetes (n=4.023), dem Typ-2-Diabetes (n=67.332) oder dem sonstigen Diabetes zugeordnet (n=1.389) 13 .
Entwicklung von Falldefinitionen
Ziel der Studie war die Entwicklung von Falldefinitionen für die diabetische Retinopathie, die diabetische Polyneuropathie und das diabetisches Fußsyndrom basierend auf dokumentierten ICD-Diagnosen zur Schätzung von Prävalenzen mikrovaskulärer Komplikationen des Diabetes in Routinedaten. Zunächst wurden alle für die ausgewählten mikrovaskulären Komplikationen relevanten ICD-Diagnosen identifiziert. Diese wurden unterschieden nach ICD-Codes, die die Erkrankungen explizit als Diabeteskomplikation verschlüsseln (Kategorie I), ICD-Codes, die die Erkrankung ohne Diabetesbezug verschlüsseln (Kategorie II) und weiteren ICD-Codes, die im Bezug der jeweiligen diabetischen Komplikation stehen können (Kategorie III) ( Tabelle S1, online verfügbar ). Die Auswahl der Diagnosen der Kategorie II und III basierte auf Vorarbeiten zu Auswertungen von diabetischen Komplikationen in Routinedaten 4 17 18 . Basierend auf der Häufigkeit und des Codiermusters in Abhängigkeit des Alters, Diabetestyps und in Kombination mit anderen ICD-Diagnosen wurden die Falldefinitionen der Komplikationen erstellt. Ausgangspunkt der Falldefinitionen stellen die jeweiligen ICD-Diagnosen der Kategorie I dar (DRP: H36.0, DPN: G63.2, DFS: E1X.74/.75). Zusätzlich wurden in der Falldefinition ICD-Diagnosen der Kategorie II berücksichtigt sofern diese in Zusammenhang mit einer entsprechenden diabetischen Komplikation codiert wurden ( Tab. 1 ). Das Vorliegen der Komplikation wurde angenommen, wenn die entsprechende Diagnose oder Diagnosekombination im Jahr 2018 mindestens in einem Quartal gesichert im ambulanten Sektor oder mindestens einmal im stationären Sektor als Haupt- oder Nebendiagnose codiert wurde.
Tab. 1 Häufigkeit der Dokumentation spezifischer ICD-Diagnosen stratifiziert nach Diabetestyp im Jahr 2018.
| ICD-Diagnose | Diabetes gesamt | Typ-1-Diabetes | Typ-2-Diabetes | |
|---|---|---|---|---|
| Diabetische Retinopathie | ||||
| Kategorie I | H36.0 | 8,4% | 24,9% | 7,3% |
| Kategorie II | H35.0 | 9,3% | 8,2% | 9,4% |
| H35.2 | 0,4% | 1,3% | 0,3% | |
| H35.8 | 2,0% | 3,4% | 1,9% | |
| Falldefinition | H36.0 ODER (E1x.3 UND (H35.0 ODER H35.2 ODER H35.8)) | 9,6% | 26,8% | 8,5% |
| Diabetische Polyneuropathie | ||||
| Kategorie I | G63.2 | 18,9% | 25,0% | 18,6% |
| Kategorie II | G62.9 | 9,5% | 7,6% | 9,6% |
| G63.3 | 0,6% | 0,9% | 0,6% | |
| Falldefinition | G63.2 ODER ((E1x.4 ODER E1x.74 ODER E1x.75) UND (G62.9 ODER G63.3)) | 20,7% | 25,0% | 20,4% |
| Diabetisches Fußsyndrom | ||||
| Kategorie I | E1x.74 ODER E1x.75 | 13,4% | 15,2% | 13,3% |
| M14.27 | 0,1% | 0,1% | 0,1% | |
| M14.67 | 0,1% | 0,2% | 0,1% | |
| Kategorie II | L89.x7 | 0,6% | 0,4% | 0,6% |
| M86.x7 | 0,3% | 0,4% | 0,3% | |
| R02.07 | 0,1% | 0,1% | 0,1% | |
| Z89.4/.5 | 0,7% | 1,1% | 0,6% | |
| Falldefinition | E1x.74 ODER E1x.75 ODER M14.27 ODER M14.67 | 13,5% | 15,2% | 13,3% |
Interne Validierung und Persistenz
Zur Überprüfung der Validität der beschriebenen Falldefinitionen wurden weiterführende Informationen der GKV-Routinedaten verwendet und eine Auswertung zur internen Validität durchgeführt. Es wurde geprüft, ob im Jahr der Dokumentation für die jeweilige Komplikation spezifische Arzneimittel oder Heil- oder Hilfsmittel verordnet und spezifische Leistungen oder Untersuchungen durchgeführt wurden. Weiterhin wurde analysiert in welchem Sektor die Diagnose dokumentiert wurde, ob die Diagnose mehrmals im gleichen oder in verschiedenen Sektoren vergeben wurde, ob mehrere Ärzte die Diagnose im ambulanten Sektor codierten und ob Fachärzte die Diagnose dokumentierten. Die Validierungskriterien wurden für jede der untersuchten diabetischen Komplikationen separat erstellt ( Tab. 3 ).
Tab. 3 Kriterien für die interne Validierung der mikrovaskulären Komplikationen.
| Kategorie | Kriterium | Codierung | Anteil |
|---|---|---|---|
| Diabetische Retinopathie | |||
| Mehrfache Codierung | Mindestens m2Q ambulante Diagnose oder m1S stationäre Hauptdiagnose | 70,3% | |
| Mindestens 2 Ärzte dokumentieren Diagnose im ambulanten Sektor im selben Quartal | 32,9% | ||
| Dokumentation der Diagnose in mindestens 2 Sektoren | 4,7% | ||
| OPS | Mindestens 1 therapeutische Maßnahme (Laser-, Injektionstherapie, Operation) | OPS-Code: 5–144, 5–154, 5–155, 5–156.9, 5–158 | 3,6% |
| ATC | Mindestens 1 Verordnung für eine Injektionstherapie | ATC-Code: L01XC07, S01BA01, S01BA05, S01LA03, S01LA04, S01LA05, S01LA06 | 5,7% |
| EBM | Mindestens 1 weiterführende Diagnostik (Fluoreszenzangiographie, Optische Kohärenztomographie) oder Therapiemaßnahme (Laser-, Injektionstherapie) | GOP: 06331, 06333, 06334, 06335, 06337, 06338, 06339, 31342, 31371, 31372, 31373, 36371, 36372, 36373 | 4,5% |
| Kontrolle des Augenhintergrundes in mindestens 2 Quartalen oder 1 Quartal und Dokumentation Diabetische Retinopathie | GOP: 06331, 06333, 06336, 06337, 06338, 06339 | 63,5% | |
| Facharzt | Augenarzt dokumentiert Kreuz-Stern-Verschlüsselung (E14.3+H36.0*) | Augenarzt: 05 | 47,8% |
| Dokumentation Mindestens 1 Diagnose Kategorie I UND Kategorie II im selben Quartal vom selben Augenarzt | Augenarzt: 05 | 31,2% | |
| Mindestens in 2 Quartalen Facharztkontakt (Augenarzt) | Augenarzt: 05 | 52,4% | |
| Mindestens | 1 Kriterium erfüllt | 96,7% | |
| Diabetische Polyneuropathie | |||
| Mehrfache Codierung | Mindestens m2Q ambulante oder m1Q stationäre Hauptdiagnose | 88,5% | |
| Mindestens 2 Ärzte dokumentieren Diagnose im ambulanten Sektor im selben Quartal | 30,3% | ||
| Dokumentation der Diagnose in mindestens 2 Sektoren | 9,2% | ||
| Dokumentation Polyneuropathie und Diabetes mit neurologischer Komplikation (E1x.4) | ICD: DPN+E1x.4 | 73,5% | |
| Dokumentation Polyneuropathie und Diabetischer Fuß (E1x.7x) | ICD: DPN+(E1x.74 oder E1x.75) | 43,2% | |
| ATC | Dokumentation Diabetische Polyneuropathie und Verordnung Medikation für neuropathischen Schmerz | ATC-Code: N06AA09, N06AA02, N06AA04, N06AA10, N03AX21, N03AX12, N03AX16, N03AF01, N03AF02, N01BB02, N01BX04, N02A, M03AX01 | 29,4% |
| EBM | Behandlung diabetischer Fuß in mindestens 1 Quartal | GOP: 02311 | 5,8% |
| Elektroneurographie/Elektromyographie und Dokumentation Diabetische Polyneuropathie im selben Quartal | GOP: 04437, 16322, 27331 | 5,9% | |
| Facharzt | Neurologe dokumentiert Diabetische Polyneuropathie | Neurologe: 53 | 10,6% |
| Mindestens in 2 Quartalen Facharztkontakt (Neurologe) | Neurologe: 53 | 14,6% | |
| Mindestens | 1 Kriterium erfüllt | 96,5% | |
| Mehrfache Codierung | Mindestens m2Q ambulante oder m1Q stationäre Hauptdiagnose | 84,4% | |
| Mindestens 2 Ärzte dokumentieren Diagnose im ambulanten Sektor im selben Quartal | 20,4% | ||
| Dokumentation der Diagnose in mindestens 2 Sektoren | 6,5% | ||
| Dokumentation Diabetisches Fußsyndrom und Diabetische Polyneuropathie oder Angiopathie | ICD: DFS+(G63.2 oder I79.2) | 69,8% | |
| Dokumentation Diabetisches Fußsyndrom und Ulkus oder Osteomyelitis | ICD: DFS+(L89.x7 oder M86.x7) | 3,6% | |
| OPS | Stationäre Behandlung oder ambulante Operation eines Diabetisches Fußsyndrom | OPS-Code: 5–865, 5–869.1, 5–896 | 4,3% |
| EBM | Behandlung diabetischer Fuß in mindestens 1 Quartal | GOP: 02311 | 10,2% |
| Heil- und Hilfsmittel | Podologische Behandlung | GOP: 68001, 78001, 68002, 78002, 68003, 78003, 68004, 78004, 68005, 78005, 68006, 78006 | 55,5% |
| Mindestens | 1 Kriterium erfüllt | 95,8% |
OPS: Operationen- und Prozedurenschlüssel; ATC: Anatomisch-Therapeutisch-Chemische Klassifikation; EBM: Einheitlicher Bewertungsmaßstab; GOP: Gebührenordnungsposition; ICD: Internationale statistische Klassifikation der Krankheiten und verwandter Gesundheitsprobleme.
Zuletzt wurde die Persistenz der Diagnosen über die Jahre analysiert, da die Komplikationen möglicherweise nicht zu einer jährlichen Inanspruchnahme von spezifischen Leistungen oder Verordnungen führen und somit nicht in den Daten dokumentiert sind, obwohl die Erkrankung weiterhin vorliegt. So wurde in weiterführenden Analysen der Beobachtungszeitraum variiert und neben der primären Analyse, welche die Diagnosedokumentation innerhalb eines Jahres (2018) betrachtete, auch der Anteil von Personen mit Diabetes und der untersuchten Dokumentation innerhalb von zwei Jahren (2017–18) bis fünf Jahren untersucht (2014–18). Aufgrund der Datenverfügbarkeit zum Zeitpunkt der Auswertung konnte der Beobachtungszeitraum nur retrospektiv erweitert werden.
Statistische Analysen
Die statistischen Analysen umfassen die deskriptive Beschreibung der Prävalenz der einzelnen mikrovaskulären Komplikationen stratifiziert nach Alter, Geschlecht und Diabetestyp. Hierzu wurde der Quotient aus der Anzahl der Personen mit Vorliegen einer Komplikation und der Diabetespopulation stratifiziert nach Altersgruppen, Geschlecht und Diabetestyp (Diabetes gesamt, Typ-1-Diabetes, Typ-2-Diabetes) gebildet. Die primäre Analyse bezog sich hierbei auf das Beobachtungsjahr 2018. In der überjährigen Analyse wurden die Zeiträume 2014–18 (5 Jahre), 2015–18 (4 Jahre), 2016–18 (3 Jahre) und 2017–18 (2 Jahre) für die Dokumentation der Komplikationen betrachtet.
Ergebnisse
Entwicklung Falldefinitionen und Schätzung der 1-Jahres-Prävalenz
Zunächst wurden die ICD-Codes der Kategorie I und II für die mikrovaskulären Komplikationen betrachtet und die Häufigkeit der Codierung innerhalb aller Personen mit Diabetes stratifiziert nach Diabetestyp bestimmt ( Tab. 1 ). So wurden im Jahr 2018 mit Ausnahme der Diagnose H35.0 Diagnosen der Kategorie II seltener dokumentiert als Diagnosen der Kategorie I. Für Personen mit Typ-2-Diabetes wurde im Kontext der diabetischen Retinopathie die Diagnose H35.0 häufiger als die Diagnose H36.0 codiert, nicht jedoch für Personen mit Typ-1-Diabetes. In die Falldefinition der mikrovaskulären Komplikationen der diabetischen Retinopathie und diabetischen Polyneuropathie wurden neben Diagnosen der Kategorie I auch der Kategorie II berücksichtigt, die Komplikation ohne expliziten Diabetesbezug verschlüsseln, wenn diese zusammen mit einem Diabetes und einer entsprechenden Komplikationskategorie verschlüsselt wurden ( Tab. 1 ). Für das diabetisches Fußsyndrom wurden nur ICD-Diagnosen der Kategorie I berücksichtigt, da der Einbezug von Diagnosen der Kategorie II die 1-Jahres-Prävalenz kaum verändert (13,5% vs. 13,7%). Unter Verwendung der Falldefinition steigt der Anteil von Personen mit dokumentierter diabetischer Retinopathie sowohl bei Personen mit Typ-2- als auch mit Typ-1-Diabetes an, wohingegen dies bei der diabetischen Polyneuropathie nur für Personen mit Typ-2-Diabetes der Fall ist.
Bei Betrachtung der 1-Jahres-Prävalenzen stratifiziert nach Alter, Geschlecht und Diabetestyp, lässt sich erkennen, dass die Prävalenzen der Komplikationen für den Typ-1-Diabetes in allen Altersgruppen höher ausfallen als für den Typ-2-Diabetes ( Tab. 2 ). Mit zunehmendem Alter lässt sich eine Zunahme der Prävalenz der Komplikationen sowohl für Typ-1-Diabetes als auch den Typ-2-Diabetes feststellen, welche jedoch beim Typ-2-Diabetes in der Altersgruppe 90 Jahre und älter wieder abfällt. Während beim Typ-2-Diabetes Männer durchweg häufiger Komplikationen aufweisen, ist dies beim Typ-1-Diabetes differenzierter und variiert in Abhängigkeit der Komplikation und Altersgruppe.
Tab. 2 1-Jahres-Prävalenz der Mikrovaskulären Komplikationen stratifiziert nach Geschlecht, Alter und Diabetestyp im Jahr 2018.
| Diabetes gesamt | Typ-1-Diabetes | Typ-2-Diabetes | ||||
|---|---|---|---|---|---|---|
| Männer | Frauen | Männer | Frauen | Männer | Frauen | |
| Diabetische Retinopathie | ||||||
| <30 Jahre | 5,4% | 4,8% | 6,2% | 6,1% | * | * |
| 30–39 Jahre | 10,4% | 9,0% | 19,7% | 24,4% | 3,0% | 1,7% |
| 40–49 Jahre | 9,9% | 8,3% | 28,6% | 27,0% | 6,0% | 4,1% |
| 50–59 Jahre | 8,2% | 9,1% | 31,8% | 40,5% | 6,1% | 6,5% |
| 60–69 Jahre | 9,9% | 8,6% | 41,9% | 43,6% | 8,8% | 7,4% |
| 70–79 Jahre | 12,0% | 9,1% | 48,6% | 41,0% | 11,5% | 8,6% |
| 80–89 Jahre | 11,2% | 9,5% | 44,9% | 40,6% | 10,9% | 9,2% |
| >90 Jahre | 5,7% | 5,6% | * | * | 5,4% | 5,5% |
| Alle Altersgruppen | 10,3% | 8,8% | 26,1% | 27,8% | 9,2% | 7,7% |
| Diabetische Polyneuropathie | ||||||
| <30 Jahre | 2,0% | 2,5% | 2,6% | 3,0% | * | * |
| 30–39 Jahre | 8,4% | 6,7% | 10,5% | 12,6% | 6,4% | 4,1% |
| 40–49 Jahre | 11,5% | 9,8% | 19,1% | 19,5% | 9,9% | 7,7% |
| 50–59 Jahre | 15,0% | 13,8% | 30,0% | 34,9% | 13,5% | 11,9% |
| 60–69 Jahre | 22,0% | 17,0% | 53,7% | 52,4% | 20,9% | 15,8% |
| 70–79 Jahre | 27,2% | 21,2% | 55,0% | 49,6% | 26,8% | 20,8% |
| 80–89 Jahre | 29,4% | 25,5% | 63,3% | 65,6% | 29,1% | 25,2% |
| >90 Jahre | 23,0% | 19,6% | * | * | 22,2% | 19,6% |
| Alle Altersgruppen | 22,1% | 19,0% | 24,3% | 25,8% | 21,7% | 18,6% |
| Diabetisches Fußsyndrom | ||||||
| <30 Jahre | 2,5% | 2,8% | 2,2% | 2,8% | * | * |
| 30–39 Jahre | 5,6% | 5,3% | 6,1% | 6,1% | 5,3% | 4,7% |
| 40–49 Jahre | 8,6% | 7,2% | 14,0% | 11,9% | 7,4% | 6,4% |
| 50–59 Jahre | 10,1% | 9,9% | 18,8% | 21,1% | 9,2% | 8,9% |
| 60–69 Jahre | 14,6% | 11,4% | 32,3% | 26,0% | 13,9% | 10,8% |
| 70–79 Jahre | 17,0% | 13,6% | 35,0% | 28,2% | 16,7% | 13,4% |
| 80–89 Jahre | 17,9% | 16,2% | 38,8% | 37,5% | 17,7% | 16,1% |
| >90 Jahre | 15,7% | 15,6% | * | * | 15,1% | 15,6% |
| Alle Altersgruppen | 14,2% | 12,6% | 15,5% | 14,7% | 14,0% | 12,5% |
*: Fallzahl n<5
Interne Validierung
Die interne Validierung ergab, dass im Jahr 2018 über 95% der gemäß Falldefinition dokumentierten mikrovaskulären Komplikationen durch mindestens ein Kriterium bestätigt werden konnten ( Tab. 3 ). Hierbei fiel der Anteil beim diabetischen Fußsyndrom etwas niedriger aus als bei der diabetischen Polyneuropathie und der diabetischen Retinopathie. Bei allen Komplikationen stellte die Dokumentation der Diagnose entweder in zwei Quartalen gesichert ambulant (m2Q) oder mindestens einmal im stationären Sektor als Hauptdiagnose (m1S) das wichtigste Validierungskriterium dar. Bei der diabetischen Retinopathie waren weiterhin die Kontrolle des Augenhintergrunds und die Dokumentation durch einen Facharzt in bis zu über der Hälfte der Personen dokumentiert. Therapeutische Maßnahmen mittels operativer oder medikamentöser Therapie waren für einen geringen Anteil dokumentiert. Bei der diabetischen Polyneuropathie erhielten fast 30% der Personen Arzneimittel zur Therapie der neuropathischen Schmerzen. Die weiteren Kriterien aus dem Bereich der ambulanten Leistungen codiert mittels EBM oder der Dokumentation durch einen Facharzt trafen auf einen geringeren Anteil der Personen mit diabetischer Polyneuropathie zu. Beim diabetischen Fußsyndrom war neben der m2Q/m1S Kriterien die podologische Behandlung relevant und wurde bei mehr als der Hälfte der Personen dokumentiert. Eine Dokumentation von ambulanten Leistungen aus dem EBM-Katalog oder von Operationen und Prozeduren erfolgte nur in einem kleinen Anteil der Personen mit diabetischem Fußsyndrom.
Zeitliche Persistenz
Zur Untersuchung der zeitlichen Persistenz wurden der Beobachtungszeitraum auf bis zu fünf Jahre vergrößert und die Prävalenz der mikrovaskulären Komplikationen stratifiziert nach dem Diabetestyp geschätzt. Bei allen drei Komplikationen stieg die Prävalenz mit jedem zusätzlichen Beobachtungsjahr an ( Abb. 1 ). Am deutlichsten fiel der Anstieg bei der diabetischen Retinopathie aus. So erhöhte sich die 5-Jahres-Prävalenz um über 50% im Vergleich zur 1-Jahres-Prävalenz, wobei der Anstieg beim Typ-2-Diabetes höher ausfiel als beim Typ-1-Diabetes. Bei der diabetischen Polyneuropathie und dem diabetischen Fußsyndrom war die 5-Jahres-Prävalenz im Vergleich zur 1-Jahres-Prävalenz jeweils um 24% höher. Die Unterschiede zwischen Typ-2-Diabetes und Typ-1-Diabetes fielen geringer aus als bei der diabetischen Retinopathie.
Abb. 1.
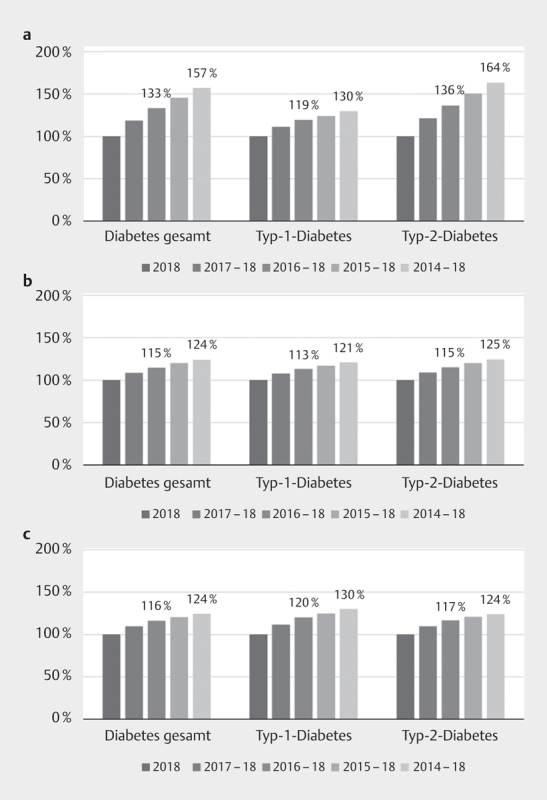
Relativer Anstieg der Prävalenz mikrovaskulärer Komplikationen in Abhängigkeit des Beobachtungszeitraums stratifiziert nach Diabetestyp a Diabetische Retinopathie.; b Diabetische Polyneuropathie.; c Diabetisches Fußsyndrom.
Diskussion
Ziel der vorliegenden Studie war die Entwicklung und interne Validierung von Falldefinitionen zur Prävalenzschätzung der mikrovaskulären Komplikationen diabetische Retinopathie, diabetische Polyneuropathie und diabetisches Fußsyndrom basierend auf Routinedaten der gesetzlichen Krankenversicherung. Unter Einschluss von spezifischen ICD-Diagnosen konnten Falldefinitionen entwickelt werden, deren interne Validität als hoch einzuschätzen ist. Bei Bewertung der zeitlichen Persistenz, zeigt sich eine mögliche Unterschätzung der 1-Jahres-Prävalenz, welche auf eine fehlende jährliche Inanspruchnahme zurückzuführen sein könnte und in der Interpretation der Ergebnisse berücksichtigt werden muss.
Diabetische Retinopathie
Die vorliegende Falldefinition ergab eine 1-Jahres-Prävalenz von 9,6% für die diabetische Retinopathie, welche für Personen mit Typ-1-Diabetes (26,8%) deutlich höher ausfiel als Personen mit Typ-2-Diabetes (8,5%). Die Prävalenzschätzung lag über den Analysen aller AOK-Versicherten mit Typ-2-Diabetes (7,1% im Jahr 2010) 19 und aller gesetzlich Versicherten mit Diabetes (7,0% im Jahr 2013) 12 , jedoch niedriger als Auswertungen von Versicherten mit Diabetes der AOK-Hessen (12,2% im Jahr 2010) 20 und Versicherten mit Typ-2-Diabetes der AOK Baden-Württemberg (24,9% im Jahr 2010) 21 . Neben Abweichungen in der Studienpopulation können die Abweichungen der Schätzungen auch anhand von Unterschieden in der Definition der diabetischen Retinopathie begründet sein. Während die ersten beiden Studien nur die H36.0 Diagnose in der Falldefinition beinhalten, umschließen die letztgenannten Studien zusätzliche Diagnosen aus der Gruppe H35.-. Die Dokumentation der Disease-Management-Programme für Typ-2- und Typ-1-Diabetes zeigen etwas niedrigere Prävalenzen (Typ-2-Diabetes: 7,3%; Typ-1-Diabetes: 20,8% im Jahr 2020) 22 . Auswertungen von Primärdaten zeigen für die diabetische Retinopathie bei Typ-1-Diabetes vergleichbare Prävalenzen (27,4% im Jahr 2009) 23 und für den Typ-2-Diabetes deutlich höhere Werte (20,1%) 24 . Der hohe Unterschied für Personen mit Typ-2-Diabetes könnte zum einen darin begründet sein, dass in der Studie des DPV-Registers auch Personen mit bisher unerkannter Morbidität enthalten sind und zum anderen, dass die Retinopathie unabhängig der Ätiologie berücksichtigt wird, da neben Diabetes auch eine Hypertonie häufig Ursache einer Retinopathie sein kann 25 . Weiterhin deuteten die Unterschiede zwischen der 5-Jahres- und 1-Jahres-Prävalenz in der vorliegenden Studie, welche für den Typ-2-Diabetes besonders ausgeprägt waren, auf eine fehlende jährliche Inanspruchnahme hin. So nahmen gemäß der DEGS Studie im Jahr 2010 78% und gemäß DMP-Dokumentation in NRW im Jahr 2021 66,7% der Personen mit Typ-2-Diabetes im letzten Jahr an einer Augenuntersuchung teil 22 26 . Da die fehlende Inanspruchnahme eines Augenarztes in höherem Alter besonders ausgeprägt ist 27 , könnte dies den Abfall der Prävalenz der diabetischen Retinopathie im Alter ab 90 Jahren in der vorliegenden Studie und auch anderen GKV-Analysen erklären 12 21 .
Diabetische Polyneuropathie und diabetisches Fußsyndrom
Die in der vorliegenden Studie ermittelte 1-Jahres-Prävalenz der diabetischen Polyneuropathie und des diabetischen Fußsyndrom fallen höher aus, als Schätzungen in früheren Analysen auf Basis von Routinedaten, welche Versicherte mit Diabetes allgemein oder nur mit Typ-2-Diabetes untersuchten und für die diabetische Polyneuropathie Prävalenzen zwischen 11–19% 12 19 20 28 und für das diabetische Fußsyndrom zwischen 3–11% berichten 12 19 28 . Eine aktuelle Analyse im Rahmen der BURDEN 2020-Studie berichtet für das Jahr 2017 vergleichbare nach Alter und Diabetestyp stratifizierte Prävalenzen, welche analog der vorliegenden Studie für Personen mit Typ-1-Diabetes höher ausfallen als für Personen mit Typ-2-Diabetes 29 . Insgesamt lässt sich über die Zeit eine Zunahme der Prävalenzschätzungen in Routinedaten erkennen, was möglicherweise darauf zurückzuführen ist, dass für die Verordnung podologischer Leistungen seit 2011 eine Diagnosedokumentation beispielsweise des diabetischen Fußsyndroms erforderlich ist 30 und in der vorliegenden Analyse für mehr als die Hälfte der Personen mit diabetischem Fußsyndrom dokumentiert war. Die Dokumentation des DMP bestätigt die Unterschiede in der Häufigkeit der Komplikationen zwischen den Diabetestypen, berichtet allerdings insgesamt für die diabetische Polyneuropathie etwas höhere (Typ-2-Diabetes: 28,6%; Typ-1-Diabetes: 31,0% im Jahr 2020) und für das diabetische Fußsyndrom (Typ-2-Diabetes: 9,6%; Typ-1-Diabetes: 13,1% im Jahr 2020) etwas niedrigere Prävalenzen 22 . Die Unterschiede zum DMP könnten auf eine unterschiedliche Versorgung zurückzuführen sein. So nehmen DMP-Teilnehmende häufiger Fußuntersuchungen in Anspruch, was einerseits zu einer höheren Diagnosewahrscheinlichkeit beiträgt und andererseits jedoch möglicherweise der Entwicklung eines diabetischen Fußes vorbeugt 31 . Analog zur diabetischen Retinopathie nehmen nicht alle Personen mit Diabetes eine jährliche Untersuchung des Fußes wahr 22 26 , was zu den Unterschieden zwischen der 1- und 5-Jahres-Prävalenz beitragen könnte.
Limitationen und Stärken
Die vorliegende Studie basiert auf der Stichprobe einer einzelnen Krankenkasse. Die stratifizierte Stichprobenziehung kann nur Abweichungen in der Alters- und Geschlechtsverteilung zur Bevölkerung ausgleichen, nicht aber bezüglich anderer Variablen, sodass ein möglicher Selektionsbias („Kassenbias“) bestehen bleibt und sich die Morbidität in der Studienpopulation von der Allgemeinbevölkerung unterscheidet 32 . Weiterhin kann auch das Kriterium hinsichtlich der durchgehenden Versichertenzeit von 2010 bis 2018 zu einem Selektionsbias führen 33 . Die Schätzung der Prävalenzen der mikrovaskulären Komplikationen hängt maßgeblich von der Codierpraxis ab, wobei die interne Validierung über 95% der Diagnosen bestätigte. Jedoch kann eine mögliche Unterschätzung der Prävalenzen vorliegen. So kann eine bisher unerkannte Morbidität, welche in Primärstudien auf Basis beispielsweise einer augenärztlichen Untersuchung festgestellt werden kann, nicht in der Falldefinition berücksichtigt werden. Im Gegensatz zu Primärdaten ermöglicht die hohe Fallzahl in den Routinedaten jedoch eine detaillierte Analyse auch für den selteneren Typ-1-Diabetes. Weiterhin werden die Daten aller Versicherten ausgewertet und es gibt keine Verzerrung durch die unterschiedliche Response verschiedener Gruppen. Andererseits sind in den Routinedaten nur Diagnosen für Personen dokumentiert, welche das Gesundheitssystem in Anspruch genommen haben.
Fazit und Ausblick
Routinedaten ermöglichen die Prävalenzschätzung von mikrovaskulären Komplikationen differenziert nach Diabetestyp, Alter und Geschlecht für die Surveillance von Diabetes im Zeitverlauf. Hierbei können zusätzliche Diagnosen, welche die Komplikation ohne expliziten Diabetesbezug verschlüsseln, die Sensitivität der Falldefinitionen erhöhen und die interne Validierung bestätigte eine hohe Plausibilität der dokumentierten Diagnosen. Allerdings deuten die Analysen der zeitlichen Persistenz darauf hin, dass Diagnosen nicht jedes Jahr dokumentiert werden, obwohl Leitlinien die jährliche Untersuchung empfehlen. Somit ist von einer Unterschätzung der Prävalenz mikrovaskulärer Komplikationen bei Betrachtung eines 1-Jahreszeitraums auszugehen. Daher könnte es sich als sinnvoll erweisen längere Zeiträume zur Prävalenzschätzung der mikrovaskulären Komplikationen zugrunde zu legen und die Falldefinitionen in externen Validierungsstudien zu prüfen. Für die Surveillance können die Daten dennoch wichtige Hinweise auf die zeitliche Entwicklung der mikrovaskulären Komplikationen liefern, müssen aber eng im Kontext der Versorgung und Inanspruchnahme interpretiert werden.
Danksagung
Die Autorinnen und Autoren bedanken sich bei der Barmer Krankenversicherung für die Bereitstellung der Daten der vorliegenden Studie.
Funding Statement
Funding Information Bundesministerium für Gesundheit — http://dx.doi.org/10.13039/ 501100003107; GE20150323
Footnotes
Interessenkonflikt Die Autorinnen/Autoren geben an, dass kein Interessenkonflikt besteht.
Zusätzliches Material
Literatur
- 1.Swart E, Ihle P, Gothe H . Bern, Schweiz: Hans Huber Verlag; 2014. Routinedaten im Gesundheitswesen: Handbuch Sekundärdatenanalyse: Grundlagen, Methoden und Perspektiven. 2. Auflage. [Google Scholar]
- 2.Rathmann W, Kuss O, Kostev K. Incidence of newly diagnosed diabetes after Covid-19. Diabetologia. 2022;65:949–954. doi: 10.1007/s00125-022-05670-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM). ICD-10-GM Version 2023. Im Internet:https://www.bfarm.de/DE/Kodiersysteme/Klassifikationen/ICD/ICD-10-GM/_node.html; Stand: 01.10.2022
- 4.Schubert I, Ihle P, Köster I. Interne Validierung von Diagnosen in GKV-Routinedaten: Konzeption mit Beispielen und Falldefinition. Gesundheitswesen. 2010;72:316–322. doi: 10.1055/s-0030-1249688. [DOI] [PubMed] [Google Scholar]
- 5.Drösler S, Garbe E, Hasford J et al. Sondergutachten zu den Wirkungen des morbiditätsorientierten Risikostrukturausgleichs. Im Internet:https://www.bundesamtsozialesicherung.de/fileadmin/redaktion/Risikostrukturausgleich/20180125Sondergutachten_Wirkung_RSA_2017_korr.pdf; Stand: 15.10.2022
- 6.Schmidt C, Heidemann C, Rommel A et al. Sekundärdaten in der Diabetes-Surveillance – Kooperationsprojekte und Referenzdefinition zur dokumentierten Diabetesprävalenz. Journal of Health Monitoring. 2019;4:54–69. doi: 10.25646/5982. [DOI] [Google Scholar]
- 7.Goffrier B, Schulz M, Bätzing-Feigenbaum J.Administrative Prävalenzen und Inzidenzen des Diabetes mellitus von 2009 bis 2015. Zentralinstitut für die kassenärztliche Versorgung in Deutschland (Zi) Versorgungsatlas-Bericht Nr. 17/03. Berlin 20172017 10.20364/VA-17.03.doi:10.20364/VA-17.03 [DOI] [Google Scholar]
- 8.Schmidt C, Reitzle L, Dreß J et al. Prävalenz und Inzidenz des dokumentierten Diabetes mellitus – Referenzauswertung für die Diabetes-Surveillance auf Basis von Daten aller gesetzlich Krankenversicherten. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2019;63:93–102. doi: 10.1007/s00103-019-03068-9. [DOI] [PubMed] [Google Scholar]
- 9.Tamayo T, Brinks R, Hoyer A et al. The Prevalence and Incidence of Diabetes in Germany: An Analysis of Statutory Health Insurance Data on 65 Million Individuals From the Years 2009 and 2010. Deutsches Ärzteblatt International. 2016;113:177. doi: 10.3238/arztebl.2016.0177. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Schmidt C, Reitzle L, Heidemann C et al. Excess mortality in adults with documented diabetes in Germany: routine data analysis of all insurance claims in Germany 2013-2014. BMJ open. 2021;11:e041508. doi: 10.1136/bmjopen-2020-041508. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Porst M, von der Lippe E, Leddin J et al. The burden of disease in Germany at the national and regional level – results in terms of disability-adjusted life years (DALY) from the BURDEN 2020 study. Dtsch Arztebl International. 2022;119:785–792. doi: 10.3238/arztebl.m2022.0314. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Reitzle L, Schmidt C, Du Y et al. Einschätzungen zur Prävalenz mikrovaskulärer Folgeerkrankungen bei Diabetes mellitus in Deutschland. Analyse von Versichertendaten aller gesetzlichen Krankenkassen für die Jahre 2012 und 2013. Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz. 2020;63:1219–1230. doi: 10.1007/s00103-020-03211-x. [DOI] [PubMed] [Google Scholar]
- 13.Reitzle L, Ihle P, Heidemann Cet al. Algorithmus zur Unterscheidung von Diabetes mellitus Typ 1 und Typ 2 bei der Analyse von Routinedaten Gesundheitswesen 2022 10.1055/a-1791-0918.doi:10.1055/a-1791-0918 [DOI] [PubMed] [Google Scholar]
- 14.Statistisches Bundesamt (Destatis). Fortschreibung des Bevölkerungsstandes (EVAS-Nr. 12411): Bevölkerung zum Stichtag 31.12.2018. Im Internet:https://www-genesis.destatis.de/genesis/online?sequenz=statistikTabellen&selectionname=12411; Stand: 01.10.2022
- 15.Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM). Anatomisch-Therapeutisch-Chemischen (ATC) Klassifikation mit Tagesdosen. Im Internet:https://www.bfarm.de/DE/Kodiersysteme/Klassifikationen/ATC/_node.html; Stand: 01.10.2022
- 16.Kassenärztliche Bundesvereinigung (KBV). Einheitlicher Bewertungsmaßstab (EBM). Im Internet:https://www.kbv.de/html/ebm.php; Stand: 01.10.2022
- 17.Köster I, Hauner H, von Ferber L. Heterogenität der Kosten bei Patienten mit Diabetes mellitus: Die KoDiM-Studie. Dtsch Med Wochenschr. 2006;131:804–810. doi: 10.1055/s-2006-939850. [DOI] [PubMed] [Google Scholar]
- 18.von Ferber L, Köster I, Hauner H. Kosten der antihyperglykämischen Behandlung des Diabetes mellitus. Medizinische Klinik. 2006;101:384–393. doi: 10.1007/s00063-006-1050-8. [DOI] [PubMed] [Google Scholar]
- 19.Müller N, Heller T, Freitag M . 2014. Diabetes mellitus Typ 2. In. Stuttgart, Deutschland: Schattauer: Klauber J, Günster C, Gerste B, Robra, BP, Schmake, N (Hrsg.) Versorgungs-Report 2013/2014 : Schwerpunkt: Depression; pp. 131–154. [Google Scholar]
- 20.Koster I, Huppertz E, Hauner H et al. Costs of Diabetes Mellitus (CoDiM) in Germany, direct per-capita costs of managing hyperglycaemia and diabetes complications in 2010 compared to 2001. Exp Clin Endocrinol Diabetes. 2014;122:510–516. doi: 10.1055/s-0034-1375675. [DOI] [PubMed] [Google Scholar]
- 21.Boehme M W, Buechele G, Frankenhauser-Mannuss J et al. Prevalence, incidence and concomitant co-morbidities of type 2 diabetes mellitus in South Western Germany – a retrospective cohort and case control study in claims data of a large statutory health insurance. BMC Public Health. 2015;15:855. doi: 10.1186/s12889-015-2188-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Zentralinstitut für die kassenärztliche Versorgung in der Bundesrepublik Deutschland (Zi). DMP-Atlas Nordrhein-Westfalen: Regionalisierte Darstellung der Disease-Management-Programme. Im Internet:https://www.zi-dmp.de/dmp-atlas_nrw/; Stand: 10.08.2022
- 23.Hammes H P, Kerner W, Hofer S et al. Diabetic retinopathy in type 1 diabetes – a contemporary analysis of 8,784 patients. Diabetologia. 2011;54:1977–1984. doi: 10.1007/s00125-011-2198-1. [DOI] [PubMed] [Google Scholar]
- 24.Hammes H P, Welp R, Kempe H P et al. Risk Factors for Retinopathy and DME in Type 2 Diabetes-Results from the German/Austrian DPV Database. PLoS One. 2015;10:e0132492. doi: 10.1371/journal.pone.0132492. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Wong T Y, Cheung C M, Larsen M et al. Diabetic retinopathy. Nat Rev Dis Primers. 2016;2:16012. doi: 10.1038/nrdp.2016.12. [DOI] [PubMed] [Google Scholar]
- 26.Du Y, Heidemann C, Schaffrath Rosario A et al. Changes in diabetes care indicators: findings from German National Health Interview and Examination Surveys 1997-1999 and 2008-2011. BMJ Open Diabetes Res Care. 2015;3:e000135. doi: 10.1136/bmjdrc-2015-000135. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Kreft D, McGuinness M B, Doblhammer G et al. Diabetic retinopathy screening in incident diabetes mellitus type 2 in Germany between 2004 and 2013 - A prospective cohort study based on health claims data. PLoS One. 2018;13:e0195426. doi: 10.1371/journal.pone.0195426. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Deckenbach B, Nolting H-D, Tisch T . Heidelberg, Deutschland: medhochzwei Verlag GmbH; 2018. Versorgungsreport Diabetes mellitus. 1. Auflage. [Google Scholar]
- 29.Schüssel K, Breitkreuz J, Brückner Get al. Nutzung von Krankenkassenroutinedaten zur Bestimmung von Krankheitshäufigkeiten im Projekt BURDEN 2020 Gesundheitswesen 2022 10.1055/a-1806-2115.doi:10.1055/a-1806-2115 [DOI] [PubMed] [Google Scholar]
- 30.GKV-Spitzenverband. Rahmenempfehlungen – Podologische Therapie - nach § 125 Abs. 1 SGB V, Anlage 3. Im Internet:https://www.gkv-spitzenverband.de/media/dokumente/krankenversicherung_1/ambulante_leistungen/heilmittel/heilmittel_rahmenempfehlungen/heilmittel_podologen/HeilM_Empf_Podologen_Anlage_3_2011.pdf Stand: 01.09.2021
- 31.Fuchs S, Henschke C, Blümel M et al. Disease-Management-Programme für Diabetes mellitus Typ 2 in Deutschland. Dtsch Arztebl International. 2014;111:453–463. doi: 10.3238/arztebl.2014.0453. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Hoffmann F, Icks A. Unterschiede in der Versichertenstruktur von Krankenkassen und deren Auswirkungen für die Versorgungsforschung: Ergebnisse des Bertelsmann-Gesundheitsmonitors. Gesundheitswesen. 2012;74:291–297. doi: 10.1055/s-0031-1275711. [DOI] [PubMed] [Google Scholar]
- 33.Epping J, Geyer S, Tetzlaff J. The effects of different lookback periods on the sociodemographic structure of the study population and on the estimation of incidence rates: analyses with German claims data. BMC Med Res Methodol. 2020;20:229. doi: 10.1186/s12874-020-01108-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.


