Abstract
目的
探讨顺铂是否能够诱导头颈部鳞状癌细胞产生TNF-α,进而激活RIP1/RIP3/MLKL依赖性的坏死性凋亡通路,抑制鳞癌细胞的增殖,并探讨其分子机制。
方法
选取头颈部鳞状癌细胞系HN4和SCC4作为实验对象,分为对照组、顺铂组、caspases抑制组、坏死性凋亡抑制组。利用CCK-8法检测顺铂刺激后24 h的细胞存活率。随后采用Western blotting检测caspase-8以及坏死性凋亡通路蛋白(RIP1/RIP3/MLKL)和NF-κB(p65)、TNF-α表达情况;结合细胞划痕实验和Western blotting检测上皮间充质转化相关蛋白(N-cadherin、Vimentin、E-cadherin)的表达情况,评估坏死性凋亡对头颈部鳞状癌细胞迁移能力的影响。
结果
顺铂对HN4、SCC4细胞毒性IC50分别约为10 μg/mL、15 μg/mL。在顺铂刺激下,与坏死性凋亡抑制剂组相比,caspase-8表达降低(P<0.05),N-cadherin、Vimentin表达降低(P<0.05)、E-cadherin表达升高(P<0.05),坏死性凋亡通路蛋白(RIP1/RIP3/MLKL)表达升高(P<0.05),TNF-α和NF-κB(p65)蛋白表达均升高(P<0.05)。在顺铂组中,细胞愈合率显著降低于对照组和坏死性凋亡抑制剂组。
结论
顺铂作用可激活头颈部鳞状癌细胞NF-κB信号通路,并促进TNF-α自分泌,从而引发鳞癌细胞经由RIP1/RIP3/MLKL通路依赖性的坏死性凋亡反应,并抑制肿瘤细胞性增殖。
Keywords: 头颈部鳞状癌细胞, 顺铂, z-VAD-fmk, 坏死性凋亡, Nec-1
Abstract
Objective
To investigate whether cisplatin induces tumor necrosis factor‑α (TNF‑α) secretion in human head and neck squamous cell carcinoma (HNSCC) cells to trigger RIP1/RIP3/MLKL-dependent necroptosis of the cells.
Methods
HNSCC cell lines HN4 and SCC4 treated with cisplatin (CDDP) or the combined treatment with CDDP and z-VAD-fmk (a caspase inhibitor) or Nec-1 (a necroptosis inhibitor) for 24 h were examined for changes in cell viability using CCK8 assay and expressions of caspase-8 and necroptosis pathway proteins (RIP1/RIP3/MLKL) using Western blotting. The changes in migration of the cells were assessed with cell scratch assay, and the expressions of epithelial-mesenchymal transition (EMT) marker proteins N-cadherin, vimentin, and E-cadherin as well as the expressions of NF‑κB (p65) and TNF‑α were detected with Western blotting.
Results
The IC50 of cisplatin was 10 μg/mL in HN4 cells and 15 μg/mL in SCC4 cells. Cisplatin treatment significantly decreased the expressions of caspase-8, N-cadherin and vimentin and increased the expressions of E-cadherin, the necroptosis pathway proteins (RIP1/RIP3/MLKL), TNF‑α, and NF‑κB (p65), and these changes were obviously inhibited by treatment with Nec-1. Cisplatin stimulation also significantly lowered migration of the cells, and this inhibitory effect was strongly attenuated by Nec-1 treatment.
Conclusion
Cisplatin activates nuclear factor‑κB signaling in HNSCCs to promote TNF‑α autocrine and induce RIP1/RIP3/MLKL-dependent necroptosis, thus leading to inhibition of cell proliferation.
Keywords: human head and neck squamous cell carcinoma, cisplatin, z-VAD-fmk, necroptosis, Nec-1
头颈癌(HNSCC)约占头颈部恶性肿瘤的90%[1]。化疗是头颈部鳞癌治疗的重要手段[2]。顺铂是头颈部鳞癌治疗的一线用药[3],临床治疗中常用于诱导肿瘤细胞发生凋亡[4]。但是,化疗、靶向治疗和免疫治疗等治疗方法在HNSCC晚期可能会出现原发性和获得性抗药性。目前还没有解决这一问题的可行方案。
坏死性凋亡是目前研究中具有代表性的可控的细胞死亡方式[5]。2005年,Miao等[6]在研究肿瘤坏死因子(TNF-α)时,首次提出坏死性凋亡的概念,并作为一种非caspases依赖的细胞死亡形式被各国学者广泛关注[7] 。其主要过程为,受体相互作用丝氨酸/苏氨酸蛋白激酶1(RIP1)与受体相互作用丝氨酸/苏氨酸蛋白激酶3(RIP3)相互作用形成坏死小体,继而使下游分子 混合谱系激酶域样蛋白(MLKL)发生磷酸化,磷酸化的 MLKL 发生一系列构象改变并作为效应分子对细胞膜产生破坏。研究表明,坏死性凋亡可以在细胞凋亡受阻时作为抑制肿瘤发展的替代疗法[8]。所以,寻找能够通过调控坏死性凋亡治疗疾病的新治疗方法是肿瘤治疗领域的重要研究目标[9]。
研究表明,顺铂可以通过诱导细胞发生坏死性凋亡杀伤胃癌细胞[10]、结肠癌细胞[11]、膀胱癌细胞[12]。且目前研究较为清楚的是,顺铂上调TNF-α,使其与受体TNFR1结合以激活NF-κB通路,促进细胞发生TNF-α自分泌[13],引发RIP1与caspase-8及Fas相关死亡结构域蛋白(FADD)相结合,继而形成新的复合体并介导凋亡通路的激活[14]。此时,若caspase-8的活性受到抑制,RIP1则与RIP3形成坏死小体,则可以使细胞发生坏死性凋亡过程 [15,16]。该机制也可能与顺铂诱导头颈部鳞癌坏死性凋亡具体机制密切联系。
本研究采用HN4、SCC4细胞系作为研究对象,探究顺铂是否能诱导HNSCCs发生RIP1/RIP3/MLKL蛋白依赖性坏死性凋亡抑制肿瘤细胞的增殖,并对顺铂诱导坏死性凋亡的具体机制进行分析,为HNSCC 临床治疗研究提供新的理论基础。
1. 材料和方法
1.1. 实验材料
人HNSCC细胞HN4、SCC4(ATCC); DMEM、胰酶及胎牛血清(GIBCO);二甲基亚砜(DMSO,1∶1000);GAPDH(1∶1000)、E-钙黏蛋白(E-cadherin,1∶1000)、波形蛋白(Vimentin)鼠抗(1:1000)、caspase-8(1∶3000)、RIP3(1∶1250)、RIP1(1∶1250)、MLKL(1∶3000)、N-钙黏蛋白(N-cadherin)(1∶1000)、TNF-α(1∶1500)、NF-κB p65兔抗(1∶1000)、顺铂、辣根过氧化物酶标记山羊抗鼠(1∶1000)、辣根过氧化物酶标记山羊抗兔(1∶1000)、CCK8试剂盒、细胞裂解液、BCA蛋白浓度测定试剂盒、caspases抑制剂z-VAD-fmk、坏死性凋亡抑制剂Nec-1(碧云天,上海)。
1.2. 方法
1.2.1. 细胞培养及传代
人头颈部鳞状癌细胞HN4、SCC4 细胞完全培养基(DMEM+10%血清+1%双抗)常规培养,每瓶5 mL完全培养基,CO2恒温培养箱保持 37 ℃左右。在细胞生长至瓶底70%~80%进行传代。
1.2.2. CCK-8检测HNSCCs活力
将细胞均匀铺在 96 孔板中(1×105/孔),通过预实验确定顺铂的作用浓度梯度。不同浓度梯度(1、5、10、20、25 μg/mL)的顺铂处理96孔板24 h,设置对照组和空白组,每组3个复孔。药物作用后,分别在避光条件下每孔加入10 μL CCK-8溶液,尽量避免打出气泡,然后放入细胞培养箱中孵育,3 h后检测各孔吸光度(A 450 nm),绘制细胞增殖曲线。
细胞活力计算:细胞存活率=[(不同处理组A值-空白组A值)/(对照组A值-空白组A值)]×100%。本次实验共重复3次。
1.2.3. Western blotting检测蛋白表达
将6孔板中对照组和实验组细胞用PBS清洗3遍,加入细胞裂解液和PMSF提取总蛋白,刮刀轻轻刮取板内细胞,镜下确认刮取完毕后将液体收集至离心管,超速离心法提取总蛋白。采用BCA试剂盒测量浓度,确定上样量,GAPDH为内参对照。用10%或8% SDS-PAGE 凝胶分离蛋白,通过湿法转印到NC膜上。10%脱脂牛奶封闭1.5 h,按照说明书稀释一抗后放入其中。4 ℃摇床过夜。二抗孵育1.5 h后用化学发光分析仪曝光,实验均重复3次。
1.2.4. 划痕实验检测细胞迁移
取处于对数生长期的HN4、SCC4细胞,接种至6孔板(1×106/孔,2 mL/孔),细胞在孔中融合率达90%后,用200 μL的无菌黄枪头沿着直尺垂直于6孔板竖向划3道线,用PBS轻轻冲洗6孔板,重复冲洗2次后置换含1%血清的培养基作为阴性对照,含1%血清和药物的做实验组,在0、6、12、24 h时于显微镜下观察并拍照,ImageJ软件分析细胞划痕面积。
1.3. HN4、SCC4头颈部鳞癌细胞药物处理
培养瓶中细胞生长至70%~80%时,用0.25%胰蛋白酶消化并均匀铺至6孔板(1×106/孔,2 mL/孔)培养,待达到一定密度且细胞状态良好时,更换无血清培养液12 h饥饿细胞,使细胞同步化生长。在顺铂诱导HNSCC坏死性凋亡实验中,以10 μg/mL和15 μg/mL的顺铂分别刺激HN4、SCC4细胞24 h,20 μmol/L z-VAD-fmk、10 μmol/L Nec-1于顺铂处理开始前1 h加入培养基中对HNSCCs进行预处理。
1.3.1. 确定顺铂最佳作用浓度
CCK-8检测顺铂刺激HNSCCs后的细胞存活率,求得IC50值。空白组:只在96孔板中加入PBS;对照组:将HNSCCs置于完全培养基中培养;顺铂组:将HNSCCs置于含有不同浓度梯度的顺铂(1、5、10、20、25 μg/mL)的完全培养基中培养。每组3个复孔,置于CO2恒温培养箱中24 h,进行CCK-8实验检测细胞存活率。
1.3.2. 检测顺铂刺激HNSCCs后caspase-8的表达情况
实验分成4组,对照组:将HNSCCs置于完全培养基中培养;顺铂组:将HNSCCs置于含有顺铂的完全培养基中培养(HN4:10 μg/mL、SCC4:15 μg/mL);caspases抑制组:于顺铂处理前1 h 将z-VAD-fmk(20 μmol/L)加入完全培养基中预处理肿瘤细胞,随后将处理后的HNSCCs置于含有CDDP(HN4:10 μg /mL、SCC4:15 μg /mL)+z-VAD-fmk(20 μmol/L)的完全培养基中;坏死性凋亡抑制组:于顺铂处理开始前 1 h 将 Nec-1(10 μmol/L)加入完全培养基中预处理,随后将处理后的HNSCCs置于含有CDDP(HN4:10 μg/mL、SCC4:15 μg/mL)+Nec-1(10 μmol/L)的完全培养基中。24 h后收集细胞裂解液,制作细胞样品预备Western blotting检测caspase-8的表达情况。
1.3.3. HNSCCs坏死性凋亡关键因子检测
确定坏死性凋亡通路蛋白(RIP1/RIP3/MLKL)在顺铂刺激HNSCCs后的表达情况,及其对HNSCCs迁移能力的影响;最终探究顺铂是否通过HNSCCs TNF-α自分泌激活坏死性凋亡通路。在药物刺激HNSCCs 24 h后,Western blotting检测RIP1、RIP3、MLKL、上皮间充质转化相关蛋白(N-cadherin、Vimentin、E-cadherin)、TNF-α、NF-κB(p65)的表达情况。另外,分别在0、6、12、24 h拍照记录HNSCCs迁移情况。
1.4. 统计学方法
采用ImageJ 、Excel进行数据处理,Graphpad prism 10.1.2、Photoshop2022进行作图。单因素方差分析用于多组间数据比较。P<0.05 为差异具有统计学意义。所有实验均独立重复3次。
2. 结果
2.1. CCK-8确定顺铂最佳作用浓度
顺铂刺激HN4、SCC4细胞24 h后,用CCK-8法检测细胞存活率(图1)。顺铂的浓度梯度设置为1、5、10、20、25 μg/mL,两种头颈部鳞癌细胞存活率随着顺铂浓度的增加而逐渐降低。根据CCK-8所得吸光度计算顺铂对HN4、SCC4细胞的IC50值分别为10、15 μg /mL。后续实验均按照此浓度对肿瘤细胞进行药物刺激。
图1.
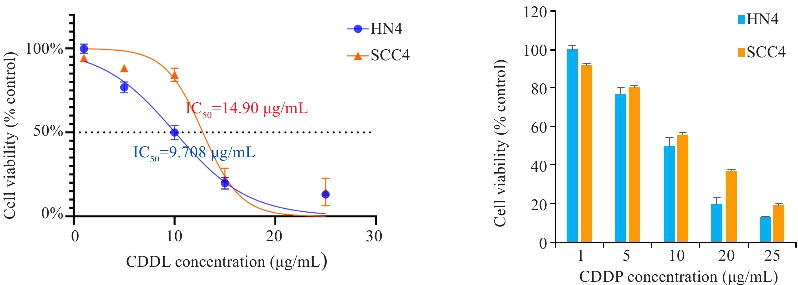
CCK8检测顺铂刺激24 h HN4和SCC4细胞存活率
Fig.1 CCK8 assay for assessing viability of HN4 and SCC4 cells after stimulation with cisplatin for 24 h.
2.2. 顺铂诱导HNSCCs发生非caspases依赖形式的细胞死亡
在HN4细胞系中,与对照组相比,顺铂组caspase-8活性略上调(P=0.2721,图2A);z-VAD-fmk预处理后,caspase-8表达量较顺铂组低(P<0.01,图2A);Nec-1预处理后,caspase-8表达量较顺铂组高(P<0.05,图2A)。在SCC4细胞系中,与对照组相比,顺铂组caspase-8活性略上调(P>0.05,图2B);z-VAD-fmk预处理后,caspase-8表达量较顺铂组略低(P>0.05,图2B);Nec-1预处理后,caspase-8表达量较顺铂组升高(P<0.05,图2B)。
图2.
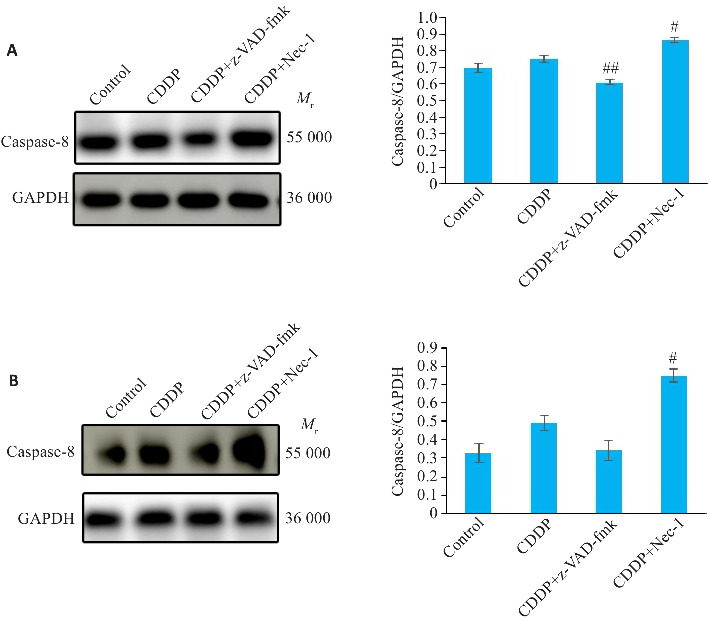
Western blotting检测HN4、SCC4细胞中caspase-8蛋白的表达情况
Fig.2 Western blotting for detecting expression of caspase-8 protein in HN4 (A) and SCC4 cells (B) with different treatments. ## P<0.01, # P<0.05 vs CDDP group.
2.3. 顺铂诱导HNSCCs发生坏死性凋亡
HN4、SCC4细胞顺铂组RIP1、RIP3、MLKL的表达水平与对照组相比均有不同程度的升高(HN4:P<0.01,P<0.0001,P<0.05;SCC4:P<0.01,P<0.05,P<0.01,图3)。与之相反,CDDP+Nec-1组的RIP1、RIP3、MLKL表达量均受到抑制,在SCC4细胞系中结果具有统计学意义(HN4:P=0.3287,P=0.1281,P=0.1661;SCC4:P=0.6840,P<0.05,P<0.05,图3)。
图3.
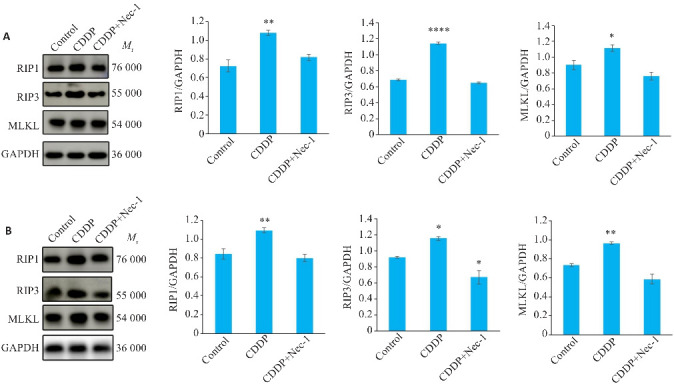
Western blotting检测顺铂诱导HN4、SCC4坏死性凋亡过程中RIP1、RIP3、MLKL的表达变化
Fig.3 Western blotting for detecting protein expression levels of RIP1, RIP3, and MLKL in HN4 (A) and SCC4 cells (B) with cisplatin-induced necroptosis. *P<0.05, **P<0.01, ****P<0.0001 vs control group.
2.4. 顺铂诱导的坏死性凋亡抑制头颈部鳞癌细胞迁移能力
2.4.1. 上皮间充质转化相关蛋白的表达变化
与对照组相比,HN4细胞顺铂组的 E-cadherin 的表达升高(P<0.05,图4A), N-cadherin、Vimentin 的表达降低(P<0.05、P<0.01,图4A),SCC4细胞顺铂组的 E-cadherin 的表达升高(P<0.001,图4B), N-cadherin、Vimentin 的表达降低(P<0.05、P<0.01,图4B)。Nec-1预处理后,2种细胞系E-cadherin表达均较顺铂组下降(HN4:P=0.4973,SCC4:P=0.6840),N-cadherin、Vimentin 的表达升高(HN4:N-cadherin P=0.1821、Vimentin P=0.3437,SCC4:N-cadherin P=0.5312、Vimentin P<0.01,图4)。
图4.
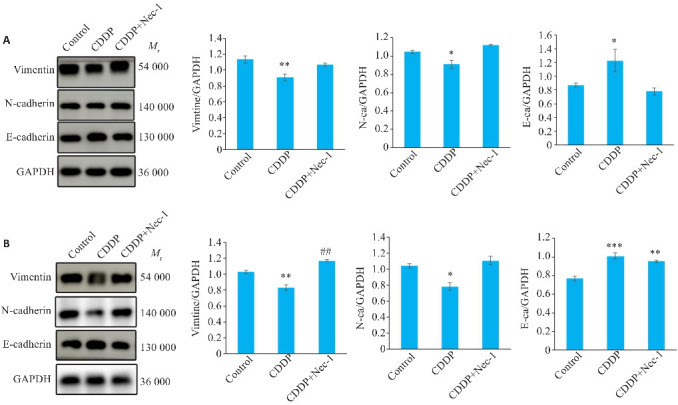
Western blotting检测顺铂诱导HN4、SCC4坏死性凋亡过程中上皮间充质转化相关蛋白的表达变化
Fig.4 Western blotting for detecting protein expressions of epithelial-mesenchymal transition (EMT) marker proteins in HN4 (A) and SCC4 cells (B) with cisplatin-induced necroptosis. *P<0.05, **P<0.01, ***P<0.001 vs control group. ## P<0.01 vs CDDP group.
2.4.2. 划痕实验检测细胞迁移能力
细胞划痕实验中,按照对照组、顺铂组、坏死性凋亡抑制组分别处理HN4、SCC4细胞(图5)。HN4细胞划痕后6 h,对照组细胞愈合率与同时期顺铂组相比差异不明显,较坏死性凋亡抑制组高;12 h时,CDDP对HN4细胞有明显增殖抑制作用;划痕后24 h,顺铂组的细胞愈合率明显低于同时期的对照组、较低于坏死性凋亡抑制组。SCC4细胞划痕后,顺铂组细胞愈合率较同时期的对照组、坏死性凋亡抑制组略低。
图5.
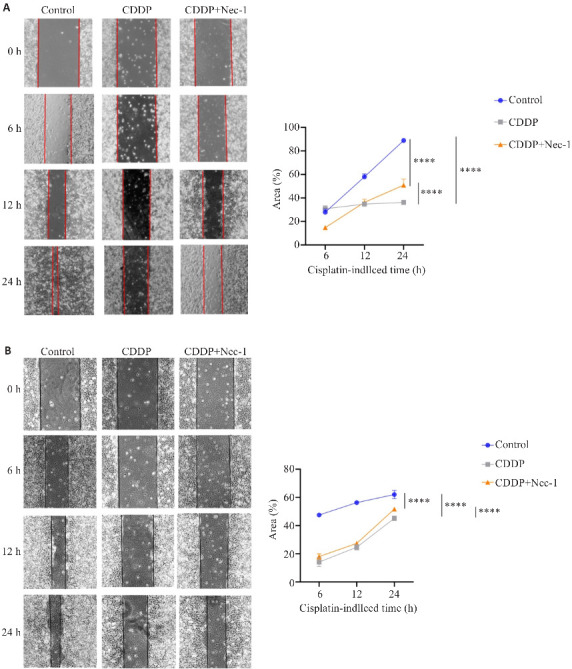
细胞划痕实验检测顺铂诱导的坏死性凋亡对HNSCCs迁移能力的影响
Fig.5 Cell scratch assay for assessing the impact of cisplatin-induced necroptosis on migratory ability of HN4 (A) and SCC4 cells (B). ****P<0.0001.
2.5. 顺铂促进TNF-α自分泌激活HNSCCs坏死性凋亡通路
与对照组相比,HN4细胞系顺铂组TNF-α表达上调(P<0.0001,图6A)、NF-κB(p65)表达上调(P<0.05,图6A);SCC4细胞系顺铂组TNF-α、、NF-κB(p65)表达均上调(P<0.01,图6B)。
图6.
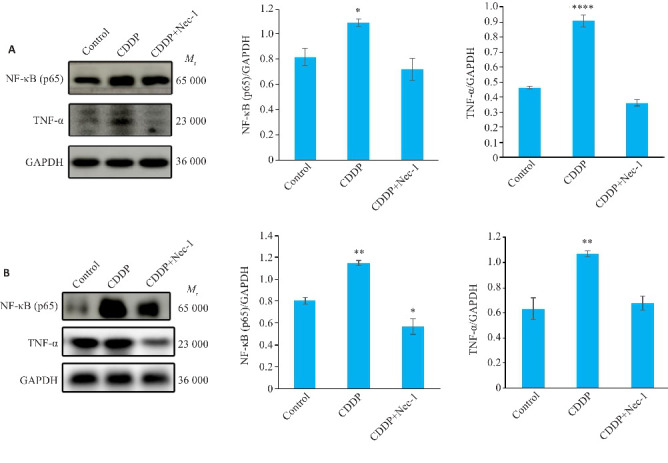
Western blotting检测HN4、SCC4细胞坏死性凋亡过程中TNF-α、NF-κB(p65)两种蛋白的表达情况
Fig.6 Western blotting for detecting expressions of TNF-α and NF-κB (p65) proteins in HN4 (A) and SCC4 cells (B) with cisplatin-induced necroptosis. *P<0.05, **P<0.01, ****P<0.0001 vs control group.
3. 讨论
坏死性凋亡在细胞的生理和病理过程中具有重要作用[17],作为一种兼具坏死与凋亡特点的死亡形式,在疾病中的作用已被广泛报道。因此,通过诱导坏死性凋亡杀死肿瘤细胞的治疗方法非常值得关注[18]。本课题针对顺铂是否能在HNSCCs中激活NF-κB通路,促进TNF‑α自分泌,诱导HNSCCs发生RIP1/RIP3/MLKL依赖性坏死性凋亡,抑制HNSCCs迁移的问题进行研究探索。将HNSCC化疗方案与诱导细胞坏死性凋亡相结合,探索改善HNSCC治疗效果的有效方法。
本研究发现顺铂对HNSCCs caspase-8有轻微抑制作用,据报道,抑制caspase-8可使癌细胞对坏死性凋亡敏感,这是一种受调控的细胞死亡机制[19]。另外,研究指出,RIP1/RIP3/MLKL是细胞发生坏死性凋亡的关键因子[20]。故本实验将坏死性凋亡关键蛋白RIP1/RIP3/MLKL作为检测指标探究顺铂对HNSCCs坏死性凋亡的诱导情况。上皮间充质转化相关蛋白表达情况和细胞划痕实验结果为坏死性凋亡抑制HNSCCs迁移能力提供证据。已有研究证明,TNF-α已经作为坏死性凋亡诱导因子在其他疾病中进行研究[15, 16, 21, 22],顺铂可以促进多种癌细胞TNF-α自分泌[10-12, 23, 24]从而诱导细胞发生坏死性凋亡。故本实验通过检测NF-κB(p65)、TNF-α的表达情况将此机制与顺铂作用HNSCC过程相联系,结果显示TNF-α自分泌促进了顺铂诱导HNSCC的坏死性凋亡。
根据目前的研究可知,尽管发现了许多化合物和药物可以诱导或调节坏死性凋亡过程,并具有强大的抗肿瘤作用,但基于诱导坏死性凋亡的实用性抗癌药物仍较为匮乏,有必要开发出具有较高特异性且对正常细胞的副作用较低的诱导剂并制定治疗策略。
但是,仍有报道表明坏死性凋亡在肿瘤治疗研究过程中的矛盾性。首先,坏死性凋亡过程可以通过释放各种炎症和免疫调节细胞因子激活树突状细胞,增强生物体抗肿瘤免疫。对此,针对HNSCC坏死性凋亡诱导的不同药物相继出现[25-27],还有更深入的研究涉及药物靶向递送系统的开发以促进肿瘤细胞坏死性凋亡的发生[28],对坏死性凋亡相关基因的研究也可能揭示肿瘤治疗的潜在靶点[29]。本研究基于以上理论基础为坏死性凋亡在HNSCC中表现抗肿瘤作用的结论提供证据。
然而,也有研究表明,坏死性凋亡过程中被激活的免疫细胞可能促进肿瘤血管生成和癌症侵袭,并产生免疫抑制的肿瘤微环境[30]。所以,对于坏死性凋亡在癌症中的确切作用,仍需要更多精心设计的实验来提高结果的确定性。
在今后关于HNSCC治疗的研究中,发现用于识别坏死性凋亡的特异性标记物,从而深入研究坏死性凋亡的分子机制和病理作用,有助于进一步阐明其与其他细胞死亡机制的串扰及其与免疫系统的相互作用[31,32],并且可能成为该领域的研究的重要方向。
基金资助
安徽省高等学校科学研究项目(2024AH040246);皖南医学院弋矶山医院引进人才基金项目(YR202108);芜湖市科技计划项目(2022JC30);安徽省大学生创新创业训练项目计划(S202210368003)
参考文献
- 1. Mohapatra P, Mohanty S, Ansari SA, et al. CMTM6 attenuates cisplatin-induced cell death in OSCC by regulating AKT/c-Myc-driven ribosome biogenesis[J]. FASEB J, 2022, 36(10): e22566. [DOI] [PubMed] [Google Scholar]
- 2. Feng YY, Cao XD, Zhao B, et al. Nitrate increases cisplatin chemosensitivity of oral squamous cell carcinoma via REDD1/AKT signaling pathway[J]. Sci China Life Sci, 2021, 64(11): 1814-28. [DOI] [PubMed] [Google Scholar]
- 3. Sasaya T, Kubo T, Murata K, et al. Cisplatin-induced HSF1-HSP90 axis enhances the expression of functional PD-L1 in oral squamous cell carcinoma[J]. Cancer Med, 2023, 12(4): 4605-15. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4. Choi HS, Kim YK, Yun PY. Cisplatin plus cetuximab inhibits cisplatin-resistant human oral squamous cell carcinoma cell migration and proliferation but does not enhance apoptosis[J]. Int J Mol Sci, 2021, 22(15): 8167. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Tang DL, Kang R, Berghe TV, et al. The molecular machinery of regulated cell death[J]. Cell Res, 2019, 29(5): 347-64. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Miao YD, Quan WX, Dong X, et al. A bibliometric analysis of ferroptosis, necroptosis, pyroptosis, and cuproptosis in cancer from 2012 to 2022[J]. Cell Death Discov, 2023, 9(1): 129. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Liu ZG, Jiao DL. Necroptosis, tumor necrosis and tumorigenesis[J]. Cell Stress, 2019, 4(1): 1-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Gong YT, Fan ZY, Luo GP, et al. The role of necroptosis in cancer biology and therapy[J]. Mol Cancer, 2019, 18(1): 100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. 王 芳, 李开颖, 蔡振宇. 程序性细胞死亡与肿瘤[J]. 中国细胞生物学学报, 2022, 44(4): 539-50. [Google Scholar]
- 10. Zhu XD, Li SL. Ferroptosis, necroptosis, and pyroptosis in gastrointestinal cancers: the chief culprits of tumor progression and drug resistance[J]. Adv Sci, 2023, 10(26): e2300824. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Liu L, Huang L, Chen WZ, et al. Comprehensive analysis of necroptosis-related long noncoding RNA immune infiltration and prediction of prognosis in patients with colon cancer[J]. Front Mol Biosci, 2022, 9: 811269. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Wang L, Hu CH, Zhao Y, et al. Novel smac mimetic ASTX660 (Tolinapant) and TNF‑α synergistically induce necroptosis in bladder cancer cells in vitro upon apoptosis inhibition[J]. Biochem Biophys Res Commun, 2022, 602: 8-14. [DOI] [PubMed] [Google Scholar]
- 13. Xu Y, Lin ZW, Zhao N, et al. Receptor interactive protein kinase 3 promotes Cisplatin-triggered necrosis in apoptosis-resistant esophageal squamous cell carcinoma cells[J]. PLoS One, 2014, 9(6): e100127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Chen J, Shao B, Wang J, et al. Chlorpyrifos caused necroptosis via MAPK/NF‑κB/TNF‑α pathway in common carp (Cyprinus carpio L.) gills[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2021, 249: 109126. [DOI] [PubMed] [Google Scholar]
- 15. Chen DS, Tong JS, Yang LH, et al. PUMA amplifies necroptosis signaling by activating cytosolic DNA sensors[J]. Proc Natl Acad Sci U S A, 2018, 115(15): 3930-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. 张一鸣. LncRNAWSF27/miRNA: 1696调控GPX3参与细胞程序性坏死介导的鸡缺硒性肠炎的研究[D]. 哈尔滨: 东北农业大学, 2023. [Google Scholar]
- 17. Ofengeim D, Yuan JY. Regulation of RIP1 kinase signalling at the crossroads of inflammation and cell death[J]. Nat Rev Mol Cell Biol, 2013, 14(11): 727-36. [DOI] [PubMed] [Google Scholar]
- 18. Cai HT, Lv MM, Wang TT. PANoptosis in cancer, the triangle of cell death[J]. Cancer Med, 2023, 12(24): 22206-23. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Krishnan RP, Pandiar D, Ramani P, et al. Necroptosis in human cancers with special emphasis on oral squamous cell carcinoma[J]. J Stomatol Oral Maxillofac Surg, 2023, 124(6S): 101565. [DOI] [PubMed] [Google Scholar]
- 20. Wu XQ, Nagy LE, Gautheron J. Mediators of necroptosis: from cell death to metabolic regulation[J]. EMBO Mol Med, 2024, 16(2): 219-37. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Duan YW, Li QY, Zhou YH, et al. Activation of the TNF‑α-necroptosis pathway in parvalbumin-expressing interneurons of the anterior cingulate cortex contributes to neuropathic pain[J]. Int J Mol Sci, 2023, 24(20): 15454. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. Lee CS, Hwang G, Nam YW, et al. IKK-mediated TRAF6 and RIPK1 interaction stifles cell death complex assembly leading to the suppression of TNF‑α‑induced cell death[J]. Cell Death Differ, 2023, 30(6): 1575-84. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23. Luo R, Onyshchenko K, Wang LQ, et al. Necroptosis-dependent immunogenicity of cisplatin: implications for enhancing the radiation-induced abscopal effect[J]. Clin Cancer Res, 2023, 29(3): 667-83. [DOI] [PubMed] [Google Scholar]
- 24. Wang S, Liu XY, Liu Y. Hydrogen sulfide protects from acute kidney injury via attenuating inflammation activated by necroptosis in dogs[J]. J Vet Sci, 2022, 23(5): e72. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25. Sulkshane P, Teni T. BH3 mimetic Obatoclax (GX15-070) mediates mitochondrial stress predominantly via MCL-1 inhibition and induces autophagy-dependent necroptosis in human oral cancer cells[J]. Oncotarget, 2017, 8(36): 60060-79. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Basit F, Cristofanon S, Fulda S. Obatoclax (GX15-070) triggers necroptosis by promoting the assembly of the necrosome on autophagosomal membranes[J]. Cell Death Differ, 2013, 20(9): 1161-73. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. Yuan TM, Liang RY, Chueh PJ, et al. Role of ribophorin II in the response to anticancer drugs in gastric cancer cell lines[J]. Oncol Lett, 2015, 9(4): 1861-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Huang YC, Yuan TM, Liu BH, et al. Capsaicin potentiates anticancer drug efficacy through autophagy-mediated ribophorin II downregulation and necroptosis in oral squamous cell carcinoma cells[J]. Front Pharmacol, 2021, 12: 676813. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29. Uzunparmak B, Gao M, Lindemann A, et al. Caspase-8 loss radiosensitizes head and neck squamous cell carcinoma to SMAC mimetic-induced necroptosis[J]. JCI Insight, 2020, 5(23): e139837. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30. Huang K, Gu XT, Xu HM, et al. Prognostic value of necroptosis-related genes signature in oral squamous cell carcinoma[J]. Cancers, 2023, 15(18): 4539. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31. Seo J, Nam YW, Kim S, et al. Necroptosis molecular mechanisms: recent findings regarding novel necroptosis regulators[J]. Exp Mol Med, 2021, 53(6): 1007-17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32. Yun HM, Park JE, Lee JY, et al. Latifolin, a natural flavonoid, isolated from the heartwood of Dalbergia odorifera induces bioactivities through apoptosis, autophagy, and necroptosis in human oral squamous cell carcinoma[J]. Int J Mol Sci, 2022, 23(21): 13629. [DOI] [PMC free article] [PubMed] [Google Scholar]


