Abstract
目的
膀胱小细胞癌(small cell carcinoma of bladder, SCCB)是一种罕见的膀胱恶性肿瘤,本研究拟探索其临床病理特征和预后因素,同时探讨围手术期治疗的疗效。
方法
收集2016年1月–2024年1月四川大学华西医院收治的SCCB患者的临床资料。总结该肿瘤的临床病理特征,分析生存结果和预后因素,探索围手术期治疗对改善预后的作用。
结果
共纳入31例SCCB病例,其临床病理特征包括:临床分期晚,所有病例T分期均在T2以上,初诊病例有23%发现远处转移;合并其他组织学类型比例高,其中96%合并尿路上皮癌。患者预后较差,中位生存时间为12.0个月,1年总生存(overall survival, OS)率57.9%,3年OS率27.6%。广泛期SCCB患者中位生存时间(4.4个月)较局限期患者中位生存时间短(17.0个月),差异有统计学意义(P<0.05)。局限期SCCB中,接受根治性膀胱切除术(radical cystectomy, RC)患者和未接受RC患者中位OS为19.9个月和15.2个月,差异有统计学意义(P<0.05)。围手术治疗联合RC组总生存时间长于单纯手术组(P<0.05),其中接受新辅助治疗患者总生存时间长于未接收新辅助治疗患者(P<0.05)。亚组分析显示,新辅助治疗有反应的患者无病生存时间和总生存时间均长于新辅助治疗无反应患者(P<0.05)。淋巴结转移为独立预后不良因素〔风险比(hazard ratio, HR)=15.21,95%置信区间(confidence interval, CI):1.732~133.912,P=0.014〕,根治性术前接受新辅助治疗是独立保护因素,对比接受初始手术能显著降低患者的死亡风险(HR=0.03,95%CI:0.001~0.724,P=0.031)。
结论
对于局限期SCCB患者,根治性手术是延长生存期的有效治疗方法,联合新辅助治疗可进一步提高其生存率。
Keywords: 膀胱小细胞癌, 临床病理特征, 预后因素, 新辅助治疗, 围手术期治疗
Abstract
Objective
Small cell carcinoma of the bladder (SCCB) is a rare malignant tumor of the bladder. This study aims to explore its clinicopathological features and prognostic factors and to explore the role of perioperative treatment methods.
Methods
The clinical data of SCCB patients admitted to West China Hospital, Sichuan University over 8 years from January 2016 to January 2024 were collected. The clinicopathological features of SCCB were summarized. The survival outcomes and prognostic factors were analyzed. The effect of perioperative treatment on the improvement in prognosis was explored.
Results
A total of 31 confirmed cases of SCCB were enrolled. We observed a number of clinicopathologic features. All cases had advanced clinical staging, with the T staging status being above T2 in all cases, and distant metastasis was found in 23% of the newly diagnosed cases. A high proportion of the SCCB cases were combined with other histologic types, with 96% showing combination with urothelial carcinoma (UC). The SCCB patients had a poor prognosis, presenting a median survival of 12 months, 1-year overall survival (OS) of 57.9%, and 3-year OS of 27.6%. Patients with extensive-stage SCCB had a significantly worse prognosis than those with limited-stage SCCB did (median OS time of 17.0 months vs. 4.4 months, P<0.05). In limited-stage SCCB, the median OS of patients who underwent radical cystectomy (RC) was 19.9 months, while that of the patients who did not undergo RC was 15.2 months (P<0.05). The OS of patients who received perioperative therapy in combination with RC had longer OS than those who received only RC did (P<0.05). Among these, patients recevied neoadjuvant therapy (NAT) had a significantly longer OS than patients who didn't receive NAT (P<0.05). Subgroup analysis revealed that patients who were responsive to neoadjuvant therapy had longer disease-free survival and longer OS than those who were not responsive did (P<0.05). Lymph node metastasis was an independent factor of poor prognosis (hazard ratio [HR]=15.21, 95% confidence interval [CI]: 1.732-133.912, P=0.014). NAT prior to RS was an independent protective factor, significantly reducing the risk of death compared with RC alone (HR=0.03, 95% CI: 0.001-0.724, P=0.031).
Conclusion
RC is an effective treatment that prolongs the survival of patients with limited-stage SCCB. RS combined with NAT can further improve their survival.
Keywords: Small cell carcinoma of the bladder, Clinicopathologic features, Prognostic factors, Neoadjuvant therapy, Perioperative treatment
膀胱小细胞癌(small cell carcinoma of the bladder, SCCB)是一种极其罕见的膀胱癌类型,在膀胱肿瘤中仅占0.35%~0.7%[1], SCCB具有细胞分化差、侵袭性强、患者预后差的特点[2]。由于病例有限,目前仍缺乏前瞻性临床研究。本研究通过收集近年来四川大学华西医院诊治并确诊为SCCB的患者的临床资料,分析其临床病理特征与预后情况,探索围手术期治疗对预后的影响。
1. 资料与方法
1.1. 研究对象及随访方法
本研究通过我院电子病历系统、电话随访等方式收集患者临床和随访资料,研究对象为2016年1月–2024年1月于四川大学华西医院就诊并确诊为SCCB的患者, 纳入标准:①经我院病理诊断为SCCB;②随访资料完整。临床资料包括临床信息、病理特征、治疗方式等。新辅助治疗指根治性膀胱切除术前进行的全身药物治疗,辅助治疗指根治性膀胱切除术后进行的全身药物治疗。本研究获四川大学华西医院生物医学伦理审查委员会批准,伦理批文号:2024年审(2148)号。
从患者确诊SCCB开始随访,随访日期截止2024年4月1日,每4~6个月进行一次随访。随访内容为患者肿瘤控制情况和生存信息。总生存期 (overall survival, OS)是指患者自确诊SCCB至患者死亡或最后一次随访的日期。无疾病生存期 (disease-free survival, DFS)是指患者自接受根治性膀胱切除术(radical cystectomy, RC)至首次出现复发转移或最后一次随访的日期。新辅助治疗后肿瘤分期相比于治疗前显著降低(术后病理分期<pT2N0)定义为对新辅助治疗有反应。
1.2. 统计学方法
采用描述性统计描述SCCB队列中年龄、性别、临床分期、治疗信息等临床特征和组织学亚型、生物标志物特征的频率等病理特征。计量资料的比较采用独立样本t检验或Wilcoxon秩和检验;计数资料的比较采用χ2检验或Fisher精确检测。采用R 4.4.0统计软件中survival及survminer包进行生存分析,应用Kaplan-Meier方法绘制生存曲线并计算生存率,应用log-rank方法检验不同亚组的生存差异。采用R 4.4.0统计软件进行单因素和多因素Cox回归分析。双侧检验,P<0.05为差异有统计学意义。
2. 结果
2.1. 临床及病理特征
2.1.1. 临床特征
本院2016年1月–2024年1月共收治膀胱神经内分泌癌患者61例,其中病理诊断符合SCCB有31例。临床资料详见表1。31例SCCB患者年龄为41~89岁,有16例患者年龄小于65岁,中位年龄64.00岁;男性19例,女性12例。根据膀胱癌TNM分期,初诊时所有患者临床肿瘤T分期均大于T2期,9例患者(29%)发生淋巴结转移,7例患者(23%)存在远处转移。根据美国退伍军人分期系统将患者分为局限期组24例和广泛期组7例。
表 1. Clinical characteristics of SCCB patients at baseline.
膀胱小细胞癌患者基线临床特征
| Item | Total (n=31) | Limited-stage group (n=24) | Extensive-stage group (n=7) | P |
| Age/yr., median (P25-P75) | 64.00 (54.00-72.50) | 62.00 (52.00-67.25) | 73.00 (70.50-80.00) | 0.040 |
| Age≥65 yr./case (%) | 15 (48) | 9 (38) | 6 (86) | 0.037 |
| Sex/case (%) | >0.999 | |||
| Female | 12 (39) | 9 (38) | 3 (43) | |
| Male | 19 (61) | 15 (63) | 4 (57) | |
| Clinical T stage/case (%) | 0.034 | |||
| T2 | 20 (65) | 18 (75) | 2 (29) | |
| T3 | 10 (32) | 6 (25) | 4 (57) | |
| T4 | 1 (3) | 0 (0) | 1 (14) | |
| Clinical N stage/case (%) | 0.150 | |||
| N+ | 9 (29) | 5 (21) | 4 (57) | |
| N0 | 22 (71) | 19 (79) | 3 (43) | |
| Clinical M stage/case (%) | <0.001 | |||
| M+ | 7 (23) | 0 (0) | 7 (100) | |
| M0 | 24 (77) | 24 (100) | 0 (0) |
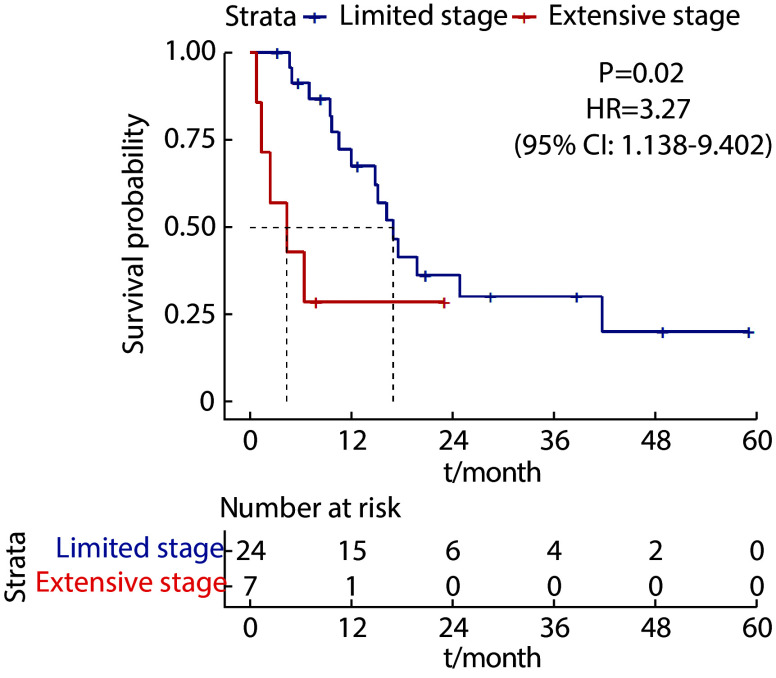
中位随访28.6个月(0.8~59.2个月),至随访结束,31 例患者中死亡22例,9例存活。所有患者中位生存时间为12.0个月,1年OS率57.9%,3年OS率27.6%。局限期患者中位生存时间为17.0个月,广泛期中位生存时间为4.4个月,1年OS率分别为57.9%和27.6%,差异有统计学意义(P<0.05,图1)。
图 1.
Overall survival for patients with limited-stage and extensive-stage SCCB
局限期和广泛期患者总生存率
Number at risk is defined as the number of subjects in a study who are still alive and under observation at a given time point.
2.1.2. 肿瘤病理特征
31 例患者中有26例为膀胱内单发肿瘤,5例为膀胱内多发肿瘤。肿瘤部位最常见于膀胱侧壁(n=18)及后壁(n=12)。组织形态学方面,8例(26%)为单纯的小细胞癌,其余23例(74%)存在混合成分。最常见的混合成分为经典型尿路上皮癌,占96%(22/23),其中有2例含有原位癌成分;其他混合成分包括,大细胞神经内分泌癌(n=3,14%)、肉瘤样癌(n=3,14%)、腺癌(n=2,9%)等。病理特征详见表2。31例中Syn、CD56、CgA的阳性检出率分别为100%、100%、58%。Ki-67增殖指数在所有病例中均在50%以上(50%~90%,中位值为70%)。7例患者接受蛋白表达检测显示RB1基因蛋白为表达缺失。10例患者接受了HER-2蛋白表达检测,结果均为阴性(表3)。
表 2. Pathological characteristics of patients with SCCB.
膀胱小细胞癌患者病理特征
| Variable | Case (%) |
| Mixed: mixed with other tumor components; single site/multiple sites refers to the number of tumor sites in bladder. | |
| Pathological classification | |
| SCCB only | 8 (26) |
| Mixed | 23 (74) |
| Urothelial carcinoma | 22 (96) |
| Large cell carcinoma | 3 (14) |
| Sarcomatoid carcinoma | 3 (14) |
| Adenocarcinoma | 2 (9) |
| Ki-67 | |
| 50%-80% | 15 (48) |
| >80% | 16 (52) |
| Single site | 26 (84) |
| Multiple sites | 5 (16) |
| Tumor site inside bladder | |
| Side wall | 18 (51) |
| Posterior wall | 12 (34) |
| Upper wall | 2 (6) |
表 3. Immunohistochemical characteristics of patients with SCCB.
膀胱小细胞癌患者免疫组化特征
| Immunohistochemical stain | Cases analyzed | Positive cases (%) |
| RB1: retinoblastoma 1; HER-2: human epidermal growth factor receptor 2. | ||
| Neuroendocrine markers | ||
| Synaptophysin | 31 | 31 (100) |
| CD56 | 31 | 31(100) |
| Chromogranin A | 31 | 18 (58) |
| RB1 | 7 | 0 (0) |
| HER-2 | 10 | 0 (0) |
2.2. 治疗方案对预后的影响
2.2.1. 治疗方案
24例局限期SCCB患者中,有18例接受了RC,其中有12例患者接受了围手术期治疗。10例患者在术前接受了新辅助治疗,其中8例为新辅助化疗,2例为新辅助化疗联合免疫治疗。6例患者在根治手术后接受辅助治疗,其中4例为辅助化疗,1例为辅助化疗联合免疫治疗,1例为辅助靶向治疗。接受围术期治疗的患者中,有4例患者既接受了新辅助治疗,也接受了辅助治疗。化疗方案均为EP(依托泊苷+顺铂)方案,免疫治疗均为抗程序性死亡受体1(programmed death 1, PD-1)抗体。另外6例未行RC的患者中,3例行经尿道膀胱肿瘤切除术联合膀胱灌注化疗,2例行经尿道膀胱肿瘤切除术,1例患者行化疗联合免疫治疗后接受以放疗为主的保膀胱综合治疗。
7例广泛期SCCB患者中,5例患者因身体状况或患者意愿仅接受局部治疗,其中1例患者行经尿道膀胱肿瘤切除术联合膀胱灌注化疗,4例行经尿道膀胱肿瘤切除术。另2例接受全身治疗,1例为一线化疗后进展接受化疗联合免疫治疗,1例为化疗联合免疫治疗后接受膀胱局部放疗。化疗方案均为EP(依托泊苷+顺铂)方案,免疫治疗为抗PD-1抗体。
2.2.2. 围术期治疗和患者预后
局限期SCCB患者中接受RC组和未接受RC组在年龄、性别、病理类型、临床分期差异无统计学意义(P>0.05)。进一步对局限期SCCB患者接受根治性手术的生存分析显示,根治性手术延长了局限期SCCB患者的生存时间。接受RC患者和未接受RC患者中位OS为19.9个月和15.2个月(P<0.05,图2A),1年OS率为76.5%和60.0%。
图 2.
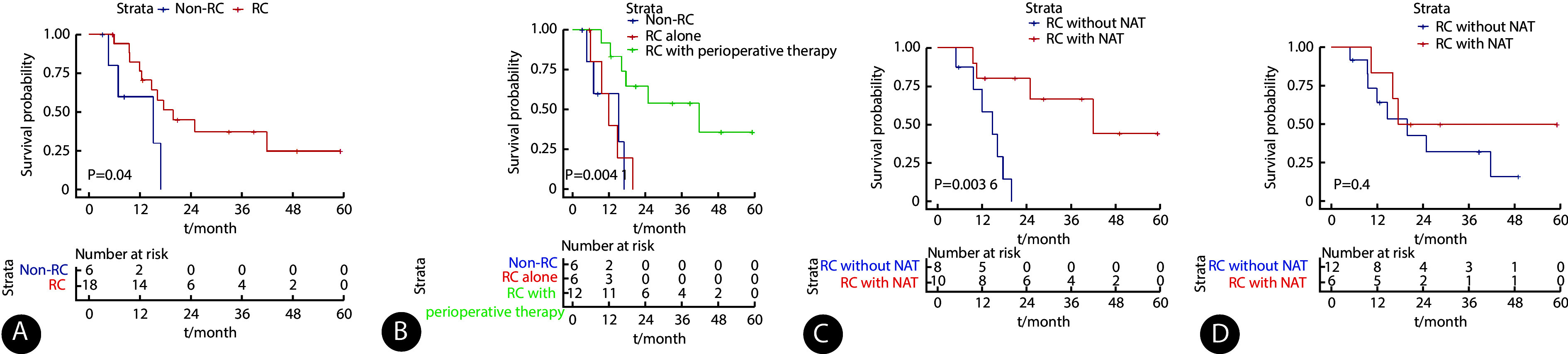
Analysis of overall survival according to radical cystectomy and perioperative treatment modalities in patients with limited-stage SCCB
局限期SCCB患者根治性膀胱切除术和围术期治疗方式的总生存率
RC: radical cystectomy; NAT: neoadjuvant therapy; AT: adjuvant therapy. Number at risk refers to the number of subjects in a study who are still alive and under observation at a given time point. A, Overall survival for patients who underwent RC and those who did not; B, overall survival of limited-stage SCCB patients who were managed by no RC, or RC alone, or RC plus perioperative chemotherapy; C, overall survival of patients who received RC and pre-RC NAT and those who received only RC; D, overall survival of patients treated by RC and post-RC AT and those treated by RC only.
亚组分析显示,围手术期治疗联合手术可以延长总生存时间(P<0.05,图2B)。围手术期治疗组和单纯手术组中位生存时间为22.9个月和10.9个月(P<0.05,图2B),1年OS率为83.3%和41.7%。围手术期治疗延长疾病控制时间,围手术期组和单纯手术组中位DFS为8.3个月和5.1个月。围手术期组1年、3年DFS率均为48.6%,而单纯手术组均在术后1年内出现疾病进展。
进一步分析发现,在接受了根治性手术的SCCB患者中,术前行新辅助治疗可以提高总生存时间(P<0.05,图2C)。接受新辅助治疗患者中位OS尚未达到,而未接受新辅助治疗的患者中位OS为14.8个月,两组的1年OS率分别为80.0%和58.3%。接受新辅助治疗患者的中位DFS尚未达到,1 年和3年的DFS率均为58.3%;未行新辅助治疗的患者在术后1年内全部复发,中位DFS为4.4个月。
在接受了根治性手术的SCCB患者中, 辅助治疗改善总生存效果不明显(P>0.05,图2D)。术后行辅助治疗患者和未行辅助治疗患者中位OS为19.9个月和17.6个月,两组1年OS率为83.3%和63.2%。辅助治疗组和未行辅助治疗组中位DFS为6.2个月和4.7个月,辅助治疗组1年、3年DFS率均为50%,未行辅助治疗组1年、3年DFS率均为24.3%。4例接受了新辅助治疗和辅助治疗患者对比8例仅接受新辅助治疗或仅接受辅助治疗患者,中位OS(P=0.357)和中位DFS(P=0.246)差异无统计学意义。
2.2.3. 新辅助治疗对患者预后的影响
对接受新辅助治疗的患者进行亚组分析发现,新辅助治疗有反应患者和无反应患者的预后差异有统计学意义(P<0.05),两组的基线特征差异无统计学意义(P>0.05)。接受新辅助治疗患者中有6例对新辅助治疗有反应(术后分期为ypT1N0),其中有3例接受了术后辅助治疗。目前5例患者存活且肿瘤控制良好,1例患者出现复发,总生存时间为12.8~49.0个月,无病生存时间为7.1~46.4个月,中位DFS和中位OS均尚未达到。其中1例患者新辅助方案为EP方案化疗联合免疫治疗,术后病理示肿瘤降期明显,图3为该患者新辅助治疗前后的肿瘤影像对比。
图 3.
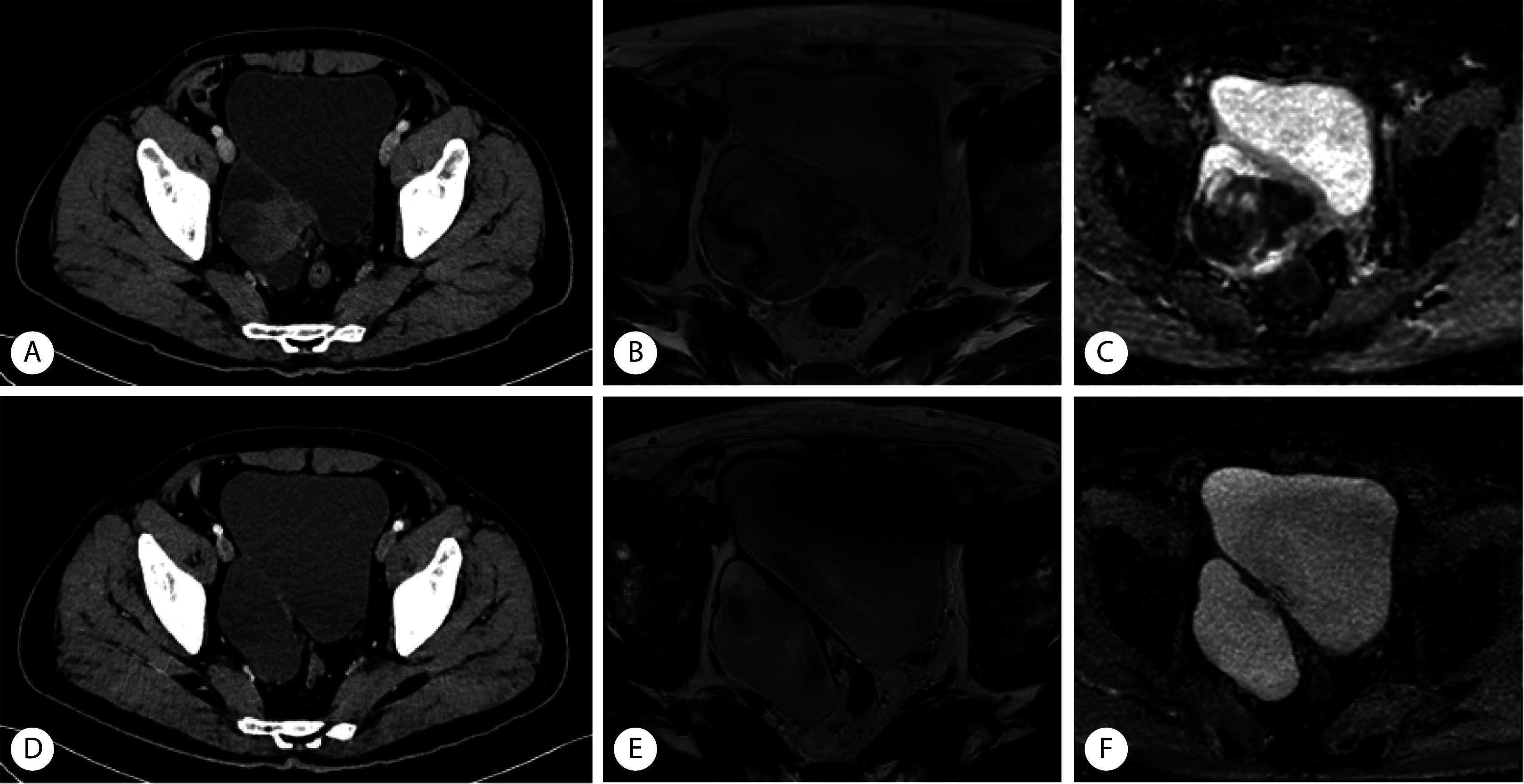
CT and MRI images of SCCB patients before and after neoadjuvant therapy
膀胱小细胞癌患者新辅助化疗联合免疫治疗前后CT和MRI图像
CT: computed tomography; MRI: magnetic resonance imaging. A-C, Before neoadjuvant therapy; D-F, after neoadjuvant therapy; A and D, CT; B and E, MRI T2WI; C and F, MRI DWI.
4例对新辅助治疗无反应的患者(3例术后分期为ypT3N0,1例为ypT3N2),其中1例接受了术后辅助治疗,无病生存时间为1.2~8.3个月,总生存时间分别为9.5~41.8个月。
2.2.4. 预后因素分析
对局限期SCCB患者的临床资料进行预后因素分析,纳入年龄(<65岁=0,≥65岁=1)、性别(女性=0,男性=1)、病理类型(单纯=0,混合=1)、T分期(T2=0,>T2=1)、N分期(无淋巴结转移=0,有淋巴结转移=1)、不同治疗方式(根治性切除、新辅助治疗、辅助治疗、围手术期治疗,以上均为未接受=0,接受=1)进行单因素回归分析,结果显示术前接受新辅助治疗患者〔风险比(hazard ratio, HR)=0.08,95%置信区间(confidence interval, CI):0.009~0.624,P=0.017〕以及接受围手术期治疗(HR=0.17,95%CI:0.042~0.689,P=0.013)显示与更好的预后相关(表4)。纳入有意义的新辅助治疗及围手术期治疗,根据文献选取肿瘤T分期、 N 分期进行多因素回归分析(表5)。结果显示,接受新辅助治疗为SCCB患者的独立预后保护因素,能显著降低SCCB患者的死亡风险(HR=0.03,95%CI:0.001~0.724,P=0.031)。而肿瘤N分期为危险因素,具有淋巴结转移的患者具有更高的死亡风险(HR=15.21,95%CI:1.732~133.912,P=0.014)。
表 4. Univariable Cox regression analyses of the prognosis of patients with limited-stage SCCB.
局限期患者预后单因素Cox回归分析
| Variable | Overall survival | |
| Hazard ratio (95% CI) | P | |
| Female | 1.26 (0.455-3.496) | 0.656 |
| Mixed with other tumor components | 0.82 (0.405-3.692) | 0.721 |
| Age≥65 yr. | 1.07 (1.015-1.133) | 0.012 |
| T stage>T2 | 1.64 (0.560-4.692) | 0.348 |
| N+ | 1.68 (0.583-4.838) | 0.337 |
| Radical cystectomy | 0.29 (0.084-1.014) | 0.052 |
| Neoadjuvant therapy | 0.08 (0.009-0.624) | 0.017 |
| Adjuvant therapy | 0.28 (0.057-1.256) | 0.095 |
| Perioperative therapy | 0.17 (0.042-0.689) | 0.013 |
表 5. Multivariable Cox regression analyses of the prognosis of patients with limited-stage SCCB.
局限期患者预后多因素Cox回归分析
| Variable | Overall survival | |
| Hazard ratio (95% CI) | P | |
| T stage>T2 | 5.76 (0.822-40.389) | 0.078 |
| N+ | 15.21 (1.727-133.912) | 0.014 |
| Neoadjuvant therapy | 0.03 (0.001-0.724) | 0.031 |
| Perioperative therapy | 0.25 (0.039-1.634) | 0.149 |
3. 讨论
原发性膀胱小细胞癌属于低分化神经内分泌肿瘤,发病率极低,占所有膀胱癌的比例<1%,SEER数据库分析显示发病率呈逐年上升趋势[3]。SCCB肿瘤恶性程度高、侵袭性强,相比膀胱尿路上皮癌预后差,5年OS率约为14%~15%[4]。近15年来研究人员尝试不同治疗策略以改善预后,但总生存未见明显提高[2]。因此回顾性分析SCCB的临床病理特征及预后因素,探讨围术期治疗对生存率的改善情况,有利于提出新的研究方向,为改善SCCB的预后提供新思考。
目前SCCB的细胞起源仍不清楚,但近年来越来越多证据支持膀胱小细胞癌具有与尿路上皮癌相同的起源或由尿路上皮癌发展而来[5-8]。组织学分析显示,SCCB常混合其他肿瘤成分,其中最常见的是尿路上皮癌[9-10]。在本研究中也显示有96%(22/23)的病例混合尿路上皮癌成分,其中有2例为原位尿路上皮癌,提示SCCB和尿路上皮癌关系密切。深入分析SCCB的分子特征,有助于了解SCCB发生发展的潜在机制,为新的治疗探索提供思路。视网膜母细胞瘤基因(RB)缺失是SCCB最常见的分子学改变之一,在SCCB中具有极高的频率,可高达90%[6],远远高于尿路上皮癌(21%~36%)[11]。在本研究中所有接受RB1检测的病例均显示RB1缺失,而针对RB1的缺失,有多个潜在靶向治疗的方法正在被研究[12-13],或许能为SCCB治疗提供新思路。
SCCB临床分期和其治疗、预后有密切相关性。临床分期主要参考美国退伍军人分期系统,根据有无远处转移,将膀胱小细胞癌分为局限期和广泛期[2]。研究表明局限期患者预后更好,中位生存时间为39个月,显著长于广泛期中位生存时间(12个月)[14]。在本研究中,局限期患者的预后明显优于广泛期患者,中位生存时间17.0个月 vs. 4.4个月(P=0.02,图1)。局限期患者接受了更积极的治疗,包括围手术期全身治疗和局部根治性治疗(手术或放疗),对疾病控制和生存延长起到重要作用。基于SEER数据库的研究均显示发生淋巴结转移是SCCB的独立不良预后因素[3, 15-16],本研究结果与此一致(HR=15.21,95%CI:1.732~133.912,P=0.014)。膀胱小细胞癌与尿路上皮癌比较,侵袭性强,初诊时多已浸润肌层或膀胱全层(T2及以上),且易出现远处转移[2]。本研究的纳入患者也符合以上特点,初诊时所有的患者已浸润膀胱肌层及以上,且23%的患者已经存在远处器官转移。而与尿路上皮癌不同的是,研究发现是否浸润膀胱肌层及以上并不影响SCCB患者的治疗策略[3],目前治疗推荐主要基于肿瘤处于局限期或广泛期,因此治疗前准确的分期是后续精准治疗的关键。
由于膀胱小细胞癌罕见,目前治疗策略的建立基于回顾性研究或极少数小样本前瞻性临床研究。对于局限期SCCB的治疗,美国国家癌症综合网络(National Comprehensive Cancer Network, NCCN)指南[17]推荐:新辅助化疗后联合局部治疗(手术/放疗),指南来源是基于一个单臂Ⅱ期前瞻性研究,其余均为回顾性研究。该前瞻性研究于2001–2006年纳入30例患者,18例手术切除组患者接受了4周期新辅助治疗,中位OS为58个月,截止2009年有13例患者仍存活且肿瘤控制良好。两项回顾性研究长期随访结果提示新辅助化疗组的预后显著高于单纯膀胱切除术组,两项研究的两组中位OS对比分别为159.5个月 vs. 18.3个月、174个月 vs. 14.4个月(P<0.05)[18-19]。国内一项小样本回顾性研究也显示新辅助治疗能显著改善局限期SCCB总生存(中位OS:32.1个月 vs. 12.4个月,P<0.05)[20]。本研究结果也显示,局限期SCCB 患者可以从新辅助治疗中获益,不仅显著降低患者死亡风险(HR=0.03,95%CI:0.001~0.724,P=0.031),还明显改善患者生存(P=0.0036)。
进一步分析显示,新辅助疗效好的患者预后获益更明显。上述回顾性研究亚组分析显示[18-19],新辅助化疗疗效好的患者,即降期明显(<ypT2N0),其预后显著优于新辅助化疗无反应患者:不仅是疾病控制,中位OS也显著延长,两项研究的两组中位OS对比分别为187个月 vs. 10.8个月、174个月 vs. 30个月(P<0.05),疾病控制时间显著延长(中位DFS 174个月 vs. 7.2个月),5年疾病特异性生存率显著延长(94.4% vs. 20.5%)。本研究也显示,新辅助治疗有反应的患者肿瘤控制和生存时间明显优于无反应患者。既往研究和本研究中均发现,新辅助治疗后肿瘤退缩可以转化为患者的长期生存获益。所以,如何提高新辅助治疗的疗效,是近年来研究的热点。
目前新辅助化疗方案参照SCLC,推荐采用EP方案(依托泊苷+顺铂),其余有EC(依托泊苷+卡铂)、GP(吉西他滨+铂类)或MVAC(甲氨蝶呤+长春花碱+阿霉素+顺铂)等方案,其病理降期率约为48%~62%,病理完全缓解率为38%[16]。由于SCCB具有高肿瘤突变负荷和免疫原性[21],免疫治疗在SCCB中也有一些治疗探索,但仅有个案报道1例SCCB患者接受新辅助化疗联合免疫治疗后,膀胱肿瘤退缩明显,根治手术标本显示达到病理完全缓解[20]。在本研究中,有两例患者接受了新辅助化疗联合抗PD-1抗体治疗,一例患者进行手术,术后病理提示膀胱肿瘤降期明显。另一例经影像学、经尿道膀胱肿瘤切除术多点活检及尿液FISH检测后,疗效评价为临床完全缓解,患者拒绝根治性手术,选择以放疗为主的保膀胱综合治疗。综上,新辅助化疗联合免疫治疗有望提高新辅助治疗效果,增加肿瘤退缩。对于新辅助治疗降期明显的患者,除了根治性膀胱切除,也可考虑以放疗为主的局部治疗保留膀胱。免疫治疗及其他新型治疗的加入可能改变SCCB患者的围手术期治疗模式。
限于本研究为单中心回顾性研究,为了更好地探索围术期治疗的作用,值得开展多中心前瞻性研究来进一步探索新的治疗策略及方法:包括如何联合新型药物(免疫治疗,靶向治疗等)加强新辅助治疗疗效,提高肿瘤降期;如何识别出对新辅助治疗有良好反应的SCCB患者,进行分层个体化治疗等。
* * *
作者贡献声明 邓佳妮负责论文构思、数据审编、正式分析、调查研究、研究方法、验证、可视化、初稿写作和审读与编辑写作,张孟尼负责数据审编、调查研究、提供资源和监督指导,杨淼负责正式分析、调查研究、验证和可视化,张朋负责论文构思、研究项目管理、提供资源和监督指导,沈亚丽负责论文构思、数据审编、研究方法、提供资源、监督指导、初稿写作和审读与编辑写作。所有作者已经同意将文章提交给本刊,且对将要发表的版本进行最终定稿,并同意对工作的所有方面负责。
Author Contribution DENG Jiani is responsible for conceptualization, data curation, formal analysis, investigation, methodology, validation, visualization, writing--original draft, and writing--review and editing. ZHANG Mengni is responsible for data curation, investigation, resources, and supervision. YANG Miao is responsible for formal analysis, investigation, validation, and visualization. ZHANG Peng is responsible for conceptualization, project administration, resources, and supervision. SHEN Yali is responsible for conceptualization, data curation, methodology, resources, supervision, writing--original draft, and writing--review and editing. All authors consented to the submission of the article to the Journal. All authors approved the final version to be published and agreed to take responsibility for all aspects of the work.
利益冲突 所有作者均声明不存在利益冲突
Declaration of Conflicting Interests All authors declare no competing interests.
Contributor Information
佳妮 邓 (Jiani DENG), Email: wwwwani44@163.com.
亚丽 沈 (Yali SHEN), Email: sylprecious123@163.com.
References
- 1.CRAMER S F, AIKAWA M, CEBELIN M Neurosecretory granules in small cell invasive carcinoma of the urinary bladder. Cancer. 1981;47(4):724–730. doi: 10.1002/1097-0142(19810215)47:4<724::aid-cncr2820470417>3.0.co;2-2. [DOI] [PubMed] [Google Scholar]
- 2.KOUBA E J,CHENG L Understanding the genetic landscape of small cell carcinoma of the urinary bladder and implications for diagnosis, prognosis, and treatment: a review. JAMA Oncol. 2017;3(11):1570–1578. doi: 10.1001/jamaoncol.2016.7013. [DOI] [PubMed] [Google Scholar]
- 3.KOAY E J, TEH B S, PAULINO A C, et al A surveillance, epidemiology, and end results analysis of small cell carcinoma of the bladder: epidemiology, prognostic variables, and treatment trends. Cancer. 2011;117(23):5325–5333. doi: 10.1002/cncr.26197. [DOI] [PubMed] [Google Scholar]
- 4.CHOONG N W, QUEVEDO J F, KAUR J S Small cell carcinoma of the urinary bladder. The Mayo Clinic experience. Cancer. 2005;103(6):1172–1178. doi: 10.1002/cncr.20903. [DOI] [PubMed] [Google Scholar]
- 5.CHENG L, JONES T D, MCCARTHY R P, et al Molecular genetic evidence for a common clonal origin of urinary bladder small cell carcinoma and coexisting urothelial carcinoma. Am J Pathol. 2005;166(5):1533–1539. doi: 10.1016/s0002-9440(10)62369-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.CHANG M T, PENSON A, DESAI N B, et al Small-cell carcinomas of the bladder and lung are characterized by a convergent but distinct pathogenesis. Clin Cancer Res. 2018;24(8):1965–1973. doi: 10.1158/1078-0432.Ccr-17-2655. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.FUJII T, SHIMADA K, TATSUMI Y, et al microRNA-145 promotes differentiation in human urothelial carcinoma through down-regulation of syndecan-1. BMC Cancer. 2015;15:818. doi: 10.1186/s12885-015-1846-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.GAISA N T, TILKI D, LOSEN I, et al. Insights from a whole cystectomy specimen--association of primary small cell carcinoma of the bladder with transitional cell carcinoma in situ. Hum Pathol, 2008, 39(8): 1258–1262.
- 9.WANG G, XIAO L, ZHANG M, et al Small cell carcinoma of the urinary bladder: a clinicopathological and immunohistochemical analysis of 81 cases. Hum Pathol. 2018;79:57–65. doi: 10.1016/j.humpath.2018.05.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.TRIAS I, ALGABA F, CONDOM E, et al Small cell carcinoma of the urinary bladder. Presentation of 23 cases and review of 134 published cases. Eur Urol. 2001;39(1):85–90. doi: 10.1159/000052417. [DOI] [PubMed] [Google Scholar]
- 11.ROBERTSON A G, KIM J, Al-AHMADIE H, et al Comprehensive molecular characterization of muscle-invasive bladder cancer. Cell. 2018;174(4):1033. doi: 10.1016/j.cell.2018.07.036. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.OSER M G, FONSECA R, CHAKRABORTY A A, et al Cells lacking the RB1 tumor suppressor gene are hyperdependent on Aurora B kinase for survival. Cancer Discov. 2019;9(2):230–247. doi: 10.1158/2159-8290.Cd-18-0389. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.XI J, MA C X Sequencing endocrine therapy for metastatic breast cancer: what do we do after disease progression on a CDK4/6 inhibitor? Curr Oncol Rep. 2020;22(6):57. doi: 10.1007/s11912-020-00917-8. [DOI] [PubMed] [Google Scholar]
- 14.Van De KAMP M, MEIJER R, POS F, et al Intravesical recurrence after bladder sparing treatment of small cell carcinoma of the bladder: Characteristics, treatment, and outcome. Urol Oncol. 2018;36(6):307.e1–307.e8. doi: 10.1016/j.urolonc.2018.02.015. [DOI] [PubMed] [Google Scholar]
- 15.NIU Q, LU Y, XU S, et al Clinicopathological characteristics and survival outcomes of bladder neuroendocrine carcinomas: a population-based study. Cancer Manag Res. 2018;10:4479–4489. doi: 10.2147/cmar.S175286. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.MOLLICA V, MASSARI F, ANDRINI E, et al Prognostic factors of survival for high-grade neuroendocrine neoplasia of the bladder: a SEER database analysis. Curr Oncol. 2022;29(8):5846–5854. doi: 10.3390/curroncol29080461. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.National Comprehensive Cancer Network. NCCN Guidelines. [2024-08-29]. https://wwsw.nccn.org/guidelines/guidelines-detail?category=1&=1417.
- 18.LYNCH S P, SHEN Y, KAMAT A, et al Neoadjuvant chemotherapy in small cell urothelial cancer improves pathologic downstaging and long-term outcomes: results from a retrospective study at the MD Anderson Cancer Center. Eur Urol. 2013;64(2):307–313. doi: 10.1016/j.eururo.2012.04.020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.TEO M Y, GUERCIO B J, ARORA A, et al Long-term outcomes of local and metastatic small cell carcinoma of the urinary bladder and genomic analysis of patients treated with neoadjuvant chemotherapy. Clin Genitourin Cancer. 2022;20(5):431–441. doi: 10.1016/j.clgc.2022.05.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.阿克周力·沙哈提艾力, 钱雷, 张天祥, 等 膀胱小细胞癌临床病理特征及新辅助治疗疗效. 现代泌尿外科杂志. 2023;28(6):474–479. doi: 10.3969/j.issn.1009-8291.2023.06.004. [DOI] [Google Scholar]; AKEZHOULI SHAHATIAILI, QIAN L, ZHANG T X, et al Clinical and pathological characteristics of small cell carcinoma of bladder and the efficacy of neoadjuvant therapy. J Mod Urol. 2023;28(6):474–479. doi: 10.3969/j.issn.1009-8291.2023.06.004. [DOI] [Google Scholar]
- 21.SHEN P, JING Y, ZHANG R, et al Comprehensive genomic profiling of neuroendocrine bladder cancer pinpoints molecular origin and potential therapeutics. Oncogene. 2018;37(22):3039–3044. doi: 10.1038/s41388-018-0192-5. [DOI] [PubMed] [Google Scholar]