RESUMEN
Fundamentos:
Existen pruebas de la factibilidad de una vacuna para prevenir la infección por Helicobacter pylori. Modelizaciones en entornos de baja prevalencia informan de una muy probable coste-efectividad a largo plazo. El objetivo de este estudio fue cuantificar su eficiencia en un contexto local.
Métodos:
Se simuló la evolución de una cohorte de nacidos a través de un modelo compartimental representativo de varios estados clínicos en relación a la infección por H. pylori. Se ejecutó dicho modelo bajo las premisas de vacunación en el periodo de lactante y de no intervención. El horizonte temporal fue equivalente a la esperanza de vida y se tuvo en cuenta la perspectiva del sistema de salud.
Resultados:
La vacunación frente a H. pylori costaría de media 2.168 €/persona más que la no intervención. Con ello se obtendrían 0,32 años de vida ganados ajustados por calidad (AVAC), lo que implicaría una razón de coste-efectividad incremental (RCEI) media de 7.196 €/AVAC. Para una disposición a pagar de 24.506 €/AVAC, el 99,96% de las simulaciones resultaron coste-efectivas al alcanzar el horizonte temporal y se cruzó dicho umbral a partir de los treinta años de la vacunación. Las variables que más peso tuvieron para explicar la variabilidad de la RCEI fueron, en este orden, la efectividad vacunal, la incidencia de la infección en la primera infancia y el precio de la vacuna. La vacunación dejaría de ser coste-efectiva con un precio mayor de 3.634€/vial o con una cobertura poblacional efectiva menor del 11%.
Conclusiones:
Una vacunación frente a la infección por H. pylori administrada en la infancia sería coste-efectiva a largo plazo en un entorno con las características epidemiológicas y económicas del sur de Europa.
Palabras clave: Coste-efectividad, Cáncer gástrico, Enfermedad úlcero-péptica, Helicobacter pylori, Vacuna
ABSTRACT
Background:
There is sufficient evidence on the feasibility of a vaccine to prevent Helicobacter pylori infection. Modeling studies in low prevalence environments report a very probable long-term cost-effectiveness. The objective of this study was to quantify its efficiency in a local context.
Methods:
The evolution of a cohort of newborns was simulated through a compartmental model representing a series of clinical situations regarding H. pylori infection and related diseases. The model was run under the assumption of both vaccination in the first year of life and no intervention. The time horizon was set as equivalent to the life expectancy and the perspective of the health system was taken into account.
Results:
Vaccination against H. pylori would cost an average of €2,168/person more than no intervention. This would yield an average additional 0.32 quality-adjusted life years gained (QALY), which would entail an incremental cost-effectiveness ratio (ICER) of €7,196/QALY. For a willingness to pay of €24,506/QALY, 99.96% of the simulations were cost-effective at eighty-four years old. This threshold was crossed thirty years after vaccination. The variables that carried the most weight in explaining the variability of the ICER were, in this order, vaccine effectiveness, the incidence of infection in young children, and the price of the vaccine. Vaccination would cease to be cost-effective with a price greater than €3,634/dose or with effective population coverage less than 11%.
Conclusions:
When implemented in an environment with the epidemiological and economic characteristics of Southern Europe, a prophylactic vaccination against H. pylori would be cost-effective in the long run.
Key words: Cost-effectiveness, Gastric cancer, Peptic ulcer disease, Helicobacter pylori, Vaccine
INTRODUCCIÓN
Se estima que la mitad de la población mundial está colonizada por Helicobacter pylori (HP). La distribución global no es homogénea e implica sobre todo a países subdesarrollados 1 . La infección confiere un riesgo aumentado de adenocarcinoma gástrico, de linfoma MALT (Mucosa-Associated Lymphoid Tissue) y de enfermedad úlcero-péptica (EUP) 2 .
Actualmente se trata la infección por HP con antisecretores gástricos y antibióticos. En consecuencia, el tratamiento puede fallar debido a las resistencias. En un estudio con más de 184.000 personas y una prevalencia de infección del 57%, las combinaciones de fármacos erradicadores presentaron un 27% de fallos primarios 3 . Además, en diversos trabajos en población pediátrica, la proporción de éxito fue, en todas las combinaciones, inferior al objetivo del 90% 4 . El tratamiento no impide la reinfección, con lo que tampoco evita la recolonización ni la aparición ulterior de enfermedades asociadas. Sin embargo, sí es posible que la inmunización activa sea una forma atractiva de prevenirlas 5 .
Una vacuna administrada en la infancia sería más interesante que una vacuna terapéutica aplicada en la edad adulta. De hecho, hay pruebas de que en entornos de baja prevalencia es deseable la máxima precocidad en la vacunación. En Estados Unidos la razón de coste-efectividad incremental (RCEI) bajaría del límite de 50.000 dólares por cada año de vida ganado ajustado por calidad (AVAC) pasados treinta y ocho años del inicio de un programa en lactantes, pero harían falta cincuenta años si la vacunación se iniciara en edad escolar 6 .
Las simulaciones reflejan que la epidemiología del HP, el adenocarcinoma gástrico y la EUP seguirán una paulatina tendencia a la baja, incluso sin vacunación sistemática. Aún así, una vacuna preventiva aceleraría el descenso en la incidencia y erradicaría el HP en menos de un siglo en Estados Unidos 8 , 8 .
Empleando como indicador de la carga de enfermedad el equivalente de mortalidad infantil (EMI), una vacuna sería coste-efectiva incluso con niveles bajos de protección (55%) si el precio unitario fuera como máximo de 60 dólares (de 1997) en Estados Unidos. Tendría incluso mayores beneficios en salud medidos en EMI que las vacunas frente a la hepatitis B, la gripe y el rotavirus. Por el contrario, en países en desarrollo, los indicadores de coste-efectividad no serían favorables 9 .
Los análisis de sensibilidad de estos trabajos reflejan la extraordinaria influencia del desarrollo del país, la prevalencia de la infección, la de las enfermedades relacionadas y el alcance del sistema sanitario. Por este motivo, y ante la falta de estudios específicos, se propuso un análisis coste-efectividad con el objetivo de estudiar el impacto de una potencial vacuna frente a la colonización por HP en el contexto sureuropeo 5 .
SUJETOS Y MÉTODOS
Diseño del estudio, ámbito y alcance.
Se llevó a cabo un estudio de evaluación económica sobre una posible vacuna preventiva frente a la infección por HP, que se administraría sistemáticamente en lactantes. Se tuvieron en cuenta datos representativos de las condiciones epidemiológicas y económicas actuales del sur de Europa. Atendiendo a la información disponible de Estados Unidos, se previó que el horizonte temporal fuera superior a cuarenta años 6 . Solo se tuvo en cuenta la perspectiva del proveedor de servicios de salud.
Descripción del modelo.
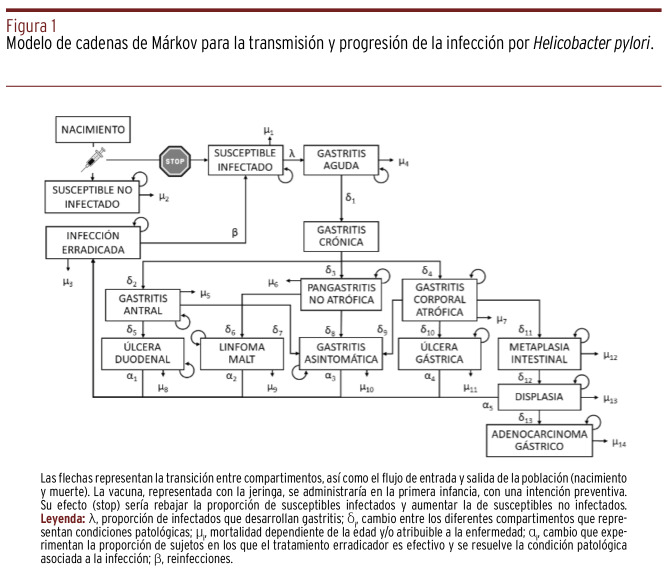
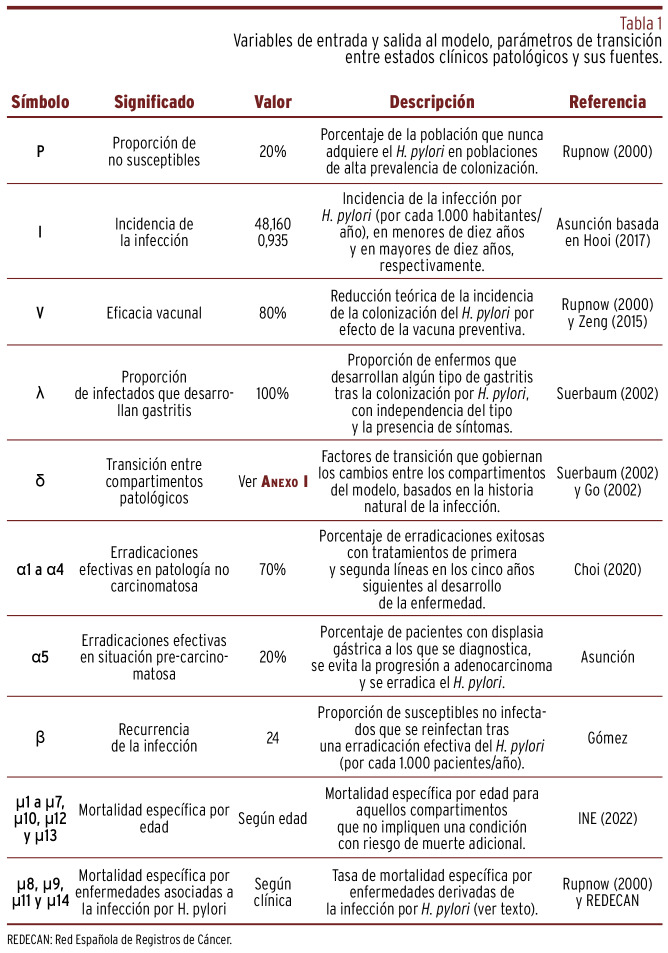
Se diseñó un modelo de cadenas de Márkov en el que una cohorte de nacidos en el mismo momento se asignó a varios compartimentos con una probabilidad de transferencia entre los mismos gobernada matemáticamente [Figura 1]. Imitando la metodología descrita por Rupnow et al., la incidencia de la infección por HP se calculó como una función del número de personas susceptibles e infectadas, así como con una constante llamada parámetro de transmisión 6 , 7 . Se buscaron los parámetros que mejor traducían la prevalencia e incidencia de la colonización, del cáncer gástrico, del linfoma MALT y de la EUP por HP en el sur de Europa 1 , 7 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , [Tabla 1].
Figura 1. Modelo de cadenas de Márkov para la transmisión y progresión de la infección por Helicobacter pylori.
Tabla 1. Variables de entrada y salida al modelo, parámetros de transición entre estados clínicos patológicos y sus fuentes.
Varias asunciones definieron el funcionamiento del modelo. En primer lugar, que la adquisición de HP es cinco-diez veces más frecuente en la infancia que en personas adultas. Una persona susceptible puede infectarse por HP a cualquier edad y puede desarrollar una gastritis predominantemente antral o corporal. El modelo representó un flujo neto del estado de gastritis aguda a crónica porque esta progresión es la predominante en la patogenia y porque es desde la gastritis crónica donde emergen las enfermedades asociadas 13. La modelización empleada respetó también las observaciones de que en personas con gastritis antral por HP es más probable la EUP duodenal, mientras que, aquellas con gastritis corporal, tienen más riesgo de EUP gástrica y de gastritis atrófica y, por tanto, de displasia y cáncer. Se despreció la posibilidad de desarrollar gastritis atrófica y cáncer en pacientes con EUP 13.
El modelo permitió volver al estado de susceptible no infectado (infección erradicada) desde todas las categorías patológicas, salvo desde gastritis aguda, que es la situación previa a la cronificación de la gastritis, asintomática y que pasa desapercibida 18. Las tasas de cambio entre compartimentos y su justificación se reflejan en la Tabla 1.
El factor que rige la transición desde el estado de infección erradicada a nueva infección se obtuvo de un estudio local, asumiendo que la vacunación no tendría efecto sobre la susceptibilidad a una recolonización 17.
La incidencia de la infección se estimó a partir de datos de prevalencia de colonización por HP del sur de Europa (55% en un reciente metanálisis 1 y la esperanza de vida del Estado español 19.
La práctica totalidad de los linfomas MALT se producen en pacientes colonizados por HP, por lo que se empleó la incidencia general de este cáncer para estimar el parámetro del cambio desde el estado previo de pangastritis no atrófica 13.
Las tasas de mortalidad en función de la edad se obtuvieron del Instituto Nacional de Estadística 19. Como fuentes para la tasa de letalidad de la EUP se emplearon las mismas que en Estados Unidos, por falta de datos locales de calidad: 4,9% en diez años para las úlceras duodenales y 9,5% en diez años para las úlceras gástricas 6. Finalmente, se consultó el informe de la Red Española de Registros de Cáncer (REDECAN) para obtener la supervivencia neta a los cinco años, ajustada por edad, del adenocarcinoma gástrico (28%) y del linfoma MALT (88,7%) 20.
Implementación del modelo.
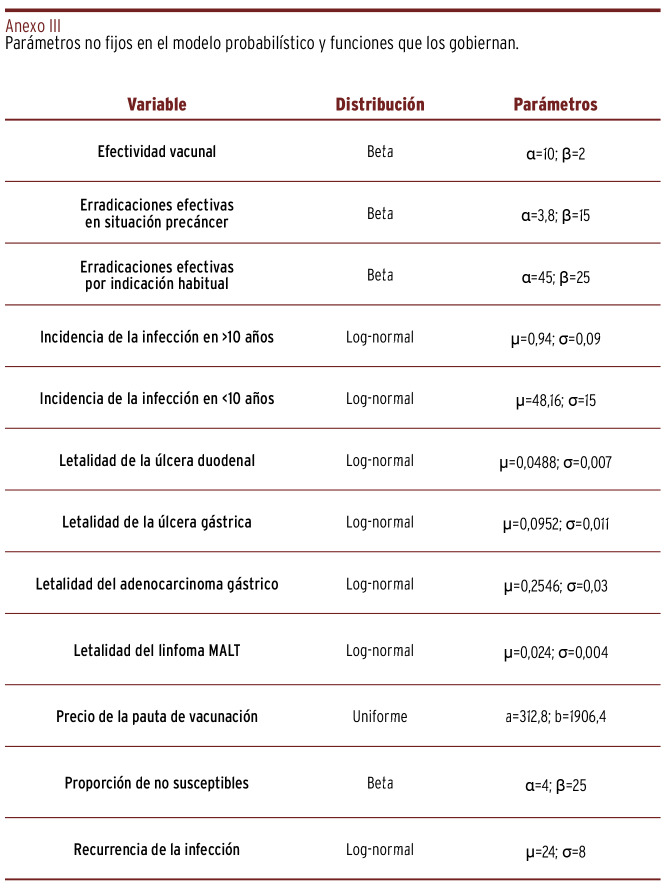
Para el cálculo de las tasas de transferencia (r) anuales entre los compartimentos se utilizó la fórmula r = (-1/t) x ln(1-P), siendo P la probabilidad obtenida en las fuentes primarias y t los años sobre los que hace referencia P. Para el modelo probabilístico, por convención, las probabilidades siguieron una distribución de tipo beta; los riesgos, distribuciones log-normal y el coste del vial y de la atención a sus efectos adversos siguieron una distribución uniforme entre los límites del intervalo señalado en el Anexo III. Se desarrolló una simulación de 2º grado de Montecarlo, generando un total de 5.000 ensayos. Todos los análisis se ejecutaron sobre una hoja de cálculo Microsoft Excel, versión 2016 MSO (Microsoft, Redmond, WA). La simulación de Montecarlo se realizó con el complemento estadístico para Excel XLSTAT Premium, versión 2022.2.1 (Addinsoft, New York, NY) 21.
Anexo III. Parámetros no fijos en el modelo probabilístico y funciones que los gobiernan.
Medida de la efectividad.
Se compararon los años de vida ganados (AVG) y los AVAC en el modelo con la vacunación con respecto al modelo sin ella. La tasa de descuento aplicada fue del 3,5% 22. El multiplicador para la pérdida de calidad de vida por la EUP se obtuvo de una revisión sistemática sobre los costes y el impacto de los síntomas en pacientes adultos con úlcera duodenal y gastritis crónica del año 2010, que resultó un 89% 23. Como los intentos de erradicación se llevan a cabo principalmente en pacientes con molestias digestivas y/o abdominales, se penalizó también la calidad de vida de los pacientes que se someten a este tratamiento por el mismo factor que para los pacientes con EUP. Para el linfoma MALT, a falta de estudios específicos, se empleó el mismo factor que para el adenocarcinoma gástrico, equivalente al asumido por Rupnow et al.: 50% 6.
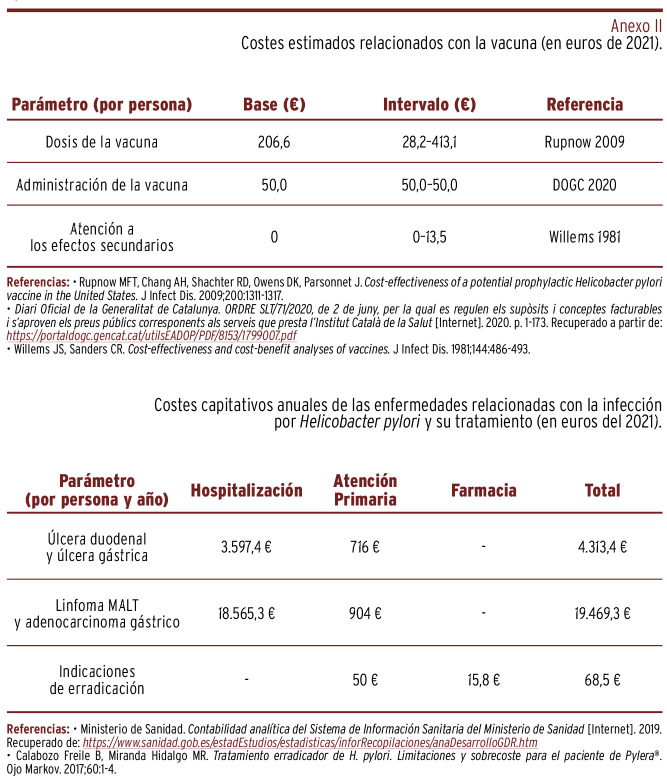
Costes relacionados con la vacuna y las enfermedades producidas por HP. Para determinar el coste capitativo de la vacunación se tuvieron en cuenta las estimaciones del coste teórico del producto farmacéutico, de su administración (equivalente a una visita a Atención Primaria) y de la atención a los efectos secundarios 6, 24, 25. Se consideró todo el intervalo de precios posibles, tomando como base la mitad del límite alto del ancho de valores. Se asumió que serían necesarias tres dosis adicionales de refuerzo y que todos los pacientes recibirían la pauta completa.
Para obtener el coste anual por paciente de la EUP y las neoplasias asociadas al HP se consultaron los datos de 2019 del Sistema de Información del Ministerio de Sanidad español 26 . Se emplearon los costes medios ambulatorios y hospitalarios sin considerar los niveles de gravedad. Además, se contempló el coste de los intentos de erradicación. Para simplificar su estimación se calculó como el coste de una visita a Atención Primaria más el coste del tratamiento más aceptado de primera línea, asumiendo una aportación del paciente del 40% (el 60% de los pacientes aportaron el 40% o el 50%) 27 .
Todos los costes se expresaron en euros de 2021 y se pueden consultar en el Anexo II. Se aplicó la misma tasa de descuento que para los efectos futuros.
Anexo II. Costes estimados relacionados con la vacuna (en euros de 2021).
Estimación del coste-efectividad.
Se calculó la RCEI para un horizonte temporal de ochenta y cuatro años de vida, que es la esperanza de vida al nacer del Estado español del año 2019, antes de la pandemia por SARS-CoV-2. Solo se tuvieron en cuenta los costes sanitarios directos.
De acuerdo con el análisis de Vallejo-Torres et al. de 2018, el umbral de disposición a pagar se fijó en 24.506 €/AVAC 28 .
Para llevar a cabo el estudio de la sensibilidad univariante, se comprobó por iteraciones a partir de qué valores de precio por dosis vacunal, y efectividad de la misma, cambiaba la RCEI de cuadrante de Drummond. Finalmente, la contribución individual de los parámetros no fijos listados en el Anexo III se representó con un gráfico de tornado.
Anexo I. Parámetros de transición entre estados patológicos del modelo.
RESULTADOS
Modelo determinístico.
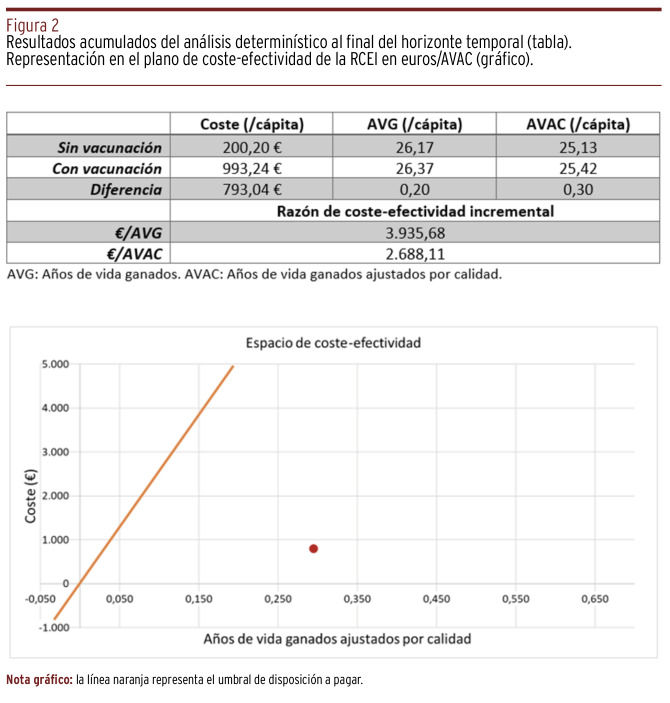
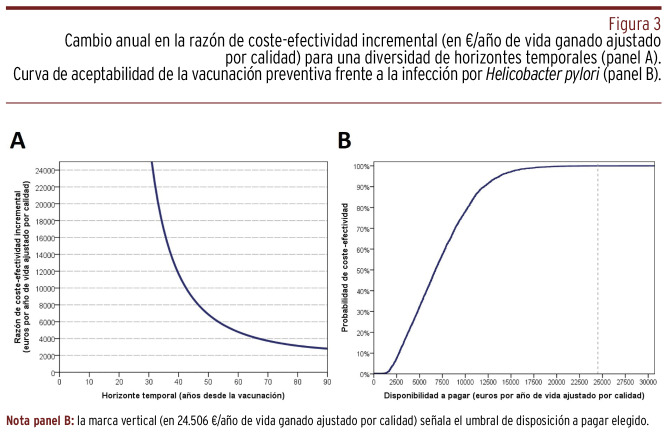
Los resultados acumulados del modelo determinístico tras ochenta y cuatro ciclos anuales se resumen en la Figura 2. Aunque cada AVAC costaría 2.688,11 €, el modelo predice una ganancia de solo 0,30 AVAC a los ochenta y cuatro años tras un plan de vacunación preventiva en el primer año de vida. Ni tan siquiera prolongando el horizonte temporal hasta los cien años, en ningún momento la opción de vacunación frente al HP sería dominante. Para que la RCEI disminuya por debajo del umbral de disposición a pagar, habría que esperar a los treinta años desde la vacunación [Panel A, Figura 3].
Figura 2. Resultados acumulados del análisis determinístico al final del horizonte temporal (tabla). Representación en el plano de coste-efectividad de la RCEI en euros/AVAC (gráfico).
Figura 3. Cambio anual en la razón de coste-efectividad incremental (en €/año de vida ganado ajustado por calidad) para una diversidad de horizontes temporales (panel A). Curva de aceptabilidad de la vacunación preventiva frente a la infección por Helicobacter pylori (panel B).
Modelo probabilístico.
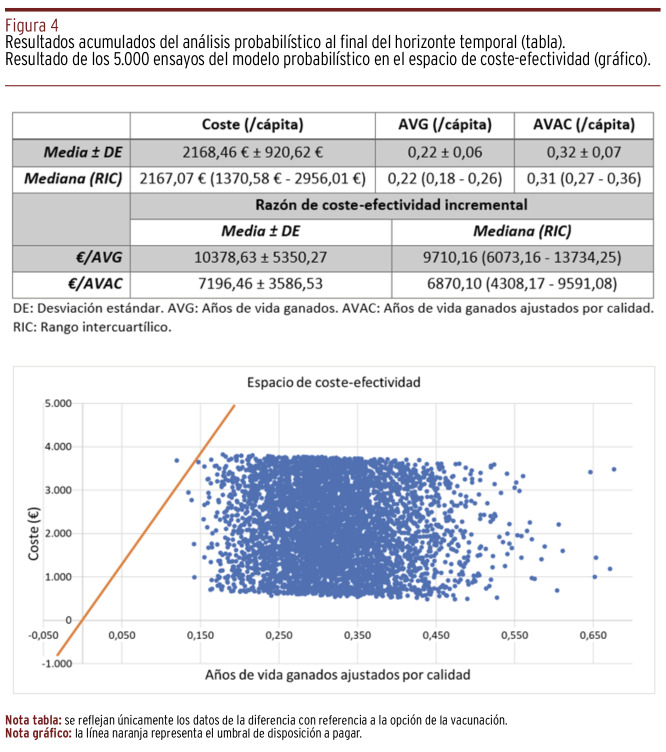
Las medidas de tendencia central y de dispersión de los resultados del análisis probabilístico se muestran en la Figura 4. La divergencia respecto al resultado del modelo determinístico reflejó la magnitud de la variabilidad de los parámetros no fijos, especialmente del precio de la vacuna. En efecto, dado que es la variable sobre la que se disponen de menos referencias robustas, se establecieron unos límites asimétricos, de una distribución de equiprobabilidad, a ambos lados del valor fijado en el análisis determinístico. Solo un 0,04% de las simulaciones quedaron por encima del umbral de disposición a pagar y, en consecuencia, representaron escenarios de no coste-efectividad. Con un umbral en 30.000 €/AVAC, la probabilidad de coste-efectividad fue del 100% [Panel B, Figura 3]. En ninguna simulación, tras ochenta y cuatro ciclos anuales, la vacunación resultó dominante.
Figura 4. Resultados acumulados del análisis probabilístico al final del horizonte temporal (tabla). Resultado de los 5.000 ensayos del modelo probabilístico en el espacio de coste-efectividad (gráfico).
Análisis de sensibilidad.
Para que el plan de vacunación sea dominante, el precio por vial debería de ser de 17 €. Esta medida queda por debajo del intervalo de precios razonable estimado por expertos 6 . Por otro lado, para que la vacunación dejara de ser coste-efectiva atendiendo al umbral de disposición a pagar elegido, el precio por vial debería de superar los 3.631 €.
Por lo que respecta a la efectividad vacunal, si esta fuera del 100% (bloqueo completo de la posibilidad de infección y cobertura vacunal de la totalidad de la población), la RCEI descendería a 2.042 €/AVAC y se obtendrían 0,41 AVAC/persona adicionales sobre la alternativa de no vacunación. Incluso con una combinación de efectividad y cobertura que protegiera efectivamente al 11% de la población, la vacunación sería coste-efectiva, aunque se conseguirían tan solo 0,04 AVAC/persona.
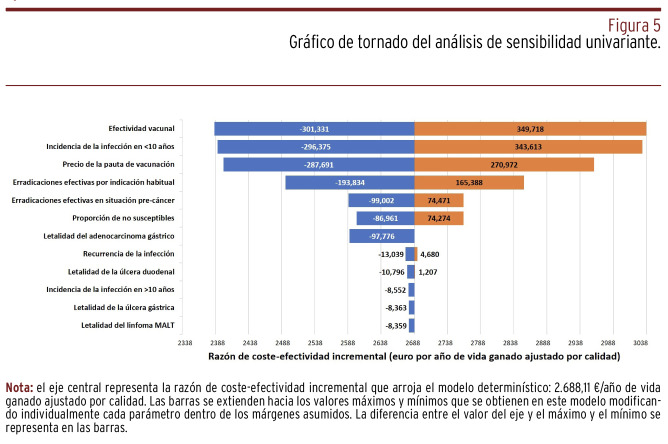
Figura 5. Gráfico de tornado del análisis de sensibilidad univariante.
Tal como queda reflejado en el gráfico de tornado [Figura 5], la máxima contribución a la variabilidad de la RCEI correspondió a la efectividad vacunal (ancho de estimaciones de RCEI de 651 €/AVAC), la incidencia de la infección en menores de diez años (ancho de 640 €/AVAC) y el precio de la pauta de vacunación (ancho de 559 €/AVAC).
DISCUSIÓN
Se obtiene en este trabajo una RCEI determinística más favorable que la comunicada para los Estados Unidos (2009), que se sitúa en 3.871 dólares/AVAC a los setenta y cinco años 6 . El detalle metodológico que más fácilmente explica esta diferencia es la incorporación al análisis de la previsible capacidad de la vacuna de proteger frente a la EUP. Los mismos autores reconocen que su modelización no lo contempla y lo justifican en la dificultad de considerar todos los tratamientos erradicadores disponibles. Se podría añadir que otra fuente de dificultad es que las indicaciones de erradicación son mucho más restrictivas en la infancia que en la edad adulta, con lo que las asunciones deberían de variar dinámicamente a medida que se ejecutan los ciclos del modelo 4 . Sin embargo, esto afectaría sobre todo a las EUP que aparecieran en los primeros años de las simulaciones, que representan una fracción despreciable del total de casos incidentes. Para compensar la dificultad en las decisiones sobre la frecuencia, costes y efectividad de la erradicación con antibióticos, las estimaciones se realizaron conservadoramente. El análisis de sensibilidad revela, además, que la contribución individual del éxito de las erradicaciones queda significativamente por detrás de algunas otras variables más influyentes, como la incidencia de la infección, el coste de la vacuna y su efectividad.
La incidencia de la infección por HP también es sensiblemente más elevada en el sur de Europa que en Norteamérica. En efecto, en Estados Unidos se informa de una tendencia a la baja muy consolidada que permitiría que una intervención de solo diez años fuera equiparable a la de un programa de vacunación continuo de setenta y cinco años 7 . Presumiblemente, en el sur de Europa se está todavía lejos de ese escenario, con lo que las ventajas de una vacunación preventiva sistemática deberían de ser superiores. En efecto, aunque el impacto económico y en la calidad de vida de las enfermedades asociadas a la infección por HP son inferiores a los de poblaciones asiáticas, algo más de la mitad de la población sureuropea está colonizada por el microorganismo 1 , 23 , 29 . Esto hace que las ventajas potenciales directas de una posible vacunación sean de un impacto considerable, al recaer principalmente sobre más de la mitad de la primera generación de vacunados.
Sobre el coste de la vacuna, se tienen en cuenta las mismas premisas y asunciones que en Rupnow et al. (2009) 6 . Consideran los precios por vial de una teórica vacuna intramuscular y los costes derivados de la atención a los efectos secundarios. Con el objetivo de minimizar el error de infraestimar el coste de la intervención, se contempla como más probable un precio superior al del estudio norteamericano, que se equipara arbitrariamente a la mitad del límite alto del ancho de valores factibles. Además, también se asume que la pauta completa debería de incorporar una dosis de recuerdo, basada en: 1) los resultados preclínicos que informan de pérdidas de efectividad a medio plazo en modelos animales; y 2) caídas relativas del 23,6% de efectividad, del primer al segundo año tras la vacunación, en el único ensayo clínico publicado hasta la fecha 15 , 30 .
En línea con lo anterior, los datos de efectividad del caso base se construyen con la información aportada por este mismo estudio en humanos con una vacuna oral frente al HP. Zeng et al. demuestran una efectividad del 71,8% en la prevención de la colonización al año de la intervención, que cae al 55,8% a los tres años 15 . Se constata como el coste por AVAC permanece dentro de los límites eficientes del espacio de coste-efectividad, incluso con efectividades vacunales como las del final del seguimiento de este ensayo. Al mismo tiempo, el análisis de sensibilidad demuestra que la incidencia de la infección en la primera infancia contribuye de forma notable a explicar la variabilidad de la RCEI. Sumado a la influencia de la efectividad vacunal (que también destaca en el análisis de sensibilidad e impactaría directamente sobre la transmisión infantil de la bacteria), pone de relieve la bondad potencial de la vacunación y sugiere que la mejoría de la coste-efectividad en el tiempo podría ser mayor que lo predicho por el modelo.
Presumiblemente, las estimaciones de RCEI de este estudio serían incluso más ajustadas a la realidad que las ofrecidas por estudios previos, como consecuencia de haber incluido otras fuentes de costes y más condiciones clínicas asociadas a la colonización con impacto en la calidad de vida. Además, hasta donde se pudo comprobar, se trata del primer estudio en emplear datos locales para este fin.
Evaluar en un futuro ensayo clínico si una vacuna frente al HP hace disminuir la incidencia de cáncer gástrico sería complicado por la latencia temporal entre los fenómenos de infección y oncogénesis. Sin embargo, la alternativa de estudiar variables respuesta subrogadas, como el porcentaje de infectados, podría ser correcta y suficiente dada la exactitud y sencillez de los métodos de los que se dispone a día de hoy para estudiar la colonización. Por su parte, comprobar los cambios epidemiológicos que generaría una vacunación sistemática debería de ser objeto de estudios ecológicos o de grandes series temporales futuras.
Cabe señalar como principales limitaciones de este estudio que la complejidad de la historia natural de la infección por HP queda excesivamente simplificada en el modelo, con el consiguiente riesgo de sesgo. Además, no se incorporó la perspectiva social al trabajo, lo que hubiera reflejado mejor la eficiencia real de la vacuna. Por otra parte, sería esperable que, por efecto de la vacunación, algunos parámetros de transmisión deberían de cambiar a medida que se ejecutan ciclos del modelo. Presumiblemente, como se ha mencionado antes, estos defectos conducen a que el coste-efectividad hallado puede estar infraestimando la real, con lo que una vacunación para el HP pudiera ser incluso más interesante.
En países desarrollados se ha informado de que estar colonizado por HP podría ofrecer protección frente a la enfermedad por reflujo gastroesofágico, la esofagitis eosinofílica y el adenocarcinoma esofágico. En países en vías de desarrollo, HP podría beneficiar a los niños, potenciando la inmunidad celular y evitando así una variedad de condiciones basadas en un desarreglo inmune por falta de estimulación 13 . Actualmente, no existen pruebas fehacientes de este comportamiento protector y la idea, aunque bien fundamentada, continúa siendo hipotética. Si bien lo correcto, dada la falta de evidencia firme, puede haber sido no haberla considerado en un primer análisis exploratorio como este, sería prudente tenerla en cuenta en el futuro. Con todo, sería inapropiado dejar de mencionar las posibles externalidades negativas, difíciles de prever, de proteger frente a una bacteria que ha convivido con el ser humano desde, como mínimo, la época de las grandes migraciones 14 .
A modo de conclusión, señalar que vacunar durante la infancia con el objetivo de prevenir la infección por HP sería coste-efectivo desde la perspectiva del proveedor de servicios de salud en un contexto similar al que comparten una diversidad de países del sur de Europa. Para ello, la vacunación debería de presentar efectividades moderadas, tener un precio dentro de los supuestos asumidos y debería poderse esperar treinta años para obtener la eficiencia buscada.
BIBLIOGRAFÍA
- 1.Hooi JKY, Lai WY, Ng WK et al. Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology. 2017;153:420-429 [DOI] [PubMed]; Hooi JKY, Lai WY, Ng WK. Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology. 2017;153:420–429. doi: 10.1053/j.gastro.2017.04.022. [DOI] [PubMed] [Google Scholar]
- 2.Malfertheiner P, Megraud F, O’Morain CA et al. Management of Helicobacter pylori infection-the Maastricht IV/Florence Consensus Report. Gut. 2012;61:646-664. [DOI] [PubMed]; Malfertheiner P, Megraud F, O’Morain CA. Management of Helicobacter pylori infection-the Maastricht IV/Florence Consensus Report. Gut. 2012;61:646–664. doi: 10.1136/gutjnl-2012-302084. [DOI] [PubMed] [Google Scholar]
- 3.Pan K, Zhang L, Gerhard M et al. A large randomised controlled intervention trial to prevent gastric cancer by eradication of Helicobacter pylori in Linqu County, China: baseline results and factors affecting the eradication. Gut. 2016;65:9-18. [DOI] [PubMed]; Pan K, Zhang L, Gerhard M. A large randomised controlled intervention trial to prevent gastric cancer by eradication of Helicobacter pylori in Linqu County, China: baseline results and factors affecting the eradication. Gut. 2016;65:9–18. doi: 10.1136/gutjnl-2015-309197. [DOI] [PubMed] [Google Scholar]
- 4.Jones NL, Koletzko S, Goodman K et al. Joint ESPGHAN/NASPGHAN Guidelines for the Management of Helicobacter pylori in Children and Adolescents (Update 2016). J Pediatr Gastroenterol Nutr. 2017;64:991-1003. [DOI] [PubMed]; Jones NL, Koletzko S, Goodman K. Joint ESPGHAN/NASPGHAN Guidelines for the Management of Helicobacter pylori in Children and Adolescents (Update 2016). J Pediatr Gastroenterol Nutr. 2017;64:991–1003. doi: 10.1097/MPG.0000000000001594. [DOI] [PubMed] [Google Scholar]
- 5.Sutton P, Boag JM. Status of vaccine research and development for Helicobacter pylori. Vaccine. 2019;37:7295-7299. [DOI] [PMC free article] [PubMed]; Sutton NL, Boag S. Status of vaccine research and development for Helicobacter pylori. Vaccine. 2019;37:7295–7299. doi: 10.1016/j.vaccine.2018.01.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Rupnow MFT, Chang AH, Shachter RD et al. Cost-effectiveness of a potential prophylactic Helicobacter pylori vaccine in the United States. J Infect Dis. 2009;200:1311-1317. [DOI] [PubMed]; Rupnow MFT, Chang AH, Shachter RD. Cost-effectiveness of a potential prophylactic Helicobacter pylori vaccine in the United States. J Infect Dis. 2009;200:1311–1317. doi: 10.1086/605845. [DOI] [PubMed] [Google Scholar]
- 7.Rupnow MF, Shachter RD, Owens DK et al. A dynamic transmission model for predicting trends in Helicobacter pylori and associated diseases in the United States. Emerg Infect Dis. 2000;6:228-237. [DOI] [PMC free article] [PubMed]; Rupnow MF, Shachter RD, Owens DK. A dynamic transmission model for predicting trends in Helicobacter pylori and associated diseases in the United States. Emerg Infect Dis. 2000;6:228–237. doi: 10.3201/eid0603.000302. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Rupnow MF, Shachter RD, Owens DK et al. Quantifying the population impact of a prophylactic Helicobacter pylori vaccine. Vaccine. 2001;20:879-885. [DOI] [PubMed]; Rupnow MF, Shachter RD, Owens DK. Quantifying the population impact of a prophylactic Helicobacter pylori vaccine. Vaccine. 2001;20:879–885. doi: 10.1016/s0264-410x(01)00401-7. [DOI] [PubMed] [Google Scholar]
- 9.Rupnow MF, Owens DK, Shachter R et al. Helicobacter pylori vaccine development and use: a cost-effectiveness analysis using the Institute of Medicine Methodology. Helicobacter. 1999;4:272-280. [DOI] [PubMed]; Rupnow MF, Owens DK, Shachter R. Helicobacter pylori vaccine development and use: a cost-effectiveness analysis using the Institute of Medicine Methodology. Helicobacter. 1999;4:272–280. doi: 10.1046/j.1523-5378.1999.99311.x. [DOI] [PubMed] [Google Scholar]
- 10.Yuan C, Adeloye D, Luk TT et al. The global prevalence of and factors associated with Helicobacter pylori infection in children: a systematic review and meta-analysis. Lancet Child Adolesc Heal. 2022;6:185-194. [DOI] [PubMed]; Yuan C, Adeloye D, Luk TT. The global prevalence of and factors associated with Helicobacter pylori infection in children: a systematic review and meta-analysis. Lancet Child Adolesc Heal. 2022;6:185–194. doi: 10.1016/S2352-4642(21)00400-4. [DOI] [PubMed] [Google Scholar]
- 11.Sung JJY, Kuipers EJ, El-Serag HB. Systematic review: the global incidence and prevalence of peptic ulcer disease. Aliment Pharmacol Ther. 2009;29:938-946. [DOI] [PubMed]; Sung JJY, Kuipers EJ, El-Serag HB. Systematic review: the global incidence and prevalence of peptic ulcer disease. Aliment Pharmacol Ther. 2009;29:938–946. doi: 10.1111/j.1365-2036.2009.03960.x. [DOI] [PubMed] [Google Scholar]
- 12.Rawla P, Barsouk A. Epidemiology of gastric cancer: global trends, risk factors and prevention. Prz Gastroenterol. 2019;14:26-38. [DOI] [PMC free article] [PubMed]; Rawla P, Barsouk A. Epidemiology of gastric cancer: global trends, risk factors and prevention. Prz Gastroenterol. 2019;14:26–38. doi: 10.5114/pg.2018.80001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Suerbaum S, Michetti P. Helicobacter pylori infection. N Engl J Med. 2002;347:1175-1186. [DOI] [PubMed]; Suerbaum S, Michetti P. Helicobacter pylori infection. N Engl J Med. 2002;347:1175–1186. doi: 10.1056/NEJMra020542. [DOI] [PubMed] [Google Scholar]
- 14.Go MF. Review article: natural history and epidemiology of Helicobacter pylori infection. Aliment Pharmacol Ther. 2002;16 Suppl 1:3-15. [DOI] [PubMed]; Go MF. Review article: natural history and epidemiology of Helicobacter pylori infection. Aliment Pharmacol Ther. 2002;16(Suppl 1):3–15. doi: 10.1046/j.1365-2036.2002.0160s1003.x. [DOI] [PubMed] [Google Scholar]
- 15.Zeng M, Mao X-H, Li J-X et al. Efficacy, safety, and immunogenicity of an oral recombinant Helicobacter pylori vaccine in children in China: a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet (London, England). 2015;386:1457-1464. [DOI] [PubMed]; Zeng M, Mao X-H, Li J-X. Efficacy, safety, and immunogenicity of an oral recombinant Helicobacter pylori vaccine in children in China: a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2015;386:1457–1464. doi: 10.1016/S0140-6736(15)60310-5. [DOI] [PubMed] [Google Scholar]
- 16.Choi IJ, Kim CG, Lee JY et al. Family History of Gastric Cancer and Helicobacter pylori Treatment. N Engl J Med. 2020;382:427-436. [DOI] [PubMed]; Choi IJ, Kim CG, Lee JY. Family History of Gastric Cancer and Helicobacter pylori Treatment. N Engl J Med. 2020;382:427–436. doi: 10.1056/NEJMoa1909666. [DOI] [PubMed] [Google Scholar]
- 17.Gómez Rodríguez BJ, Rojas Feria M, García Montes MJ et al. Incidence and factors influencing on Helicobacter pylori infection recurrence. Rev Esp Enferm Dig. 2004;96:620-3; 424-427. [DOI] [PubMed]; Gómez Rodríguez BJ, Rojas Feria M, García Montes MJ. Incidence and factors influencing on Helicobacter pylori infection recurrence. Rev Esp Enferm Dig. 2004;96(620-3):424–427. doi: 10.4321/s1130-01082004000900005. [DOI] [PubMed] [Google Scholar]
- 18.Parsonnet J. The incidence of Helicobacter pylori infection. Aliment Pharmacol Ther. 1995;9 Suppl 2:45-51. [PubMed]; Parsonnet J. The incidence of Helicobacter pylori infection. Aliment Pharmacol Ther. 1995;9(Suppl 2):45–51. [PubMed] [Google Scholar]
- 19.Instituto Nacional de Estadística. Tablas de mortalidad por año, sexo, edad y funciones. Series desde 1991. Disponible en: https://www.ine.es/jaxiT3/Datos.htm?t=27153 [consultado agosto 2023].; Instituto Nacional de Estadística https://www.ine.es/jaxiT3/Datos.htm?t=27153 .
- 20.Sociedad Española de Oncología Médica. Las cifras del cáncer en España 2021. Disponible en: https://seom.org/images/Cifras_del_cancer_en_Espnaha_2021.pdf [consultado agosto 2023].; Sociedad Española de Oncología Médica https://seom.org/images/Cifras_del_cancer_en_Espnaha_2021.pdf .
- 21.XLSTAT statistical and data analysis solution [programa de ordenador]. Versión 2022.2.1. New York, USA: Addinsoft; 2022.; New York: Addinsoft; 2022. [Google Scholar]
- 22.Lipscomb J, Weinstein M, Torrance G. Time preference. En: Gold M, Siegel J, Russel L, Weinstein M, editores. Cost-effectiveness in health and medicine. New York: Oxford University Press; 1996. p. 214-216.; Lipscomb J, Weinstein M, Torrance G. Cost-effectiveness in health and medicine. New York: Oxford University Press; 1996. [Google Scholar]
- 23.Barkun A, Leontiadis G. Systematic review of the symptom burden, quality of life impairment and costs associated with peptic ulcer disease. Am J Med. 2010;123:358-366.e2. [DOI] [PubMed]; Barkun A, Leontiadis G. Systematic review of the symptom burden, quality of life impairment and costs associated with peptic ulcer disease. Am J Med. 2010;123:358–366. doi: 10.1016/j.amjmed.2009.09.031. [DOI] [PubMed] [Google Scholar]
- 24.Willems JS, Sanders CR. Cost-effectiveness and cost-benefit analyses of vaccines. J Infect Dis. 1981;144:486-493. [DOI] [PubMed]; Willems JS, Sanders CR. Cost-effectiveness and cost-benefit analyses of vaccines. J Infect Dis. 1981;144:486–493. doi: 10.1093/infdis/144.5.486. [DOI] [PubMed] [Google Scholar]
- 25.Diari Oficial de la Generalitat de Catalunya. ORDRE SLT/71/2020, de 2 de juny, per la qual es regulen els supòsits i conceptes facturables i es aproven els preus públics corresponents als serveis que presta l’Institut Català de la Salut. 2020. p. 1-173. Disponible en: https://portaldogc.gencat.cat/utilsEADOP/PDF/8153/1799007.pdf [consultado agosto 2023].; Diari Oficial de la Generalitat de Catalunya. 2020 https://portaldogc.gencat.cat/utilsEADOP/PDF/8153/1799007.pdf .
- 26.Ministerio de Sanidad. Contabilidad analítica del Sistema de Información Sanitaria del Ministerio de Sanidad. 2019. Disponible en: https://www.sanidad.gob.es/estadEstudios/estadisticas/inforRecopilaciones/anaDesarrolloGDR.htm [consultado agosto 2022].; Ministerio de Sanidad Ministerio de Sanidad. 2019 https://www.sanidad.gob.es/estadEstudios/estadisticas/inforRecopilaciones/anaDesarrolloGDR.htm .
- 27.Calabozo Freile B, Miranda Hidalgo MR. Tratamiento erradicador de H. pylori. Limitaciones y sobrecoste para el paciente de Pylera®. Ojo Markov. 2017;60:1-4.; Calabozo Freile B, Miranda Hidalgo MR. Tratamiento erradicador de H. pylori. Limitaciones y sobrecoste para el paciente de Pylera®. Ojo Markov. 2017;60:1–4. [Google Scholar]
- 28.Vallejo-Torres L, García-Lorenzo B, Serrano-Aguilar P. Estimating a cost-effectiveness threshold for the Spanish NHS. Health Econ. 2018;27:746-761. [DOI] [PubMed]; Vallejo-Torres L, García-Lorenzo B, Serrano-Aguilar P. Estimating a cost-effectiveness threshold for the Spanish NHS. Health Econ. 2018;27:746–761. doi: 10.1002/hec.3633. [DOI] [PubMed] [Google Scholar]
- 29.Plummer M, Franceschi S, Vignat J et al. Global burden of gastric cancer attributable to Helicobacter pylori. Int J cancer. 2015;136:487-490. [DOI] [PubMed]; Plummer M, Franceschi S, Vignat J. Global burden of gastric cancer attributable to Helicobacter pylori. Int J cancer. 2015;136:487–490. doi: 10.1002/ijc.28999. [DOI] [PubMed] [Google Scholar]
- 30.Tobias J, Lebens M, Wai SN et al. Surface expression of Helicobacter pylori HpaA adhesion antigen on Vibrio cholerae, enhanced by co-expressed enterotoxigenic Escherichia coli fimbrial antigens. Microb Pathog. 2017;105:177-184. [DOI] [PubMed]; Tobias J, Lebens M, Wai SN. Surface expression of Helicobacter pylori HpaA adhesion antigen on Vibrio cholerae, enhanced by co-expressed enterotoxigenic Escherichia coli fimbrial antigens. Microb Pathog. 2017;105:177–184. doi: 10.1016/j.micpath.2017.02.021. [DOI] [PubMed] [Google Scholar]