Abstract
Objetivos
Analizar la precisión diagnóstica de la nueva prueba MeMed® para predecir infección bacteriana en los pacientes adultos atendidos con sospecha clínica de infección en el servicio de urgencias hospitalario (SUH), así como comparar su rendimiento con otros biomarcadores de uso habitual (proteína C reactiva-PCR-, procalcitonina -PCT-).
Métodos
Estudio observacional, de cohortes, prospectivo y analítico de pacientes adultos atendidos en un SUH con el diagnóstico clínico de un proceso infeccioso. Se realizó un seguimiento durante 30 días. Como variable dependiente se consideró el diagnóstico de infección bacteriana (IB). Se analizó la capacidad predictiva con el área bajo la curva (ABC) de la característica operativa del receptor (COR) y los valores de sensibilidad (Se), especificidad (Es), valor predictivo positivo (VPP) y negativo (VPN) de la PCR, PCT, recuento de leucocitos y el test LIAISON® MeMed®.
Resultados
Se incluyó a 258 pacientes, de los que 36 (14%) habían fallecido a los 30 días tras su consulta en el SUH. La edad media fue 68,28 (DE 19,53) años, el 57,4% (148) eran hombres. A los 30 días el grupo con el diagnóstico IB tenía 137 pacientes, el grupo infección viral 68 casos y 17 en el grupo indeterminado. El ABC-COR que consigue MeMed® en el grupo que analiza todos los pacientes es de 0,920 (IC 95%: 0,877-0,962) y la PCT de 0,811 (IC 95%: 0,754-0,867). Con un punto de corte (PC) > 65 puntos del test MeMed® se obtiene una Se:79,2% y Es:91,2% y con PC > 90 puntos una Se: 57% y Es:95,9%. Aplicando el índice de Youden el PC > 50 puntos consigue una Se:84,1% y Es:88,2%.
Conclusiones
En los pacientes adultos atendidos con sospecha clínica de infección en el SUH, la prueba de LIAISON MeMed® presenta una gran capacidad para diagnosticar su origen bacteriano y obtiene un mejor rendimiento que la PCT, la PCR y el recuento de leucocitos.
Keywords: Biomarcadores, Servicio de Urgencias, Diagnóstico, Infección bacteriana
Abstract
Objectives
To analyze the diagnostic accuracy of the new MeMed® test to predict bacterial infection in adult patients seen in emergency departments (ED) with clinical suspicion of infection, as well as to compare its performance with other commonly used biomarkers (protein C reactive-PCR-, procalcitonin -PCT-).
Methods
A prospective, observational and analytical study was carried out on adult patients who were treated in an ED with the clinical diagnosis of an infectious process. Follow-up was carried out for 30 days. The diagnosis of bacterial infection (BI) was considered as the dependent variable. The predictive ability was analyzed with the area under the curve (AUC) of the receiver operating characteristic (COR) and the values of sensitivity (Se), specificity (Es), positive predictive value (PPV) and negative predictive value (NPV) of the PCR, PCT, leukocyte count and the LIAISON® MeMed® test.
Results
The study included 258 patients, 54 (15.6%) of whom died within 30 days of visiting the ED. The mean age was 68.28 (SD 19.53) years, 57.4% (148) were men. At 30 days, the group with the IB diagnosis had 137 patients, the viral infection group 68 cases and 17 in the indeterminate group. The AUC-COR achieved by MeMed® in the group that analyzes all patients was 0.920 (95% CI: 0.877-0.962) and the PCT was 0.811 (95% CI: 0.754-0.867). With a cut-off point (PC) > 65 points of the MeMed® test, achieves a Se: 79.2% and Es: 91.2% and with PC > 90 points a Se: 57% and Es: 95.9%. Applying the Youden index, the PC > 50 points achieves Se:84.1% and Es:88.2%.
Conclusions
In adult patients treated with clinical suspicion of infection in the ED, the LIAISON MeMed® test has a great ability to diagnose its bacterial origin and achieves better performance than PCT, PCR and leukocyte count.
Keywords: Biomarkers, Emergency Department, Diagnostic, Bacterial Infection
INTRODUCCIÓN
La presencia de pacientes con sospecha de un proceso infeccioso en los servicios de urgencias hospitalarios (SUH) se ha incrementado significativamente en los últimos años, hasta suponer estos entre un 15%-20% de todos los atendidos diariamente en estas áreas asistenciales en España [1,2]. Asimismo, la gravedad de su presentación clínica y la mortalidad tanto intrahospitalaria como a corto plazo (30 días), también han aumentado en los últimos años, especialmente en los pacientes que cumplen criterios de sepsis, presentan comorbilidades relevantes, inmunodeprimidos, ancianos o con bacteriemia significativa confirmada desde el SUH [3,4].
En este escenario, la administración precoz y adecuada del tratamiento antibiótico (AB), junto con el control y drenaje del foco de infección, así como la toma inmediata de otras decisiones diagnóstico-terapéuticas (como solicitar pruebas complementarias, obtener hemocultivos y otras muestras microbiológicas, la intensidad del soporte hemodinámico, o la necesidad de ingreso, entre otras), repercuten directamente en la supervivencia de los enfermos con infección bacteriana grave [1,2,5,6].
Por otro lado, es conocido que las manifestaciones clínicas de los procesos infecciosos son a menudo inespecíficas y variables, lo que dificulta el reconocimiento precoz de estos enfermos y de su posible etiología bacteriana o viral [1,2]. Todo ello favorece que se prescriban AB innecesarios sin la certeza de que el cuadro tenga un origen infeccioso bacteriano, sobre todo en aquellos pacientes con síndrome febril de origen desconocido en el SUH (en los que del 30 al 50% de las ocasiones su etiología es no infecciosa), con la consiguiente presión antibiótica y la posibilidad de aumento de las resistencias y de la virulencia bacterianas [2,7,8]. Esta realidad representa un verdadero problema, al conllevar un incremento de las pruebas diagnósticas realizadas, de la estancia hospitalaria, de los costes y de la administración en ocasiones de tratamientos anti-bióticos innecesarios o, en otros casos, de la no administración precoz [1,2,7,8].
En los últimos años, se ha acentuado la búsqueda de herramientas objetivas de ayuda para intentar predecir, desde la primera valoración del paciente con sospecha de infección grave, un diagnóstico precoz, el pronóstico, la gravedad y junto con la posible etiología bacteriana la sospecha de bacteriemia (al ser estos factores claramente determinantes del pronóstico y la mortalidad de los procesos infecciosos) [2,5,8-11]. En esta línea, los biomarcadores de respuesta inflamatoria e infección (BMRIeI) se han posicionado como herramientas de gran ayuda para el clínico a la hora de mejorar el diagnóstico y el tratamiento de la infección, ya que podrían facilitar y adelantar la toma de decisiones vitales en el SUH [2,5,8-12]. Entre todos ellos, la procalcitonina (PCT) sigue destacando como un BMRIeI sensible y específico para predecir infección bacteriana, guiar hacia el patógeno causante de la infección, así como prever su evolución clínica (hacia sepsis grave y shock séptico) y la mortalidad asociada [2,9,10,12].
Recientemente, se ha descrito la utilidad de una nueva prueba basada en la alteración de las concentraciones de distintas proteínas que se producen en la respuesta inmunológica. Este test, denominado LIAISON®MeMed®, calcula una puntuación en función de un modelo que correlaciona los resultados de tres proteínas solubles del huésped, lo que permite diferenciar entre el origen bacteriano frente al viral de la infección [13,14]. Hasta ahora, se han publicado pocos estudios que evalúen esta capacidad predictiva de infección bacteria-na de LIAISON®MeMed®, la mayoría en pacientes pediátricos [15-20], aunque también alguno en pacientes adultos [21-27]. Se trata de la primera prueba de diagnóstico que incluye una puntuación basada en la combinación de la concentración de 3 proteínas circulantes en sangre de BMRIeI inducidos tanto por virus como por bacterias [13-27]: 1.- El ligando inductor de apoptosis relacionado con el factor de necrosis tumoral (TRAIL) que se eleva como expresión de infección viral y disminuye en infección bacteriana, 2.- la proteína 10 inducida por el inter-ferón gamma (IP-10) que se incrementa en mayor medida en infecciones virales y en menor medida en bacterianas, y 3.- la proteína C reactiva (PCR) que muestra un patrón opuesto a la IP-10. De esta manera, la presencia de proteínas del huésped no relacionadas entre sí que participan en diferentes vías puede mejorar la precisión del diagnóstico. En particular, la inclusión de nuevas proteínas del huésped que están reguladas positivamente en infecciones virales puede ser un complemento innovador a las proteínas inducidas por bacterias en el uso clínico actual, como la PCR o la PCT [13-27].
El objetivo principal de este estudio es investigar la precisión diagnóstica de la prueba MeMed® para predecir infección bacteriana en los pacientes adultos atendidos con sospecha clínica de infección en el SUH, así como comparar su rendimiento con otros BMRIeI de uso habitual (PCR, PCT).
PACIENTES Y MÉTODOS
Diseño y sitio. Estudio observacional, de cohortes, pros-pectivo y analítico de pacientes adultos (con 18 o más años) atendidos en un SUH con el diagnóstico clínico de un proceso infeccioso. Se realizó un seguimiento durante 30 días y tras este periodo el diagnóstico de infección fue mantenido. El estudio fue elaborado en un hospital universitario de tercer nivel de 786 camas perteneciente al Servicio de Salud de Castilla La Mancha.
Periodos de estudio y población incluida. Desde el 1 de julio de 2023 hasta el 7 de febrero de 2024 se incluyeron mediante un muestreo por oportunidad (cuando los investigadores estuvieron de guardia) a los pacientes con 18 o más años que fueron diagnosticados clínicamente de un proceso infeccioso en el SUH y en los que, por sus características clínicas y epidemiológicas, los médicos responsables indicaron la obtención de muestras sanguíneas para realizar pruebas complementarias analíticas (hemograma, bioquímica y biomarcadores como PCR, PCT, lactato y el test LIAISON® MeMed®), así como pruebas para el diagnóstico microbiológico (hemocultivos -HC-, otros cultivos, pruebas de detección rápida, serologías, antigenuria, etc.).
Se excluyeron los pacientes de pediatría y obstetricia-ginecología.
Variables recogidas. Como variable dependiente se consideró el diagnóstico de infección bacteriana (IB). Se diseñaron varios grupos entre los pacientes en función del mantenimiento del diagnóstico de sospecha o confirmado microbiológicamente a los 30 días: 1.- Diagnóstico de IB sospechado en el SUH y confirmado microbiológicamente; 2.- Diagnóstico de infección viral (IV) sospechado en el SUH y confirmado microbiológicamente; 3.- Diagnóstico de IB sospechado en el SUH y mantenido a los 30 días pero no confirmado microbiológicamente (diagnóstico y decisión tomada por unanimidad por un grupo formado por un/a médico de urgencias, un/a de microbiología, un/a del laboratorio de análisis clínicos y un/a de medicina interna); 4.- Diagnóstico de IV sospechado en el SUH y mantenido a los 30 días pero no confirmado microbiológicamente (decisión por el grupo de seguimiento); 5.- Sospecha indeterminada (el grupo de seguimiento no consensuó una decisión).
Como variables independientes se recogieron aquellas que se consideraron interesantes y que pudieran influir en el pronóstico y evolución del paciente durante los 30 días posteriores a la visita al SUH: A.-Demográficas y epidemiológicas: edad, sexo, institucionalización, toma de AB previos, ingreso en el último mes, de comorbilidad (índice de Charson [28]). B.-Clínicas: temperatura, alteración de la consciencia definida con ≤14 puntos en la escala del coma de Glasgow, existencia de náuseas/vómitos, escalofríos/tiritona, presión arterial sistólica (PAS), criterios de sepsis y las variables que los definen según la conferencia de expertos de sepsis de 2001 [1], definición de sepsis según un qSOFA ≥2 y de shock séptico y las variables que la constituyen según la tercera conferencia de consenso de sepsis(Sepsis-3)1. C.-De evolución y destino: días desde el inicio de la clínica y estancia hospitalaria, destino de los pacientes, reconsulta-reingreso en el SUH y mortalidad en 30 días tras la atención en el SUH. D.-De laboratorio de bioquímica con la analítica habitual y determinaciones de los BM incluidos (PCR en mg/L, PCT en ng/ml, lactato sérico en mmol/L); y E.- Del Servicio de Microbiología.
Definiciones, técnicas y métodos establecidos para las muestras. El test LIAISON® MeMed® es una fórmula matemática que integra un modelo que combina las concentraciones sanguíneas de tres proteínas del sistema inmunológico y con ellas genera una puntuación final cualitativa numérica (de 0 a 100 puntos) que indica la probabilidad de una respuesta inmune bacteriana o coinfección frente a una probable respuesta inmune viral. Utiliza tecnología de inmunoensayo de electro-quimioluminiscencia ECLIA para las tres proteínas (TRAIL de 15-300 pg/ml, IP-10 de 100-2000 pg/ml y PCR 1-250 mg/ml). Inicialmente se estudió y comparó el rendimiento diagnóstico de IB en todos los pacientes de nuestra muestra y, posteriormente, de forma individual en distintos grupos con interés en los SUH (pacientes con el diagnóstico microbiológico confirmado, en los mayores de 65 años y en los diagnosticados como infección respiratoria de vías bajas -IVRB-). Además, según indicaciones del fabricante (DiaSorin) y debido a la posible respuesta inmunológica artefactada o no controlada, también se realizó la comparación eliminando a los pacientes que LIAISON® MeMed® incluye como criterios de exclusión (“grupo exclusión LIAISON-MeMed”): aquellos con sintomatología y fiebre constatada de más de 7 días, sospecha de gastroenteritis/colitis infecciosa, enfermedad inflamatoria activa, inmunodeficiencia congénita o adquirida, infección por virus de la inmunodeficiencia humana (VIH), de la hepatitis B (VHB), de la hepatitis C (VHC), tuberculosis activa, infección fúngica o parasitaria crónica, embarazadas, con neoplasia maligna activa y aquellos con traumatismos o quemaduras importantes o intervenidos de cirugía mayor en los últimos 7 días.
La interpretación de los resultados de LIAISON® MeMed® se realizó, inicialmente, según las indicaciones del fabricante y los primeros estudios publicados [13,21,22] (Tabla 1).
Tabla 1.
Interpretación de los resultados de la fórmula LIAISON® MeMed®
| Puntuación MeMed® | Interpretación |
|---|---|
| 0 a 10 | Muy alta probabilidad de IV (u otra etiología no bacteriana) |
| 11 a 34 | Probabilidad moderada de IV (u otra etiología no bacteriana) |
| 35 a 65 | Resultado dudoso en relación a la etiología (IV frente IB o coinfección) |
| 66 a 89 | Probabilidad moderada de IB (o coinfección IB-IV) |
| 90-100 | Muy alta probabilidad de IB (o coinfección IB-IV) |
IV: infección de etiología viral,IB: infección de etiología bacteriana. Adaptado de las indicaciones del fabricante y referencias 13, 21 y 22
Para los BMRIeI se adoptaron como valores de referencia los de nuestro laboratorio. Así, para la PCT por ECLIA en el equipo cobas e801 de Roche (R), medido en plasma con heparina de litio (con rango de detección de 0,02-100 ng/ml). Para el lactato amperometría en gasómetro Gem 5000 de Werfen (R) en sangre total con heparina de litio (con rango de detección de 0,3-17 mmol/l o 3-153 mg/dl). Y para la PCR por inmunoturbidimetría en cobas c702 de Roche en plasma con heparina de litio (con rango de detección 0,6-305 mg/L).
En relación con las pruebas microbiológicas realizadas, en la tabla 2 se detallan las utilizadas para la confirmación de la etiología bacteriana o viral. A todos los pacientes se les realizaron hemocultivos (por protocolo del centro al ser consideramos como pacientes con una potencial infección grave) y, además, una o varias de las pruebas microbiológicas recogidas en la tabla 2 (en función de la sospecha diagnóstica decidida por el médico de urgencias).
Tabla 2.
Pruebas microbiológicas realizadas
| Dos muestras de hemocultivos compuestas por dos frascos de cultivo (medios BD BACTEC™ Plus Aerobic y Lytic Anaerobic) incubados durante 5 días en el sistema BACTEC de Becton Dickinson. En los casos de sospecha de endocarditis se prolongó hasta 30 días. |
| PCR múltiple del sistema FilmArray® de Biomereux para la detección de bacterias, virus, levaduras y parásitos mediante diferentes paneles sindrómicos. |
| Estudio bacteriológico aerobio/anaerobio y fúngico de muestras del tracto respiratorio superior e inferior con un periodo de incubación entre 3-5 días. |
| Antigenuria de S. pneumoniaey L. pneumophila(serogrupo 1) en muestras de orina mediante inmunocromatografía de flujo lateral ImmuView® de SSI Diagnostica. |
| Detección de virus respiratorios (SARS-CoV-2, influenza A, influenza B y virus respiratorio sincitial) en muestras de exudado nasofaríngeo mediante los sistemas de PCR en tiempo real LIAISON MDX de Diasorin, GeneXpert de Cepheid y Vircell en el equipo Equipo CFX96 de Werfen. |
| Serología para la detección de patógenos implicados en infección respiratoria. Detección de clase IgG/IgM mediante técnica de inmunoanálisis quimioluminiscente en equipo Virclia (Vircell). |
| Estudio bacteriológico aerobio y fúngico en muestras de orina con periodo de incubación entre 24-48 horas. |
| Estudio bacteriológico aerobio/anaerobio y fúngico de muestras de piel y partes blandas, líquidos estériles y otros exudados con periodo de incubación entre 3-5 días. |
| Estudio bacteriológico de muestras del tracto gastrointestinal con un periodo de incubación entre 2-5 días. |
| La identificación de los microorganismos en los estudios bacteriológicos se realizó mediante espectrometría de masas MALDI-TOF de BrukerDaltonics. |
| Detección de antígeno GDH de Clostridioides difficile en muestras de heces mediante inmunoensayo enzimático cualitativo Immunocard® C. difficile GDH de Meridian Bioscience y confirmación de cepas toxigénicas mediante método LAMP en el sistema Illumipro-10™ de Meridian Bioscience. |
| Determinación de marcadores relacionados con otras infecciones víricas (virus de hepatitis, VIH) mediante técnica de inmunoanálisis quimioluminiscente en equipo Alinity (Abbott). |
| Detección de micobacterias: Tinción de Ziehl-Neelsen y cultivo en medio de cultivo líquido MGIT (Beckton Dickinson) con incubación en sistema MGIT960 (Becton Dickinson®)durante 40 días y medio sólido Lowenstein con un periodo de incubación de 60 días. La identificación de las micobacterias se realizó mediante espectrometría de masas MALDI-TOF de BrukerDaltonics. PCR de Mycobacterium tuberculosis mediante sistema GeneXpert de Cepheid en muestra directa. |
La extracción de los hemocultivos (HC) se realizó por la técnica estándar por venopunción cutánea. En cada paciente se realizaron dos extracciones separadas entre sí en el tiempo (y asegurando que los sitios de venopunción eran diferentes). La técnica de extracción, el tiempo de inoculación y las definiciones de bacteriemia verdadera y hemocultivos contaminados fueron las mismas que las utilizadas en un reciente estudio del grupo INFURG-SEMES [29].
Análisis estadístico. Para el análisis de la asociación entre la IB y las variables independientes se utilizaron medias y sus desviaciones estándar (DE) para variables cuantitativas y porcentajes para las cualitativas. Se utilizaron las pruebas de Ji al cuadrado o exacta de Fisher, la t de Student y la U de Mann-Whitney, según fueran aplicables, para investigar la relación entre el diagnóstico de IB y las variables independientes (y aquellas que se dicotomizaron). Se consideró como significativo un valor de p <0,05 y todos los contrastes fueron bilaterales.
Se realizó un análisis descriptivo (números absolutos y porcentajes) de ambos grupos de pacientes (en función del diagnóstico final de IB o IV).
La eficacia para la predicción de IB a los 30 días de los distintos BMRIeI, recuento de leucocitos y la fórmula LIAISON® MeMed® se estudió mediante el análisis de las curvas de la característica operativa del receptor (COR) con el IC 95% del área bajo la curva (ABC) y se comparó frente al valor neutro (0,5). Los errores estándar de las ABC se calcularon por métodos no paramétricos.
Se utilizaron los puntos de corte (PC) en los valores de los BMRIeI (según las publicaciones recientes del grupo INFURGSEMES) [9,10] y del test LIAISON® MeMed® según recomendaciones del fabricante y publicaciones previas [13-25]. Asimismo, para el test LIAISON® MeMed® se buscó el PC con mayor capacidad diagnóstica que maximizaba la diferencia entre la tasa de verdaderos positivos y falsos positivos mediante el índice de Youden. Se halló la sensibilidad (Se), la especificidad (Es), el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN), el coeficiente de probabilidad positivo (CP+) y negative (CP–) para cada resultado estudiado, así como sus IC 95% por métodos binomiales exactos y por el de Taylor para los CP.
El análisis estadístico se realizó con los programas IBMSPSS® Statistics 29 para Windows y STATA 17.0.
Consideraciones éticas. El estudio ha seguido todos los protocolos y normas de nuestro centro e internacionales (Declaración de Helsinki) para la utilización de los datos de los pacientes que se codificaron para asegurar la confidencialidad de los mismos. Se revisó la historia clínica informatizada y de atención primaria cuando se requirió. El estudio fue aprobado por el Comité Ético de Investigación Clínica con medicamentos (CEIm) del Hospital Universitario de Toledo (nº: 1075/2023). Se informó oralmente y por escrito al paciente o sus familiares y se solicitó consentimiento informado previo a la inclusión. El estudio no supuso ninguna intervención terapéutica ni tuvo ninguna implicación clínica.
RESULTADOS
Durante el periodo de estudio se seleccionaron por oportunidad 373 pacientes que cumplían con los criterios de inclusión inicialmente. De estos, se excluyeron 115 (30,8%) por perderse en el seguimiento de 30 días o cambiar o añadir otro diagnóstico distinto a un proceso infeccioso por un lado, o bien por no obtenerse adecuadamente y de forma validada el resultado de MeMed®. Finalmente, se incluyeron 258 pacientes (Figura 1). De éstos, 36 pacientes (14,0%) fallecieron durante los 30 días posteriores a su consulta en el SUH. La edad media fue 68,28 (DE 19,53), el 57,4% (148) eran hombres.
Figura 1.
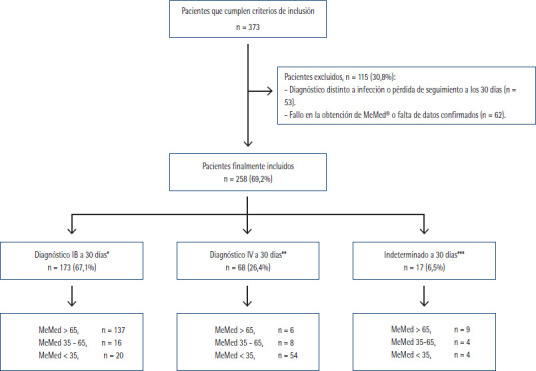
Diagrama de flujo de la inclusión de casos
IB: infección bacteriana; IV: infección viral
*: Incluye a los pacientes con diagnóstico de IB confirmado microbiológicamente y aquellos con la sospecha de IB en urgencias que se mantuvo a los 30 días (por unanimidad por el grupo formado por un/a médico de urgencias, un/a de microbiología, un/a del laboratorio de análisis clínicos y un/a de medicina interna).
**: Incluye a los pacientes con diagnóstico de IV confirmado microbiológicamente y aquellos con la sospecha de IV en urgencias que se mantuvo a los 30 días (por unanimidad por el grupo evaluador descrito antes).
***: Pacientes con diagnóstico de IB o IV sospechados en urgencias sin confirmación microbiológica y en los que el grupo evaluador no llegó a un consenso por unanimidad o se planteó posibilidad de coinfección (IB + IV).
Las características demográficas, epidemiológicas, de comorbilidad, datos clínicos (signos y síntomas) y de gravedad, destino y evolución durante 30 días, así como las pruebas analíticas, resultados de los hemocultivos y del test MeMed® se muestran en la tabla 3.
Tabla 3.
Características clínico-epidemiológicas, de comorbilidad, de evolución y analíticas estudiadas en la primera valoración del paciente en el SUH (análisis univariable)
| Total n=258 | Diagnóstico indeterminado n=17 (6,5%) | Diagnóstico infección bacteriana n= 173 (67,1%) | Diagnóstico infección viral n= 68 (26,4%) | Valor p* | |
|---|---|---|---|---|---|
| DATOS DEMOGRÁFICOS-EPIDEMIOLÓGICOS | |||||
| Edad (años), media (DE) | 68,28 (19,53) | 70,47 (17,05) | 69,03 (19,33) | 65,79 (20,61) | 0,252 |
| Edad >65 años, (%) | 162 (62,8) | 10 (58,8) | 112 (64,7) | 40 (58,8) | 0,652 |
| Género masculino, (%) | 148 (57,4) | 10 (58,8) | 99 (57,2) | 39 (57,4) | 0,952 |
| Institucionalizado, (%) | 42 (16,3) | 4 (23,5) | 29 (16,8) | 9 (13,2) | 0,302 |
| Toma de AB en mes previo, (%) | 101 (39,1) | 8 (47,1) | 66 (38,2) | 27 (39,7) | 0,768 |
| Ingreso en el último mes previo, (%) | 48 (18,6) | 3 (17,6) | 31 (17,9) | 14 (20,6) | 0,654 |
| COMORBILIDADES | |||||
| Índice de Charlsona[media (DE)] | 4,78 (3,16) | 5,65 (3,98) | 4,83 (3,15) | 4,83 (3,15) | 0,352 |
| Índice de Charlson ≥ 3, (%) | 188 (72,86) | 13 (76,47) | 129 (74,56) | 129 (74,56) | 0,084 |
| DATOS CLÍNICOS Y DE GRAVEDAD | |||||
| Temperatura en grados centígrados [media (DE)] | 36,86 (0,94) | 36,42 (0,56) | 36,80 (0,81) | 37,13 (1,23) | 0,015 |
| Temperatura > 38,3°C, (%) | 25 (9,7) | 1 (5,9) | 15 (8,7) | 9 (13,2) | 0,233 |
| FC en lpm [media (DE)] FC > 90 lpm, (%) |
96,22 (21,24) 153 (59,3) |
95,47 (17,77) 7 (41,2) |
97,67 (21,76) 108 (62,4) |
93,96 (20,50) 38 (55,9) |
0,216 0,188 |
| FR en rpm [media (DE)] FR ≥ 22 rpm, (%) |
23,59 (6,5) 145 (56,6) |
24,14 (6,46) 11 (68,8) |
23,86 (6,70) 94 (54,7) |
22,85 (6,30) 40 (58,8) |
0,417 0,505 |
| Alteración de la consciencia ECG ≤ 14, (%) | 69 (19,9) | 2 (0,6) | 41 (14,0) | 28 (51,9) | 0,008 |
| PAS en mmHg [media (DE)] | 118,66 (27,06) | 121,18 (32,64) | 115,76 (26,28) | 125,41 (26,70) | 0,011 |
| PAS < 100 mmHg, (%) | 75 (29,1) | 5 (29,4) | 57 (32,9) | 13 (19,1) | 0,083 |
| Criterios de sepsis (SRIS ≥2), (%) | 167 (64,7) | 7 (41,2) | 123 (71,1) | 37 (54,4) | 0,006 |
| qSOFA ≥2, (%) | 72 (27,9) | 6 (35,3) | 56 (32,4) | 10 (14,7) | 0,018 |
| Criterios Shock séptico (Sepsis-3), (%) | 17 (6,6) | 1 (5,9) | 16 (9,2) | 0 (0,0) | 0,004 |
| Náuseas/vómitos, (%) | 57 (22,1) | 8 (47,1) | 38 (22,0) | 11 (16,2) | 0,023 |
| Escalofríos/Tiritona, (%) | 108 (41,9) | 4 (23,5) | 73 (42,2) | 31 (45,6) | 0,254 |
| DATOS DE EVOLUCIÓN Y DESTINO | |||||
| Días desde inicio de la clínica [media (DE)] | 3,55 (3,23) | 3,88 (3,60) | 3,65 (3,36) | 3,22 (2,79) | 0,348 |
| Destino inicial de los pacientes | <0,001 | ||||
| Alta Observación-Unidad corta estancia Planta de hospitalización convencional Unidad de cuidados intensivos Quirófano Éxitus en urgencias |
53 (20,5) 26 (10,1) 152 (58,9) 16 (6,2) 10 (3,9) 1 (0,4) |
5 (29,4) 1 (5,9) 9 (52,9) 1 (5,9) 1 (5,9) 0 (0,0) |
17 (9,8) 16 (9,2) 116 (67,1) 14 (8,1) 9 (5,2) 1 (0,6) |
31 (45,6) 9 (13,2) 27 (39,7) 1 (1,5) 0 (0,0) 0 (0,0) |
|
| Reingreso en 30 días tras atención en SUH, n (%) | 33 (12,8) | 4 (23,5) | 21 (12,4) | 8 (11,8) | 0,729 |
| Estancia hospitalaria en días [media (DE)] | 7,72 (8,47) | 10,71 (18,64) | 8,65 (7,37) | 4,60 (6,18) | <0,001 |
| Mortalidad durante 30 días tras atención en SUH | 36 (14,0) | 3 (17,6) | 28 (16,2) | 5 (7,4) | 0,048 |
| HALLAZGOS ANALÍTICOS Y MICROBIOLÓGICOS | |||||
| Bacteriemia verdaderab, n (%) | 47 (18,2) | 2 (11,7) | 45 (26,1) | 0 (0,0) | <0,001 |
| Creatinina en mg/dl [media (DE)] | 1,38 (1,04) | 1,52 (1,41) | 1,47 (1,14) | 1,13 (0,54) | 0,023 |
| Leucocitos por mm3[media (DE)] | 12.603 (6.544) | 12.606 (7.886) | 14.112 (6.662) | 8.538 (3.795) | <0,001 |
| Neutrófilos (% de los leucocitos) [media (DE)] Monocitos (% de los leucocitos) [media (DE)] Linfocitos (% de los leucocitos) [media (DE)] |
80,22 (14,03) 7,34 (5,48) 11,50 (11,28) |
72,80 (21,15) 9,81 (11,55) 15,15 (11,87) |
82,21 (13,79) 6,57 (4,91) 10,49 (12,05) |
77,01 (11,21) 8,68 (4,10) 13,16 (8,53) |
0,006
0,002 0,096 |
| Plaquetas por mm3[media (DE)] | 230.291 (101.369) | 240.118 (108.662) | 241.486 (105.615) | 199.353 (81.623) | 0,003 |
| Lactato sérico en mmol/l ([media (DE)] | 19,34 (14,24) | 19,46 (17,40) | 20,52 (15,17) | 15,18 (7,62) | 0,029 |
| Proteína C reactiva en mg/L [media (DE)] | 118,6 (116,6) | 79,8 (102,3) | 152,1 (122,2) | 43,2 (48,1) | <0,001 |
| Procalcitonina en ng/ml [media (DE)] | 4,14 (13,40) | 0,86 (1,73) | 5,84 (16,01) | 0,57 (2,23) | <0,001 |
| Procalcitonina ≥ 0,25 ng/ml, n (%) | 137 (54,6) | 7 (43,8) | 116 (68,6) | 14 (21,2) | <0,001 |
| Procalcitonina ≥ 0,5 ng/ml, n (%) | 106 (42,4) | 5 (31,3) | 94 (55,6) | 7 (10,6) | <0,001 |
| Puntuación MeMed® [media (DE)] | 62 (39) | 65 (35) | 79 (29) | 18 (27) | <0,001 |
| MeMed® < 35, n (%) MeMed® 35 - 65, n (%) MeMed® > 65, n (%) |
78 (30,23) 28 (10,85) 152 (58,91) |
4 (23,52) 4 (23,52) 9 (52,94) |
20 (11,56) 16 (9,24) 137 (79,19) |
54 (79,41) 8 (11,76) 6 (8,82) |
<0,001
<0,001 <0,001 |
SUH: servicio de urgencias hospitalario; DE: desviación estándar; n: número de casos; AB: antibióticos; C: centígrados; FC: frecuencia cardiaca; lpm: latidos por minuto; FR: frecuencia respiratoria; rpm: respiraciones por minuto; máx: máximo; ECG: escala del coma de Glasgow; PAS: presión arterial sistólica; SRIS: síndrome de respuesta inflamatoria sistémica; qSOFA: quick Sepsis-related Organ Failure Assessment. *contraste bilaterales entre los grupos infección bacteriana frente a infección viral.
aÍndice de Charlson: ponderado por la edad (referencia 28).
b Bacteriemia verdadera: definida según criterios de anteriores estudios de INFURG-SEMES (referencia 29). Criterios de sepsis (SRIS ≥ 2) según conferencia de Consenso de 2001 (referencia 1). Criterios de sepsis (qSOFA ≥ 2) según la tercera conferencia de consenso (Sepsis-3) (referencia 1)
Se encontraron diferencias significativas al comparar los pacientes en función del diagnóstico final de IB con el resto en las siguientes variables: temperatura, alteración del nivel de consciencia, PAS <100 mmHg, qSOFA ≥2, SRIS ≥ 2, criterios de shock séptico (sepsis-3), existencia de náuseas/vómitos, destino del paciente, estancia hospitalaria, mortalidad a los 30 días, bacteriemia verdadera y en distintos resultados del laboratorio (creatinina ≥2 mg/dl, lactacidemia, recuento de plaquetas, recuento de leucocitos y proporciones de monocitos y neutrófilos, así como en las concentraciones de PCR, PCT (y dicotomizado para ≥ 0,25 y ≥ 0,5 ng/ml) y MeMed® (y dicotomizado para <35, 35-65 y >65). En 45 (26,1%) de las IB y 2 (11,7%) del grupo indeterminado, hubo aislamiento significativo en los hemocultivos.
El posible foco u origen clínico de presunción en el SUH en relación a los pacientes con diagnóstico final de IB o IV a los 30 días se muestra en la tabla 4.
Tabla 4.
Posibles focos/diagnósticos clínico en el servicio de urgencias en los grupos según sospecha etiológica
| Foco/diagnóstico clínico en el Servicio de Urgencias | Total n = 258 | Diagnóstico indeterminado n=17 (6,5%) | Diagnóstico infección bacteriana n= 173 (67,1%) | Diagnóstico infecciónviral n= 68 (26,4%) |
|---|---|---|---|---|
| Infección respiratoria de vías bajas, n (%) | 115 (44,6) | 4 (23,5) | 58 (33,5) | 53 (77,9) |
| Infección del tracto urinario, n (%) | 60 (23,3) | 4 (23,5) | 56 (32,4) | 0 (0,0) |
| Infección abdominala,n (%) | 34 (13,2) | 1 (5,9) | 28 (16,2) | 5 (7,3) |
| Fiebre o sospecha de infección de origen desconocido, n (%) | 29 (11,2) | 3 (17,6) | 20 (11,6) | 6 (8,8) |
| Infección de piel y partes blandas, n (%) | 14 (5,4) | 4 (23,5) | 6 (3,5) | 4 (5,9) |
| Otros focosb, n (%) | 6 (2,3) | 1 (5,9) | 5 (2,9) | 0 (0,0) |
aGastroenteritis, colitis infecciosa, colangitis o colecistitis, hepatitis, appendicitis
bOtorrinolaringológico, sospecha de endocarditis, infección de dispositivos vasculares, etc.
En la figura 2 se describen los valores de ABC-COR del recuento leucocitos, de los BMRIeI estudiados (PCR, PCT) y del test MeMed® para la capacidad de diagnóstico de IB en todos los pacientes atendidos en el SUH por un proceso infeccioso (Figura 2a), así como en el grupo exclusión LIAISON-MeMed (Figura 2b) con 237 pacientes (una vez excluidos 21 que cumplían alguno de los criterios de exclusión), en los pacientes en los que se consiguió confirmación microbiológica (155) (Figura 2c), en los 162 pacientes con ≥ 65 años (Figura 2d) y en los 115 pacientes con IRVB (neumonías, EPOC agudizado, bronquitis)
Figura 2.
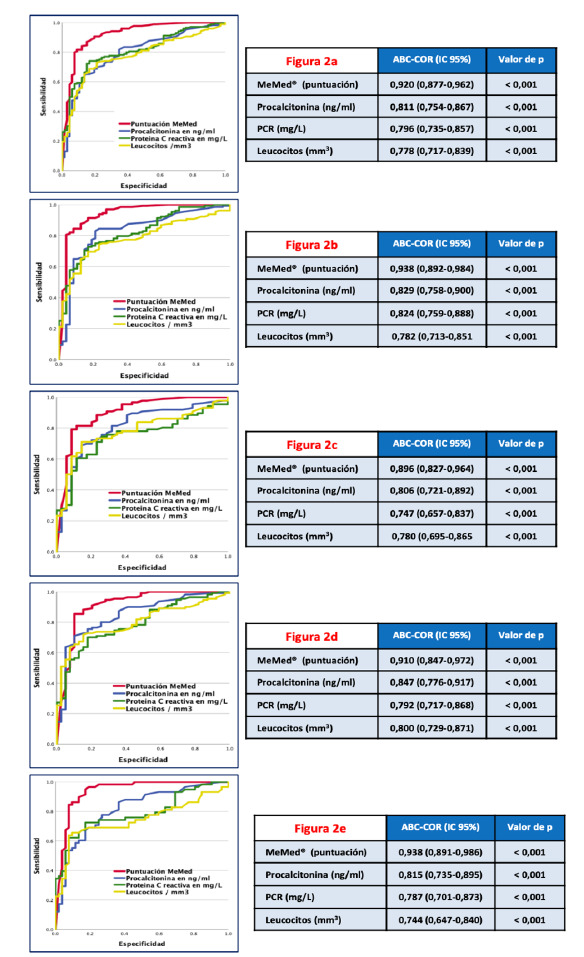
Capacidad diagnóstica de infección bacteriana en pacientes atendidos en el servicio de urgencias por infección
2a : todos los pacientes; 2b : grupo exclusión LIAISON-MeMed; 2c : grupo confirmación microbiológica; 2d: grupo ≥ 65 años; 2e: grupo pacientes con infección respiratoria de vías bajas; El valor de p indica el riesgo de error tipo I en el contraste de la hipótesis nula de que el ABC-ROC es igual a 0,5.; ABC-COR: área bajo la curva de la capacidad operativa del receptor; IC 95%: intervalo de confianza del 95%; PCR: proteína C reactiva
(Figura 2e). Para el grupo con bacteriemia verdadera (47 aislamientos) el ABC-COR es de 0,936 (0,859-1,000), p <0,001.
Los mejores resultados en todos los grupos (2a, 2b, 2c, 2d y 2d) por orden de rendimiento los obtiene el test MeMed®, seguido de la PCT. El ABC-COR que consigue MeMed® en el grupo que analiza todos los pacientes es de 0,920 (IC 95%: 0,877-0,962) y la PCT de 0,811 (IC 95%: 0,754-0,867). En la tabla 5 se pueden consultar todos los valores de rendimiento diagnóstico de los PC definidos para MeMed® previamente y el encontrado por el índice de Youden, así como para la PCT, en el grupo que incluye todos los pacientes.
Tabla 5.
Puntos de corte y rendimiento para el rendimiento diagnóstico de infección bacteriana
| TODOS LOS PACIENTES n = 258 | ABC-COR (IC 95%) | Se % (IC 95%) | Es % (IC 95%) | VPP % (IC 95%) | VPN % (IC 95%) | CP+ (IC 95%) | CP- (IC 95%) |
|---|---|---|---|---|---|---|---|
| Puntuación MeMed > 65 | 0,857 (0,803-0,911) |
79,2 (72,2-84,8) |
91,2 (81,1-96,49) |
95,8 (90,7-98,3) |
63,3 (52,9-72,6) |
8,97 (4,21-19,32) |
0,23 (0,17-0,31) |
| Puntuación MeMed > 90 | 0,801 (0,741-0,861) |
57,0 (49,3-64,5) |
95,9 (87,2-99,2) |
97,4 (91,3-99,5) |
46,8 (38,4-55,4) |
13,24 (4,61-39,42) |
0,45 (0,38-0,54) |
| Puntuación MeMed > 50* | 0,852 (0,797-0,907 |
84,1 (77,4-89,3) |
88,2 (77,6-94,4) |
94,7 (89,4-97,5) |
65,9 (55,2-75,3) |
6,98 (3,63-13,43) |
0,20 (0,15-0,28) |
| Procalcitonina ≥ 0,25 ng/ml | 0,787 (0,707-0,858) |
70,7 (62,9-77,4) |
80,8 (68,7-89,6) |
91,2 (84,3-95,8) |
51,5 (41,7-61,4) |
3,24 (2,01-5,21) |
0,40 (0,31-0,51) |
| Procalcitonina ≥ 0,50 ng/ml | 0,725 (0,659-0,791) |
57,6 (49,8-65,2) |
89,4 (78,8-95,3) |
93,1 (85,8-96,9) |
46,1 (37,6-54,9) |
5,44 (2,77-10,9) |
0,50 (0,41-0,60) |
: punto de corte obtenido por el índice de Youden
Se: sensibilidad; Es: especificidad; VPP: valor predictivo positivo; VPN: valor predictivo negativo;
CP+: cociente de probabilidad positivo; CP-: cociente de probabilidad negativo; IC 95%: intervalo de confianza al 95%
Finalmente, por su interés, se analizaron y compararon los resultados de rendimiento diagnóstico de IB de la PCT, la PCR y MeMed® en el grupo de los 28 pacientes con resultado dudoso (rango 35-65 puntos de MeMed®). Se obtuvieron los siguientes resultados: Para la PCT un ABC-COR de 0,622 (IC 95%: 0,376-0,869), p=0,371; para la PCR un ABC de 0,469 (IC 95%: 0,210-0,729), p=0,823; y para MeMed® un ABC-COR de 0,500 (IC 95%: 0,213-0,787), p=1.
DISCUSIÓN
Los resultados del presente estudio nos permiten confirmar la gran capacidad diagnóstica de infección bacteriana que ofrecen algunos BMRIeI, como la PCT [9,10,12] y sobre todo el nuevo test MeMed®, para los pacientes atendidos en los SUH con la sospecha de sufrir un proceso infeccioso [13-26]. En este estudio, LIAISON-MeMed® se presenta como una prueba novedosa que obtiene el mejor rendimiento diagnóstico de infección bacteriana frente a aquellos pacientes con infección de origen viral y los no infecciosos [13,14]. Este hecho ya había sido señalado por otros autores para los pacientes adultos [21-27], así como para los pacientes pediátricos [15-20].
Se trata de la primera prueba de diagnóstico que incluye una puntuación de 0 a 100 basada en la combinación de la concentración de 3 proteínas circulantes en sangre (por una fórmula matemática surgida de un modelo de regresión). Di-chos BMRIeI son inducidos tanto por virus como por bacterias [13-27]: el TRAIL que se eleva como expresión de IV y disminuye en IB, la IP-10 que se incrementa en mayor medida en IV y en menor medida en las bacterianas, y la PCR que muestra un patrón opuesto a la IP-10 [13,14]. Este modelo representa un claro ejemplo de la “sinergia de los BMRIeI” que aumenta y supera el rendimiento diagnóstico de cada uno de ellos individualmente [12].
LIAISON-MeMed® puede convertirse en una nueva herramienta de ayuda cuando las manifestaciones clínicas de los procesos infecciosos son inespecíficas y variables, lo que dificulta el reconocimiento precoz de estos enfermos y, asimismo, de su posible etiología bacteriana o viral [1,2]. De forma, que se puede mejorar la adecuación de la indicación de antibioterapia desde los SUH en todos los pacientes, pero sobre todo en los más vulnerables [2,5,30]. El test puede tener sus resultados al mismo tiempo que el resto de la analítica urgente (y otros BMRIeI) utilizando los aparatos de inmunoensayo automatizado que habitualmente disponen los centros hospitalarios para su analítica urgente [13-15]. En este sentido, con los datos comunicados de nuestro laboratorio y de los fabricantes, se estima que en este momento en España la realización de la prueba urgente tendría un coste de 30-40€, según si se realiza individualmente o junto con otras determinaciones urgentes. Por lo que serían necesarios estudios de coste-efectividad donde se pueda valorar una reducción y adecuación del uso de antibióticos y/o del destino del paciente que demuestren la rentabilidad y eficiencia del uso de la prueba.
Los resultados de nuestro estudio, en todos los pacientes evaluados (figura 2a), son muy relevantes, MeMed® consigue un ABC-COR excelente de 0,920 que no difiere del grupo que excluye a los pacientes indicados por el fabricante (figura 2b) con ABC-COR de 0,938 o la de los diagnosticados de un cuadro de IVRB (figura 2e), también con 0,938. Y son ligeramente superiores de los del grupo de pacientes con ≥ 65 años (figura 2d) con un ABC-COR de 0,910 y del grupo que tuvo una confirmación microbiológica (figura 2c) con un ABC-COR de 0,896 (aunque estos siguen siendo muy buenos). En cuanto a los resultados de los PC evaluados como referencia por artículos previos y el fabricante [13-26], cabe destacar que con PC > 65 puntos del test MeMed® en nuestra muestra obtiene una Se de 79,2% y Es de 91,2% y con PC > 90 puntos se pierde bastante Se (57%), pero se gana en Es (95,9%). Pero, aplicando el índice de Youden el PC > 50 puntos consigue una interesante Se de 84,1% y Es 88,2%. Por lo que creemos que en futuros estudios habrá que seguir explorando y analizando distintos PC para valorar y validar estos en los distintos subgrupos. Por su parte, la PCT tanto con el PC ≥ 0,25 ng/ml, señalado por una reciente revisión sistemática como el más indicado para predecir el diagnóstico de IB [10], como el PC ≥ 0,50 ng/ml como el más adecuado para predecir bacteriemia [9], en nuestro estudio confirma un menor rendimiento con diferencias significativas respecto a los PC de 65 y 90 puntos de MeMed®. Y, aunque no ha sido publicado en otros estudios, el ABC-COR de 0,936 en el grupo de pacientes con bacteriemia verdadera, abre otra línea interesante para explorar en un futuro con el test MeMed®.
En uno de los primeros estudios publicados, Oved et al [13], consiguen un ABC de 0,94 (IC 95%: 0,92-0,96) para todos los pacientes y, también, en los subgrupos de adultos, de confirmación microbiológica e IRVB. Y, como en nuestro estudio, con un significativo mejor rendimiento que la PCT, la PCR y el recuento de leucocitos. Asimismo, Ashkenazi-Hoffnung et al [22], también comunican unos resultados excelentes para MeMed® con un ABC superior a 0,92 para pacientes adultos, con una Se del 92,6% y una Es de 95,7%, muy superiores a los conseguidos por la PCT y la PCR para distinguir entre etiologías bacterianas y virales en pacientes con infecciones respiratorias y fiebre sin foco conocido. De forma que estos autores estimaron que se podría reducir el uso de los AB innecesarios en un 88% de los casos [22]. En esta misma línea, Stein et al [21], en una muestra de 124 casos de IRVB en adultos y niños, consigue una Se del 93% y Es del 91%, superando a la PCR y leucocitos. Más recientemente, Halibi et al [23], en una muestra de 415 IRVB en adultos, publican unos resultados muy relevantes para proponer el test MeMed® como una prueba de cribado en el SUH para diferenciar las IB de las IV e indicar adecuadamente la administración de antibioterapia, al conseguir una Se del 98,1%, Es de 88,4% y en VPN de 98,8%.
Finalmente, en un estudio publicado en el último año, Bachur et al [27], en un trabajo prospectivo, multicéntrico y ciego sobre 314 adultos y 162 niños, tras conseguir una Se de 90%, Es de 92,8% y un VPN de 98,8%, concluyen que el test MeMed® es útil en adultos y niños atendidos en el SUH para distinguir el origen bacteriano del viral en distintos procesos infecciosos y para decidir la administración de antibióticos o no.
Aunque, como hemos comentado, sí se ha comparado en otros estudios los resultados en pacientes con la sospecha clínica de infección bacteriana (consensuada por paneles de expertos) y aquellos con confirmación microbiológica o, específicamente, en pacientes con IRVB, es la primera vez que se analiza el test MeMed® en el subgrupo de pacientes ≥ 65 años y con bacteriemia, específicamente.
Nuestro estudio tiene distintas limitaciones. Las principales son, por una parte, el carácter unicéntrico del estudio y, por otra, el haber reclutado los casos por oportunidad (cuando los investigadores estaban de guardia) en una muestra limitada (258 casos). Por ello, existe la posibilidad de un sesgo de selección al depender la inclusión de los pacientes de la presencia de uno de los investigadores, aunque esta fuera consecutiva durante esos periodos de tiempo. Por otro lado, se trata de una muestra heterogénea con distintos procesos (IRBV, ITU, infecciones abdominales, fiebre sin foco, etc.) y múltiples patógenos bacterianos y virales y no se han analizado las características diferenciales entre estos grupos.
A pesar de estas limitaciones, creemos que el estudio es un reflejo de la realidad clínica de nuestros SUH y de los pacientes que se atienden habitualmente. Y es que, a pesar de los avances en el diagnóstico de enfermedades infecciosas, la identificación oportuna de infecciones bacterianas sigue siendo un desafío, así como mejorar la adecuación de la administración de la antibioterapia precoz en los SUH.
Por todo ello, es necesario que se realicen estudios pros-pectivos, multicéntricos y con potencia que puedan validar o matizar estos resultados sobre una prueba novedosa pero prometedora como es MeMed®. En la actualidad, son muchos los grupos como el nuestro que están estudiando nuevos BMRIeI y modelos combinados para proporcionar el mejor rendimiento diagnóstico y pronóstico en la primera evaluación del paciente en el SUH que mejoren y superen las limitaciones de los que se utilizan habitualmente [31-35]. Asimismo, junto con otros BMRIeI, estos futuros estudios deberán evaluar para MeMed® junto al rendimiento diagnóstico de IB, el predictivo de bacteriemia y el pronóstico (gravedad, ingreso en UCI, mortalidad) con el objetivo de encontrar el BMRIeI o combinación de estos que sea eficaz y eficiente para la práctica clínica habitual en los SUH [12,32,33].
Como conclusiones de este estudio podemos señalar que la prueba de LIAISON MeMed® podría ser útil para diagnosticar el origen bacteriano en los pacientes adultos atendidos con sospecha clínica de infección en el SUH, así como que obtiene un mejor rendimiento que la PCT, la PCR y el recuento de leucocitos.
FINANCIACIÓN
Los reactivos para medir LIAISON®MeMed®fueron cedidos por Diasorin.
Nadie de la compañía participó en el diseño del estudio ni en la evaluación de sus resultados ni condicionó ninguna fase de su elaboración. Este manuscrito no ha recibido ninguna financiación por parte de ningún organismo ni público ni privado.
CONFLICTO DE INTERESES
Los autores declaran la ausencia de conflictos de intereses en relación con el presente artículo.
AJJ ha participado en reuniones científicas organizadas por Roche, Thermo Scientific Biomarkers, B.R.A.H.M.S. AG, ViroGates y Biomerieux. Ningún autor ha recibido compensación económica por participar en este trabajo.
References
- 1.Julián-Jiménez A, Supino M, López Tapia JD, Ulloa González C, Vargas Téllez LE, González del Castillo J, et al. Puntos clave y controversias sobre la sepsis en los servicios de urgencias: propuestas de mejora para Latinoamérica. Emergencias 2019;31:123-135. PMid: . [PubMed] [Google Scholar]
- 2.Julián-Jiménez A, Gorordo-Delsol LA, Merinos-Sánchez G, Santillán-Santos DA, Rosas Romero FA, Sánchez Arreola D, et al. Declaración de Guadalajara: una visión constructiva desde el servicio de urgencias a partir de la Surviving Sepsis Campaign 2021. Emergencias. 2023;35:53-64. PMid: . [PubMed] [Google Scholar]
- 3.Rudd KE, Johnson SC, Agesa KM, Shackelford KA, Tsoi D, Kievlan DR, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. Lancet. 2020; 395(10219): 200-11. doi: 10.1016/S0140-6736(19)32989-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Bauer M, Gerlach H, Vogelmann T, Preissing F, Stiefel J, Adam D. Mortality in sepsis and septic shock in Europe, North America and Australia between 2009 and 2019–results from a systematic review and meta-analysis. Crit Care. 2020;24:239. doi: 10.1186/s13054-020-02950-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Evans L, Rhodes A, Alhazzani W, Antonelli M, Coopersmith CM, French C, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 2021;47:1181-247. doi: 10.1007/s00134-021-06506-y. . [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Carbó Díez M, Osorio Quispe G, Fresco Quindós L, Miota Hernández N, Perea Gainza M, Ortega Romero MM. Cumplimiento del paquete de medidas en las primeras tres horas en urgencias y su relación con el pronóstico de los pacientes mayores de 65 años con sepsis. Emergencias. 2024;36:179-87 doi: 10.55633/s3me/009.2024. PMid: . [DOI] [PubMed] [Google Scholar]
- 7.Martínez-de la Cruz P, Moreno-Núñez L, Álvarez-Atienza S, SanzMárquez S, Valverde-Canovas JF, Losa-García JE. Antibiotic discontinuation through an antibiotic treatment optimization program in emergency department patients with low suspicion of infection. Enferm Infecc Microbiol Clin (Engl Ed). 2023;41:423-425. doi: 10.1016/j.eimce.2022.10.004. . [DOI] [PubMed] [Google Scholar]
- 8.Rodríguez M.R, Llopis Roca F, Rubio Díaz R, García DE, Julián-Jiménez A. Administración precoz de la antibioterapia empírica en los pacientes atendidos con sospecha de sepsis en el servicio de urgencias: una revisión sistemática. Emergencias. 2024; doi: 10.55633/s3me/092.2024 [DOI] [Google Scholar]
- 9.Julián-Jiménez A, Eduardo García D, Merinos-Sánchez G, García de Guadiana-Romualdo L, González Del Castillo J. Precisión diagnóstica de la procalcitonina para la bacteriemia en el servicio de urgencias: una revisión sistemática. Rev Esp Quimioter. 2024;37:29-42. doi: 10.37201/req/099.2023. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Julián-Jiménez A, García de Guadiana-Romualdo L, Merinos-Sánchez G, Eduardo García D. Precisión diagnóstica de la procalcito-nina para la infección bacteriana en el servicio de urgencias: una revisión sistemática. Rev Clin Esp. 2024;224:400-16. doi: 10.37201/req/099.2023. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Cancella de Abreu M, Freund Y. Conjunto de medidas para la sepsis y consideraciones pragmáticas desde el servicio de urgencias. Emergencias. 2024;36:164-5 doi: 10.55633/s3me/015.2024. [DOI] [PubMed] [Google Scholar]
- 12.Julián-Jiménez A, Candel-González FJ, González del Castillo J. Utilidad de los biomarcadores de inflamación e infección en los servicios de urgencias. Enferm Infecc Microbiol Clin. 2014;32:177–190. doi: 10.1016/j.eimc.2013.01.005. [DOI] [PubMed] [Google Scholar]
- 13.Oved K, Cohen A, Boico O, Navon R, Friedman T, Etshtein L, et al. A novel host-proteome signature for distinguishing between acute bacterial and viral infections. PLoS One. 2015;10:e0120012. doi: 10.1371/journal.pone.0120012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Eden E, Srugo I, Gottlieb T, Navon R, Boico O, Cohen A, et al. Diagnostic accuracy of a TRAIL, IP-10 and CRP combination for discriminating bacterial and viral etiologies at the Emergency Department. J Infect. 2016;73:177-80. doi: 10.1016/j.jinf.2016.05.002. [DOI] [PubMed] [Google Scholar]
- 15.Papan C, Argentiero A, Porwoll M, Hakim U, Farinelli E, Testa I, et al. A host signature based on TRAIL, IP-10, and CRP for reducing antibiotic overuse in children by differentiating bacterial from viral infections: a prospective, multicentre cohort study. Clin Microbiol Infect. 2022;28:723-730. doi: 10.1016/j.cmi.2021.10.019. . [DOI] [PubMed] [Google Scholar]
- 16.van Houten CB, de Groot JAH, Klein A, Srugo I, Chistyakov I, de Waal W, et al. A host-protein based assay to differentiate between bacterial and viral infections in preschool children (OPPORTUNITY): a double-blind, multicentre, validation study. Lancet Infect Dis. 2017;17:431-440. doi: 10.1016/S1473-3099(16)30519-9. [DOI] [PubMed] [Google Scholar]
- 17.Chokkalla AK, Tam E, Liang R, Cruz AT, Devaraj S. Validation of a multi-analyte immunoassay for distinguishing bacterial vs. viral infections in a pediatric cohort. Clin Chim Acta. 2023;546:117387. doi: 10.1016/j.cca.2023.117387. Erratum In: Clin Chim Acta. 2023;548:117468. doi: 10.1016/j.cca.2023.117468. [DOI] [PubMed] [Google Scholar]
- 18.Ibrahim RB, Ona H, Chokkalla AK, Tam E, Devaraj S. Validation of a whole blood machine learning strategy for distinguishing between bacterial and viral infection in a pediatric hospital setting. Pract Lab Med. 2024;39:e00387. doi: 10.1016/j.plabm.2024.e00387. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Lacroix L, Papis S, Mardegan C, Luterbacher F, L’Huillier A, Sahyoun C, et al. Host biomarkers and combinatorial scores for the detection of serious and invasive bacterial infection in pediatric patients with fever without source. PLoS One. 2023;18:e0294032. doi: 10.1371/journal.pone.0294032. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Klein A, Shapira M, Lipman-Arens S, Bamberger E, Srugo I, Chistyakov I, et al. Diagnostic Accuracy of a Real-Time Host-Protein Test for Infection. Pediatrics. 2023;152:e2022060441. doi: 10.1542/peds.2022-060441. [DOI] [PubMed] [Google Scholar]
- 21.Stein M, Lipman-Arens S, Oved K, Cohen A, Bamberger E, Navon R, et al. A novel host-protein assay outperforms routine parameters for distinguishing between bacterial and viral lower respiratory tract infections. Diagn Microbiol Infect Dis. 2018;90:206-213. doi: 10.1016/j.diagmicrobio.2017.11.011. [DOI] [PubMed] [Google Scholar]
- 22.Ashkenazi-Hoffnung L, Oved K, Navon R, Friedman T, Boico O, Paz M, et al. A host-protein signature is superior to other biomarkers for differentiating between bacterial and viral disease in patients with respiratory infection and fever without source: a prospective observational study. Eur J Clin Microbiol Infect Dis. 2018;37:1361-1371. doi: 10.1007/s10096-018-3261-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Halabi S, Shiber S, Paz M, Gottlieb TM, Barash E, Navon R, et al. Host test based on tumor necrosis factor-related apoptosis-inducing ligand, interferon gamma-induced protein-10 and C-reactive protein for differentiating bacterial and viral respiratory tract infections in adults: diagnostic accuracy study. Clin Microbiol Infect. 2023;29:1159-1165. doi: 10.1016/j.cmi.2023.05.033. [DOI] [PubMed] [Google Scholar]
- 24.Novak D, Masoudi A, Shaukat B, Kabariti S, Drapkin J, Christian M, et al. MeMed BV testing in emergency department patients presenting with febrile illness concerning for respiratory tract infection. Am J Emerg Med. 2023;65:195-199. doi: 10.1016/j.ajem.2022.11.022. [DOI] [PubMed] [Google Scholar]
- 25.Schneider JE, Cooper JT. Cost impact analysis of novel host-response diagnostic for patients with community-acquired pneumonia in the emergency department. J Med Econ. 2022;25:138-151. doi: 10.1080/13696998.2022.2026686. [DOI] [PubMed] [Google Scholar]
- 26.Langedijk AC, Rengerink KO, Harding E, Wensing A, van Slooten R, Israeli Y, et al. Natural variability of TRAIL, IP-10, and CRP in healthy adults-The “HERACLES” study. Cytokine. 2024;176:156530. doi: 10.1016/j.cyto.2024.156530. [DOI] [PubMed] [Google Scholar]
- 27.Bachur RG, Kaplan SL, Arias CA, Ballard N, Carroll KC, Cruz AT, et al. A rapid host-protein test for differentiating bacterial from viral infection: Apollo diagnostic accuracy study. J Am Coll Emerg Physicians Open. 2024;5:e13167. doi: 10.1002/emp2.13167. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Charlson M, Pompei P, Ales KL, McKenzie CR. A new method of classyfing pronostic comorbidity in longitudinal studies: Development and validation. J Chron Dis. 1987;40:373–83. doi: 10.1016/0021-9681(87)90171-8. [DOI] [PubMed] [Google Scholar]
- 29.Julián-Jiménez A, García-Lamberechts EJ, González del Castillo J, Navarro Bustos C, LLopis-Roca F, Martínez-Ortiz de Zárate M, et al. Validación del modelo predictivo de bacteriemia (5MPB-Toledo) en los pacientes atendidos en el servicio de urgencias por infección. Enferm Infecc Microbiol Clin. 2021. doi: 10.1016/j.eimc.2020.12.007. [DOI] [PubMed] [Google Scholar]
- 30.Aguiló Mir S. Identificar al paciente frágil en un servicio de urgencias: un esfuerzo urgente y necesario. Emergencias. 2023;35:165-6. doi: 10.55633/s3me/E058.2023. [DOI] [PubMed] [Google Scholar]
- 31.Bachur RG, Kaplan SL, Arias CA, Ballard N, Carroll KC, Cruz AT, et al. A rapid host-protein test for differentiating bacterial from viral infection: Apollo diagnostic accuracy study. J Am Coll Emerg Physicians Open. 2024;5:e13167. doi: 10.1002/emp2.13167. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Clemente C, Fuentes Ferrer ME, Ortega Heredia D, Julián Jiménez A, Martín-Sánchez FJ, González Del Castillo J. Utilidad de la combinación de biomarcadores de respuesta inflamatoria y escalas clínicas para la estratificación del riesgo en pacientes atendidos en urgencias por sospecha de infección. Emergencias. 2024;36:9-16. doi: 10.55633/s3me/04.2023. [DOI] [PubMed] [Google Scholar]
- 33.Yañez Palma MC, Roman F, Llopis-Roca F, Fragiel M, Julián Jiménez A, Martín-Sánchez FJ, et al. Utilidad de la región medial de la pro-adrenomodulina para la detección de bacteriemia verdadera en pacientes mayores atendidos en urgencias por sospecha de infección. Rev Esp Quimioter. 2024;37:78-87. doi: 10.37201/req/110.2023. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Castro-Delgado R, Pardo Ríos M. Artificial intelligence and emergency services: We need to take a step forward. Emergencias. 2024;36:145-7. doi: 10.55633/s3me/002.2024. [DOI] [PubMed] [Google Scholar]
- 35.Leticia Fernandez-Carballo B, Escadafal C, MacLean E, Kapasi AJ, Dittrich S. Distinguishing bacterial versus non-bacterial causes of febrile illness-A systematic review of host biomarkers. J Infect. 2021;82:1-10. doi: 10.1016/j.jinf.2021.01.028. [DOI] [PubMed] [Google Scholar]


