Abstract
目的
研究五谷虫通过免疫应激-补体活化途径治疗C57BL/6银屑病样小鼠的药效学及作用机制。
方法
取36只SPF级雄性C57BL/6小鼠,随机分为正常组、模型组、五谷虫(1.25%,2.5%,5%剂量)组、本维莫德(1%)组,6只/组,咪喹莫特乳膏涂抹造模。MPASI评分检测小鼠皮损的严重程度;游标卡尺检测小鼠耳廓肿胀厚度;HE染色检测小鼠背部皮肤及右耳组织病理学变化;观察小鼠抓挠行为学;称重计算小鼠脾脏指数;甲苯胺蓝染色检测小鼠背部皮肤组织肥大细胞数量;ELISA法检测免疫应激(IgG、IgM)、补体活化(CH50、C1s、C3、C3a、C5、C5a)、炎症反应(IL-23、IL-17A、TNF-α)相关因子水平。
结果
与正常组相比,模型组小鼠MPASI评分、耳廓肿胀厚度均升高(P<0.001);背部皮肤及右耳组织病理损伤加重;抓挠行为次数,脾脏指数,肥大细胞数量,血清IgG、C1s、C3a、C5a、IL-23、IL-17A、TNF-α,组织C1s、C3、C3a、C5、C5a水平均升高(P<0.05),血清CH50、C3、C5水平降低(P<0.001),血清IgM水平有升高趋势,但差异无统计学意义。与模型组相比,五谷虫低、中、高剂量组小鼠MPASI评分、耳廓肿胀厚度降低(P<0.05);背部皮肤及右耳组织病理损伤减弱;抓挠行为次数、脾脏指数、肥大细胞数量降低(P<0.01),五谷虫高剂量组血清IgG、C1s、C3a、C5a、IL-23、IL-17A、TNF-α,组织C1s、C3、C3a、C5、C5a水平降低(P<0.05),血清CH50、C3、C5水平升高(P<0.01)。五谷虫疗效呈现剂量-效应依赖关系。
结论
五谷虫通过调控免疫应激-补体活化途径发挥治疗银屑病作用。
Keywords: 五谷虫, 银屑病, 免疫应激, 补体活化, 炎症反应
Abstract
Objective
To explore the therapeutic mechanism of maggot for psoriasis-like lesions in mice from the perspective of immune stress and complement activation regulation.
Methods
Thirty-six male C57BL/6 mice were randomly divided into control group, model group, maggot (1.25%, 2.5%, and 5%) groups, and Benvitimod (1%) group. Psoriasis-like lesions were induced by application of imiquimod cream, and the severity of skin lesions was assessed using the modified Psoriasis Area and Severity Index (MPASI) score. Auricular swelling of the mice was observed, and histopathological changes of the skin lesions were examined with HE staining. Scratching behavior of the mice was observed and the spleen index was calculated. Toluidine blue staining was used to detect mast cells in the skin lesions, and serum levels of IgG, IgM, the complements CH50, C1s, C3, C3a, C5 and C5a, and the inflammatory factors IL-23, IL-17A and TNF-α were determined with ELISA.
Results
In mice with imiquimod-induced psoriasis-like skin lesions, treatment with the maggot at the 3 doses significantly decreased MPASI score, alleviated auricular swelling and pathologies in the skin lesions, reduced scratching behaviors, spleen index, and the number of mast cells in the lesions. Treatment with high-dose maggot significantly lowered serum levels of IgG, C1s, C3a, C5a, IL-23, IL-17A and TNF-α and the levels of C1s, C3, C3a, C5 and C5a in the lesion tissue, and increased serum levels of CH50, C3, and C5. The therapeutic effect of maggot showed a dose-effect dependence.
Conclusion
Maggot can alleviate psoriasis-like skin lesions in mice by inhibiting immune stress and complement activation.
Keywords: maggot, psoriasis, immune stress, complement activation, inflammatory response
银屑病(PSO)是免疫介导的慢性、复发性、炎症性、系统性疾病,全球发病率2%~3%,临床表现为鳞屑性红斑或斑块,全身局限或广泛分布[1, 2]。PSO是由多种细胞及因子共同作用介导的免疫紊乱[3],机体发生过度免疫反应,B细胞过度分化成浆细胞分泌大量免疫球蛋白G(IgG)、免疫球蛋白M(IgM)[4, 5],IgG、IgM与抗原结合形成免疫复合物激活补体系统经典途径,产生补体成分3a(C3a)和补体成分5a(C5a)[6],C3a/C5a与其受体结合诱导细胞分泌白细胞介素-23(IL-23)、白细胞介素-17(IL-17)、肿瘤坏死因子-α(TNF-α)等炎性因子[7, 8],最终导致PSO皮损。
中药五谷虫又名蝇蛆,为丽蝇科常见医学昆虫丝光绿蝇或其近缘动物的幼虫或蛹壳。五谷虫始载于《本草纲目》,列于虫部第四十卷,其味咸、甘,性寒,归脾、胃经,具有清热、消滞、除疳等功效,临床上可用于去热、治热病、治臁烂等[9]。研究表明,五谷虫中所含化学成分包括蛋白质类、脂肪酸类、甲壳素类等,并发现其具有调节免疫、抗炎、促创面愈合及组织重建和再生等药理作用[10],且其是通过美国食品药品监督管理局认证的首批、唯一的医疗用昆虫[11]。然而,目前五谷虫治疗PSO的研究较少,通过免疫应激-补体活化途径治疗PSO的药效学及作用机制尚未见报道。因此,本研究通过咪喹莫特(IMQ)乳膏诱发构建PSO小鼠模型,研究五谷虫调控免疫应激-补体活化途径治疗PSO的药效学及作用机制。
1. 材料和方法
1.1. 材料
1.1.1. 实验动物
SPF级雄性C57BL/6小鼠36只,6~8周龄,体质量20~25 g,购自成都达硕实验动物有限公司[许可证号:SCXK(川)2020-0030]。小鼠分笼饲养,温度22±2 ℃,湿度55%~75%,光照12 h昼夜周期循环,自由饮水、摄食,所有小鼠在实验前先适应环境1周。本实验符合动物实验伦理规范,经陕西中医药大学动物实验伦理委员会审核并批准(伦理批号:SUCMDL20240124001)。
1.1.2. 主要试剂与仪器
五谷虫软膏(实验室自研),IMQ乳膏(明欣利迪),本维莫德乳膏(欣比克),凡士林乳膏(昭诺);IgG、IgM、血清总补体(CH50)、补体成分1s(C1s)、补体成分3(C3)、C3a、补体成分5(C5)、C5a、 IL-23、IL-17A、TNF-α ELISA检测试剂盒(酶联生物);锌合金数显卡尺(上海美耐特实业有限公司);恒温摇床(上海一恒科学仪器有限公司);酶标仪(深圳迈瑞生物医疗有限公司)。
1.2. 方法
1.2.1. 小鼠PSO模型及分组
36只C57BL/6小鼠随机分为正常组,模型组,五谷虫低剂量(1.25%)、中剂量(2.5%)、高剂量(5%)组,本维莫德(1%)组,6只/组。实验第0天将小鼠背部皮肤脱毛,24 h后在正常组小鼠背部皮肤及右耳耳廓内外侧涂抹凡士林乳膏,1次/d,连续8 d;其他各组小鼠背部皮肤及右耳耳廓内外侧涂抹IMQ乳膏,1次/d,连续8 d。实验第4天起,给药组小鼠背部皮肤及右耳耳廓内外侧涂抹IMQ乳膏,4 h前、后涂抹不同剂量五谷虫和本维莫德乳膏,2次/d,连续5 d。
1.2.2. MPASI评分法
采用改良的MPASI法评估小鼠背部皮肤损伤的严重程度。皮损面积评分将小鼠分为头部、上肢、躯干、下肢、尾部共5个部分,拟定分别占据体表总面积的20%、10%、50%、10%、10%,采用Ah、Au、At、Al、Ae表示小鼠各部分皮损占相应皮肤表面的波及程度,采用0~6分的七级评分法表示。皮损严重程度评分以红斑、浸润、鳞屑进行描述,采用0~4分的五级评分法表示。在MPASI分值计算中,因模型为小鼠背部药物刺激诱导建模,皮损主要局限于小鼠的背部,即躯干部位,其余结构的皮损均为0,所以计算小鼠的MPASI分值应为躯干部的红斑(E,0~4分)、浸润(I,0~4分)、鳞屑(D,0~4分)与躯干所占总体表面积的系数(50%)和躯干部累及皮损的面积比例(A,0~6分)的乘积,即MPASI=0.5(Et +It+Dt)At,其最小值为0分,最大值为36分(表1)。
表1.
小鼠皮损面积及严重程度指数评分表
Tab.1 Psoriasis area and severity index in mice (MPASI)
| Score | Severity | Erythema (E) | Infitration (I) | Desquamation (D) | Area of psoriatic involvement (%) |
|---|---|---|---|---|---|
| 0 | None | No erythema | No infitration | No scales | 0 |
| 1 | Slight | Slight erythema | The injured skin is slightly raised. | Some of the injured skin is covered with fine scales. | <10 |
| 2 | Moderate | Moderate erythema |
The injured skin is moderately raised, and the edge of the plaque is round or sloping. |
Most of the injured skin is completely or incompletely covered with flaky scales. | 10-29 |
| 3 | Marked | Striking erythema | The injured skin is markedly raised and thickened. | Almost all of the injured skin is covered with thick and layered scales. | 30-49 |
| 4 | Very marked | Exceptionally striking erythema |
The injured skin is very markedly raised and thickened. |
All of the injured skin is covered with very thick and layered scales. | 50-69 |
| 5 | - | - | - | - | 70-89 |
| 6 | - | - | - | - | 90-100 |
MPASI=0.2(Eh+Ih+Dh)Ah+0.1(Eu+Iu+Du)Au+0.5(Et+It+Dt)At+0.1(El+I+D)Al+0.1(Ee+Ie+De)Ae.
1.2.3. 检测小鼠耳廓肿胀厚度
实验第1、9天,游标卡尺测量小鼠右耳耳廓厚度,测量3次取均值,测量时尽量选择靠近耳缘部位的耳中部皮肤,避免测量耳根部皮肤褶皱引起实验误差。耳廓肿胀厚度增加量(mm)=第9天耳廓厚度(mm)-第1天耳廓厚度(mm)。
1.2.4. HE染色检测小鼠组织病理学变化
取小鼠背部皮肤组织和右耳组织,4%多聚甲醛固定,常规脱水、石蜡包埋,连续厚4 μm切片,HE染色后封片。光学显微镜下评估PSO的组织病理学特征,包括过度角化、颗粒层变薄或消失、棘层肥厚、表皮波浪状起伏并向真皮下延伸,以及炎性细胞浸润等。
1.2.5. 观察小鼠抓挠行为学
通过观察小鼠10 min内抓挠次数判断各组小鼠皮肤的瘙痒严重程度。将小鼠置于透明观察笼中,适应10 min后,在安静环境下持续拍摄记录小鼠10 min内的挠痒情况,统计小鼠抓挠次数。小鼠举起前后爪、用嘴咬、挠耳朵连续抓挠造模区域1次或多次,然后将前后爪落在地上或收回时代表1次抓挠结束。前后爪、用嘴咬抓挠涂抹部位以外的其他部位皮肤不进行计数。
1.2.6. 计算小鼠脾脏指数
称量小鼠体质量,分离得到的脾脏,去除周围多余组织,于生理盐水中清洗去除血污,滤纸吸干水分,电子天平称量脾脏质量,计算脾脏指数。脾脏指数=脾脏质量(mg)/小鼠体质量(g)。
1.2.7. 甲苯胺蓝染色检测小鼠组织肥大细胞数量
取小鼠背部皮肤组织,4%多聚甲醛固定,常规脱水、石蜡包埋,连续厚4μm切片,用甲苯胺蓝染色后封片。光学显微镜下观察肥大细胞数量并计数。
1.2.8. ELISA法检测
小鼠眼眶采血,室温静置30 min后,3500 r/min离心10 min,分离血清,血清收集于1.5 mL EP管中,取1.2.4、1.2.7剩余小鼠背部皮肤组织,-80 ℃保存。按照ELISA试剂盒说明书分别检测免疫应激(IgG、IgM)、补体活化(CH50、C1s、C3、C3a、C5、C5a)、炎症反应(IL-23、IL-17A、TNF-α)相关因子水平。
1.3. 统计学分析
采用Graphpad Prism8.0.2软件进行统计分析,计量资料以均数±标准差表示,多组间比较采用单因素方差分析,多组间样本均数的两两比较采用Sidak法,P<0.05为差异有统计学意义。
2. 结果
2.1. 五谷虫降低PSO小鼠MPASI评分
与正常组相比,模型组小鼠造模处皮肤皮损肥厚,出现较多鳞屑且有红色斑痕,皮肤损伤严重,MPASI评分升高(P<0.001,图1);与模型组相比,五谷虫低、中、高剂量及本维莫德组小鼠皮肤损伤均有缓解,皮损组织厚度变薄,鳞屑和红色斑痕减少,MPASI评分降低(P<0.001,图1),五谷虫疗效呈现剂量-效应依赖关系。
图1.
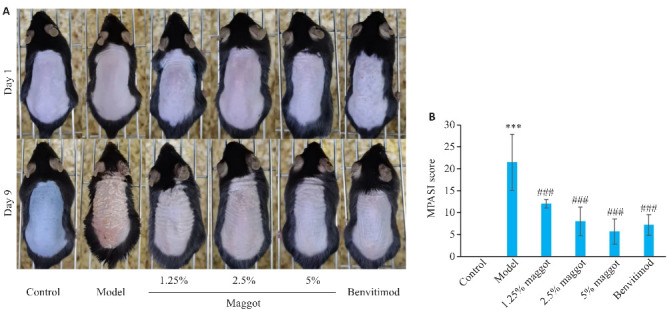
五谷虫对PSO小鼠MPASI评分的影响
Fig.1 Effect of maggot MPASI score in psoriasis (PSO) mice. A: Skin lesions on day 1 and day 9 in the groups. B: Maggot significantly decreased MPASI score in PSO mice (Mean±SD, n=6). ***P<0.001 vs Control group; ### P<0.001 vs Model group.
2.2. 五谷虫减少PSO小鼠耳廓肿胀厚度
与正常组相比,模型组小鼠造模处右耳耳廓出现较多鳞屑,耳廓肿胀厚度增加(P<0.001,图2);与模型组相比,五谷虫低剂量组,中、高剂量及本维莫德组小鼠右耳耳廓鳞屑减少,耳廓肿胀厚度减少(P<0.05,图2),五谷虫疗效呈现剂量-效应依赖关系。
图2.
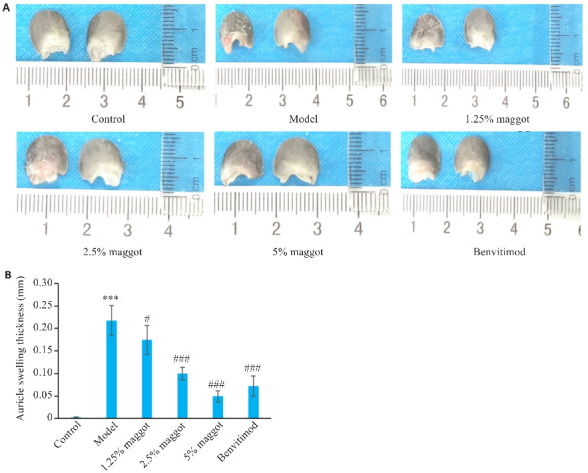
五谷虫对PSO小鼠耳廓肿胀厚度的影响
Fig.2 Effect of maggot on thickness of swelling auricle in PSO mice. A: Skin lesions in the right (shown on the left) and left ear (on the right) in mice. B: Maggot significantly decreased the auricle swelling thickness in PSO mice (Mean±SD, n=6). ***P<0.001 vs Control group; #P<0.05, ###P<0.001 vs Model group.
2.3. 五谷虫改善PSO小鼠背部皮肤和右耳组织病理学变化
小鼠背部皮肤组织和右耳组织HE染色结果显示(图3),正常组表皮结构完整清晰,表皮层较薄,细胞排列较为整齐紧密;真皮内胶原纤维交错排列,胞质红染、均匀;结缔组织与脂肪层结构清晰可见;皮下肌层肌纤维排列整齐,体积大小均一,细胞核形态正常,核仁多分布四周,未见明显病理变化。与正常组相比,模型组角质层过度角化、角化不全,颗粒层变薄或消失,表皮层棘层肥厚,表皮突延长、起伏,真皮层单核及多核细胞浸润,乳突上顶。与模型组相比,五谷虫低、中、高剂量及本维莫德组角质层过度角化、角化不全,颗粒层变薄或消失,表皮层棘层肥厚,表皮突延长、起伏,真皮层单核及多核细胞浸润,乳突上顶等情况均有所改善。
图3.
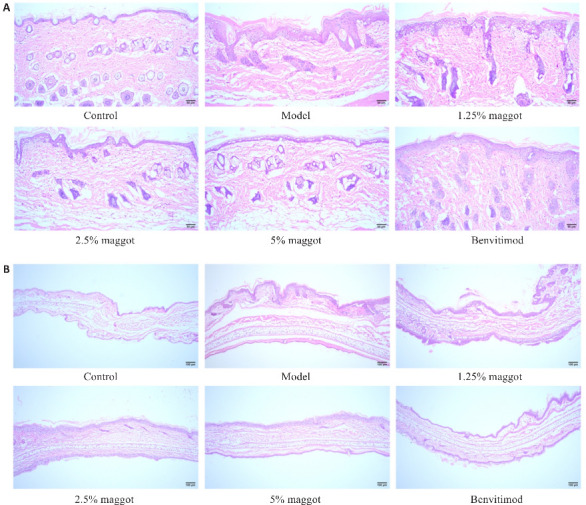
五谷虫对PSO小鼠组织病理学变化的影响
Fig.3 Effect of maggot on histopathological changes in PSO mice. A: Maggot significantly improved pathological changes of back skin lesions in PSO mice (Scale bar=50 μm). B: Maggot significantly improved pathological changes in right ear lesions in PSO mice (Scale bar=100 μm).
2.4. 五谷虫改善PSO小鼠抓挠行为学
与正常组相比,模型组小鼠皮肤瘙痒程度严重,精神烦躁不安,抓挠、撕咬、舔舐造模区域皮肤等行为次数增多(P<0.001,图4);与模型组相比,五谷虫低剂量组,中、高剂量及本维莫德组小鼠的皮肤瘙痒程度得到改善,抓挠、撕咬、舔舐造模区域皮肤等行为次数减少(P<0.01,图4),五谷虫疗效呈现剂量-效应依赖关系。
图4.
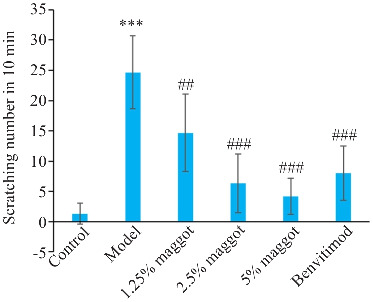
五谷虫对PSO小鼠抓挠行为学的影响
Fig.4 Maggot significantly decreased the number of scratching of PSO mice (Mean±SD, n=6). ***P<0.001 vs Control group; ## P<0.01, ### P<0.001 vs Model group.
2.5. 五谷虫降低PSO小鼠脾脏指数
与正常组相比,模型组小鼠脾脏颜色变黑,体积肿大明显,脾脏指数升高(P<0.001,图5);与模型组相比,五谷虫低、中、高剂量及本维莫德组小鼠脾脏体积明显缩小,脾脏指数降低(P<0.001,图5),五谷虫疗效呈现剂量-效应依赖关系。
图5.
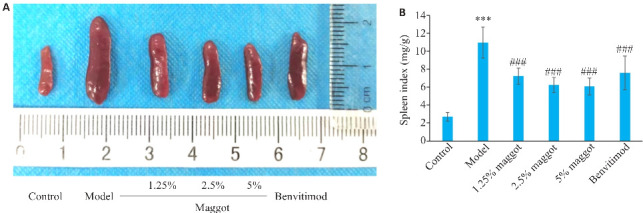
五谷虫对PSO小鼠脾脏指数的影响
Fig.5 Effect of maggot on spleen index in PSO mice. A: Comparison of mice spleen. B: Maggot significantly decreased the spleen index in PSO mice (Mean±SD, n=6). ***P<0.001 vs Control group; ### P<0.001 vs Model group.
2.6. 五谷虫减少PSO小鼠组织肥大细胞数量
与正常组相比,模型组小鼠组织肥大细胞数量增加(P<0.001,图6);与模型组相比,五谷虫低剂量组,中、高剂量组及本维莫德组小鼠组织肥大细胞浸润情况改善,肥大细胞数量减少(P<0.01,图6),五谷虫疗效呈现剂量-效应依赖关系。
图6.
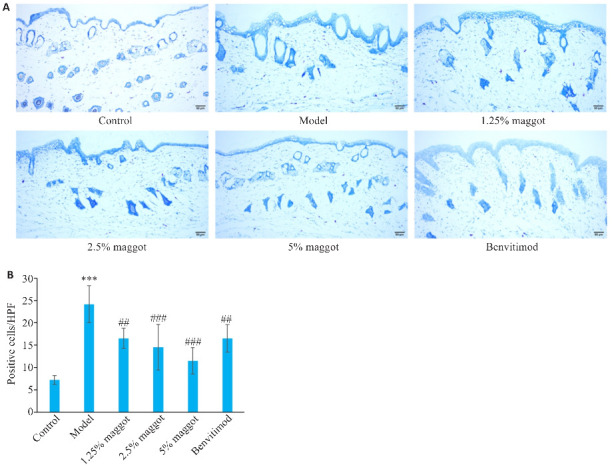
五谷虫对PSO小鼠组织肥大细胞数量的影响
Fig.6 Effect of maggot on the number of mast cells in PSO mice. A: Toluidine blue staining of dorsal skin lesions in mice (Scale bar=50 μm). B: Maggot significantly decreased the number of mast cells in PSO mice (Mean±SD, n=6). ***P<0.001 vs Control group; ##P<0.01, ###P<0.001 vs Model group.
2.7. 五谷虫降低PSO小鼠免疫应激相关因子水平
与正常组相比,模型组小鼠血清IgG水平升高(P<0.001),IgM水平有升高趋势,但差异无统计学意义(图7);与模型组相比,五谷虫高剂量及本维莫德组小鼠血清IgG水平降低(P<0.01,图7)。
图7.
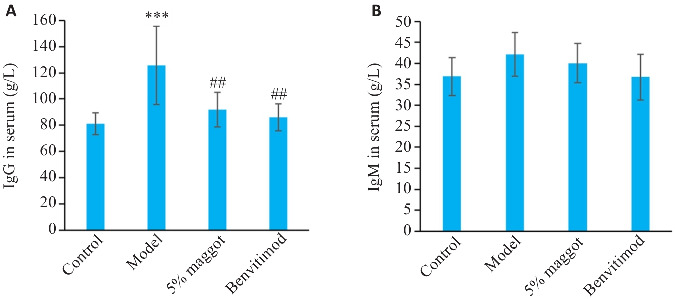
五谷虫对PSO小鼠免疫应激相关因子水平的影响
Fig.7 Effect of maggot on serum levels of IgG (A) and IgM (B) in PSO mice (Mean±SD, n=6). ***P<0.001 vs Control group; ## P<0.01 vs Model group.
2.8. 五谷虫降低PSO小鼠补体活化相关因子水平
与正常组相比,模型组小鼠血清CH50、C3、C5水平降低(P<0.001,图8A~C),C1s、C3a、C5a水平升高(P<0.001,图8D~F);与模型组相比,五谷虫高剂量组小鼠血清CH50、C3、C5水平升高(P<0.01,图8A~C),C1s、C3a、C5a水平降低(P<0.05,图8D~F);本维莫德组小鼠血清CH50、C3水平升高(P<0.05),C5水平有升高趋势,但差异无统计学意义(图8A~C),C3a、C5a水平降低(P<0.05),C1s水平有降低趋势,但差异无统计学意义(图8D~F)。
图8.
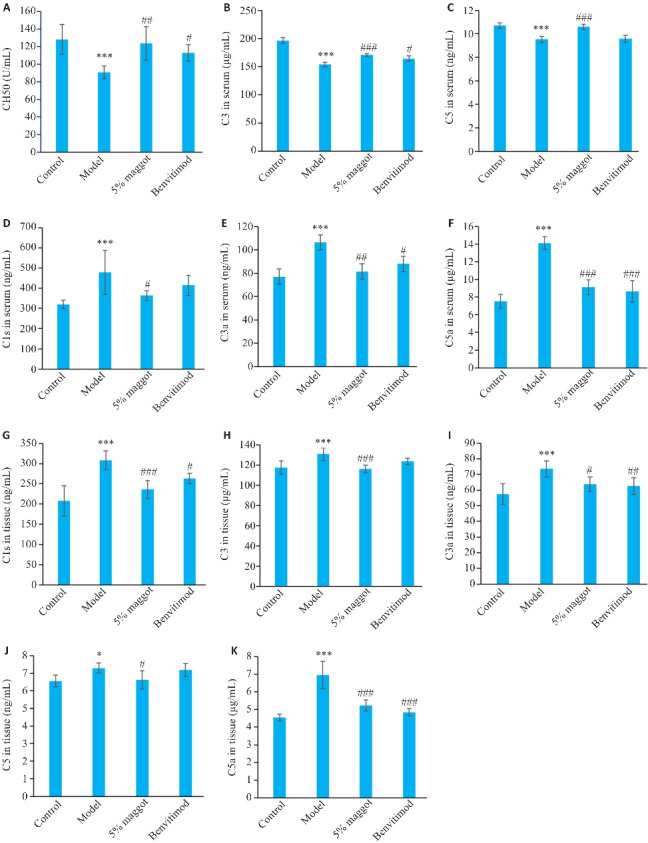
五谷虫对PSO小鼠补体活化相关因子水平的影响
Fig.8 Effect of maggot on levels of complements in PSO mice (Mean±SD, n=6). A-F: Serum levels of CH50, C3, C5, C1s, C3a and C5a. G-K: C1s, C3, C3a, C5 and C5a contents in the skin tissue. *P<0.05, ***P<0.001vs Control group; # P<0.05, ## P<0.01, ### P<0.001 vs Model group.
与正常组相比,模型组小鼠组织C1s、C3、C3a、C5、C5a水平升高(P<0.05,图8G~K);与模型组相比,五谷虫高剂量组小鼠组织C1s、C3、C3a、C5、C5a水平降低(P<0.05,图8G~K);本维莫德组小鼠组织C1s、C3a、C5a水平降低(P<0.05),C3、C5水平有降低趋势,但差异无统计学意义(图8G~K)。
2.9. 五谷虫降低PSO小鼠炎症反应相关因子水平
与正常组相比,模型组小鼠血清IL-23、IL-17A、TNF-α水平升高(P<0.01,图9);与模型组相比,五谷虫高剂量及本维莫德组小鼠血清IL-23、IL-17A、TNF-α水平降低(P<0.05,图9)。
图9.
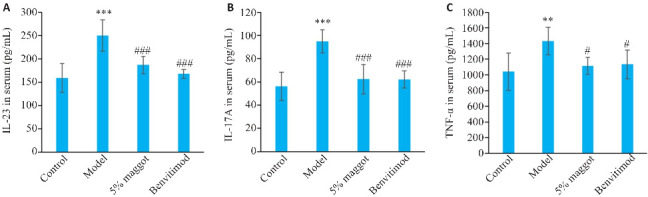
五谷虫对PSO小鼠炎症反应相关因子水平的影响
Fig.9 Effect of maggot on serum levels IL-23 (A), IL-17A (B) and TNF-α (C) in PSO mice (Mean±SD, n=6). **P<0.01, ***P<0.001 vs Control group; # P<0.05, ### P<0.001 vs Model group.
3. 讨论
中医称PSO为“白疕”,多因情绪不畅或饮食失节、素体阳热偏盛,加之外感邪毒,毒热入血而发病,临床辨证多从血论治。隋·巢元方所著《诸病源候论》记载,PSO病机发生发展在“血热”的基础上,与“毒”“瘀”“虚”密切相关,热邪壅盛产毒,久病入络成瘀,慢性反复发作性疾病本质为虚,治疗以清热解毒,活血化瘀,调和气血为主要原则[12]。五谷虫其味咸、甘,性寒,具有清热,消滞等功效[9],可能通过清血之热毒,化络脉之瘀,从而发挥治疗PSO作用。
研究表明,五谷虫在慢性创面治疗中具有较高的价值,在清创的同时还具有调节免疫、抑制补体活化、抗炎等作用[10]。五谷虫提取物通过抑制核因子-κB(NF-κB)和丝裂原活化蛋白激酶(MAPK)信号通路的激活,进而抑制辅助性T细胞1(Th1)、辅助性T细胞17(Th17)及干扰素-γ(IFN-γ)、IL-17A等炎性因子的表达,从而显著缓解特应性皮炎模型小鼠的皮肤炎症,提示五谷虫具有抗炎、免疫调节等作用[13]。五谷虫可通过升高环腺苷酸抑制人单核细胞的促炎症反应,也可以抑制多种中性粒细胞促炎症反应[14]。五谷虫分泌物可抑制促炎介质和补体系统组分的产生和表达,并可抑制嗜中性粒细胞向创面区域迁移。研究结果证实五谷虫分泌物主要是通过抑制创面炎症反应,抑制组织分解从而共同达到促进创面愈合的效果[15]。
PSO皮疹好发于头皮、背部和四肢伸侧,典型表现为界限清楚的暗红色斑块或浸润性红斑,上附白色、银白色鳞屑[2]。采用改良的MPASI法评估PSO小鼠皮损严重程度。研究表明,给予IMQ连续诱导8 d,造模完成时小鼠表现出典型的PSO皮损特征,MPASI评分较正常组显著升高[16]。本研究结果显示,连续8 d给予IMQ后,小鼠造模区域皮肤红斑、浸润、鳞屑等皮损症状显著增多,MPASI评分显著升高,提示IMQ成功诱导出小鼠严重PSO样皮损症状;给予五谷虫治疗后,小鼠造模区域皮肤红斑、浸润、鳞屑、皮损面积等皮损症状明显减少,MPASI评分显著降低,且存在剂量-效应依赖关系,并不劣于本维莫德,提示五谷虫具有一定治疗皮肤损伤效果,可能与其具有促创面愈合及组织重建和再生功效有关。
IMQ诱导的PSO小鼠模型可模拟与人类相似的PSO病程及组织病理学症状,如表皮增生、角化不全、棘层肥大、组织增厚等[17]。故本研究采用IMQ诱导小鼠PSO模型。本研究显示,给予IMQ后,PSO小鼠造模区域皮肤出现角质层过度角化、角化不全,颗粒层变薄或消失,表皮层棘层肥厚,表皮突延长、起伏,真皮层单核及多核细胞浸润,乳突上顶等病理变化,耳廓肿胀厚度显著增加,这与Zheng等[8]采用IMQ诱导小鼠PSO模型病理结果一致,提示IMQ成功诱导出小鼠PSO模型;给予五谷虫治疗后,PSO小鼠造模区域皮肤病理变化均得到有效改善、耳廓肿胀厚度显著降低,且存在剂量-效应依赖关系,并不劣于本维莫德,提示五谷虫具有一定改善PSO组织病理变化效果,可能与其抗炎功效有关。
临床研究表明64%~97%的PSO患者主诉瘙痒,且呈周期性、泛发性的特点[18]。给予IMQ诱导小鼠PSO模型,记录小鼠10 min内的抓挠次数,发现模型组小鼠抓挠次数较正常组显著增多;给予药物治疗后,给药组小鼠抓挠次数较模型组显著减少,瘙痒症状缓解[19]。本研究显示,给予IMQ后,PSO小鼠抓挠、撕咬、舔舐造模区域皮肤等行为明显活跃且抓挠次数显著增加,提示IMQ诱导可导致小鼠皮肤瘙痒;给予五谷虫治疗后,PSO小鼠抓挠、撕咬、舔舐造模区域皮肤等行为明显减少,抓挠次数显著减少,且存在剂量-效应依赖关系,并不劣于本维莫德,提示五谷虫具有一定止痒效果,可能与其具有清热功效有关。
脾脏可产生多种免疫活性细胞因子,脾脏指数的升高,说明机体炎症免疫反应激活了脾脏细胞增殖,在某种水平上反应机体的免疫功能异常[20]。IMQ诱导的PSO小鼠脾脏明显肿大,脾脏指数显著升高;给予药物治疗后,给药组小鼠脾脏指数显著降低[21]。本研究显示,给予IMQ后,PSO小鼠脾脏明显肿大,脾脏指数显著升高,提示IMQ诱导了PSO中免疫功能异常症状,可以使免疫系统亢进;给予五谷虫治疗后,PSO小鼠脾脏体积明显缩小,脾脏指数显著降低,且存在剂量-效应依赖关系,并不劣于本维莫德,提示五谷虫具有一定抑制免疫系统亢进效果,可能与其具有免疫调节功效有关。
肥大细胞是天然免疫细胞[22],作为PSO皮损中最先出现的细胞,疾病初期时大量堆积于毛细血管周围,当被激活后可诱导产生PSO皮损。给予IMQ诱导小鼠PSO模型,模型组小鼠皮肤组织水肿情况严重,肥大细胞数激增;给予药物治疗后,给药组小鼠水肿情况较模型组有不同程度减轻,肥大细胞数减少明显,浸润情况改善[23]。本研究给予IMQ后,PSO小鼠背部皮肤中肥大细胞数量显著增多,提示IMQ诱导PSO中肥大细胞过度激活;给予五谷虫治疗后,肥大细胞浸润情况显著改善,数量显著减少,且存在剂量-效应依赖关系,并不劣于本维莫德,提示五谷虫可能通过抑制肥大细胞激活而对PSO发挥治疗效果。
IgG、IgM主要分布于血清中,具有激活补体、免疫调节等功能。通常情况下IgM产生早,一经机体免疫应答,快速产生,维持时间短,消失快,血液中检测阳性可作为早期免疫应答的指标。IgG是再次免疫应答的产物,出现时间较晚,维持时间长,消失慢[24]。IgG、IgM均可激活补体系统的经典途径[25]。PSO患者血清IgG的水平值比正常人群要高;而IgM的水平值报告不尽一致,可能与受试人群及PSO发病进程有关[24]。本研究显示,给予IMQ后,PSO小鼠血清IgG水平显著升高,IgM水平有增加趋势,但无显著性差异,可能由于IgM是早期免疫应答过程中产生的抗体,随着疾病进展,因消耗增多而逐步下降,IgG的升高可以反应炎症反应一直存在,免疫反应持续激活,提示IMQ通过升高IgG水平诱导了PSO中免疫应激症状;给予五谷虫治疗后,PSO小鼠血清IgG水平显著降低,提示五谷虫具有一定抑制免疫应激作用。
补体是皮肤免疫系统中体液成分的重要物质,被激活后可产生一系列复杂的生物学效应,参与多种皮肤病的发生发展。CH50反映补体固有成分C1~C9的综合水平,临床上主要用于评估机体免疫功能。补体活化、被大量消耗会导致补体成分减少,引起CH50降低,可用于评估补体系统是否被激活[26]。C3、C5是补体活化过程中发挥生物学功能重要的补体成分,且C3在补体中含量最多。当机体补体系统发生异常或过度激活后,C3、C5裂解产生大量过敏毒素C3a、C5a促进PSO的发生发展。补体裂解产物C3a、C5a的产生情况可以反映补体的活化程度[27]。补体活化引起大量C3裂解为C3a,C5裂解为C5a,C3、C5含量下降,导致CH50含量下降,补体活化产物C3a、C5a含量升高[28]。本研究显示,给予IMQ后,模型组小鼠血清补体活化相关因子CH50、C3、C5水平显著降低,C1s、C3a、C5a水平显著升高;组织补体活化相关因子C1s、C3、C3a、C5、C5a水平显著升高。这提示IMQ使大量C3裂解为C3a,C5裂解为C5a诱导了PSO中补体活化症状,对于PSO患者组织C3升高,有研究[29]用直接免疫荧光(DIF)法证实PSO患者皮损中有免疫沉积物,在皮肤角质层内存在抗原-抗体-补体反应,推测PSO患者组织C3升高可能是因为血清C3沉积皮损处造成的。对于PSO患者组织C5升高,C5也可沉积于皮损处[30]。综上所述,PSO患者组织C3、C5升高可能是由于血清C3、C5沉积皮损处造成的。本研究给予五谷虫治疗后,PSO小鼠血清CH50、C3、C5水平显著升高,血清C1s、C3a、C5a水平显著降低;组织C1s、C3、C3a、C5、C5a水平显著降低,提示五谷虫具有一定抑制补体活化效果。
部分适应性免疫系统的过度激活被认为是PSO发病的核心[31]。C3a和C5a可通过与其受体结合,诱导多种细胞分泌IL-23、IL-17A、TNF-α等炎性因子参与炎症调节,影响PSO的发生发展。给予IMQ诱导,PSO小鼠血清IL-23、IL-17A、TNF-α水平显著升高;给予药物治疗后,给药组小鼠血清IL-23、IL-17A、TNF-α水平显著降低,机体炎症反应程度显著减轻[32]。本研究显示,给予IMQ后,PSO小鼠血清IL-23、IL-17A、TNF-α水平显著升高,表明血清炎性因子处于激活状态,提示机体炎症反应程度较重;给予五谷虫治疗后,血清IL-23、IL-17A、TNF-α水平显著降低,提示五谷虫具有一定抗炎效果。
综上所述,本文研究了五谷虫对IMQ诱导的PSO小鼠的药效学及作用机制。五谷虫抑制IMQ诱导机体过度免疫反应引发的高IgG水平,进而抑制IgG激活补体系统经典途径,从而抑制大量C3、C5裂解产生过敏毒素C3a、C5a与其受体结合促进炎症反应,降低促炎因子IL-23、IL-17A、TNF-α的释放,降低PSO小鼠体内免疫应激、补体活化及炎症反应水平,最终发挥PSO治疗作用。本研究初步阐明了五谷虫调控免疫应激-补体活化途径治疗PSO的药效学及作用机制,为临床使用五谷虫治疗PSO提供理论依据和实验支撑。
基金资助
上海市2022年度“科技创新行动计划”生物医药科技支撑专项(22S21902600)
参考文献
- 1. 中华医学会皮肤性病学分会银屑病专业委员会 . 中国银屑病诊疗指南(2023版)[J]. 中华皮肤科杂志, 2023, 56(7): 573-625. [Google Scholar]
- 2. Griffiths CEM, Armstrong AW, Gudjonsson JE, et al. Psoriasis[J]. Lancet, 2021, 397(10281): 1301-15. [DOI] [PubMed] [Google Scholar]
- 3. Schett G, McInnes IB, Neurath MF. Reframing immune-mediated inflammatory diseases through signature cytokine hubs[J]. N Engl J Med, 2021, 385(7): 628-39. [DOI] [PubMed] [Google Scholar]
- 4. Hirobe S, Yamasaki T, Ito S, et al. Transcutaneous administration of imiquimod promotes T and B cell differentiation into effector cells or plasma cells[J]. Pharmaceutics, 2022, 14(2): 385. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Cyster JG, Allen CDC. B cell responses: cell interaction dynamics and decisions[J]. Cell, 2019, 177(3): 524-40. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Mastellos DC, Hajishengallis G, Lambris JD. A guide to complement biology, pathology and therapeutic opportunity[J]. Nat Rev Immunol, 2024, 24(2): 118-41. [DOI] [PubMed] [Google Scholar]
- 7. Qiao P, Zhi DL, Yu C, et al. Activation of the C3a anaphylatoxin receptor inhibits keratinocyte proliferation by regulating keratin 6, keratin 16, and keratin 17 in psoriasis[J]. FASEB J, 2022, 36(5): e22322. [DOI] [PubMed] [Google Scholar]
- 8. Zheng QY, Liang SJ, Xu F, et al. C5a/C5aR1 pathway is critical for the pathogenesis of psoriasis[J]. Front Immunol, 2019, 10: 1866. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. 蔺 瑞, 边海旭, 郭 超, 等. 五谷虫的药理作用研究进展[J]. 中国药房, 2017, 289(4): 558-61. DOI: 10.6039/j.issn.1001-0408.2017.04.35 [DOI] [Google Scholar]
- 10. 张 玮, 石晓丽, 刘一凡, 等. 中药五谷虫活性肽-酶类化学成分研究进展[J]. 时珍国医国药, 2022, 33(8): 1978-82. 35870187 [Google Scholar]
- 11. Shamloul G, Khachemoune A. Reappraisal and updated review of maggot debridement therapy in chronic lower extremity ulcers[J]. Int J Dermatol, 2023, 62(7): 962-8. [DOI] [PubMed] [Google Scholar]
- 12. 杭小涵, 李 雪, 李 楠, 等. 基于p38MAPK/NF-κB信号通路探讨外用应急软膏治疗银屑病的机制研究[J]. 世界临床药物, 2023, 44(3): 215-9, 251. DOI: 10.13683/j.wph.2023.03.004 [DOI] [Google Scholar]
- 13. Peng F, Zong J, Zhao T, et al. Anti-inflammatory and immunomodulatory effects of polysaccharide extracted from Wuguchong (maggot) on 2, 4-dinitrochlorobenzene-induced atopic dermatitis in mice[J]. Front Pharmacol, 2023, 14: 1119103. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. van der Plas MJ, van der Does AM, Baldry M, et al. Maggot excretions/secretions inhibit multiple neutrophil pro-inflammatory responses[J]. Microbes Infect, 2007, 9(4): 507-14. [DOI] [PubMed] [Google Scholar]
- 15. Cazander G, Schreurs MW, Renwarin L, et al. Maggot excretions affect the human complement system[J]. and, 2012, 20(6): 879-86. [DOI] [PubMed] [Google Scholar]
- 16. 张海龙, 安月鹏, 崔晓倩, 等. 通过调控滤泡性辅助性T细胞亚群研究蜈蚣败毒饮治疗银屑病模型鼠的机制[J]. 中国皮肤性病学杂志, 2022, 36(8): 890-7. DOI: 10.13735/j.cjdv.1001-7089.202111204 [DOI] [Google Scholar]
- 17. Zhao F, Wang YJ, Zuo HJ, et al. Cyclin-Dependent kinase 9 (CDK9) inhibitor Atuveciclib ameliorates Imiquimod-Induced Psoriasis-Like dermatitis in mice by inhibiting various inflammation factors via STAT3 signaling pathway[J]. Int Immunopharmacol, 2024, 129: 111652. [DOI] [PubMed] [Google Scholar]
- 18. 郭智玮, 晋红中. 银屑病伴瘙痒的临床特点、发病机制及治疗研究进展[J]. 中华皮肤科杂志, 2020, 53(12): 1029-32. DOI: 10.35541/cjd.20190683 [DOI] [Google Scholar]
- 19. 何亚男, 蔡 翔, 邱百怡, 等. 穿心莲内酯调节cGAS-STING信号通路对银屑病小鼠的治疗作用[J]. 天津医药, 2024, 52(4): 379-86. [Google Scholar]
- 20. Sulthana S, Chary PS, Bhavana V, et al. Development and evaluation emulgel for effective management of the imiquimod-induced psoriasis[J]. Inflammopharmacology, 2023, 31(1): 301-20. [DOI] [PubMed] [Google Scholar]
- 21. Zhang S, Zhang J, Yu JJ, et al. Hyperforin ameliorates imiquimod-induced psoriasis-like murine skin inflammation by modulating IL-17A-producing γδ T cells[J]. Front Immunol, 2021, 12: 635076. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. Zhang YJ, Shi YQ, Lin JX, et al. Immune cell infiltration analysis demonstrates excessive mast cell activation in psoriasis[J]. Front Immunol, 2021, 12: 773280. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23. 张 喻, 向雪川, 周正繁, 等. 龙珠软膏对银屑病模型小鼠治疗作用的研究[J]. 中国医院药学杂志, 2023, 43(8): 897-902, 909. DOI: 10.13286/j.1001-5213.2023.08.12 [DOI] [Google Scholar]
- 24. Syzon OO, Dashko MO, Fedorova UV. Modern specific features and therapy of psoriasis and arthropathic psoriasis courses[J]. Wiad Lek, 2018, 71(2 pt 1): 322-5. [PubMed] [Google Scholar]
- 25. Giang J, Seelen MAJ, van Doorn MBA, et al. Complement activation in inflammatory skin diseases[J]. Front Immunol, 2018, 9: 639. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Costabile M. Measuring the 50% haemolytic complement (CH50) activity of serum[J]. J Vis Exp, 2010(37): 1923. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. Laumonnier Y, Karsten CM, Köhl G, et al. Characterization of anaphylatoxin receptor expression and C3a/C5a functions in anaphylatoxin receptor reporter mice[J]. Curr Protoc Immunol, 2020, 130(1): e100. [DOI] [PubMed] [Google Scholar]
- 28. Ling M, Murali M. Analysis of the complement system in the clinical immunology laboratory[J]. Clin Lab Med, 2019, 39(4): 579-90. [DOI] [PubMed] [Google Scholar]
- 29. Hashimoto T, Tsuruta D, Yasukochi A, et al. Granular C3 dermatosis[J]. Acta Derm Venereol, 2016, 96(6): 748-53. [DOI] [PubMed] [Google Scholar]
- 30. Ring J, Senter T, Cornell RC, et al. Complement and immunoglobulin deposits in the skin of patients with atopic dermatitis[J]. Br J Dermatol, 1978, 99(5): 495-501. [DOI] [PubMed] [Google Scholar]
- 31. Armstrong AW, Read C. Pathophysiology, clinical presentation, and treatment of psoriasis: a review[J]. JAMA, 2020, 323(19): 1945-60. [DOI] [PubMed] [Google Scholar]
- 32. Liu LJ, Zhang HL, Tang XR, et al. Geniposide ameliorates psoriatic skin inflammation by inhibiting the TLR4/MyD88/NF‑κB p65 signaling pathway and MMP9[J]. Int Immunopharmacol, 2024, 133: 112082. [DOI] [PubMed] [Google Scholar]


