Abstract
目的
探讨孤立性侧脑室扩张胎儿孕妇羊水外泌体中的微小RNA(miRNA)的差异表达,对其靶基因进行预测分析。
方法
收集2021年9月~2024年5月在南方医科大学南方医院产前超声诊断为胎儿中度孤立性侧脑室扩张的孕妇羊水样本9例,和由于高龄或唐筛高风险行羊水穿刺的正常胎儿对照组的孕妇羊水样本8例。分离羊水外泌体,运用miRNA测序技术筛选两组羊水外泌体中的差异表达miRNA,并从中挑选3个在对照和样本组中的表达差异显著,且文献报道参与的信号通路和侧脑室关联的miRNA进行qPCR验证测序结果。对显著差异表达的TOP 40个miRNA进行靶基因预测及功能分析(GO)和信号通路分析(KEGG)。通过双荧光素酶报告基因技术验证miR-122-5p对预测靶基因AKT3和CCDC88C的调控。
结果
与对照组相比,侧脑室扩张组中存在272个显著差异表达miRNA,其中表达上调的有43个,表达下调的有229个。GO分析发现靶基因主要功能与转录因子结合、转运蛋白活性、神经系统过程、跨膜运输等有关。KEGG通路分析发现富集显著的功能通路包括有MAPK信号通路、Wnt信号通路、配体-受体神经活性互作和细胞因子-细胞因子受体互作等。qPCR验证结果发现,与对照组相比,miR-122-5p表达显著下降(P<0.05),与测序结果一致;而let-7b-5p的表达病例组较对照组下调,与测序结果相反。双荧光素酶报告基因检测结果显示miR-122-5p不调控AKT3和CCDC88C的表达。
结论
羊水外泌体中高丰度差异表达的miRNAs可能通过参与MAPK信号通路、PI3K-Akt信号通路、Wnt信号通路和cGMP-PKG通路在胎儿侧脑室扩张的发生发展中发挥作用。
Keywords: 孤立性侧脑室扩张, 羊水, 外泌体, 微小RNA
Abstract
Objective
To investigate the role of miRNAs in maternal amniotic fluid exosomes in development of isolated ventriculomegaly (VM) in fetuses.
Methods
Amniotic fluid samples were collected from 9 cases of moderate isolated VM and 8 normal control cases to extract exosomal miRNA, and miRNA sequencing technique was used to identify differentially expressed miRNAs between the two groups. Three miRNAs with significant differential expression between the two groups, whose high expression was associated with VM, were selected for verification with RT-qPCR. Dual luciferase reporter assays were used to verify the regulatory effect of miR-122-5p on its predicted target genes AKT3 and CCDC88C. Gene ontology (GO) and KEGG pathway analyses were performed to explore the possible roles of the top 40 significant differential miRNAs in the pathophysiology of VM.
Results
We identified a total of 272 differentially expressed miRNAs in VM cases, including 43 up-regulated and 229 down-regulated miRNAs. The target genes of these differential miRNAs were associated with DNA and transcription factor binding, transmembrane transporter and nucleic acid binding transcription factor activity, and cell developmental process. These miRNAs were mostly enriched in the MAPK, cGMP-PKG and Wnt signaling pathways. Verification with RT-qPCR showed that miR-122-5p expression level was significantly lower in VM group than in the control group (P<0.05), which was consistent with miRNA sequencing results; let-7b-5p expression level was significantly lower in VM group, which was contrary to miRNA sequencing result. Dual luciferase reporter assays showed that miR-122-5p was not capable of regulating AKT3 or CCDC88C expressions.
Conclusions
The highly abundant differentially expressed miRNAs in maternal amniotic fluid exosomes play important roles in the occurrence of fetal VM possibly by regulating the MAPK, PI3K-Akt, Wnt and cGMP-PKG signaling pathways.
Keywords: fetal isolated ventriculomegaly, amniotic fluid, exosomes, miRNA
侧脑室扩张(VM)是胎儿发育中大脑侧脑室液体过量所致[1],它是产前超声检查中最常见的脑部异常,是胎儿脑发育异常的标志之一[2]。正常侧脑室宽度在中晚期较稳定,为6~8 mm,产前超声检测侧脑室内径≥10 mm时,称为侧脑室扩张[3]。胎儿侧脑室扩张的发病率为0.78%~2.20%,其原因多样,感染、畸形、染色体异常、脑脊液循环障碍、脑室周围损伤都会导致胎儿脑室扩张。孤立性侧脑室扩张是指产前超声检查中除侧脑室扩张外未发现任何其他颅内或颅外畸形[4]。目前研究显示[5],侧脑室严重扩张者和持续进展的侧脑室扩张者易合并其他颅内畸形和染色体疾病,是造成胎儿流产和死产的原因之一,出生后神经系统发育异常的风险也明显增高。
外泌体广泛存在于外周血液、唾液、尿液、脑脊液、腹水等人体各种体液中,含量较高且容易获取。外泌体携带的蛋白质,微小RNA(miRNA)和其它RNA片段,能够参与细胞之间的物质传导和信号交流[6]。自2007年Valadi等[7]首次报道外泌体中的miRNA和转运RNA(mRNA)是细胞间遗传交换的一种新机制以来,学者对外泌体miRNA的研究逐渐深入。相比较mRNA,富集于外泌体中的miRNA更稳定,不容易被内源性核糖核酸酶降解,这些特性使外泌体miRNA可作为最佳的生物标志物。在孕妇妊娠过程中,脐血,胎盘,羊水和羊膜都可以分泌外泌体,可作为孕期新的诊断标志物和治疗靶标[8]。羊水是羊膜腔内包围胎儿的动态的生物液体,是胎儿胃肠道、肺部、胎盘和羊膜细胞的分泌物,为胎儿提供所需的机械保护和营养[9],羊水的转录组学可作为潜在的胎儿疾病的指导[10]。外泌体是重要的生物学功能的介质,可以反映亲本细胞的健康状况。因此,羊水中的外泌体可提供重要的诊断信息[11]。近年来,虽然外泌体的研究已广泛开展,但羊水外泌体miRNA的研究还非常有限。目前报道的有对唐氏综合症胎儿孕妇羊水外泌体miRNA的差异表达谱分析[12, 13],对先天性肾盂积水孕妇羊水外泌体miRNA的研究[14, 15],室间隔缺损胎儿孕妇羊水外泌体的全转录组分析[16],对子痫和正常妊娠孕妇的羊水外泌体标志物表达的检测来探讨子痫表型和羊水外泌体miRNA的关联[17],及对严重先天性膈疝胎儿患者的孕妇羊水和胎儿气管液体外泌体miRNA的特征及与产后结局的关联分析[18],目前国内外尚未发现侧脑室扩张胎儿孕妇羊水外泌体miRNA的相关研究报道。侧脑室扩张可以影响胎儿或新生儿神经发育及预后,它是评估神经系统功能的重要指标之一。侧脑室扩张胎儿的临床转归和神经发育预后是临床关注的热点,目前的研究主要集中在产前诊断、遗传学原因,妊娠结局和出生后的神经发育,侧脑室扩张胎儿在产前胎儿发育过程中的发病机制的研究还很少。由于羊水中的外泌体miRNA可以反映胎儿的疾病情况,且人体miRNA中70%为神经源性miRNA,其与中枢神经系统的关联非常密切[19]。本研究对侧脑室扩张和正常胎儿孕妇羊水外泌体的miRNA表达谱进行分析,筛选差异表达miRNA,采用实时定量qPCR技术验证差异表达,并利用双荧光素酶活性检测技术分析目的miRNA和靶基因的调控关系,为进一步研究胎儿侧脑室扩张的发病机制及转归提供理论基础和新思路。
1. 资料和方法
1.1. 研究对象
羊水标本收集于南方医科大学南方医院,患者为2021年9月~2024年5月在我院胎儿医学门诊就诊的孕妇,均具有行羊膜腔穿刺术的指征。纳入标准:病例组为产前超声检查提示胎儿侧脑室中度扩张≥12 mm的单胎妊娠孕妇,对照组为穿刺原因仅为唐筛高风险或高龄的孕妇。排除标准为:双胎妊娠;合并其他脑部发育异常;孕妇具妊娠合并症及并发症;染色体核型和基因芯片检测染色体异常;羊水检测TORCH感染阳性。研究对象共17例,病例组9例(年龄25.5±3.8岁,孕周28.5±2.8周),对照组8例(年龄31.3±7.6岁,孕周19.4±2.0周)。本研究经南方医科大学南方医院伦理委员会批准(伦理批号:NFEC-202109-K15),所有参与者均已签署知情同意书。
1.2. 研究方法
1.2.1. 羊水外泌体的分离
超净工作台中取实验组和对组照羊水样本8 mL,2000×g,4 ℃,20 min离心;取上清,10 000×g,4 ℃,30 min离心;取上清,过0.45 μm滤膜;过滤液100 000×g,4 ℃,70 min离心;去掉上清,10 mL预冷的PBS重悬,然后100 000×g,4 ℃,70 min再次离心;去掉上清,150 μL预冷的PBS重悬;所得即为外泌体溶液。
1.2.2. 羊水外泌体的鉴定
1.2.2.1 磷钨酸负染透射电子显微镜法观察外泌体形态 移液器吸取10 μL外泌体悬液样本到Parafilm 封口膜上,载膜铜网正面朝下,自然吸附悬液10~15 min,滤纸条吸除多余液滴,晾干;移液器吸取2%磷钨酸溶液10 μL,滴于封口膜上,吸附完成的铜网正面倒扣在染色液上静置3~5 min;滤纸条吸除多余液滴,白炽灯下晾干;透射电子显微镜下观察拍照。
1.2.2.2. ZetaView纳米颗粒跟踪分析技术检测外泌体的粒径和浓度
纯水清洗样本池,标准品聚苯乙烯微球(100 nm PS beads)校准,校准完成后1×PBS清洗样本池,样本用1×PBS稀释后加入到样本池,ZetaViewParticle Metrix(PMX-120)观察外泌体颗粒实时动态影像。
1.2.2.3. 蛋白质免疫印迹检测外泌体标志蛋白
外泌体与RIPA裂解液按体积1∶1混匀,冰上裂解10 min,4 ℃以12 000 g离心5 min取上清,按照BCA蛋白测定试剂盒(Beyotime,增强型)说明书检测外泌体总蛋白。取15 μL上清约15 μg总蛋白上样,行SDS-PAGE(10%),电泳结束后转移蛋白至PVDF膜,5%脱脂奶粉的TBST封闭1 h,分别加入TSG101(DLM 1∶1000);CD9(DLM 1∶500);CD63(DLM 1∶2000);和CD81(Proteintech 1∶1000)抗体,4 ℃摇床孵育过夜。第2天用TBST洗膜后加入辣根过氧化物酶标记的Ⅱ抗HRP-conjugated Affinipure Goat Anti-Mouse IgG(H+L) (Proteintech1∶6000),室温孵育30min,TBST 洗膜3次,5 min/次,ECL(Share-bio,SB-WB011)发光成像。Image Lab图像分析软件对每个条带灰度值进行定量分析。
1.2.3. 羊水外泌体的miRNA测序和生物信息学分析
采用HiPure总RNA小量抽提试剂盒(美基生物)提取外泌体总RNA。miRNA测序文库制备用QIAseqTM miRNA Library Kit文库制备试剂盒(QIAGEN)。文库制备完成后,对构建好的文库使用illuminaNovaSeq6000进行测序,测序读长为双端2×150 bp。通过对原始数据过滤得到可信的目标序列,对这些序列的质量、长度及样品间公共序列进行统计。对样本组和对照组表达miRNA做归一化处理,使其表达水平在同一量级,即归一化表达量(TPM),TPM=(miRNA表达量/标本总表达量)×106。采用ANOVA对实验组和对照组对已知miRNA进行差异表达分析,阈值log2FC的绝对值大于1和P<0.05判断两组样品之间的表达量是否存在显著性差异。对高表达的显著上下调前20个已知miRNA采用targetscan,miRanda和PITA软件预测靶基因。对目的miRNA靶基因的集合进行Gene Ontology富集分析,包括基因的分子功能,细胞组成和参与的生物过程。并对候选靶基因进行KEGG代谢通路分析,通过信号通路显著性富集分析,确定候选靶基因参与的最主要生化代谢途径和信号转导途径。
1.2.4. qPCR验证测序结果
挑选3个在对照和样本组间显著差异表达,具高表达,经文献检索可能和胎儿侧脑室扩张相关的基因及信号通路有关联的miRNA进行qPCR验证,包括let-7b-5p,miR-122-5p和miR-146a-5p。使用Trizol提取外泌体总RNA,根据TaqManTM的miRNA逆转录试剂盒说明反转录为cDNA,根据miRNA qRT-PCR TB Green@说明书进行定量分析,以rRNA-U6为内参,采用2-△△CT法计算各组miRNA的相对表达量。目的miRNAs和U6的引物序列如下:let-7b-5p,CGTGAGGTAGTAGGTTGT GTGGTT;miR-146a-5p,CGTGAGAACTGAATTCC ATGGGTT;miR-122-5p,CGTGGAGTGTGACAATG GTGTTTG;miRNA通用反向引物,AGTGCAGGGTC CGAGGTATT;U6-S,CTCGCTTCGGCAGCACA,U6-A,AACGCTTCACGAATTTGCGT。
1.2.5. 通过双荧光报告基因系统检测miR-122-5p对AKT3和CCD88C的调控作用
采用生物学软件预测,结合文献检索与脑室扩张相关的基因及全转录组测序的实验结果,预测miR-122-5p可能调控的靶基因有AKT3和CCDC88C,评估miR-122-5p靶向调控这两个基因的可能性。根据预测的启动子区域结合位点,分别设计AKT3 3'UTR WT、AKT3 3'UTR mut、CCDC88C 3'UTR WT和CCDC88C 3'UTR mut序列,克隆至双荧光素酶报告载体pmirGLO的BglII-SalI双酶切位点中进行酶连接。连接产物转化至EPI400感受态细胞,挑选阳性克隆进行酶切验证和一代测序验证。荧光素酶活性鉴定是采用Lipo2000转染重组质粒,复苏293T细胞,接种于6孔板中,37 ℃,5% CO2培养箱中培养过夜,使之第2天能达到70%~90%汇合度。采用miR-122-5p体外模拟物(mimics)转染,构建miR-122上调表达模型。miR-122-5p mimics及其阴性对照物(NC),AKT3-3' UTR-WT/mut、CCDC88C-3' UTR-WT/mut(赛索飞生物)。将miR-122-5p mimics/ mimics NC分别与重组载体AKT3 WT/mut, CCDC88C WT/mut共转染293T细胞,转染分组为mimics NC+AKT3-WT,miR-122-5p mimics+AKT3-WT,mimics NC+AKT3-mut,miR-122-5p mimics+AKT3-mut;mimics NC+CCDC88C-WT,miR-122-5p mimics+CCDC88C-WT,mimics NC+CCDC88C-mut和miR-122-5p mimics+CCDC88C-mut。转染48 h后,参照Duo-Luciferase Assay Kit说明书进行荧光素酶活性检测。miR-122-5p序列与AKT3和CCDC88C基因的3'UTR野生型和突变型的合成序列见表1。
表1.
miR-122-5p和ATK3, CCDC88C的合成序列
Tab.1 Synthesized sequences of miR-122, ATK3, and CCDC88C for dual luciferase reporter assays
| Name | Sequence |
|---|---|
| miR-122-5p | 3' gtT-TGTG-GTAACAGTGTGAGGt 5' |
| AKT3 3'UTR-WT | 5' acATACACGCA-AAT-ACACTCCa 3' |
| AKT3 3'UTR-mut | 5' actTtCtCcCt-AtT-tCtCaCgA 3' |
| CCDC88C 3'UTR-WT | 5' agAAGATGAGTTGTCACACTCCc 3' |
| CCDC88C 3'UTR-mut | 5' agtAGATGAGaTcTgAgAgTgCg 3' |
1.2.6. 统计学分析
所有数据均采用均数±标准差表示,两样本构成比的统计学分析采用四格表资料的卡方检验,采用SPSS 21.0统计学软件分析处理。两组样本均数比较采用两个独立样本的t检验,多变量采用F检验,采用GraphPad Prism8进行分析,以P<0.05表示差异有统计学意义。所有的实验都是独立重复3次。
2. 结果
2.1. 羊水外泌体鉴定
透射电镜下,外泌体的形态学特征为小囊泡,大小不等,具有明显的脂质双分子层,直径约为30~100 nm,透射电镜下,负染色显示对照和样本中检测到茶托状的外泌体(图1A)。Western blotting检测两组羊水外泌体标志蛋白,结果发现两组羊水外泌体均表达CD9、CD63、CD81、TSG101,且表达水平一致(图1B)。纳米颗粒检测,对照样本C2的颗粒检测浓度为3.0×107 /mL,稀释倍数30 000,原始浓度为9.1×1011/mL,Median(×50)为153.0nm。实验样本AFS042的颗粒检测浓度为2.9×107/mL,稀释倍数10 000,原始浓度为2.9×1011 /mL,Median(×50)为145.8 nm (图1C)。
图1.
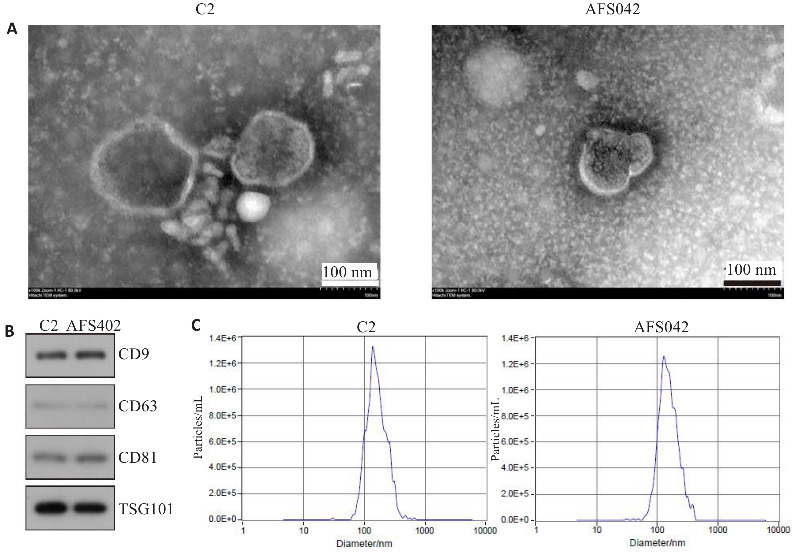
羊水外泌体鉴定
Fig.1 Identification of exosomes in maternal amniotic fluid. A: Exosome morphology under transmission electron microscope. B: Protein expressions of exosome markers CD9, CD63, CD81 and TSG101 detected by Western blotting. C: Particle size of the exosomes.
2.2. 两组羊水外泌体miRNA差异表达情况
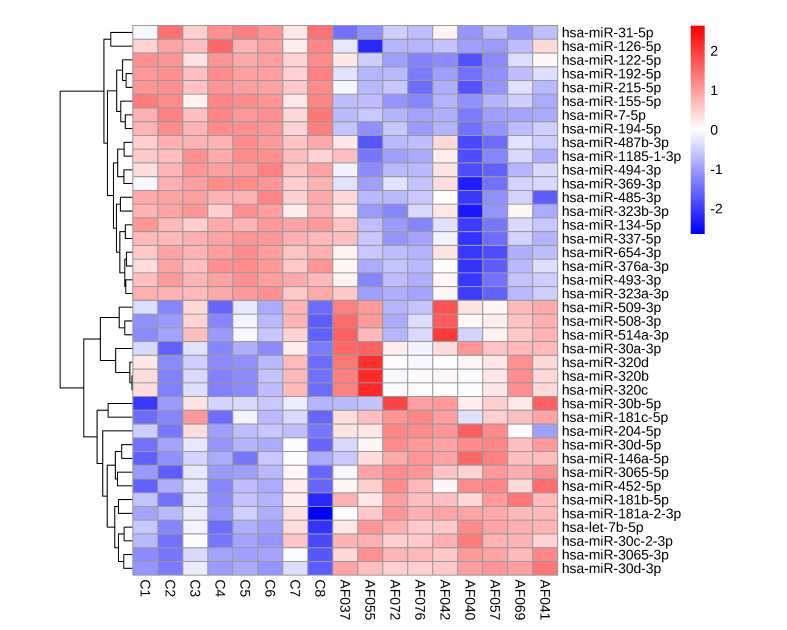
测序结果显示,侧脑室扩张和对照组存在272个差异表达的miRNA,其中43个miRNA上调,229个miRNA下调;对照平均表达量大于20 TPM的有90个差异表达miRNA,21个上调,69个下调。表达量上调的TOP20和下调的TOP 20个,共40个miRNAs在对照和病例组中的表达丰度热图,红色为上调,蓝色为下调(图2)。
图2.
羊水外泌体在侧脑室扩张样本和对照组中差异表达的miRNA的丰度热图
Fig.2 Heat map of the differentially expressed miRNAs between ventriculomegaly and control groups. Red and blue indicates up-regulated and down-regulated miRNAs, respectively.
2.3. qPCR验证测序结果
侧脑室扩张组的miR-122-5p较对照组显著降低(P=0.028),与测序结果一致。miR-146a-5p较对照组上调,与测序组结果一致,但差异没有统计学意义(P=0.693)。let-7b-5p较对照组下调,差异没有统计学意义(P=0.249),与测序结果相反(图3)。
图3.
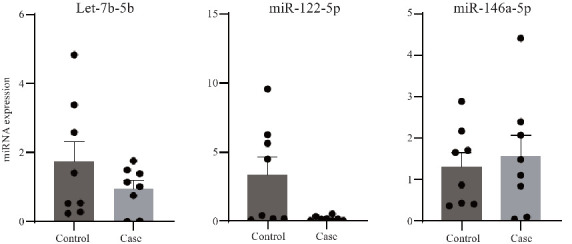
qPCR检测两组羊水外泌体中let-7b-5p,miR-122-5p和miR-146a-5p表达水平
Fig.3 Expression levels of let-7b-5p, miR-122-5p and miR-146a-5p in amniotic fluid exosomes from the two groups detected by RT-qPCR.
2.4. 双荧光素酶报告基因检测结果
重组质粒共转染48 h后,荧光素酶活性检测结果(图4)。在293T细胞中,miR-122-5p过表达对AKT3 3'UTR-WT荧光素酶的活性与空白对照组(mimics NC+AKT3-WT)差异无统计学意义(P=0.958);miR-122-5p过表达对AKT3 3'UTR-mut荧光素酶的活性与空白对照组(mimics NC+AKT3-mut)差异无统计学意义(P=0.093);miR-122-5p过表的AKT3-WT和AKT3-mut荧光素酶活性差异无统计学意义(P=0.929)。对于CCDC88C,miR-122-5p过表达对CCDC88C 3'UTR-WT荧光素酶的活性与空白对照组(mimics NC+CCDC88C-WT)差异无统计学意义(P=0.836);miR-122-5p过表达对CCDC88C 3'UTR-mut荧光素酶的活性与空白对照组(mimics NC+CCDC88C-mut)差异无统计学意义(P=0.170);miR-122-5p过表的CCDC88C-WT和CCDC88C-mut荧光素酶活性差异无统计学意义(P=0.418)。
图4.
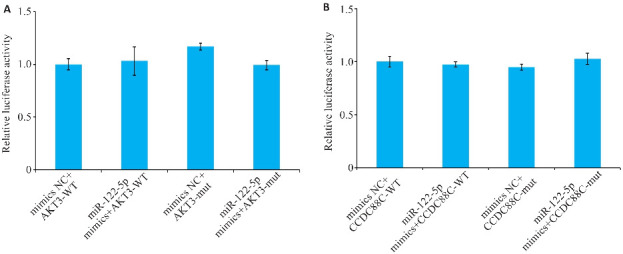
miR-122-5p 的预测靶基因荧光素酶活性测定结果
Fig.4 Result of 3'UTR luciferase report system for assessing interactions between miRNA-122-5p and its predicted target genes. A: Luciferase assays with AKT3 3'UTR-WT/mut. B: Luciferase assays with CCDC88C 3'UTR-WT/mut.
2.5. TOP40差异表达miRNAs靶基因预测和生物学功能
对于TOP40差异表达miRNAs的调控靶基因进行GO和KEGG分析,发现归属GO条目里富集显著的有:细胞组分上的质膜(GO:0005886),膜(GO:0016020)和细胞外围(GO:0071944);发挥的分子功能有核酸结合转录因子活性(GO:0001071),跨膜转运蛋白活性(GO:0022857),转运蛋白活性(GO:0005215),DNA结合(GO:0003677)和转录因子结合(GO:0008134)相关;参与的生物学过程中有定位(GO:0051179),发育过程(GO:0032502),移动(GO:0040011),细胞分化、迁移、定位和发育过程(GO:0030154,0048870,0051674,0048869),神经系统过程(GO:0050877),跨膜运输(GO:0055085)等。KEGG信号通路显著性分析显示前20的通路主要包括:MAPK信号通路、cGMP-PKG信号通路,趋化因子信号通路、钙信号通路、配体-受体神经活性互作、神经营养因子信号通路、细胞粘附分子、Wnt信号通路、轴突引导即神经发育过程中轴突生长的方向和路径的调控过程等(图5)。
图5.
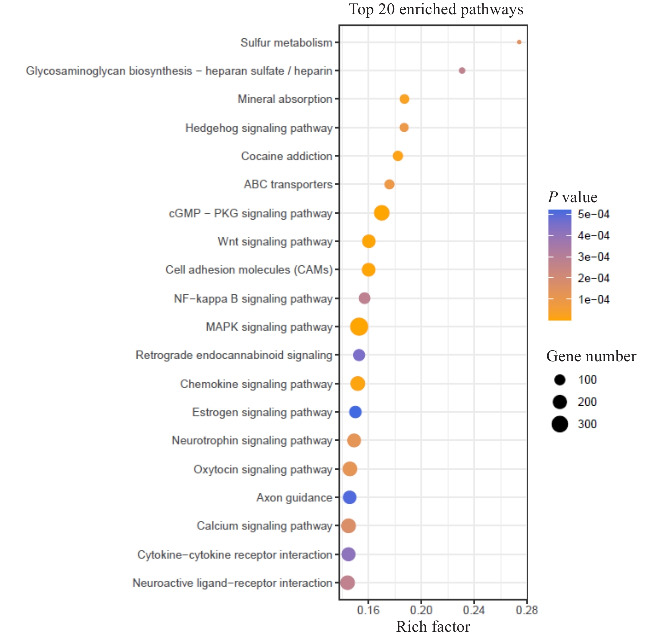
KEGG信号通路分析TOP40差异表达miRNA的靶基因功能
Fig.5 KEGG pathway analysis of the top 40 significant differential miRNAs in the exosomes for biological functions of their target genes.
3. 讨论
miRNA是一类高度保守的内源性小RNA,miRNA的种类非常有限,人体中大约有2654种成熟的人类miRNA,每个miRNA可以识别并沉默多个mRNA,而多个miRNA也可以沉默同一个mRNA。miRNA最经典的调控方式是直接结合到mRNA 3'端非翻译区,导致mRNA降解,在转录后翻译水平调节蛋白质的表达。外泌体中转运的miRNA非常安全稳定,miRNA到达靶细胞仍能保持功能活性。目前人体外泌体miRNA的研究主要集中在肿瘤、神经系统疾病和心血管疾病[20]。丁凯泽等[12]对唐氏综合征羊水miRNA的特征表达谱分析发现15个差异表达miRNA,其中有4个miRNA在本研究也发现差异表达,包括miR-30a,miR-323a-3p,miR-329-3p和与let-7e同属let-7家族的let-7d。柯买春等[13]的研究在唐筛综合征胎儿孕妇羊水中验证的5种21号染色体编码的外泌体miRNA中也包含了3种本研究检测发现的let-7,miR-155和miR-802。Xie等[14]对胎儿先天性肾阻塞病例羊水外泌体miRNA研究中表达显著下降的miR-122-5p,miR-299-3p,miR-299-5p,miR-320a,miR-379-5p,miR-493-5p,miR-548t和miR-585,在本研究中都有显著下调,除了miR-30a上调。Fabietti等[18]在胎儿先天性膈疝病例的羊水外泌体中检测到的显著增加的miR-190-5p,miR-379-5p和miR-889-3p,在本研究中也有显著差异表达,说明miRNA在羊水外泌体广泛存在,并且有一些共同的差异表达miRNAs,这些共性miRNAs可能在胎儿的发育中具广泛调控机体生物学功能的特点,包括细胞分化、凋亡、炎症及免疫反应,结合孕妇血清中miRNA的研究,有潜力作为临床诊断胎儿疾病及孕妇妊娠期疾病的生物标志物。脑室扩张外泌体miRNA的研究,目前已报道的有先天性脑积水,但都是在脑脊液中的研究[21, 22]。胎儿侧脑室后角宽度≥15 mm时为脑积水。Chen等[21]对脑积水的病人和对照的脑脊液外泌体进行分离和表达谱测序分析,发现31个差异表达miRNAs,26个上调5个下调,其中包括本研究的羊水外泌体中也存在显著差异表达的miR-130b-3p,miR-134-5p,miR-136-5p,miR-137,miR-181a,miR-320a,miR-320b,miR-320c,miR-320d,miR-1298和let-7,表明羊水和脑脊液的外泌体具有共同的显著差异表达miRNAs,个别miRNA在脑脊液和羊水外泌体中的表达上下调不一致,可能是由于样本例数和个体差异导致,特别是异质性比较高的疾病。脑脊液的样本在产前无法获得,而羊穿已成为成熟而广泛使用的产前诊断技术。虽然脑脊液更能反映脑室扩张miRNA的表达情况,但从羊水中挖掘寻找出和脑脊液外泌体中共同作用的相关miRNAs,可为进一步探讨产前胎儿脑室扩张的分子作用机制提供更便捷的研究载体。
本研究发现的TOP40差异表达miRNA,let-7是细胞分化的关键调节因子,作为一个远古的致死miRNA,在动物的生存进化史上对生存和发育起着必需的作用。let-7已被发现靶向调控Trim71基因,是先天性脑积水的致病基因[23]。let-7和本研究的另一个TOP40差异表达miR-155参与的生物学通路都是对BACH1活性起调节作用,BACH1在大多数哺乳动物组织中广泛表达,BACH1活性的增加可以激活AKT/mTOR信号通路[24],PI3K-AKT-mTOR通路参与神经元和胶质细胞增值、凋亡等过程,在神经系统中普遍存在且发挥重要作用,有研究表明PI3K/Akt通路的过度激活可导致小鼠脑室的过度扩张继而导致脑积水[25]。miR-181c作用的生物学通路是NOTCH的前转录和翻译,miR-181c在高度甲基化时,会导致NOTCH2/4和KRAS的表达增加[26],上调的NOTCH信号通路促进室管膜细胞的增殖,从而导致导水管狭窄和脑积水[27]。miR-181c还可能参与MAPK调节通路[28],p38 MAPK是神经细胞凋亡调控的重要通路,其表达强弱与神经细胞存活密切相关,而ERK/MAPK通路的激活可以触发星形胶质细胞的增生,星形胶质细胞的增生可能会引起脑积水的发生[29, 30]。miR-215参与的生物学通路是调节RUNX1的表达活性,RUNX1基因是miR-215的直接靶点,miR-215的异常表达会降低RUNX1启动子的荧光素酶活性,下调RUNX1的表达。RUNX1作为一个转录因子,它能直接或间接调节多个信号通路,包括TGF-β信号通路,BMP信号通路和Wnt信号通路[31]。TGF-β通路在脑积水形成过程中起重要的作用,活化后可以启动胞内一系列信号级联反应,使得多种胶原等细胞外基质合成增多及脑膜纤维化[32]。Wnt信号通路则在多种组织细胞活化及纤维化中起重要作用,有研究报道在脑积水大鼠模型中Wnt/β-catenin通路活性增高,抑制β-catenin的表达可以减轻大鼠模型反应胶质的增生,减缓脑积水的形成[33]。miR-452的直接靶基因是血管内皮生长因子A(VEGFA)[34],VEGFA已被证明是脑积水患者脑脊液中的炎症标志物之一[35]。miR-134则是一种富集于大脑的miRNA,参与细胞生长、分化、突触可塑性、神经炎症和凋亡等多种过程,在各种神经过程中起重要的作用。miR-134-5p已报道的靶基因也是VEGFA [36],它参与的信号通路有miR-134-5p/Itgb1/MAPK通路[37]和ITGB1/MMP2/PI3K/Akt通路[38]。此外,Chen等[21]的研究指出,上调的hsa-miR-130b-3p可能介导与脑积水相关的磷酸酶和张力蛋白同源基因(PTEN)的下调。
本研究采用qPCR对显著差异的miRNA中高表达的3个miRNA进行验证,miRNA-122-5p和miRNA-146a-5p与测序结果一致,而let-7b-5p与测序结果相反,原因可能是由于测序和qPCR是两种不同的技术方法,原理和计算公式均不同。qPCR检测目标miRNA的表达是利用茎环状引物进行miRNA的反转录,然后再进行实时定量PCR。测序法是通过miRNA文库构建、簇生成及上机测序,一次获得数百万条miRNA序列,然后再将reads比对到参考基因组、miRBase上,计算miRNA表达量。qPCR是靶向检测一种miRNA,测序是同时检测多个miRNA,受文库和测序深度影响,且本研究有些样本在全转录测序实验中已经用完,验证只做了其中的8个样本和8个对照,临床样本个体差异较大,两种检测方法的结果会出现不一致的情况。
本研究经qPCR验证在脑室扩张样本组中显著下降的miR-122是一种在肝组织中高峰度表达的miRNA[39],但近年来研究发现miR-122-5p调控神经细胞,有研究表明大鼠颅脑受伤后脑组织miR-122-5p表达下降,神经元凋亡增加,神经功能受损[40]。有研究发现[41],在创伤性脑外伤小鼠模型中,miR-122-5p的表达显著下调,而NLRP3炎症小体表达显著上调;在细胞模型中,miR-122-5p抑制剂减轻小胶质细胞凋亡,显著促进小胶质细胞从M1(促炎)向M2(抗炎)表型转化;抑制miR-122-5p的表达,可以抑制NLRP3炎症小体激活和NFkB磷酸化,这两个都是典型的炎症信号通路,与神经毒性有关。有研究报道miR-122可以通过靶向RUNX2促进线粒体凋亡通路的激活,促进神经胶质瘤细胞凋亡[42]。另有研究发现,脑出血小鼠模型中miR-122-5p通过破坏MLLT1/PI3K/AKT信号通路的破坏促进外周和中枢神经系统的炎症[43]。本研究通过生物信息学分析,结合文献报道的脑室扩张相关信号通路,预测miR-122-5p可能靶向AKT3,CCDC88C基因。AKT3是AKT激酶家族之一,AKT激酶是细胞信号中响应胰岛素和生长因子的调控因子。AKT3在大脑中广泛存在,其缺失可以造成小头畸形,重复可造成巨头畸形[44]。研究报道体内实验敲除miR-122-5p,通过MLLT1/PI3K/AKT信号通路,降低脑出血小鼠外周血和中枢神经系统的神经弄能受损和炎症[43],但作用的靶基因是MLLT1。CCDC88C是Wnt信号通路的负调控因子,Wnt信号通路在胚胎发育、组织维持和肿瘤进展中发挥重要作用。CCDC88C基因突变是已知的导致胎儿先天性脑积水致病基因,但具体作用机制不明[45]。本研究的荧光素酶活性测定结果,在AKT3-WT组中,miR-122过表达转染细胞后的荧光素酶活性较NC组无显著差异;在AKT3-mut组中,过表miR-122的细胞素酶活性与NC组也无显著差异的改变,说明miR-122-5p不靶向AKT3的3'端非翻译区。在CCDC88C-WT组中,转染miR-122过表达后细胞荧光素酶活性较NC组下降,但差异不显著;在CCDC88C-mut组中,过表达miR-122后细胞荧光酶活性较NC组也无明显改变,说明miR-122-5p也不靶向于CCDC88C的3'端非翻译区。虽然本研究未找到miR-122-5p的靶向基因,但提示miR-122-5p不靶向AKT3和CCDC88C,在以后的研究需更进一步的生物学信息学分析和更多的实验验证。
综上所述,本研究首次报道了侧脑室扩张胎儿和正常胎儿羊水外泌体中的显著差异表达miRNAs,发现了在侧脑室扩张胎儿发育过程中可能起调控作用的外泌体miRNAs,包括let-7,miR-122,miR-130,miR-134,miR-145,miR-155,miR-181c,miR-215和miR-452,这些差异表达miRNAs主要通过MAPK, PI3K-Akt和Wnt信号通路参与脑室扩张的发病过程,具体的靶基因和调控作用的途径和机制仍需进一步的实验。其次,对比分析了胎儿其它病种孕妇羊水外泌体,及脑积水病人在脑脊液和孕妇羊水外泌体中的差异表达miRNAs。脑室扩张胎儿孕妇羊水外泌体中这些高峰度差异显著miRNAs的发现为miRNA调控胎儿脑室扩张的分子机制研究奠定了基础,并提供了新的思路和方向。
基金资助
广州市科技计划(202002020010)
参考文献
- 1. Gaglioti P, Oberto M, Todros T. The significance of fetal ventriculomegaly: etiology, short- and long-term outcomes[J]. Prenat Diagn, 2009, 29(4): 381-8. [DOI] [PubMed] [Google Scholar]
- 2. Griffiths PD, Reeves MJ, Morris JE, et al. A prospective study of fetuses with isolated ventriculomegaly investigated by antenatal sonography and in utero MR imaging[J]. AJNR Am J Neuroradiol, 2010, 31(1): 106-11. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Salomon LJ, Bernard JP, Ville Y. Reference ranges for fetal ventricular width: a non-normal approach[J]. Ultrasound Obstet Gynecol, 2007, 30(1): 61-6. [DOI] [PubMed] [Google Scholar]
- 4. 彭奕贤, 黄莉萍, 黎 静, 等. 孤立性侧脑室扩张胎儿的结局及其影像学随访的结果[J]. 中华妇产科杂志, 2018, 53(5): 294-8. [DOI] [PubMed] [Google Scholar]
- 5. McKechnie L, Vasudevan C, Levene M. Neonatal outcome of congenital ventriculomegaly[J]. Semin Fetal Neonatal Med, 2012, 17(5): 301-7. [DOI] [PubMed] [Google Scholar]
- 6. van Niel G, D'Angelo G, Raposo G. Shedding light on the cell biology of extracellular vesicles[J]. Nat Rev Mol Cell Biol, 2018, 19(4): 213-28. [DOI] [PubMed] [Google Scholar]
- 7. Valadi H, Ekström K, Bossios A, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J]. Nat Cell Biol, 2007, 9(6): 654-9. [DOI] [PubMed] [Google Scholar]
- 8. Ghafourian M, Mahdavi R, Akbari Jonoush Z, et al. The implications of exosomes in pregnancy: emerging as new diagnostic markers and therapeutics targets[J]. Cell Commun Signal, 2022, 20(1): 51. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Bardanzellu F, Fanos V. The choice of amniotic fluid in metabolomics for the monitoring of fetus health - update[J]. Expert Rev Proteomics, 2019, 16(6): 487-99. [DOI] [PubMed] [Google Scholar]
- 10. Zwemer LM, Bianchi DW. The amniotic fluid transcriptome as a guide to understanding fetal disease[J]. Cold Spring Harb Perspect Med, 2015, 5(4): a023101. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Ebert B, Rai AJ. Isolation and characterization of amniotic fluid-derived extracellular vesicles for biomarker discovery[J]. Methods Mol Biol, 2019, 1885: 287-94. [DOI] [PubMed] [Google Scholar]
- 12. 丁凯泽, 余 蕾, 黄 智, 等. 唐氏综合征胎儿羊水外泌体miRNA差异表达谱分析[J]. 南方医科大学学报, 2022, 42(2): 293-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. 柯买春, 王小中, 袁素珍, 等. 羊水外泌体21号染色体源性miRNAs检测在唐氏综合征产前诊断中的意义[J]. 江西医药, 2022, 57(9): 1270-5. [Google Scholar]
- 14. Xie JT, Zhou Y, Gao WZ, et al. The relationship between amniotic fluid miRNAs and congenital obstructive nephropathy[J]. Am J Transl Res, 2017, 9(4): 1754-63. [PMC free article] [PubMed] [Google Scholar]
- 15. Li JZ, Fu Y, Liu QS, et al. Multiomics-based study of amniotic fluid small extracellular vesicles identified Moesin as a biomarker for antenatal hydronephrosis[J]. Clin Transl Med, 2023, 13(8): e1360. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Yang HN, Yang SP, Shen HL, et al. Construction of the amniotic fluid-derived exosomal ceRNA network associated with ventricular septal defect[J]. Genomics, 2021, 113(6): 4293-302. [DOI] [PubMed] [Google Scholar]
- 17. Gebara N, Scheel J, Skovronova R, et al. Single extracellular vesicle analysis in human amniotic fluid shows evidence of phenotype alterations in preeclampsia[J]. J Extracell Vesicles, 2022, 11(5): e12217. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Fabietti I, Nardi T, Favero C, et al. Extracellular vesicles and their miRNA content in amniotic and tracheal fluids of fetuses with severe congenital diaphragmatic hernia undergoing fetal intervention[J]. Cells, 2021, 10(6): 1493. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Nowak JS, Michlewski G. miRNAs in development and pathogenesis of the nervous system[J]. Biochem Soc Trans, 2013, 41(4): 815-20. [DOI] [PubMed] [Google Scholar]
- 20. Li SJ, Lv DQ, Yang H, et al. A review on the current literature regarding the value of exosome miRNAs in various diseases[J]. Ann Med, 2023, 55(1): 2232993. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Chen SY, Li H, Zheng JC, et al. Expression profiles of exosomal microRNAs derived from cerebrospinal fluid in patients with congenital Hydrocephalus determined by microRNA sequencing[J]. Dis Markers, 2022, 2022: 5344508. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. Spaull R, McPherson B, Gialeli A, et al. Exosomes populate the cerebrospinal fluid of preterm infants with post-haemorrhagic hydrocephalus[J]. Int J Dev Neurosci, 2019, 73: 59-65. [DOI] [PubMed] [Google Scholar]
- 23. Duy PQ, Furey CG, Kahle KT. Trim71/Lin-41 links an ancient miRNA pathway to human congenital Hydrocephalus [J]. Trends Mol Med, 2019, 25(6): 467-9. [DOI] [PubMed] [Google Scholar]
- 24. Wang CM, Zhang L, Cao MQ, et al. Thioredoxin facilitates hepatocellular carcinoma stemness and metastasis by increasing BACH1 stability to activate the AKT/mTOR pathway[J]. FASEB J, 2023, 37(6): e22943. [DOI] [PubMed] [Google Scholar]
- 25. Mirzaa GM, Rivière JB, Dobyns WB. Megalencephaly syndromes and activating mutations in the PI3K-AKT pathway: MPPH and MCAP[J]. Am J Med Genet C Semin Med Genet, 2013, 163C(2): 122-30. [DOI] [PubMed] [Google Scholar]
- 26. Hashimoto Y, Akiyama Y, Otsubo T, et al. Involvement of epigenetically silenced microRNA-181c in gastric carcinogenesis[J]. Carcinogenesis, 2010, 31(5): 777-84. [DOI] [PubMed] [Google Scholar]
- 27. Lin X, Liu BH, Yang XS, et al. Genetic deletion of Rnd3 results in aqueductal stenosis leading to hydrocephalus through up-regulation of Notch signaling[J]. Proc Natl Acad Sci USA, 2013, 110(20): 8236-41. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Magnelli L, Schiavone N, Staderini F, et al. MAP kinases pathways in gastric cancer[J]. Int J Mol Sci, 2020, 21(8): 2893. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29. Mandell JW, VandenBerg SR. ERK/MAP kinase is chronically activated in human reactive astrocytes[J]. Neuroreport, 1999, 10(17): 3567-72. [DOI] [PubMed] [Google Scholar]
- 30. Xu H, Zhang SL, Tan GW, et al. Reactive gliosis and neuroinflammation in rats with communicating hydrocephalus[J]. Neuroscience, 2012, 218: 317-25. [DOI] [PubMed] [Google Scholar]
- 31. Li N, Zhang QY, Zou JL, et al. MiR-215 promotes malignant progression of gastric cancer by targeting RUNX1[J]. Oncotarget, 2016, 7(4): 4817-28. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32. Yan H, Chen YJ, Li LY, et al. Decorin alleviated chronic hydrocephalus via inhibiting TGF-β1/Smad/CTGF pathway after subarachnoid hemorrhage in rats[J]. Brain Res, 2016, 1630: 241-53. [DOI] [PubMed] [Google Scholar]
- 33. Xu H, Xu B, Wang ZX, et al. Inhibition of Wnt/β-catenin signal is alleviated reactive gliosis in rats with hydrocephalus[J]. Childs Nerv Syst, 2015, 31(2): 227-34. [DOI] [PubMed] [Google Scholar]
- 34. Mo JS, Park WC, Choi SC, et al. MicroRNA 452 regulates cell proliferation, cell migration, and angiogenesis in colorectal cancer by suppressing VEGFA expression[J]. Cancers, 2019, 11(10): 1613. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35. Lolansen SD, Rostgaard N, Oernbo EK, et al. Inflammatory markers in cerebrospinal fluid from patients with Hydrocephalus: a systematic literature review[J]. Dis Markers, 2021, 2021: 8834822. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36. Ma Z, Li K, Chen P, et al. MiR-134, mediated by IRF1, suppresses tumorigenesis and progression by targeting VEGFA and MYCN in osteosarcoma[J]. Anticancer Agents Med Chem, 2020, 20(10): 1197-208. [DOI] [PubMed] [Google Scholar]
- 37. Huang M, Wang Y, Wang ZN, et al. MiR-134-5p inhibits osteoclastogenesis through a novel miR-134-5p/Itgb1/MAPK pathway[J]. J Biol Chem, 2022, 298(7): 102116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38. Yan L, Zhou RH, Feng Y, et al. MiR-134-5p inhibits the malignant phenotypes of osteosarcoma via ITGB1/MMP2/PI3K/Akt pathway[J]. Cell Death Discov, 2024, 10(1): 193. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39. Amr KS, Elmawgoud Atia HA, Elazeem Elbnhawy RA, et al. Early diagnostic evaluation of miR-122 and miR-224 as biomarkers for hepatocellular carcinoma[J]. Genes Dis, 2017, 4(4): 215-21. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40. 刁 波, 杨 前, 王 刚, 等. 大鼠颅脑损伤后脑组织miR-122-5p含量变化及其对神经功能的影响[J]. 中国临床神经外科杂志, 2018, 23(4): 250-3. [Google Scholar]
- 41. 康璐璐, 龙小兵, 王 静, 等. MiR-122-5p调节创伤性脑外伤后小胶质细胞极化减弱炎症反应[J]. 中华急诊医学杂志, 2022, 31(8): 1077-84. [Google Scholar]
- 42. 杨才弟, 王丽娟, 曾鼎华, 等. MiR-122通过靶向RUNX2诱导胶质瘤细胞凋亡的实验研究[J]. 临床肿瘤学杂志, 2019, 24(2): 124-8. [Google Scholar]
- 43. Yu N, Tian WB, Liu C, et al. MiR-122-5p promotes peripheral and central nervous system inflammation in a mouse model of intracerebral hemorrhage via disruption of the MLLT1/PI3K/AKT signaling[J]. Neurochem Res, 2023, 48(12): 3665-82. [DOI] [PubMed] [Google Scholar]
- 44. Nellist M, Schot R, Hoogeveen-Westerveld M, et al. Germline activating AKT3 mutation associated with megalencephaly, polymicrogyria, epilepsy and hypoglycemia[J]. Mol Genet Metab, 2015, 114(3): 467-73. [DOI] [PubMed] [Google Scholar]
- 45. Marguet F, Vezain M, Marcorelles P, et al. Neuropathological hallmarks of fetal hydrocephalus linked to CCDC88C pathogenic variants[J]. Acta Neuropathol Commun, 2021, 9(1): 104. [DOI] [PMC free article] [PubMed] [Google Scholar]