Abstract
目的
观察黄芩汤对小鼠溃疡性结肠炎(UC)细胞凋亡的影响并探讨其作用机制。
方法
将雄性Balb/c小鼠随机分为:正常组、模型组、美沙拉嗪组(5-ASA,200 mg/kg)、黄芩汤低、中、高剂量组(HQDL,2.275 g/kg;HQDM,4.55 g/kg;HQDH,9.1 g/kg),8只/组。各组自由饮食,除正常组自由饮用无菌水外,其余各组小鼠自由饮用3% DSS溶液,持续7d以建立UC模型。取结肠组织采用HE、AB-PAS和TUNEL染色分别观察结肠损伤和细胞凋亡情况,采用ELISA法检测炎症因子表达变化;采用Western blotting、免疫组化和qRT-PCR法分别检测肠道化学屏障、机械屏障、内质网应激等相关指标的蛋白或基因表达变化。
结果
与模型组相比,黄芩汤干预下的UC小鼠,DAI评分和宏观评分下降(P<0.01),TUNEL染色荧光强度下降(P<0.01)。促炎因子IL-6、TNF-α、IL-1β、IL-8表达减少(P<0.01),MUC2和TFF3的基因表达升高(P<0.05),Claudin-1、Occludin和E-cadherin的蛋白表达升高(P<0.05),GRP78、CHOP和Caspase-12的基因和蛋白表达下降(P<0.01)、PERK、eIF2α和IRE1α的磷酸化表达降低(P<0.05),Bcl-2/Bax蛋白表达比例升高(P<0.01)和Caspase-3的蛋白表达降低(P<0.01)。
结论
黄芩汤能够抑制UC小鼠的细胞凋亡反应并改善肠道屏障功能,其机制可能与PERK和IRE1α信号通路介导的内质网应激有关。
Keywords: 溃疡性结肠炎, 黄芩汤, 内质网应激, 细胞凋亡
Abstract
Objective
To evaluate the therapeutic effect of Huangqin Decoction (HQD) on ulcerative colitis (UC) in mice and explore its mechanism.
Methods
Male Balb/c mice were randomly divided into normal control group, model group, mesalazine group (5-ASA, 200 mg/kg), and low-, medium- and high-dose HQD groups (2.275, 4.55 and 9.1 g/kg, respectively). With the exception of those in the normal control group, all the mice were exposed to 3% DSS solution in drinking water for 7 days to establish UC models. After treatment with the indicated drugs, the mice were assessed for colon injury and apoptosis using HE, AB-PAS and TUNEL staining, and the expression levels of inflammatory factors were detected with ELISA. Western blotting, immunohistochemistry and qRT-PCR were used to detect the changes in protein expressions associated with the intestinal chemical barrier, mechanical barrier and endoplasmic reticulum stress (ERS).
Results
HQD treatment significantly reduced DAI score and macro score of UC mice, decreased colonic epithelial cell apoptosis, lowered expressions of IL-6, TNF-α, IL-1β and IL-8, and enhanced the expressions of MUC2 and TFF3. HQD treatment also upregulated the protein expressions of claudin-1, occludin and E-cadherin, reduced the expressions of GRP78, CHOP, caspase-12 and caspase-3, decreased the phosphorylation levels of PERK, eIF2α and IRE1α, and increased the Bcl-2/Bax ratio in the colon tissues of UC mice.
Conclusion
HQD inhibits colonic epithelial cell apoptosis and improves intestinal barrier function in UC mice possibly by reducing ERS mediated by the PERK and IRE1α signaling pathways.
Keywords: ulcerative colitis, Huangqin Decoction, endoplasmic reticulum stress, apoptosis
溃疡性结肠炎(UC)病因复杂、发病机制不明,且临床治疗上常常延绵难愈、反复发作,这为患者生活带来了极大的困扰[1]。肠黏膜屏障损伤作为UC发病发展的核心环节之一,与免疫炎症密切相关[2]。除了抑制黏膜炎症外,恢复肠上皮屏障和黏膜愈合有助于UC缓解和降低手术风险[3, 4]。目前认为,过多的糖脂、多不饱和脂肪酸和食品添加剂的摄入等西式不健康饮食习惯,通过影响肠道上皮细胞和免疫细胞的代谢和功能,可能导致宿主免疫系统与肠道微生物群之间的失衡,影响内质网和线粒体等重要细胞器的功能,从而促进UC产生[5]。在持续炎症、代谢失调、肠道菌群紊乱等不良刺激下,细胞应激反应贯穿UC发病始终,包括内质网应激(ERS)、氧化应激、自噬和线粒体稳态等[6, 7]。
肠道黏膜上皮的快速更新、高度分泌的生理活动时常在复杂的代谢环境中进行,这要求肠上皮细胞具有完备的蛋白质折叠处理能力[8]。内质网对细胞内蛋白质稳态的干扰高度敏感,来自宿主和外界的不利刺激可能导内质网腔中未折叠或错误折叠的蛋白质积累,这种情况被称为内质网应激。有报道称黏液层的改变可能是UC上皮细胞损伤早期发作的诱发因素[9,10],负责生产分泌黏蛋白MUC2的杯状细胞容易遭受ERS,并依赖未折叠蛋白反应来维持内环境稳态[7, 11]。当未折叠蛋白反应无力恢复内质网的正常功能而使细胞长期处于ERS的状态下时,ERS可能通过影响全局蛋白合成、诱导肠上皮细胞死亡和激活促炎反应等进而损害肠道黏膜屏障的完整性,这可能是导致UC的重要发病机制之一[9, 11, 12]。
黄芩汤最早见于张仲景所著的《伤寒论》,由黄芩、芍药、大枣和甘草四味药物组成,具有清肠止痢、和中止痛的功效,临床上常用于治疗湿热内蕴、气血失调的溃疡性结肠炎[13]。临床和动物实验表明,黄芩汤具有抑制UC的免疫炎症反应、改善肠道微生态平衡以及恢复肠黏膜屏障功能的疗效。[14-17]。研究证明,黄芩汤可通过调控能量代谢相关信号通路,维持肠道微环境的活跃状态,从而促进组织修复,缓解UC的症状[18, 19]。内质网作为肠道微环境中细胞应激响应、细胞代谢适应的关键细胞器之一,与肠上皮细胞的炎症和凋亡反应密切相关[12]。然而,是否存在证据支持内质网作为黄芩汤治疗UC的潜在作用靶标尚不明确。黄芩汤通过抑制细胞凋亡和改善肠道屏障功能的机制是否与ERS相关,尚缺乏文献报道。本研究拟采用DSS诱导的UC小鼠模型,以ERS调控为切入点,重点分析黄芩汤对ERS介导的细胞凋亡反应的作用机制,探讨其对UC的影响,旨在为探索具有临床应用潜力的治疗策略提供科学依据。
1. 材料和方法
1.1. 动物
48只SPF级BALB/c小鼠(雄性,6~7周龄,体质量17~19 g),从广东省医学实验动物中心购买[动物生产许可证号:SYXK(粤)2022-0002]。动物饲养于广州中医药大学中药学院SPF级实验动物房,室温23±2 ℃,相对湿度55%±5%,光暗周期12 h。本次实验符合广州中医药大学动物实验伦理条件要求(伦理批号:ZYD-2023-095)。
1.2. 药物
黄芩饮片(广东天诚中药饮片有限公司);白芍饮片、炙甘草饮片、大枣饮片(广州至信中药饮片有限公司);美沙拉秦缓释颗粒(上海爱的发制药有限公司);葡聚糖硫酸钠(DSS, MP Biomedicals)。
1.3. 试剂
苏木精、伊红、分化液、返蓝液、DAPI染色试剂、抗荧光淬灭封片剂、一步法TUNEL细胞凋亡检测试剂盒、RIPA裂解液(武汉塞维尔生物科技);IL-6、TNF-α、IL-1β、IL-8 ELISA试剂盒(上海酶联生物科技)、TRIzol(Invitrogen Life Technologies);HiScript ®II Q RT SuperMix for qPCR、ChamQ Universal SYBR qPCR Master Mix(南京诺唯赞生物科技);BCA蛋白定量试剂盒(上海贝博生物技术);兔抗小鼠一抗GAPDH、Occludin、E-cadherin(Proteintech);兔抗小鼠一抗Claudin-1、PERK(Abcam);兔抗小鼠一抗GRP78、CHOP(武汉塞维尔生物科技);兔抗小鼠一抗Caspase-12(Bioss)、p-PERK、Bcl-2、Bax(Zenbio);兔抗小鼠一抗IRE1α、eIF2α、p-eIF2α、Cleaved-Caspase-3(CST);p-IRE1α(Affinity);β-tubuin(Abmart);山羊抗兔IgG二抗(biosharp);牛血清白蛋白BSA(Biofroxx);Goat-Anti-Rabbit IgG(EarthOX)。
1.4. 黄芩汤制备及分装
黄芩汤(黄芩9 g、白芍6 g、炙甘草6 g、大枣49 g),均购自广州中医药大学第一附属医院中药房。将中药混合于10倍体积蒸馏水中浸泡30 min后,经2次煎煮、过滤,利用旋转蒸发仪将过滤药液浓缩至生药浓度为1 g/mL的黄芩汤生药原液并装瓶。小鼠剂量黄芩汤药液的配制:根据第3版《医学实验动物学》中人与动物给药剂量换算方法,小鼠的每日给药剂量为成人的每日服药剂量的9.1倍。以70 kg作为成人的标准体质量,黄芩汤成人的每日临床剂量以70 g计算,则小鼠的每日给药剂量 9.1 g/kg,以此剂量设置为小鼠实验给药的高剂量,则中剂量设置为4.55 g/kg、低剂量设置为2.275 g/kg。小鼠的给药体积按10 mL/kg计算,取上述黄芩汤浓缩生药原液,加入蒸馏水分别配制成0.91 g/mL、0.455 g/mL、0.2275 g/mL,现配现用。
1.5. 造模、分组与给药
48只小鼠适应性喂养1周后,随机分为6组,8只/组,分别为空白对照组(CON)、UC模型组(DSS)、美沙拉嗪组(5-ASA,200 mg/kg)、黄芩汤低剂量组(HQDL,2.275 g/kg)、黄芩汤中剂量组(HQDM,4.55 g/kg)、黄芩汤高剂量组(HQDH,9.1 g/kg)。造模及给药共7 d,其中5-ASA组及HQD各剂量组每日灌胃相应浓度的药物,CON组及DSS组则每日灌胃等量生理盐水。CON组在实验过程中给予蒸馏水自由饮用,其余各组给予3%的DSS水溶液自由饮用。从实验第1天开始,记录喂养小鼠的饲料和蒸馏水用量,第2天统计摄食量和饮水量,作为实验第1天的摄食量和饮水量,依此类推进行记录。
1.6. 疾病活动指数(DAI)评分
给予3%DSS水溶液自由饮用期间,每天观察各组实验小鼠的精神活动状况,并记录小鼠的体质量和摄水量、摄食量情况,记录各组小鼠的粪便性状、便血状况,由实验人员参照Li等[18]的评分细则进行评分(表1),根据公式一计算得DAI评分,公式如下:
表 1.
DAI评分量化表
Tab.1 Quantitative table of DAI score
| Weight loss (%) | Feces consistency | Hemafecia | Score |
|---|---|---|---|
| 0 | Normal | N/A | 0 |
| 1-5 | Mild soft | Slight bleeding | 1 |
| 5-10 | Soft and wet | Moderate bleeding | 2 |
| 10-20 | Half loose stool | Gross bleeding | 3 |
| >20 | loose stool | Blood clot around anus | 4 |
1.7. 样本采集与处理
在第7天给药后,小鼠禁食但不禁水。第8天解剖小鼠,采用眼眶静脉丛采集全血样本,室温静置4 h后,置于4 ℃低温离心机以3000 r/min离心10 min,吸取血清至冻存管,储存于-80 ℃冰箱。使用颈椎脱臼法处死小鼠,完整剖取结肠并测量长度。选取距肛门上方0.5 cm的结肠肠管,固定于4%多聚甲醛中待处理,剩余结肠组织存入冻存管,放于-80 ℃冰箱待检测。
1.8. HE染色并行结肠组织病理学评分
将固定于4%多聚甲醛溶液中24 h的结肠组织取出,按要求用不同浓度的乙醇冲洗,接着进行乙醇及二甲苯透明处理。使用适宜熔点的纯净蜡快速浸蜡包埋,得到组织蜡块。蜡块在4 ℃冰箱中过夜后切段,放入清水中,待切片平整无褶皱后捞出,放入60 ℃烘箱过夜,常温保存。将切片以二甲苯和梯度乙醇脱蜡,然后使用苏木素染色液和分化液进行核染色,再用伊红染色液进行胞浆染色,最后以无水乙醇清洗。切片经二甲苯透明处理后,用中性树胶封片,观察结肠黏膜形态、腺体结构、隐窝数量及杯状细胞变化。最后,根据Li等[19]的评分细则,对结肠进行组织病理学评分(表2)。
表 2.
结肠组织病理学评分
Tab.2 Histopathological score of the colon
| Inflammation degree | Inflammation range | Colonic crypt damage | Score |
|---|---|---|---|
| N/A | N/A | Normal | 0 |
| Mild inflammation | Inflammation of the mucosa | One-third of crypt damage | 1 |
| Moderate inflammation | Inflammation of the mucosa and submucosa | Two thirds of crypt damage | 2 |
| Severe inflammation | Inflammation of the mucosa and intestinal wall | Crypts disappeared but epithelium remains | 3 |
| Acute severe inflammation | Transmural inflammation | Both crypts and epithelium disappeared | 4 |
1.9. Western blotting检测结肠组织内质网应激、细胞凋亡、机械屏障等相关蛋白表达
提取新鲜结肠组织总蛋白,使用BCA法测定蛋白浓度。采用8%~12%SDS-PAGE电泳分离总蛋白,转膜(120 V、1 h~1.5 h)后快速封闭20 min,加入兔抗小鼠一抗PERK(1∶1000)、p-PERK(1∶1000)、IRE1α(1∶1000)、p-IRE1α(1∶1000)、eIF2α(1∶1000)、p-eIF2α(1∶1000)、β-tubuin(1∶4000)、Occludin(1∶4000)、E-cadherin (1∶5000)、Claudin-1(1∶2000)、GAPDH(1∶5000)、Bax(1∶1000)、Bcl-2(1∶1000)、cleaved-Caspase-3(1∶1000),4 ℃孵育过夜,洗膜后使用山羊抗兔IgG二抗(1∶5000)孵育2 h,洗膜后加入ECL曝光并拍照,分析各蛋白相对表达量。
1.10. 阿利新蓝-过碘酸雪夫(AB-PAS)染色
石蜡切片以二甲苯和梯度乙醇脱蜡。按照说明书使用阿利新蓝染色液进行染色,随后用水洗涤,进行乙醇脱水后,取PBS染液避光浸染。这后在苏木素分化液和返蓝液中短暂浸没染核,最后用无水乙醇清洗并进行二甲苯透明处理。切片用中性树胶封片,在明场显微镜下观察肠上皮黏液的分泌状况。
1.11. TUNEL染色检测结肠上皮细胞凋亡状况
在室温下,将湿润的石蜡切片以二甲苯和梯度乙醇脱蜡并进行通透处理。使用DNase I处理作为阳性对照。然后,按照一步法TUNEL细胞凋亡检测试剂盒的说明,向每个样品添加50 μL平衡缓冲液进行平衡处理。计算并配制足够的TdT酶反应缓冲液,去除平衡缓冲液后,加入56 μL TdT酶反应缓冲液于37 ℃恒温箱中避光孵育1 h。孵育后,用PBS缓冲液洗涤样本,进行DAPI核染色,室温静置10 min后封片。最后,在荧光显微镜下观察样本中凋亡细胞的情况。
1.12. ELISA检测血清及结肠组织中炎症因子
精密称取50 mg的结肠组织,置于2 mL研磨管中,按1∶9比例加入预冷PBS溶液及3~4 mm研磨珠,使用组织研磨机充分匀浆。随后,将样本转移至4 ℃冰冻离心机,以2000~3000 r/min离心20 min,小心提取上清液,分装备用,其余部分存于-80 ℃冰箱。按照BCA定量试剂盒的说明检测结肠组织上清液浓度,并根据ELISA试剂盒的说明检测血清中IL-6和TNF-α,以及结肠组织中IL-1β和IL-8的含量。
1.13. 免疫组化染色检测结肠组织GRP78、CHOP、Caspase-12蛋白表达
石蜡切片脱蜡后透膜5 min,置于含有3%H2O2的甲醇溶液中避光育2 min,以消除内源性过氧化物酶的活性。随后对切片进行封闭1 h,分别以兔抗小鼠一抗GRP78(1∶500)、CHOP(1∶500)、Caspase-12(1∶500)敷育。然后选择山羊抗兔二抗在室温下敷育2 h。洗涤后,切片滴加DAB显色液覆盖组织并敷育10 min,然后用苏木素染核,用中性树脂封片,在明场显微镜下进行拍摄。
1.14. qRT-PCR检测结肠组织GRP78、CHOP、Caspase-12、ATF4、XBP1s基因表达
提取结肠组织总RNA,采用PrimeScriptTM RT试剂盒将RNA逆转录为模板cDNA。采用Novostart SYBR qPCR SuperMix Plu进行qPCR反应。反应条件设置为95 ℃预变性1 min,95 ℃变性20 s,60 ℃退火1 min,40个循环,收集荧光信号,结果采用2-ΔΔCT计算mRNA的相对表达量。引物序列由生工生物工程(上海)股份有限公司设计合成(表3)。
表 3.
引物序列
Tab.3 Primer sequence
| Gene | Orientation | Sequence (5′ to 3′) |
|---|---|---|
| MUC2 | Forward | AGGGCTCGGAACTCCAGAAA |
| Reverse | CCAGGGAATCGGTAGACATCG | |
| TFF3 | Forward | TTGCTGGGTCCTCTGGGATAG |
| Reverse | TACACTGCTCCGATGTGACAG | |
| AGR2 | Forward | ACAACTGACAAGCACCTTTCTC |
| Reverse | GTTTGAGTATCGTCCAGTGATGT | |
| GRP78 | Forward | ACTTGGGGACCACCTATTCCT |
| Reverse | GTTGCCCTGATCGTTGGCTA | |
| CHOP | Forward | AAGCCTGGTATGAGGATCTGC |
| Reverse | TTCCTGGGGATGAGATATAGGTG | |
| Caspase-12 | Forward | TTGGAAGGTAGGCAAGACTGGTTC |
| Reverse | TCAGTTCACCTGGGACCTCAAATG | |
| ATF4 | Forward | AACCTATAAAGGCTTGCGGC |
| Reverse | GATTTCGTGAAGAGCGCCAT | |
| XBP1s | Forward | AAGAACACGCTTGGGAATGG |
| Reverse | CTGCACCTGCTGCGGAC |
1.15. 统计学方法
采用SPSS 26.0软件用于数据分析,采用Graphpad Prism 9.5.0软件进行制图。计量资料用均数±标准差表示,多组间样本比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2. 结果
2.1. 黄芩汤减轻DSS诱导的UC小鼠的症状
各组小鼠日均摄水量约为4 mL/只,各组间差异并无统计学意义。正常组小鼠日均摄食量约4 g/只,与正常组相比,其余组别小鼠摄食量总体呈下降趋势,但该差异并无统计学意义(P>0.05,图1A、B)。
图 1.
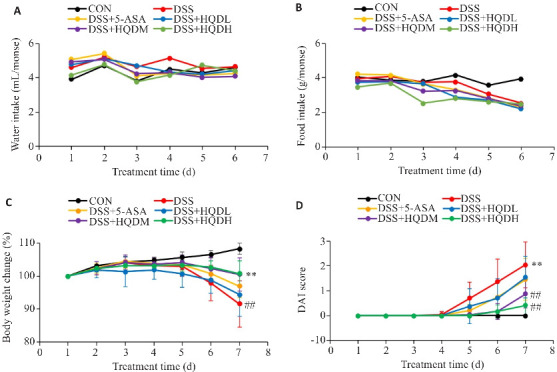
各组小鼠造模期间摄水、摄食及体质量、DAI评分动态变化
Fig.1 Changes of water intake (A), food intake (B), body weight (C) and DAI score (D) of the mice during modeling (Mean±SD, n=8). ## P<0.01 vs CON group; **P<0.01 vs DSS group.
与CON组相比,其余各组小鼠体质量在第5天开始明显下降,伴随出现不同程度的腹泻、血便等情况,DAI评分开始明显上升。至实验第7天,各小组小鼠体质量出现不同程度的下降、DAI评分出现不同程度的上升,其中以DSS组的体质量下降和DAI评分上升最为明显(P<0.01,图1C、D),DSS组小鼠出现精神萎靡、严重腹泻、血便等情况。而予黄芩汤治疗后,实验小鼠精神状态良好、体质量下降趋势减缓,与DSS组相比,HQDM组和HQDH组DAI评分降低(P<0.01,图1C、D)。
2.2. 黄芩汤改善DSS诱导的UC小鼠结肠缩短和病理损伤
与CON组相比,DSS组结肠缩短(P<0.01,图2A、B),与DSS组相比,美沙拉嗪和黄芩汤干预后结肠缩短现象得到遏制,其中以HQDM组和HQDH组的结肠长度恢复最为明显(P<0.01,图2A、B);
图 2.
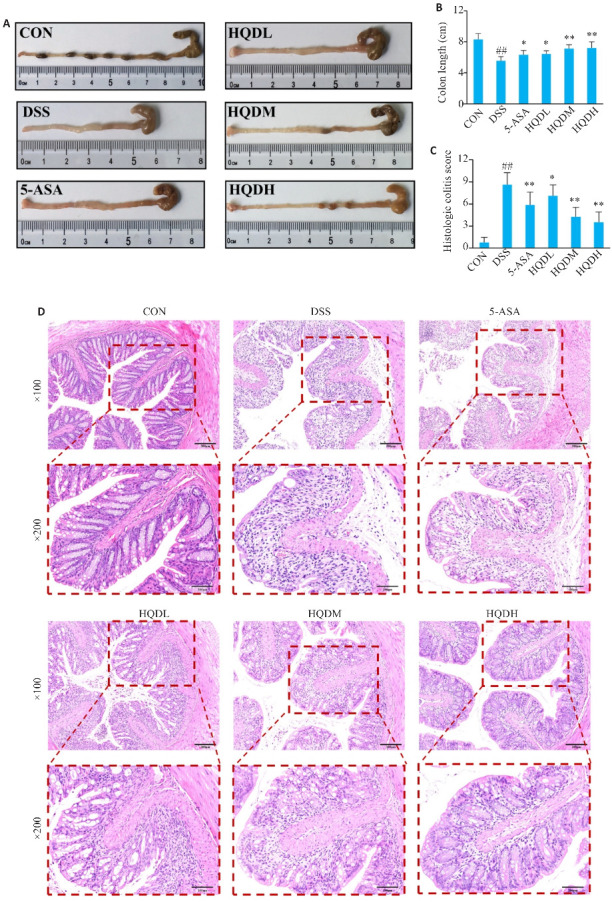
黄芩汤对UC小鼠结肠长度及病理形态的影响
Fig. 2 Effect of Huangqin Decoction on colon length and pathology in UC mice. A: Colon length of the mice in each group. B: Statistics of colon length in each group. C: Histopathological score of the colon in each group (Mean±SD, n=8). D: HE staining of the colon tissues in each group (Original magnification: ×100 or 200). ## P<0.01 vs CON group; *P<0.05, **P<0.01 vs DSS group.
病理切片染色可见DSS组结肠黏膜损伤和炎症浸润严重,包括充血、糜烂、结构损坏以及肠腺坏死,还有明显的黏膜下层水肿。HQDH组小鼠结肠绒毛较完整,肠腺体清晰可见且排列整齐,肌层及黏膜下层没有明显水肿现象(图2 D)。与CON组相比,DSS组结肠宏观病理评分显著升高(P<0.01);与DSS组相比,HQDM和HQDH组的结肠宏观病理评分下降(P<0.01,图2C)。
2.3. 黄芩汤缓解DSS诱导的UC小鼠结肠上皮凋亡状况
与CON相比,DSS组小鼠结肠皱壁上的阳性细胞个数增多、平均荧光强度上升(P<0.01),给药组均见凋亡细胞数的减少、平均荧光强度下降(P<0.01,图3)。
图 3.
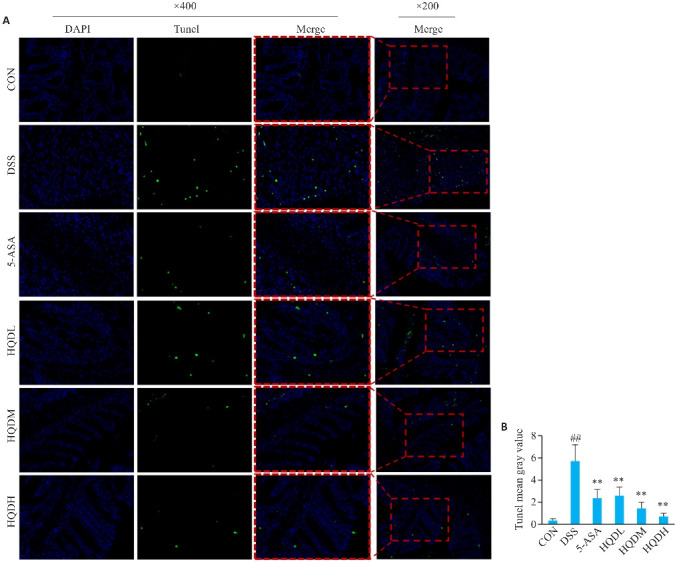
黄芩汤对UC小鼠结肠上皮细胞凋亡的影响
Fig.3 Effect of Huangqin decoction on apoptosis of colonic epithelial cells in UC mice. A: TUNEL staining of the colon tissue in each group (×400 or 200). B: Mean fluorescence intensity in each group (Mean±SD, n=3) . ## P<0.01 vs CON group;**P<0.01 vs DSS group.
2.4. 黄芩汤下调DSS诱导的UC小鼠促炎细胞因子的表达
与CON组相比,DSS组血清中促炎细胞因子IL-6、TNF-α和结肠组织上清中促炎细胞因子IL-1β、IL8含量升高(P<0.01)。与DSS组相比,各给药组促炎细胞因子IL-6、TNF-α、IL-1β、IL8含量均下调(P<0.01,图4)。
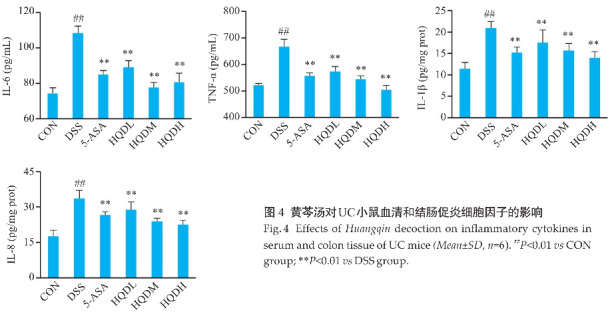
2.5. 黄芩汤改善DSS诱导的UC小鼠肠道化学屏障损伤
采用AB-PAS染色法检测杯状细胞分泌情况,并利用qRT-PCR分析MUC2、TFF3和AGR2基因的表达水平。与CON组相比,DSS组酸性糖蛋白与中性糖原减少(图5 A),同时MUC2、TFF3和AGR2基因的表达下降(P<0.05,图5B、C)。与DSS组相比,5-ASA组MUC2基因没有统计学差异(P>0.05);HQDH组酸性糖蛋白与中性糖原增多,且MUC2(P<0.05)和TFF3基因(P<0.01)的表达升高,然而AGR2基因的表达差异无统计学意义(P>0.05,图5)。
图 5.
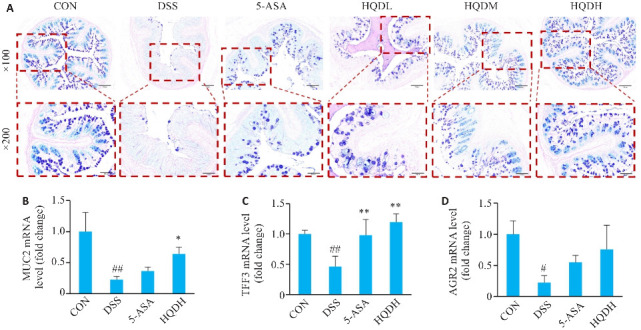
黄芩汤对UC小鼠黏蛋白和杯状细胞分泌的影响
Fig.5 Effect of Huangqin Decoction on mucin and goblet cell secretion in UC mice (Mean±SD, n=3). A: AB-PAS staining of mice in each group (×100, ×200). B:Expression of MUC2 MRNA. C: Expression of TFF3 MRNA. D: Expression of AGR2 mRNA. # P<0.005, ## P<0.01 vs CON group; *P<0.05, **P<0.01 vs DSS group.
2.6. 黄芩汤改善DSS诱导的UC小鼠肠道机械屏障损伤
与CON组相比,DSS组Claudin-1、Occludin和 E-cadherin蛋白表达降低(P<0.01)。与DSS组相比,5-ASA组E-cadherin蛋白差异没有统计学意义(P>0.05),HQDH组Claudin-1、Occludin和E-cadherin的蛋白表达升高(P<0.05,图6)。
图 6.
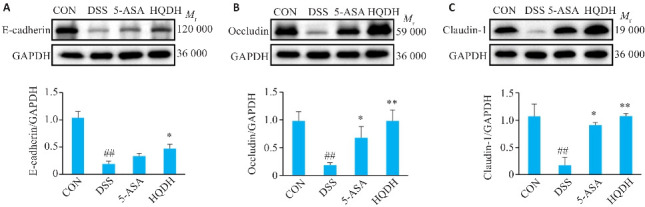
黄芩汤对UC小鼠结肠上皮机械屏障蛋白表达的影响
Fig 6 Effect of Huangqin Decoction on mechanical barrier function of the colonic epithelium in UC mice (Mean±SD, n=3). ## P<0.01 vs CON group; *P<0.05, **P<0.01 vs DSS group. A: E-cadherin. B: Occludin. C: Claudin-1.
2.7. 黄芩汤抑制UC小鼠内质网应激中GRP78蛋白和基因的表达
免疫组化染色及阳性面积占比分析结果显示,与CON组相比,DSS组GRP78在结肠中表达升高(P<0.01),而相比于DSS组,HQDH组黄芩汤干预下GRP78蛋白表达水平降低(P<0.01,图7A、B)。qRT-PCR结果表明黄芩汤能够抑制GRP78基因的过度表达(P<0.01,图7C)。
图 7.
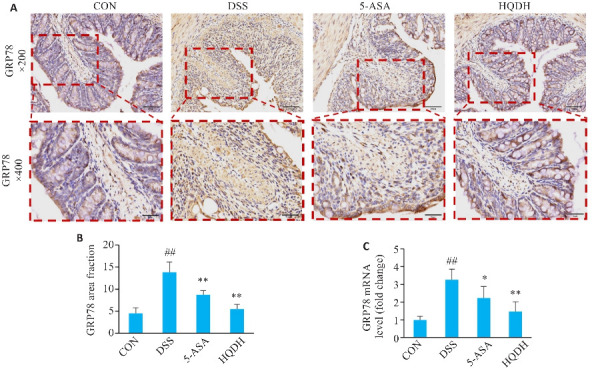
黄芩汤对UC小鼠GRP78基因和蛋白表达的影响
Fig.7 Effect of Huangqin Decoction on expression of GRP78 mRNA and protein in UC mice (Mean±SD, n=6). A: Immunohistochemistry staining of GRP78 protein of mice in each group (×200, ×400). B: Area fraction of GRP78 protein of mice in each group. C: Expression of GRP78 mRNA; ## P<0.01 vs CON group; *P<0.05, **P<0.01 vs DSS group.
2.8. 黄芩汤抑制UC小鼠内质网应激PERK和IRE1α通路的激活
与CON组相比,DSS组PERK、IREα、eIF2α显著活化,蛋白磷酸化水平上升(P<0.05,图8A~C),与DSS组相比,HQDH组抑制了PERK、IREα(P<0.01,图8 A、B)和eIF2α(P<0.05,图8C)蛋白磷酸化水平。
图 8.
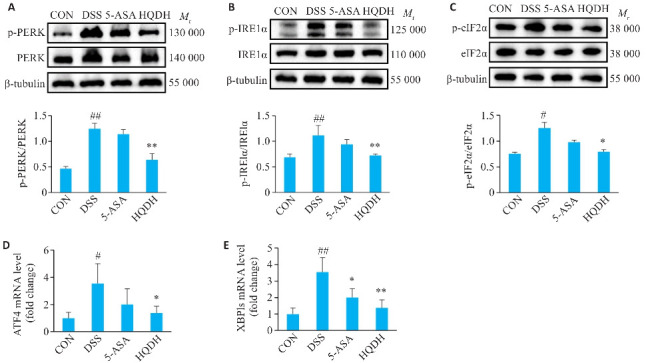
黄芩汤对UC小鼠内质网应激通路相关蛋白和基因的影响
Fig.8 Effect of Huangqin decoction on protein and mRNA expressions related to endoplasmic reticulum stress pathway in UC mice (Mean±SD, n=3). ## P<0.01 vs CON group; *P<0.05, **P<0.01 vs DSS group. A: p-PERK/PERK. B: p-IRElα/IRElα. C: p-eIF2α/eIF2α. D: ATF4 mRNA level (fold change). E: XBPls mRNA level (fold change).
与CON相比,DSS组ATF4和XBP1s基因表达上升(P<0.05);与DSS组相比,HQDH组ATF4(P<0.05,图8D)和XBP1s基因表达下调(P<0.01,图8E)。
2.9. 黄芩汤可能通过内质网途径抑制Caspase凋亡通路
与CON组相比,DSS组CHOP和Caspase-12在结肠中的表达升高(P<0.01),与DSS组相比,HQDH组上述蛋白表达水平均降低(P<0.01,图9A~C)。qRT-PCR显示,黄芩汤能够下调CHOP基因和Caspase-12基因的表达水平(P<0.01,图9 D、E)。
图 9.
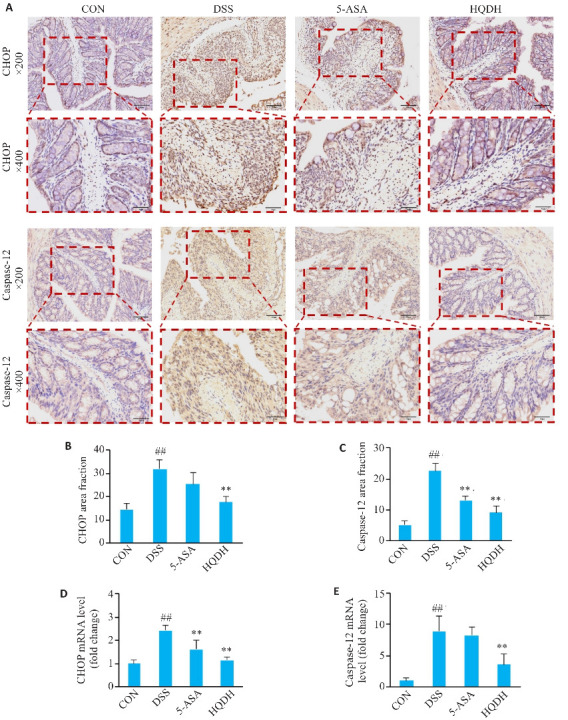
黄芩汤对UC小鼠ERS中CHOP和Caspase-12的影响
Fig.9 Effect of Huangqin Decoction on CHOP and Caspase-12 expressions in UC mice (Mean±SD, n=3). A: Immunohistochemistry staining of CHOP and Caspase-12 protein of mice in each group (×200, ×400). B-C: Area fraction of immunohistochemistry staining of CHOP and Caspase-12 protein of mice in each group. D-E: Expression of CHOP and Caspase-12 mRNA; ## P<0.01 vs CON group; **P<0.01 vs DSS group.
与CON组相比,DSS组Bcl-2/Bax降低(P<0.01)、cleaved-Caspase-3/β‑Tubulin升高(P<0.01),与DSS组相比,HQDH组Bcl-2/Bax升高(P<0.01)、cleaved-Caspase-3/β-Tubulin降低(P<0.01,图10)。
图 10.
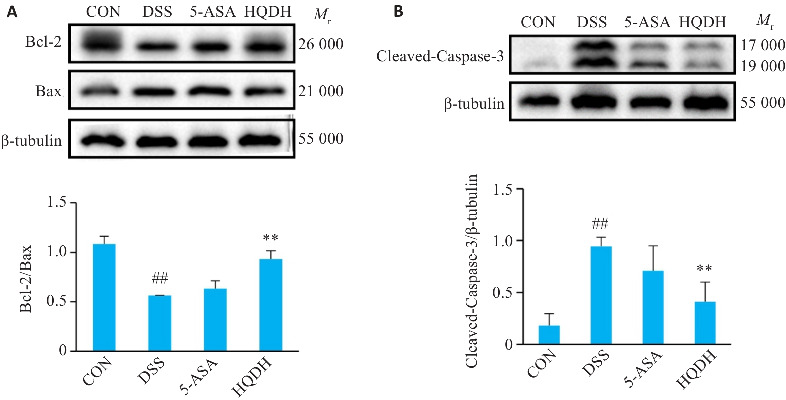
黄芩汤对UC小鼠Bcl-2、Bax、Cleaved-Caspase-3的影响
Fig 10 Effect of Huangqin Decoction on Bcl-2, Bax and Caspase-3 expressions in UC mice (Mean±SD, n=3). ## P<0.01 vs CON group; **P<0.01 vs DSS group. A: Bcl-2/Bax. B: Cleaved-Caspase-3/β-tubulin.
3. 讨论
UC的病因以及引发并延续UC黏膜炎症的关键驱动因素尚未完全明确。但随着科学探索的不断深入,越来越多的学者发现ERS在UC的发病过程中扮演着重要的角色,过度的ERS可能通过诱导肠上皮细胞死亡、损害黏膜屏障功能和激活肠道内的促炎反应导致UC[8-12]。本研究采用DSS诱导的UC小鼠模型,以美沙拉嗪为阳性对照组与黄芩汤组进行药效对比,结合DAI评分、结肠长度及病理变化等指标,评估黄芩汤对UC小鼠的药效作用。结果显示,黄芩汤高剂量组能够缓解UC小鼠的体质量下降情况、降低DAI评分,各给药组均能缓解结肠短缩和结肠病理损伤。肠上皮细胞凋亡是UC的重要表现,模型组小鼠结肠组织TUNEL染色表现出相当高的阳性率,而各给药组均能够抑制UC小鼠结肠上皮的细胞凋亡情况,减轻了结肠上皮损伤,同时,AB-PAS染色结果显示黄芩汤显著改善杯状细胞功能,促进黏液分泌和黏液层恢复,其药效结果与结肠病理表现相符,以黄芩汤中高剂量组为优。ELISA法检测血清中IL-6和TNF-α评估系统性炎症反应水平,检测结肠组织中IL-1β和IL-8评估结肠炎症水平,在黄芩汤的干预下,UC小鼠的促炎细胞因子表达均显著下降,且整体改善效果呈现一定的剂量依赖性。PCR结果显示,黄芩汤高剂量组UC小鼠结肠组织中的MUC2和TFF3的基因表达水平显著升高,同时Western blotting结果显示黄芩汤高剂量组UC小鼠结肠组织中的Claudin-1、Occludin、E-cadherin的蛋白表达升高,表明黄芩汤对UC小鼠肠道化学屏障和机械屏障具有改善作用。以上实验证明,黄芩汤能够有效改善UC小鼠的症状和病理损伤,抑制炎症和凋亡反应,促进屏障功能恢复。
GRP78是ERS反应中的关键蛋白感应器,在UC急性期ERS发生并诱导未折叠蛋白反应时,GRP78的表达会上调进而激活PERK-eIF2α和IRE1α-XBP1通路,促进错误折叠蛋白降解和蛋白翻译衰减,此外也可能触发促炎基因、自噬基因和凋亡基因的激活[20-22]。炎症状态下,细胞因子或趋化因子等蛋白质的大量加工合成会加重内质网负担[23-25],ERS相关分子缺陷的小鼠模型研究也表明,ERS在分泌型肠上皮细胞中与抗菌防御和肠道炎症相关[20, 26-29]。在本次实验的研究结果中,DSS组GRP78的基因和蛋白表达显著上调,下游PERK、eIF2α、IRE1α的蛋白磷酸化均显著增强,ATF4、XBP1s的基因表达显著增加,提示ERS的发生。而在黄苓汤干预下,以上异常表达的现象均得到显著抑制,表明黄芩汤可能是通过抑制GRP78以及抑制PERK-eIF2α、IRE1α-XBP1通路的激活,从而抑制过度ERS的发生,这有助于促进细胞内质网功能的恢复。CHOP、Caspase-12是ERS特异性转录的凋亡信号分子,当细胞无法通过未折叠蛋白反应恢复平衡时,持续的ERS会通过CHOP和Caspase-12诱导细胞凋亡,其中CHOP通过抑制Bcl-2表达和促进Bax激活,从而引发线粒体途径的细胞凋亡反应,而Caspase-12被认为可以不依赖线粒体细胞色素C所调控的凋亡信号而直接激活Caspase级联反应,Caspase-3蛋白水解酶是执行细胞凋亡作用的终未分子[30-32]。在黄芩汤的干预下,CHOP和Caspase-12的基因和蛋白表达显著降低,Bcl-2/Bax比例显著升高、同时Cleaved-Caspase-3活化水平降低。以上结果表明,黄芩汤能够抑制过度的ERS,并可能基于调控内质网所介导的内源性细胞凋亡过程发挥了缓解UC的作用。
综上所述,本研究结果表明,黄芩汤能够抑制UC小鼠的细胞凋亡反应并改善肠道屏障功能,其机制可能与PERK和IRE1α信号通路介导的内质网应激有关。黄芩汤的复杂成分通过多种相互作用发挥治疗UC的药效,涉及多种作用靶点和途径,例如与ERS有关的多信号通路和调控因子。然而,目前的实验方法和途径并不足以全面揭示其药理机制,未来仍需进一步深入研究其药效分子和靶点,以更好地理解其药理作用。
基金资助
国家自然科学基金(82274227);广东省基础与应用基础研究基金(2022A1515140011,2021B1515140043,2022A1515010092,2021A1515220162)
Supported by National Natural Science Foundation of China (82274227).
参考文献
- 1. Eisenstein M. Ulcerative colitis: towards remission[J]. Nature, 2018, 563(7730): S33. [DOI] [PubMed] [Google Scholar]
- 2. Ungaro R, Mehandru S, Allen PB, et al. Ulcerative colitis[J]. Lancet, 2017, 389(10080): 1756-70. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Rieder F, Karrasch T, Ben-Horin S, et al. Results of the 2nd scientific workshop of the ECCO (III): basic mechanisms of intestinal healing[J]. J Crohns Colitis, 2012, 6(3): 373-85. [DOI] [PubMed] [Google Scholar]
- 4. Ho GT, Cartwright JA, Thompson EJ, et al. Resolution of inflammation and gut repair in IBD: translational steps towards complete mucosal healing[J]. Inflamm Bowel Dis, 2020, 26(8): 1131-43. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Adolph TE, Meyer M, Schwärzler J, et al. The metabolic nature of inflammatory bowel diseases[J]. Nat Rev Gastroenterol Hepatol, 2022, 19(12): 753-67. [DOI] [PubMed] [Google Scholar]
- 6. Solà-Tapias N, Vergnolle N, Denadai-Souza A, et al. The interplay between genetic risk factors and proteolytic dysregulation in the pathophysiology of inflammatory bowel disease[J]. J Crohns Colitis, 2020, 14(8): 1149-61. [DOI] [PubMed] [Google Scholar]
- 7. Larabi A, Barnich N, Nguyen HTT. New insights into the interplay between autophagy, gut microbiota and inflammatory responses in IBD[J]. Autophagy, 2020, 16(1): 38-51. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Eugene SP, Reddy VS, Trinath J. Endoplasmic reticulum stress and intestinal inflammation: a perilous union[J]. Front Immunol, 2020, 11: 543022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. van der Post S, Jabbar KS, Birchenough G, et al. Structural weakening of the colonic mucus barrier is an early event in ulcerative colitis pathogenesis[J]. Gut, 2019, 68(12): 2142-51. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Ren MT, Gu ML, Zhou XX, et al. Sirtuin 1 alleviates endoplasmic reticulum stress-mediated apoptosis of intestinal epithelial cells in ulcerative colitis[J]. World J Gastroenterol, 2019, 25(38): 5800-13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Naama M, Telpaz S, Awad A, et al. Autophagy controls mucus secretion from intestinal goblet cells by alleviating ER stress[J]. Cell Host Microbe, 2023, 31(3): 433-46. e4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Coleman OI, Haller D. ER stress and the UPR in shaping intestinal tissue homeostasis and immunity[J]. Front Immunol, 2019, 10: 2825. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. 黄 煌. 黄芩汤的拓展应用与适用人群特征[J]. 南京中医药大学学报, 2022, 38(9): 761-4. [Google Scholar]
- 14. 铉 力, 王晓红, 胡 兵, 等. 复方黄芩汤治疗湿热型溃疡性结肠炎临床观察[J]. 光明中医, 2024, 39(2): 281-4. [Google Scholar]
- 15. 高 勤, 陈一川, 杨 宸, 等. 黄芩汤治疗溃疡性结肠炎疗效与安全性的Meta分析[J]. 海南医学, 2021, 32(10): 1343-9. [Google Scholar]
- 16. Li MY, Li MX, Xu N, et al. Effects of Huangqin Decoction on ulcerative colitis by targeting estrogen receptor alpha and ameliorating endothelial dysfunction based on system pharmacology[J]. J Ethnopharmacol, 2021, 271: 113886. [DOI] [PubMed] [Google Scholar]
- 17. Li MY, Luo HJ, Wu X, et al. Anti-inflammatory effects of Huangqin Decoction on dextran sulfate sodium-induced ulcerative colitis in mice through regulation of the gut microbiota and suppression of the ras-PI3K-akt-HIF-1α and NF‑κB pathways[J]. Front Pharmacol, 2020, 10: 1552. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Li MY, Wu YZ, Qiu JG, et al. Huangqin Decoction ameliorates ulcerative colitis by regulating fatty acid metabolism to mediate macrophage polarization via activating FFAR4-AMPK-PPARα pathway[J]. J Ethnopharmacol, 2023, 311: 116430. [DOI] [PubMed] [Google Scholar]
- 19. Li MX, Li MY, Lei JX, et al. Huangqin decoction ameliorates DSS-induced ulcerative colitis: role of gut microbiota and amino acid metabolism, mTOR pathway and intestinal epithelial barrier[J]. Phytomedicine, 2022, 100: 154052. [DOI] [PubMed] [Google Scholar]
- 20. Rodrigues BL, Dotti I, Pascoal LB, et al. Endoplasmic reticulum stress in colonic mucosa of ulcerative colitis patients is mediated by PERK and IRE1 pathway activation[J]. Mediators Inflamm, 2022: 6049500. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Lebeaupin C, Proics E, de Bieville CHD, et al. ER stress induces NLRP3 inflammasome activation and hepatocyte death[J]. Cell Death Dis, 2015, 6(9): e1879. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. Akbal A, Dernst A, Lovotti M, et al. How location and cellular signaling combine to activate the NLRP3 inflammasome[J]. Cell Mol Immunol, 2022, 19(11): 1201-14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23. Iwasaki Y, Suganami T, Hachiya R, et al. Activating transcription factor 4 links metabolic stress to interleukin-6 expression in macrophages[J]. Diabetes, 2014, 63(1): 152-61. [DOI] [PubMed] [Google Scholar]
- 24. Oslowski CM, Hara T, O' Sullivan-Murphy B, et al. Thioredoxin-interacting protein mediates ER stress-induced β cell death through initiation of the inflammasome[J]. Cell Metab, 2012, 16(2): 265-73. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25. Choi EH, Park SJ. TXNIP: a key protein in the cellular stress response pathway and a potential therapeutic target[J]. Exp Mol Med, 2023, 55(7): 1348-56. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Heazlewood CK, Cook MC, Eri R, et al. Aberrant mucin assembly in mice causes endoplasmic reticulum stress and spontaneous inflammation resembling ulcerative colitis[J]. PLoS Med, 2008, 5(3): e54. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. Zhao F, Edwards R, Dizon D, et al. Disruption of Paneth and goblet cell homeostasis and increased endoplasmic reticulum stress in Agr2-/ - mice[J]. Dev Biol, 2010, 338(2): 270-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Hu XM, Deng JL, Yu TM, et al. ATF4 deficiency promotes intestinal inflammation in mice by reducing uptake of glutamine and expression of antimicrobial peptides[J]. Gastroenterology, 2019, 156(4): 1098-111. [DOI] [PubMed] [Google Scholar]
- 29. Kaser A, Lee AH, Franke A, et al. XBP1 links ER stress to intestinal inflammation and confers genetic risk for human inflammatory bowel disease[J]. Cell, 2008, 134(5): 743-56. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30. Zhang Q, Liu JN, Chen SL, et al. Caspase-12 is involved in stretch-induced apoptosis mediated endoplasmic reticulum stress[J]. Apoptosis, 2016, 21(4): 432-42. [DOI] [PubMed] [Google Scholar]
- 31. Yang L, Wang J, Yang J, et al. Antioxidant metallothionein alleviates endoplasmic reticulum stress-induced myocardial apoptosis and contractile dysfunction[J]. Free Radic Res, 2015, 49(10): 1187-98. [DOI] [PubMed] [Google Scholar]
- 32. Sano R, Reed J C. ER stress-induced cell death mechanisms[J]. Biochimica et biophysica acta, 2013, 1833(12): 3460-70. [DOI] [PMC free article] [PubMed] [Google Scholar]


