Abstract
目的
探索外周血浆中与帕金森病(PD)诊疗相关的关键基因和长链非编码RNA(lncRNA)。
方法
收集6例PD患者和6例健康对照者的外周血血浆样本。采用竞争性内源性RNA(ceRNA)芯片技术检测mRNA和lncRNA的表达,运用生物信息学方法对差异表达的基因进行分析。将DElncRNAs上游或下游10 kb内转录的DEmRNAs定义为DElncRNAs潜在的可顺式调控的靶基因。构建PD特异性蛋白质-蛋白质相互作用网络。利用差异lncRNAs与mRNA及已知的microRNA构建ceRNA网络。采用MPP+处理SH-SY5Y细胞建立PD细胞模型,验证关键lncRNA的功能。
结果
PD患者与健康对照者间有316个基因和986个lncRNA的表达存在差异(P<0.05)。通过GO和KEGG富集分析对差异表达的mRNA和lncRNA潜在的可顺式调控的靶基因进行了功能注释,预测了差异表达的mRNA和lncRNAs与microRNA的靶向关系,并根据差异表达的lncRNA的上调或下调分别构建了ceRNA网络。基于网络分析,推测lnc-MTG2-1∶1、lnc-CTSD-5∶1、lnc-PCCA-3∶1、lnc-VTCN1-3∶1、lnc-ZNF25-7∶1和lnc-DAZ3-1∶1可能是PD的关键lncRNA。在MPP+诱导的PD细胞模型中,lnc-CTSD-5∶1的表达变化最显著(P<0.01),且其沉默有助于恢复酪氨酸羟化酶的蛋白表达水平。
结论
PD患者血浆中的lncRNA表达模式发生改变,本研究发现了新的DEGs和DElncRNAs,为探索PD的发病机制和开发潜在的生物标志物提供了新的线索。
Keywords: 帕金森病, 血浆, 长链非编码RNA, 生物信息学分析, 酪氨酸羟化酶
Abstract
Objective
To explore the key genes and long non-coding RNAs (lncRNAs) associated with Parkinson's disease (PD).
Methods
Peripheral blood plasma samples were collected from 6 PD patients and 6 healthy individuals. The mRNA and lncRNA expression profiles were detected using ceRNA microarray technology, and the differentially expressed genes were analyzed using bioinformatics methods. The differentially expressed mRNAs transcribed within 10 kb upstream or downstream of the differentially expressed lncRNAs were defined as potential cis-regulatable (Cis) target genes of the lncRNAs. A PD-specific protein-protein interaction network (PPI) was constructed. Competitive endogenous RNA (ceRNA) networks were also constructed using the differential lncRNAs with mRNAs and known microRNAs. Using MPP+-treated SH-SY5Y cells as a PD cell model, the expressions of the key lncRNAs and their functions were examined.
Results
We identified 316 genes and 986 lncRNAs showing significant differential expressions in PD patients (P<0.05). The differentially expressed mRNAs and the potential cis-regulatable target genes of these lncRNAs were functionally annotated using GO and KEGG enrichment analysis, and the targeting relationship of the differentially expressed mRNAs and lncRNAs with microRNAs were predicted. Analysis of the ceRNA networks constructed based on the differentially expressed lncRNAs suggested that lnc-MTG2-1:1, lnc-CTSD-5:1, lnc-PCCA-3:1, lnc-VTCN1-3:1, lnc-ZNF25-7:1, and lnc-DAZ3-1:1 might be the key lncRNAs in PD. In MPP+-treated SH-SY5Y cells, the expression of lnc-CTSD-5:1 showed the most significant changes, and silencing lnc-CTSD-5:1 obviously restored the expression level of tyrosine hydroxylase.
Conclusion
PD patients have significant changes in plasma lncRNA expression profile, and the differentially expressed genes and lncRNAs found in this study may provide new clues for exploring the pathogenesis and identifying potential biomarkers of PD.
Keywords: Parkinson's disease, plasma, long non-coding RNA, bioinformatics analysis, tyrosine hydroxylase
帕金森病(PD)是常见的神经退行性疾病,PD患者典型临床症状包括运动迟缓、肌肉僵硬、平衡失调和静止性震颤,产生这些运动障碍的主要原因是黑质区多巴胺能神经元进行性丢失,导致纹状体多巴胺缺乏,进而导致运动障碍 [1, 2]。PD分子发病机制涉及多种途径、机制,包括α-突触核蛋白(α-syn)的降解、线粒体功能障碍、氧化应激、自噬和凋亡、钙稳态、轴突转运、神经炎症和表观遗传调控等[3]。目前PD尚无彻底根治的方法,其病理机制仍待进一步阐明。
长非编码RNA(lncRNAs)是一类长度超过200个核苷酸的非蛋白质编码转录物。近年来,研究发现lncRNA在大脑功能和中枢神经系统疾病中的关键作用[4-6]。lncRNA的生物学功能覆盖了从调节大脑的进化过程、神经发育到影响行为模式和认知功能的各个方面。虽然不编码蛋白,但lncRNAs可以通过顺式作用机制(Cis)调控其邻近基因的转录[7-9],可通过内源竞争RNA的方式海绵化microRNAs,进而调控mRNA的表达[10, 11]。lncRNAs在PD发生发展中的作用已引起广泛关注。有报道显示多种lncRNAs在PD中发挥作用,参与PD多种病理过程的调控,如NEAT1[12-14]、SNHG14[15]、MAPT-AS1和HOTAIR[16]可作为潜在的治疗靶点。然而,PD关联lncRNA的鉴定和功能的研究仍然不足。本研究的目的是鉴定新型lncRNA并验证其在PD中的作用。
本研究首先通过ceRNA芯片和生物信息学分析鉴定PD和正常对照之间差异表达的lnc RNA(DElncRNAs)和DEmRNAs。鉴定DElncRNAs靶向DEmRNAs附近的顺式作用元件。通过GO和KEGG对DEmRNAs及DElncRNAs潜在的Cis靶基因进行功能注释,有助于探索DEmRNAs和DElncRNAs在PD中的生物学功能。本研究将为了解PD的发病机制和开发潜在的生物标志物提供新的线索。
1. 资料和方法
1.1. 患者选择、血浆样本采集和处理
收集6例PD患者和6例健康对照者的外周血血浆样本。PD病例来源于襄阳第一人民医院住院患者,根据2016年MDS临床诊断标准诊断为原发性PD。健康对照组为同期在襄阳第一人民医院的体检人群,诊断无PD、PD综合征及其他神经系统疾病,与PD患者年龄、性别相当。采集研究对象空腹外周血2.5 mL,经4 ℃ 3000 g离心5 min取上层血浆,并在处理前储存于-80 ℃冰箱。本项目获襄阳第一人民医院伦理委员会批准(伦理批号:2020KY027),已获参与者知情同意。
1.2. RNA提取、微阵列杂交和扫描
血浆由上海伯豪生物科技有限公司进行RNA提取并使用SBC Human (4×180 K) ceRNA芯片对外周血血浆lncRNA和mRNA进行分析。
1.3. 差异表达mRNA及lncRNA的筛选
芯片扫描得到的原始数据由R软件中limma包进行归一化处理,所用算法为Quantile。采用Fold-change以及T检验对差异基因进行筛选,挑选条件如下:Fold Change (linear)≤0.5或者Fold Change (linear)≥2;T-test P<0.05。
1.4. 差异mRNA的GO富集分析和KEGG富集分析
为详细分析调控途径,用R/bioconductor数据包clusterProfiler对差异mRNA进行GO富集分析和KEGG富集分析。
1.5. 蛋白质相互作用网络(PPI)分析
通过STRING数据库(https://string-db.org/)对蛋白互作分析,并使用Cytoscape (V3.9.1)软件进行可视化构图。
1.6. lncRNA靶基因预测及lncRNA cis网络
LncRNA可能会以顺式(Cis-)调控临近基因的表达。选取与lncRNA基因组坐标距离小于10 kb的基因作为Cis作用的靶基因,并对靶基因进行PPI网络分析。
1.7. 靶向DElncRNAs的ceRNA网络构建
LncRNA可通过碱基互补方式竞争性吸附miRNA,作为竞争性内源性RNA (ceRNA)抑制miRNA对靶基因的调控。使用芯片中检测到的DElncRNAs、DEmRNAs与所有已知的miRNA构建ceRNA网络。使用miRanda (v3.3a)预测lncRNAs和miRNAs之间的关系,使用TargetScan数据库(V7.2)预测miRNAs和demmRNA之间的关系。使用Cytoscape (V3.9.1)软件显示lncRNA-miRNA-mRNA对ceRNA的调控网络。
1.8. PD细胞模型的构建及关键lncRNA的验证
SH-SY5Y细胞(武汉普诺赛生物有限公司)用含有10%胎牛血清(Sigma)和1%青霉素/链霉素的高糖DMEM(GIBCO)培养。将对数期生长的SH-SY5Y细胞按3×103/(100 μL·孔)接种至96孔板,用0、125、250、500、1000、2000 μmol/L MPP+处理24、48、72 h,之后进行CCK-8检测,计算细胞活性。
1.9. lnc-CTSD-5∶1 siRNA干扰
silencer-lnc-CTSD-5∶1由广州锐博生物技术有限公司进行设计合成。该siRNA靶向的序列包括:TCG GACTCCAACCTCCAGGA;GCTCAACAGTGCCTC CATTC;GCCTGAACAAATTACTTAGG;GCAGCCT GAACAAATTACT;GAAGCCTTAGTCGCTAATA;G CAGCCATTGCCATGTTTA。使用Lipofectamine RNAiMAX(Invitrogen)按照说明书步骤进行细胞转染,48 h后进行干扰效果检测。
1.10. qRT-PCR检测
细胞加入TRIZOL试剂裂解细胞,吹打后转移至无核酶EP管,加入1/5体积氯仿,4 ℃ 12 000 g离心15 min,分离上层水相至新EP管中,加入等体积异丙醇混匀后4 ℃ 12 000 g离心10 min,弃上清,加入75%乙醇4 ℃ 7500 g离心5 min,弃上清,置于空气中干燥RNA;使用紫外分光光度计测量RNA浓度和纯度;使用TaKaRa PrimeScript RT Master Mix RR036试剂盒进行逆转录操作,获得cDNA,并以此为模版使用TaKaRa荧光PCR试剂盒TB Green® Premix Ex Taq™ II进行q-RTPCR扩增检测。以GAPDH为内参,3次重复,使用2-ΔΔCT分析基因的相对表达量。引物序列如下:lnc-CTSD-5:1上5'-GCCTTAGTCGCTAATACTTCAGAA-3',下5'-TGT GTCTCATCTCCTCTTGTTA-3';lnc-MTG2-1:1上5'-CTTGGAGTGCCTGCTTGTTG-3',下5'-TGTTGAT GATGATGATGGTGATGG-3'; lnc-PCCA-3:1上5'-A TAGCAATGTCCTCCTGATTCAAG-3',下5'-CCACC TCAGCCTCCAAGTAG-3';lnc-VTCN1-3:1:上5'-GG CGTCTCTTCATTGTTCAGT-3',下5'-CAGCACCTC CTTATTCATCCATT-3';lnc-DAZ3-1:1上5'-AGAAC GAAGCAACAAGAGAACA-3',下5'-GTAGAAGAG TAGAGCCAGATAGCA-3';lnc-ZNF25-7:1上5'-CAA GAGACCTGAAAGTGTGGGC-3',5'-TCTTCCAGTG TGGGATCCATGTCC-3';GAPDH上5'-AGAAGGCT GGGGCTCATTTG-3',下5'-AGGGGCCATCCACAG TCTTC-3'。
1.11. Western blotting检测
使用含有PMSF及蛋白酶抑制剂的RIPA裂解细胞,经超声后4 ℃ 12 000 g离心15 min,收集上清,通过BCA进行蛋白浓度检测,加入1/4体积的5*SDS-PAGE蛋白上样缓冲液于100 ℃金属浴10 min进行变性处理,之后进行SDS-PAGE电泳,转模至PVDF,5%牛奶封闭2 h后加入酪氨酸羟化酶(TH)抗体(Proteintech,1∶1000)、GAPDH(Proteintech,1∶2000)抗体4 ℃封闭过夜,TBST洗膜后加入辣根过氧化物酶标记的山羊抗兔二抗室温孵育2 h后,TBST洗膜,使用ECL显影液于Bio-Rad成像仪中进行检测。
1.12. 统计学分析
用GraphPad Prism8进行统计分析,计量资料以均数±标准差表示,组间比较采用单因素方差分析或两独立样本t检验,P<0.05为差异有统计学意义。
2. 结果
2.1. lncRNA和mRNA的差异表达分析
PD组与对照组比较,共获得316个DEmRNAs(185个上调,131个下调)和986个DElncRNAs(573个上调,413个下调)(图1A、B)。聚类热图显示了每个样本中的所有DEmRNAs和DElncRNAs(图1C、D)。
图1.
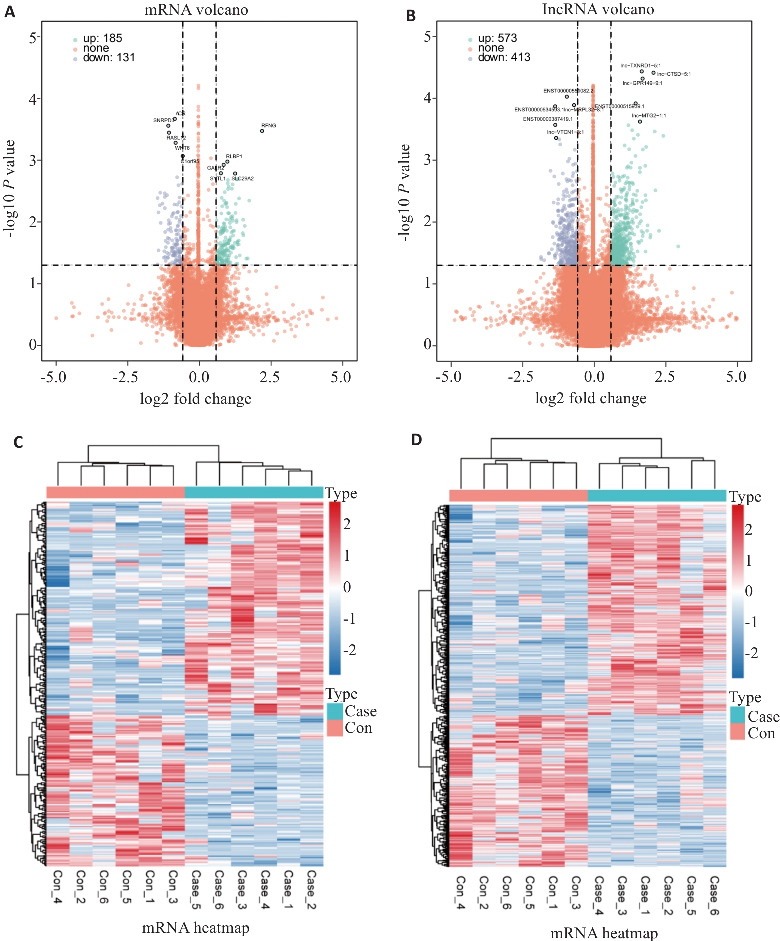
PD患者和健康对照的差异表达基因(DEGs)及lncRNA(DElncRNAs)
Fig.1 Differentially expressed genes (DEGs) and lncRNA (DElncRNAs) between PD and healthy individuals. A, B: Volcanic maps showing differences in plasma lncRNA and mRNA levels between PD patients and healthy control individuals. The significantly up-regulated DEmRNAs and DElncRNAs are shown in green, the significantly down-regulated DemRNAs are shown in blue, and those without significant differences are shown in orange. C, D: Cluster heat map showing all DEmRNAs and DElncRNAs in each sample.
2.2. DEmRNAs的PPI网络
将DEmRNAs导入STRING数据库构建PPI(图2A),红色和绿色分别表示上调和下调的DEmRNAs。对DEmRNAs进行GO富集分析显示:上调DEmRNAs富集的生物过程包括兴奋性突触后电位的调节、干扰素β的产生、蛋白质插入膜、神经递质水平的调节、微管囊泡运输、突触囊泡细胞骨架运输和蛋白质位置的维持;下调DEmRNAs富集的生物过程包括神经元投射发育的调控、平面极性建立的调控、多巴胺能神经元分化、脂质易位、树突发育、细胞投射组织的负调控和蛋白K63关联的去泛素化(图2B)。KEGG分析显示,下调DEmRNAs富集于Erbb信号通路、Purine_Metabolism、Jak Stat信号通路、神经营养因子信号通路、B细胞受体信号通路(图2C)。
图2.
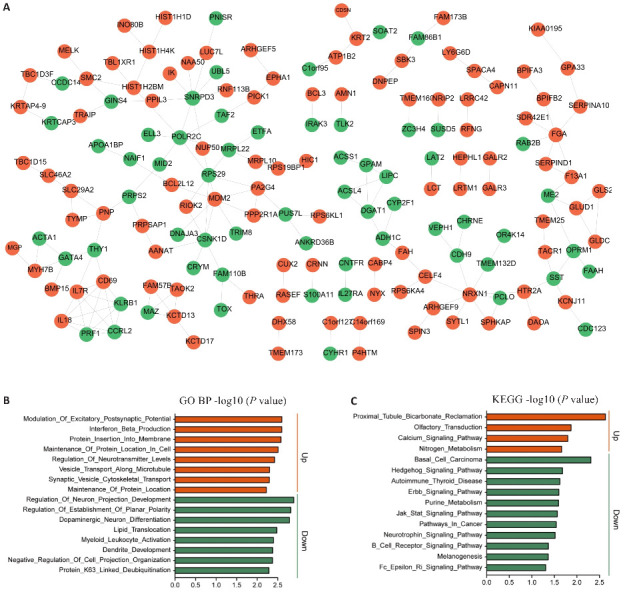
DEGs的PPI网络(A)及GO(B)和KEGG(C)富集分析
Fig.2 PPI network (A) and GO (B) and KEGG (C) enrichment analysis of the DEGs in PD patients and healthy control individuals.
2.3. lncRNA潜在靶基因的预测及功能富集分析
为探索DElncRNAs的潜在功能,选择lncRNA在基因组上的上、下游长度为10 kb的基因作为候选顺式调控靶基因并进行PPI可视化(图3A)。GO分析显示(图3B):分子功能主要富集与甘丙氨酸受体活性、cullin家族蛋白结合、磷酸酶调节因子活性、氨基酸结合、蛋白丝氨酸/苏氨酸磷酸酶活性、含核碱基化合物跨膜转运蛋白活性和碳水化合物衍生物跨膜转运蛋白活性。细胞成分主要富集于涉及到膜锚定组分、u2型剪接体复合物、高尔基膜整体组分、高尔基膜固有组分、DNA包装复合物、内质网腔、核常染色质、微绒毛膜、剪接体复合物和常染色质。生物过程富集与胚胎上皮管的形成、上皮管的形成、试管的形成、胚胎上皮的形态发生、激活素受体信号通路的负调控、蛋白同质寡聚化、着丝粒姐妹染色单体的内聚以及Wnt信号通路的正调控。KEGG显示(图3C),富集于近端小管碳酸盐回收、d -谷氨酰胺和d-谷氨酸代谢、氮代谢、精氨酸生物合成、其他类型的o-聚糖生物合成、补体和凝血级联、Hippo信号通路、丙氨酸、天冬氨酸和谷氨酸代谢。
图3.
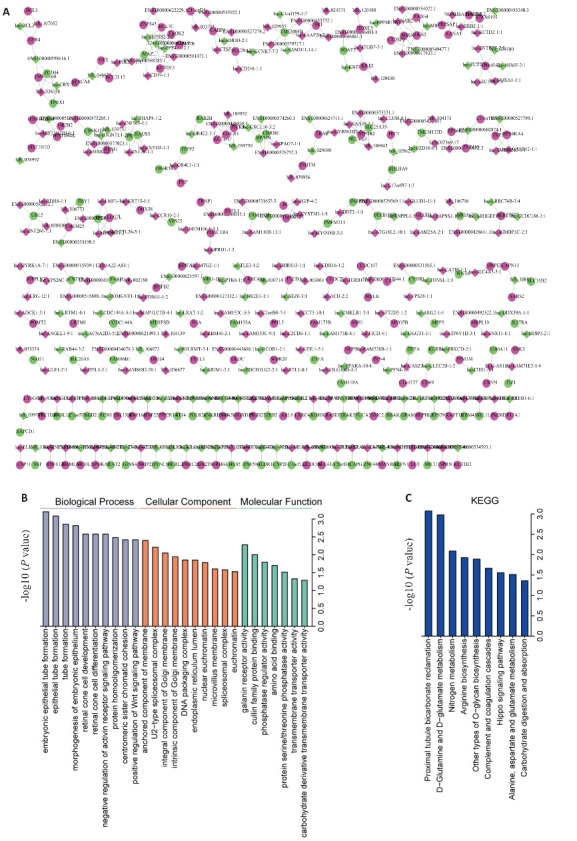
DElncRNAs候选顺式调控靶基因的PPI网络(A)及GO(B)和KEGG(C)富集分析
Fig. 3 PPI network (A) and GO (B) and KEGG (C) enrichment analysis of DElncRNAs candidate cis-regulatory target genes in PD patients and healthy control subjects.
2.4. ceRNA网络
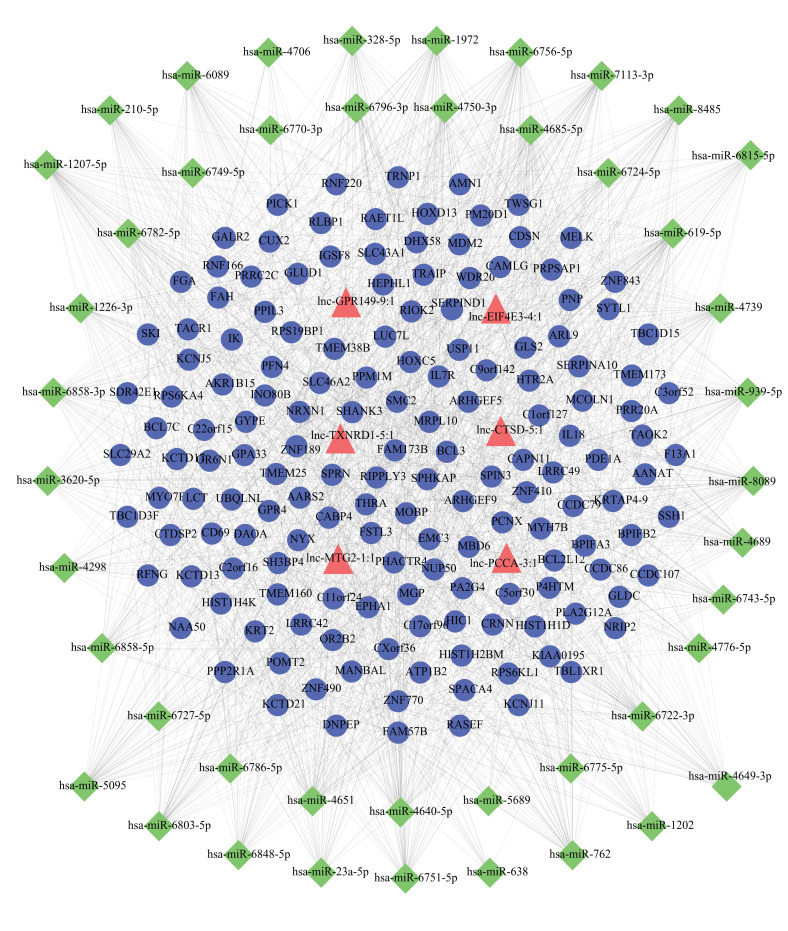
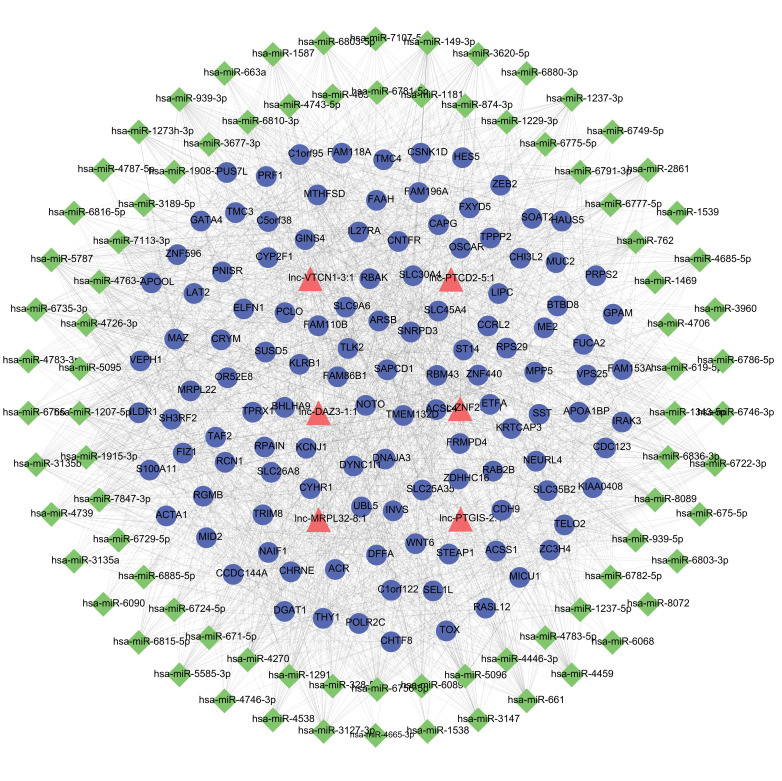
用检测到的DEmRNAs和DElncRNAs以及所有已知的人类miRNAs来进行ceRNA网络预测。使用Cytoscape软件构建了上调的lncRNA-miRNA-mRNA相互作用网络,共有209个节点和1635对关系对,其中lncRNA排名前3的依次为lnc-MTG2-1∶1、lnc-CTSD-5∶1和lnc-PCCA-3∶1(图4)。使用Cytoscape软件构建了下调的lncRNA-miRNA-mRNA相互作用网络,共有209个节点和1976对关系,其中lncRNA排名前3的lncRNA分别为lnc-VTCN1-3∶1、lnc-ZNF25-7∶1和lnc-DAZ3-1∶1(图5)。
图4.
上调的DElncRNAs的ceRNA网络
Fig.4 ceRNA network of the upregulated DElncRNAs.
图5.
下调的DElncRNAs的ceRNA网络
Fig.5 ceRNA network of the down-regulated DElncRNAs.
2.5. MPP+处理SH-SY5构建PD细胞模型,验证预测关键lncRNA
CCK-8实验显示,500 μmol/L MPP+处理SH-SY5Y细胞48 h后,细胞存活率下降至67.95%(图6A)。qRT-PCR检测结果显示,在MPP+处理的细胞中,lnc-CTSD-5∶1的表达与对照组差异最大,并与生信分析结果趋势一致(图6B)。因SH-SY5Y细胞中lnc-DAZ3-1∶1表达量较少,CT值>30或扩增不出,所以未进行验证。通过Western blotting检测发现500 μmol/L MPP+处理SH-SY5Y细胞48 h后TH的表达显著降低(图6C)。构建lnc-CTSD-5∶1的siRNA,并通过qRT-PCR验证沉默效果(图6D)。Western blotting检测发现,沉默lnc-CTSD-5∶1有助于TH表达的回复(图6E)。
图6.
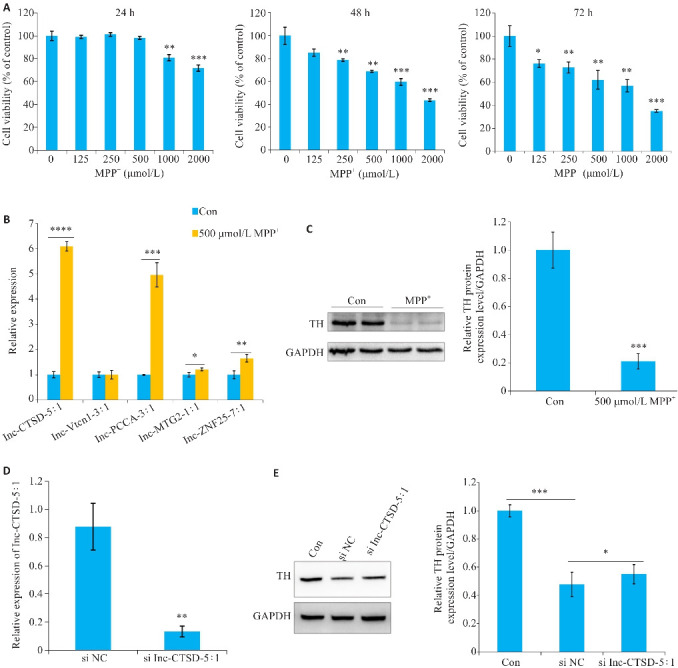
在PD细胞模型中验证 ceRNA 网络中的DElncRNAs
Fig.6 Validation of DElncRNAs in ceRNA networks in a PD cell model. A: Viability of SH-SY5Y cells determined by CCK-8 method after treatment with MPP+ at different concentrations for 24, 48 and 72 h. B: qRT-PCR for detecting expression levels of lnc-CTSD-5:1, lnc-VTCN1-3:1, lnc-PCCA-3:1, lnc-MTG2-1:1 and lnc-ZNF25-7:1 in SH-SY5Y cells treated with 500 μmol/L MPP+ treatment for 48 h. C: Western blotting for analyzing the expression of TH protein in SH-SY5Y cells treated with 500 μmol/L MPP+ for 48 h. D: lnc-CTSD-5:1 expression in SH-SY5Y cells after transfection with lnc-CTSD-5:1 siRNA detected by qRT-PCR. E: Western blotting for analyzing the expression of TH protein in SH-SY5Y cells with lnc-CTSD-5:1 knockdown treated with 500 μmol/L MPP+ for 48 h. *P<0.05, **P<0.01, ***P<0.001 vs 0 μmol/L, control group, or siNC group.
3. 讨论
目前PD的临床治疗方法仅能缓解症状,并不能阻止病情恶化,亟需寻找明确的生物标志物和高效治疗策略。尽管已识别了部分风险和遗传因素,但PD的确切分子机制仍不明确。哺乳动物基因组编码了数以万计的lncRNA,可在不同水平上影响基因表达和细胞稳态。近年来,研究发现了许多与PD相关的LncRNAs。例如,lncRNA-T199678通过靶向miR-101-3p减轻α-syn诱导的多巴胺能神经元损伤[17]。lncRNA XIST通过海绵化miR-199a-3p调节Sp1的表达,加速PD的进展[18]。lncRNA-HOTAIR通过上调LRRK2 mRNA表达,诱导PD小鼠和PD细胞模型中的多巴胺能神经元死亡[16]。lnc-MALAT1在MPTP诱导的PD小鼠的中脑组织和PD细胞模型中上调,通过结合a-syn改变其蛋白稳定性,进而调节其表达[19,20]。部分lncRNA对PD发生及进展具有积极的保护作用,而另有部分则具有消极的破坏作用,还有更多LncRNA功能未知。
本研究通过ceRNA芯片发现了大量的lncRNA和mRNA,它们在PD患者血浆和正常对照组血浆之间存在差异表达现象。值得注意的两个差异基因,其中一个是显著下调的基因--神经化样蛋白4(NEURL4)。它是一个具有6个重复神经结构域的连接蛋白。研究表明,NEURL4能够与PD家族性致病基因PARK8编码的蛋白质--富亮氨酸重复激酶2(LRRK2)结合,稳定Notch信号通路中的配体Dll1/D1,进而激活Notch信号。通过这一机制,NEURL4可以促进神经干细胞分化,并调节分化后的多巴胺能神经元的存活,影响其功能发挥,从而对PD的进程产生影响[21-25]。另一个差异基因是上调的肌球蛋白VIIB(MYO7B)。研究显示MYO7B通过调节质膜相关肌动蛋白网络介导的内吞作用,促进了错误折叠的α-syn在细胞间传递,诱导PD关联的病理现象[26]。
然而,大多数在PD患者和正常对照之间筛选到的DElncRNAs的生物学功能仍不清楚。先前研究表明,lncRNAs可能通过顺式调节效应来影响其附近基因的转录[7]。例如lncRNA-MAP3K4通过p38 MAPK顺式调节MAP3K4在血管炎症中发挥作用[27]。LncRNA-p21可以顺式调控的方式促进邻近细胞周期基因Cdkn1a/p21的p53依赖性表达[28]。lncRNA MAAT通过顺式调控增加邻近基因Mbnl1的表达 [29]。本研究中,为了进一步研究DELncRNAs在PD中的功能,选择lncRNA在基因组上的上、下游长度为10 kb的基因作为候选顺式调控靶基因。本研究发现其中一些潜在顺式调控基因CSNK1D、SKI、ZEB2、RNF220、TBL1XR1富集在Wnt信号通路的正向调节上。而Wnt信号通路是多巴胺能神经发生的重要途径,是胚胎发育和衰老过程中必不可少的信号系统,是PD发生的关键因素[30, 31]。因此,这些基因也值得进行进一步的PD关联分析验证。虽然lncRNAs不编码蛋白质,但是lncRNAs可以调节其他基因的转录及编码蛋白的过程。ceRNA机制明确了lncRNAs通过海绵化microRNAs进而调控mRNA的表达。有研究报道PD中存在此机制,例如LncRNA DLX6-AS1通过与miR-223-3p竞争性结合NRP1,从而促进PD中小胶质细胞的炎症反应[32]。同样,LncRNA-GAS5通过海绵化miR-223-3p来调控NLRP3,促进PD中小胶质细胞炎症反应[33]。lncRNA GAS5还结合microRNA-150调控Fosl1的表达,从而加重PD的神经损伤[34]。PD患者外周血单个核细胞中Lnc00938可直接海绵吸附miR-30c-5p来调控LRRK2的表达[35]。这些发现揭示了lncRNA在PD病理过程中的潜在作用机制。SNHG14通过介导miR-135b-5p/KPNA4轴促进MPP+诱导的PD细胞模型的凋亡、炎症和细胞毒性,敲低LncRNA SNHG14可减轻此种损伤[15]。本研究利用差异上调和下调的lncRNAs分别与mRNA及已知的microRNA构建2个ceRNA网络,观察到lnc-CTSD-5∶1、lnc-VTCN1-3∶1、lnc-PCCA-3∶1、lnc-MTG2-1∶1、lnc-ZNF25-7∶1及lnc-DAZ3-1∶1的关系对及节点较多,成为PD关联lncRNA的可能性较大。本研究通过qRT-PCR检测发现,在MPP+处理SH-SY5Y细胞构建的PD细胞模型中lnc-CTSD-5∶1表达升高变化最为显著,并且通过siRNA沉默lnc-CTSD-5∶1的表达有助于PD细胞模型中TH表达的回复。TH是多巴胺合成的关键限速酶,其活性的降低直接影响多巴胺的产量,还影响着神经传递和运动信号的协调。维持TH含量或提高TH的活性,对于改善PD患者或者细胞、动物模型均具有潜在的治疗意义。
lncRNA可以在血液中稳定存在,许多研究报道了在血液中异常表达的lncRNA成为可靠的疾病相关标记物。如研究报道PD患者循环lncRNA水平存在异常[26];lncRNA GAS5在PD患者血清中明显升高,并与患者的HY分期和UPDRS评分存在显著的负相关[37]。在PD患者中,一些在脑组织差异表达lncRNAs同样也在血浆中差异表达。例如lncRNA NEAT1在PD患者黑质中表达升高[12],而这种表达增加的现象也在患者的外周血[13]和PD细胞模型[14]中被观察到。研究发现PD患者外周血单个核细胞中linc001128显著下调,而Linc00938显著上调,此两种lncRNA有可能成为PD患者的生物标志物[35]。血液、血浆、血清和外周血单个核细胞均为可便捷获取的体液标本,识别其中差异表达的lncRNA有助于更好地了解PD的机制,识别新的PD相关生物标志物和靶点,并为未来的诊断和治疗策略提供了新的方向[38]。
综上所述,通过ceRNA芯片技术可以发现到PD和健康人群血浆中大量的、新的DElncRNAs和DEmRNAs。本研究验证了lnc-CTSD-5∶1在PD细胞模型中对TH表达的影响,提示lnc-CTSD-5∶1可能在PD的病理过程中扮演关键角色。lnc-CTSD-5∶1长1903 bp,位于chr11∶1939786-1946496,可在GeneCards或lncipedia网站查询。但lnc-CTSD-5∶1以及其他的差异基因及lncRNA在PD中具体发挥的作用,未来仍需扩大临床患者样本量进行验证,开展基础研究对相应的作用机制进行进一步探究分析。
基金资助
湖北省科技计划重点研究专项(2023BCB140);湖北省自然科学基金(2022CFB341);襄阳市第一人民医院创新科技项目(XYY2023QT09)
参考文献
- 1. 陈芝君, 马 建, 唐 娜, 等. 中国帕金森病疾病负担变化趋势分析及预测[J]. 中国慢性病预防与控制, 2022, 30(9): 649-54. [Google Scholar]
- 2. 刘永文, 焦 敏, 王 岩, 等. 1990-2019年中国帕金森病疾病负担分析[J]. 疾病监测, 2024, 39(3): 363-8. [Google Scholar]
- 3. Morris HR, Spillantini MG, Sue CM, et al. The pathogenesis of Parkinson's disease[J]. Lancet, 2024, 403(10423): 293-304. [DOI] [PubMed] [Google Scholar]
- 4. Li K, Wang ZQ. lncRNA NEAT1: key player in neurodegenerative diseases[J]. Ageing Res Rev, 2023, 86: 101878. [DOI] [PubMed] [Google Scholar]
- 5. Su LN, Li RQ, Zhang ZQ, et al. Identification of altered exosomal microRNAs and mRNAs in Alzheimer's disease[J]. Ageing Res Rev, 2022, 73: 101497. [DOI] [PubMed] [Google Scholar]
- 6. Wang C, Duan YJ, Duan G, et al. Stress induces dynamic, cytotoxicity-antagonizing TDP-43 nuclear bodies via paraspeckle LncRNA NEAT1-mediated liquid-liquid phase separation[J]. Mol Cell, 2020, 79(3): 443-58. e7. [DOI] [PubMed] [Google Scholar]
- 7. Yan PX, Luo S, Lu JY, et al. Cis- and trans-acting lncRNAs in pluripotency and reprogramming[J]. Curr Opin Genet Dev, 2017, 46: 170-8. [DOI] [PubMed] [Google Scholar]
- 8. Li LL, Li ZW, Meng XQ, et al. Histone lactylation-derived LINC01127 promotes the self-renewal of glioblastoma stem cells via the cis-regulating the MAP4K4 to activate JNK pathway[J]. Cancer Lett, 2023, 579: 216467. [DOI] [PubMed] [Google Scholar]
- 9. Ben-Tov Perry R, Tsoory M, Tolmasov M, et al. Silc1 long noncoding RNA is an immediate-early gene promoting efficient memory formation[J]. Cell Rep, 2023, 42(10): 113168. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Bazrgar M, Mirmotalebisohi SA, Ahmadi M, et al. Comprehensive analysis of lncRNA-associated ceRNA network reveals novel potential prognostic regulatory axes in glioblastoma multiforme[J]. J Cell Mol Med, 2024, 28(11): e18392. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Zhao J, Feng ZY, Deng H, et al. Bioinformatics-based analysis reveals IDR-1018-mediated ceRNA regulation network for protective effect on hypoxia-ischemic brain injury in neonatal mice[J]. Exp Neurol, 2022, 357: 114159. [DOI] [PubMed] [Google Scholar]
- 12. Simchovitz A, Hanan M, Niederhoffer N, et al. NEAT1 is overexpressed in Parkinson's disease substantia nigra and confers drug-inducible neuroprotection from oxidative stress[J]. FASEB J, 2019, 33(10): 11223-34. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Boros FA, Maszlag-Török R, Vécsei L, et al. Increased level of NEAT1 long non-coding RNA is detectable in peripheral blood cells of patients with Parkinson's disease[J]. Brain Res, 2020, 1730: 146672. [DOI] [PubMed] [Google Scholar]
- 14. Sun Q, Zhang YL, Wang SL, et al. NEAT1 decreasing suppresses Parkinson's disease progression via acting as miR-1301-3p sponge[J]. J Mol Neurosci, 2021, 71(2): 369-78. [DOI] [PubMed] [Google Scholar]
- 15. Yuan XJ, Wu YN, Lu L, et al. Long noncoding RNA SNHG14 knockdown exerts a neuroprotective role in MPP+-induced Parkinson's disease cell model through mediating miR-135b-5p/KPNA4 axis[J]. Metab Brain Dis, 2022, 37(7): 2363-73. [DOI] [PubMed] [Google Scholar]
- 16. Liu S, Cui B, Dai ZX, et al. Long non-coding RNA HOTAIR promotes Parkinson's disease induced by MPTP through up-regulating the expression of LRRK2[J]. Curr Neurovasc Res, 2016, 13(2): 115-20. [DOI] [PubMed] [Google Scholar]
- 17. Bu LL, Xie YY, Lin DY, et al. LncRNA-T199678 mitigates α-synuclein-induced dopaminergic neuron injury via miR-101-3p[J]. Front Aging Neurosci, 2020, 12: 599246. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Zhou Q, Zhang MM, Liu M, et al. LncRNA XIST sponges miR-199a-3p to modulate the Sp1/LRRK2 signal pathway to accelerate Parkinson's disease progression[J]. Aging, 2021, 13(3): 4115-37. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Zhang QS, Wang ZH, Zhang JL, et al. Beta-asarone protects against MPTP-induced Parkinson's disease via regulating long non-coding RNA MALAT1 and inhibiting α‑synuclein protein expression[J]. Biomed Pharmacother, 2016, 83: 153-9. [DOI] [PubMed] [Google Scholar]
- 20. Xia DJ, Sui RB, Zhang Z. Administration of resveratrol improved Parkinson's disease-like phenotype by suppressing apoptosis of neurons via modulating the MALAT1/miR-129/SNCA signaling pathway[J]. J Cell Biochem, 2019, 120(4): 4942-51. [DOI] [PubMed] [Google Scholar]
- 21. Snead DM, Matyszewski M, Dickey AM, et al. Structural basis for Parkinson's disease-linked LRRK2's binding to microtubules[J]. Nat Struct Mol Biol, 2022, 29(12): 1196-207. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. Sosero YL, Gan-Or Z. LRRK2 and Parkinson's disease: from genetics to targeted therapy[J]. Ann Clin Transl Neurol, 2023, 10(6): 850-64. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23. Jennings D, Huntwork-Rodriguez S, Vissers MFJM, et al. LRRK2 inhibition by BIIB122 in healthy participants and patients with Parkinson's disease[J]. Mov Disord, 2023, 38(3): 386-98. [DOI] [PubMed] [Google Scholar]
- 24. 赵丽丽, 张 硕, 张 洋, 等. 汉族人群LRRK2基因突变携带者与非携带者患家族性帕金森病的风险预测[J]. 中国老年学杂志, 2024, 44(5): 1099-101. [Google Scholar]
- 25. Watanabe R, Buschauer R, Böhning J, et al. The in situ structure of Parkinson's disease-linked LRRK2[J]. Cell, 2020, 182(6): 1508-18.e16. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Zhang Q, Xu Y, Lee J, et al. A myosin-7B-dependent endocytosis pathway mediates cellular entry of α‑synuclein fibrils and polycation-bearing cargos[J]. Proc Natl Acad Sci USA, 2020, 117(20): 10865-75. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27. Zhou HY, Simion V, Pierce JB, et al. LncRNA-MAP3K4 regulates vascular inflammation through the p38 MAPK signaling pathway and cis-modulation of MAP3K4[J]. FASEB J, 2021, 35(1): e21133. [DOI] [PubMed] [Google Scholar]
- 28. Winkler L, Jimenez M, Zimmer JT, et al. Functional elements of the cis-regulatory lincRNA-p21[J]. Cell Rep, 2022, 39(3): 110687. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29. Li J, Yang TT, Tang HF, et al. Inhibition of lncRNA MAAT controls multiple types of muscle atrophy by cis- and trans-regulatory actions[J]. Mol Ther, 2021, 29(3): 1102-19. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30. Marchetti B, Tirolo C, L’Episcopo F, et al. Parkinson's disease, aging and adult neurogenesis: Wnt/β-catenin signalling as the key to unlock the mystery of endogenous brain repair[J]. Aging Cell, 2020, 19(3): e13101. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31. Gamit N, Dharmarajan A, Sethi G, et al. Want of Wnt in Parkinson's disease: could sFRP disrupt interplay between Nurr1 and Wnt signaling?[J]. Biochem Pharmacol, 2023, 212: 115566. [DOI] [PubMed] [Google Scholar]
- 32. Liu L, Zhou TT, Li T, et al. LncRNA DLX6-AS1 promotes microglial inflammatory response in Parkinson's disease by regulating the miR-223-3p/NRP1 axis[J]. Behav Brain Res, 2022, 431: 113923. [DOI] [PubMed] [Google Scholar]
- 33. Xu W, Zhang L, Geng Y, et al. Long noncoding RNA GAS5 promotes microglial inflammatory response in Parkinson's disease by regulating NLRP3 pathway through sponging miR-223-3p[J]. Int Immunopharmacol, 2020, 85: 106614. [DOI] [PubMed] [Google Scholar]
- 34. Ma JJ, Sun WH, Chen SY, et al. The long noncoding RNA GAS5 potentiates neuronal injury in Parkinson's disease by binding to microRNA-150 to regulate Fosl1 expression[J]. Exp Neurol, 2022, 347: 113904. [DOI] [PubMed] [Google Scholar]
- 35. Yousefi M, Peymani M, Ghaedi K, et al. Significant modulations of linc001128 and linc0938 with miR-24-3p and miR-30c-5p in Parkinson disease[J]. Sci Rep, 2022, 12(1): 2569. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36. Honarmand Tamizkar K, Gorji P, Gholipour M, et al. Parkinson's disease is associated with dysregulation of circulatory levels of lncRNAs[J]. Front Immunol, 2021, 12: 763323. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37. Ozdilek B, Kaya Alper I, Demircan B, et al. Clinical significance of serum lncRNA H19, GAS5, HAR1B and linc01783 levels in Parkinson's disease[J]. Ideggyogy Sz, 2023, 76(5/6): 189-96. [DOI] [PubMed] [Google Scholar]
- 38. Tolosa E, Garrido A, Scholz SW, et al. Challenges in the diagnosis of Parkinson's disease[J]. Lancet Neurol, 2021, 20(5): 385-97. [DOI] [PMC free article] [PubMed] [Google Scholar]