RESUMEN
Objetivo.
Describir los desafíos, las estrategias y las lecciones aprendidas en Venezuela durante el brote de sarampión y divulgar los mecanismos empleados para su contención, cuyos resultados derivaron en la interrupción de la transmisión endémica.
Método.
Estudio descriptivo sobre las acciones tomadas por Venezuela para la interrupción del brote.
Resultados.
Confirmado el brote, el gobierno de Venezuela, con la cooperación técnica de la Organización Panamericana de la Salud, activó el plan de interrupción de la transmisión de sarampión que consistió en actividades de vacunación, vigilancia epidemiológica, fortalecimiento de la capacidad diagnóstica laboratorial y conformación de equipos de respuesta rápida.
Conclusiones.
Aunque el brote fue un desafío significativo, el abordaje integral y las acciones sanitarias priorizadas fueron fundamentales para lograr el control e interrupción del brote después de 111 semanas de circulación del virus en el país dejando lecciones aprendidas para futura contención de brotes.
Palabras clave: Sarampión, vacunación, estrategias de salud, Venezuela
ABSTRACT
Objective.
Describe the challenges, strategies and lessons learned in Venezuela during the measles outbreak of 2017–2019, and discuss the mechanisms employed for its containment, which led to the interruption of endemic transmission.
Methods.
Descriptive study of the actions taken by Venezuela to interrupt the outbreak.
Results.
When the outbreak was confirmed, the Venezuelan government, with technical cooperation from the Pan American Health Organization, activated a plan to interrupt measles transmission. This plan consisted of vaccination activities, epidemiological surveillance, strengthening of laboratory diagnostic capacity, and the formation of rapid response teams.
Conclusions.
The measles outbreak posed a significant challenge to the country, but a comprehensive approach and prioritized health actions were fundamental in achieving control of the outbreak and interrupting it after 111 weeks, with lessons learned for the containment of future outbreaks.
Keywords: Measles, vaccination, health strategies, Venezuela
RESUMO
Objetivo.
Descrever os desafios, as estratégias e as lições aprendidas na Venezuela durante o surto de sarampo e divulgar os mecanismos de contenção empregados, que resultaram na interrupção da transmissão endêmica.
Método.
Estudo descritivo sobre as medidas tomadas pela Venezuela para interromper o surto.
Resultados.
Assim que o surto foi confirmado, o governo venezuelano, com a cooperação técnica da Organização Pan-Americana da Saúde, ativou o plano para interromper a transmissão do sarampo, que consistia em atividades de vacinação, vigilância epidemiológica, fortalecimento da capacidade de diagnóstico laboratorial e criação de equipes de resposta rápida.
Conclusões.
Embora o surto tenha sido um grande desafio, a abordagem integral e as ações sanitárias priorizadas foram fundamentais para controlar e interromper o surto após 111 semanas de circulação do vírus no país, deixando lições para a contenção de surtos no futuro.
Palavras-chave: Sarampo, vacunação, estratégias de saúde, Venezuela
El sarampión es una enfermedad viral contagiosa prevenible por vacunación, se transmite por vía respiratoria. Tiene un período de incubación de 7 a 21 días antes de la aparición de síntomas como fiebre alta, erupción maculopapular, rinorrea y manchas de Koplik, ente otros. Puede causar complicaciones graves y, en pocos casos, derivar en la muerte (1).
En la República Bolivariana de Venezuela (de ahora en adelante, Venezuela), la vacunación en 1939, a cargo de la División de Epidemiología y Estadística Vital que hoy forma parte del Ministerio del Poder Popular para la Salud (MPPS), con el objetivo de combatir las enfermedades prevenibles por vacunación (EPV). El Programa Ampliado de Inmunizaciones (PAI) se creó en 1977 (2, 3), y pasó de incluir de seis vacunas en ese año a 16 en el 2023, con un aumento del espectro de vacunación a todo el ciclo de vida (4).
El inicio de la vacunación contra el sarampión en 1962 redujo la magnitud de los brotes y distanció el lapso de ocurrencia. Entre 1964 y 1994, la tasa de incidencia y de mortalidad por sarampión disminuyeron en todo el territorio nacional (3, 5). Con base en las recomendaciones de la Organización Panamericana de la Salud (OPS), Venezuela se incorporó a la iniciativa de eliminación del sarampión en 1994, que incluyó la rubéola y el síndrome de rubéola congénita (SRC) en el 2003 (4, 6).
Tras un meticuloso proceso de documentación desde el 2010 y la evaluación de las evidencias presentadas al Comité Internacional de Expertos, Venezuela recibió la certificación de país libre de sarampión, rubéola y SRC en el 2016 (7).
El 1 de julio del 2017, un lactante de 5 meses residente en el municipio Caroní del estado Bolívar presenta una erupción cutánea. En el 2016, el estado Bolívar registró una cobertura de la vacuna contra el sarampión, rubéola y parotiditis (SRP) de 105% con la primera dosis (SRP1) y 49% con segunda dosis (SRP2). El paciente no tenía historia de viaje previo y presentó cuadro respiratorio, fiebre y erupción maculopapular. La primera muestra de suero se tomó el 7 de julio, y la segunda, el 31 de julio. Este intervalo entre las dos muestras se debió a que se trata de una zona rural dedicada a la minería, lo cual dificultó el envío de ambas muestras, cuyos resultados fueron positivos el 2 de agosto para la primera y el 22 de agosto para la segunda. En el mes de agosto se confirmaron en Caroní siete nuevos casos en menores de 10 años. En septiembre se envió la notificación oficial del brote a la OPS, y durante ese mes se detectaron 30 casos por seguimiento de contactos, visitas domiciliarias, búsquedas activas institucionales (BAI) y búsquedas activas comunitarias (BAC) (6).
El brote se propagó a 23 de las 24 entidades federales (EF) del país. Las investigaciones epidemiológicas determinaron que la mayoría de los casos fueron por transmisión comunitaria. Las pruebas virológicas realizadas en diferentes etapas del brote dieron cuenta del aislamiento del genotipo D8, linaje MVi/Hulu-Langat.MYS/26.11 (9). Dado que no logró identificar el caso primario, el brote se clasificó como de fuente desconocida.
No se logró la interrupción de la transmisión durante los primeros 12 meses, por lo que se restableció la transmisión endémica en julio del 2018 (8, 10), que se extendió hasta agosto del 2019, cuando se registró en el estado Zulia el último de los 7 054 casos confirmados (42,6% por laboratorio, 13,4% por nexo epidemiológico y 44,0% por cuadro clínico) (6).
Las causas asociadas a la lenta respuesta fueron: 1) el impacto del bloqueo económico impuesto al país, intensificado a partir del 2016, que limitó la adquisición de vacunas con fondos propios, y afectó el acceso de la población a la vacunación con disminución de la cobertura de todos los antígenos; 2) la movilización de personas desde y hacia el estado Bolívar, con una dispersión rápida del virus; 3) la falta de ERR actualizados y el agotamiento del escaso personal de salud que atendía el brote de difteria desde el 2016; 4) la presencia de coberturas >100% con SRP1 en Caroní causaron una sensación de seguridad; y 4) el tiempo sin que el personal de salud observara un caso de sarampión (el último fue en el 2007), que hizo dudar sobre la coincidencia del cuadro clínico del caso índice y de los primeros casos secundarios, con la consiguiente demora en la detección de casos y la aplicación de acciones oportunas.
Una vez confirmada la circulación del virus, el Ejecutivo Nacional activó como prioridad las acciones sanitarias para su contención. El MPPS, con la cooperación técnica de la OMS, elaboró un plan de interrupción de la transmisión de sarampión (PITS), con la participación de todo del sistema de salud y la movilización masiva de brigadas de vacunación, incluida la inversión de siete millones de dólares por la OPS y otros donantes, principalmente la Iniciativa sarampión y rubéola (6, 11).
Este artículo tiene como objetivo sistematizar las estrategias, los desafíos y las lecciones aprendidas en Venezuela durante el brote de sarampión que afectó al país entre el 2017 y el 2019, y compartir con los países de la Región los mecanismos empleados para la interrupción de la transmisión endémica del virus.
MATERIALES Y MÉTODOS
Bajo el marco regional para el monitoreo y la reverificación de la eliminación del sarampión, la rubéola y el SRC (1), se presenta un trabajo descriptivo que hace referencia a la caracterización epidemiológica del brote de sarampión ocurrido en Venezuela entre el 2017 y el 2019, las medidas implementadas en respuesta a este y las evidencias de la interrupción del brote en función de los criterios epidemiológicos, de vacunación y de laboratorio.
Para la caracterización epidemiológica se emplean las variables de tiempo, espacio y persona, y se usan medidas de tendencia central y dispersión. En las medidas de respuesta al brote se describen las actividades implementadas en el PITS diseñado por el MPPS con apoyo de la OPS. Por último, se proporciona una descripción detallada de las evidencias epidemiológicas, de vacunación y de laboratorio que permitieron verificar la interrupción del brote.
La medida que se toma para la incidencia es la de incidencia acumula (IA), que se expresa como proporción, y toma como numerador los casos confirmados (A) y como denominador la población (B), usa la fórmula (A/B × 100) y no toma en cuenta el tiempo (t).
RESULTADOS
Caracterización del brote
El brote de sarampión que derivó en el restablecimiento de la transmisión endémica en Venezuela inició en la semana epidemiológica (SE) 26 del 2017 y terminó en la SE 33 del 2019. Duró 111 semanas y se registraron 11 792 casos sospechosos de sarampión, 7 054 confirmados y 80 defunciones (5). La tasa de incidencia acumulada en ese período fue de 22,2 casos por cada 100 000 habitantes, y la tasa de letalidad fue de 1,1 muertes por cada 100 casos (figura 1).
FIGURA 1. Dispersión de casos de sarampión según la semana epidemiológica, República Bolivariana de Venezuela, 2017-2019.
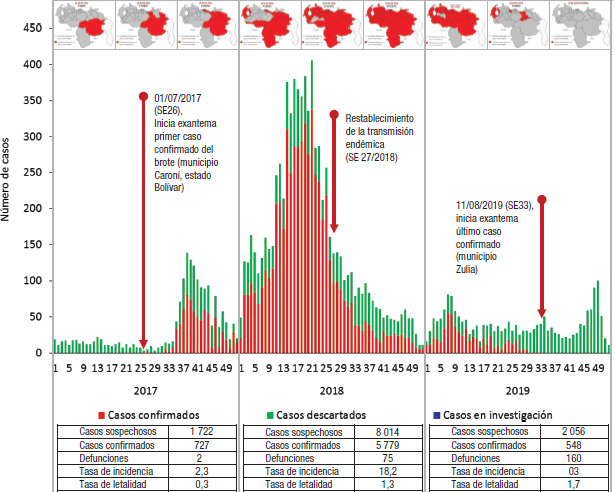
SE: semana epidemiológica.
Fuente: Dirección de Inmunizaciones, Viceministerio de Redes de Salud Colectiva, Ministerio del Poder Popular para la Salud.
Afectó a 95,8% (23/24) de las EF y 47,5% (174/366) de los municipios del país. En el 2019 se redujo en 90,5% el número de casos confirmados en relación con el 2018, y el último caso confirmado se registró en la SE 33 en el estado Zulia. La única EF donde no se confirmaron casos por genotipo D8 fue Nueva Esparta, que en la SE 24 del 2019 notificó un caso confirmado por serología y las evidencias epidemiológicas demostraron que el paciente se había infectado en Rusia, por lo que se trató de una nueva importación. A partir de este caso se informó un caso secundario que se lo consideró como relacionado con la importación (6).
La media de incidencia acumulada fue 27,6 casos por cada 100 000 habitantes, con una desviación estándar de 52,02 y un coeficiente de variación de 98%, lo que indica una alta dispersión en las tasas de incidencia entre las distintas EF (figuras 1 y 2), información que llevó a considerar las diferentes situaciones de riesgo y aplicar medidas de intervención adecuadas a las particularidades territoriales (cuadro 1).
FIGURA 2. Tasa de incidencia de sarampión según el grupo de edad, República Bolivariana de Venezuela, 2016-2020.
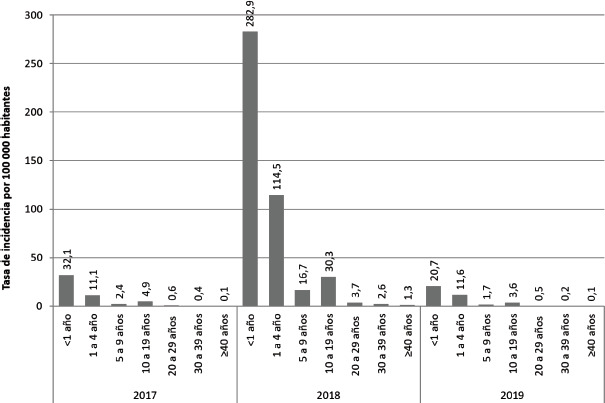
Fuente: Dirección de Inmunizaciones, Viceministerio de Redes de Salud Colectiva, Ministerio del Poder Popular para la Salud.
CUADRO 1. Casos sospechosos de sarampión y rubéola, mediana y promedio de casos por semana epidemiológica y rango por año, República Bolivariana de Venezuela, 2016-2019.
|
Año |
N.° de casos sospechosos |
Mediana (n.° de casos por SE) |
Promedio (n.° de casos por SE) |
Rango (n.° de casos) |
|---|---|---|---|---|
|
2016 |
796 |
15,0 |
13,3 |
2 (SE 1) - 35 (SE 4) |
|
2017 |
1 722 |
16,0 |
33,1 |
3 (SE 26) - 139 (SE 38) |
|
2018 |
8 014 |
126,0 |
154,1 |
11 (SE 51) - 406 (SE 21) |
|
2019 |
2 056 |
37,5 |
39,5 |
11 (SE 52) - 100 (SE 49) |
SE, semana epidemiológica.
Fuente: Dirección de Inmunizaciones, Viceministerio de Redes de Salud Colectiva, Ministerio del Poder Popular para la Salud.
El mayor porcentaje de incidencia acumulada (>70% de los casos) y las mayores tasas de incidencia se observaron en el grupo de 0 a 5 años, con un promedio de incidencia en no vacunados >95% para estas edades. De los casos confirmados, 62,4% (4 399/7 054) tenían <5 años y, de estos, la mayoría eran <1 año (figura 2).
También sobre el total de los casos confirmados, 7,4% (520/7 054) tenían aplicada la vacuna contra el sarampión. De estos, 54,8% (285/520) con más de 30 días transcurridos entre la aplicación de la vacuna y la fecha de inicio de exantema (FIE); 27,5% (143/483) con un lapso de 7 a 30 días entre la aplicación de la vacuna y la FIE; y 17,7% (92/520) con menos de 7 días entre la aplicación de la vacuna y la FIE. No observaron diferencias estadísticamente significativas en la incidencia por sexo (6).
Medidas de control
El PITS requirió la activación de actores nacionales e internacionales, la acción de las comunidades organizadas, los ministerios de defensa, pueblos indígenas, y las autoridades estatales y municipales para garantizar la movilización coordinada de recursos bajo la conducción rectora del MPPS. Se establecieron unidades de análisis y salas situacionales. La OPS asesoró en la elaboración conjunta de recomendaciones sobre la respuesta al brote, la capacitación, el fortalecimiento del Laboratorio Nacional de Referencia (LNR), el envío de muestras para genotipificación al Laboratorio Regional de Referencia (LRR) y la logística necesaria para la movilización del personal e insumos. Además, brindó apoyo técnico a través de consultores internacionales y nacionales durante la duración del brote en todo el territorio nacional.
COORDINACIÓN
En octubre del 2017, el MPPS, con la cooperación técnica de la OPS, diseñó el PITS que consideró aspectos normativos, estratégicos y de coordinación interinstitucional. El plan incluyó la evaluación de riesgo, la vigilancia epidemiológica y laboratorial, la investigación de casos, la vacunación y el plan de capacitación, la supervisión y la comunicación social.
Se conformaron 836 ERR distribuidos en todo el territorio nacional para realizar el análisis de riesgo, planificar e implementar actividades de vacunación y vigilancia epidemiológica, y monitorear el impacto de las intervenciones. Las direcciones regionales de salud eran las instancias responsables de mantener actualizado, a nivel subnacional, municipal y en las áreas de salud integral comunitarias (ASIC), el listado de los integrantes de los ERR y que la información formara parte del contenido de las salas de situación en los diferentes niveles de gestión.
VIGILANCIA EPIDEMIOLÓGICA Y LABORATORIAL
En el brote se utilizó la definición de caso sospechoso sensible, es decir toda persona en la que un trabajador de la salud sospechara sarampión, o que presentara cuadro clínico de fiebre y exantema maculopapular. La confirmación de casos se realizó por laboratorio al inicio del brote. Una vez propagado el brote, se incluyó la confirmación por nexo epidemiológico y por clínica (6).
Se elaboró una ruta de desplazamiento de todos los casos para identificar la fecha y el lugar probable de infección, determinar el período de transmisibilidad y, en función de este, establecer la lista de contactos directos e indirectos, el tiempo de seguimiento de estos y el período de aislamiento de los casos.
Los equipos básicos de salud de las ASIC, con acompañamiento de consultores nacionales de inmunización de la OPS, realizaron el seguimiento de los contactos de casos con visitas domiciliaria dos veces por semana, llamadas telefónicas cada dos días, o ambas. En las últimas tres semanas del brote se detectaron 67 casos y 1 057 contactos, de los cuales 80,4% (850/1 057) contaron con seguimiento por 30 días.
A partir de las líneas de tiempo de los casos, se identificaron 355 cadenas de transmisión de sarampión durante las 111 semanas que duró el brote.
El manejo de los pacientes no complicados se realizó de manera ambulatoria con aislamiento domiciliario y monitoreo de los equipos básicos de salud de las ASIC. Los pacientes con complicaciones que requerían hospitalización o con riesgo social eran referidos a salas de aislamiento designadas en la red de servicios de salud.
Durante el brote se intensifico la realización de BAI y BAC para evaluar la calidad del sistema de vigilancia, identificar otros casos relacionados no detectados por el sistema de salud y documentar la ausencia de casos confirmados por un período de 12 semanas a partir de la FIE de los últimos casos confirmados en cada EF. Entre el 2017 y el 2019, se revisaron por BAI más de 48 634 millones de diagnósticos y se detectaron 1 159 casos sospechosos de sarampión y rubéola, de los cuales se confirmó 26,1% (304/1 159). Por BAC, entre el 2017 y el 2019 se visitaron 128 076 casas y se detectaron 1 271 casos sospechosos de sarampión y rubéola, con 44,1% (561/1 271) confirmados.
Durante diferentes fases del brote, el LNR envío muestras al LRR. Las pruebas virológicas determinaron que el genotipo D8, linaje MVi/Hulu-Langat.MYS/26.11 fue el único que circuló durante las 111 semanas del brote. En el 2017 se procedió a tomar muestras para genotipificación viral a ocho casos sospechosos con nexo con el caso índice y se muestrearon casos de dos EF del oriente del país donde inició la dispersión del brote. En el 2018, las muestras para genotipificación se tomaron en EF priorizadas según la evolución temporoespacial del brote. En el 2019 se tomaron muestras para genotipificación en los municipios donde se registraron las últimas cadenas de transmisión (figura 3).
FIGURA 3. Vigilancia virológica de las cadenas de transmisión, República Bolivariana de Venezuela, 2017-2019.
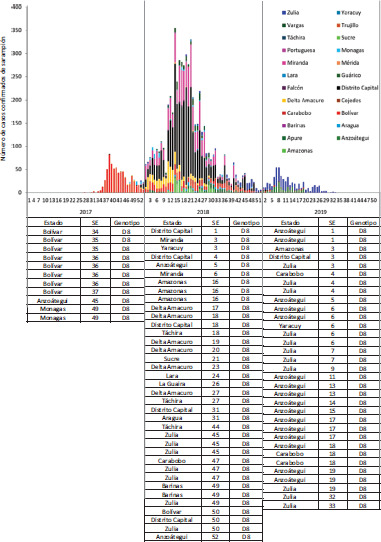
SE: semana epidemiológica.
VACUNACIÓN
La vacunación a todos los niños de 6 meses a 10 años comenzó en Caroní, en una población concentrada en unidades educativas, casa por casa y puestos fijos. En esta fase se empleó la vacuna SRP, y a partir del mes de noviembre del 2017 se usó la vacuna doble viral contra el sarampión y la rubéola (SR).
Ante la rápida propagación del brote, en el 2018 se planificó e implementó la campaña nacional de vacunación (CNV) de respuesta al brote para todo el país con una meta de 8,5 millones de niños entre 6 meses a 15 años, el grupo etario que presentaba la incidencia más alta. Estas acciones se llevaron a cabo en forma simultánea con la campaña con toxoide tetánico diftérico (Td) en respuesta al brote de difteria en la población de 7 a 15 años. Durante la CNV, se vacunaron con SR más de 8,6 millones personas pertenecientes a la población meta. Para agosto del 2019, la CNV había concluido con 104,4% de cobertura y 6,2% correspondientes a “dosis cero” en la población de 6 a 11 meses (figura 4).
FIGURA 4. Estratificación según porcentaje de cumplimiento acumulado con la vacuna doble viral, por entidad federal y municipio, República Bolivariana de Venezuela, 2018-2019.
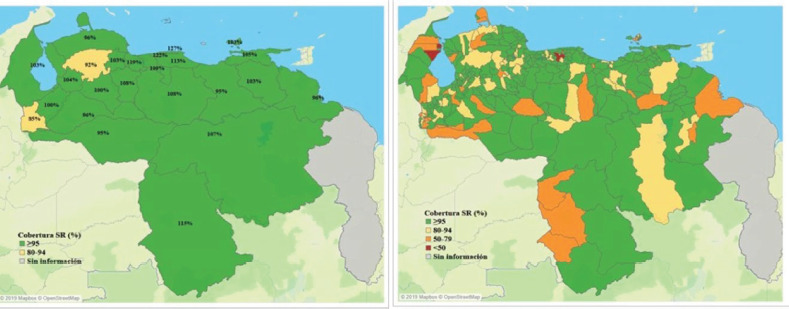
SR: sarampión y rubéola.
Fuente: Dirección de Inmunizaciones, Viceministerio de Redes de Salud Colectiva, Ministerio del Poder Popular para la Salud.
Las dosis de SRP y de SR, las jeringas y los insumos conexos requeridos para la respuesta al brote se adquirieron a través del mecanismo del Fondo Rotatorio de la OPS.
Con el apoyo de la OPS, entre el 2017 y el 2019 se movilizaron de 19 000 a 31 000 vacunadores en todo el país, y más de 50 expertos nacionales e internacionales de la OPS. Además, se fortaleció la cadena de frío, se garantizó el almacenamiento de las vacunas en las ASIC y más de 13 000 trabajadores de la salud recibieron capacitación en respuesta al brote de sarampión en las 24 EF (6).
Por recomendaciones del grupo técnico asesor de EPV, el 1 de enero de 2019 se oficializó la administración de la SRP2 a los 18 meses de edad para los nacidos a partir del segundo semestre del 2017, y se mantuvo la SRP2 a los cinco años para los nacidos entre el 2014 y el primer semestre del 2017.
CIERRE DEL BROTE
Para verificar la interrupción del brote en la SE 33 del 2019, se elaboró un informe especial de cierre en cada una de las 24 EF con los criterios epidemiológicos, de vacunación y de laboratorio que recomienda el marco regional para la monitorización y la reverificación de la eliminación (1). Con los informes subnacionales y con las orientaciones de la Comisión regional de monitoreo y reverificación de la eliminación del sarampión, la rubéola y el SRC, Venezuela elaboró el informe del brote que incluyó la caracterización de epidemiológica y laboratorial, así como los mecanismos utilizados para poner en práctica los criterios de interrupción (6).
La ausencia de casos confirmados después de la SE 33 del 2019 se demostró por seguimiento y la exclusión de todos los casos sospechosos, información disponible en la base de datos nacional y en la base de resultados del LNR. Se realizó el seguimiento de contactos de los casos confirmados durante los últimos 21 días del brote. Las BAI y BAC se intensificaron en todos los municipios del país donde se notificaron los últimos casos del brote y en los que había silencio epidemiológico. Desde el 2019, y en los años siguientes, el desempeño de los indicadores de vigilancia a nivel nacional y subnacional superó el estándar (≥80%) de casos con investigación adecuada, igual el indicador de porcentaje de casos con muestra adecuada, con excepción del 2019, cuando este indicador cerró en 70% (6).
A pesar de que Venezuela alcanzó un porcentaje de 104,4% en la CNV con SR en la respuesta al brote, y 87% (21/24) de las EF alcanzaron porcentajes de cumplimiento ≥95%, las coberturas del programa de rutina no fueron óptimas, ya que se registró 65,4% con SRP1, y SRP2 con 12,9% en población de 1 año y 30,9% en población de 5 años. Aun cuando las coberturas no fueron óptimas a nivel nacional y en la mayoría de las EF, el porcentaje óptimo alcanzado en la población de 1 año en la CNV con SR indica que 100% de esta población recibió al menos una dosis contra el sarampión y la rubéola (figura 3). Se programaron monitorizaciones rápidas de vacunación diarias, intermedias y finales, con prioridad para las zonas de difícil acceso, zonas con alta densidad poblacional, comunidades indígenas, zonas periurbanas y limítrofes, y zonas baja cobertura de vacunación, silencio epidemiológico y zonas con aparición reciente de casos (6).
Con las orientaciones de la OPS, Venezuela cumplió con el protocolo de búsqueda activa de laboratorio (BAL). En el total de las muestras procesadas por la BAL, el resultado para sarampión y rubéola fue negativo; entre las SE 33 y la SE 52 del 2019 se procesaron 137 muestras de 73 municipios correspondientes a casos con fiebre y erupción.
Desde el inicio y en diferentes etapas del brote se recolectaron y se enviaron muestras a la División de enfermedades virales prevenibles con vacunas de los CDC para la genotipificación viral. Se identificó el genotipo D8, linaje MVi/Hulu-Langat.MYS/26.11 en 100% (40/40) de las muestras analizadas. Con la finalidad de identificar y documentar el genotipo viral asociado a las cadenas de transmisión detectadas durante el brote de sarampión, Venezuela envió 81 muestras para la secuenciación al Laboratorio global de referencia de la Organización Mundial de la Salud, provenientes de diferentes estados y en diferentes momentos del brote; todas tenían el mismo genotipo antes mencionado (figura 4).
DISCUSIÓN
El brote de sarampión en Venezuela (2017-2019) fue un desafío sanitario en un contexto nacional caracterizado por la imposición de un bloqueo económico unilateral que dificultó la adquisición y administración de vacunas, con aumento de la susceptibilidad a EPV y del riesgo epidemiológico, incluso para los países de la Región.
La migración de personal de salud y la falta de actualización complicaron la identificación de casos y la activación de ERR.
El seguimiento virológico permitió comprobar la persistencia de la circulación del mismo genotipo durante más de 12 meses, lo que resultó en el restablecimiento de la transmisión endémica del sarampión y la consecuente pérdida de la certificación de Venezuela como país libre de sarampión otorgada en el 2016.
Las medidas tomadas por Venezuela con la cooperación técnica de la OPS incluían las actividades contempladas en el PITS, con una disminución progresiva de casos hasta lograr cero casos notificados desde la SE 33 del 2019.
Las medidas exitosas adoptadas incluyeron la disponibilidad y la distribución de vacunas, la vacunación en terreno, la capacitación, la búsqueda activa de casos, el seguimiento de contactos, el fortalecimiento de la red laboratorial, la formación y actualización de los ERRA, y la notificación oportuna (5, 12).
Como limitación de este trabajo, se puede mencionar que los formatos de registro nominal y consolidado de la CNV no permitieron desagregar las dosis de SR según las dosis de esquema o adicionales, por lo que no incidieron en la cobertura de rutina del período 2017-2019. El denominador para calcular coberturas son estimaciones de población del censo del 2011, que no considera la migración interna y externa. Para la CNV, el denominador permaneció invariable, mientras que al numerador se agregaron nuevas cohortes de <1 año, no contempladas en la meta inicial.
CONCLUSIONES
El trabajo del MPPS, con la cooperación técnica de la OPS, la activación de instituciones del sector público y privado, universidades y la participación de las comunidades organizadas fortalecieron los mecanismos que condujeron a la interrupción del brote de sarampión, bajo el principio inestimable de corresponsabilidad social. El reto que enfrenta tanto el país como la Región para sostener la eliminación (13) radica en asegurar la provisión constante de vacunas y otros recursos esenciales, reforzar la demanda espontánea de la vacunación, fortalecer la vigilancia epidemiológica y garantizar la respuesta rápida y oportuna a brotes originados a partir de casos importados de otras naciones o regiones (14, 15).
Declaración.
Las opiniones expresadas en este manuscrito son responsabilidad del autor y no reflejan necesariamente los criterios ni la política de la RPSP/PAJPH, de la OPS o de los Centros para el Control y la Prevención de Enfermedades o del Departamento de Salud y Servicios Humanos de EE.UU.
Agradecimiento.
A las autoridades del MPPS. A los Ministerios del Poder Popular: Ciencia y Tecnología, Defensa, Pueblos Indígenas y Comunas, al Programa de Inmunizaciones del MPPS y sus equipos y vacunadores en todos los niveles, al personal de salud y al personal del laboratorio nacional, a las comunidades organizadas, a la OPS/OMS y su equipo de consultores y socios estratégicos.
Funding Statement
Este artículo ha sido financiado mediante la subvención o el acuerdo de cooperación NU66GH002171 de los Centros para el Control y la Prevención de Enfermedades de EE.UU.
Footnotes
Financiación.
Este artículo ha sido financiado mediante la subvención o el acuerdo de cooperación NU66GH002171 de los Centros para el Control y la Prevención de Enfermedades de EE.UU.
REFERENCIAS
- 1.Organización Panamericana de la Salud . Marco regional para el monitoreo y la reverificación de la eliminación del sarampión, la rubéola y el síndrome de rubéola congénita en la Región de las Américas. Washington D.C.: OPS; 2022. Disponible en: https://iris.paho.org/handle/10665.2/56856. [Google Scholar]; Organización Panamericana de la Salud. Marco regional para el monitoreo y la reverificación de la eliminación del sarampión, la rubéola y el síndrome de rubéola congénita en la Región de las Américas. Washington D.C.: OPS; 2022. Disponible en: https://iris.paho.org/handle/10665.2/56856
- 2.Mago H. Vacunas: historia y novedades. Salus. 2011;15(3):5–6. [Google Scholar]; Mago H. Vacunas: historia y novedades. Salus. 2011;15(3):5-6.
- 3.Ministerio del Poder Popular para la Salud . Antecedentes del Programa Ampliado de Inmunizaciones. Caracas: MPPS; 2023. [Google Scholar]; Ministerio del Poder Popular para la Salud. Antecedentes del Programa Ampliado de Inmunizaciones. Caracas: MPPS; 2023.
- 4.Ministerio del Poder Popular para la Salud . Hitos del programa de vacunación de la República Bolivariana de Venezuela. Caracas: MPPS; 2023. [Google Scholar]; Ministerio del Poder Popular para la Salud. Hitos del programa de vacunación de la República Bolivariana de Venezuela. Caracas: MPPS; 2023.
- 5.Valero N, Gotera J. Hacia la eliminación del sarampión en Venezuela. Investig Clínica. 2007;48(2):135–7. [PubMed] [Google Scholar]; Valero N, Gotera J. Hacia la eliminación del sarampión en Venezuela. Investig Clínica. 2007;48(2):135-7. [PubMed]
- 6.Organización Panamericana de la Salud . Segunda reunión anual de la Comisión regional de monitoreo y la reverificación de la eliminación del sarampión, la rubéola y el SRC de las Américas. Washington D.C.: OPS; 2022. [Google Scholar]; Organización Panamericana de la Salud. Segunda reunión anual de la Comisión regional de monitoreo y la reverificación de la eliminación del sarampión, la rubéola y el SRC de las Américas. Washington D.C.: OPS; 2022.
- 7.Morán-Mariños C, Nieto-Gutiérrez W. Pacheco-Mendoza JSarampión en Latinoamérica: un análisis de tendencia y red de colaboración científica en los últimos 20 años. Rev Cubana Med Trop. 2021;73(2) Disponible en: http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0375-07602021000200013&lng=es&nrm=iso&tlng=es. [Google Scholar]; Morán-Mariños C, Nieto-Gutiérrez W, Pacheco-Mendoza JSarampión en Latinoamérica: un análisis de tendencia y red de colaboración científica en los últimos 20 años. Rev Cubana Med Trop. 2021;73(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0375-07602021000200013&lng=es&nrm=iso&tlng=es
- 8.Condori-Yujra FJ, Jimenez-Vasquez V, Enríquez-Alva GW, Gordillo-Vilchez SM, Cabezudo-Pillpe NE. Genotipificación molecular de las cepas del virus sarampión en el Perú, 2018. An Fac Med. 2018;79(1):94–5. [Google Scholar]; Condori-Yujra FJ, Jimenez-Vasquez V, Enríquez-Alva GW, Gordillo-Vilchez SM, Cabezudo-Pillpe NE. Genotipificación molecular de las cepas del virus sarampión en el Perú, 2018. An Fac Med. 2018;79(1):94-5.
- 9.Gutiérrez RU, Trejos AM, Agüero MLÁ. El regreso del sarampión. Acta Médica Costarric. 2020;59(4) Disponible en: http://actamedica.medicos.cr/index.php/Acta_Medica/article/view/975. [Google Scholar]; Gutiérrez RU, Trejos AM, Agüero MLÁ. El regreso del sarampión. Acta Médica Costarric. 2020;59(4). Disponible en: http://actamedica.medicos.cr/index.php/Acta_Medica/article/view/975
- 10.Márquez FJV, Navas RJ. Consenso sarampión. Bol Venez Infectol. 2018;29(2):53–67. [Google Scholar]; Márquez FJV, Navas RJ. Consenso sarampión. Bol Venez Infectol. 2018;29(2):53-67.
- 11.Organización Panamericana de la Salud . Alerta Epidemiológica-Sarampión-24 de enero de 2020. Washington D.C.: OPS; 2020. Disponible en: https://www.paho.org/es/documentos/actualizacion-epidemiologica-sarampion-24-enero-2020. [Google Scholar]; Organización Panamericana de la Salud. Alerta Epidemiológica-Sarampión-24 de enero de 2020. Washington D.C.: OPS; 2020. Disponible en: https://www.paho.org/es/documentos/actualizacion-epidemiologica-sarampion-24-enero-2020
- 12.Organización Panamericana de la Salud . El brote de sarampión en Venezuela está bajo control. Washington D.C.: OPS; 2020. Disponible en: https://www.paho.org/es/noticias/30-1-2020-brote-sarampion-venezuela-esta-bajo-control. [Google Scholar]; Organización Panamericana de la Salud. El brote de sarampión en Venezuela está bajo control. Washington D.C.: OPS, 2020. Disponible en: https://www.paho.org/es/noticias/30-1-2020-brote-sarampion-venezuela-esta-bajo-control
- 13.Minta AA. Progress toward measles elimination - worldwide, 2000-2022. MMWR. 2023;72 doi: 10.15585/mmwr.mm7246a3. Disponible en: https://www.cdc.gov/mmwr/volumes/72/wr/mm7246a3.htm. [DOI] [PMC free article] [PubMed] [Google Scholar]; Minta AA. Progress toward measles elimination - worldwide, 2000-2022. MMWR. 2023;72. Disponible en: https://www.cdc.gov/mmwr/volumes/72/wr/mm7246a3.htm [DOI] [PMC free article] [PubMed]
- 14.Asociación Española de Pediatría . La vacunación del sarampión a nivel mundial a la baja: señal de peligro. [Internet] AEP; [28 de noviembre del 2022]. Disponible en: https://vacunasaep.org/profesionales/noticias/la-vacunacion-del-sarampion-nivel-mundial-la-baja-senal-de-peligro. [Google Scholar]; Asociación Española de Pediatría. La vacunación del sarampión a nivel mundial a la baja: señal de peligro. [Internet]. AEP; 28 de noviembre del 2022. Disponible en: https://vacunasaep.org/profesionales/noticias/la-vacunacion-del-sarampion-nivel-mundial-la-baja-senal-de-peligro
- 15.Fondo de las Naciones Unidas para la Infancia . La mortalidad por sarampión en el mundo aumenta en un 50% de 2016 a 2019 y se cobra más de 207.500 vidas en 2019. [Internet] UNICEF; [12 de noviembre del 2020]. Disponible en: https://www.unicef.org/elsalvador/comunicados-prensa/la-mortalidad-por-sarampi%C3%B3n-en-el-mundo-aumenta-en-un-50-de-2016-2019-y-se-cobra. [Google Scholar]; Fondo de las Naciones Unidas para la Infancia. La mortalidad por sarampión en el mundo aumenta en un 50% de 2016 a 2019 y se cobra más de 207.500 vidas en 2019. [Internet], UNICEF; 12 de noviembre del 2020. Disponible en: https://www.unicef.org/elsalvador/comunicados-prensa/la-mortalidad-por-sarampi%C3%B3n-en-el-mundo-aumenta-en-un-50-de-2016-2019-y-se-cobra


