Abstract
目的
探讨育龄期系统性红斑狼疮(systemic lupus erythematosus,SLE)女性患者的卵巢功能及其影响因素。
方法
选取2017年1月至2024年5月于北京大学人民医院就诊明确诊断的SLE女性患者107例,年龄20~40岁,同时选取40例年龄在20~40岁之间的健康女性作为对照。采用化学发光法检测健康对照及SLE患者血清中抗缪勒氏管激素(anti-Müllerian hormone,AMH)水平,通过病例检索形式收集SLE患者的一般临床特征、用药情况(包括激素、免疫抑制剂及生物制剂),分析SLE患者接受生物制剂治疗前后血清中AMH水平的变化。
结果
(1) SLE患者的AMH水平显著低于健康对照组[1.475(0.344, 3.030) μg/L vs. 2.934(1.893, 4.761) μg/L,P < 0.001]。(2)SLE患者月经正常组AMH水平显著高于月经不规律组[1.931(0.638,3.414) μg/L vs. 0.335(0.159,1.527) μg/L,P=0.004],AMH降低组与AMH正常组在临床特征及实验室指标方面差异无统计学意义。(3)多因素Logistic回归分析结果显示,年龄(OR=1.124,95%CI1.033~1.224,P=0.007)和病程(OR=1.100,95%CI1.017~1.190,P=0.018)是AMH下降的危险因素。(4)接受泰它西普治疗6个月后,患者AMH水平显著高于治疗前[治疗后2.050(0.763,4.259) μg/L vs.治疗前1.988(0.473,2.822) μg/L,P=0.043];接受利妥昔单抗治疗6个月后,患者AMH水平与治疗前差异无统计学意义[治疗后2.026(0.376,2.267) μg/L vs.治疗前1.545(0.503,3.414) μg/L,P=0.127]。
结论
育龄期SLE患者存在卵巢功能下降,年龄和病程是其危险因素;生物制剂的使用对于育龄期SLE患者的卵巢功能有较好的安全性。
Keywords: 系统性红斑狼疮, 卵巢功能, 抗缪勒氏管激素
Abstract
Objective
To explore the ovarian function and its influencing factors in women of childbearing age with systemic lupus erythematosus (SLE).
Methods
A total of 107 female patients diagnosed with SLE at Peking University People' s Hospital from January 2017 to May 2024, aged between 20 and 40 years, were included in the study. At the same time, 40 matched healthy women aged between 20 and 40 years were selected as controls. Serum levels of anti-Müllerian hormone (AMH) were measured using the chemiluminescence method in both the control group and the SLE patients. The general clinical characteristics and medication history (including hormones, immunosuppressants, and biological agents) of the SLE patients were obtained through case retrieval. Changes in serum AMH levels before and after treatment with biological agents in the SLE patients were analyzed.
Results
(1) The AMH levels in the SLE patients were significantly lower than those in the healthy control group [1.475 (0.344, 3.030) μg/L vs. 2.934 (1.893, 4.761) μg/L, P < 0.001]. (2) The level of AMH in the SLE patients with normal menstruation was significantly higher than that in the patients with irregular menstruation [1.931 (0.638, 3.414) μg/L vs. 0.335 (0.159, 1.527) μg/L, P=0.004]. No statistical differences were found in clinical characteristics and laboratory indicators between the groups with decreased AMH group and normal AMH group. (3) The multivariate logistic regression analysis revealed that age (OR=1.124, 95%CI: 1.033-1.224, P=0.007) and disease duration (OR=1.100, 95%CI: 1.017-1.190, P=0.018) were identified as significant risk factors for the decline in AMH levels. (4) After 6 months of treatment with telitacicept, the AMH level was significantly higher than that before treatment [2.050 (0.763, 4.259) μg/L vs. 1.988 (0.473, 2.822) μg/L, P=0.043]. There was no significant difference in AMH level between patients receiving rituximab treatment for 6 months [2.026 (0.376, 2.267) μg/L vs. 1.545 (0.503, 3.414) μg/L, P=0.127].
Conclusion
Ovarian function is decreased in SLE patients of childbearing age, and age and disease duration are the risk factors. The utilization of biological agents demonstrates favorable safety profiles regarding ovarian function in childbearing-age patients with SLE.
Keywords: Systemic lupus erythematosus, Ovarian function, Anti-Müllerian hormone
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及全身多系统的自身免疫性疾病,病情易反复, 该病女性患者的比例远高于男性,我国男女发病比例为1 ∶ 10~1 ∶ 12[1]。随着糖皮质激素及环磷酰胺等免疫抑制剂的应用,SLE患者的预后得到很大改善。然而,越来越多的证据表明环磷酰胺可损害SLE女性患者卵巢功能[2]。伴随国家对优生优育及二胎政策的推广,女性卵巢功能减退(diminished ovarian reserve,DOR)的研究越来越受到关注。目前关于SLE患者疾病状态下卵巢功能的研究多集中于雌激素、孕激素、血清泌乳素、促卵泡生成素及促黄体生成素,由于这些指标在整个月经周期的不同时期波动较大,因此,无法准确反映女性的卵巢功能。有研究证实,抗缪勒氏管激素(anti-Müllerian hormone,AMH)在整个月经周期中表达稳定,且与卵巢中有腔卵泡的数量呈正相关,能直接反映卵泡库的大小,是评估卵巢储备功能很好的血清学指标[3]。
本研究探讨AMH在女性SLE患者中的分布情况及AMH与年龄、药物使用的关系,评价生物制剂泰它西普和利妥昔单抗对育龄期SLE女性患者卵巢功能的影响,为有生育需求的SLE女性患者治疗方案的选择提供依据。
1. 资料与方法
1.1. 研究对象
选取2017年1月至2024年5月于北京大学人民医院门诊就诊及住院的年龄在20~40岁的SLE女性患者107例,有详细随访及临床用药、病情变化、月经变化的完整记录。同时选取40例年龄在20~40岁的月经周期正常且未妊娠的健康女性作为对照。入选标准:(1)所有入组患者均符合《美国风湿病学会1997年系统性红斑狼疮分类标准》;(2)月经周期正常,每个月经周期21~35 d,每次月经持续3~5 d;(3)所有患者均可合并使用糖皮质激素和羟氯喹,具体剂量由临床医师根据患者的病情判断来决定。排除标准:(1)SLE治疗前已经出现卵巢功能衰竭;(2)与SLE的病情或治疗无关的生殖系统疾病,如子宫全切术后、盆腔放疗术后、卵巢切除术后、多囊卵巢综合征、子宫内膜异位症、卵巢颗粒细胞肿瘤;(3)入组前3个月曾口服避孕药以及妊娠等情况。
本研究获得北京大学人民医院伦理审查委员会的批准(批准号:2023PHB026-001),所有入组患者均签署知情同意书。
1.2. 临床与实验室资料
记录SLE患者的临床特征、实验室指标、月经情况及用药情况。临床特征包括皮疹、光过敏、口腔溃疡、关节炎、浆膜炎、肾脏病变、神经病变、血液系统病变,使用系统性红斑狼疮疾病活动指数2000(systemic lupus erythematosus disease activity index 2000,SLEDAI-2000)评估患者SLE疾病活动程度[4]。实验室指标包括血常规、红细胞沉降率、C反应蛋白、免疫球蛋白(IgA、IgG、IgM)、补体C3、补体C4、抗核抗体、抗双链DNA抗体及抗Smith抗体。月经情况指月经周期、行经期、经量。患者用药情况包括激素、免疫抑制剂及生物制剂。
1.3. AMH水平
所有患者血清均来自于北京大学人民医院生物样本库,健康对照血清来源于北京大学人民医院体检中心,冻存于-80 ℃冰箱待用。AMH采用化学发光法检测,所用试剂及仪器来自湖南携光有限公司,并且使用配套校准品及质控品保证质量,重复性变异系数不大于10%,批间差变异系数不大于15%。参考国内最新的卵巢储备功能减退专家共识[5],当AMH < 1.1 μg/L定义为AMH降低,按此标准将SLE患者分为AMH正常组(n=59)和AMH降低组(n=48),分析AMH水平与SLE患者临床特征和实验室指标的相关性。
1.4. 统计学分析
采用SPSS 26.0软件进行数据统计和分析。符合正态分布的连续变量用均数±标准差表示,组间比较采用配对t检验;非正态分布的连续变量用中位数(四分位数)[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验。使用Spearman相关系数分析年龄与AMH水平的相关性。使用卡方检验比较AMH正常组和AMH降低组的临床和实验室指标的差异,若2×2列联表单元格中期望数 < 5,则采用Fisher精确检验。运用二元Logistic回归分析来评估AMH下降的相关因素。P < 0.05为差异有统计学意义。
2. 结果
2.1. 一般情况
共纳入107例符合条件的女性SLE患者(表 1),年龄中位数为31(25,34)岁,病程4(1,10)年,40例健康对照组年龄中位数为29(25,37)岁,两组年龄比较差异无统计学意义(P=0.897)。
表 1.
SLE患者的基本资料
Demographics characteristics of SLE patients
| Parameters | SLE (n=107) |
| SLE, systemic lupus erythematosus; Anti-dsDNA, anti-double-stranded DNA; Anti-Sm, anti-Smith; GC, glucocorticoid; HCQ, hydroxychloroquine; MMF, mycophenolate mofetil; CTX, cyclophosphamide; RTX, rituximab. | |
| Age/years, M (P25, P75) | 31 (25, 34) |
| Disease duration/years, M (P25, P75) | 4 (1, 10) |
| Rash, n (%) | 64 (59.8) |
| Photosensitivity, n (%) | 18 (16.8) |
| Oral ulcers, n (%) | 17 (15.9) |
| Arthritis, n (%) | 62 (57.9) |
| Serositis, n (%) | 31 (29.0) |
| Renal disorder, n (%) | 54 (50.5) |
| Neurologic disorder, n (%) | 30 (28.0) |
| Hematologic disorder, n (%) | 54 (50.5) |
| Antinuclear antibody positive, n (%) | 101 (94.4) |
| Anti-dsDNA antibody positive, n (%) | 66 (60.7) |
| Anti-Sm antibody positive, n (%) | 19 (17.8) |
| GC, n (%) | 74 (69.1) |
| HCQ, n (%) | 69 (64.5) |
| MMF, n (%) | 45 (42.1) |
| CTX, n (%) | 5 (4.7) |
| RTX, n (%) | 20 (18.7) |
| Telitacicept, n (%) | 19 (17.8) |
SLE患者的AMH水平显著低于健康对照组[1.475(0.344,3.030)μg/L vs. 2.934(1.893,4.761) μg/L],差异有统计学意义(P < 0.001)。SLE患者的AMH水平与年龄呈一定的负相关(r=-0.400,P < 0.001)。
2.2. AMH水平与SLE患者临床特征和实验室指标的相关性
SLE患者中AMH正常组和AMH降低组除年龄(P=0.001)与病程(P < 0.001)外,两组其余的临床特征与实验室指标差异无统计学意义(表 2)。
表 2.
AMH水平与SLE患者临床和实验室指标的关系
Relationship between AMH and clinical symptoms and laboratory parameters in SLE patients
| Parameters | AMH normal (n=59) | AMH decreased (n=48) | U/ χ2 value | P value |
| AMH, anti-Müllerian hormone; SLE, systemic lupus erythematosus; Anti-dsDNA, anti-double-stranded DNA; Anti-Sm, anti-Smith; IgA, immunoglobulin A; IgG, immunoglobulin G; IgM, immunoglobulin M; C3, complement 3; C4, complement 4; MMF, mycophenolate mofetil; CTX, cyclophosphamide; RTX, rituximab; SLEDAI-2000, systemic lupus erythematosus disease activity index 2000. | ||||
| Age/years, M(P25, P75) | 29.00 (24.00, 32.00) | 33.00 (28.00, 36.00) | 855.0 | 0.001 |
| Disease duration/years, M (P25, P75) | 2.00 (0.50, 7.00) | 6.50 (3.00, 12.00) | 860.5 | < 0.001 |
| Clinical symptoms | ||||
| Rash, n (%) | 33 (55.9) | 31 (64.6) | 0.824 | 0.364 |
| Photosensitivity, n (%) | 9 (15.3) | 9 (18.8) | 0.231 | 0.631 |
| Oral ulcers, n (%) | 8 (13.6) | 9 (18.8) | 0.534 | 0.465 |
| Arthritis, n (%) | 32 (54.2) | 30 (62.5) | 0.742 | 0.389 |
| Serositis, n (%) | 19 (32.2) | 12 (25.0) | 0.667 | 0.414 |
| Renal disorder, n (%) | 30 (50.8) | 24 (50.0) | 0.008 | 0.931 |
| Neurologic disorder, n (%) | 14 (23.7) | 16 (33.3) | 1.210 | 0.271 |
| Hematologic disorder, n (%) | 29 (49.2) | 25 (52.1) | 0.091 | 0.763 |
| Laboratory parameters | ||||
| Antinuclear antibody positive, n (%) | 57 (96.6) | 44 (91.7) | 1.559 | 0.459 |
| Anti-dsDNA antibody positive, n (%) | 37 (62.7) | 28 (58.3) | 0.213 | 0.645 |
| Anti-Sm antibody positive, n (%) | 8 (13.6) | 11 (22.9) | 1.587 | 0.208 |
| IgA, M (P25, P75) | 2.285 (1.758, 3.245) | 2.800 (1.600, 3.570) | 1 236.0 | 0.414 |
| IgG, M (P25, P75) | 13.70 (10.90, 17.54) | 13.68 (9.07, 17.00) | 1 322.0 | 0.794 |
| IgM, M (P25, P75) | 1.085 (0.690, 1.450) | 0.826 (0.470, 1.340) | 1 078.0 | 0.066 |
| C3, M (P25, P75) | 0.716 (0.528, 0.437) | 0.610 (0.437, 0.943) | 1 236.0 | 0.323 |
| C4, M (P25, P75) | 0.121 (0.080, 0.237) | 0.140 (0.080, 0.214) | 1 345.0 | 0.768 |
| Immunosuppressant | ||||
| MMF, n (%) | 25 (42.4) | 20 (41.7) | 0.490 | 0.783 |
| CTX, n (%) | 2 (3.4) | 3 (6.3) | 0.003 | 0.953 |
| Biologics | ||||
| RTX, n (%) | 12/53 (20.3) | 8/42 (16.7) | 0.452 | 0.502 |
| Telitacicept, n (%) | 12/53 (20.3) | 7/42 (14.6) | 0.817 | 0.366 |
| SLEDAI-2000, M(P25, P75) | 9.0 (5.0, 14.0) | 9.0 (5.3, 14.0) | 1 333.0 | 0.605 |
SLE患者月经正常组AMH水平显著高于月经不规律组[1.931(0.638,3.414)μg/L vs. 0.335(0.159,1.527) μg/L,P=0.004]。
2.3. AMH下降的相关因素
107例SLE患者中,有48例出现了AMH下降,首先对其进行单因素分析,再将单因素分析结果中差异有统计学意义的变量(P < 0.05)进行多因素分析。多因素Logistic回归分析结果显示,年龄(OR=1.124,95%CI:1.033-1.224,P=0.007)和病程(OR=1.100,95%CI:1.017-1.190,P=0.018)是AMH下降的危险因素(表 3)。
表 3.
AMH下降的Logistic回归分析结果
Results of binary Logistic regression analysis for decreased AMH
| Variables | Univariate | Multivariate | |||||||||
| B | Wald | P | OR | 95%CI | B | Wald | P | OR | 95%CI | ||
| AMH, anti-Müllerian hormone; IgA, immunoglobulin A; IgG, immunoglobulin G; IgM, immunoglobulin M; C3, complement 3; C4, complement 4; MMF, mycophenolate mofetil; CTX, cyclophosphamide; RTX, rituximab; SLEDAI-2000, systemic lupus erythematosus disease activity index 2000. | |||||||||||
| Age | 0.141 | 11.485 | 0.001 | 1.152 | 1.061-1.250 | 0.117 | 7.281 | 0.007 | 1.124 | 1.033-1.224 | |
| Disease duration | 0.123 | 10.018 | 0.002 | 1.131 | 1.048-1.221 | 0.095 | 5.619 | 0.018 | 1.100 | 1.017-1.190 | |
| IgA | 0.135 | 0.901 | 0.343 | 1.144 | 0.866-1.512 | ||||||
| IgG | 0.001 | 0.001 | 0.979 | 1.001 | 0.947-1.057 | ||||||
| IgM | -0.306 | 0.981 | 0.322 | 0.736 | 0.401-1.350 | ||||||
| C3 | -0.874 | 1.909 | 0.167 | 0.417 | 0.121-1.442 | ||||||
| C4 | 0.253 | 0.017 | 0.895 | 1.288 | 0.030-55.334 | ||||||
| MMF | -0.223 | 0.553 | 0.457 | 0.800 | 0.444-1.440 | ||||||
| CTX | 0.642 | 0.472 | 0.492 | 1.900 | 0.304-11.861 | ||||||
| RTX | -0.405 | 0.789 | 0.374 | 0.667 | 0.273-1.631 | ||||||
| Telitacicept | -0.539 | 1.284 | 0.257 | 0.583 | 0.230-1.482 | ||||||
| SLEDAI-2000 | 0.008 | 0.069 | 0.792 | 1.008 | 0.949-1.071 | ||||||
2.4. SLE患者接受泰它西普与利妥昔单抗治疗6个月后AMH水平变化
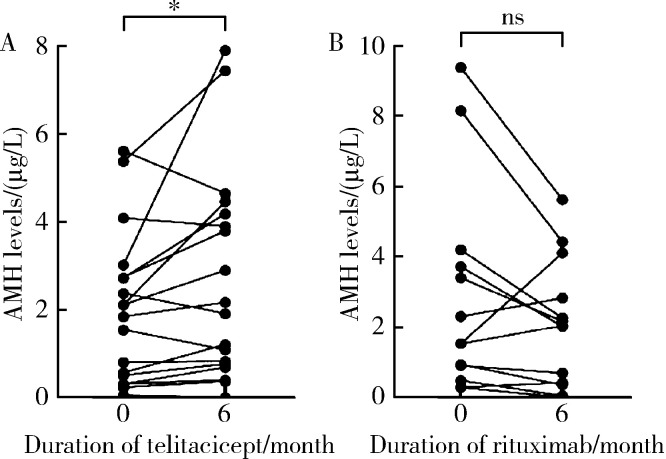
接受泰它西普治疗的19例患者中,1例患者在随访6个月后失访,剩余18例患者的AMH水平显著高于治疗前[治疗后2.050(0.763,4.259) μg/L vs.治疗前1.988(0.473,2.822) μg/L,P=0.043];接受利妥昔单抗治疗的20例患者中,7例患者在随访6个月后失访,剩余13例患者AMH水平与治疗前差异无统计学意义[治疗后2.026(0.376,2.267) μg/L vs.治疗前1.545(0.503,3.414) μg/L,P=0.127](图 1)。
图 1.
SLE患者接受泰它西普或利妥昔单抗治疗6个月前后的AMH水平
SLE patients' AMH levels before and after six months of treatment with telitacicept or rituximab
A, telitacicept; B, rituximab. * P < 0.05; ns, no significance; AMH, anti-Müllerian hormone; SLE, systemic lupus erythematosus.
3. 讨论
AMH的基本结构是同源二聚体糖蛋白,属于转化生长因子-β家族,基因定位于19p13.3号染色体,由5个外显子组成,从女性卵巢中前卵泡和小卵泡的颗粒细胞分泌[6-7]。AMH水平在25岁时达到高峰,然后开始逐渐下降,直到绝经前几年无法检测到[8-9]。由于生长中的小卵泡数量与原始卵泡总数处于平衡状态,因此,血清AMH水平反映了卵巢卵泡池,被认为是卵巢储备的准确标志。此外,与促卵泡生成素等其他卵巢活性生物标志物相比,AMH水平在不同月经周期和一个月经周期内的变化较小[10],因此,本研究选择AMH作为评价卵巢功能的指标。本研究中AMH水平与年龄呈负相关,有研究显示随着年龄的增长,血清AMH浓度每年下降6%(95%CI:5%~8%)[11],卵母细胞的数量和质量也会减少,称为DOR[12]。DOR一个关键特征是卵巢储备测试结果异常(但并非绝经后),由于社会环境、个体差异及疾病状态,一些女性在生育年龄内卵巢功能下降,会更早地经历DOR,导致早期不孕症(病理性DOR)。AMH对于卵巢储备测试具有预测意义,我们依据国内最新的卵巢储备功能减退专家共识[5],认为AMH < 1.1 μg/L时提示DOR,本研究发现SLE患者AMH水平低于1.1 μg/L时易出现月经不规律、闭经以及绝经年龄提前,与既往研究一致[13]。
SLE病情活动以及用于治疗的药物都可能对卵巢功能产生不良影响。既往研究显示,SLE患者血清AMH水平显著降低[14]。无论月经周期是否存在变化,SLE患者的卵巢储备都发生了变化[15]。本研究结果与文献[14-15]一致,与健康对照相比,SLE患者的AMH水平明显降低,并且SLE患者中,月经正常组的AMH水平显著高于月经不规律组。有研究报道,卵巢是常见的自身免疫攻击靶点,多种自身免疫疾病如桥本氏甲状腺炎、艾迪生(Addison)病、类风湿关节炎、SLE等都可诱发DOR的发生[16]。SLE疾病的特点是产生多种自身抗体,其传统的治疗以泛靶点抗炎和免疫抑制药物为主,例如抗疟药、糖皮质激素和免疫抑制剂。这些药物在发挥治疗作用的同时,通常也伴随着多种副作用,我们所熟知的环磷酰胺可通过影响颗粒细胞和卵母细胞DNA合成,消耗卵巢储备,造成卵巢功能减退。SLE患者,尤其是年轻女性患者,对外貌、生育和生活质量有更高需求,这对疾病的长期规范化管理提出了新挑战。
随着对SLE发病机制认识的增加,以B细胞为靶向的生物制剂应运而生,其使用为SLE治疗提供了新手段,它不仅有助于控制疾病活动,减少激素用量,而且较常规治疗更有利于实现达标治疗[17],同时还能改善血清学指标、降低复发风险、延缓器官损伤进展[18-19]。泰它西普是一种靶向结合B淋巴细胞刺激因子和A增殖诱导配体的新型全人重组融合蛋白[20],用于在传统治疗基础上仍具有高疾病活动度、自身抗体阳性的SLE成人患者[21]。本研究中接受泰它西普治疗6个月的患者AMH水平显著高于治疗前,这表明泰它西普对于育龄期SLE患者在卵巢功能方面表现出较好的安全性。
研究人类的原始卵泡形成和激活非常困难,动物模型对于更好地理解卵泡发生的遗传学至关重要,并且动物模型的研究提供了大量与卵巢功能衰竭相关的候选基因。LIM同源盒基因8是转录调节因子,有助于激活多个对卵母细胞成熟至关重要的基因的转录,可以诱导B细胞淋巴瘤2相关X蛋白和半胱天冬酶2和3的表达。叉头盒转录因子3(forkhead box O3,FOXO3)是一种转录因子,在卵母细胞中起着重要的调节作用,有观点认为FOXO3与颗粒细胞中的细胞周期蛋白依赖性激酶抑制因子1B共同协作以维持原始卵泡库,从而维持卵巢储备[22]。新生儿Fc受体(neonatal Fc receptor,FcRn)是卵巢中表达比例最高的IgG受体,FcRn的表达随卵泡发育无明显变化,从卵巢功能减退的机制研究中我们不难发现,从基因遗传到适应性免疫,Breg细胞缺陷、B细胞亚群紊乱及免疫球蛋白水平的异常能导致卵巢免疫环境的失衡[23],泰它西普的使用可能在一定程度上改善了这一现象。
本研究还存在一定的局限性和不足:(1)仅是单中心的回顾性临床研究;(2)未进一步明确泰它西普在改善SLE患者的适应证。因此,后续需要开展多中心、前瞻性和样本量较大的研究试验,观察相应指标随疾病严重程度的变化趋势,获得更加精准的临床数据,以便为SLE年轻女性患者的临床诊治提供个性化指导。
综上所述,本研究从血清AMH含量层面揭示SLE患者卵巢功能低下的原因,探讨生物制剂的使用对育龄期SLE女性患者卵巢功能的影响,发现泰它西普的使用没有降低患者卵巢功能,相反在一定程度上改善了卵巢炎性的免疫环境,为育龄期SLE患者提供了更安全的用药选择。
Funding Statement
北京大学人民医院横向科研课题(2023-Z-49)
Supported by the Horizontal Scientific Research Project of Peking University People' s Hospital (2023-Z-49)
Footnotes
利益冲突 所有作者均声明不存在利益冲突。
作者贡献声明 陈丹丹:设计研究方案,收集、分析、整理数据,撰写论文;李云:收集数据,撰写论文;卢情怡:收集、分析、整理数据,撰写论文;相晓红、孙峰、李英妮、赵静、王红彦:收集数据;李春:提出研究思路,设计研究方案,总体把关和审定论文。
References
- 1.中华医学会风湿病学分会, 国家皮肤与免疫疾病临床医学研究中心, 中国系统性红斑狼疮研究协作组 2020中国系统性红斑狼疮诊疗指南. 中华内科杂志. 2020;59(3):172–185. [Google Scholar]
- 2.刘 霞, 张 丽丽, 赵 伟, et al. 环磷酰胺对育龄系统性红斑狼疮患者卵巢功能影响的评价. 中华医学杂志. 2019;99(3):174–177. [Google Scholar]
- 3.中国医师协会生殖医学专业委员会 抗米勒管激素临床应用专家共识(2023年版) 中国实用妇科与产科杂志. 2023;39(4):431–439. [Google Scholar]
- 4.Gladman DD, Ibañez D, Urowitz MB. Systemic lupus erythematosus disease activity index 2000. J Rheumatol. 2002;29(2):288–291. [PubMed] [Google Scholar]
- 5.卵巢储备功能减退临床诊治专家共识专家组, 中华预防医学会生育力保护分会生殖内分泌生育保护学组 卵巢储备功能减退临床诊治专家共识. 生殖医学杂志. 2022;31(4):425–434. [Google Scholar]
- 6.Dewailly D, Andersen CY, Balen A, et al. The physiology and clinical utility of anti-Mullerian hormone in women. Hum Reprod Update. 2014;20(3):370–385. doi: 10.1093/humupd/dmt062. [DOI] [PubMed] [Google Scholar]
- 7.Broer SL, Broekmans FJ, Laven JS, et al. Anti-Mullerian hormone: Ovarian reserve testing and its potential clinical implications. Hum Reprod Update. 2014;20(5):688–701. doi: 10.1093/humupd/dmu020. [DOI] [PubMed] [Google Scholar]
- 8.Garcia-Velasco JA, Moreno L, Pacheco A, et al. The aromatase inhibitor letrozole increases the concentration of intraovarian androgens and improves in vitro fertilization outcome in low responder patients: A pilot study. Fertil Steril. 2005;84(1):82–87. doi: 10.1016/j.fertnstert.2005.01.117. [DOI] [PubMed] [Google Scholar]
- 9.Grossman MP, Nakajima ST, Fallat ME, et al. Müllerian-inhibiting substance inhibits cytochrome P450 aromatase activity in human granulosa lutein cell culture. Fertil Steril. 2008;89(Suppl 5):S1364–S1370. doi: 10.1016/j.fertnstert.2007.03.066. [DOI] [PubMed] [Google Scholar]
- 10.La Marca A, Grisendi V, Griesinger G. How much does AMH really vary in normal women? Int J Endocrinol. 2013;2013:959487. doi: 10.1155/2013/959487. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Khan HL, Bhatti S, Suhail S, et al. Antral follicle count (AFC) and serum anti-Müllerian hormone (AMH) are the predictors of natural fecundability have similar trends irrespective of fertility status and menstrual characteristics among fertile and infertile women below the age of 40 years. Reprod Biol Endocrinol. 2019;17(1):20. doi: 10.1186/s12958-019-0464-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Sharara FI, Scott JRT, Seifer DB. The detection of diminished ovarian reserve in infertile women. Am J Obstet Gynecol. 1998;179(3):804–812. doi: 10.1016/S0002-9378(98)70087-0. [DOI] [PubMed] [Google Scholar]
- 13.王国倩. 血清AMH水平与复发性流产的相关性分析[D]. 河南: 郑州大学, 2023.
- 14.Luo W, Mao P, Zhang L, et al. Assessment of ovarian reserve by serum anti-Müllerian hormone in patients with systemic lupus erythematosus: A meta-analysis. Ann Palliat Med. 2020;9(2):207–215. doi: 10.21037/apm.2020.02.11. [DOI] [PubMed] [Google Scholar]
- 15.Morales-Martínez FA, Salas-Castro C, García-Garza MR, et al. Evaluation of the ovarian reserve in women with systemic lupus erythematosus. J Family Reprod Health. 2021;15(1):38–44. doi: 10.18502/jfrh.v15i1.6076. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.何 瑞芬, 杨 永秀, 梁 晓磊. 卵巢储备功能减退动物模型研究进展. 中国实验动物学报. 2024;32(2):254–259. [Google Scholar]
- 17.Sun F, Wu H, Wang Z, et al. Effectiveness and safety of belimumab in chinese lupus patients: A multicenter, real-world observational study. Biomedicines. 2023;11(3):962. doi: 10.3390/biomedicines11030962. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Zhang F, Bae SC, Bass D, et al. A pivotal phase Ⅲ, rando-mised, placebo-controlled study of belimumab in patients with systemic lupus erythematosus located in China, Japan and South Korea. Ann Rheum Dis. 2018;77(3):355–363. doi: 10.1136/annrheumdis-2017-211631. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Zhang F, Zheng J, Li Y, et al. Phase 3, long-term, open-label extension period of safety and efficacy of belimumab in patients with systemic lupus erythematosus in China, for up to 6 years. RMD Open. 2022;8(1):e001669. doi: 10.1136/rmdopen-2021-001669. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Cai J, Gao D, Liu D, et al. Telitacicept for autoimmune nephro-pathy. Front Immunol. 2023;14:1169084. doi: 10.3389/fimmu.2023.1169084. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.耿 研, 武 丽君, 谢 其冰, et al. 生物制剂在系统性红斑狼疮中应用的中国专家共识(2024版) 中华风湿病学杂志. 2024;28(2):78–92. [Google Scholar]
- 22.Wood MA, Rajkovic A. Genomic markers of ovarian reserve. Semin Reprod Med. 2013;31(6):399–415. doi: 10.1055/s-0033-1356476. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.卢悦双. 早发性卵巢功能不全患者B细胞亚群及免疫球蛋白异常[D]. 山东: 山东大学, 2023.