Abstract
目的
探讨分析吲哚菁绿(ICG)近红外荧光(NIF)成像技术对口腔潜在恶性疾患及口腔鳞状细胞癌早期诊断的可行性。
方法
利用二甲基苯并蒽丙酮溶液,给予金黄地鼠颊囊黏膜不同时间的局部刺激,诱导建立轻/中度异常增生、重度异常增生、鳞状细胞癌等病理状态的颊黏膜病变模型。采用ICG-NIF技术对病变组织进行荧光信号定量分析,免疫组织化学染色法对不同病理状态黏膜的微血管密度(MVD)、微淋巴管密度(MLVD)进行分析。
结果
ICG-NIF荧光定量分析结果显示,实验组中黏膜病变组织的荧光强度均高于正常黏膜,差异具有统计学意义(P<0.05),且实验组中黏膜病变恶性程度越高,其荧光强度越高。组织学分析显示,随着黏膜病变恶性程度增加,MVD增加(P<0.05),MLVD减小(P<0.05)。
结论
金黄地鼠异常增生的颊部黏膜病变与正常黏膜组织间具有ICG-NIF荧光信号差异,荧光定量分析方法具有辅助鉴别的临床应用潜能。
Keywords: 吲哚菁绿, 近红外荧光成像, 口腔潜在恶性疾患, 口腔鳞状细胞癌
Abstract
Objective
To explore and analyze the feasibility of using indocyanine green (ICG) near-infrared fluorescence (NIF) imaging technology for the early diagnosis of oral potential malignant disorders and oral squamous cell carcinoma.
Methods
7,12-Dimethylbenz[a]anthracene in acetone solution was used to induce various pathological models of buccal mucosal lesions (mild/moderate dysplasia, severe dysplasia, squamous cell carcinoma) in golden hamster. ICG-NIF was conducted for the quantitative analysis of the fluorescence signal of lesion tissue, and evaluation of the diagnostic and discriminative capabilities of the ICG-NIF technology for mucosal lesions in various pathological states. Immunohistochemical staining was perform to examine the microvessel density (MVD) and microlymphatic vessel density (MLVD) of mucosa in various pathological states and explore the histological reasons underlying the differences in fluorescence signals.
Results
The results of ICG-NIF fluorescence quantitative analysis reveal the higher fluorescence intensity of mucosal lesions in the experimental group compared with that of the normal mucosa on the control side, with statistical differences (P<0.05). Moreover, the more severe the malignancy of mucosal lesions in the experimental group, the higher the fluorescence intensity. According to histopathological analysis, the malignant progression of mucosal lesions in golden hamsters was accompanied with an increase in MVD (P<0.05) and a decrease in MLVD (P<0.05).
Conclusion
The abnormal proliferation of mucosal lesions in golden hamsters exhibits a difference in ICG-NIF fluorescence signal compared with normal mucosal tissue. Fluorescence quantitative analysis methods can provide assistance in differentiation and show potential for clinical applications.
Keywords: indocyanine green, near-infrared fluorescence imaging, oral potentially malignant disorders, oral squamous cell carcinoma
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔颌面部最常见的上皮来源的恶性肿瘤之一[1],目前公认的治疗方案是以手术治疗为主的综合治疗,但是OSCC患者的5年生存率为60%左右[2]–[3],晚期患者生存率更低。因此OSCC患者的早期诊断及治疗至关重要。口腔黏膜白斑、红斑、扁平苔藓等是一类具有癌变潜能的口腔潜在恶性疾患(oral potentially malignant disorders,OPMD),临床工作中需要对OPMD患者进行长期随访和定期复查,以早期发现早期治疗OSCC,降低死亡率[4]–[5]。组织病理活检是诊断OPMD和OSCC的金标准,但活检属于有创检查,存在创伤大、耗时长、患者接受程度低等问题,不适合作为OPMD早期诊断及长期监测的手段。积极探索OPMD及OSCC的无创筛查、早期诊断方法具有重大意义[6]。
近年来,自体荧光技术(autofluorescence imaging,AFI)、窄带成像技术(narrow band imaging,NBI)、反射式共聚焦显微镜(reflectance confocal microscopy,RCM)、光学相干断层扫描技术(optical coherence tomography,OCT)等光学诊断技术逐渐得到发展[7]。吲哚菁绿(indocyanine green,ICG)近红外荧光(near-infrared fluorescence,NIF)成像技术的推广应用,为光学诊断提供了一种新的选择。ICG-NIF的原理是利用病变组织血管、淋巴管缺陷形成的高通透性和滞留(enhanced permeability and retention,EPR)效应,使静脉注射的ICG在病变部位聚集,继而在近红外光的激发下(常用的激发波长为785 nm,发射波长为820 nm)与周围正常组织形成对比[8]–[10]。目前ICG-NIF技术已经在多种肿瘤疾病的荧光引导手术(fluorescence guided surgery,FGS)中被广泛应用,通过对ICG-NIF图像的分析可以辅助区分肿瘤病变和正常组织[11]–[12]。本研究旨在应用二甲基苯并蒽(7,12-dimethylbenz[a]anthracene,DMBA)丙酮溶液诱导建立不同病理状态的金黄地鼠颊黏膜病变模型,依靠ICG-NIF成像技术定量分析不同病变组织的荧光信号差异,探索通过荧光定量法辅助区分黏膜病变的可行性,为OPMD及OSCC的早期荧光辅助诊断提供一种新的策略。
1. 材料和方法
1.1. 主要材料和仪器
1.1.1. 实验动物
金黄地鼠,清洁级,鼠龄4~6周,体重约为150 g,雌雄各半,购于辽宁长生生物技术股份有限公司。实验操作符合南京大学动物实验伦理要求。
1.1.2. 主要试剂及仪器
DMBA(Sigma公司,美国),注射用ICG(25 mg/支,丹东医创药业有限责任公司),CK5/6、CD31、LYVE1抗体购买自艾博抗贸易有限公司。小动物活体成像仪(IVIS®Lumina,Perkin Elmer公司,美国),荧光手术导航系统(Real-IGS,南京诺源医疗器械有限公司)。
1.2. 金黄地鼠颊黏膜癌变模型构建
将40只金黄地鼠随机分成4组:对照组、轻/中度异常增生组、重度异常增生组、OSCC组,每组10只。将金黄地鼠分别固定于自制鼠架上,拉开颊囊,在实验组小鼠右侧(病变侧)颊囊黏膜下注射50 µL的0.5%DMBA丙酮溶液,在对照组小鼠颊囊黏膜及实验组左侧(对照侧)黏膜涂布丙酮溶液,每周处理3次。轻/中度异常增生组、重度异常增生组、OSCC组造模处理时间分别为4、6、10周,处理后禁食、禁饮2 h。观察监测并记录颊囊黏膜颜色、质地变化以及增生、糜烂情况。初次处理后每2周于各组随机挑选1只金黄地鼠,取颊囊黏膜进行组织病理检查,免疫组织化学染色法标记CK5/6,确认病理状态。在造模结束后对各组小鼠拍照记录颊囊黏膜状态,之后进行荧光成像及定量分析。
1.3. ICG-NIF技术进行荧光成像及定量分析
黏膜病变模型构建成功后,4组中随机选取5只金黄地鼠,腹腔注射2%戊巴比妥(40 mg/kg)麻醉,静脉注射5 mg/kg ICG溶液,在注射后1、6、12、24 h通过荧光手术导航系统采集颊部组织荧光信号进行定量分析,24 h后拍摄荧光图像。随后安乐处死金黄地鼠,解剖其颊囊黏膜,置于小动物活体成像仪拍摄荧光图像。根据ImageJ软件对目标区域的荧光图像定量分析,获取其平均荧光强度(mean fluorescence intensity,MFI),计算实验组中病变组织与正常组织的荧光信号对比(signal to background ratio,SBR),SBR=MFI(病变黏膜)/MFI(对照侧正常黏膜)。
1.4. 组织学分析
荧光检测完成后,将颊囊组织固定于4%多聚甲醛中,常规石蜡包埋、切片后进行苏木精-伊红(hematoxylin-eosin,HE)染色,免疫组织化学染色法CD31标记微血管,LYVE1标记微淋巴管,进行组织病理学评估。采用Weidner法进行微血管密度(microvessel density,MVD)、微淋巴管密度(microlymphatic vessel density,MLVD)计数。
1.5. 统计学分析
采用SPSS 22.0软件对数据进行统计分析。计量数据以均数±标准差的形式表示。不同组别的数据进行单因素方差分析。P<0.05表示差异具有统计学意义。
2. 结果
2.1. 不同病理状态颊囊黏膜模型构建
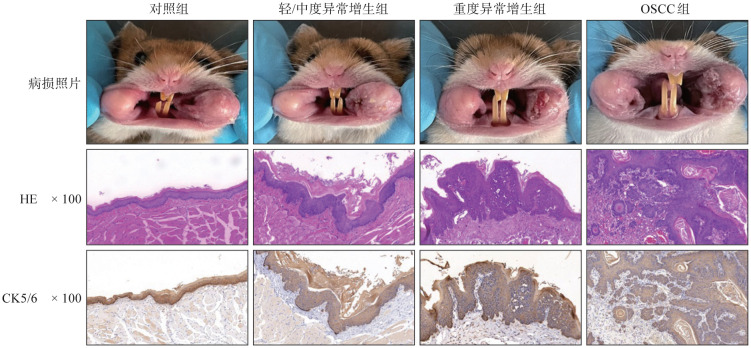
根据不同处理时间构建金黄地鼠颊囊黏膜病变模型,荧光成像定量分析后进行病理验证。肉眼大体观察(图1上),对照组及实验组对照侧颊囊黏膜表面红润光滑,弹性良好,微血管充盈清晰。与对照组相比,实验组病变侧黏膜颜色较灰暗苍白,黏膜增厚,表面粗糙,弹性减弱,微血管模糊,黏膜表面可见散在乳头状新生物。随着造模时间增长至6~10周时,黏膜病变累及范围扩大,新生物增生明显呈菜花状,突向口腔内侧,表面糜烂不规整,触之易出血。
图 1. 不同病理状态黏膜病变模型构建.
Fig 1 Construction of mucosal lesion models with different pathological states
对黏膜组织进行HE及CK5/6染色切片观察(图1中、下),对照组颊囊黏膜为复层鳞状上皮,表面角化,黏膜厚度为4~6层细胞,基底细胞层结构清晰,与人类正常黏膜结构相似。与对照组相比,轻/中度异常增生组病变侧颊囊黏膜细胞整体排列尚规整,表面出现过度角化,颗粒细胞层明显,棘层增厚,基底细胞层结构完整;重度异常增生组病变侧颊囊黏膜鳞状上皮异常增生明显,上皮分层不规则,结构紊乱层次超过上皮2/3,上皮钉突增生呈指状、水滴状,细胞大小不一,核深染,核浆比增大,核分裂象增多,但基底膜仍完整;黏膜癌变组病变侧颊囊黏膜细胞异常增生,核分裂象明显增加,可见病理性核分裂象,瘤细胞突破基底膜,呈团块状、条索状侵犯黏膜下结缔组织,形成浸润癌巢。
2.2. 荧光成像结果及定量分析
ICG-NIF荧光定量分析结果(图2)显示,各组中黏膜组织荧光强度均在注射后持续衰减,实验组病变侧黏膜荧光强度始终高于对照组。静脉注射24 h后对颊囊黏膜进行荧光成像及定量分析(图3,表1),对照组中颊囊黏膜组织内荧光信号微弱,MFI为(65±9.16)AU;实验组中病变侧黏膜组织荧光信号均高于对照侧黏膜,差异具有统计学意义(P<0.05);各实验组中,随着黏膜病变恶性程度增加,黏膜组织MFI升高,3组间差异均有统计学意义(P<0.05),其中OSCC组病变黏膜的MFI达到了(325±47.46)AU,SBR为4.97±0.87。
图 2. 各组黏膜组织荧光强度定量分析.
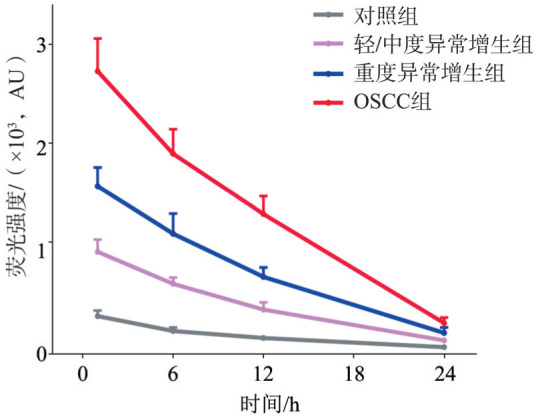
Fig 2 Quantitative analysis of fluorescence intensity in mucosal lesions of every group
图 3. 各组黏膜病变NIF成像.
Fig 3 NIF imaging of mucosal lesions of every group
表 1. ICG-NIF成像及MVD、MLVD定量分析.
Tab 1 Quantitative analysis of ICG-NIF imaging, MVD and MLVD
| 组别 | MFI | SBR | MVD | MLVD |
| 对照组 | 65±9.16 | - | 14.4±2.97 | 7.8±2.59 |
| 轻/中度异常增生组 | 123±12.26 | 1.89±0.32 | 26.4±5.32 | 6.4±1.64 |
| 重度异常增生组 | 214±21.12 | 3.27±0.46 | 73.2±11.14 | 5.6±1.32 |
| OSCC组 | 325±47.46 | 4.97±0.87 | 101.2±15.30 | 4.2±1.14 |
2.3. 不同病理状态颊囊黏膜组织学分析
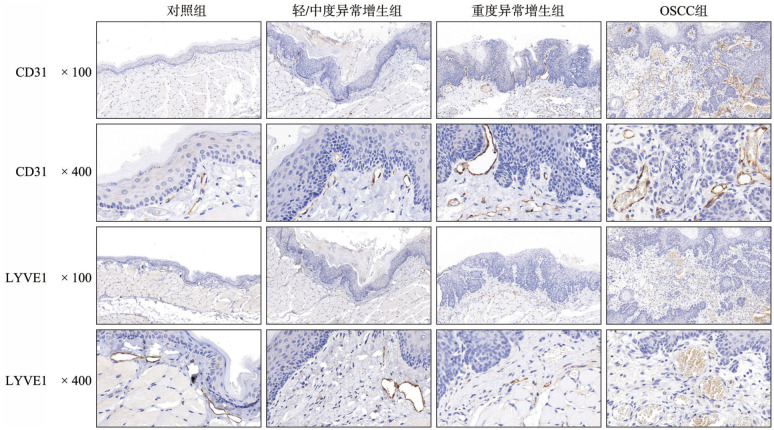
对各组黏膜下层组织MVD和MLVD进行分析(图4,表1),与对照组相比,各实验组病变侧黏膜均表现出MVD增加,MLVD减小,差异具有统计学意义(P<0.05)。各实验组中,随着黏膜病变恶性程度增加,MVD密度增加,3组间差异均有统计学意义(P<0.05),其中OSCC组织内血管网络丰富,MVD计数达到了101.2±15.30。随着刺激时间增长,MLVD在实验组中有下降的趋势,OSCC组织中MLVD计数为4.2±1.14,与异常增生组相比差异有统计学意义(P<0.05),而2个异常增生组间差异无统计学意义(P>0.05)。
图 4. 各组黏膜病变组织血管、淋巴管免疫组织化学染色.
Fig 4 Immunohistochemical staining of blood vessels and lymphatic vessels in tissue slices of every group
3. 讨论
研究[13]–[14]表明,5%~18%的OPMD会转变为癌症,其中伴有中度或重度异常增生的病损癌变可能性更高。针对OPMD的早期筛查及诊断有利于降低OSCC发病率,一直是研究的热点。目前,临床已较广泛地应用AFI、甲苯胺蓝染色技术作为传统口腔检查的辅助手段,以帮助临床医生无创筛查OPMD,并辅助判断取材活检的部位[15]–[17]。AFI通过识别健康口腔黏膜荧光基团的淡绿色荧光(波长515 nm),与黏膜病变荧光缺失区域进行区分,但该技术特异性较低,出血区域会产生假阳性,高度角化区域会出现假阴性,且图像判断依赖检查者的个人经验,具有较强的主观性。甲苯胺蓝染色技术可以增强局部病损的可视性,从而显示病变部位,甚至发现隐匿、无临床表现的OPMD病损,但具有较高的假阳性,且存在误食风险。ICG-NIF成像技术目前已在口腔癌的FGS中被逐渐应用[18]–[20],能够较好地显示肿瘤边界,辅助界定手术切缘[21]–[22]。相较NBI、RCM、OCT等技术,ICG-NIF的荧光具备更深的组织穿透,检查结果具有可定量分析的优势表2。将该技术应用于口腔黏膜癌变组织的筛查,能较好辅助判断黏膜状态,符合OPMD的长期随访和状态监测的临床需求。但其临床应用需要注射荧光造影剂,并需要特定成像设备的支持,这对该技术的广泛推广具有一定的限制。
表 2. OPMD辅助诊断的光学成像技术对比.
Tab 2 Optical imaging in the diagnosis of OPMD malignant transformation
| 技术 | 检测深度/mm | 优势 | 不足 |
| 自体荧光成像 | - | 操作简便,阴性预测值较高 | 特异性较低 |
| 窄带成像技术 | 0.17~0.20 | 显示上皮内血管,提高组织表面结构的对比度 | 穿透深度不足,角化物影响血管可见性 |
| 反射式共聚焦显微镜 | 0.2~03 | 高分辨率显示亚细胞结构 | 穿透深度不足,角化物影响观察 |
| 光学相干断层扫描技术 | 1.5~2 | 提供口腔组织微观结构和微血管的二维或三维成像 | 机械压力会影响,软组织的光学特征 |
| ICG-NIF成像 | 5~10 | 足够的穿透深度,可定量分析 | 需注射荧光显影剂 |
利用金黄地鼠的颊囊诱导口腔癌模型是较为理想且成熟的动物模型。颊囊是金黄地鼠特有的解剖结构,相关动物模型已被广泛用于口腔癌前病变、口腔癌相关的基础研究及口腔器械的生物学评价[23]–[24]。本研究利用该动物模型,在给予不同时间的局部刺激后,成功诱导出黏膜轻/中度异常增生、重度异常增生及OSCC等不同病理阶段,且较好地模拟了临床中口腔黏膜癌变的进展规律。本研究对该动物模型中不同病理阶段的黏膜组织进行荧光成像定量分析发现,随着黏膜病变恶性程度的增加,ICG-NIF荧光信号增强,且黏膜表面角化物对ICG-NIF荧光强度的影响微弱,利用该定量分析方法对于辅助区分正常黏膜与癌前病变黏膜、癌变黏膜有一定的参考价值。
目前认为,荧光分子在病变组织的蓄积主要依赖EPR效应。本研究从组织学层面分析不同病理阶段的黏膜组织,发现金黄地鼠黏膜病变恶性程度的进展伴随着MVD的增加及MLVD的减少,揭示了黏膜组织在异常增生进展过程中微血管、淋巴管的改建规律。这些改变会导致病变黏膜组织中更多的ICG灌注以及更长时间的蓄积,从而与正常黏膜形成荧光信号对比,解释了恶性程度更高的黏膜病变模型中ICG荧光信号增强的原因。实际应用中,炎症组织血管通透性的增强会对ICG-NIF成像的结果产生干扰[25],本研究的动物模型具有一定局限性,无法模拟并排除炎症组织的干扰。Pal等[26]报道了“荧光寿命”在荧光诊断中的重要性,强调癌变细胞对于荧光分子ICG更多的摄取也会导致荧光信号的增强,提示细胞生物学行为的改变在黏膜病变进展过程中也同样需要被关注。
综上所述,本研究表明通过ICG-NIF荧光定量分析,可辅助鉴别不同病理状态的黏膜病变,具备临床应用的潜能。当然,本研究采用的标准化动物模型具有一定局限性,后续研究还需要进一步的临床验证。
Funding Statement
[基金项目] 江苏省重点研发计划——社会发展项目(BE2018618);南京市医学科技发展项目(YKK19089)
Supported by: Key R&D Program of Jiangsu Province—Social Development Project (BE2018618); Nanjing Medical Science and Technology Development Project (YKK19089)
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2021[J] CA Cancer J Clin. 2021;71(1):7–33. doi: 10.3322/caac.21654. [DOI] [PubMed] [Google Scholar]
- 2.Warnakulasuriya S. Global epidemiology of oral and oropharyngeal cancer[J] Oral Oncol. 2009;45(4/5):309–316. doi: 10.1016/j.oraloncology.2008.06.002. [DOI] [PubMed] [Google Scholar]
- 3.Xia CF, Dong XS, Li H, et al. Cancer statistics in China and United States, 2022: profiles, trends, and determinants[J] Chin Med J. 2022;135(5):584–590. doi: 10.1097/CM9.0000000000002108. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Parak U, Lopes Carvalho A, Roitberg F, et al. Effectiveness of screening for oral cancer and oral potentially malignant disorders (OPMD): a systematic review[J] Prev Med Rep. 2022;30:101987. doi: 10.1016/j.pmedr.2022.101987. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Bouaoud J, Bossi P, Elkabets M, et al. Unmet needs and perspectives in oral cancer prevention[J] Cancers. 2022;14(7):1815. doi: 10.3390/cancers14071815. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.梁 甲武, 卫 明慧, 刘 青. 口腔潜在恶性病变癌变的早期无创检查方法[J] 实用口腔医学杂志. 2018;34(4):557–560. [Google Scholar]; Liang JW, Wei MH, Liu Q. Early non-invasive examination methods for malignant transformation of potential oral lesions[J] J Pract Stomatol. 2018;34(4):557–560. [Google Scholar]
- 7.Xu Y, Deng X, Sun Y, et al. Optical imaging in the diagnosis of OPMDs malignant transformation[J] J Dent Res. 2022;101(7):749–758. doi: 10.1177/00220345211072477. [DOI] [PubMed] [Google Scholar]
- 8.Fang J, Islam W, Maeda H. Exploiting the dynamics of the EPR effect and strategies to improve the therapeutic effects of nanomedicines by using EPR effect enhancers[J] Adv Drug Deliv Rev. 2020;157:142–160. doi: 10.1016/j.addr.2020.06.005. [DOI] [PubMed] [Google Scholar]
- 9.Shi Y, van der Meel R, Chen XY, et al. The EPR effect and beyond: strategies to improve tumor targeting and cancer nanomedicine treatment efficacy[J] Theranostics. 2020;10(17):7921–7924. doi: 10.7150/thno.49577. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Ikeda-Imafuku M, Wang LLW, Rodrigues D, et al. Strategies to improve the EPR effect: a mechanistic perspective and clinical translation[J] J Control Release. 2022;345:512–536. doi: 10.1016/j.jconrel.2022.03.043. [DOI] [PubMed] [Google Scholar]
- 11.Egloff-Juras C, Bezdetnaya L, Dolivet G, et al. NIR fluorescence-guided tumor surgery: new strategies for the use of indocyanine green[J] Int J Nanomedicine. 2019;14:7823–7838. doi: 10.2147/IJN.S207486. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Mieog JSD, Achterberg FB, Zlitni A, et al. Fundamentals and developments in fluorescence-guided cancer surgery[J] Nat Rev Clin Oncol. 2022;19(1):9–22. doi: 10.1038/s41571-021-00548-3. [DOI] [PubMed] [Google Scholar]
- 13.Iocca O, Sollecito TP, Alawi F, et al. Potentially malignant disorders of the oral cavity and oral dysplasia: a systematic review and Meta-analysis of malignant transformation rate by subtype[J] Head Neck. 2020;42(3):539–555. doi: 10.1002/hed.26006. [DOI] [PubMed] [Google Scholar]
- 14.Mello FW, Miguel AFP, Dutra KL, et al. Prevalence of oral potentially malignant disorders: a systematic review and Meta-analysis[J] J Oral Pathol Med. 2018;47(7):633–640. doi: 10.1111/jop.12726. [DOI] [PubMed] [Google Scholar]
- 15.李 晨曦, 施 芷怡, 喻 仲麟, et al. 口腔白斑病自体荧光成像结果与临床病理特征相关性分析[J] 临床口腔医学杂志. 2023;39(3):153–157. [Google Scholar]; Li CX, Shi ZY, Yu ZL, et al. Correlation analysis between autofluorescence imaging results and clinicopathological characteristics of oral leukoplakia[J] J Clin Stomatol. 2023;39(3):153–157. [Google Scholar]
- 16.王 倩, 徐 偲, 韩 莹, et al. 甲苯胺蓝染色在口腔潜在恶性疾患及口腔鳞状细胞癌早期诊断中的临床应用价值研究[J] 中国实用口腔科杂志. 2020;13(12):738–744. [Google Scholar]; Wang Q, Xu S, Han Y, et al. Clinical application value of toluidine blue staining in the early diagnosis of oral potential malignant disorders and oral squamous cell carcinoma[J] Chin J Pract Stomatol. 2020;13(12):738–744. [Google Scholar]
- 17.王 映, 李 志萍, 王 浩然, et al. VELscope自体荧光检查在糜烂型口腔扁平苔藓诊断及恶变筛查中的应用研究[J] 中国实用口腔科杂志. 2022;15(2):212–215. [Google Scholar]; Wang Y, Li ZP, Wang HR, et al. Application of VELscope autofluorescence examination in diagnosis and malignancy screening of erosive oral lichen planus[J] Chin J Pract Stomatol. 2022;15(2):212–215. [Google Scholar]
- 18.Lee YJ, Krishnan G, Nishio N, et al. Intraoperative fluorescence-guided surgery in head and neck squamous cell carcinoma[J] Laryngoscope. 2021;131(3):529–534. doi: 10.1002/lary.28822. [DOI] [PubMed] [Google Scholar]
- 19.王 育新, 王 志勇, 王 永功, et al. 吲哚菁绿荧光成像技术在口腔鳞癌治疗中的应用: 中国专家共识[J] 中国口腔颌面外科杂志. 2022;20(1):1–6. [Google Scholar]; Wang YX, Wang ZY, Wang YG, et al. Chinese expert consensus statement on the application of of indocyanine green (ICG) fluorescence imaging in the treatment of oral squamous cell carcinoma[J] Chin J Oral Maxillofac Surg. 2022;20(1):1–6. [Google Scholar]
- 20.张 誉, 季 彤. 吲哚菁绿在口腔癌可视化治疗中的应用[J] 口腔疾病防治. 2020;28(2):118–122. [Google Scholar]; Zhang Y, Ji T. Application of indocyanine green in visual treatment of oral cancer[J] J Prev Treat Stomatol Dis. 2020;28(2):118–122. [Google Scholar]
- 21.Pan J, Deng H, Hu S, et al. Real-time surveillance of surgical margins via ICG-based near-infrared fluorescence imaging in patients with OSCC[J] World J Surg Oncol. 2020;18(1):96. doi: 10.1186/s12957-020-01874-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Wu ZH, Dong YC, Wang YX, et al. Clinical application of indocyanine green fluorescence navigation technology to determine the safe margin of advanced oral squamous cell carcinoma[J] Gland Surg. 2022;11(2):352–357. doi: 10.21037/gs-22-33. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Vairaktaris E, Spyridonidou S, Papakosta V, et al. The hamster model of sequential oral oncogenesis[J] Oral Oncol. 2008;44(4):315–324. doi: 10.1016/j.oraloncology.2007.08.015. [DOI] [PubMed] [Google Scholar]
- 24.Wang ZD, Cormier RT. Golden Syrian hamster models for cancer research[J] Cells. 2022;11(15):2395. doi: 10.3390/cells11152395. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Xie DY, Wang YX, Wang ZY, et al. Kinetics analysis of indocyanine green based on a novel mouse model to distinguish between tumor and inflammation[J] Anal Methods. 2019;11(44):5704–5710. [Google Scholar]
- 26.Pal R, Lwin TM, Krishnamoorthy M, et al. Fluorescence lifetime of injected indocyanine green as a universal marker of solid tumours in patients[J] Nat Biomed Eng. 2023;7(12):1649–1666. doi: 10.1038/s41551-023-01105-2. [DOI] [PubMed] [Google Scholar]