Abstract
目的
基于cGAS-STING 信号通路,研究中药凉血解毒化瘀方(LXJDHYF)治疗小鼠慢加急性肝衰竭(ACLF)的可能作用机制。
方法
30只C57BL/6小鼠随机分为空白组、模型组、凉血解毒化瘀方高剂量组、凉血解毒化瘀方低剂量组及cGAS-STING 信号通路特异性抑制剂H151组,6只/组。除空白组外,其余各组采用CCl4诱导形成肝硬化,后予以脂多糖联合D-氨基半乳糖腹腔注射急性攻击形成ACLF小鼠模型。取小鼠肝组织进行HE以及TUNEL染色,生化法测定血清ALT、AST及TBil水平以检测凉血解毒化瘀方对小鼠肝功能的影响。同时采用RT-qPCR测定凉血解毒化瘀方对小鼠骨髓巨噬细胞(BMDMs)β干扰素(IFN-β)、干扰素刺激基因15(ISG15)、白细胞介素6(IL-6)及肿瘤坏死因子-α(TNF-α)mRNA表达水平的影响;Western blotting分析凉血解毒化瘀方对BMDMs干扰素调节因子3(IRF3)及干扰素基因刺激因子(STING)蛋白磷酸化水平的影响;结合RT-qPCR检测ACLF小鼠肝组织中上述mRNA表达水平,ELISA法检测ACLF小鼠血清 IL-6及TNF-α水平以观察凉血解毒化瘀方对cGAS-STING 信号通路的作用。
结果
HE染色显示,凉血解毒化瘀方组肝细胞坏死及炎症浸润程度与模型组相比较轻,TUNEL染色提示凉血解毒化瘀方组凋亡阳性细胞比例低于模型组(P<0.001)。凉血解毒化瘀方组血清ALT、AST及TBil水平均低于模型组(P<0.001)。RT-qPCR结果表明,凉血解毒化瘀方能抑制BMDMs及小鼠肝组织IFN-β、ISG15、IL-6及TNF-α的mRNA表达(P<0.05)。Western blotting结果显示,随着凉血解毒化瘀方给药剂量增加,BMDMs细胞中IRF3及STING蛋白磷酸化水平降低(P<0.05),凉血解毒化瘀方组血清IL-6及TNF-α水平均低于模型组(P<0.05)。
结论
凉血解毒化瘀方能够改善ACLF小鼠肝功能,降低小鼠血清促炎细胞因子水平,其机制可能与抑制cGAS-STING 通路过度激活有关。
Keywords: 慢加急性肝衰竭, cGAS-STING 信号通路, β干扰素, 干扰素刺激基因15, 凉血解毒化瘀方
Abstract
Objective
To explore the role of the cGAS-STING signaling pathway in the therapeutic mechanism of Liangxue Jiedu Huayu Formula (LXJDHYF) for acute-on-chronic liver failure (ACLF) in mice.
Methods
Thirty C57BL/6 mice were randomly divided into blank control group, model group, low- and high-dose LXJDHYF groups, and H151 (a specific cGAS-STING pathway inhibitor) group (n=6). In all but the control group, the mice were treated with CCl4 to induce liver cirrhosis followed by intraperitoneal injections of lipopolysaccharide and D-amino galactose to establish mouse models of ACLF. After the treatments, the mouse livers were collected for HE and TUNEL staining, and serum levels of ALT, AST and TBil were determined. In bone marrow-derived macrophages (BMDMs) and liver tissues of ACLF mice, the expressions of cGAS-STING signaling pathway-related mRNAs including IFN‑β, ISG15, IL-6 and TNF-α were determined with RT-qPCR, and the phosphorylation levels of IRF3 and STING proteins were investigated using Western blotting.
Results
Compared with the mice in the model group, the LXJDHYF-treated mice exhibited milder hepatocyte necrosis and inflammatory cell infiltration in the liver with significantly reduced hepatocyte apoptosis. LXJDHYF treatment also significantly lowered serum levels of ALT, AST, TBil, IL-6 and TNF-α in ACLF mice and effectively suppressed the expressions of cGAS-STING signaling pathway-related mRNA in both the BMDMs and the liver tissues and the phosphorylation of IRF3 and STING proteins in the BMDMs.
Conclusion
LXJDHYF can significantly improve liver function and attenuate inflammation in ACLF mice possibly by inhibiting excessive activation of the cGAS-STING signaling pathway.
Keywords: acute-on-chronic liver failure, cGAS-STING signaling pathway, interferon‑β, interferon stimulating gene 15, Liangxue Jiedu Huayu Formula
慢加急性肝衰竭(ACLF)是指在慢性肝病基础上,由各种诱因引起以急性黄疸加深、凝血功能障碍为临床表现的一组症候群[1]。ACLF患者病情危重,短期病死率高,常伴肝外多器官系统功能障碍甚至衰竭[2]。中西医结合治疗ACLF具有一定的优势,课题组前期研究对ACLF证候规律进行梳理,提炼出湿热瘀黄、气虚瘀黄证两种核心证候,并拟定了凉血解毒化瘀方(LXJDHYF)用于治疗湿热瘀黄证[3],前期开展的多项前瞻性多中心随机对照临床试验证明凉血解毒化瘀方在降低ACLF病死率及减少并发症方面具有确切疗效[3-5]。但具体机制尚不清楚。环GMP-AMP合成酶(cGAS)是近年发现的一种存在于细胞质内的核酸感受器,与下游干扰素基因刺激因子(STING)组成的核酸识别系统对于维持宿主正常的免疫功能、防止免疫损伤具有重要作用[6]。ACLF发病机制与免疫损伤密切相关[7],相关研究表明,抑制cGAS/STING信号通路能够改善肝损伤[8,9],凉血解毒化瘀方的君药芍药的主要有效成分芍药苷能够靶向作用于STING介导的自噬与细胞凋亡[10],目前研究大多基于单味中药或成分,尚缺乏复方制剂对ACLF cGAS-STING信号通路影响的研究,因此本研究拟基于cGAS-STING 信号通路,研究凉血解毒化瘀方治疗ACLF小鼠的作用机制。
1. 材料和方法
1.1. 实验材料
1.1.1. 实验动物及细胞
6~8周雄性C57BL/6J小鼠,购自斯贝福(北京)生物技术有限公司。饲养于SPF环境中,小鼠可以自由采食及饮水,实验动物房有固定的12 h∶12 h白天与黑夜循环交替。本实验中使用的小鼠骨髓来源巨噬细胞(BMDMs)分离自8~10周雄性C57BL/6J小鼠股骨骨髓,于DMEM培养基(含有10%胎牛血清及1%青霉素-链霉素双抗)中加入50 ng/mL小鼠巨噬细胞集落刺激因子(M-CSF),置于37 ℃、5% CO2、湿度95%的培养箱内进行培养。
1.1.2. 主要实验仪器与试剂
二氧化碳培养箱(Thermo Fisher);酶标仪(BioTEK);电泳仪(Bio-rad);转印槽(Bio-Rad);细胞超净工作台(三莉科技有限公司);ArchimedX6时间分辨定量PCR系统(鲲鹏基因);显微镜(olympus);多功能漩涡混合器(scientific industries)。
pIRF3兔单克隆抗体(Genetex);TMEM173/STING单克隆抗体(Proteintech);HSP90单克隆抗体(Proteintech);DMEM培养基(Macgene);Opti-mem培养基(Gibco);脂多糖、D-氨基半乳糖(Sigma);H-151(陶术生化);RT supermix for qpcr(+gDNAwiper)、Taq pro universal SYBR qPCR master mix(诺唯赞);AST/GOT检测试剂盒、ALT/GPT检测试剂盒(南京建成生物)。
1.1.3. 实验药物及剂量
凉血解毒化瘀方由赤芍60 g、茵陈30 g、栀子9 g、白花蛇舌草30 g、丹参30 g、炒白术30 g、茜草30 g、豨莶草30 g、白及15 g组成,单味颗粒剂均购自北京康仁堂药业有限公司,按照小鼠与人的等效剂量比值为9∶1进行折算,换算出小鼠给药量为13.1 g/kg(低剂量组)及26.2 g/kg(高剂量组)。将颗粒剂溶于蒸馏水中,配成1.63 g/mL药液备用。将cGAS-STING通路特异性抑制剂H-151[每只小鼠给药量为7.5 mg/(kg·d)]溶解于含10%的Tween-80的 PBS溶液中,腹腔注射给药,1次/d[11]。凉血解毒化瘀方及H-151均于急性攻击前1周开始给药。本研究经中国人民解放军总医院第五医学中心实验动物伦理委员会批准(伦理批号:IACUC-2024-0003)。
1.2. 实验方法
1.2.1. 检测凉血解毒化瘀方对小鼠肝功能的影响
1.2.1.1. ACLF小鼠模型构建
使用资源方程法进行动物实验的样本量计算[12]。为避免造模过程中小鼠死亡引起的误差,将样本量定为6只/组。将30只6~8周雄性C57BL/6J小鼠按随机数字表法等分为对照组、模型组、凉血解毒化瘀方低剂量组、凉血解毒化瘀方高剂量组及H-151组,适应性饲养1周后,除对照组以外,其余各组均按2 mL/kg剂量灌胃给药10%CCl4溶液(CCl4∶橄榄油=1∶9)以诱导形成肝硬化,2次/周,共持续8周,对照组给予等体积橄榄油灌胃,第8周末除对照组外其余各组予以脂多糖(50 μg/kg)联合D-氨基半乳糖(400 mg/kg)腹腔注射以建立ACLF模型[13]。
1.2.1.2. 标本收集
脂多糖(50 μg/kg)联合D-氨基半乳糖(400 mg/kg)腹腔注射12 h后处死小鼠,采集血液以及肝脏组织样本,血液样本4 ℃静置30 min后,3500 r/min离心15 min,吸取血清并分装于1.5 mL EP管中,于-80 ℃条件下储存,肝组织取出后部分于4%多聚甲醛中浸泡,部分于液氮中快速冷冻后置于-80 ℃冰箱中保存用于后续实验。
1.2.1.3. 小鼠肝脏HE及TUNEL染色
新鲜小鼠肝脏组织取出后于4%多聚甲醛中浸泡,固定24 h后取出组织进行石蜡包埋切片,经过石蜡切片脱蜡至水、高清恒染预处理液预处理、苏木素染色、伊红染色、脱水封片等步骤对肝组织切片进行HE染色;经过脱蜡至水、蛋白酶K修复、破膜、室温平衡、加入TDT酶、dUTP,buffer孵育、DAPI复染细胞核及封片等步骤对小鼠肝组织进行TUNEL染色。
1.2.1.4. 生化检测试剂盒检测小鼠肝功能指标
使用南京建成谷丙转氨酶(ALT/GPT)测试盒与谷草转氨酶(AST/GOT)测试盒、中生北控生物TBil测试盒检测小鼠血清AST、ALT及TBil水平。测定AST及ALT时首先加入提前预热至37 ℃的基质液20 μL至测定孔及对照孔,再按照说明书先后加入待测样本及2,4-二硝基苯肼液,37 ℃分别反应30 min及20 min后加入0.4 mol/L氢氧化钠溶液终止反应。最后酶标仪测定A 510 nm值。测定TBil时首先在测定孔及空白孔分别加入65 μL待测样本及蒸馏水,按照说明书先后加入试剂1及试剂2,均37 ℃避光孵育5 min后分别测定加入试剂1及试剂2后测定孔及空白孔A 450 nm值。
1.2.2. 检测凉血解毒化瘀方对cGAS-STING信号通路的影响
1.2.2.1 细胞实验
1.2.2.1.1 BMDMs细胞培养与接种
8~10周雄性C57BL/6J小鼠脱颈处死后使用75%乙醇充分浸泡消毒后转移至超净工作台中无菌条件下分离小鼠腿骨,分离股骨与胫骨,后吸取提前37℃预热的DMEM完全培养基反复充分冲洗骨髓腔,直至腿骨内无明显红色,最后加入反复吹打混匀,使细胞团均匀分散,将细胞转移至细胞培养皿中,置于37 ℃、5% CO2、湿度95%的培养箱内进行培养。第5日即可得到成熟的BMDMs细胞。所得BMDMs细胞经0.25%胰酶消化后收集含细胞DMEM培养基,离心得到细胞团沉淀,弃上清,加入DMEM培养基定容后显微镜下计数,按照密度为1.2×106/mL接种后置于培养箱内中过夜,待细胞完全贴壁后用于后续实验。
1.2.2.1.2. BMDMs细胞给药预处理
用于Western blotting实验的BMDMs细胞接种于24孔板中,使用opti-MEM 培养基溶解并稀释凉血解毒化瘀方颗粒剂至相应浓度(0.5、1、2 mg/mL)用于给药,另外设置不加入药物及刺激的空白孔及只加入刺激的刺激孔,弃上清后给予相同体积opti-MEM培养基。给药后1 h,分别加入cGAS-STING信号通路激动剂干扰素刺激DNA(ISD)、2,3-cGAMP、DMXAA和diABzi,刺激2 h后,收集细胞裂解液用于后续实验。用于RT-qPCR实验的BMDMs细胞以相同浓度接种于12孔板,给药预处理1 h后给予刺激4 h。
1.2.2.1.3. ATP 发光法检测细胞活性
凉血解毒化瘀方给药浓度依次为0、0.25、0.5、1、1.25、1.5、1.75、2、4 mg/mL,加入上述不同浓度含凉血解毒化瘀方完全培养基,细胞培养箱中培养12 h后每孔取50 μL含药DMEM培养基加入新的白色96孔板中,在避光条件下再在上述白色96孔板中每孔加入50 μL ATP溶液(使含药DMEM培养基与ATP溶液比例为1∶1),并使其充分混合,静置15 min后使用系统选择程序测量荧光强度,检测细胞活性。
1.2.2.1.4. RT-qPCR
加入TRIzol试剂裂解BMDMs细胞使用常规方法进行RNA提取,采用NanoDrop 2000 分光光度计测定其260~280 mm吸光度以得到样品RNA浓度与纯度后进行定量后逆转录以获取cDNA,使用PCR仪进行RT-qPCR反应检测,目的基因相对表达量使用2-△△Ct法进行计算,使用β-ACTIN作为内参。引物由北京天一辉远生物科技有限公司合成(表1)。
表1.
引物序列
Tab.1 Primer sequences for RT-qPCR
| Gene | Sequence | |
|---|---|---|
| β-ACTIN | P1 | GGCTGTATTCCCCTCCATCG |
| P2 | CCAGTTGGTAACAATGCCATGT | |
| IFN-β | P1 | TCCGAGCAGA GATCTTCAGGAA |
| P2 | TGCAACCACCACTCATTCTGAG | |
| TNF-α | P1 | GGGCAGTTAGGCATGGGAT |
| P2 | TGAGCCTTT TAGGCTTCCCAG | |
| IL-6 | P1 | CACTTCA CAAGTCGGAGGCT |
| P2 | CTGCAAGTGCATCATCGTTGT | |
| ISG15 | P1 | GGTGTCCGTGACTAACTCCAT |
| P2 | CTGTACCACTAG CATCACTGTG | |
1.2.2.1.5. Western blotting
采用Western blotting检测细胞裂解液中IRF3及STING蛋白的磷酸化水平,使用HSP90作为内参蛋白。根据本实验所需检测目的蛋白分子量,采用10%十二烷基硫酸钠-聚丙烯酰胺凝胶进行蛋白电泳,电泳结束后将凝胶上的蛋白转印至PVDF膜上,转印参数设置为100 V,转印90 min。转印完成后将PVDF膜置于10%封闭液中,在摇床上室温封闭30 min。pIRF3及TMEM173/STING单克隆抗体均按照说明书1∶1000比例进行稀释,pIRF3单克隆抗体于4 ℃冰箱中隔夜孵育,TMEM173/STING单克隆抗体置于4 ℃冰箱中孵育2 h。HSP90孵育条件为4 ℃冰箱中孵育30 min。二抗(1∶10 000)室温摇床孵育1 h。抗体孵育结束后将PVDF膜置于塑封膜中,滴加配制好的ECL发光液于PVDF膜上涂匀,压片避光反应,曝光,定影,对相应蛋白表达进行分析。
1.2.2.2 动物实验
1.2.2.2.1 RT-qPCR实验
取100 mg新鲜小鼠肝脏组织,研磨前尽量剪碎,加入1 mL TRIzol 试剂,使用高通量组织研磨仪快速充分匀浆(6 m/s,研磨20 s,静置15 s,研磨2个循环)。RNA提取、体外反转录、qPCR反应检测及数据分析步骤见1.2.2.1.4部分。
1.2.2.2.2. ELISA法检测血清TNF-α、IL-6细胞因子
严格按照ELISA试剂盒中说明检测各组小鼠血清TNF-α、IL-6水平,其中TNF-α试剂盒用于检测小鼠血清样本时血清样本无需稀释处理,使用IL-6试剂盒检测小鼠血清样本时按10倍稀释后进行。
1.2.3. 统计学方法
使用SPSS25.0 软件进行数据分析,符合正态分布的数据用均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验法。当P<0.05时,差异具有统计学意义。
2. 结果
2.1. 凉血解毒化瘀方 对小鼠肝功能的影响
2.1.1. 小鼠肝脏组织HE染色及TUNEL染色结果
HE病理染色结果显示正常对照组可见清晰的肝小叶结构,肝细胞排列结构规整。模型组小鼠肝细胞形态改变,核质染色异常,出现大块、亚大块坏死,肝小叶结构被破坏,大量炎性细胞浸润。凉血解毒化瘀方组及H-151组与模型组相比病理损伤较轻,细胞肿胀程度较轻,肝细胞坏死面积与模型组相比均较小(图1A)。TUNEL染色中绿色荧光部分代表凋亡阳性细胞,凉血解毒化瘀方组凋亡阳性细胞比例低于模型组(P<0.001,图1B)。
图1.
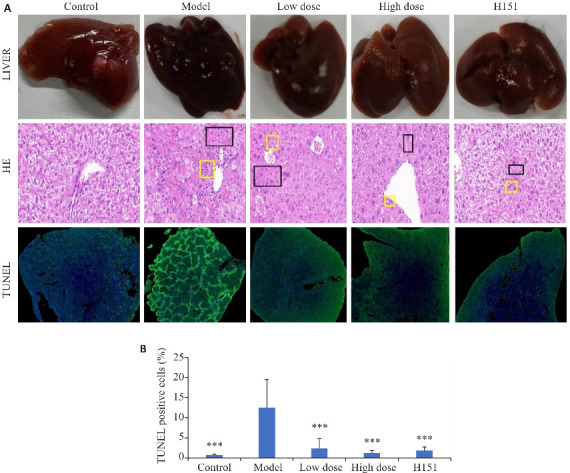
各组肝脏病理图像和肝组织 HE染色、TUNEL染色的代表图和TUNEL凋亡阳性细胞数比例
Fig.1 HE staining (Original magnification: ×200) and TUNEL staining (×20) for examining pathologies and hepatocyte apoptosis in mouse livers (A) and comparison of TUNEL-positive cell percentages among the groups (B). ***P<0.001 vs model group.
2.1.2. 凉血解毒化瘀方对ACLF小鼠肝功能的影响
凉血解毒化瘀方高、低剂量组及H-151组小鼠ALT、AST及TBil水平低于模型组,模型组ALT、AST及TBil水平升高(P<0.001,图2)。
图2.
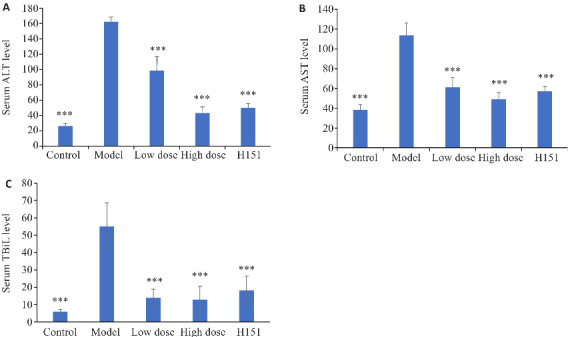
各组小鼠肝功能指标
Fig.2 Serum levels of ALT (A), AST (B) and TBil (C) of the mice in each group. ***P<0.001 vs model group.
2.2. 凉血解毒化瘀方对cGAS-STING信号通路的影响
2.2.1. 细胞实验
2.2.1.1. 凉血解毒化瘀方对小鼠BMDMs细胞活性的影响
当凉血解毒化瘀方浓度低于2 mg/mL时无明显细胞毒性,但当给药浓度达到4 mg/mL时,则表现出细胞毒性,因此在后续相关细胞实验中将给药最高浓度设置为2 mg/mL(图3)。
图3.
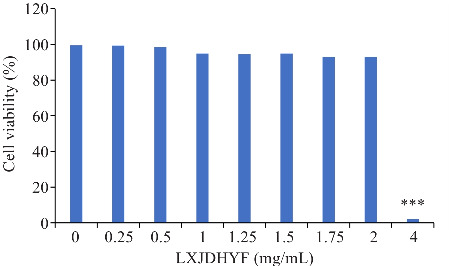
ATP法测定不同浓度凉血解毒化瘀方作用于BMDMs细胞中的毒性
Fig.3 ATP assay for evaluating cytotoxicity of different concentrations of LXJDHYF in BMDMs. ***P<0.001 vs 0 mg/mL.
2.2.1.2. 凉血解毒化瘀方对小鼠BMDMs细胞cGAS-STING信号通路相关mRNA表达的影响
不同浓度凉血解毒化瘀方对小鼠BMDMs细胞cGAS-STING信号通路相关mRNA表达的影响,结果显示给药孔IFN-β、ISG15、TNF-α及IL-6 mRNA表达水平降低(P<0.05,图4A~D)。采用不同种类的STING激动剂活化cGAS-STING信号通路,结果显示浓度为1 mg/mL的凉血解毒化瘀方可下调IFN-β、ISG15、TNF-α及IL-6 mRNA的表达水平(P<0.05,图4E~H)。
图4.
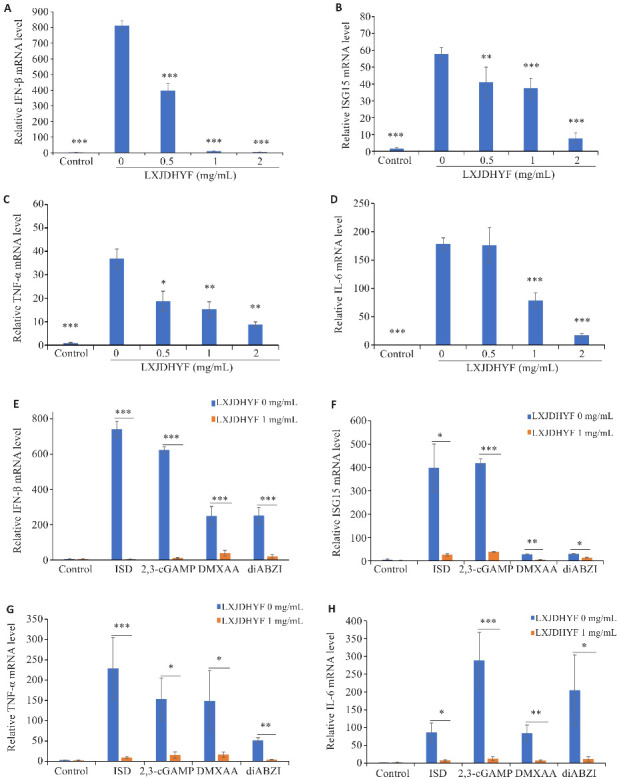
不同浓度凉血解毒化瘀方在BMDMs中对ISD激活的 cGAS-STING 信号通路相关mRNA的表达(A-D)及其对不同激活剂激活STING通路对相关mRNA表达水平的影响(E-H)
Fig.4 Effects of different concentrations of LXJDHYF on expressions of IFN-β (A), ISG 15 (B), TNF-α (C) and IL-6 mRNAs (D) in BMDMs with ISD-induced cGAS-STING signaling pathway activation. E-H: Expressions of IFN-β (E), ISG 15 (F), TNF-α (G) and IL-6 mRNAs (H) in BMDMs pre-treated with LXJDHYF (1 mg/mL) prior to stimulation with different STING agonists. *P<0.05, **P<0.01, ***P<0.001 vs 0 mg/mL.
2.2.1.3. 凉血解毒化瘀方对小鼠BMDMs细胞cGAS-STING信号通路相关蛋白磷酸化水平的影响
Western blotting结果表明,随着凉血解毒化瘀方给药剂量增加,BMDMs细胞中IRF3及STING蛋白磷酸化水平降低(P<0.05,图5A~C)。浓度为1 mg/mL的凉血解毒化瘀方在不同激动剂活化STING通路时均能抑制IRF3蛋白以及STING蛋白的磷酸化(P<0.05,图5D~F)。
图5.
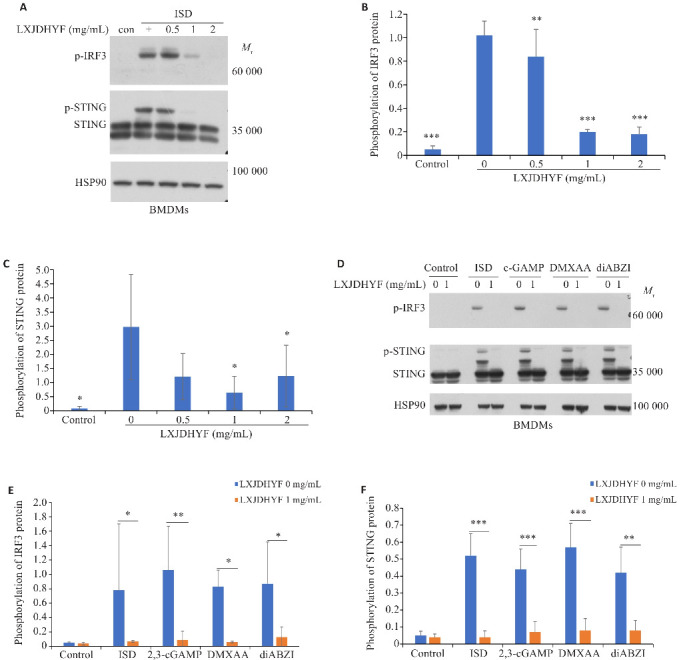
不同浓度凉血解毒化瘀方在BMDMs中对ISD激活的 cGAS-STING 信号通路相关蛋白磷酸化水平的影响(A-C); 不同种类STING激活剂激活STING通路时凉血解毒化瘀方对相关蛋白磷酸化水平的影响(D-F)
Fig.5 Western blotting for detecting phosphorylation levels of STING and IRF3 proteins in BMDMs with ISD-induced cGAS-STING signaling pathway activation and treated with different concentrations of LXJDHYF (A-C). D-F: Phosphorylation levels of STING and IRF3 proteins in BMDMs pre-treated with LXJDHYF (1 mg/mL) and then stimulated with different STING agonists. *P<0.05, **P<0.01, ***P<0.001 vs 0 mg/mL.
2.2.2. 动物实验
2.2.2.1. 凉血解毒化瘀方对ACLF小鼠cGAS-STING信号通路相关mRNA表达的影响
与模型组相比,凉血解毒化瘀方低剂量组、高剂量组及H151组小鼠肝组织中IFN-β、ISG15、TNF-α及IL-6 mRNA表达下调(P<0.001,图6)。
图6.
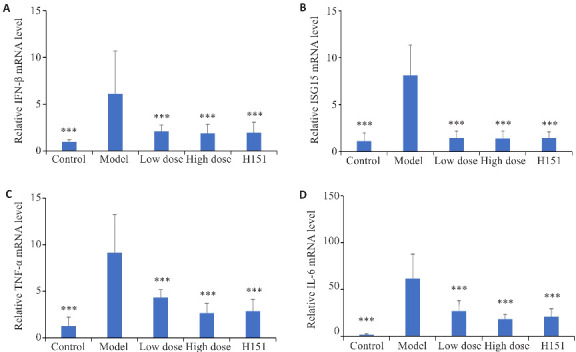
各组小鼠cGAS-STING信号通路相关mRNA相对表达水平
Fig.6 Expressions of IFN-β (A), ISG15 (B), TNF-α (C) and IL-6 mRNAs (D) in the liver tissues of the mice in each group. ***P <0.001 vs model group.
2.2.2.1. 凉血解毒化瘀方对ACLF小鼠血清IL-6、TNF-α水平的影响
凉血解毒化瘀方组小鼠IL-6及TNF-α水平均低于模型组(P<0.05,图7)。
图7.
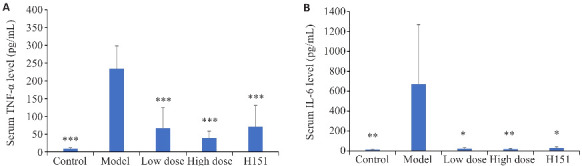
各组小鼠血清炎症细胞因子水平
Fig.7 Serum levels of IL-6 (A) and TNF-α (B) of the mice in each group. *P<0.05, **P<0.01, ***P<0.001 vs model group.
3. 讨论
中医认为ACLF核心病因病机为“热、毒、瘀、湿、虚”。凉血解毒化瘀方具有凉血活血、解毒化瘀之功效,单味中药对于肝功能的保护作用在既往研究中均有报道。方中茵陈和赤芍共为君药。赤芍具有清热凉血,祛瘀止痛的功效。茵陈具有清利湿热之功效,被誉为黄疸要药。茵陈水提物能够通过降低肝损伤小鼠血清ALT及AST水平,同时具有抗氧化及抗炎功能,能够降低炎症因子如IL-1β、IL-6及TNF-α的表达[14]。本方取茜草、豨莶草、丹参、白花蛇舌草为臣药。茜草素能够缓解四氯化碳诱导的肝损伤[15]。豨莶草具有抗炎作用,相关研究提示其能够抑制NF-κB信号通路相关炎症因子如IL-1β,IL-8,TNF-α的表达[16]。丹参用于本方主要取其凉血活血祛瘀之效,现代药理学研究发现其主要脂溶性活性成分丹参酮ⅡA能够缓解刀豆蛋白A诱导形成的小鼠肝损伤,减少炎症因子IL-2、IL-4、IFN-γ及TNF-α的产生[17]。栀子用于本方取其清热利湿、凉血解毒之效。相关研究发现栀子苷对大鼠体内负责胆汁酸稳态的酶和转运体具有调控作用,能够改善大鼠胆汁淤积及肝损伤情况[18]。白花蛇舌草在抗炎、抗氧化及免疫调节方面均具有良好的效果[19]。炒白术具有补气健脾的功效,在本方中为佐药,现代药理学发现其能够清除氧化自由基,保护小鼠肝功能[20]。白及在本方中作为第二佐剂,其活性成分会促进血小板的变形、聚集和分泌,可能是其发挥止血功能的主要机制[21]。本研究中凉血解毒化瘀方组小鼠肝功能及HE染色结果同样证明其对ACLF小鼠肝损伤的保护作用,与既往研究相互印证。
cGAS与STING组成的胞质核酸监控系统在肝损伤的机制中扮演了重要角色 [22, 23]。STING监测到细胞损伤释放的DNA后IRF3磷酸化,并易位到细胞核中从而启动下游I型干扰素及多种ISGs的转录表达[24],使干扰素被释放,进入胞质,启动适应性免疫,还可激活NF-κB信号通路,导致促炎细胞因子如TNF-α和IL-6的过度分泌[25]。IFN-β属于I型干扰素家族,相关研究指出,在病毒感染引发急性肝衰竭时,I型干扰素不仅具有直接抗病毒作用,还能与相应受体结合,调节骨髓细胞的免疫反应以及外周浸润单核细胞向Kupffer细胞的分化[26]。ISG15蛋白经I型干扰素诱导后表达,其与细胞底物结合形成的蛋白复合物显示出抗病毒和抗菌活性[27, 28],对于维持宿主固有免疫具有重要作用,以上因子均与cGAS-STING信号通路密切相关,本研究中Western blotting结果提示凉血解毒化瘀方能够降低IRF3及STING蛋白的磷酸化水平,RT-qPCR结果提示凉血解毒化瘀方在体内、外均能下调cGAS-STING信号通路相关IL-6、TNF-α、IFN-β以及ISG15 mRNA的表达,且能降低ACLF小鼠血清IL-6和TNF-α水平,表明凉血解毒化瘀方在体内外均能抑制cGAS-STING信号通路的激活。
综上所述,凉血解毒化瘀方可改善ACLF小鼠肝功能,减轻炎症反应,其作用机制可能与抑制cGAS-STING信号通路过度活化有关。本研究尚存在一些不足,虽然小鼠BMDMs细胞及动物实验证实了凉血解毒化瘀方对cGAS-STING通路的抑制作用,但尚缺乏临床样本的机制验证。
基金资助
十三五国家科技重大专项课题(2018ZX10725-506-002);国家自然科学基金青年项目(82305067)
Supported by Natural Science Foundation for the Youth (NSFY) of China (82305067).
参考文献
- 1. 中国中西医结合学会, 中华中医药学会, 中华医学会 . 慢加急性肝衰竭中西医结合诊疗指南[J]. 临床肝胆病杂志, 2023, 39(7): 1547-52. [Google Scholar]
- 2. European Association for the Study of the Liver Electronic address: eueasloffice@easloffice, European Association for the Study of the Liver . EASL Clinical Practice Guidelines on acute-on-chronic liver failure[J]. J Hepatol, 2023, 79(2): 461-91. [DOI] [PubMed] [Google Scholar]
- 3. 周 超, 宫 嫚, 张 宁, 等. 中西医结合治疗方案干预乙型肝炎病毒相关慢加急性肝衰竭的疗效分析 [J]. 中西医结合肝病杂志, 2019, 29(3): 203-7. [Google Scholar]
- 4. 殷光辉, 闻 涛. 凉血解毒化瘀汤治疗乙肝相关性慢加急性肝衰竭临床研究[J]. 新中医, 2020, 52(17): 81-3. [Google Scholar]
- 5. 刘慧敏, 王宪波, 侯艺鑫, 等. 解毒凉血方联合西药治疗乙型肝炎慢加急性肝衰竭患者64例临床观察[J]. 中医杂志, 2013, 54(21): 1829-33. 23412089 [Google Scholar]
- 6. Chen C, Xu PL. Cellular functions of cGAS-STING signaling[J]. Trends Cell Biol, 2023, 33(8): 630-48. [DOI] [PubMed] [Google Scholar]
- 7. 项晓刚, 尚大宝, 张金铭. 慢加急性肝衰竭的疾病定义及发病机制[J]. 临床肝胆病杂志, 2023, 39(10): 2281-7. DOI: 10.3969/j.issn.1001-5256.2023.10.003 [DOI] [Google Scholar]
- 8. Li J, Lu YY, Lin G. Blocking cGAS/STING signaling protects against sepsis-associated acute liver injury[J]. Int Immuno-pharmacol, 2022, 113(Pt A): 109276. [DOI] [PubMed] [Google Scholar]
- 9. Yu T, Cheng HR, Li XL, et al. Design and synthesis of hederagenin derivatives modulating STING/NF‑κB signaling for the relief of acute liver injury in septic mice[J]. Eur J Med Chem, 2023, 245(Pt 1): 114911. [DOI] [PubMed] [Google Scholar]
- 10. 龚莹洁. 芍药苷通过靶向STING介导的自噬和细胞凋亡保护糖尿病肝损伤[D]. 合肥: 安徽医科大学, 2023. [Google Scholar]
- 11. Gong W, Lu LL, Zhou Y, et al. The novel STING antagonist H151 ameliorates cisplatin-induced acute kidney injury and mitochondrial dysfunction[J]. Am J Physiol Renal Physiol, 2021, 320(4): F608-16. [DOI] [PubMed] [Google Scholar]
- 12. Arifin WN, Zahiruddin WM. Sample size calculation in animal studies using resource equation approach[J]. Malays J Med Sci, 2017, 24(5): 101-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Engelmann C, Habtesion A, Hassan M, et al. Combination of G-CSF and a TLR4 inhibitor reduce inflammation and promote regeneration in a mouse model of ACLF[J]. J Hepatol, 2022, 77(5): 1325-38. [DOI] [PubMed] [Google Scholar]
- 14. Park CY, Choi E, Yang HJ, et al. Efficacy of Artemisia annua L. extract for recovery of acute liver failure[J]. Food Sci Nutr, 2020, 8(7): 3738-49. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Rao GM, Rao CV, Pushpangadan P, et al. Hepatoprotective effects of rubiadin, a major constituent of Rubia cordifolia Linn[J]. J Ethnopharmacol, 2006, 103(3): 484-90. [DOI] [PubMed] [Google Scholar]
- 16. Wang ZX, Fan XW, Xu YE, et al. Efficacy of Xixiancao (Herba Siegesbeckiae Orientalis) on interactions between nuclear factor kappa-B and inflammatory cytokines in inflammatory reactions of rat synovial cells induced by sodium urate[J]. Chung I Tsa Chih Ying Wen Pan, 2020, 40(5): 774-81. [DOI] [PubMed] [Google Scholar]
- 17. Qin XY, Li T, Yan L, et al. Tanshinone IIA protects against immune-mediated liver injury through activation of T-cell subsets and regulation of cytokines[J]. Immunopharmacol Immunotoxicol, 2010, 32(1): 51-5. [DOI] [PubMed] [Google Scholar]
- 18. Wang LL, Wu GX, Wu FH, et al. Geniposide attenuates ANIT-induced cholestasis through regulation of transporters and enzymes involved in bile acids homeostasis in rats[J]. J Ethnopharmacol, 2017, 196: 178-85. [DOI] [PubMed] [Google Scholar]
- 19. 黄 岚, 陈碧莲, 罗 镭. 白花蛇舌草的化学成分、药理作用及临床应用研究进展[J]. 中国药事, 2023, 37(12): 1451-60. [Google Scholar]
- 20. Han B, Gao Y, Wang YL, et al. Protective effect of a polysaccharide from Rhizoma Atractylodis Macrocephalae on acute liver injury in mice[J]. Int J Biol Macromol, 2016, 87: 85-91. [DOI] [PubMed] [Google Scholar]
- 21. Dong L, Liu XX, Wu SX, et al. Rhizoma Bletillae polysaccharide elicits hemostatic effects in platelet-rich plasma by activating adenosine diphosphate receptor signaling pathway[J]. Biomedecine Pharmacother, 2020, 130: 110537. [DOI] [PubMed] [Google Scholar]
- 22. Lei Z, Deng MH, Yi ZJ, et al. cGAS-mediated autophagy protects the liver from ischemia-reperfusion injury independently of STING[J]. Am J Physiol Gastrointest Liver Physiol, 2018, 314(6): G655-G667. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23. Dong KH, Sun YX, Gao XT, et al. Mixed micelles loaded with hesperidin protect against acetaminophen induced acute liver injury by inhibiting the mtDNA-cGAS-STING pathway[J]. Colloids Surf B Biointerfaces, 2024, 233: 113656. [DOI] [PubMed] [Google Scholar]
- 24. Reisländer T, Groelly FJ, Tarsounas M. DNA damage and cancer immunotherapy: a STING in the tale[J]. Mol Cell, 2020, 80(1): 21-8. [DOI] [PubMed] [Google Scholar]
- 25. Gan Y, Li XY, Han SZ, et al. The cGAS/STING Pathway: a novel target for cancer therapy[J]. Front Immunol, 2021, 12: 795401. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Borst K, Frenz T, Spanier J, et al. Type I interferon receptor signaling delays Kupffer cell replenishment during acute fulminant viral hepatitis[J]. J Hepatol, 2018, 68(4): 682-90. [DOI] [PubMed] [Google Scholar]
- 27. Mustachio LM, Lu Y, Kawakami M, et al. Evidence for the ISG15-specific deubiquitinase USP18 as an antineoplastic target[J]. Cancer Res, 2018, 78(3): 587-92. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28. Lee MK, Kim YJ, Kim YE, et al. Transmembrane protein pUL50 of human cytomegalovirus inhibits ISGylation by downregulating UBE1L[J]. J Virol, 2018, 92(15): e00462-18. [DOI] [PMC free article] [PubMed] [Google Scholar]


