Abstract
目的
探讨电针百会、神庭对脑缺血再灌注损伤大鼠的神经保护作用机制。
方法
将雄性SD大鼠48只随机分为假手术组、模型组、电针组和非穴组,12只/组。采用Longa法制备局灶性缺血损伤大鼠模型。电针干预大鼠百会、神庭穴7 d。观察大鼠神经功能缺损评分、脑梗死体积变化、学习记忆功能、海马CA1区病理变化、神经元及突触超微结构,并计数突触密度、血清血清γ-氨基丁酸(GABA)、海马组织中GABAARα1、钙调蛋白依赖性蛋白激酶II(CaMKⅡ)、突触素1(SYN1)和突触后致密蛋白-95(PSD-95)蛋白及mRNA表达情况、SYN1和PSD-95表达水平。
结果
与模型组比较,电针组大鼠神经功能缺损评分降低(1.75±0.45 vs 1.50±0.67,P<0.05);脑梗死体积降低(11.25±6.22 vs 3.51±2.21,P<0.05);逃避潜伏期降低下降(62.65±5.12 vs 51.83±6.19,P<0.05)及穿越平台次数增加(1.17±0.75 vs 3.17±0.75,P<0.05);缺血侧海马CA1区神经细胞数量增加;突触间隙宽度相对变小,突触小体相对增加(2.00±0.11 vs 4.00±0.25, P<0.05);血清中GABA含量上升(3.90±0.75 vs 5.54±0.35,P<0.05);海马组织中GABAARα1、SYN1和PSD-95 mRNA表达水平升高(P<0.05);CaMKⅡ mRNA表达水平下降(P<0.05)。
结论
电针百会、神庭可改善脑缺血再灌注损伤大鼠学习记忆功能,其机制可能通过促进突触再生,上调GABAARα1、SYN1和PSD-95表达,下调CaMKⅡ表达有关。
Keywords: 脑中动脉缺血再灌注损伤, 电针, 学习记忆功能, 突触再生, 突触可塑性
Abstract
Objective
To explore the neuroprotective mechanism of electroacupuncture at the acupoints Baihui and Shenting in rats with cerebral ischemia-reperfusion (IR) injury.
Methods
Forty-eight male SD rats were equally randomized into sham operation group, cerebral IR model group, acupoint electroacupuncture group and non-acupoint acupuncture group. In the latter 3 groups, cerebral focal ischemic injury was induced using the Longa method; in the two electroacupuncture groups, electroacupuncture was performed either at the acupoints Baihui and Shenting or at non-acupoint sites for 7 days. The changes in neurological deficit scores, cerebral infarction volume, learning and memory function, pathologies in hippocampal CA1 area, neuronal and synaptic ultrastructures, and synaptic density of the rats were observed, and serum GABA level and mRNA and protein expressions of GABAAR α1, CaMK II, SYN1 and PSD-95 in the hippocampal tissue were detected.
Results
Compared with those in cerebral IR model group, the rats receiving electroacupuncture at the acupoints, but not those with electroacupuncture at the non-acupoints, showed significantly decreased neurological deficit scores and cerebral infarction volume with shortened escape latency and increased platform crossings. Electroacupuncture at the acupoints significantly increased neuronal cell number, decreased the width of the synaptic gaps and increased density of synaptic bodies in the ischemic hippocampal CA1 area, resulting also in increased serum GABA levels and hippocampal expressions of GABAARα1, SYN1 and PSD-95 and lowered expression level of CaMK II.
Conclusion
Electroacupuncture at Baihui and Shenting improves learning and memory function of rats with cerebral IR injury possibly through a mechanism that promotes synaptic regeneration, upregulates hippocampal expressions of GABAAR α 1, SYN1 and PSD-95 and downregulates the expression of CaMK II.
Keywords: cerebral ischemia-reperfusion injury, electroacupuncture, learning and memory function, synaptic regeneration, synaptic plasticity
缺血性脑卒中为常见的急性脑血管病,随着社会人口老龄化增长及危险因素的流行,其发病率和致残率持续上升[1]。多数卒中患者表现为神经功能缺损,出现不同程度的卒中后认知功能障碍(PSCI),如学习记忆障碍等[2, 3]。目前有效的卒中恢复疗法多限于神经康复,而大多数卒中后康复发生在有限和有效的时间窗口。PSCI的发生与卒中病变关键区域和大脑可塑性密切相关[4],且海马是学习记忆的关键脑区[5],也是脑损伤时的选择性易损区[6, 7]。γ-氨基丁酸(GABA)、钙调蛋白依赖性蛋白激酶II(CaMKⅡ)、突触素1(SYN1)和突触后致密蛋白-95(PSD-95)等相关蛋白在海马突触再生中起到重要作用,但电针神庭、百会是否影响突触再生相关蛋白而改善PSCI尚未知。
本课题组前期研究显示临床电针神庭、百会改善PSCI疗效确切,简易智力状态量表(MMSE)、MoCA量表评分提高,独立处理事件能力加强,而不良事件率下降[8, 9];并发现记忆尚与左侧海马和右侧额中回的功能连接、右侧海马和左侧额上回的功能连接、右侧海马和左侧顶叶的功能连接呈正相关[10]。课题组还分别从炎症、凋亡等方面对其机制进行了研究[11, 12],但尚未完全阐明。因此,本文将结合前期研究工作,通过制备大脑中动脉栓塞再灌注(MCAO/R)大鼠模型,进一步揭示和明确电针神庭、百会改善PSCI相关机制,为推广应用针刺技术促进卒中的康复奠定研究基础。
1. 材料和方法
1.1. 实验动物
SPF级健康雄性Sprague-Dawley大鼠48只,体质量280±30 g,由上海斯莱克实验动物有限责任公司提供,饲养于福建中医药大学实验动物中心,许可证号:SYXK(闽)2019-0007。室内恒温(22 ℃)、恒湿,自由饮水、进食,采用12 h昼夜循环照明系统,适应性喂养1周。本研究经福建中医药大学动物伦理委员会审批通过(伦理批号:2021035)。
1.2. 主要试剂与仪器
异氟烷(深圳瑞沃德生命科技有限公司);GABAARα1抗体(Abcam);CaMKⅡ抗体(CST);SYN1抗体、PSD-95抗体、GAPDH抗体(武汉Proteintech);苏木素伊红(HE)试剂盒(索莱宝);BCA定量试剂盒(ThermoFisher);大鼠GABA ELISA试剂盒(上海酶联生物)。
华佗牌SDZ-V型电子针疗仪、半寸针灸针(苏州医疗用品厂有限公司);7.0T小动物核磁共振仪(BRUKER);Morris水迷宫(上海欣软信息科技有限公司);光学显微镜(Nikon);透射电镜(H-7650);荧光显微镜(LEICA);荧光定量PCR仪(BIO-RAD CFX);Western blotting系统(BIO-RAD)。
1.3. 实验分组与模型制备
1.3.1. 实验分组
将SD大鼠分为假手术组(Sham)和造模组。依据Zea Longa神经功能评分和小动物核磁T2WI加权成像观察,将符合脑缺血再灌注模型条件的造模组大鼠按随机数字表法随机分为模型组(MCAO/R)、电针组(EA)、非穴组(NA),12只/组。
1.3.2. 模型制备
参考Zea Longa法[13]制备左侧MCAO/R大鼠模型。具体步骤:造模前大鼠禁食不禁水12 h。腹腔注射2%戊巴比妥钠溶液麻醉后,消毒颈部皮肤,钝性分离大鼠左侧颈总动脉、颈外动脉、颈内动脉。在左侧颈总动脉、颈外动脉处结扎,微动脉夹夹闭远端颈内动脉。于左侧颈总动脉分叉处用微血管剪作一切口,将线栓轻柔插入颈内动脉,插入长度约18.0 mm至有轻微阻力即止。常规缝合伤口,碘酒消毒。1.5 h后,拔出线栓约10.0 mm实现再灌注。假手术组仅钝性分离相同的颈外动脉、颈内动脉、左侧颈总动脉,不进行结扎,不损伤血管。大鼠腹腔注射青霉素消炎。过程中大鼠温度保持37 ℃左右,直至清醒恢复活动。采用Zea Longa评分法[13]进行神经功能评定,1~3分者纳入实验。实验期间,大鼠出现死亡或不符合标准均排除,并按上述造模方法补齐。
1.4. 干预方法
电针组:“百会”、“神庭”穴位选择参考《实验针灸学》[14]和《大鼠脑立体定位图谱》[15],电针前轻抚大鼠,将大鼠套入自制棉袜以减少大鼠活动、挣扎。取“百会”(位于顶骨正中)、“神庭”(位于前正中线上,在额顶骨缝交界线前方处),穴位处经常规消毒后,采用一次性针灸针进行针刺,针柄连接电针仪,予以电针干预,采用疏密波,频率1/20 Hz,刺激强度1 mA,以针体轻轻抖动为宜,30 min/次。干预时段为上午9~12时,术后次日开始干预,1次/d,连续干预7 d。
非穴组:电针大鼠双侧胁下非经非穴,参考文献[16]的实验方法进行定位,选择双侧胁下各两个固定非穴点(髂嵴垂直向上10、15 mm)作为对照,其余实验条件同电针组。
假手术组和模型组均同等条件抓取,不予治疗。
1.5. 观察指标
1.5.1. Zea Longa神经行为学评分评估大鼠神经功能
分别于大鼠干预前后采用Zea longa评分法[13]评价大鼠的神经损伤程度。0分:无神经功能缺损,活动正常;1分:提尾时对侧前爪屈曲且不能完全伸展;2分:行走时向对侧转圈;3分:行走时向对侧倾倒;4分:不能自发行走,意识丧失。
1.5.2. 小动物核磁共振成像仪检测大鼠脑梗死体积
干预前后使用7.0 T小动物核磁共振成像仪进行扫描。异氟烷吸入麻醉,选用大鼠头颅线圈成像,俯卧位定位扫描及T2加权成像扫描。T2WI采用弛豫增强快速采集序列,重复时间TR=2500 ms,回波时间TE=35 ms,层厚1 mm,视野30 mm×30 mm,矩阵256×256,扫描时间5 min 20 s。
所有数据在 Paravision 6.0.1软件上进行转换分析。观察缺血周围脑区、健侧和患侧有无异常强化以及强化的部位、类型。利用图象处理软件Image J计算脑梗体积百分比(脑梗体积百分比=脑梗体积/同层面全脑体积×100%),共统计21层。测量 T2WI 增强图像上相应部位的感兴趣区(ROI)信号强度,并计算T2WI的相对信号强度值,计算公式为:增强后相对信号强度值=(信号强度增强后-信号强度增强前)/信号强度增强前×100%。采用ITK-SNAP软件手绘出脑组织T2WI图中梗死区用ROI,后用伪彩显示,每只大鼠展示12个层面的T2WI图像。
1.5.3. Morris水迷宫检测学习记忆能力
在干预第3天,参考Frick等[17]方案,采用Morris水迷宫行为学测试,包括定位航行实验和空间探索实验,测试时段为下午17~20时。Morris水迷宫为黑色内壁的圆桶形水池(直径160 cm,深50 cm),水温保持18~23 ℃,空间环境避光,池壁上4个等距离点分水池为4个象限,在第3象限放置逃生平台。平台直径 6 cm,高28 cm,平台没于水面下1.5 cm,每个象限分别做不同颜色及几何形状的标识物,便于大鼠测试中学习记忆。
定位航行实验:顺时针方向将大鼠分别放入水池的4个象限(大鼠面向池壁),测其找到逃生平台所需要的时间,即为其逃避潜伏期;若90 s内未找到逃生平台,记录其潜伏期为90 s,并移动大鼠至逃生平台停留学习15 s。实验于干预的第3~6天进行,历时4 d。
空间探索实验:干预的第7天,撤掉第3象限的逃生平台,将大鼠放入水池第1象限中(大鼠面向池壁),记录90 s内大鼠穿越原逃生平台区域次数。
1.5.4. HE染色法观察大鼠缺血侧海马CA1区组织病理形态
干预结束24 h后麻醉大鼠,经心脏灌注0.9%生理盐水和4%多聚甲醛固定液,取出完整脑组织浸泡于4%多聚甲醛固定液中,置于4 ℃冰箱24 h后石蜡包埋。常规石蜡切片为冠状面4 μm,进行苏木素-伊红染色,中性树胶封片。200倍光镜下观察大鼠海马CA1区组织病理形态的改变。
1.5.5. 透射电镜观察大鼠缺血侧海马CA1区突触结构变化
干预结束后迅速灌流固定取脑,取病变侧大脑海马CA1区,将样品切成约1 mm3的小块放入4%戊二醛中,后经3%戊二醛-1.5%多聚甲醛前固定4 h(4 ℃),1%锇酸-1.5%亚铁氰化钾后固定2 h,PBS漂洗;酒精-丙酮梯度脱水,环氧树脂618包埋剂包埋。超薄切片80 nm,醋酸铀、柠檬酸铅染色。透射电镜下观察各组神经元及突触超微结构变化情况。突触形态定量分析用0.45 mm透明正方格测试系统覆盖于照片上,按方格点计数法[18]逐一测量每张照片中的突触数和突触与测试格的交叉点数,然后用立体测量学公式计算突触小体数量(个),数据经统计学处理后作组间比较。
1.5.6. ELISA法测定大鼠血清中GABA含量
麻醉后经腹主动脉取血约5 mL,4 ℃静置2 h,于4 ℃离心机3000 r/min低温离心10 min,分离上层血清放入冻存管中,保存于-80 ℃冰箱中备用。按照ELISA试剂盒说明书进行操作,检测血清中GABA含量。
1.5.7. RT-PCR
取大鼠海马组织,使用TRIZOL法提取总RNA。随后进行RNA质量检测浓度及纯度。逆转录的反应体系为20 μL,使用逆转录试剂盒将RNA逆转录为cDNA,通过RT-PCR检测。上机预变性反应为95 ℃ 10 min,;变性反应为95 ℃ 10 s,退火延伸60 ℃ 30 s,循环40次。以内参GAPDH的特异性引物作为对照。采用2-ΔΔCt方法计算分析,检测GABAARα1、CaMKⅡ、SYN1和PSD-95 mRNA的相对表达量。引物序列见表1。
表1.
引物序列
Tab.1 Primer sequences for RT-qPCR
| Gene | Primer sequences 5'-3' | Amplified size (bp) |
|---|---|---|
| GABAARα1 | F: TGTCTTTGGAGTGACGACCG | 187 |
| R: ATCCCACGCATACCCTCTCT | ||
| CaMKⅡ | F: AAGATGTGCGACCCTGGAAT | 178 |
| R: ACTGAGTGATGCGGATGTAGG | ||
| SYN1 | F: GGTGGATTCTCCGTGGACAT | 142 |
| R: GCAGCCCAATGACCAAACTG | ||
| PSD-95 | F: CAGTGAGACCGACGACATTG | 199 |
| R: GATGATGGGACGAGCATAGTG | ||
| GADPH | F: ACGGCAAGTTCAACGGCACAG | 149 |
| R: AAGACGCCAGTAGACTCCACGAC |
1.5.8. Western blotting检测蛋白表达水平
提取左侧海马组织,加入含蛋白酶抑制剂的RIPA裂解液、裂解离心取上清。BCA定量调齐浓度并变性。10% SDS-PAGE凝胶电泳,PVDF膜湿转,5%脱脂奶粉封闭1 h,相应一抗4 ℃孵育过夜:GABAARα1 (1∶5000),CaMKⅡ(1∶1000),SYN1(1∶5000),PSD-95(1∶3000)和GAPDH(1∶5000)。次日相应二抗(1∶5000)室温孵育1 h,TBST洗膜3次,随后显影。采用Image J软件进行分析。
1.5.9. 免疫荧光检测缺血侧海马CA1区SYN1和PSD-95表达
制作4 μm石蜡切片,常温下进行二甲苯脱蜡,梯度乙醇复水,过蒸馏水中。将切片放入煮沸的Tris-EDTA抗原修复液,持续加热20 min进行抗原修复。冷却至室温后PBS溶液洗3次,放入湿盒,同时滴加5% BSA封闭液室温孵育1 h。除去封闭液,滴加稀释的SYN1、PSD-95一抗溶液(1∶100)完全覆盖组织,4 ℃孵育过夜。次日取出玻片,PBS溶液洗3次,滴加相应的荧光二抗溶液(1∶500),室温避光孵育1 h,PBS溶液洗3次,滴加抗荧光淬灭封片液(含DAPI)封片后置于荧光显微镜观察。
1.6. 统计学方法
采用SPSS 25.0软件进行统计分析,计量资料采用均数±标准差表示。数据符合正态性分布且方差齐,多组间比较采用单因素重复方差分析,进一步两两比较用LSD法或Games-Howell法检验;不服从正态分布的数据比较采用秩和检验,组间比较采用独立样本Kruskal-Wallis单因素 ANOVA 检验。P<0.05为差异具有统计学意义。
2. 结果
2.1. 电针能改善MCAO大鼠的神经行为学能力
假手术组大鼠无神经功能障碍。干预前,与假手术组比较,各组大鼠Zea Longa神经行为学评分升高(P<0.05)。干预7 d后,MCAO/R组、NA组、EA组神经功能评分均降低,与模型组比较,电针组大鼠转圈及倾倒情况减轻、活动能力增强,神经行为学评分降低(P<0.05,图1)。
图1.
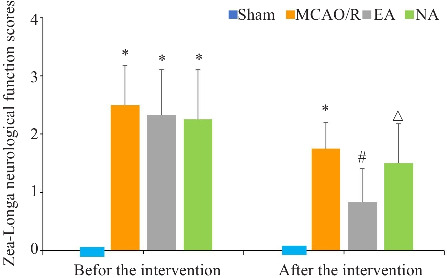
Zea-Longa神经功能评分比较
Fig.1 Comparison of Zea-Longa neurological function scores among the 4 groups before and after the treatment. *P<0.05 vs Sham group; # P<0.05 vs MCAO/R group; △ P<0.05 vs EA group. EA: Electroacupuncture at acupoints; NA: Electroacupuncture at non-acupoints.
2.2. 电针能缩小MCAO大鼠脑梗死体积
干预前,假手术组大鼠脑室居中,灰质、白质无水肿、缺血等现象,结构清晰;模型组、电针组和非穴组的灰质、白质脑区出现水肿,并出现缺血等现象,大鼠左侧大脑均出现明显梗死灶(图2A)。干预7 d后,与模型组比较,电针组大鼠梗死体积百分比降低(P<0.05,图2B)。
图2.
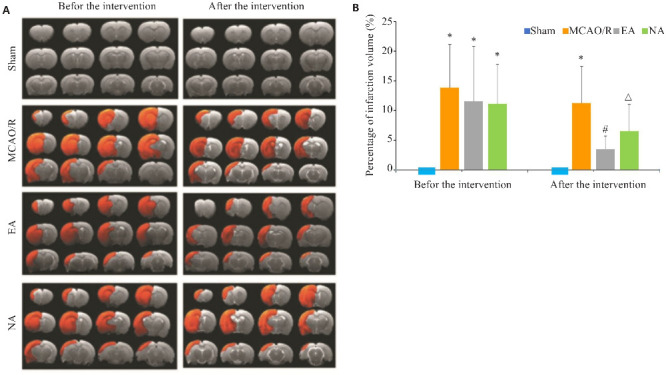
各组大鼠干预前后T2WI图及梗死体积比较
Fig.2 Comparison of T2WI and cerebral infarction volume among the 4 groups before and after the treatment. A: T2WI before and after intervention. Red area indicates cerebral infarction. B: Comparison of cerebral infarction volume.*P<0.05 vs Sham group; # P<0.05 vs MCAO/R group; △ P<0.05 vs EA group.
2.3. 电针能促进MCAO大鼠学习记忆能力的恢复
在Morris水迷宫定位航行实验中,各组大鼠逃避潜伏期均随时间增加而下降,但组间比较显示,电针组下降趋势明显(P<0.05, 图3A)。在Morris水迷宫空间探索实验中,模型组大鼠穿越逃生平台的次数减少,电针组大鼠的穿越逃生平台次数有所增加,非穴组大鼠的穿越逃生平台次数略有减少(P<0.05,图3B)。
图3.
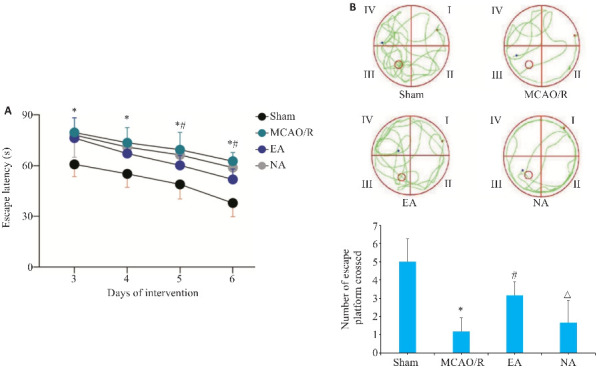
各组大鼠逃避潜伏期和穿越逃生平台次数比较
Fig.3 Comparison of escape latency (A) and number of platform crossings (B) among the 4 groups. *P<0.05 vs Sham group; # P<0.05 vs MCAO/R group; △ P<0.05 vs EA group.
2.4. 电针能减轻MCAO大鼠脑组织水肿
假手术组大鼠缺血侧海马CA1区组织细胞排列规则,核仁清晰。模型组出现部分神经细胞核固缩,细胞界限不清,而电针组与非穴组的脑组织神经元密度均有所改善,神经细胞数量较模型组有一定程度的增加(图4)。
图4.
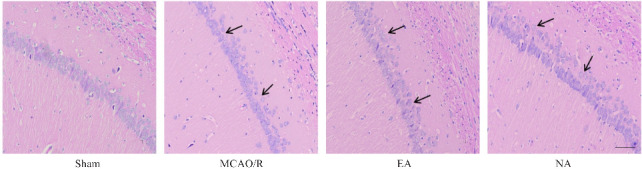
海马CA1区HE染色图
Fig.4 HE staining of the hippocampal CA1 region (Scale bar=50 μm). Arrows indicate the destroyed structure.
2.5. 电针能改善MCAO大鼠神经元和突触超微结构病变
假手术组大鼠缺血侧海马CA1区神经元细胞大致正常,排列整齐,细胞膜完整,可见饱满的细胞核,突触小泡较多。而模型组和非穴组可见神经元细胞结构被破坏,空泡样明显,细胞膜可见破裂,胞核肿胀,突触间隙变宽,突触小泡减少或消失(图5A)。电针组神经元有所恢复,细胞结构整体较完整,胞膜、核膜较完整,突触间隙宽度有所变小,突触小泡相对增加。通过计数发现,电针组的突触数量较模型组大幅增加,差异有统计学意义(P<0.05,图5B)。
图5.
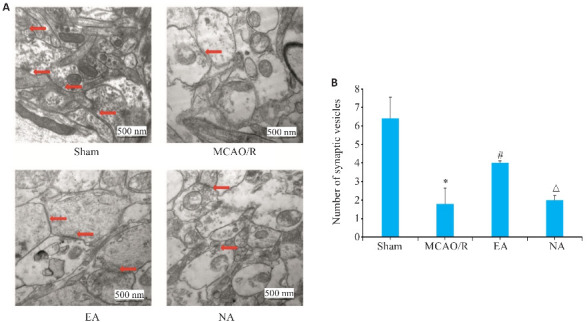
缺血侧海马CA1区突触结构及突触小体数量
Fig.5 Transmission electron microscopy of the synaptic structure and synapsis number in the hippocampal CA1 region on the ischemic side. A: Synaptic ultrastructure of hippocampal CA1 region. Arrows indicate the changed synaptic vesicle. B: Synapsis number in the hippocampal CA1 region on the ischemic side. *P<0.05 vs Sham group; # P<0.05 vs MCAO/R group; △ P<0.05 vs EA group.
2.6. 电针能增加GABA含量
与假手术组比较,模型组、电针组和非穴组大鼠血清中GABA含量降低;与模型组比较,电针组大鼠血清中GABA含量升高(P<0.05,图6)。
图6.
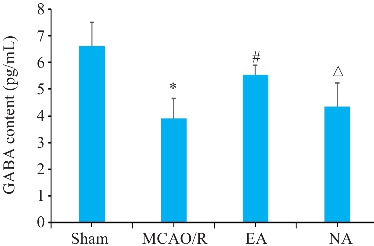
血清中GABA含量比较
Fig.6 Comparison of serum GABA levels among the 4 groups. *P<0.05 vs Sham group; # P<0.05 vs MCAO/R group; △ P<0.05 vs EA group.
2.7. 电针能改善突触再生相关基因表达
与模型组比较,电针组GABAARα1、SYN1和PSD-95 mRNA表达水平升高(P<0.05);CaMKⅡ mRNA表达水平下降(P<0.05,图7)。
图7.
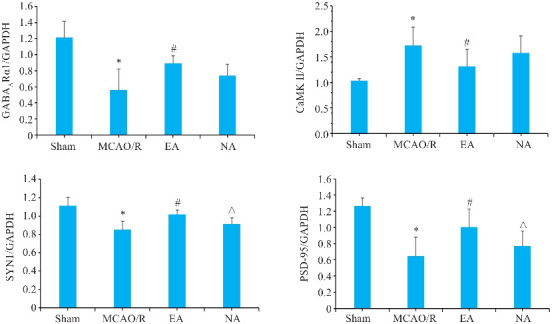
缺血侧海马GABAARα1、CaMK Ⅱ、SYN1和PSD-95 mRNA相对表达量比较
Fig.7 Comparison of relative expressions of GABAAR1, CaMK II, SYN1 and PSD-95 mRNA in the hippocampus on the ischemic side. *P<0.05 vs Sham group; # P<0.05 vs MCAO/R group; △ P<0.05 vs EA group.
2.8. 电针能改善突触再生相关蛋白表达
与模型组比较,电针组GABAARα1、SYN1、PSD-95蛋白表达水平升高(P<0.05),电针组CaMKⅡ蛋白表达水平降低(P<0.05);与电针组比较,非穴组GABAARα1、SYN1、PSD-95蛋白相对表达量降低(P<0.05,图8)。
图8.
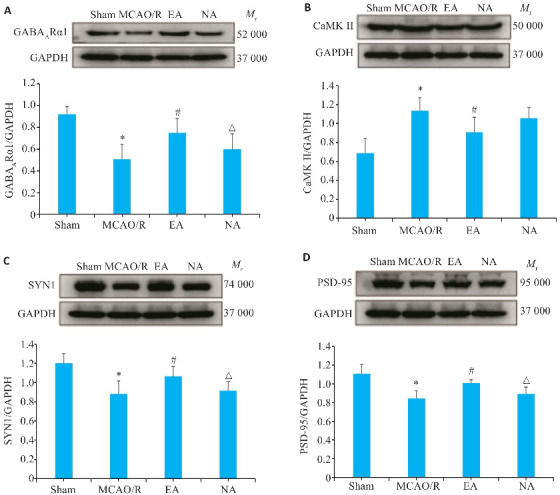
缺血侧海马GABAARα1、CaMK Ⅱ、SYN1和PSD-95蛋白表达比较
Fig.8 Comparison of GABAAR1 (A), CaMK II (B), SYN1 (C) and PSD-95 protein (D) expressions in the hippocampus on the ischemic side detected by Western blotting. *P<0.05 vs Sham group; # P<0.05 vs MCAO/R group; △ P<0.05 vs EA group.
2.9. 电针能改善大鼠缺血侧海马CA1区SYN1和PSD-95免疫荧光表达
与模型组比较,电针组SYN1、PSD-95免疫荧光表达水平升高(P<0.05,图9A、B);与电针组比较,非穴组PSD-95免疫荧光表达水平降低(P<0.05,图9B)。
图9.
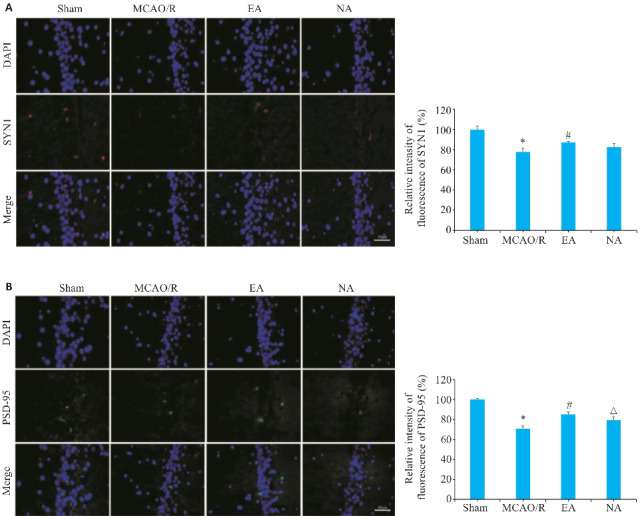
缺血侧海马CA1区SYN1、PSD-95免疫荧光表达比较
Fig.9 Immunofluorescence staining for SYN1 (A) and PSD-95 (B) in the CA1 region of the ischemic hippocampus in the 4 groups (Scale bar=50 μm). *P<0.05 vs Sham group; # P<0.05 vs MCAO/R group; △ P<0.05 vs EA group.
3. 讨论
针灸百会穴能通过大脑皮层的反射调节自主神经,增强脑皮层相关部位的兴奋性,对改善大脑血供、修复受损神经和调节免疫有直接作用[19, 20]。针刺百会还可促进Na+/Ca2+交换促进脑组织恢复[21]、调整缺血组织的生化指标[22]、泛素化修饰调控[23]、减轻血脑屏障的损害等[24]。神庭是督脉与足阳明、足太阳经之交会穴,督脉上行之气聚集于此,具有安心神、开脑窍之功,针刺此穴位能减轻脑组织损伤、神经功能缺损程度[25]。神庭位于脑海前庭,有宁神、开窍的功用,研究认为神庭穴对“窍闭神匿”的脑系疾病效果显著,联合百会穴可改善患者的认知功能[26],并改善脑组织的血管结构,血流速度及PDGFs、CD31等相关蛋白的表达,以促进脑卒中的恢复[27]。两穴位联合应用研究针刺神庭、百会对认知功能障碍患者的疗效,结果发现患者自身治疗前后有明显变化[28]。电针两穴位能减轻炎症的损害[29]、促进蛋白质磷酸化、干预对胰岛素分泌、轴突导引、磷脂酰肌醇信号系统及赖氨酸生物合成等对中枢神经系统组织功能有重要作用的信号通路产生了影响[30]。以上表明神庭、百会在基础研究及临床应用上较广,其安全性、适用性得到认可。
Zea-Longa神经行为学评分原则被作为是MCAO/R造模成功的评判标准之一[31]。本研究结果显示,电针组大鼠在神经行为学评分降低,提示电针“百会”、“神庭”可以改善MCAO/R大鼠的神经功能缺损。大鼠逃避潜伏期及穿越平台次数均较模型组增加,表明电针能促进MCAO/R大鼠的学习记忆能力,与有关研究[32]结果一致。随着小动物MRI技术的出现,越来越多的研究采用T2WI序列成像作为脑缺血模型的评判标准[33, 34]。本实验电针组大鼠脑梗死体积百分比均有降低,说明电针“百会”、“神庭”可减轻MCAO/R大鼠脑梗死体积。
本实验观察到电针组缺血侧海马CA1区神经细胞数量增加,突触间隙宽度变小,突触小泡、突触数量增加,表明电针可修复部分神经元,促进突触结构再生,与相关研究结果趋势相同[35]。但未观察到缺血再灌注损伤的学习记忆相关脑区以及AD引起的记忆障碍的脑区病理变化有明显的差异,可能尚需从学习记忆相关脑区的功能方面进行探讨,有待在功能核磁方面深入分析细分脑区,如CA1、CA2、CA3、DG区的纤维连接,可从参与损伤修复的突触可塑性方面进行探讨。
突触可塑性是调控神经功能的基础,生理状态下与大脑的发育和学习记忆有关,病理状态下参与脑损伤的修复[35]。有研究显示,在AD早期表现为大量的突触缺失及突触功能障碍,导致认知及其他功能缺陷[36]。而突触内的一些重要基因和蛋白影响了突触功能,包括GABAARα1、CaMKⅡ、SYN1和PSD-95等。GABA释放过少和过多都会损害记忆[37],其中GABAARα1广泛地分布在海马和皮层中,可介导神经回路中的快速抑制信号传导,与学习记忆有关[38-40]。降低GABA能神经元间特异性蛋白的水平可能导致早期认知能力下降[41]。CaMKⅡ在突触后膜部位参与长时相增强的诱导与维持,诱导分子信号级联反应,调节长期记忆形成所需的基因表达,重塑突触结构及功能[42]。积聚于突触后密度中的CaMKⅡ是哺乳动物大脑海马中最丰富的蛋白激酶之一[43]。细胞内钙浓度的病理性升高被认为是缺血再灌注后细胞死亡的触发因素[44]。本研究证实,电针能降低脑缺血再灌注大鼠海马CA1区钙调蛋白表达水平,减轻大脑神经元受损。CaMKⅡ蛋白和mRNA表达水平下降,提示电针“百会”、“神庭”不仅能促进抑制性神经递质GABAARα1表达,而且抑制CaMKⅡ表达,进而降低神经元兴奋性,保护神经细胞,改善神经缺损,本研究结果与文献报道接近[45, 46]。
在海马切片的膜片钳实验中,SYN1可协助GABA释放并调节兴奋/抑制平衡,且Ca2+通道参与了其中[47]。有研究发现在AD大鼠中,长期记忆缺陷伴随着与海马突触可塑性,与突触可塑性相关基因Dlg4、CaMKII和SYN1密切相关[48]。本研究中,大鼠血清GABA含量升高,GABAARα1蛋白和mRNA表达水平升高,电针“百会”、“神庭”治疗后可能影响了突触效能的传递。且本研究发现缺血侧海马SYN1和PSD-95蛋白和mRNA表达水平及免疫荧光表达均升高,提示电针可通过调节海马突触可塑性相关因子SYN1和PSD-95,进而调节突触功能,改善学习记忆功能障碍的可能,与相关文献报道结论一致[49]。
综上所述,本研究分别从活体到离体、动态到静态角度,阐述了电针百会、神庭可能通过调节海马区GABAARα1、SYN1、PSD-95、CaMKⅡ等相关蛋白和基因,加强神经元之间的联络及突触连接效能,调节海马突触再生与突触可塑性,进而改善卒中后的学习记忆能力的作用机制。但本研究未进行膜片钳及神经电生理实验验证突触传递效能变化、钙成像实验验证脑缺血损伤后检测钙离子浓度变化等。电针对于其他不同脑区的治疗效应、不同治疗周期或频率,对神经元间兴奋或抑制功能传递变化,与 MCAO/R大鼠认知功能的作用影响目前尚不完全清楚。未来需要进一步探讨缺血受损神经元的电信号、葡萄糖代谢活动变化以及神经胶质细胞的影响,为电针改善脑功能变化提供更多的科学解释和参考依据。
基金资助
Supported by National Natural Science Foundation of China (81774386).
参考文献
- 1. 《中国脑卒中防治报告》编写组 . 《中国脑卒中防治报告2020》概要[J]. 中国脑血管病杂志, 2022, 19(2): 136-44. [Google Scholar]
- 2. Lo JW, Crawford JD, Desmond DW, et al. Profile of and risk factors for poststroke cognitive impairment in diverse ethnoregional groups[J]. Neurology, 2019, 93(24): e2257-e2271. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Gorelick PB, Scuteri A, Black SE, et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the American heart association/american stroke association[J]. Stroke, 2011, 42(9): 2672-713. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4. Mok VC, Lam BY, Wong A, et al. Early-onset and delayed-onset poststroke dementia-revisiting the mechanisms[J]. Nat Rev Neurol, 2017, 13(3): 148-59. [DOI] [PubMed] [Google Scholar]
- 5. Bettio LEB, Rajendran L, Gil-Mohapel J. The effects of aging in the hippocampus and cognitive decline[J]. Neurosci Biobehav Rev, 2017, 79: 66-86. [DOI] [PubMed] [Google Scholar]
- 6. Preston AR, Eichenbaum H. Interplay of hippocampus and prefrontal cortex in memory[J]. Curr Biol, 2013, 23(17): R764-73. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Eichenbaum H. On the integration of space, time, and memory[J]. Neuron, 2017, 95(5): 1007-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Yang SL, Ye HC, Huang J, et al. The synergistic effect of acupuncture and computer-based cognitive training on post-stroke cognitive dysfunction: a study protocol for a randomized controlled trial of 2×2 factorial design[J]. BMC Complement Altern Med, 2014, 14: 290. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. 刘 娇, 冯晓东. 电针百会、神庭穴配合康复训练治疗脑卒中后认知障碍临床研究[J]. 中医学报, 2013, 28(4): 608-10. [Google Scholar]
- 10. 林志诚, 杨珊莉, 薛偕华, 等. 针刺百会穴改善脑卒中患者记忆力的中枢机制[J]. 中国康复理论与实践, 2015, 21(2): 184-8. DOI: 10.3969/j.issn.1006-9771.2015.02.014 [DOI] [Google Scholar]
- 11. Chen B, Wang GX, Li WW, et al. Memantine attenuates cell apoptosis by suppressing the calpain-caspase-3 pathway in an experimental model of ischemic stroke[J]. Exp Cell Res, 2017, 351(2): 163-72. [DOI] [PubMed] [Google Scholar]
- 12. Zhong XY, Chen B, Li ZF, et al. Correction to: electroacupuncture ameliorates cognitive impairment through the inhibition of NLRP3 inflammasome activation by regulating melatonin-mediated mitophagy in stroke rats[J]. Neurochem Res, 2022, 47(7): 1931-3. [DOI] [PubMed] [Google Scholar]
- 13. Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. [DOI] [PubMed] [Google Scholar]
- 14. 邓春雷, 殷克敬. 实验针灸学[M]. 北京: 人民卫生出版社, 1998: 147. [Google Scholar]
- 15. George P, Charles W(著), 诸葛启钏(主 译. 大鼠脑立体定位图谱[M]. 北京: 人民卫生出版社, 2005. [Google Scholar]
- 16. Yin CS, Jeong HS, Park HJ, et al. A proposed transpositional acupoint system in a mouse and rat model[J]. Res Vet Sci, 2008, 84(2): 159-65. [DOI] [PubMed] [Google Scholar]
- 17. Frick KM, Baxter MG, Markowska AL, et al. Age-related spatial reference and working memory deficits assessed in the water maze[J]. Neurobiol Aging, 1995, 16(2): 149-60. [DOI] [PubMed] [Google Scholar]
- 18. 郑富盛. 细胞形态立体计量学[M]. 北京: 北京医科大学、中国协和医科大学联合出版社, 1990: 112-113. [Google Scholar]
- 19. 洪文学, 樊凤杰, 宋佳霖. 百会穴研究概况[J]. 上海针灸杂志, 2006, 25(2): 42-5. [Google Scholar]
- 20. 刘 芳, 姚立群, 陈金辉. 针刺百会、神庭穴治疗脑卒中后认知功能障碍效果的系统评价[J]. 上海针灸杂志, 2018, 4(1): 104-11. [Google Scholar]
- 21. Ning WH, Li L, Wang RQ, et al. Electroacupuncture pretreatment enhances the calcium efflux activity of Na+/Ca2+ exchanger to attenuate cerebral injury by PI3K/Akt-mediated NCX1 upregulation after focal cerebral ischaemia[J]. Heliyon, 2024, 10(12): e33265. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. 许能贵, 易 玮, 赖新生, 等. 电针对局灶性脑缺血大鼠NO、NOS和ET-1的影响[J]. 广州中医药大学学报, 2002, 19(1): 63-4. [Google Scholar]
- 23. 曹娅军, 王思诺, 余 燕, 等. 电针 “百会” “神庭” 穴对血管性认知障碍大鼠海马泛素化修饰蛋白质组学的影响[J]. 中国康复医学杂志, 2023, 38(8): 1025-34. [Google Scholar]
- 24. Chen YL, Ouyang L, Meng LL, et al. Electroacupuncture ameliorates blood-brain barrier disruption after ischemic stroke through histone acetylation regulation at the matrix metalloproteinase 9 and tissue inhibitor of metalloproteinase 2 genes[J]. Chung I Tsa Chih Ying Wen Pan, 2024, 44(4): 734-44. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25. 李章晗, 黎华茂, 艾年年. 通督调神针刺法联合康复运动治疗脑卒中恢复期偏瘫肢体运动功能障碍的临床观察[J]. 广州中医药大学学报, 2021, 38(7): 1401-6. [Google Scholar]
- 26. 詹 杰, 潘锐焕, 郭友华, 等. 针刺百会、神庭联合基础治疗和常规康复训练治疗脑卒中后认知障碍: 随机对照研究[J]. 中国针灸, 2016, 36(8): 803-6. [Google Scholar]
- 27. 杜坤锐, 刘 畅, 陈潇煜, 等. 电针对血管性痴呆大鼠海马微血管结构和相关蛋白表达的影响[J]. 针刺研究, 2023, 48(11): 1079-87. [DOI] [PubMed] [Google Scholar]
- 28. 陈 磊, 焦 鹏, 李方辉. 针刺百会、神庭穴联合康复训练治疗卒中后认知功能障碍[J]. 中国老年保健医学, 2020, 18(2): 11-3. [Google Scholar]
- 29. 屈媛媛, 冯楚文, 孙忠人, 等. 电针对慢性疲劳综合征大鼠行为学及海马炎性因子的影响[J]. 针刺研究, 2024, 49(3): 274-82. [DOI] [PubMed] [Google Scholar]
- 30. 杨 燕, 孙忠人, 李超然, 等. 电针干预对慢性疲劳综合征大鼠海马组织蛋白质磷酸化表达的影响[J]. 针刺研究, 2024, 49(6): 594-603. [DOI] [PubMed] [Google Scholar]
- 31. Liu WL, Wang X, Yang SL, et al. Electroacupunctre improves motor impairment via inhibition of microglia-mediated neuroinflammation in the sensorimotor cortex after ischemic stroke[J]. Life Sci, 2016, 151: 313-22. [DOI] [PubMed] [Google Scholar]
- 32. Huang YC, Tzeng WS, Wang CC, et al. Neuroprotective effect of agmatine in rats with transient cerebral ischemia using MR imaging and histopathologic evaluation[J]. Magn Reson Imaging, 2013, 31(7): 1174-81. [DOI] [PubMed] [Google Scholar]
- 33. 孔营楠, 詹松华, 龚志刚, 等. 从TLR4信号通路探讨电针减轻小鼠脑缺血再灌注损伤的炎症反应机制[J]. 中国中西医结合影像学杂志, 2020, 18(6): 568-71, 581. [Google Scholar]
- 34. Ovadia-Caro S, Margulies DS, Villringer A. The value of resting-state functional magnetic resonance imaging in stroke[J]. Stroke, 2014, 45(9): 2818-24. [DOI] [PubMed] [Google Scholar]
- 35. Sweatt JD. Neural plasticity and behavior-sixty years of conceptual advances[J]. J Neurochem, 2016, 139(Suppl 2): 179-99. [DOI] [PubMed] [Google Scholar]
- 36. Forner S, Baglietto-Vargas D, Martini AC, et al. Synaptic impairment in Alzheimer's disease: a dysregulated symphony[J]. Trends Neurosci, 2017, 40(6): 347-57. [DOI] [PubMed] [Google Scholar]
- 37. Barberis A. Postsynaptic plasticity of GABAergic synapses[J]. Neuropharmacology, 2020, 169: 107643. [DOI] [PubMed] [Google Scholar]
- 38. Sente A, Desai R, Naydenova K, et al. Differential assembly diversifies GABAA receptor structures and signalling[J]. Nature, 2022, 604(7904): 190-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39. Rudolph U, Crestani F, Möhler H. GABA(A) receptor subtypes: dissecting their pharmacological functions[J]. Trends Pharmacol Sci, 2001, 22(4): 188-94. [DOI] [PubMed] [Google Scholar]
- 40. Xu YF, Lian YJ, Li J, et al. KangPiLao decoction modulates cognitive and emotional disorders in rats with central fatigue through the GABA/Glu pathway[J]. Front Pharmacol, 2022, 13: 939169. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41. Govindpani K, Calvo-Flores Guzmán B, Vinnakota C, et al. Towards a better understanding of GABAergic remodeling in Alzheimer's disease[J]. Int J Mol Sci, 2017, 18(8): 1813. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42. Hell JW. CaMKII: claiming center stage in postsynaptic function and organization[J]. Neuron, 2014, 81(2): 249-65. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43. Dittmer PJ, Wild AR, Dell’Acqua ML, et al. STIM1 Ca2+ sensor control of L-type Ca2+-channel-dependent dendritic spine structural plasticity and nuclear signaling[J]. Cell Rep, 2017, 19(2): 321-34. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44. Fels JA, Manfredi G. Sex differences in ischemia/reperfusion injury: the role of mitochondrial permeability transition[J]. Neurochem Res, 2019, 44(10): 2336-45. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45. 姚路路, 杜 鑫, 付渊博, 等. 针灸调控神经可塑性作用机制初探[J]. 针灸临床杂志, 2022, 38(10): 1-5. [Google Scholar]
- 46. 程 洁, 李忠仁, 朱 毅, 等. 电针对脑缺血再灌注大鼠海马钙调蛋白表达的影响[J]. 中国针灸, 2011, 31(11): 1015-9. [PubMed] [Google Scholar]
- 47. Forte N, Binda F, Contestabile A, et al. Synapsin I synchronizes GABA release in distinct interneuron subpopulations[J]. Cereb Cortex, 2020, 30(3): 1393-406. [DOI] [PubMed] [Google Scholar]
- 48. Habif M, Do Carmo S, Báez MV, et al. Early long-term memory impairment and changes in the expression of synaptic plasticity-associated genes, in the McGill-R-Thy1-APP rat model of alzheimer's-like brain amyloidosis[J]. Front Aging Neurosci, 2020, 12: 585873. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49. Xiao LY, Wang XR, Yang Y, et al. Applications of acupuncture therapy in modulating plasticity of central nervous system[J]. Neuromodulation, 2018, 21(8): 762-76. [DOI] [PubMed] [Google Scholar]


