Abstract
目的
本研究旨在基于列线图方法构建阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)相关高血压的风险预测模型,并探讨OSA相关高血压的独立危险因素,为临床治疗决策提供帮助与参考。
方法
本研究回顾性收集2019年10月至2021年12月经多导睡眠监测诊断为OSA患者的临床资料,并将其随机分为训练队列和验证队列。共纳入1 493例OSA患者,及27个变量。最小绝对收缩和选择算子(the least absolute shrinkage and selection operator,Lasso)logistic回归用于选择潜在的相关特征,建立OSA相关高血压的列线图。从区分度、校准能力和临床净收益等方面验证列线图的性能和临床效益。
结果
多因素logistic回归发现身体质量指数(body mass index,BMI)、高血压家族史、最低血氧饱和度(lowest oxygen saturation,LSaO2)、年龄及血氧饱和度小于90%的总睡眠时间百分比是OSA相关高血压的独立危险因素。Lasso logistic回归确定BMI、高血压家族史、LSaO2及年龄作为纳入列线图的预测因素。列线图提供了有利的区分,训练队列和验证队列的C指数分别为0.835(95%CI 0.806~0.863)和0.865(95%CI 0.829~0.900),并且校准良好。临床决策曲线显示列线图在临床上有用。
结论
较血氧饱和度小于90%的总睡眠时间百分比,LSaO2对OSA相关高血压发病的影响可能更大,未来应进一步探讨不同缺氧时间与不同缺氧程度对OSA相关高血压的影响。在OSA相关高血压的预测中,呼吸暂停低通气指数参与度较弱,血氧指标可能会是一个更好的预测变量。此外,本研究使用列线图方法建立了OSA相关高血压患者的风险预测模型,证明了该预测模型有助于识别OSA相关高血压的高危患者。该模型有助于提供早期的、个体化的诊断和治疗方案,保护患者免受OSA相关高血压的严重后果,最大限度地减轻社会负担。
Keywords: 阻塞性睡眠呼吸暂停, 高血压, 列线图, 危险因素
Abstract
Objective
This study aimed to construct a risk prediction model for obstructive sleep apnea(OSA) related hypertension based on the nomogram, and to explore the independent risk factors for OSA-related hypertension, so as to provide reference for clinical treatment decision-making.
Methods
The clinical data of OSA patients diagnosed by polysomnography from October 2019 to December 2021 were collected retrospectively and randomly divided into training sets and validation sets. A total of 1 493 OSA patients with 27 variables were included. The least absolute shrinkage and selection operator(Lasso) logistic regression model was used to select potentially relevant features and establish a nomogram for OSA-related hypertension.The performance and clinical benefits of this nomogram were verified in terms of discrimination, calibration ability and clinical net benefit.
Results
Multivariate logistic regression showed that body mass index(BMI), family history of hypertension, lowest oxygen saturation(LSaO2), age and cumulative percentage of total sleep time with oxygen saturation below 90% were independent risk factors for OSA-related hypertension. Lasso logistic regression identified BMI, family history of hypertension, LSaO2 and age as predictive factors for inclusion in the nomogram. The nomogram provided a favorable discrimination, with a C-indexes of 0.835(95% confidence interval[CI]0.806-0.863) 和 0.865(95%CI 0.829-0.900) for the training and validation cohort, respectively, and well calibrated. The clinical decision curve analysis displayed that the nomogram was clinically useful.
Conclusion
Compared with cumulative percentage of total sleep time with blood oxygen saturation below 90%, LSaO2 may have a greater impact on the incidence of OSA-related hypertension, and the effects of different times and degrees of hypoxia on OSA-related hypertension should be further explored in the future. Apnea hypopnea index involvement is weak in predicting OSA-related hypertension, and the blood oxygen index may be a better predictor variable. Furthermore, we established a risk prediction model for OSA-related hypertension patients using nomogram, and demonstrated that this prediction model was helpful to identify high-risk OSA-related hypertension patients. This model can provide early and individualized diagnosis and treatment plans, protect patients from the serious
Keywords: obstructive sleep apnea, hypertension, nomogram, risk factor
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是上气道在睡眠期间反复的部分或完全塌陷所导致的一种阵发性的呼吸暂停疾病,其特征是间歇性低氧血症、自主神经波动、高碳酸血症及睡眠破碎化[1-2]。OSA是一个日益严重的全球性健康问题,截至2019年,中国OSA患病率已达24.2%,位居世界第一,且随着肥胖症的日益流行和人口老龄化的加剧,OSA在未来将会更加流行[3]。
OSA作为一种全身性疾病,与许多并发症密切相关,如心血管疾病、代谢紊乱及神经精神疾病等[4]。近年来,OSA相关合并症成为国际研究热点,其中,心血管疾病,特别是高血压,因其后果严重、发病率高的特点更是受到广泛关注[5-7]。OSA相关高血压指在排除其他明确的继发性病因(肾实质性疾病、肾动脉狭窄、嗜铬细胞瘤等)后,由OSA引起或加重的高血压[8]。研究表明OSA与高血压之间存在双向的因果关系[4, 9-10],据估计轻、中、重度OSA患者中高血压患病率分别高达59%、62%和67%,而高血压患者中OSA的患病率超过30%[8],但由于OSA的普遍诊断不足,这可能被低估。此外,研究表明,OSA相关高血压很可能是不可逆的,夜间高血压的非杓型患者和夜间血压升高的患者表现出更大程度的终末器官损害、更高的中风风险、更高的心力衰竭风险和更高的肾脏疾病进展风险[8]。持续气道正压通气(continuous positive airway pressure,CPAP)是当前OSA的首选的治疗方法。然而,荟萃分析研究表明,CPAP在逆转OSA高血压方面无效或效果最低[11]。此外,OSA动物研究表明,间歇性缺氧导致的血管重塑不能通过CPAP改善。因此早期识别此类高风险人群并对其及早干预非常有必要。
OSA相关高血压虽然患病率高且后果更为严重,但却反而很容易被患者及临床医生所忽视,这主要可以归结于两方面,一是意识不足,二是诊断技术存在缺陷。对一般人群,高血压的诊断主要是基于诊室血压测量。但由于OSA相关高血压的特殊性,即隐匿性高血压的高发率、夜间血压升高、夜间非杓型血压及血压变异性增加[10],特别是它主要影响夜间血压的事实,使得这种诊断方法在OSA人群中并不可靠。现有数据表明,OSA患者的“白大褂高血压”及“隐匿性高血压”的患病率较正常人更高[12],说明OSA患者存在着更高的漏诊以及过度诊断风险。因此,欧洲的心脏病/高血压协会一直建议对所有的OSA患者应用动态血压监测(ambulatory blood pressure monitoring,ABPM)进行系统的、正确的血压评估[13-14]。然而ABPM的成本效益不高且较为繁琐,对于患者来说是一种负担,因此,在日常临床实践中,急需要一种简单方便的临床工具来识别OSA相关高血压患者。
列线图已被公认为一种可靠的工具,在临床疾病的诊断及预后预测中都有着极佳的表现[15]。因此,本研究进行了一项大样本量的横断面研究分析,通过结合回归分析方法(Lasso和logistic回归)来确定OSA相关高血压的重要预测因素,并首次构建列线图来预测OSA相关高血压的风险。
1. 对象与方法
1.1. 研究对象
本研究回顾性纳入2019年10月至2021年12月就诊于我科的鼾症患者。所有患者均接受夜间多导睡眠监测(polysomnography,PSG)及多次血压监测,并由心内科医生对患者血压进行评估,血压异常者推荐行动态血压监测。入组流程见图 1。根据诊疗标准,呼吸暂停低通气指数(apnea hypopnea index,AHI)≥5次/h的患者被诊断为OSA[16]。高血压定义为既往诊断为高血压并且当前正在接受相关治疗的患者以及经ABPM确诊的新发患者。其中,新诊断的高血压患者是指对无高血压病史但血压异常的患者进一步行ABPM检查,并由经验丰富的心内科专家对患者进行评估,最终诊断为高血压的OSA患者。ABPM将高血压定义为白天收缩压/舒张压≥ 135/85 mmHg(1 mmHg=0.133 kPa),夜间收缩压/舒张压≥ 120/70 mmHg,或24 h收缩压/舒张压≥ 130/80 mmHg[17]。
图 1.

入组流程图
纳入标准:①年龄≥18岁;②AHI≥5次/h;③此前未接受过OSA相关治疗。排除标准:①基线资料不完整;②可能影响血压调节的疾病,如多器官功能障碍综合征,严重心衰等;③继发性的高血压常见病因:肾实质疾病,原发性醛固酮增多症等;④孕妇;⑤睡眠打鼾时间或憋气时间短于高血压病程;⑥中枢性睡眠呼吸暂停患者(中枢性呼吸暂停指数≥ 5次/h)。
本研究已经西安交通大学第二附属医院伦理委员会批准(No:2021031)。
1.2. 数据收集
根据既往研究及临床可能危险因素,收集27项相关临床指标,包括:①人口学特征:性别,心脏病病史,糖尿病病史,高血压家族史,甲状腺功能减退病史,身体质量指数(body mass index,BMI)(kg/m2),腰围(cm),颈围(cm),年龄(岁);②生活方式:吸烟史,饮酒史,高盐饮食史,高脂饮食史,睡眠质量差,是否久坐,是否情绪易激动,精神压力大,吸烟量(包/d);③OSA病史及相关指标:记忆力减退病史,注意力不集中,Epworth嗜睡量表(ESS),睡眠打鼾病史(年),睡眠憋气病史(年),AHI(次/h),阻塞性呼吸暂停指数(obstructive apnea index,OAI)(次/h),最低血氧饱和度(lowest oxygen saturation,LSaO2)(%),血氧饱和度小于90%的总睡眠时间百分比(cumulative percentage of sleep time with SpO2below 90%,CT90)(%)。
1.3. 统计学分析
使用R软件(版本4.1.1)以及SPSS 21.0对患者的临床特征变量进行处理和分析。分类变量用数量及%方式呈现,通过χ2检验或者Fisher精确检验进行组间比较。连续变量的正态性检验采用Shapiro-Wilk检验,符合正态分布使用t检验,采用X±S表示,非正态分布采用非参数检验,用M(P25,P75)表示。
使用R的“插入”程序包生成的排列随机数字表,以7︰3的比例随机将患者分配到训练队列和验证队列。使用最小绝对收缩和选择算子对数据进行降维,从训练队列中识别出最优的预测特征。选取Lasso回归模型中系数不为零的特征。在Lasso回归筛选的预测因素的基础上,进行多因素logistic回归分析,建立预测OSA相关高血压的列线图。采用C指数评价列线图的区分度,对列线图进行自举验证(1 000次的自举重新采样),以计算相对校正的C指数。绘制校准曲线,结合Hosmer-Lemeshow检验(P>0.05被认为是校准的优度)评估模型校准性,理想的校准曲线将完全的贴合45 °参考线。在训练队列和验证队列基于不同阈值概率下的列线图的净收益,使用决策曲线分析(decisioncurveanalysis,DCA)来评估临床效果。P<0.05为差异有统计学意义。
2. 结果
2.1. 2组间人口学和临床特征比较
经过纳入与排除标准后,本研究最终纳入1 493例患者的基线特征,见表 1。人口学特征方面,2组患者在心脏病病史、高血压家族史、糖尿病病史、BMI、腰围、颈围和年龄/10岁方面差异有统计学意义(P<0.05)。生活方式变量中,高盐饮食、睡眠质量差、吸烟量为显著变量(P<0.05)。在与OSA病史和相关指标中,记忆力减退、Epworth嗜睡评分、鼾声病程、窒息病程、AHI、OAI、LSaO2/10、CT90/10在2组间差异有统计学意义(P<0.05)。
表 1.
2组人群的临床特征分析
| 特征变量 | 总人数(n=1 493) | 非高血压组(n=1 134) | 高血压组(n=359) | P |
| 性别/例(%) | 0.143 | |||
| 女 | 224(15.0) | 161(14.2) | 63(17.5) | |
| 男 | 1 269(85.0) | 973(85.8) | 296(82.5) | |
| 心脏病病史/例(%) | <0.001 | |||
| 否 | 1 394(93.4) | 1 085(95.7) | 309(86.1) | |
| 是 | 99(6.6) | 49(4.3) | 50(13.9) | |
| 高血压家族史/例(%) | <0.001 | |||
| 否 | 1 063(71.2) | 905(79.8) | 158(44.0) | |
| 是 | 430(28.8) | 229(20.2) | 201(56.0) | |
| 糖尿病病史/例(%) | <0.001 | |||
| 否 | 1 437(96.2) | 1 113(98.1) | 324(90.3) | |
| 是 | 56(3.8) | 21(1.9) | 35(9.7) | |
| 甲状腺功能减退史/例(%) | 0.278 | |||
| 否 | 1 464(98.1) | 1 109(97.8) | 355(98.9) | |
| 是 | 29(1.9) | 25(2.2) | 4(1.1) | |
| BMI | 26.7(24.6,29.4) | 26.2(24.4,28.7) | 28.1(25.9,30.5) | <0.001 |
| 腰围 | 98.0(92.0,105.0) | 97.0(92.0,103.0) | 102.0(95.0,108.0) | <0.001 |
| 颈围 | 40.0(37.5,42.0) | 39.0(37.0,41.0) | 41.0(38.0,43.0) | <0.001 |
| 年龄/10 | 4.0(3.3,4.9) | 3.7(3.2,4.6) | 4.8(4.0,5.6) | <0.001 |
| 饮酒/例(%) | 0.965 | |||
| 否 | 901(60.3) | 684(60.3) | 217(60.4) | |
| 是 | 592(39.7) | 450(39.7) | 142(39.6) | |
| 吸烟/例(%) | 0.112 | |||
| 否 | 834(55.9) | 647(57.1) | 187(52.1) | |
| 是 | 659(44.1) | 487(42.9) | 172(47.9) | |
| 高盐饮食/例(%) | <0.050 | |||
| 否 | 1 124(75.3) | 869(76.6) | 255(71.0) | |
| 是 | 369(24.7) | 265(23.4) | 104(29.0) | |
| 高脂饮食/例(%) | 0.069 | |||
| 否 | 1 049(70.3) | 811(71.5) | 238(66.3) | |
| 是 | 444(29.7) | 323(28.5) | 121(33.7) | |
| 睡眠质量差/例(%) | <0.050 | |||
| 否 | 808(54.1) | 634(55.9) | 174(48.5) | |
| 是 | 685(45.9) | 500(44.1) | 185(51.5) | |
| 久坐/例(%) | 0.182 | |||
| 否 | 573(38.4) | 424(37.4) | 149(41.5) | |
| 是 | 920(61.6) | 710(62.6) | 210(58.5) | |
| 情绪稳定/例(%) | 0.157 | |||
| 否 | 416(27.9) | 305(26.9) | 111(30.9) | |
| 是 | 1 077(72.1) | 829(73.1) | 248(69.1) | |
| 精神压力大/例(%) | 0.099 | |||
| 否 | 1 092(73.1) | 842(74.3) | 250(69.6) | |
| 是 | 401(26.9) | 292(25.7) | 109(30.4) | |
| 吸烟量 | 0(0,1.0) | 0(0,1.0) | 0(0,1.0) | <0.050 |
| 记忆力减退/例(%) | <0.010 | |||
| 否 | 549(36.8) | 439(38.7) | 110(30.6) | |
| 是 | 944(63.2) | 695(61.3) | 249(69.4) | |
| 注意力不集中/例(%) | 0.744 | |||
| 否 | 687(46.0) | 525(46.3) | 162(45.1) | |
| 是 | 806(54.0) | 609(53.7) | 197(54.9) | |
| ESS | 9(6,14) | 8.5(5,13) | 11(7,16) | <0.001 |
| 打鼾病史 | 9.0(4.0,12.0) | 8.0(3.6,10.0) | 10.0(6.0,20.0) | <0.001 |
| 憋气病史 | 3.0(1.0,6.0) | 2.0(1.0,5.0) | 4.0(1.0,8.0) | <0.001 |
| AHI | 46.2(23.0,67.9) | 41.8(19.8,66.1) | 57.7(33.1,70.8) | <0.001 |
| OAI | 21.1(5.2,46.6) | 17.5(4.2,43.5) | 32.5(14.7,53.1) | <0.001 |
| LSaO2/10 | 7.6(6.5,8.4) | 7.9(6.8,8.5) | 6.9(5.7,7.8) | <0.001 |
| CT90/10 | 0.7(0.1,3.0) | 0.5(0.1,2.6) | 1.5(0.3,4.0) | <0.001 |
2.2. 单因素及多因素逻辑回归分析
在单因素回归分析的基础上,选取P<0.05的变量进行多因素logistic回归分析以确定OSA相关高血压的独立危险因素,结果见表 2。高血压家族史OR=5.388,95%CI 3.975~7.302,BMI(OR=1.121,95%CI 1.038~1.210),年龄/10(OR=2.136,95%CI 1.834~2.487),LSaO2/10(OR=0.552,95%CI 0.456~0.668),CT90 /10(OR=0.842,95%CI 0.751~0.944)是OSA相关高血压的独立危险因素。
表 2.
多因素回归分析
| 特征变量 | 种类 | 回归系数 | 标准误 | Wald值 | P | OR(95%CI) |
| OR,比值比;95%CI,95%的置信区间。 | ||||||
| 心脏病病史 | 否 | - | - | - | - | - |
| 是 | 0.363 | 0.271 | 1.789 | 0.181 | 1.437(0.845~2.446) | |
| 高血压家族史 | 否 | - | - | - | - | - |
| 是 | 1.684 | 0.155 | 117.883 | <0.001 | 5.388(3.975~7.302) | |
| 糖尿病病史 | 否 | - | - | - | - | - |
| 是 | 0.615 | 0.349 | 3.108 | 0.078 | 1.849(0.934~3.662) | |
| BMI | - | 0.114 | 0.039 | 8.415 | <0.01 | 1.121(1.038~1.210) |
| 腰围 | - | 0.014 | 0.015 | 0.809 | 0.368 | 1.014(0.984~1.045) |
| 颈围 | - | 0.017 | 0.033 | 0.264 | 0.607 | 1.017(0.953~1.085) |
| 年龄/10 | - | 0.759 | 0.078 | 95.609 | <0.001 | 2.136(1.834~2.487) |
| 高盐饮食 | 否 | - | - | - | - | - |
| 是 | 0.080 | 0.170 | 0.220 | 0.639 | 1.083(0.776~1.511) | |
| 睡眠质量差 | 否 | - | - | - | - | - |
| 是 | 0.057 | 0.153 | 0.138 | 0.711 | 1.058(0.784~1.428) | |
| 吸烟量 | - | 0.141 | 0.144 | 0.968 | 0.325 | 1.152(0.869~1.527) |
| 记忆力减退 | 否 | - | - | - | - | - |
| 是 | 0.068 | 0.163 | 0.171 | 0.679 | 1.070(0.777~1.474) | |
| ESS | - | 0.021 | 0.014 | 2.122 | 0.145 | 1.021(0.993~1.049) |
| 打鼾病史 | - | 0.009 | 0.012 | 0.589 | 0.443 | 1.009(0.986~1.033) |
| 憋气病史 | - | 0.004 | 0.017 | 0.049 | 0.825 | 1.004(0.971~1.037) |
| AHI | - | -0.006 | 0.006 | 0.906 | 0.341 | 0.994(0.982~1.006) |
| OAI | - | 0.007 | 0.006 | 1.159 | 0.282 | 1.007(0.995~1.019) |
| LSaO2/10 | - | -0.594 | 0.097 | 37.507 | <0.001 | 0.552(0.456~0.668) |
| CT90/10 | - | -0.172 | 0.058 | 8.664 | <0.01 | 0.842(0.751~0.944) |
| 常量 | - | -6.167 | 1.408 | 19.192 | <0.001 | |
2.3. 预测因子筛选
本研究使用Lasso logistic回归模型来选择最重要的预测特征。通过构造一个惩罚函数来压缩一些不重要的特征变量的回归系数,从而获得一个更精细的模型。通过因子系数加权的线性组合来计算风险评分,并生成交叉验证的误差图,见图 2a。Lasso筛选变量的动态过程图显示见图 2b,使用10倍交叉验证来选择最优参数λ。最终,根据Lasso logistic回归,在λ=0.004 5时确立了4个预测因子,即年龄、高血压家族史、BMI和LSaO2。
图 2.
lasso进行特征筛选的过程
2.4. 列线图的构造
根据Lasso logistic回归筛选的影响因素,进行多因素logistic回归,生成了预测OSA相关高血压的列线图(图 3)。列线图将列入的变量量化为特定的分数,通过将列线图中年龄、高血压家族史、BMI及LSaO2这4项指标对应的评分相加,计算总分,即可推导出该患者发生OSA相关高血压的风险,进一步采用了赤池信息准则来衡量模型复杂性与拟合优良性,该模型为855.29。
图 3.
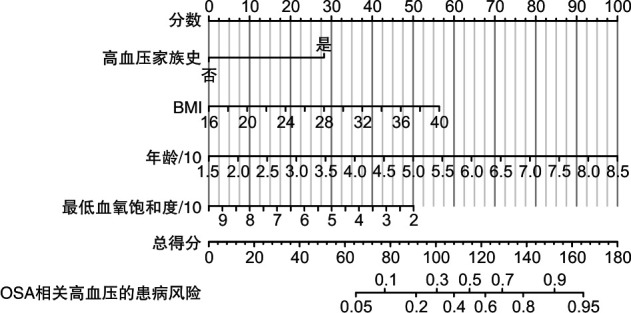
OSA相关高血压的列线图
2.5. 列线图的验证与评估
列线图在训练(0.835,95%CI 0.806~0.863)和验证队列(0.865,95%CI 0.829~0.900)中都产生了相对较高的C指数,这表明该模型具有良好的区分性。校准曲线在训练和验证队列中的预测和观测之间显示出良好的一致性(图 4a、b)。Hosmer-Lemesow检验还表明,训练队列(χ2=1.943,P=0.983)和验证队列(χ2=4.986,P=0.759)之间差异无统计学意义,表明列线图校准良好。
图 4.
校准曲线
2.6. 临床有效性
如图 5所示,使用DCA评估了列线图的临床实用性。结果显示,训练组中,当阈值概率>5%时,该列线图比对所有患者进行干预或全不进行干预时提供更多的净收益。验证组显示,不管其阈值概率为多少,利用列线图预测OSA相关高血压患者并对高危患者进行干预,较对全部的患者治疗或者不治疗的净收益都高。因此,列线图在临床上有用,它能使临床医生做出更好的临床决策。
图 5.
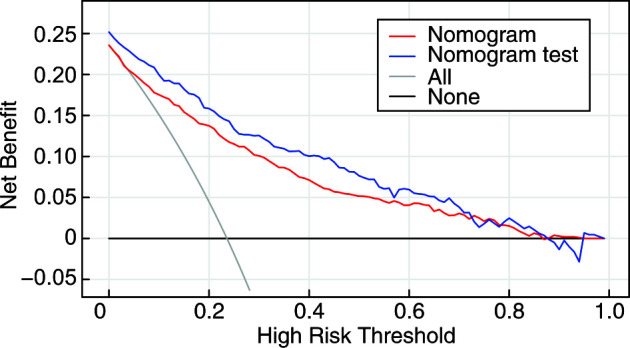
临床决策曲线
3. 讨论
早期准确识别OSA相关高血压患者对保护患者免受其不可逆的严重后果具有重要意义。这项研究首次开发了简单易用的OSA相关高血压的预测模型。该模型具有较好的准确性和区分性,并使用DCA评估了该列线图的临床有效性。
本研究的多因素logistic回归表明,BMI、年龄/10和LSaO2、高血压家族史、CT90是OSA相关高血压的显著独立危险因素。其中,BMI、LSaO2及年龄的发现与以往的研究相吻合[18-19],由于研究设计和研究人群的差异,还发现CT90这项在以往心血管研究中被忽视的变量。既往研究表明CT90与冠状动脉钙、脑小血管疾病、糖尿病肾病[20-21]之间存在显著相关性,但CT90与高血压之间的关系尚未充分探讨。目前OSA和高血压的潜在原因尚未完全阐明,一些病理生理机制被认为参与其中,如交感神经系统活性升高、肾素-血管紧张素-醛固酮系统活性、内皮功能障碍、炎症和代谢失调。López-Cano等[22]发现夜间尿液中总肾上腺素的浓度与CT90之间存在显著正相关,表明CT90可能影响了交感神经活动。这也解释了CT90在OSA相关高血压中的重要作用。近期,也有文献报道称CT90与重度OSA患者在调整了传统危险因素后的高血压风险独立相关[23]。这些研究都提示CT90与OSA相关高血压的发生发展密切相关,未来需要更多的关注。
本次统计模型中,AHI作为成人OSA的诊断指标,参与程度较弱,提示相较于呼吸暂停的次数,缺氧对OSA相关高血压的影响可能更大。OSA的严重程度(AHI)与高血压的累积发病率之间是否存在剂量-反应关系一直存在争议。威斯康星睡眠队列研究发现OSA和4年后高血压的发生之间存在剂量反应相关性[24]。与此同时,维多利亚睡眠队列的研究和睡眠心脏健康研究却发现,在年龄和BMI控制后高血压和OSA之间的关系不再显著[25-26]。AHI不能充分地量化OSA病理生理学机制,全面表征OSA的所有方面已经成为共识。关于OSA指标的探索从未停止,但OSA作为一种异质性疾病,很可能无一项单一的指标可以充分体现OSA的所有方面及其相关风险[27]。而本研究结果揭示,至少在OSA相关高血压方面,血氧指标(LSaO2和CT90)可能是比AHI能更好地预测OSA相关高血压的替代指标。这个结果并不难理解,事实上,间歇性缺氧是OSA的标志性表现,如前所述,间歇性缺氧会导致交感神经激活、氧化应激和ROS的产生,其中,ROS水平升高可导致黏附分子表达增加,白细胞活化和全身炎症产生。而氧化应激、全身炎症和交感神经激活是OSA中心血管疾病的发病基础。
早期的研究已经证实OSA患者中动脉血压升高主要是由于慢性间歇性缺氧[13],在此基础上,进一步发现LSaO2对OSA相关高血压发病的贡献可能大于CT90,这值得进一步探讨。本研究表明相较于缺氧的时间,血氧下降的严重程度可能对高血压的影响更大,这提示不同的缺氧时间、缺氧程度与OSA相关高血压的发生与发展密切相关,且缺氧程度在其中可能起到了关键作用。虽然已经有相关临床研究报道LSaO2、CT90均与OSA相关高血压息息相关,但是二者的具体贡献程度尚未见报道,且尚无相关动物模型进行验证。
在模型的构建过程中,整合了常规的临床指标与PSG指标,并通过Lasso logistic回归对其进行筛选,最终确立了4个临床上简单易获取的变量并构建了OSA相关高血压列线图。C指数、校准图和Hosmer-Lemeshow拟合优度检验表明,预测模型具有良好的判别能力和校准能力,其C指数为0.865(95%CI 0.829~0.900),敏感性和特异性分别为72.7%和84.8%;Hosmer-Lemeshow拟合优度检验χ2=4.986(P=0.759)。在临床应用中,只需将危险因素对应的评分相加得到总分,通过总分即可判断OSA相关高血压的风险。从这项研究中得出的DCA表明,本列线图对患者是有益的,在临床决策中可以帮助患者获得更大的受益。
本研究是一个单中心的回顾性研究,因此存在一些不足与局限性,未来需要通过来自不同医院的患者来对该模型的鲁棒性和可重复性进行验证。其次,这次一些可能的危险因素被忽视,从而未纳入研究,未来需收集更多的可能变量。
本次研究开发并验证了一种新的列线图,该图具有良好的性能和区分性,可用于预测OSA相关高血压患者。可以作为一种简明实用的工具,可帮助临床医生识别OSA相关高血压高危患者,提供早期、个体化的诊断和治疗方案,保护患者免受OSA相关高血压的严重后果,减轻社会负担。
Funding Statement
国家自然科学基金资助项目(No:62076198);西安交通大学基本科研业务费自由探索与创新-教师类项目(No:xzy012023119)
Footnotes
利益冲突 所有作者均声明不存在利益冲突
References
- 1.张 香侠, 厉 雪艳, 陈 贵海, et al. REM相关阻塞性睡眠呼吸暂停的临床研究进展. 临床耳鼻咽喉头颈外科杂志. 2022;36(2):145–148. doi: 10.13201/j.issn.2096-7993.2022.02.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Trzepizur W, Blanchard M, Ganem T, et al. Sleep apnea-specific hypoxic burden, symptom subtypes, and risk of cardiovascular events and all-cause mortality. Am J Respir Crit Care Med. 2022;205(1):108–117. doi: 10.1164/rccm.202105-1274OC. [DOI] [PubMed] [Google Scholar]
- 3.Benjafield AV, Ayas NT, Eastwood PR, et al. Estimation of the global prevalence and burden of obstructive sleep apnoea: a literature-based analysis. Lancet Respir Med. 2019;7(8):687–698. doi: 10.1016/S2213-2600(19)30198-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Gleeson M, McNicholas WT. Bidirectional relationships of comorbidity with obstructive sleep apnoea. Eur Respir Rev. 2022;31(164):210256. doi: 10.1183/16000617.0256-2021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.宋 海齐, 王 莉斐, 吴 淼淼, et al. 睡眠障碍与高血压相关研究热点与趋势分析. 中国全科医学. 2022;25(14):1674–1680. doi: 10.12114/j.issn.1007-9572.2022.01.002. [DOI] [Google Scholar]
- 6.刘 敏, 张 文理, 张 锐, et al. 高血压病合并OSA患者睡眠结构对血压节律的影响. 临床心血管病杂志. 2020;36(11):1034–1038. [Google Scholar]
- 7.谢 林涧, 刘 峻金, 李 骊华. 高血压高血压合并OSA患者血浆VEGF-A、IGF-2的表达及临床意义. 临床心血管病杂志. 2020;36(10):941–945. [Google Scholar]
- 8.国家卫生健康委高血压诊疗研究重点实验室学术委员会, 国家卫生健康委高血压诊疗研究重点实验室, 新疆维吾尔自治区人民医院高血压中心 2023阻塞性睡眠呼吸暂停相关性高血压临床诊断和治疗专家共识. 中华高血压杂志. 2023;31(12):1142–1155. [Google Scholar]
- 9.罗 斌玉, 徐 仕晗, 李 逸雯, et al. 阻塞性睡眠呼吸暂停与心血管疾病的因果关系: 一项两样本孟德尔随机化研究. 中国循证医学杂志. 2023;23(10):1137–1142. [Google Scholar]
- 10.Kario K, Hettrick DA, Prejbisz A, et al. Obstructive sleep apnea-induced neurogenic nocturnal hypertension: a potential role of renal denervation? Hypertension. 2021;77(4):1047–1060. doi: 10.1161/HYPERTENSIONAHA.120.16378. [DOI] [PubMed] [Google Scholar]
- 11.Bratton DJ, Gaisl T, Wons AM, et al. CPAP vs mandibular advancement devices and blood pressure in patients with obstructive sleep apnea: a systematic review and meta-analysis. JAMA. 2015;314(21):2280–2293. doi: 10.1001/jama.2015.16303. [DOI] [PubMed] [Google Scholar]
- 12.Pio-Abreu A, Moreno H, Drager LF. Obstructive sleep apnea and ambulatory blood pressure monitoring: current evidence and research gaps. J Hum Hypertens. 2021;35:315–324. doi: 10.1038/s41371-020-00470-8. [DOI] [PubMed] [Google Scholar]
- 13.Parati G, Lombardi C, Hedner J, et al. Recommendations for the management of patients with obstructive sleep apnoea and hypertension. Eur Respir J. 2013;41(3):523–538. doi: 10.1183/09031936.00226711. [DOI] [PubMed] [Google Scholar]
- 14.2018 ESC/ESH Guidelines for the management of arterial hypertension[J]. Rev Esp Cardiol, 2019, 72(2): 160.
- 15.Wang XX, Lu JL, Song ZX, et al. From past to future: Bibliometric analysis of global research productivity on nomogram(2000-2021) Front Public Health. 2022;10:997713. doi: 10.3389/fpubh.2022.997713. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Sateia MJ. International classification of sleep disorders-third edition: highlights and modifications. Chest. 2014;146(5):1387–1394. doi: 10.1378/chest.14-0970. [DOI] [PubMed] [Google Scholar]
- 17.Whelton PK, Carey RM, Aronow WS, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: executive summary: a report of the American college of cardiology/American heart association task force on clinical practice guidelines. Circulation. 2018;138(17):e426–e483. doi: 10.1161/CIR.0000000000000597. [DOI] [PubMed] [Google Scholar]
- 18.Natsios G, Pastaka C, Vavougios G, et al. Age, body mass index, and daytime and nocturnal hypoxia as predictors of hypertension in patients with obstructive sleep apnea. J Clin Hypertens. 2016;18(2):146–152. doi: 10.1111/jch.12645. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Pan M, Ou Q, Chen B, et al. Risk factors for obstructive sleep apnea-related hypertension in police officers in Southern China. J Thorac Dis. 2019;11(10):4169–4178. doi: 10.21037/jtd.2019.09.83. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Liu XD, Lam DC, Mak HK, et al. Associations of sleep apnea risk and oxygen desaturation indices with cerebral small vessel disease burden in patients with stroke. Front Neurol. 2022;13:956208. doi: 10.3389/fneur.2022.956208. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Seo MY, Lee SH, Hong SD, et al. Hypoxemia during sleep and the progression of coronary artery calcium. Cardiovasc Toxicol. 2021;21(1):42–48. doi: 10.1007/s12012-020-09593-3. [DOI] [PubMed] [Google Scholar]
- 22.López-Cano C, Gutiérrez-Carrasquilla L, Sánchez E, et al. Sympathetic hyperactivity and sleep disorders in individuals with type 2 diabetes. Front Endocrinol. 2019;10:752. doi: 10.3389/fendo.2019.00752. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Wang L, Wei DH, Zhang J, et al. Time under 90% oxygen saturation and systemic hypertension in patients with obstructive sleep apnea syndrome. Nat Sci Sleep. 2022;14:2123–2132. doi: 10.2147/NSS.S388238. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Peppard PE, Young T, Palta M, et al. Prospective study of the association between sleep-disordered breathing and hypertension. N Engl J Med. 2000;342(19):1378–1384. doi: 10.1056/NEJM200005113421901. [DOI] [PubMed] [Google Scholar]
- 25.O'connor GT, Caffo B, Newman AB, et al. Prospective study of sleep-disordered breathing and hypertension: the Sleep Heart Health Study. Am J Respir Crit Care Med. 2009;179(12):1159–1164. doi: 10.1164/rccm.200712-1809OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Cano-Pumarega I, Durán-Cantolla J, Aizpuru F, et al. Obstructive sleep apnea and systemic hypertension: longitudinal study in the general population: the Vitoria Sleep Cohort. Am J Respir Crit Care Med. 2011;184(11):1299–1304. doi: 10.1164/rccm.201101-0130OC. [DOI] [PubMed] [Google Scholar]
- 27.Malhotra A, Ayappa I, Ayas N, et al. Metrics of sleep apnea severity: beyond the apnea-hypopnea index. Sleep. 2021;44(7):zsab030. doi: 10.1093/sleep/zsab030. [DOI] [PMC free article] [PubMed] [Google Scholar]




